
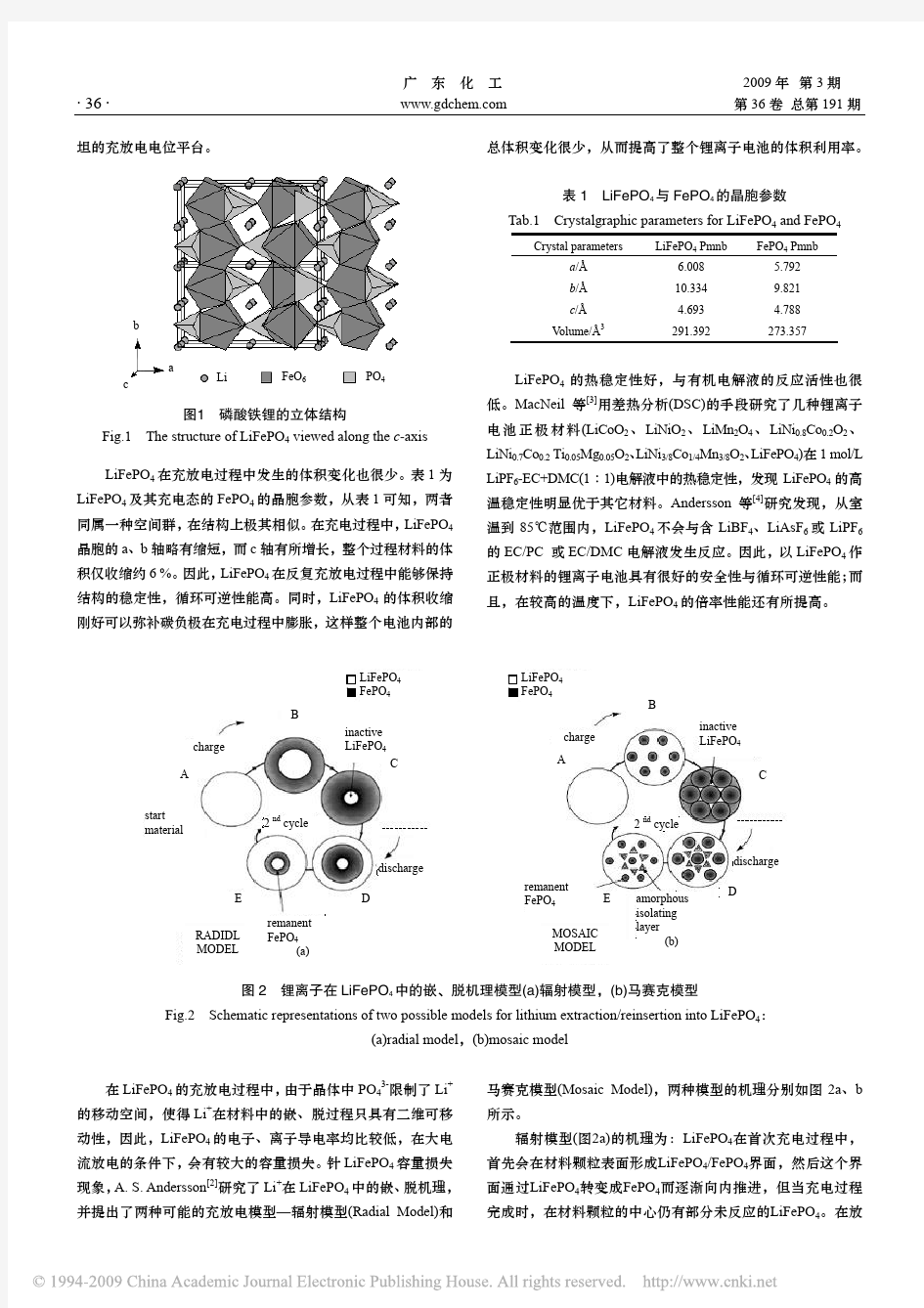
橄榄石型磷酸铁锂的研究进展
谢辉
(电子科技大学中山学院化学与生物系,广东中山 528402)
[摘 要]介绍了橄榄石型磷酸锂铁(LiFePO4)的晶体结构,及其性能特点,评述了近年来各种制备LiFePO4的方法,包括固相反应法、水热合成法、液相共沉淀法以及其他多种方法。介绍了近年来对于提高LiFePO4的性能所进行的改性研究,并对其发展方向作了展望。
[关键词]锂离子电池;正极材料;磷酸铁锂;改性
[中图分类号]O627 [文献标识码]A [文章编号]1007-1865(2009)03-0035-05
Research Progress on Olivine-type Cathode Material of Lithium Iron Phosphate
Xie Hui
(Electrochemical and Biologic Department, Zhongshan College, University of Electronic Science
and Technology, Zhongshan 528402, China)
Abstract: A potential cathode material for Li-ion batteries, olivine-type lithium iron phosphate has recently been paid close attention. The crystal structure of LiFePO4 was described briefly. The synthetic methods for the preparation of LiFePO4 developed in recent years were reviewed, such as high temperature solid state reaction method, sol-gelmethod, microwave radiation method hydrothermal method and co-precipitation method, were summarized. The related research abroad on enhancing the capability of LiFePO4 was introduced and the developing trend of LiFePO4 was prospected.
Keywords: lithium-ion batteries;cathode material;lithium iron phosphate;doping
1 概述
在锂离子电池材料的研发过程中,铁系化合物一直是人们所希望取代LiCoO2的首选正极材料,在所有研究用于锂离子电池正极的材料中,其价格最为低廉,资源丰富、无环境污染。而且LiFePO4具有适中的电位平台和较高的比容量,结构也非常稳定,因此受到了人们极大的关注[1-2]。LiFePO4为有序的橄榄石结构,属正交晶系(16
2h
D,Pmnb空间群),其晶胞参数为a=6.008 ?、b=10.324 ?、c=4.694 ?,每个晶胞中有4个LiMPO4单元。其结构如图1所示[2]。在LiFePO4的晶体结构中,氧原子近似于六方紧密堆积,磷原子在氧四面体的4c位,铁原子、锂原子分别在氧八面体的4c位和4a位。在b-c平面上,FeO6八面体通过共点连结;一个FeO6八面体与两个LiO6八面体和一个PO4四面体共棱,而一个PO4四面体则与一个FeO6八面体和两个LiO6八面体共棱。Li+在4a位形成共棱的连续直线链,并平行于c轴,从而Li+具有二维可移动性,使之在充放电过程中可以脱出和嵌入。在充放电过程中,LiFePO4会发生如下电化学反应:
Li x FePO4?x Li + x e- +MPO4 (0≤x≤1)
其理论比容量为170 mAh/g,并且在3.5 V附近有非常平
[收稿日期]2008-11-03
[基金项目] 中山市科技计划项目(20073A166);电子科技大学中山学院博士科研启动基金项目(2007KQ11) [作者简介]谢辉(1976-),男,湖南人,博士,讲师,主要研究方向为材料物理与化学。
坦的充放电电位平台。
图1 磷酸铁锂的立体结构
Fig.1 The structure of LiFePO 4 viewed along the c -axis
LiFePO 4在充放电过程中发生的体积变化也很少。表1为LiFePO 4及其充电态的FePO 4的晶胞参数,从表1可知,两者同属一种空间群,在结构上极其相似。在充电过程中,LiFePO 4晶胞的a 、b 轴略有缩短,而c 轴有所增长,整个过程材料的体积仅收缩约6 %。因此,LiFePO 4在反复充放电过程中能够保持结构的稳定性,循环可逆性能高。同时,LiFePO 4的体积收缩刚好可以弥补碳负极在充电过程中膨胀,这样整个电池内部的
总体积变化很少,从而提高了整个锂离子电池的体积利用率。
表1 LiFePO 4与FePO 4的晶胞参数
Tab.1 Crystalgraphic parameters for LiFePO 4 and FePO 4
Crystal parameters
LiFePO 4 Pmnb
FePO 4 Pmnb
a /? 6.008 5.792
b /? 10.334 9.821
c /? 4.693 4.788
V olume/?3 291.392
273.357
LiFePO 4的热稳定性好,与有机电解液的反应活性也很低。MacNeil 等[3]用差热分析(DSC)的手段研究了几种锂离子电池正极材料(LiCoO 2、LiNiO 2、LiMn 2O 4、LiNi 0.8Co 0.2O 2、LiNi 0.7Co 0.2 Ti 0.05Mg 0.05O 2、LiNi 3/8Co 1/4Mn 3/8O 2、LiFePO 4)在1 mol/L LiPF 6-EC+DMC(1︰1)电解液中的热稳定性,发现LiFePO 4的高温稳定性明显优于其它材料。Andersson 等[4]研究发现,从室温到85℃范围内,LiFePO 4不会与含LiBF 4、LiAsF 6或LiPF 6的EC/PC 或EC/DMC 电解液发生反应。因此,以LiFePO 4作正极材料的锂离子电池具有很好的安全性与循环可逆性能;而且,在较高的温度下,LiFePO 4的倍率性能还有所提高。
图2 锂离子在LiFePO 4中的嵌、脱机理模型(a)辐射模型,(b)马赛克模型
Fig.2 Schematic representations of two possible models for lithium extraction/reinsertion into LiFePO 4:
(a)radial model ,(b)mosaic model
在LiFePO 4的充放电过程中,
由于晶体中PO 43-限制了Li +的移动空间,使得Li +在材料中的嵌、脱过程只具有二维可移动性,因此,LiFePO 4的电子、离子导电率均比较低,在大电流放电的条件下,会有较大的容量损失。针LiFePO 4容量损失现象,A. S. Andersson [2]研究了Li +在LiFePO 4中的嵌、脱机理,并提出了两种可能的充放电模型—辐射模型(Radial Model)和
马赛克模型(Mosaic Model),两种模型的机理分别如图2a 、b 所示。
辐射模型(图2a)的机理为:LiFePO 4在首次充电过程中,首先会在材料颗粒表面形成LiFePO 4/FePO 4界面,然后这个界面通过LiFePO 4转变成FePO 4而逐渐向内推进,但当充电过程完成时,在材料颗粒的中心仍有部分未反应的LiFePO 4。在放
Li
FeO 6
PO 4
a
b
c
RADIDL MODEL
remanent FePO 4
(a)
remanent FePO 4
MOSAIC MODEL
amorphous isolating layer
(b)
discharge
discharge
start material
charge charge 2 nd cycle
2 nd cycle inactive LiFePO 4
inactive LiFePO 4
A B
C
D
E
E
D
C
B
A
LiFePO 4
FePO 4
LiFePO 4 FePO 4
电过程中,锂离子首先与外部的FePO4结合成LiFePO4,形成LiFePO4/FePO4的环形界面,随着锂离子的嵌入,界面也不断从外表面向中心的LiFePO4区域推移。当到达放电末期时,中心区域的LiFePO4被环形的FePO4区域所包围,因此不能与新生成的LiFePO4重新结合,形成非活性的LiFePO4。这部分的LiFePO4也成为了材料容量损失的来源。马赛克模型(图2b)的机理为:在充电过程中,锂离子能够在一个LiFePO4颗粒内部的多个部位发生脱嵌,相应地,颗粒内部也会形成多个由无定形物质包围LiFePO4区域,这些区域不具有电化学活性,在以后的充放电过程中不会发生锂离子的嵌、脱。在放电过程中,也会有一部分FePO4不能转变为LiFePO4,同样也不具有电化学活性,它与非活性的LiFePO4共同造成了材料的容量损失。大多科研人员认为,LiFePO4的锂离子嵌、脱过程不是完全符合上述任一迁移模型,而是两种模型形式同时存在,即在“呈辐射状”迁移的区域上具有“马赛克”特征。
Padhi等[1]也曾对大电流放电条件下LiFePO4的容量损失机理进行了推测。他们认为,在放电过程中,随着锂离子的嵌入,Li x FePO4/FePO4界面不断向LiFePO4颗粒中心移动,界面的面积也随之不断缩小。由于在单位界面面积上锂离子的迁移速度可以视为一定,因此,当界面面积减少到一定程度时(临界面积),锂离子在材料的迁移速度就不足以平衡电子的转移速度(电流),材料放电过程就会中止。材料的放电电流愈大,所需临界面积也就愈大,可在材料中发生嵌、脱的锂离子含量x就愈小,从而造成了材料放电容量的下降。
从实用的角度考虑,LiFePO4资源丰富、价格低廉、对环境友好,是极具应用潜力的锂离子电池正极材料。但LiFePO4电子导电率低,高倍率放电条件下的电化学过程又受Li+扩散控制,导致大电流放电性能较差。为克服上述缺陷,目前的对LiFePO4的研究工作主要从两方面展开:一方面,通过不同的合成方法来控制晶粒生长,制备出粒径均一、细小的材料,从而强化材料的离子传导性能;另一方面,在优化合成工艺的基础上,通过非晶相掺杂、晶相掺杂等手段来同时提高材料的电子、离子导电率。
2 磷酸铁锂的合成方法研究
LiFePO4的合成方法主要包括高温固相法、液相法等。高温固相法以碳酸锂(或氢氧化锂、醋酸锂及磷酸锂等)、草酸亚铁(或醋酸铁、磷酸亚铁等)和磷酸氢二铵(或磷酸二氢铵)为原料,在保护气氛(氮气、氩气或它们与氢气的混合气体)中经300~400 ℃加热3~6 h进行预处理,然后在500~800 ℃煅烧4~24 h,冷却后可得LiFePO4粉体材料。Padhi等[1]首先采用高温固相法在800 ℃合成了LiFePO4,发现其在3.4 V左右有个平稳的放电电压平台,放电容量为100 mAh左右,且经20个循环后容量基本没有衰减,初步显示了LiFePO4作为正极材料的优势。Yamada等[5]以FeAc2、(NH4)2HPO4和Li2CO3为原料,在400~800 ℃的范围内合成了一系列LiFePO4正极材料,发现在500~600 ℃内所合成的材料电性能最佳,其放电比容量在室温下可达160 mAh/g;他们认为,过高温度下(大于600 ℃)的晶粒生长和过低温度下(小于500 ℃)材料中的非晶态Fe3+相是降低LiFePO4电性能的两种主要因素。Takahashi等[7]用FeC2O4·2H2O、(NH4)2HPO4和LiOH为原料,分别在675、725和800 ℃下合成了LiFePO4样品,发现在675 ℃下合成的材料表面较粗糙、粒径较小,具有最佳的充放电性能。H. Kim等[6]采用Li3PO4和Fe3(PO4)2·8H2O为原料,在保护气氛中通过不同的热处理温度合成了LiFePO4,发现在700 ℃煅烧所得产品的电性能要优于在其它温度下(600、800 ℃)所合成的试样。高温固相法的优点是工艺简单、易实现产业化;而其主要缺点是产物颗粒不均匀,晶形无规则,粒径分布范围广,实验周期长,其中合成温度是影响产物结构与电性能的主要因素之一,适当降低合成温度,有利于减小产物的粒径,增大比表面积,从而提高产物的电性能。
通过液相法合成LiFePO4的主要途径有水热法、溶胶-凝胶法,共沉淀法等。水热法是以可溶性亚铁盐、锂盐和磷酸为原料,在水热条件下直接合成LiFePO4的方法。由于整个合成过程是在密闭的条件下进行的,而氧气在水热体系中的溶解度很小,水热体系为LiFePO4的合成提供了一个优良的惰性环境,因此,水热合成不再需要惰性气体的保护。Yang等[8]将FeSO4、LiOH和H3PO4按1︰3︰1(摩尔比)的比例配成混合溶液,将其置于高压釜中,在120 ℃下保温5 h后合成了LiFePO4。XRD分析和氧化-还原滴定结果表明,所合成的材料为单一的LiFePO4相,平均粒径约为3 μm;以0.14 mA/cm2的电流密度充放电,该材料容量为100 Ah/kg。Tajimi等[9]将聚乙烯醇加入FeSO4、LiOH和H3PO4中,在150 ℃下,通过水热法在短时间(3 h)内合成了晶型完整、粒度细小的LiFePO4。在0.5 mA/cm2的电流密度下,该材料的首次放电容量为143 mAh/g,经15次循环后,仍具有120 mAh/g的放电容量。采用水热法合成LiFePO4,不需要惰性气氛,具有操作简单、物相均匀、粒径小等优点;但水热法需要耐高温高压设备,工业化生产的困难较大;同时水热法容易生成亚稳态的FePO4,影响产物的电性能。
溶胶-凝胶法(Sol-gel法)制备LiFePO4的主要过程为:将金属(Li、Fe)有机盐或无机盐经水解形成金属氧化物或金属氢氧化物的均匀溶胶,然后通过蒸发浓缩将溶质聚合成透明的凝胶,再将凝胶干燥、高温处理去除有机成分得到LiFePO4正极材料。Croce等[10]首先将LiOH、Fe(NO3)3以及抗坏血酸的溶液混合,然后加入H3PO4溶液,在用氨水将溶液调节到一定的pH后,在60 ℃下使其成为凝胶;在氮气气氛下,将凝胶在350 ℃保温12 h,再在800 ℃保温24 h后得到样品。恒电流充放电结果表明,该样品在0.2 C倍率下的放电容量约120 mAh/g,经50个循
环后容量无衰减。Gaberscek M.等[11]采用溶胶-凝胶法合成了多孔型LiFePO4正极材料。他们首先将Li3PO4与H3PO4水溶液混合,在70 ℃下充分搅拌1 h使原料充分溶解,然后向其中加入柠檬酸铁溶液,在60 ℃下保温24 h使其形成凝胶;在氮气气氛下,将凝胶在750 ℃保温1 h后得到了电性能优异的LiFePO4样品。SEM结果表明,该样品颗粒表面存在大量的微孔结构,这些微孔能增大材料与电解液的接触面积,更有利于锂离子在其中的嵌入与脱出;在0.1 C倍率下放电,其容量可达150 mAh/g左右。用溶胶-凝胶法合成的LiFePO4具有化学均匀性好、纯度高、颗粒细、可容纳不溶性组分或不沉淀组分等优点,但其主要不足是制备工艺较复杂,且凝胶干燥时收缩性大,粉体材料的烧结性不好。
共沉淀法也是制备LiFePO4的一种常用方法。具体过程是将按化学计量配比的原料溶解,加入适当的某种化合物以析出沉淀,洗涤、干燥、焙烧后得到产物。Arnold等[12]利用Fe2+盐和Li3PO4为原料,在惰性气氛的保护下采用液相共沉积法合成出电化学性能优良的LiFePO4粉末。Park等[13]以LiOH为沉淀剂,在氮气的保护下,将其加入到(NH4)2Fe(SO4)2·6H2O和H3PO4的混合溶液中,得到绿色沉淀,将所得沉淀烘干后于650 ℃下保温处理5 h后即得LiFePO4正极材料。在0.1、1 C放电倍率下,该材料的放电容量分别为125、110 mAh/g。Park等[14]还采用共沉淀-微波烧结的方法合成了单一橄榄石型LiFePO4,该材料在0.1 C倍率下的放电容量可达150 mAh/g。共沉淀法制备的LiFePO4正极材料具有活性大、粒度小且分布均匀等优点,同时还可以降低热处理温度,缩短热处理时间,减少能耗。但由于Fe2+容易氧化,共沉淀阶段的pH难以控制,要求不同原料具有相似的水解或沉淀条件而限制了原料的选择范围,影响了其实际应用。
除了上述合成方法外,合成LiFePO4的途径还包括乳化-干燥法、碳热还原法以及微波法等[15]。
3 磷酸铁锂的改性研究
3.1非晶相掺杂
非晶相掺杂是在LiFePO4中引入导电率高、粒径细小的碳黑或金属粒子,使其均匀地分布在LiFePO4晶粒之间,从而提高材料的导电率的一种方法。Prosini等[15]通过在原料中添加高比表面积的碳黑的方法,制备了性能优良的LiFePO4/C复合材料;当碳黑为10(wt) %时,在80 ℃下以C/10倍率充放电,其放电比容量为170 mAh/g;在20 ℃下以1 C倍率充放电,放电比容量也可达100 mAh/g左右。Huang等[16]采用CH3COOLi、Fe(CH3COO)2和NH4H2PO4与碳凝胶混合烧结后得到了LiFePO4/C复合材料,以C/10倍率充放电,其放电比容量为161 mAh/g;以C/5倍率充放电,循环100次后容量损失小于1 %。Mi[17]等以聚丙烯为碳源,与FePO4·4H2O和LiO H·2H2O混合后,在700 ℃下烧结10 h后制得碳包覆L iFePO4/C复合材料,以0.1、0.3、0.5、1 C倍率放电,该材料的容量分别为164、160、153和119 mAh/g。Bauer等[18]将Li2CO3与不同的Fe2+有机磷酸盐混合均匀,在600 ℃烧结12 h后,发现以Fe[C6H5PO3(H2O)]为原料所制得的LiFePO4/C样品具有最佳的充放电性能。在0.1 C放电倍率下,该材料的比能量可达550 Wh·kg-1,以30 C的高倍率进行放电,仍能达到其理论比能量的28 %。
采用碳掺杂的方法虽然可以大幅度提高LiFePO4的电性能,但由于碳为非活性物质,密度很小,因此会降低材料的实际密度和体积比能量。Park等[19]首先将纯LiFePO4粉末均匀分散在AgNO3水溶液中制成悬浮液,然后用抗坏血酸将Ag+还原成金属制备Ag掺杂表面改性LiFePO4,使材料的电性能大大提高。Croce等[20]以LiOH、Fe(NO3)3和H3PO4为原料,并向其中添加少量的金属(银或铜)超细粉末作为分散剂,采用溶胶-凝胶法合成了掺杂LiFePO4。在0.1 C倍率下放电,其比容量为140 mAh/g,并具有优异的循环性能。这是因为金属粉体可以充当LiFePO4晶粒生长的成核剂,有助于获得细小、均匀的粉体,还可以增强LiFePO4颗粒间的电子传导。添加的金属粉末对材料能量密度的影响很小,但能明显提高材料的高倍率性能。
非晶相掺杂虽然能够提高LiFePO4的电性能,但其仍具有一定的缺陷。因为这些导电物质只是改变了LiFePO4晶粒之间的导电性,而对晶粒自身的导电性却影响甚微。当材料颗粒的尺寸不是足够小时,要得到大电流、高容量的充放电性能仍比较困难。因此,如何提高LiFePO4晶粒内部的导电性是问题的关键。
3.2 晶相掺杂
对LiFePO4进行晶相掺杂的方法是由Chung等[21]提出来的。他们首先对LiCoO2、LiMn2O4和LiFePO4晶体的导电率进行了比较,发现LiCoO2、LiMn2O4的导电率都比较高(分别为10-3 S·cm-1及10-5 S·cm-1),而LiFePO4晶体的导电率(10-10 S·cm-1)要比前两者要低5~8个数量级。这是因为LiCoO2、LiMn2O4在充放电过程中,其晶体内部分别存在着混合价态的阳离子对(Co4+/3+或Mn4+/3+),因此,电子可以通过存在于共边八面体点阵之间的混合价态阳离子进行转移,从而大大提高了材料晶格内部的电子传导率;而对于LiFePO4来说,由于受橄榄石型晶体结构的限制,因此,在充放电过程中会形成单一的LiFePO4和FePO4两相,而这两相中分别只存在单一价态的Fe2+或Fe3+,导致其导电率很低。根据这一导电机理,他们采用对LiFePO4晶体中的锂位进行掺杂的方法,用少量的高价金属离子(Mg2+、Al3+、Ti4+、Nb5+或W6+)取代部分Li+,使复合材料Li1-x M x FePO4在室温下的导电率均超过了10-3 S·cm-1,并且具有良好的充放电性能,特别是大电流性能,即使在21.5 C的倍率下放电,仍具有60 mAh/g的放电容量。其原因是掺杂后能形成Fe2+/Fe3+混合价态,可有效的增强LiFePO4的导电性。Chung
等的发现立刻引起了人们的极大兴趣,因为这种晶相掺杂的方法可在几乎不影响材料实际密度的情况下提高LiFePO4晶格内部的导电率,为LiFePO4走向实用化迈出了一大步。因此,继Chung的研究后,掺杂金属离子的种类及用量、金属离子在LiFePO4晶格内部的掺杂位置(如锂位、铁位)以及混合离子掺杂的协同作用研究相继成为人们关注的焦点。
3.3 合成高电位复合正极材料
在制备LiFePO4时加入其它过渡金属盐(如锰盐、镍盐或钴盐),合成出LiM y Fe1-y PO4复合正极材料,有助于提高材料的工作电压,从而提高电池的比能量。Yamada等[22]以Li2CO3、MnCO3、FeC2O4·2H2O和NH4H2PO4为原料合成LiMn y Fe1-y PO4,并考察了y值对其电化学性能的影响。研究表明:由于高自旋状态的Mn2+和Fe2+的离子半径差别很小,因此由LiFe(Ⅱ)PO4-LiMn(Ⅱ)PO4二元体系形成的Li(Mn y Fe1-y)PO4(放电态)在0≤y≤1.0范围内是单一相固溶体;但在Fe(Ⅲ)PO4-Mn(Ⅲ)3+PO4二元体系形成的(Mn y Fe1-y)PO4(充电态)中,由于存在Mn(Ⅲ)的Jahn-Teller效应,所以y>0.8的富锰(Mn y Fe1-y)PO4是不稳定的。目前是通过合成Li(Mn y Fe1-y)PO4(y≤0.6)来利用4 V平台的容量。4 V平台的容量随锰含量的增加而增加,其中Li(Mn0.6Fe0.4)PO4的容量大于160 mAh/g。Li等[23]以Li2CO3、MnCO3、FeC2O4·2H2O和NH4H2PO4为原料,采用原料中添加碳黑的方法,通过高温固相反应合成了性能优良的LiMn y Fe1-y PO4/C复合正极材料。当y=0.75时,在室温下材料的平均放电电压为3.63 V,放电比容量为164 mAh/g。经20次充放电循环,其容量基本无衰减。所以富锰橄榄石型正极材料的合成是一个很有意义的研究方向。
4 展望
LiFePO4具有原料来源广泛,价格低廉,高温下安全稳定,循环性能良好等突出的优点,是一种可供开发高安全、低成本锂离子电池的首选正极材料,特别是在锂离子动力电池市场中有巨大的应用前景。今后对LiFePO4的研究,以下几方面应加以重点考虑:继续加强改性研究,全面提高其导电率,即同时提高材料晶粒之间以及晶粒内部的电子传导能力;提高锂离子扩散速率,而纳米LiFePO4颗粒合成技术将在这方面得到应用;继续深入研究Li+在材料晶体结构中的嵌/脱机理和扩散机理,为LiFePO4的改性提供必要的指导。
参考文献
[1]Padhi A K,Nanjundaswamy K S,Masquelier C,et al.Effect of structure on the Fe3+/Fe2+ redox couple in iron phosphates[J].J. Electrochem. Soc.,1997,144(5):1609-1613.
[2]Andersson A S,Thomas John O S.The source of first-cycle capacity loss in LiFePO4[J].J. Power Sources,2001,97-98:498-502.
[3]MacNeil D D,Lu Z H,Chen Z H,et al.A comparison of the electrode/electrolyte reaction at elevated temperatures for various Li-ion battery cathodes[J].Electrochim. Acta,2002,108:8-14.
[4]Andersson A S,Thomas J O,Kalska B,et al.Thermal stability of LiFePO4- based cathodes[J].Electrochemical and Solid-state Letters,2000,3(2):66-68.[5]Yamada A,Chung S C,Hinokuma K.Optimized LiFePO4 for lithium battery cathodes[J].J. Electrochem. Soc.,2001,148(3):224-229.
[6]Kim H S,Cho B W,Cho W.Cycling performance of LiFePO4 cathode material for lithium secondary batteries[J].J. Power Sources,2004,132:235-239.
[7]Takahashi M,Tobishima S,Takei K,et al.Characterizaiton of LiFePO4 as the cathode material for rechargeable lithium batteries[J].Electrochemistry communication 2001,(4):591-592.
[8]Yang S,Zavalij Peter Y,Whittingham M,et al.Hydrothermal synthesis of lithium iron phosphate cathodes[J].Electrochemistry Communications 2001,3:505-508.
[9]Tajimi S,Ikeda Y,Uematsu K,et al.Enhanced electrochemical performance of LiFePO4 prepared by hydrothermal reaction [J].Solid state ionics,2004,175:287-290.
[10]Doeff M M,Finones R,Yaoqin H.Electrochemical performance of Sol-Gel synthesized LiFePO4 in lithium battery[C].11th International Meeting on Lithium Battery,Monterey,CA. USA:2002.
[11]Gaberscek M,Dominko R,Bele M P.Carbon-decorated LiFePO4 prepared by sol-gel method based on citric acid[J].Solid State Ionics,2005,176:1801-1805.
[12]Arnold G,Garhe J,Hemmer R,et al.Fine-particle lithium iron phosphate LiFePO4 synthesized by a new low-cost aqueous precipition technique[J].J Power Sources,2003,119-121:247-251.
[13]Park K S,Kang K T,Lee G Y,et al.Synthesis of LiFePO4 with fine particle by co-precipitation method[J].Materials Research Bulletin,2004,39:1803-1810.
[14]Park K S,Son J T,Chung H T,et al.Synthesis of LiFePO4 by co-precipitation and microwave heating[J].Electrochemistry communications,2003,5:839-842.
[15]Prosini P P,Zane D,Pasquali M.Improved electrochemical performance of
a LiFePO4-based composite cathode[J].Electrochimi. Acta,2001,46:3517-3523.
[16]Huang H,Yin S C,Nazra L F.Approaching theoretical capacity of LiFePO4 at room temperature at high rates[J].Electrochemical and Solid-state Letters,2001,4(10):170-172.
(下转第118页)
Smoke Constituents[J].Britr.Tabakforsch,1973,7:165-178.
[4]Schlotzhauer W S,Chortyk O T.Sulphur isotope composition of his evolved during the non-isothermal pyrolysis of sulphur-containing materials[J].J.Anal.Appl.Pyrol,1987,12:19-29.
[5]Chipman J K,Marsh J W,Livngstone D R.Genetic Toxicity in the dab from the normal sea[J].Mur.Ecol.Prog.Ser,1992,91:121-126.
[6]Okona-Mensah K B,Battershill J,Boobis A.An approach to investigating the importance of high potency polycyclic aromatic hydrocarbons in the induction of lung cancer by air pollution[J].Food and Chemical Toxicology,2005,7(43):1103-1116.
[7]Gmeiner G,Stehlik G,Tausch H.Determination of seventeen polycyclic aromatichydrocarbons in tobacco smoke condenste[J].Chromatography A,1997,767:163-169.
[8]Seike K,Murata M,Hirakawa K.Oxidative DNA damage induced by Benz[a]anthracene dihydrodiols in the presence of dihydrodiol dehydrogenase[J].Chem.Res.Toxicol,2004,17(11):1445-1451.
[9]Briscoe R J,Jeanville P M,Camilo C.A catalytic antibody against cocaine attenustes cocaine’s cardiovascular effects in mice:a dose and time course analysis[J].International Immunopharmacology,2001,1(6):1189-1198.[10]Yang X H,Wacholder S,Xu Z Y.CYP1A1 and GSTM1 polymorphims in relation to lung cancer risk in Chinese women[J].Cancer Letters,2004,214(2):197-204.
[11]Rodin S N,Rodin A S.Origins and selection of p53 mutations in lung carcinogenesis[J].Seminars in Cancer Biology,2005,2(15):103-112.[12]Thyssen J,Althoff J,Kimmerle G U.J.Natl.cancer Inst,1981,66:575-577.
[13]Seo K Y,Nagalingam A,Miri S.Mirror imagest-ereocsomers of the major benzo[a]pyrene N2-dG adduct are bypassed by different lesion-bypass DNA polymerases in E.coli[J].DNA Repair,2006,4(5):515-522.
[14]Gaspari l,Chang S S,Santella R M,et al.Polycyclic aromatic hydrocarbon-DNA adducts in human sperm as a marker of DNA damage and infertility[J].Mutat.Res,2003,535:155-160.
[15]聂建群.卷烟烟气中稠环芳烃的分析、形成及其相关降害技术的初步研究[D].云南:云南师范大学,2006.
[16]陈杰,郑遵法,陈丽娜.中草药对香烟中烟雾毒害的解毒作用研究[J].中国中西医结合杂志,2007,14(2):73-75.
[17]许永,向能军,缪明明.中草药添加剂在卷烟中的运用[J].云南化工,2007,34(2):67-75.
[18]吴承任,张东云,孙建军.卷烟减害保健添加剂:CN,9311839[P].中国,1995-05-17.
[19]李笃生,高战华,李崇山.中草药添加剂降低卷烟焦油量的研究[C].吸烟与健康论文集:经济日报出版社,1997:139-144.
[20]聂基兰.一种降低卷烟焦油中多环芳烃的添加剂及多环芳烃含量较低的卷烟:CN,98113546.3[P].中国,1999-11-17.
[21]谢雯燕,张怡春,孙凯健.中草药降低卷烟烟气中稠环芳烃的研究[J].上海烟业,2001,3:6-8.
[22]柯亨林.降低卷烟烟气中多环芳烃和自由基的中药添加剂[J].华东理工大学学报,2002,(1):74-76.
[23]郑晓晖,孟庆乃.烟草生产与人体健康和环境保护协调发展研讨会专题报告论文集[R].2003:25-28.
[24]王建新,熊斌,李青城.新型AXL卷烟的研制及其降焦减害效果评价[J].武汉化工学院学报,2003:25(4):4-9.
[25]马宇平.茶叶香味成分、茶多酚提取及在新型卷烟滤棒中的应用研究
[D].西北农业科技大学,2006.
[26]孟仟样.选择性消除烟气中致癌物质的香烟嘴棒添加剂:CN,9911769[P].中国,2001-02-02.
[27]戴亚,汪长国,朱立军.一种复合生化制剂在卷烟减害中的应用[J].烟草科技,2008,(5):5-8.
(本文文献格式:谢山岭,向能军,倪朝敏,等.植物添加剂降低卷烟烟气稠环芳烃的研究进展[J].广东化工,2009,36(3):115-118)
(上接第39页)
[17]Mi C H,Zhao X B,Cao G S,et al.In situ synthesis and properties of carbon-coated LiFePO4 as li-ion battery cathodes[J].J. Electrochem. Soc,2005,152(3):483-487.
[18]Bauer E M,Bellitto C.Pasquali M,et al.Versatile synthesis of carbon-Rich LiFePO4 enhancing its electrochemical properties[J].J. Electrochem. Soc,2004,7(4):85-87.
[19]Park K S,Son J T,Chung H T,et al.Surface modification by sliver coating for improving electrochemical properties of LiFePO4.
[20]Croce F,Epifanio A D,Hassoun J,et al.A novel concept for the synthesis of an improved LiFePO4 lithium battery cathode[J].Electrochemical and Solid State Letters,2002,5(3):47-50.[21]Chung S Y,Blocking J T,Chiang Y M. Electronically conductive phospho- olivines as lithium storage electrodes[J].Nature Materials,2002,2:123-128.
[22]Yamada A,Kudo Y,Liu K.Reaction mechanism of the olive-type Li x(Mn0.6Fe0.4)PO4(0≤x≤1)[J].J Electrochem. Soc.,2001,148(7):747-754.[23]Li G H,Azuma H,Tohda M.Optimized LiMn y Fe1-y PO4 as the cathode for lithium batteries[J].J. Electrochem. Soc.,2002,149(6):743-747.
(本文文献格式:谢辉.橄榄石型磷酸铁锂的研究进展[J].广东化工,2009,36(3):35-39)
磷酸铁锂市场分析研究报告
一、项目概述 磷酸铁又叫正磷酸铁,自然界存在的磷酸铁叫做蓝铁矿。磷酸铁中的铁为三价铁,以二水合物居多。用途:正磷酸铁可用到陶瓷、电池、食品等行业中: 1.陶瓷级正磷酸铁:生产高档陶瓷金属釉、黑釉、仿古釉等色釉料的原料; 2.电池级磷酸铁:高级磷酸铁锂电池;电光材料等的重要原料; 3.食品级正磷酸铁:营养增补剂(铁质强化剂),本品性能稳定,不易发生反 应而影响食品品质,是理想的铁源制剂,多用于蛋白质,米制品及糊状制品,正磷酸铁应用于食品是很好的一种营养强化剂。 目前看来,磷酸铁锂是最有可能真正大规模应用于动力型和储能型锂离子电池的理想材料。自从1997年美国的JohnB.Goodenough教授提出这一材料以来,国内外对此进行了广泛而深入的研究。 随着化石能源的枯竭,国际原油、天燃气等一次能源价格的上涨,锂电池在电动汽车及蓄能材料领域的成熟应用,加上国家产业政策的大力支持,高安全性、高可靠性、绿色环保的磷酸铁锂储能材料的需求日益攀升,磷酸铁锂材料根据应用领域的不同,可分为能量型与功率型两种。其性能要求的共性是重量比容量高、安全性能好、可加工性能好、循环寿命长。差异是能量型要求有高的体积比容量。功率型要求有高的充、放电倍率且低温性能好。目前合成磷酸铁锂的铁源主要有三种,分别是草酸亚铁、三氧化二铁及磷酸铁。前两种铁源不具有骨架作用。合成工艺也相对复杂,其稳定性问题是业界最为担心的问题。而后者——磷酸铁的的骨架作用,对合成产品磷酸铁锂的性能上体现得优为明显。 二、产品目标市场分析、影响、趋势预测、前景分析 1.电池市场介绍 电池市场分类
磷酸亚铁锂材料专利最新进展 今年上半年,德州大学和其商业授权的加拿大魁北克水电公司、Phostech公司指控美国电池制造商A123(高博)公司、威能(Valence)公司侵权的磷酸铁锂专利纠纷案。这一事件引起了业内外广泛关注。如今,关于磷酸铁锂电池专利的话题再次牵动着电动车业界的神经,不过这次事件的主角换成了中国。 就在北美磷酸铁锂专利诉讼案打得不可开交的时候,一场磷酸铁锂电池专利保卫战在中国打响。 为避免DVD专利池的悲剧重演,我国多家电池企业和科研机构正在积极行动,收集证据,以证明加拿大魁北克水电公司和法国科研中心去年在华申请的磷酸铁锂包敷碳技术专利(现已独家授权给加拿大Phostech公司)无效。不过,从目前情况看,中方想要获胜,极为困难。 ■ 外企成功在华申请包敷碳技术专利 今年以来,我国电动汽车和动力电池的论坛特别多。几乎在每一个论坛上,都能看到加拿大Phostech公司代表的身影。 前不久,第四届华南锂电(国际)高层技术论坛在深圳召开。专程从加拿大赶来参加此次论坛的Phostech公司CEO莱斯?托斯顿满面春风。在介绍了产品和技术后,托斯顿回答了现场听众关于专利的提问。他透露:“在美国,法庭打算休庭一段时间再继续审理我们与
A123等公司的磷酸铁锂电池专利纠纷案。去年12月,欧洲专利局驳回了Phostech公司的磷酸铁锂电池专利申请。我们打算继续申请专利,预计到2010年会获批。另外,在日本我们也在积极申请专利。” 托斯顿谈了Phostech公司在美、日、欧的专利申请情况,却没有谈及中国,不知是否在有意回避。据记者了解,1999年,法国科研中心教授米歇尔阿曼德发明了包敷碳技术,解决了磷酸铁锂材料导电性不佳的难题。随后,由加拿大魁北克水电公司和法国科研中心共同申请了这项技术专利。2008年,两家机构在中国的专利申请获得批准,其专利使用权现已独家许可给加拿大Phostech公司。 在抢占了专利制高点之后,Phostech公司积极开拓中国市场。目前,该公司已经在上海设立了办事处。与此同时,其高层在华频频亮相,积极推销该公司的磷酸铁锂电池和材料。 ■ 两大专利无法绕行 中国工程院院士陈立泉告诉记者,在磷酸铁锂电池和材料领域,有两大核心技术专利是无法绕行的,其中一个是包敷碳技术专利,另一个是碳热还原技术专利。前者已经在华申请,加拿大Phostech公司拥有独家使用权;后者归美国威能公司所有,目前尚未到中国申请专利。但是,威能公司现已在苏州成立了两家公司―――威能科技有限公司、威泰能源有限公司,分别负责磷酸铁锂材料的生产和电池制作。为抢占中国市场,威能公司不排除会在专利上做文章。 陈立泉院士还向记者透露了一件令人吃惊的事情:原来,威能公
低温磷酸铁锂电池测试方法及检测标准 1.电池测试方法 1.1蓄电池充电 在20℃士5℃条件下,蓄电池以1I 3 (A)电流放电,至蓄电池电压达到2.0 V,静置 1h,然后在20℃±5℃条件下以1I 3 (A)恒流充电,至蓄电池电压达3.65V时转恒 压充电,至充电电流降至0.1I 3 时停止充电。充电后静置lh。 1.2 20℃放电容量 a) 蓄电池按1.1方法充电。 b) 蓄电池在20℃士5℃下以1I 3 (A)电流放电,直到放电终止电压2.0V 。 c) 用1I 3 (A)的电流值和放电时间数据计算容量(以A.h计)。 d) 如果计算值低于规定值,则可以重复a)一c)步骤直至大于或等于规定值,允许5次。 1.3 -20℃放电容量 a) 蓄电池按1.1方法充电。 b) 蓄电池在-20℃士2℃下储存20h。 c) 蓄电池在-20℃士2℃下以1I 3 (A)电流放电,直到放电终止电压2.0V。 d) 用c)电流值和放电时间数据计算容量(以A.h计),并表达为20℃放电容量的百分数。 1.4 -40℃放电容量 a) 蓄电池按1.1方法充电。 b) 蓄电池在-40℃士2℃下储存20h。 c) 蓄电池在-40℃士2℃下以1I 3 (A)电流放电,直到放电终止电压2.0V。 d) 用c)电流值和放电时间数据计算容量(以A.h计),并表达为20℃放电容量的百分数。 备注:1I 3— 3h率放电电流,其数值等于C 3 /3。 C 3 — 3 h率额定容量(Ah)。 1.5 高温荷电保持与容量恢复能力: a) 蓄电池按1.1方法充电。 b) 蓄电池在60℃士2℃下储存7day。 c) 蓄电池在20℃士5℃下恢复5h后,以1I 3 (A)电流放电,直到放电终止电压2.OV d) 用 c)的电流值和放电时间数据计算容量(以A.h计),荷电保持能力可以表达为额定容量的百分数。 e) 蓄电池再按1.1方法充电。 f) 蓄电池在20℃士5℃下以11 3 (A )电流放电,直到放电终止电压2.0V 。
磷酸铁锂的消费分析与预测 4.1 世界磷酸铁锂消费分析与预测 4.1.1 世界磷酸铁锂消费分析 锂离子动力电池是一种以满足混合电动汽车、纯电动汽车、电动自行车、电动摩托车、不间断电源、割草机、矿灯和小型发电站电能存储和转换的大容量、高功率的大型锂离子电池。工业的发展和人类文明的进步很大程度建立在石油能源的基础上,并且依赖程度日趋严重,石油能源是不可再生能源,随着石油能源的匮乏,人类提出了节约、合理使用石油能源。锂离子动力电池可以在大量领域内使用电能取代石油能源,节约了大量宝贵的石油资源,同时电能是一种清洁能源,可以缓解使用石油能源带来的严重的环境污染。因此,大量发展锂离子动力电池具有重要的社会经济意义。 环保的呼声和不可再生能源紧缺给绿色二次能源提供了广阔的发展空间,促进了电动自行车,混合电动汽车的研究、生产和应用。锂离子动力电池具有能量密度高、环境友好、安全性好和循环寿命长的特点,成为电动车首选移动能源。锂离子动力电池作为绿色二次能源具有巨大的市场需求,其主要可用于电动自行车和混合电动汽车及车用蓄电池。 全球锂离子电池市场呈现中、日、韩三足鼎立的局面。日本是最早实现锂电池商用化的国家,在2000年以前,全球锂电的生产基本被日本垄断。但随着中国、韩国锂电池制造技术的开发和提升,日本锂电池出货量的比例在逐渐降低,而中国和韩国锂电池出货量的比例在逐渐增加。如下表统计数据显示,从2002年到2008年中国和韩国的锂离子电池市场占有率逐年增加,而日本的市场份额也因此逐年减少。 表4.1 2002~2008年世界锂离子电池市场占有率变化情况表
锂离子电池的性能主要取决于正负极材料,目前,主要应用于锂离子电池的正极材料是嵌锂过渡金属氧化物,包括层状LiMO2(M=Co,Ni,Mn)和尖晶石LiMn2O4等,然而这些材料分别由于价格、安全性、电化学性能等原因使他们在高容量电池的应用方面受到制约。 1997年美国德克萨斯大学的Goodenough首次报道了磷酸铁锂能够可逆地嵌入和脱嵌锂离子,考虑到其无毒,对环境友好,原材料来源丰富,比容量高,循环性能好,认为这类材料将成为动力型锂离子电池最有希望的正极材料。磷酸铁锂动力电池的研发,为解决全球能源紧缺问题,具有十分重要的意义。 磷酸铁锂作为锂电池材料是近几年出现的事,其安全性能与循环寿命是其它材料所无法相比的,这些也正是动力电池最重要的技术指标。1C充放循环寿命近2000次。单节电池过充电压30V不燃烧,穿刺不爆炸。磷酸铁锂正极材料做出的大容量锂离子电池更易串联使用,以满足电动车频繁充放电的需要。磷酸铁锂具有无毒、无污染、安全性能好、原材料来源广泛、价格便宜,寿命长等优点,是新一代锂离子电池的理想正极材料。 2003年,百得(Black & Decker)公司想制造一种性能优于有绳的无绳电动工具,认为A123的磷酸铁锂电池材料符合要求,下了几百万块电池的订单。2006年,百得公司新的无绳专业电动工具上市销售。2008年,A123年产锂电池1,000万只以上,产品主要用于电动工具及远程通信方面。 据Science Daily 2009年5月11日报道,由磷酸铁锂电池驱动的电动滑板车、电动自行车、电动轮椅等在欧洲首次亮相,其所用到的磷酸铁锂粉末由Phostech Lithium公司位于加拿大魁北克省St. Bruno的工厂生产。“磷酸铁锂电池最终将给电动汽车行业带来丰厚的利润,在电池行业掀起一场革命……”蒙特利尔大学化学系教授、Phostech Lithium的创办人之一Michel Gauthier如是说。Phostech Lithium 公司因拥有生产和销售基于Goodenough博士专利的电池材料的专有权而在锂电
锂离子电池技术发展现状与 趋势
一、文献综述 1、前言 现阶段,日本、韩国、美国等国家引领锂离子动力电池技术的发展。日本的行业技术水平具有领先优势,韩国的动力电池制造能力处于领先地位,美国则具有引领前沿的科研能力。 2、国外发展现状 2·1日本 2·11 2009年,日本政府推出了RISING计划(创新型蓄电池尖端科学基础研究事业)和U~EAD项目(汽车用下一代高性能电池系统),并于2013年更新了动力电池技术发展路线图(RM2013),具体指标有2020年电池的续航里程实现250~350km·电池系统总电量达到25~35kW·h,电池能量密度实现250Wh· kg-1,功率密变达到1500W·kg-1,循环寿命达到1000-1500次,价格成本降低到2万日元/W·h。RM2013指明了电极材料的发展方向,正极材料要发展xLiMn03·(1~x)LiMO2(M=Ni,Co,Mn,0≤x≤1)、LizMSi0s、LiNiosMn1s04、LiCnP04、Li2MSO·F、LiMO2(M=Ni,Co,Mn);负极材料要发展Sn~CoC合金,Si基负极包括Si/C和Si0,以及Si基合金。 2·12日本具有代表性的锂离子动力电池企业为松下电池公司。松下是动力电池行业的领导者,作为Tesla最主要的动力电池供应商,凭借Tesla的发展稳居市场领导者地位,全球市场份额在20%左右。目前松下电池主要给ModelS和MndelX提供18650圆柱电池,正极采用镍钴铝三元材料(NCA),负极使用硅碳复合材料,单体能量密度可达252Wh·kg-1,而即将使用在Mode13上的21700圆柱形电池单体能量密度更是提高到300Wh·kg-1·是目前行业内能量密度最高的电池。 2·2韩国 2·21 2011年,韩国启动了包含锂离子电池关键材料、应用技术研究、评价及测试基础设施以及下一代电池研究的二次电池技术研发项目。LG化学和三星SDI是具有代表性的韩国锂离子动力电池企业,也是动力电池领域的后起之秀,两者凭借先
磷酸铁锂电池在通信行业中的应用 关键词:通信、移动基站、宏基站、室外一体化基站、蓄电池、铁电池、纯电动汽车电池、军用锂电池、电动工具锂电池、磷酸铁锂电池组、磷酸铁锂电池、铁锂电池、锂离子电池、新能源汽车锂电池、锂电池、新能源电池、新型蓄电池、矿灯锂电池、储能电池、UPS电源、基站后备电源、太阳能路灯电池、LED灯锂电池、风电电池、船舶锂电池、光伏电池、电动大巴用锂电池、混合动力电池、动力电池、电动车电池、电动车用锂电池、锂离子电池组 传统的阀控式密封铅酸电池以其成本低廉、技术成熟、维护方便得到广泛应用,然而,随着无线通信技术的不断发展和移动基站应用场景的复杂化,传统的蓄电池逐步显现出体积大、对环境温度要求苛刻等劣势。磷酸铁锂电池由于具有体积小、重量轻,高温性能突出,循环性能优异,可高倍率充、放电,绿色环保等众多优点,更适用于环境温度高、机房面积及承重小等恶劣的基站环境。在末端供电后备电池方面可作为铅酸蓄电池的有效补充。 一、目前后备电源面临的问题 1、传统铅酸蓄电池对环境温度要求比较高 目前市内宏基站的站址选择越来越难,室外一体化基站开始大规模建设。传统的铅酸蓄电池对环境温度要求比较高的特点造成传统的铅酸蓄电池很难适应室外高温等恶劣天气。另外,除了铅酸蓄电池外,室内宏基站的其他设备对环境温度的适应范围都比较宽。机房空调就是为了给铅酸蓄电池提供适当的环境温度。为了节能减排,目前已开发出蓄电池保温箱等蓄电池专用的小型空调设备。如果能找到一种对环境温度要求不高的电池作为后备电源,不仅能解决室外一体化基站后备电源的问题,而且还能省掉机房专用空调,这样既节省了工程初期购买空调的投资,也节省了基站运行时的大量电费开销。 2、传统铅酸蓄电池对机房面积和承重要求高 室内宏基站设备中,电源设备占比最大,而电源设备中提及和占地面积最大的就是蓄电池。室内宏基站的机房大多采用民房,根据结构专业的统计计算,民房的承重设计一般为150~200kg/m,而铅酸蓄电池对机房的承重要求不低于400kg/m,所以在现有的民房内摆放铅酸蓄电池都需要经过加固处理。这样一方面加大了工程量,另一方面也加大了选址难度。另外,目前通信设备逐步向小型化、分散化的方向发展,末端设备的功耗越来越小,要求后备电池的体积更小,重量更轻。 3、传统铅酸蓄电池的高倍率放电性能较差 目前电网质量越来越完善,很少出现市电大面积长时间停电的状况,而基站的停电往往是由于市政项目的频繁建设所造成的短时间频繁停电,这需要蓄电池短时间大电流高倍率放电,而传统铅酸蓄电池的高倍率放电性能较差。 4、蓄电池没有纳入监控系统 蓄电池没有纳入监控系统,蓄电池还剩余多少容量不清楚。 5、传统铅酸蓄电池会对环境造成污染 传统的铅酸蓄电池在生产制造和使用后期,如果处理不当,会对环境造成污染。
湖南农业大学 全日制普通本科生毕业论文 FePO4制备工艺对流变相法合成LiFePO4/C性能的影响EFFECTS OF FEPO4 REACTION CONDITIONS ON ELECTROCHEMICAL PROPERTIES OF LIFEPO4/C BY RHEOLOGICAL PHASE METHOD 学生姓名:李季 年级专业及班级:2010级材料化学(2)班 指导老师及职称:钟美娥讲师 学院:理学院 湖南·长沙 提交日期:20年月
湖南农业大学全日制普通本科生毕业论文(设计) 诚信声明 本人郑重声明:所呈交的本科毕业论文(设计)是本人在指导老师的指导下,进行研究工作所取得的成果,成果不存在知识产权争议。除文中已经注明引用的内容外,本论文不含任何其他个人或集体已经发表或撰写过的作品成果。对本文的研究做出重要贡献的个人和集体在文中均作了明确的说明并表示了谢意。本人完全意识到本声明的法律结果由本人承担。 毕业论文(设计)作者签名: 20 年月日
目录 摘要 (1) 关键词 (1) 1 前言 (2) 1.1 LiFePO4的研究现状 (2) 1.2 LiFePO4与FePO4.2H2O的结构及特点 (3) 1.3 锂离子电池的工作原理 (4) 1.4 课题设计思路 (5) 2实验部分 (6) 2.2 试验方法 (7) 2.2.1 样品的的制备与实验方案设计 (7) 2.2.2 LiFePO4材料的结构表征 (8) 2.2.3 电极的制备及模拟电池的装配 (8) 2.2.4 模拟电池的电性能测试 (8) 3 结果与讨论 (8) 3.1 不同碳锂比 (8) 3.2 不同反应温度 (9) 3.3 不同反应pH (10) 3.4 不同搅拌速度 (11) 3.5 不同碳源 (11) 3.6 掺杂 (12) 4 实验结果的总结......................................................................... 错误!未定义书签。 4.1 最佳工艺条件下所制LiFePO4材料的XRD结果 (12) 4.2 最佳工艺条件下所制LiFePO4材料的SEM结果 (13) 5 总结 (14) 参考文献 (14)
沃特玛电池有限公司 磷酸铁锂动力电池使用手册 电子部 2013-3-15 [为了方面售后服务更好的对OPT管理系统进行维护,特此制定本手册,希望对售后服务有所帮助]
前言 为应对日益突出的燃油供求矛盾和环境污染问题,世界主要汽车生产国纷纷加快部署,将发展新能源汽车作为国家战略,加快推进技术研发和产业化,同时大力发展和推广应用汽车节能技术。节能与新能源汽车已成为国际汽车产业的发展方向。新能源客车,目前正在飞速发展。 当新能源客车穿行于街市,走进人们的生活时,对它的了解和认知也就成我们的必修课。然而,在这新能源之风势在必行之际,谈到动力电池,我们中大多数的人对其都知之甚少,这其中包括很多从事纯电动客车工作的相关从业人员,也正因为如此,才给你们的工作和和生活到来了诸多的困难和疑惑。 为解决这些问题,让从事纯电动客车工作的相关从业人员对动力电池有一些初步的了解和认识,本手册将通过重点介绍磷酸铁锂动力电池和管理系统的运用与维护来让大家了解动力电池的相关知识。为了更好服务客户,让相关从业人员熟悉和掌握我公司的纯电动客车动力电池,也为更好的发挥磷酸铁锂动力电池优越的性能,做好相关的维护保养工作,特制定本手册。希望此举能为大家避免在使用或维护我公司产品时造成不必要的困扰和预防产生一些不可挽回的损失。 烦请在使用或维护沃特玛公司纯电动客车动力电池之前,详细阅读本手册!
目录 前言2 第一章为何选择磷酸铁锂电池作为动力电池5 1.1电池的概念 (5) 1.2磷酸铁锂电池优势: (5) 1.3动力电池种类性能对比: (5) 1.4.关键设计说明 (6) 1.5.产品用途 (7) 第二章动力电池系统构成8 2.1.电池组的主要参数(以五洲龙为例)8 2.2电池组结构说明及其示意图 (9) 第三章技术特性13 3.1 单体放电特性 (13) 3.2不同放电倍率下的放电曲线 (13) 3.3 单体充电特性 (14) 3.4 五洲龙电池系统充放电特性曲线图 (15) 3.5 保存特性 (15) 3.6寿命特性 (16) 第四章. 电池系统的使用与安装17 4.1 电池系统使用环境 (17) 4.2 电池系统的使用 (18) 4.4电池系统的安装 (18) 第五章动力电池信息仪表认识23 5.1混合动力电池信息仪表认识 (23) 5.2纯电动电池信息仪表认识 (24) 第六章动力电池存储、维护与保养25 6.1 储存、维护和保养基本要求 (25) 6.2维护与保养: (25) 6.3日常保养: (27) 6.4周保养: (28) 6.5.月保养: (29) 第七章OPT管理系统运用与维护31 7.1电池管理系统BMS基本结构 (31) 7.2 BMS管理系统安装 (33) 7.3 BMS故障处理方法 (34) 第八章紧急处理方案43
磷酸铁锂正极材料制备方法比较 A ?固相法 一.高温固相法1.流程:传统的高温固相合成法一般以亚铁盐(草酸亚铁,醋酸铁,磷酸亚铁等),磷酸盐(磷酸氢二铵,磷酸二氢铵),锂盐(碳酸锂,氢氧化锂,醋酸锂及磷酸锂等)为原料,按LiFePO4 分子式的原子比进行配料,在保护气 氛(氮气、氩气或它们与氢气的混合气体)中一步、二步或三步加热,冷却后可得 LiFePO4 粉体材料。 例1: C.H.Mi等采用一:步加热法得到包覆碳的LiFeP04,其在30C, 0.1 C 倍率下的初始放电容量达到160 mAh - g-1 ;例2:S.S.Zhang等采用二步加热法,以FeC:2O4?2H2O和LiH2PO4为原料,在氮气保护下先于350~380C加热5 h形成前驱体,再在800E下进行高温热处理,成功制备了LiFePO4/C复合材料,产物在0.02 C倍率下的放电容量为159 mAh ? g-1;例3: A.S.Andersson等采用三步加热法, 将由:Li2CO3、FeC2O4?2H2O和(NH4)2HPO4组成的前驱体先在真空电炉中于300r下预热分解,再在氮气保护下先于450r加热10 h,再于800r烧结36 h,产物在放电 电流密度为2.3 mA- g-1时放电,室温初始放电容量在136 mAh ? g-1 左右;例 4:Padhi 等以Li2CO3,Fe(CH3COO)2,NH4H2PO4 为原料,采用二步法合成了LiFePO4正极材料,其首次放电容量达110 mA-h /g;Takahashi 等以LiOH ? H2O, FeC2O4 ? 2H2O,(NH4)2HPO4 为原料,在675、725、800r 下,制备出具有不同 放电性能的产品,结果表明,低温条件下合成的产品放电容量较大;例5:韩国的Ho Chul Shin、Ho Jang等以碳酸锂、草酸亚铁、磷酸二氢铵为原料,添加5wt%的乙炔黑为碳源、以At+5%H2为保护气氛,在700r下煅烧合成10h,得到碳包覆的LiFePO4材料。经检测表明,用该工艺合成的LiFePO4制备的电池放电平台在3 4-3 5V之间,0 ? 05C首次放电比容量为150mA ? h/g;例6: 高飞、唐致远等以醋酸锂、草酸亚铁、磷酸二氢铵为原料,聚乙烯醇为碳源。混料球磨所得粒径细小,分布的悬浊液。然后将悬浊液采用喷雾干燥的方法制得LiFePO4 前驱体,再通过高温煅烧合成LiFePO4/C 正极材料,首次放电比容量最为139 ? 4mA ? h/g,并具有良好的循环性能,经10C循环50次后,比容量仅下降0 ? 15%;例7:赵新兵、周鑫等以氢氧化锂、磷酸铁、氟化锂为原料,,聚丙烯
关于磷酸铁锂电池的知识 导读:锂离子电池的正极材料主要有钴酸锂、锰酸锂、镍酸锂、三元材料、磷酸铁锂等。其中钴酸锂是目前绝大多数锂离子电池使用的正极材料。从材料的原理上讲,磷酸铁锂也是一种嵌入/脱嵌过程,这一原理与钴酸锂,锰酸锂完全相同。 磷酸铁锂电池,是指用磷酸铁锂作为正极材料的锂离子电池。锂离子电池的正极材料主要有钴酸锂、锰酸锂、镍酸锂、三元材料、磷酸铁锂等。其中钴酸锂是目前绝大多数锂离子电池使用的正极材料。从材料的原理上讲,磷酸铁锂也是一种嵌入/脱嵌过程,这一原理与钴酸锂,锰酸锂完全相同。 1.介绍 磷酸铁锂电池属于锂离子二次电池,一个主要用途是用作动力电池,相对NI-MH、Ni-Cd电池有很大优势。 磷酸铁锂电池充放电效率较高,倍率放电情况下充放电效率可达90%以上。而铅酸电池约为80%。 2.八大优势 安全性能的改善 磷酸铁锂晶体中的P-O键稳固,难以分解,即便在高温或过充时也不会像钴酸锂一样结构崩塌发热或是形成强氧化性物质,因此拥有良好的安全性。有报告指出,实际操作中针刺或短路实验中发现有小部分
样品出现燃烧现象,但未出现一例爆炸事件,而过充实验中使用大大超出自身放电电压数倍的高电压充电,发现依然有爆炸现象。虽然如此,其过充安全性较之普通液态电解液钴酸锂电池,已大有改善。寿命的改善 磷酸铁锂电池是指用磷酸铁锂作为正极材料的锂离子电池。 长寿命铅酸电池的循环寿命在300次左右,最高也就500次,而磷酸铁锂动力电池,循环寿命达到2000次以上,标准充电(5小时率)使用,可达到2000次。同质量的铅酸电池是“新半年、旧半年、维护维护又半年”,最多也就1~1.5年时间,而磷酸铁锂电池在同样条件下使用,理论寿命将达到7~8年。综合考虑,性能价格比理论上为铅酸电池的4倍以上。大电流放电可大电流2C快速充放电,在专用充电器下,1.5C 充电40分钟内即可使电池充满,起动电流可达2C,而铅酸电池无此性能。 高温性能好 磷酸铁锂电热峰值可达350℃-500℃而锰酸锂和钴酸锂只在200℃左右。工作温度范围宽广(-20C--+75C),有耐高温特性磷酸铁锂电热峰值可达350℃-500℃而锰酸锂和钴酸锂只在200℃左右。 大容量 具有比普通电池(铅酸等)更大的容量。5AH-1000AH(单体) 无记忆效应 可充电池在经常处于充满不放完的条件下工作,容量会迅速低于额定容量值,这种现象叫做记忆效应。像镍氢、镍镉电池存在记忆性,而
磷酸铁锂电池在电力储能市场的应用现状 及分析 摘要:本文通过中航锂电(洛阳)有限公司磷酸铁锂电池产品在国内电力储能市场领域的应用情况,分析国内锂电池储能市场现状,讨论了目前国内储能市场遇到的问题,探索了锂电池在电力储能市场的开发应用前景及市场运作模式。未来锂电储能市场的需求很大,但目前仍以科研示范项目为主;我国储能产业仍需要相关政府部门在颁布奖励政策、鼓励建设示范项目、建立健全产品标准化等方面做出部署,促进中国锂电储能产业发展。 关键词:磷酸铁锂电池储能应用现状 1引言 随着新能源技术的开发和应用,新能源发电项目越来越多,发电容量也越来越大。但新能源发电的可控性和电能质量等问题也随之浮现,这些问题都指向储能技术。储能是智能电网、新能源接入、分布式发电和微网以及电动汽车发展必不可少的支撑技术,这些领域巨大的发展前景也给储能创造出前所未有的机遇。未来无论是新能源智能电网建设、电动车还是风力发电、太阳能光伏发电等,其大规模推广和商业化应用,除政策等宏观环境外,前提和关键在储能技术。储能技术的好坏直接影响到新能源发电行业的发展,国家为推动储能技术的快速发展在政策上和资金上给与大力支持。目前,储能形式主要有以下几种:机械储能、化学储能、电池储能和相变储能,在各种储能形式中,化学储能是业内人士关注的热点,而化学储能中的磷酸铁锂电池(简称锂电池或锂电)储能产业链和技术最为成熟,许多国家都
已建或在建储能示范工程,锂电被认为最具有发展前景;而且,锂电池是电动车发展的首选,电动汽车为锂电池发展提供了广阔的市场前景。本文将重点阐述锂电池储能的现状,商务运作模式,并结合国内政策和市场预测对该现状进行对策分析(1)。 2国内能源背景及相关政策 2.1国内能源背景 在当今石油、天然气等不可再生能源日益枯竭的大环境下,世界各地都在寻找传统能源的替代品或者研究新能源发电技术。发展风电是解决我国能源环境问题的重要措施,根据新能源振兴规划,预计到2020 年我国风力装机容量将达到1.5 亿kW,将超过电力总装机容量的10%。 2.2新能源发展鼓励政策 《可再生能源发展“十二五”规划》中可再生能源发电在电力体系中上升为重要电源。并且制定的目标为“十二五”时期,可再生能源新增发电装机1.6亿千瓦,其中常规水电6100万千瓦,风电7000万千瓦,太阳能发电2000万千瓦,生物质发电750万千瓦,到2015年可再生能源发电量争取达到总发电量的20%以上。 财政部、国家发展改革委在《电力需求侧管理城市综合试点工作中央财政奖励资金管理暂行办法》中规定了对新能源项目建设的支持范围和奖励办法,奖励资金支持范围: (1)建设电能服务管理平台; (2)实施能效电厂; (3)推广移峰填谷技术,开展电力需求响应; (4)相关科学研究、宣传培训、审核评估等。 奖励资金奖励标准: (1)对通过实施能效电厂和移峰填谷技术等实现的永久性节约
磷酸铁锂正极材料制备方法比较 A.固相法 一.高温固相法 1.流程:传统的高温固相合成法一般以亚铁盐(草酸亚铁,醋酸铁,磷酸亚铁等),磷酸盐(磷酸氢二铵,磷酸二氢铵),锂盐(碳酸锂,氢氧化锂,醋酸锂及磷酸锂等)为原料,按LiFePO4分子式的原子比进行配料,在保护气氛(氮气、氩气或它们与氢气的混合气体)中一步、二步或三步加热,冷却后可得LiFePO4粉体材料。 例1:C.H.Mi等采用一:步加热法得到包覆碳的LiFePO4,其在30℃,0.1 C 倍率下的初始放电容量达到160 mAh·g-1;例2:S.S.Zhang等采用二步加热法,以FeC:2O4·2H2O和LiH2PO4为原料,在氮气保护下先于350~380℃加热5 h形成前驱体,再在800℃下进行高温热处理,成功制备了LiFePO4/C复合材料,产物在0.02 C倍率下的放电容量为159 mAh·g-1;例3:A.S.Andersson等采用三步加热法,将由:Li2CO3、FeC2O4·2H2O和(NH4)2HPO4组成的前驱体先在真空电炉中于300℃下预热分解,再在氮气保护下先于450℃加热10 h,再于800℃烧结36 h,产物在放电电流密度为2.3 mA·g-1时放电,室温初始放电容量在136 mAh·g-1左右;例4:Padhi等以Li2CO3,Fe(CH3COO)2,NH4H2PO4为原料,采用二步法合成了LiFePO4正极材料,其首次放电容量达110 mA·h /g;Takahashi 等以LiOH·H2O, FeC2O4·2H2O,(NH4)2HPO4为原料,在675、725、800℃下,制备出具有不同放电性能的产品,结果表明,低温条件下合成的产品放电容量较大;例5:韩国的Ho Chul Shin、Ho Jang等以碳酸锂、草酸亚铁、磷酸二氢铵为原料,添加5wt%的乙炔黑为碳源、以At+5%H2为保护气氛,在700℃下煅烧合成10h,得到碳包覆的LiFePO4材料。经检测表明,用该工艺合成的LiFePO4制备的电池放电平台在3·4-3·5V之间,0·05C首次放电比容量为150mA·h/g;例6:高飞、唐致远等以醋酸锂、草酸亚铁、磷酸二氢铵为原料,聚乙烯醇为碳源。混料球磨所得粒径细小,分布的悬浊液。然后将悬浊液采用喷雾干燥的方法制得LiFePO4前驱体,再通过高温煅烧合成LiFePO4/C正极材料,首次放电比容量最为139·4mA·h/g,并具有良好的循环性能,经10C循环50次后,比容量仅下降0·15%;例7:赵新兵、周鑫等以氢氧化锂、磷酸铁、氟化锂为原料,,聚丙烯
磷酸铁锂电池简介 1.磷酸铁锂电池定义 磷酸铁锂电池是指用磷酸铁锂作为正极材料的锂离子电池。 2.磷酸铁锂正极材料 磷酸铁锂作为锂离子电池用正极材料具有良好的电化学性能,充放电平台十分平稳,充放电过程中结构稳定。同时,该材料无毒、无污染、安全性能好、可在高温环境下使用、原材料来源广泛等优点,是目前电池界竞相开发研究的热点。该材料具有发上图所示的晶体结构。工作电压范围:2.5~3.6V,平台约3.3V,比钴酸锂电池3.7V低一些。由于该材料导电性差,需往磷酸铁锂颗粒内部掺入导电碳材料或导电金属微粒,或者往磷酸铁锂颗粒表面包覆导电碳材料,提高材料的电子电导率;或掺杂金属离子来提高导电性。这样材料的密度低,做成电池的体积比容量低,只有180Wh/L(钴酸锂可做到400Wh/L 以上),在小电池领域,同样尺寸电池只有现有电池容量的一半不到。 3.磷酸铁锂的优点: (1)安全。磷酸铁锂的安全性能是目前所有的材料中最好的。绝不用担心爆炸。 (2)稳定性高。包括高温充电的容量稳定性,储存性能等。这是最大的优点。 (3)环保。整个生产过程清洁无毒。所有原料都无毒。不像钴是有
毒的物质。 (4)价格便宜。 4.磷酸铁锂的缺点: (1)导电性差,目前可通过添加C或其它导电剂得到解决。即:LiFePO4/C正极。 (2)振实密度较低。一般只能达到1.3-1.5,电池极片的面密度低,所以同样型号的电池容量更低。从消费便携电子产品上看,磷酸铁锂没有前途,在特定的电池领域使用较有优势,如动力电池。 (3)制造成本偏高,在电池生产上加工困难、倍率放电不稳定(需要特定的电池工艺配合,受工艺影响很大)。 (4)技术还未成熟。由于振实密度低,比表面积大,需要改变电池先行工艺。而且电解液也需重新开发适用的电解液体系,用现有的成熟电解液难发挥其性能。没有批量配套的保护线路和充电器,较难在现有的电子设备上发挥出其特性,需要一个整体的行业整合。 5.磷酸铁锂电池产业:优势分析 (1)磷酸铁锂产业符合政府产业政策的导向,各国都把储能电池和动力电池的发展放在国家战略层面高度,配套资金和政策支持的力度很大,中国在这方面有过之而不及,过去关注镍氢电池,现在则把目光更多的集中到磷酸铁锂电池上。 (2)LFP代表了电池未来发展的方向,随着技术成熟,甚至可能成为
磷酸铁锂合成工艺选择 各位LFP大牛们,以下两个生产工艺,你们更看好哪个?从原料来源、成本、生产工艺复杂度、质量控制、环保等角度考虑 (一)磷酸二氢锂+ 氧化铁红 化学反应方程式:LiH2PO4 + 0.5Fe2O3 + 0.5C --> LiFePO4 + H2O + 0.5CO (二)正磷酸铁+ 氢氧化锂 化学反应方程式:FePO4 + LiOH + 0.5C --> LiFePO4 + 0.5H2O + 0.5CO两种方案消耗的C与排出的CO等量,但方案(二)排出少一半儿的水 一的优点:成本低,容量偏低 二的优点:合成材料的电性能优良, 0.5Li2CO3+ FeC2O4·2H2O+NH4H2PO4 --> LiFePO4 + H2O + 0.5CO 不过正磷酸铁好像有结晶水? 方案1. 两个都是比较常见的原料,原料质量相对稳定,供应商也相对较多。成本分两块,原料成本该路线较低,但工艺成本该路线偏高,因为其对混料与后处理的要求更高。从产品质量上来说,该工艺路线从氧化铁到最终磷酸铁锂,经历的晶体结构变化巨大,产物的颗粒也会较大,如果后处理工艺不过关,很容易导致最终产品电化学性能不过关。 方案2. 首先,你的分析有误,常规的正磷酸铁都含几份结晶水(通常是2份)。氢氧化锂是较常见的锂盐,但吸湿性较强,可能实际使用中会有一定问题,当然,你在这里采用氢氧化锂是有道理的,固相反应更容易进行。正磷酸铁,目前国内供应商的产品,质量有待提高(主要是颗粒,纯度,铁磷比)。成本上来说,该路线的材料成本肯定高于方案1,但该路线的工艺成本相对较低,因为该工艺的后处理会相对简单。产品质量方面,煅烧过程中,磷酸铁与磷酸铁锂的结构变化相对较小,如果工艺控制得当,最终产品基本能够维持原料磷酸铁的粒度大小,后处理简单,且电化学性能也会较稳定。 在我个人看来,如果真是有技术实力的公司,自产FePO4,而后制备磷酸铁锂,应该是今后的一个主流。 两种方法理论上都是可行的,但高质量的LFP合成一般不会采用以上的工艺路线,原因主要是:方法一的原料质量很难控制,易导致合成化学计量偏离。方法二除了
2010年第7期广东化工 第37卷总第207期https://www.doczj.com/doc/109563019.html, · 59 · 动力电池用正极材料磷酸铁锂的研究进展 侯贤华,胡社军,彭薇 (华南师范大学物理与电信工程学院,广东广州 510006) [摘要]文章综述了锂离子动力电池关键正极材料磷酸铁锂的产业化制备方法,市场状况分析和近年来国内外对该正极材料的研究进展情况。结果表明:产业化制备方法目前主要是固相反应法和水热合成,市场需求大于市场供给,具有很好的市场前景,高倍率磷酸铁锂将成为未来的一个重要研究方向。 [关键词]磷酸铁锂;正极材料;倍率性能 [中图分类号]TM912 [文献标识码]A [文章编号]1007-1865(2010)07-0059-02 Research Progress of LiFePO4 Cathode Materials for Power Lithium-ion Battery Hou Xianhua, Hu Shejun, Peng Wei (School of Physics and Telecommunication Engineering, South China Normal University, Guangzhou 510006, China) Abstract: The research progress in LiFePO4 Cathode materials for lithium ion battery was reviewed. The emphasis was expressed preparation method of industrialization, market analysis and cathode materials progress for the past few years. The result suggested that the industrialized method have solid state reaction and hydrothermal synthesis, market requirement is more than supply, this product has excellent market prospects, high rate property will become one of the research fields in the future. Keywords: LiFePO4;cathode material;rate property 锂离子电池因具有电压高、比能量高、工作温度范围广、 环境友好等优点,而被广泛应用于各种便携式电子产品[1-2], 如手机、数码相机、笔记本电脑和电动工具等,并有望成为未 来混合动力汽车和纯动力汽车的能源供给之一[3]。正极材料是 决定锂离子电池综合性能优劣的关键因素之一,目前商业化正 极材料主要是LiCoO2,因钴为战略资源,由此导致电池的成 本较高(目前在整个电池成本中,正极材料成本占35 %),且 LiCoO2安全性较差,因而限制了其使用范围。LiFePO4具有稳 定的橄榄石结构,理论容量约为170 mAh/g,原材料价格低廉 丰富,工作电压适中、电容量大、高放电功率、可快速充电且 循环寿命长、稳定性高,是一种理想的动力电池用正极材料。 1 磷铁铁锂晶体结构 LiFePO4晶体是有序的橄榄石型结构,属于正交晶系,空间群为Pnma,晶胞参数a = 1.0329 nm,b = 0.60072 nm,c= 0. 46905 nm。在LiFePO4晶体中氧原子呈微变形的六方密堆积,磷原子占据四面体空隙,锂原子和铁原子占据八面体空隙。八面体结构的FeO6在晶体的bc面上相互连接,在b轴方向上八面体结构的LiO6相互连接成链状结构。1个FeO6与2个LiO6共边,1个PO4和FeO6共用一条边,与LiO6共用两条边。 充放电反应是在LiFePO4和FePO4两相之间进行,如图1所示。在充电过程中,LiFePO4逐渐脱出锂离子形成FePO4,在放电过程中锂离子插入FePO4形成LiFePO4。在锂离子反复嵌入与脱出的过程中,当晶格结构由LiFePO4转变为Li1-x FePO4时,磷酸根离子(FePO4-)可稳定整个材料的晶格结构。由于在这2种物相互变过程中铁氧配位关系变化很小,故此电极材料虽然存在物相的变化,但是没有影响电化学效应的体积效应产生。当磷酸铁锂进行充电时,材料本身的体积约减少6.5 %,这也是材料具有良好循环性能的主要原因。LiFePO4的电化学曲线非常平坦,具有较高的理论容量,约为170 mAh/g。 2 磷酸铁锂产业化制备方法 目前产业化制备LiFePO4材料最常用的方法是固相法,此法工艺简单,制备条件容易控制和规模化,缺点是球磨的均匀程度以及强度同样制约了产物的性能,产物颗粒不均匀,晶形无规则,粒径分布范围广,实验周期长。S.A.Anna等测试了LiFePO4在不同温度下的充放电性能,发现即使在85 ℃下,它仍然能稳定工作,而且经过20次循环以后,60 ℃下测试的样品比23 ℃下测试的样品中的Fe3+含量低了14 % ,说明在较低温度下,锂离子的嵌入比较困难。 图1 充放电前后LiFePO4和FePO4两相图 Fig.1 The structural modes of LiFePO4 and FePO4 before and after charge/discharge 水热法也是制备磷酸铁锂的另一种常见方法,具有操作简单、物相均匀、粒径小的优点。在密闭体系中,以水为溶剂,在一定温度下,在水的自生压强下,溶液内部的金属盐具有较高的活性,在溶液中进行结晶反应。S.Yang等对水热法合成LiFePO4晶体进行了大量研究。他们发现pH值对实验结果的影响不大,而且水热法比高温固相法合成的晶体颗粒要小,Fe2+含量高。A.K.Padhi等发现用水热法在还原性条件下可得LiFePO4晶体,在氧化性条件下则得LiFePO4(OH) 晶体。当锂盐的量很少时,则会有多孔的FePO4·2H2O生成,它在高温时失水生成电化学非活性的FePO4。在用水热法合成LiFePO4晶体时要保证锂盐的量,以防止电化学非活性的FePO4晶体的生成。 除了固相法和水热法两种产业化方法外,在研究过程中还有各种各样的合成方法涌现出来,包括共沉淀法,乳化干燥法,机械化学激活法,微波炉加热法等。 3 磷酸铁锂的市场状况 采用磷酸铁锂作为锂离子电池正极材料的电池被称为磷酸铁锂电池(简称铁电池),由于铁电池的众多优点被广泛使用于各个领域。其中主要应用领域有: (1)储能设备:风力发电系统的储能设备,太阳能电池的储能设备,如太阳能LED路灯(比亚迪已经生产出该类电池); (2)电动工具:高功率电动工具、电钻、除草机等;(3)电动车辆:电动摩托车、电动自行车、电动婴儿车、电动轮椅和电动 [收稿日期] 2010-4-19 [基金项目] 国家自然科学基金资助项目(50771046) [作者简介] 侯贤华(1977-),男,湖北恩施人,博士后,主要研究方向为清洁能源材料。LiFePO4 FePO4 充电 放电
磷酸铁锂电池的安全性能研究 电动车应用最基本的要求是保证安全。电池的安全性归根到底体现的是温度问题。任何安全性问题最终的结果就是温度升高直至失控,直至出现安全事故。电池的安全性检测通常包括过充电、过放电、穿刺、挤压、跌落、加热、短路等,在这些情况下,会引起电池温度上升或部分区域温度过高,达到某一底限温度值,大量的热产生由于不能及时被消散引发一系列放热副反应,从而出现热失控。热失控一旦被引发就完全不能停止,直到所有反应物被完全地消耗,在大多数情况下导致电池的破裂,随之伴有火焰和浓烟,有时甚至是电池的爆炸。 在锂电池当中,公认的以LiFePO4为正极材料的锂电池具有最好的安全性能。主要是由于LiFePO4在高温条件下的氧保持能力好,即使在超过500℃的高温也不会失氧,比钴酸锂、锰酸锂及三元材料等药高得多。但在滥用条件下,即使LiFePO4为正极的锂电池,也会出现安全性问题。本文主要研究和分析不同的安全性检测条件对磷酸铁锂电池的安全性能检测结果的影响。 安全性问题最终的反映是热量累积或能量短时释放引起的温度迅速升高出现失控。在电池滥用过程中,产生热的原因有以下几个方面:(1)负极SEI膜的分解;(2)负极与电解质的反应;(3)电解液的热分解;(4)电解液在正极的氧化反应;(5)正极的热分解;(6)负极的热分解;(7)隔膜的溶解以及引起的内部短路。电池抵抗各种滥用的能力主要取决于产热和散热的相对速度。当电池的散热速度低于产
热速度时,它可能会遭受热失控。 1.测试对象与设备 2.试验 3.结果与分析 3.1过充电 锂离子电池在充电时发生式(1)所示的反应,Li不完全脱出,生成物为LiFePO4和FePO4。 LiFePO4——LiFePO4+FePO4+Li+xe 电池过充时,Li+大量脱出,生成的FePO4增多,引起较大的极化电阻和极化电势,使电池的电压快速升高;过多的锂脱出,极片上的粘结剂被破坏,使正极膏片从集流体上脱离,出现大面积掉膏,脱出的Li聚集在负极片上,形成点状白点;电池正极附近的高氧化氛围引起电解液氧化分解使过充电池剩余的电解液较少,电解液分解产生更多的热量和气体,使电池鼓胀加剧,爆炸的可能性加大;LiFePO4在过充时发生了不可逆分解,有氧气和含Fe的物质生成,电解液因含有Fe3+而显出黄色,与解剖电池时看到的情况一致。 水、乙醇等质子性化合物,在电池的首次充放电过程中,与LiPF6发生反应,造成HF含量的增加;而水和HF又会和SEI膜的主要成分ROCO2Li和Li2CO3反应,从而破坏SEI膜的稳定性,致使电池性能