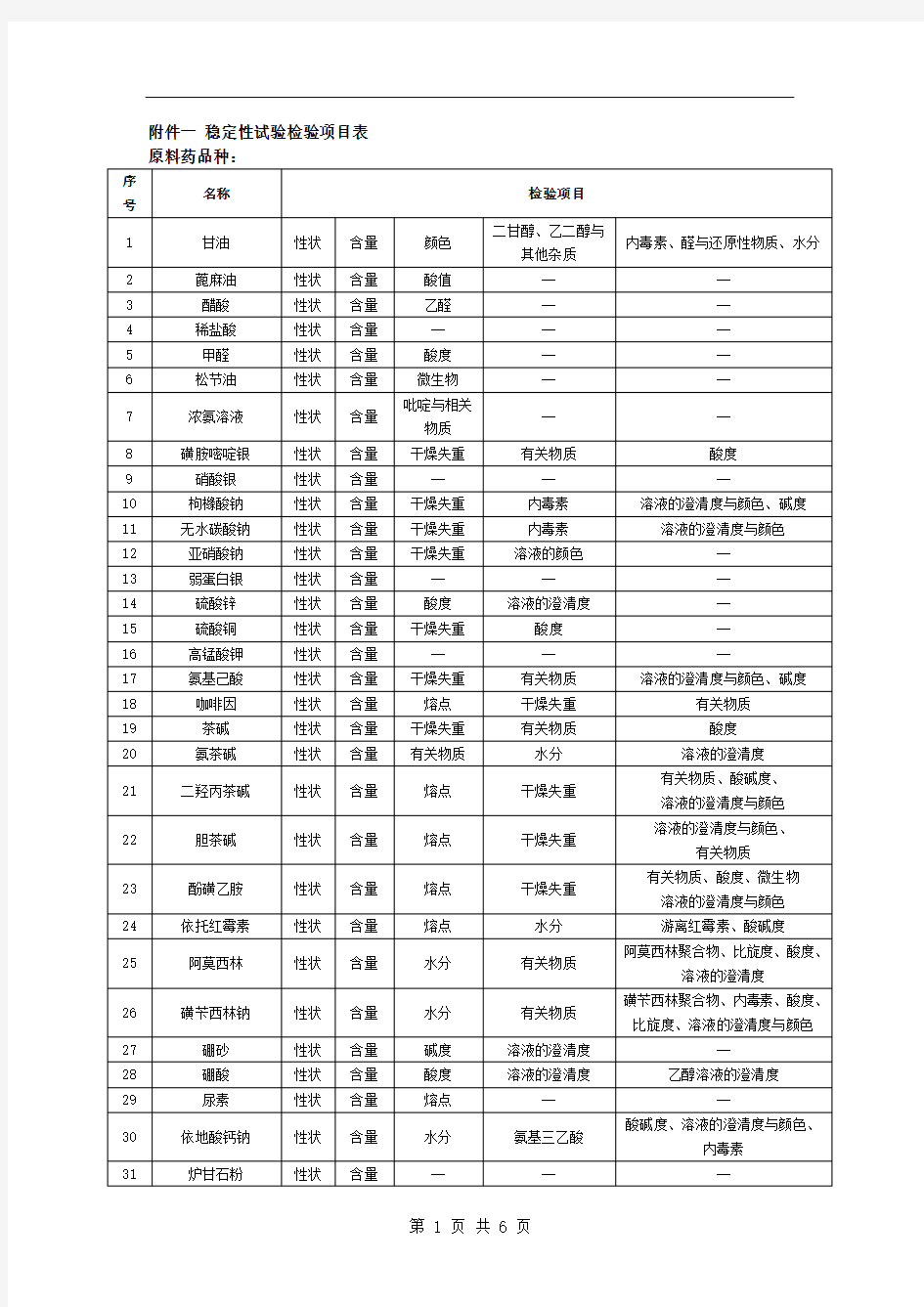
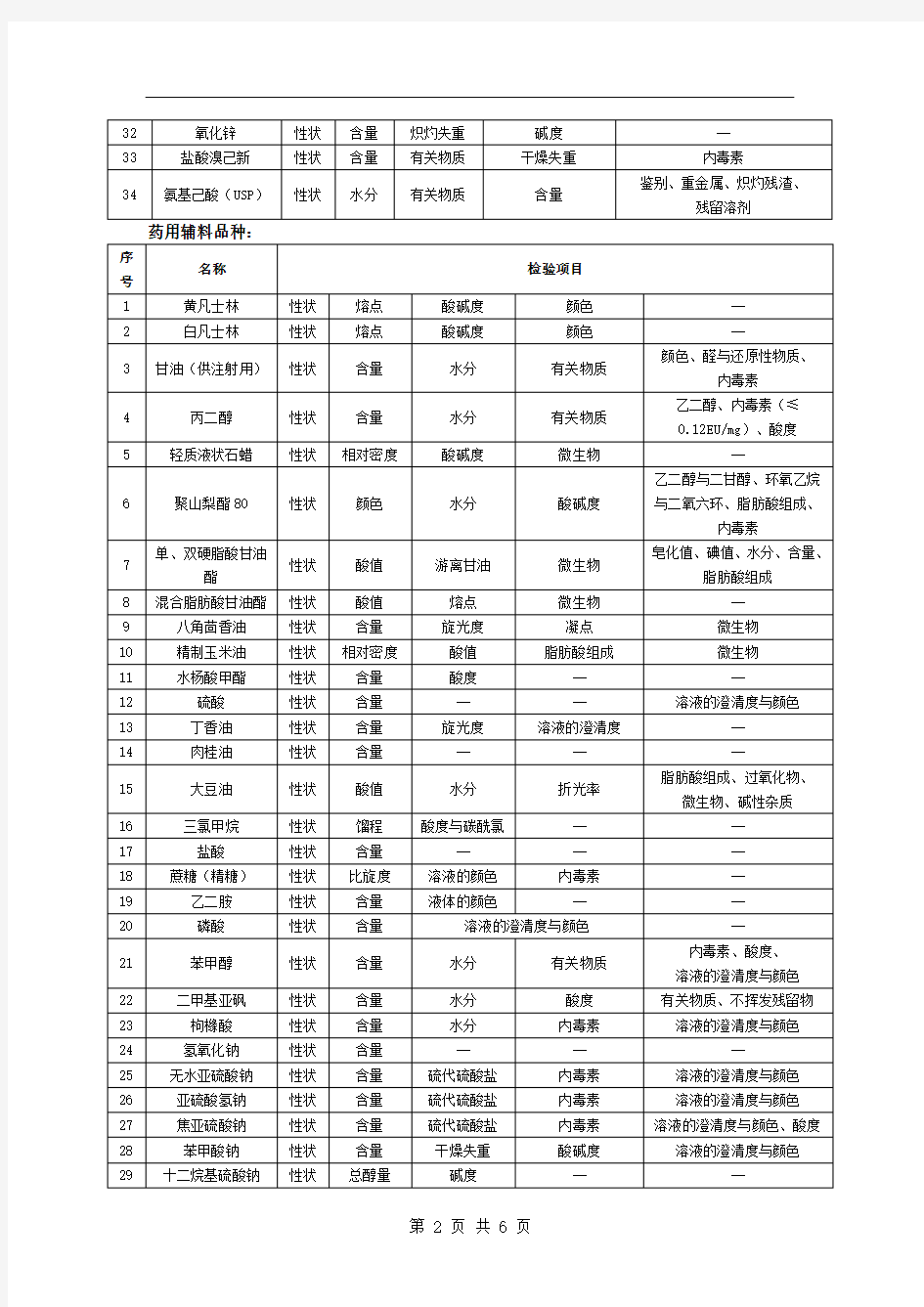
附件一稳定性试验检验项目表
35kV*** 变电站扩建工程施工 质量验收及评定 项目划分表 ** 电力集团有限责任公司 35kV*** 电站扩建工程项目部 编制说明 为规范和统一**35 kV** 变电站增容扩建工程的施工质量检查、验收和单位工程质 量评定,加强工程建设质量的管理与控制,保证工程质量,特制定本划分表。 本施工质量验收及评定项目划分表依据工程实际和现行国家有关工程质量的法律、法规、管理标准、技术规范及电力行业有关标准所编制,并符合国家标准和有关强制性标准的规定。 **35 kV** 变电站增容扩建工程施工质量验收及评定项目划分表分为单位工程、子单位工程、分部工程、子分部工程、分项工程和检验批。 检验批质量验收记录中主控项目、一般项目的划分以及“质量标准”的内容与
《35kV?110kV变电站工程施工质量验收及评定规程》一致。 检验批是按同一生产条件或规定方式汇总起来供检验用的,由一定数量样本组成的检验体;可根据施工及质量控制和专业验收需要按施工段进行划分。 分项工程按施工工艺、主要工种、材料划分,由一个或若干个检验批组成。分项工程所含的检验批均应符合合格质量的规定;所含检验批的质量验收记录应完整。如模板分项、混凝土分项等。 分部工程按专业性质、建筑部位确定的各分项工程的汇总。 工程施工质量检查、验收和单位工程质量评定均应在施工单位自行检查、评定的 基础上进行;隐蔽工程在隐蔽前应由施工单位通知有关单位进行验收并形成验评文件;涉及结构安全的试块、试件以及有关材料应按规定进行见证取样检测;工程观感质量和结构尺寸应由验收人员通过现场检查共同确认。 35kV** 变电站扩建工程质量检验项目划分表
首营企业和首营品种审核制度 1为确保经营行为的合法性,保证药品的购进质量,把好药品购进质量关,根据《药品管理法》及《药品经营质量管理规范》等法律、法规,特制定本制度。 2首营企业,是指与本企业首次发生药品供需关系的药品经营企业。首营品种,是指向某一药品生产企业首次购进的药品,包括药品的新品种、新规格、新剂型、新包装等。 3药店应对首营企业和首营品种进行质量审核,确保供货单位和所经营药品的合法性。 4购进首次经营药品或首营企业开展业务关系前,业务部门应详细填写“首营品种企业审批表”,连同规定的资料及样品报质量管理部。 5审批首营企业和首营品种的必备资料: 5.1首营企业应提供加盖首营企业原印章的合法证照复印件; 5.2与本药店进行业务联系的供货单位销售人员,应提供药品销售人员身份证复印件、首营企业质量认证的有关证明、加盖委托企业原印章和企业法定代表人印章和签字的法人委托授权书,并标明委托授权范围及有效期; 5.3购进首营品种,应提供加盖生产单位原印章的合法证照复印件、药品质量标准、药品生产批准证明文件、首营品种的药品
出厂检验报告书,以及药品包装、标签、说明书实样及批文等资料。 6质量管理部对业务部门填报的“首营品种企业审批表” 及相关资料和样品进行质量审核后,报质量负责人审批。 7首营品种及首营企业的审核以资料的审核为主,对首营企业的审批如依据所报送的资料无法作为准确的判断时,业务部门应会同质量管理部门对首营企业进行实地考察,并由质量管理部根据考察情况形成书面考察报告,再上报审批。 8首营企业和首营品种必须经质量审核批准后,方可开展业务往来,购进药品。 9首营品种或首营企业的审批原则上应在1天内完成。 10质量管理部负责收集审核批准的“首营企业审批表”和“首营品种审批表”及报批资料,建立质量档案。
如何进行工程项目划分确认 工程项目划分应在工程建设正式开工前进行,项目法人是责任单位,监理、设计、施工单位是参加单位,项目法人可以委托监理单位根据批准的设计文件和施工合同文件,组织设计、施工单位进行划分,并确定主要单位工程、主要分部工程、重要隐蔽单元工程和关键部位单元工程。项目法人在主体工程开工前应将项目划分表及说明书面报相应工程质量监督机构确认。 监督工程项目划分是质量监督的重要工作,在项目划分过程中,质量监督员应关心划分情况,收到报告后应及时组织人员对项目划分的合理性进行研究,及时确认批复。进行工程项目划分确认应注意如下问题: (一)审查单位工程、分部工程、单元工程划分原则是否正确,有无遗漏。 水利水电工程项目划分应结合工程结构特点、施工部署及施工合同要求进行,划分结果应有利于保证施工质量以及施工质量管理。水利水电工程,执行国家和水利水电行业的有关规定和标准;水利水电工程中其他行业工程执行相关行业标准,如电站厂房及泵站的房屋建筑安装工程执行建筑行业标准。 1、单位工程是工程项目划分的第一级,按下述原则划分: (1)枢纽工程:以每座独立的建筑物为一个单位工程,工程规模大时,也可将一个建筑物中具有独立施工条件的一部分划分为一个单位工程。如枢纽工程中挡水建筑物、溢洪道、放水系统、发电站、管理房屋等划分为单位工程。 (2)渠道工程:按渠道级别(干、支渠)或工程建设期、段划分,以一条干(支)渠或同一建设期、段的渠道工程为一个单位工程。大型渠道建筑物也可以每座独立的建筑物为一个单位工程。 (3)堤防工程,按招标标段或工程结构划分单位工程。规模
较大的交叉联结建筑物及管理设施以每座独立的建筑物为一个单位工程。在实际操作中可以按下述原则划分单位工程: ①一个工程项目由若干法人负责建设时,每一项目法人所负责的工程可划分为一个单位工程。 ②一个工程项目由几个施工企业施工时,每个施工企业施工的标段可划分为一个单位工程。 ③根据设计和施工部署划分为堤身、堤岸防护、交叉联接建筑物和管理设施等单位工程。 (4)水库除险加固工程,按招标标段或加固内容,并结合工程量划分单位工程。在实际操作中可以按下述原则划分单位工程: ①加固工程量大,由几个施工企业施工时,每个施工企业施工的标段可划分为一个单位工程。如每个施工企业施工的标段工程量还比较大时,以每座独立的建筑物为一个单位工程。 ②加固工程量大,由一个施工企业施工时,以每座独立的建筑物为一个单位工程。 ③加固工程量不大,由一个施工企业施工时,整个加固工程可划分为一个单位工程。小(一)型水库除险加固工程划分为一个单位工程。 2、分部工程是项目划分的第二级,在实际操作中可以按下述原则划分: (1)枢纽的土建工程按设计的主要组成部分划分分部工程,如心墙土石坝按主要组成部分:基础处理、上、下游坝壳、心墙、反滤层、坝顶等划分分部工程。 (2)水库除险加固工程,按加固内容或部位划分。在实际操作中可以按下述原则划分分部工程: ①以每座独立的建筑物为一个单位工程时,按加固设计的组成部分划分,如主坝加固工程单位工程划分为上、下游坝体加固分部工程、塑性砼防渗墙分部工程、灌浆分部工程,新建放水隧洞单位工程划分为进口段、洞身段(包含开挖、衬砌、灌浆三个类型单元工程)、出口段等分部工程。 ②整个加固工程为一个单位工程时,以每座独立的建筑物为
首营品种审核程序 1、目的:建立首营品种审核工作程序,规范首营品种购进工作,保证购进药品质量。 2、依据:〈〈药品经营质量管理规范〉〉。 3、范围:本程序规定了首营品种审核工作的内容、方法和要求,明确了相关部门或人员的职 责,适用于本企业向某一药品生产企业首次购进药品的质量审核管理。 4、职责:企业主要负责人、药品购进人员、质量管理人员和物价人员对本程序的实施负责。 5、内容: 5.1 药品购进人员购进首营品种时,应执行以上程序和要求: 5.1.1 向药品生产企业索取下列各项资料并进行验证: 5.1.1.1 加盖有药品生产企业原印章的药品生产批件及附件,包括药品质量标准和说明书的复印件。 5.1.1.2 药品包装(最小包装)、标签、说明书的样板。 5.1.1.3 该品种生产车间(或企业)如已进行GMP认证,则需索取加盖有药品生产企业原印章的GMP证书复印件。 5.1.1.4 国家的药品价格批文复印件或省级物价部门的登记证明资料。 5.1.2 填写“首营药品审批表”并附上述资料,经本部门主管加具意见后,送质量管理部门和企业主管负责人进行审批。 5.1.3 质量管理部门如对资料有其它要求的,由药品购进人员负责向厂家索取,资料完备后再送相应部门审批。 5.2 销售部门审核程序和要求:根据市场对该首营品种的接受程度、销售能力及资料审核情况,决定是否同意销售(或试销),并在“首营药品审批表”上签署具体的意见。 5.3 质量管理部门审核程序和要求: 5.3.1 检查资料是否齐全。 5.3.2 验证资料的真实性。
5.3.3 审核资料的合法性: 5.3.3.1 证明文件是否有效。 5.3.3.2 药品包装、标签和说明书是否符合法律、法规要求。 5.3.3.3 药品说明书的内容是否与国家药品监督管理部门批准的内容一致。 5.3.3.4 首营品种是否超出生产企业的生产范围和本企业经营范围。 5.3.4 资料审查符合规定的,在“首营药品审批表”上签署“符合规定,准予购进”的具体意见;凡首营品种超出生产企业的生产范围或本企业的经营范围,没有有效的证 明文件或证明文件超出有效期限的,应签署“不符合规定,不得购进”的具体意见。5.3.5 资料不齐全的,应另纸以文字形式写上原因和要求,随资料和审批表退回药品购进部门补充完备后,再行审核。 5.4 财务部门审核程序和要求:财务部门按照国家有关物价管理法规对首营品种的定价是否符合国家和地方物价管理部门的有关规定进行审核。符合规定的,在“首营药品审批表” 签署意见后退回药品购进部门;如不符合规定的,按5.3.5处理。 5.5 主管经理的审批程序和要求: 5.5.1 审核上述各部门的签署意见,如有部门不同意销售的,召集有关人员进行研究分析,确定是否接纳;如为质量管理部门不同意购进的,可对原因进行核实后,签署不同意购进的意见。 5.5.2 各部门均同意购进和销售的,主管经理可根据企业实际情况及资料审核情况,在“首营药品审批表”上签署明细的同意购进的具体意见后,;转药品购进部门办理具体购进手续。 5.6 药品购进和资料归档: 5.6.1 药品购进人员根据有关部门及主管经理审批同意购进销售的意见,办理具体购进手续,并对第一批来货向该企业索取该批号药品出厂质量检验合格报告书。 5.6.2药品购进人员将有关资料文档案管理人员存档。 5.6.3药品购进人员对不同意购进的,应向生产企业说明原因。 5.7 所有意见的签署均须有签署人全名和签署的日期。
医疗器械工作程序文件目录 一、医疗器械的米购程序 二、医疗器械产品质量检查验收程序 三、医疗器械入库储存程序 四、医疗器械产品在库养护程序 五、医疗器械产品配送出库复核程序 六、医疗器械配送退回处理程序 七、不合格医疗器械的确认处理程序 八、医疗器械拆零和拼装发货程序 九、医疗器械运送程序 十、医疗器械进货退出程序 十^一、证照资料的收集、审核、存档的程序 十二、质量事故上报处理程序 十三、首营品种的审批程序
、医疗器械的采购程序 1、目的:建立一个医疗器械商品采购的标准操作程序,以保证采购行为的规范。 2、范围:适用于医药商品采购的环节与行为。 3、责任:采购员、质管员、采购资金管理员及其部门负责人对本程序负责。 4、程序: (一)、采购计划的制定程序 1、采购部门计划员根据实际库存消耗制定年度、季度或月份进货采购计划。 2、采购计划提交采购小组(采购部、营销部、质管部、财务部人员组成)讨论、修改、审定。 3、质量管理机构对计划所列商品合法性及其供货渠道的质量信誉与质量保证能力进行审核。 4、采购部门负责人审批后交各类别采购人员具体执行。 5、临时调整采购计划、审批程序同1—4 条。 6、每月召开采购部门与营销部门、质管部、配送中心的联合会议,沟通商品在销售、使用、储运环节中的信息和存在的问题,以便及时调整购进计划。 (二)、合格供货单位的选择程序 1、采购部门应协助质量管理机构建立、健全和更新“合格供货方”资料档案。 2、首营企业按有关管理制度办理审批手续。 3、对拟采购的医疗器械,查看其合法的产品注册证,了解供货单位的质量保证能力和履行合同的能力。 4、对拟采购进口医疗器械,收集国外厂商在我国国家药品监督管理局已注册的证书,收集进口医疗器械注册证及进口检验报告书复印件加盖供货单位质管机构的红色印章。 5、根据购货计划表,以“合格供货方”档案中拟出需采购医疗器械的生产和供货单位。 6、相同品名、规格的产品应择厂、择优、就近进货。 (三)、采购合同的签订程序 1、各类别采购员应严格执行业务经营质量管理制度。 2、标准合同应明确签订以下质量条款:产品应符合质量标准和有关质量要求;附产品合格证;产品包装符合有关规定和货物运输要求;进口产品应提供符合规定的证书和文件。 3、与签订质量保证协议的供应商采取传真、电话等方式订货须建立非标准合同采购记录,对所订产品的质量有简明约定。 首营品种的审批程序
内部编号:AN-QP-HT730 版本/ 修改状态:01 / 00 In A Group Or Social Organization, It Is Necessary T o Abide By The Rules Or Rules Of Action And Require Its Members To Abide By Them. Different Industries Have Their Own Specific Rules Of Action, So As To Achieve The Expected Goals According T o The Plan And Requirements. 编辑:__________________ 审核:__________________ 单位:__________________ 首营企业和首营品种审核制度通用范 本
首营企业和首营品种审核制度通用范本 使用指引:本管理制度文件可用于团体或社会组织中,需共同遵守的办事规程或行动准则并要求其成员共同遵守,不同的行业不同的部门不同的岗位都有其具体的做事规则,目的是使各项工作按计划按要求达到预计目标。资料下载后可以进行自定义修改,可按照所需进行删减和使用。 1为确保经营行为的合法性,保证药品的购进质量,把好药品购进质量关,根据《药品管理法》及《药品经营质量管理规范》等法律、法规,特制定本制度。 2首营企业,是指与本企业首次发生药品供需关系的药品经 营企业。首营品种,是指向某一药品生产企业首次购进的药品,包括药品的新品种、新规格、新剂型、新包装等。 3药店应对首营企业和首营品种进行质量审核,确保供货单 位和所经营药品的合法性。
首营品种审核管理制度 1.目的:加强公司药品经营质量管理,确保从具有合法资格的企业购进合格的质量可靠的药品。 2、依据:《中华人民共和国药品管理法》(2019年修订版)、《药品经营质量管理规范》(国家食品药品监督管理总局令第1 3、28号)等法律、法规和规章。 3.适用范围:适用于首营品种的质量审核工作。 4.责任:采购部、质量管理部及质量负责人对本制度的实施负责。 5.内容: 5.1 首营品种是指本公司首次购进的药品(含新规格、新剂型、新包装、新品种等)。 5.2、采购员购进首营品种时,应首先对首营品种进行合法性和质量基本情况的审核,索取并审核内容包括: 5.2.1供应商为生产厂家时:采购员应向生产企业索取加盖生产厂家公章原印章的该品种的在有效期内的药品注册批件、补充证明文件复印件(如变更生产厂商名称、增加或改变规格、修改包装说明书等)、法定质量标准、省检报告(如有则提供)、该品种的省物价批文(或厂家自主定价的文件、发改委价格文件)、药品说明书、样盒及标签的原件及复印件; 5.2.2供应商为经营企业时:采购员应索取加盖供应商公章原印章的在有效期内的《药品注册批件》/《再注册批件》/《药品补充申请批件》、省检报告(如有则提供)及执行质量标准;如有可能,应索取药品的包装、标签、说明书等原件及复印件。 5.2.3采购进口药品时需要索取加盖供应商公章原印章的在有效期内的:A、《进口药品注册证》或《医药产品注册证》;B、《进口药品注册批件》复印件;C、《进口药品检验报告书》复印件或者注明“已抽取”并加盖抽样单位公章的《进口药品通关单》复印件;实行批签发管理的生物制品,除了索取A、B、C项,需要同时提供口岸所在地核发的批签发证明复印件,例如《生物制品批签发合格证》、《进口生物制品检验报告书》。 5.3 资料齐全后,采购员在计算机系统内填写《首营品种审批表》,将电子版
医疗器械工作程序文件目录 一、医疗器械的采购程序 二、医疗器械产品质量检查验收程序 三、医疗器械入库储存程序 四、医疗器械产品在库养护程序 五、医疗器械产品配送出库复核程序 六、医疗器械配送退回处理程序 七、不合格医疗器械的确认处理程序 八、医疗器械拆零和拼装发货程序 九、医疗器械运送程序 十、医疗器械进货退出程序 十一、证照资料的收集、审核、存档的程序 十二、质量事故上报处理程序 十三、首营品种的审批程序
一、医疗器械的采购程序 1、目的:建立一个医疗器械商品采购的标准操作程序,以保证采购行为的规范。 2、范围:适用于医药商品采购的环节与行为。 3、责任:采购员、质管员、采购资金管理员及其部门负责人对本程序负责。 4、程序: (一)、采购计划的制定程序 1、采购部门计划员根据实际库存消耗制定年度、季度或月份进货采购计划。 2、采购计划提交采购小组(采购部、营销部、质管部、财务部人员组成)讨论、修改、审定。 3、质量管理机构对计划所列商品合法性及其供货渠道的质量信誉与质量保证能力进行审核。 4、采购部门负责人审批后交各类别采购人员具体执行。 5、临时调整采购计划、审批程序同1—4条。 6、每月召开采购部门与营销部门、质管部、配送中心的联合会议,沟通商品在销售、使用、储运环节中的信息和存在的问题,以便及时调整购进计划。 (二)、合格供货单位的选择程序 1、采购部门应协助质量管理机构建立、健全和更新“合格供货方”资料档案。 2、首营企业按有关管理制度办理审批手续。 3、对拟采购的医疗器械,查看其合法的产品注册证,了解供货单位的质量保证能力和履行合同的能力。 4、对拟采购进口医疗器械,收集国外厂商在我国国家药品监督管理局已注册的证书,收集进口医疗器械注册证及进口检验报告书复印件加盖供货单位质管机构的红色印章。 5、根据购货计划表,以“合格供货方”档案中拟出需采购医疗器械的生产和供货单位。 6、相同品名、规格的产品应择厂、择优、就近进货。 (三)、采购合同的签订程序 1、各类别采购员应严格执行业务经营质量管理制度。 2、标准合同应明确签订以下质量条款:产品应符合质量标准和有关质量要求;附产品合格证;产品包装符合有关规定和货物运输要求;进口产品应提供符合规定的证书和文件。 3、与签订质量保证协议的供应商采取传真、电话等方式订货须建立非标准合同采购记录,对所订产品的质量有简明约定。
首营企业和首营品种审核制度 1、目的:确保企业依法经营,规范对供货企业、品种的审核工作,保证购进药品质量。 2、范围:规定首营企业、首营品种审核工作的内容。 3、职责:主管负责人、质量管理人员、购进人员、各相关人员。 4、内容: 4.1为确保企业经营行为的合法性,保证药品的购进质量,把好药品购进质量关,根据《药品管理法》及《药品经营质量管理规范》等法律、法规,特制定本制度。 4.2首营企业,是指与本企业首次发生药品供需关系的药品生产企业或药品经营企业。首营品种,是指本企业向某一药品生产企业首次购进的药品,包括药品的新品种、新规格、新剂型、新包装等。 4.3本企业应对首营企业和首营品种进行质量审核,确保供货单位和所经营药品的合法性。 4.4购进首次经营药品或与首营企业开展业务关系前,业务部门应详细填写“首营品种(企业)审批表”,连同规定的资料及样品报质量管理部。 4.5审批首营企业和首营品种的必备资料: 4.5.1首营企业应提供加盖首营企业原印章的合法证照复印件; 4.5.2与本企业进行业务联系的供货单位销售人员,应提供药品销售人员身份证复印件、首营企业质量认证的有关证明、加盖委托企业原印章和企业法定代表人印章或签字的法人委托授权书,并标明委托授权范围及有效期; 4.5.3购进首营品种时,应提供加盖生产单位原印章的合法证照复印件、药品质量标准、药品生产批准证明文件、首营品种的药品出厂检验报告书,以及药品包
装、标签、说明书实样及批文等资料。 4.6质量管理人员对业务部门填报的“首营品种(企业)审批表”及相关资料和样品进行质量审核后,报企业质量负责人审批。 4.7首营品种及首营企业的审核以资料的审核为主,对首营企业的审批如依据所报送的资料无法作出准确的判断时,业务部门应会同质量管理人员对首营企业进行实地考察,并由质量管理人员根据考察情况形成书面考察报告,再上报审批。 4.8首营企业和首营品种必须经质量审核批准后,方可开展业务往来,购进药品。 4.9首营品种或首营企业的审批原则上应在5天内完成。 4.10质量管理部负责收集审核批准的“首营企业审批表”和“首营品种审批表”及报批资料,建立质量档案。
第三章商品质量与品种 第一节商品质量概念及相关术语 ISO9402-94定义质量 反映实体满足明确或隐含需要的能力和特性组合 ISO9000-2000定义质量 产品、体系或过程的一组固有特性满足顾客和其他方要求的能力 现代商品质量观 商品质量的涵义 ? 广义:商品质量是指商品满足规定或潜在要求(或需要)的特征(同类商品不同)和特性(不同类商品)的总和 狭义:商品质量仅指商品满足规定或潜在要求(或需要)的特性的总和。 ? 广义:合狭义的商品质量和商品品种两方面的内容。 1、是商品质量特性的综合 特征是指同类商品不同品种特别显著的标志,质量管理中,特征指外观质量特性。质量中统称为特性。2、核心是满足需要 明确:国家、国际法律法规要求、各级各类的质量标准。贸易合同规定的要求 隐含:消费群体对商品的希望 内在特征满足:可靠性、寿命、适用性 外在特性满足:包装、品牌、外形、经济特 性满足(物美价廉,物有所值) 服务性满足 环境质量希望 质量意识随生产经济的发展而发展 物质需要(核心内容): 基本性能+寿命(内在质量)结实耐用 文化精神需要:外观、社会、 经济、品种、 综合质量 ☆以学生宿舍为例 内在质量:结实、保温、长久、照明、采光、通风;寿命、可靠性、安全卫生 外观质量:水泥抹灰,刷涂料、贴瓷砖、方形→曲线型、艺术标志,5# →13# 内墙涂料→麻灰→多彩喷涂→立邦漆→吊灯→吸顶灯、护栏; 外观构型。质地、色彩、气味 社会质量:满足全社会利益需要的程度 社会道德、环境污染、能源资源浪费 小造纸厂、一次性筷子。 经济质量:性能价格比、性能维护比、 家用车:以面的、夏利、奥拓为代表: 商品质量特性
XX药店管理文件 1、目的:为确保从具有合法资格的企业购进合格和质量可靠的药品。 2、依据:《药品经营质量管理规范》第70、73条,《药品经营质量管理规范实施细则》第69条。 3、适用范围:适用于首营企业和首营品种的质量审核管理。 4、责任:企业负责人、质量管理人员、采购员对本制度的实施负责。 5、内容: 5.1 首营企业的审核 5.1.1 首营企业是指购进药品时,与本企业首次发生药品供需关系的药品生产或经营企业。 5.1.2 索取并审核加盖有首营企业原印章的《药品生产(经营)许可证》、《营业执照》、企业GSP或GMP等质量体系认证证书的复印件及有法人代表签章的企业法人授权书原件,药品销售人员身份证、上岗证复印件等资料的合法性和有效性。 5.1.3 审核是否超出有效证照所规定的生产(经营)范围和经营方式。 5.1.4 质量保证能力的审核内容:GMP或GSP证书等。首营企业资料审核还不能确定其质量保证能力时,应组织进行实地考察,考察企业的生产或经营场所、技术人员状况、储存场所、质量管理体系、检验设备及能力、质量管理制度等,并重点考察其质量管理体系是否满足药品质量的要求等。
5.1.5 采购员填写《首营企业审批表》,依次送质量管理人员和企业负责人审批后,方可从首营企业购进药品,首营企业审核的有关资料应归档保存。5.2 首营品种的审核 5.2.1 首营品种是指本企业向某一药品生产企业首次购进的药品(含新规格、新剂型、新包装、新品种等)。 5.2.2 采购员应向生产企业索取该品种生产批件、法定质量标准、药品出厂检验报告书、药品说明书及药品最小包装样品等资料。 5.2.3 资料齐全后,采购员填写《首营品种审批表》,依次送质量管理人员审查合格后,企业负责人审核同意后方可进货。 5.2.4 对首营品种的合法性和质量基本情况应进行审核,审核内容包括:5.2.4.1 审核所提供资料的完整性、真实性和有效性。 5.2.4.2 了解药品的适应症或功能主治、储存条件及质量状况。 5.2.4.3 审核药品是否符合供货单位《药品生产许可证》规定的生产范围。 5.2.5 当生产企业原有经营品种发生规格、剂型或包装改变时,应按首营品种审核程序重新审核。 5.2.6 审核结论应明确,相关审核记录及资料应归档保存。 5.3 质量负责人接到首营品种后,原则上应在15天内完成审批工作。质量负责人接到首营企业后,原则上应在5天内完成审批工作。 5.4 质量负责人将审核批准的“首营企业审批表”和“首营品种审批表”及产品资料、使用说明书、标签等一起作为药品质量档案保存备查。 5.5 本制度自企业开办之日起每三个月考核一次。
首营品种审核操作规程(AHYY-QP-009-2014) 一、目的:建立首营品种审批的工作操作规程,规范首营品种购进工作,保证购进药品 质量。 二、依据:《药品管理法》《药品经营质量管理规范》《药品流通管理办法》等法律法规。 三、范围:本操作规程规定了首营品种审批工作的内容、方法和要求,明确了相关部门 或人员的职责,适用于本公司首次购进的药品审核工作。 四、职责:公司业务副总、采购部、质管部、财务部对本操作规程的实施负责。 五、术语:首营品种:本企业首次采购的药品。 六、内容: 1、药品采购人员采购首营品种时,应履行以下操作规程和要求: (1)、向供货单位索取下列各项资料并进行验证。 A、加盖有药品生产(经营)企业原印章的《药品生产(经营)许可证》、《营业执照》、 《GMP(GSP)》及药品生产批件及附件(包括药品质量标准和说明书)的复印件。 B、药品包装(最小包装)、标签、说明书的样张或符合《局24号令》包装备案证明及 药品包装(最小包装)、标签、说明书的复印件。 C、该品种生产车间(或企业)如通过GMP认证,则需索取加盖有药品生产企业原印章的 GMP证书复印件。 D、国家的药品价格批文复印件或省级物价部门的登记证明资料。 (2)、采购员进入计算机管理系统登记《首次经营品种登记表》和《首营品种审批表》等电子信息,采购部经理签署意见后附上述资料,经业务部门主管、质管部签署意见后,由质量副总进行审批。经批准同意后方可购进药品。 (3)、有关部门如对资料有其它要求的,由药品购进人员负责向厂家索取,资料完备后再送相应部门审批。 2质管部审查程序和要求:(1)、检查资料是否齐全。 (2)、验证资料的真实性。 (3)、审查资料的合法性: A、证明文件是否有效。 B、药品包装、标签和说明书是否符合《药品说明书和标签管理规定》(局24号令) 要求。 C、药品说明书的内容是否与国家食品药品监督管理部门批准的内容一致。
第一章商品学的研究对象与内容 一、名词解释 1.商品学 商品学是研究商品使用价值及其变化规律的科学。 2.商品的有形附加物 商品的有形附加物包括商品名称、商标及其注册标记或品牌、商品条码、商品包装及其标志、专利标记、商品原产地标志或证明、质量、安全及卫生标志、环境标志、商品使用说明标签或标识、检验合格证、使用说明书、维修卡、购货发票。 3.商品的使用价值 商品的使用价值是指商品对于人或社会的正面意义或积极作用,或者说是指商品具有能够满足人或社会需要的能力。 4.商品的交换使用价值 商品的交换使用价值商品的生产者、经营者用其进行交换从而获得所需要的货币,成为交换价值的物质承担者。 5.商品的消费使用价值 商品的消费使用价值商品对其消费者、用户所具有的直接的消费使用价值。由商品的有用性在实际消费中所表现出来的满足消费者需要的作用形成。 二、单项选择题 1.商品是()发展到一定历史阶段的产物。 A.劳动力; B.人类社会生产力; C.工业化; D.农业化 2.商品是具有使用价值的()。 A.劳动产品; B.社会产品; C.工业品; D.农产品 3.商品是供()消费的。 A.生产者; B.经营者; C.社会; D.城乡 4.从本质上说,消费者购买的不是商品本身,而是它的()。 A.功能/效用; B.附加服务; C.使用价值; D.价值
5.商品的使用价值就是商品的()。 A.功能; B.有用性; C.价值性; D.价格 6.商品使用价值的大小是由()来衡量的。 A.消费需要; B.商品属性; C.商品价格; D.商品品种和质量 7.商品学是研究()的科学。 A.商品质量; B.商品品种; C.商品消费; D.商品使用价值及其变化规律 8.商品学是一门()。 A.自然科学; B.技术科学; C.社会科学; D.综合性交叉应用学科 9.商品学研究的核心内容是()。 A.商品使用价值; B.商品价值; C.品种、质量及其相关问题; D.微观、宏观管理 10.商品学起源于()。 A.美国; B.英国; C.意大利; D.德国 11.商品学的产生大约在()。 A.18世纪末; B.19世纪末; C.300年前; D.400年前 12.商品学产生和发展的前提在于()。 A.第一次工业革命; B.第二次工业革命; C.商品生产的发展,特别是商人的出现; D.商业教育的发展 13.国外最早涉及商品学领域的著作是()。 A.《完美商人》; B.《商业之美》; C.《商品学导论》 14.商品学的创始人是()。 A.约翰·贝克曼; B.达尔文; C.陆羽; D.李时珍 15.()年,我国商业教育中开始把商品学作为一门必修课。 A.1902; B.1949; C.1978; D.1985 三、多项选择题 1.某些天然物品,如()等,虽然具有使用价值,但因其不是劳动产品,所
药品首营品种审核程序 1、目的:建立首营品种审核工作程序,规范首营品种购进工作,保证购进药品质量。 2、根据:《药品经营质量管理规范》第73条,《药品经营质量管理规范实施细则》第69条。 3、适用范围:本程序规定了首营品种审核工作的内容、方法和要求,明确了相关人员的职责,适用于本企业向某一药品生产企业首次购进药品的质量审核管理。 4、责任:企业负责人、采购员、质量管理人员对本程序的实施负责。 5、内容: 5.1 采购员购进首营品种时,应执行以下程序和要求: 5.1.1 向药品生产企业索取下列各项资料并进行验证: 5.1.1.1 加盖有药品生产企业原印章的药品生产批件及附件,包括药品质量标准和说明书的复印件。 5.1.1.2 药品包装(最小包装)、标签、说明书的样板,任意一批的检验合格的药品检验报告书。 5.1.1.3 该品种生产车间(或企业)如已进行GMP认证,则需索取加盖有药品生产企业原印章的GMP证书复印件。 5.1.1.4 国家的药品价格批文复印件或省级物价部门的登记证明资料。
5.1.1.5 对药品生产企业证照和销售人员的资格等文件的索取同首营企业的要求,或可从首营企业审批材料中复印(同时注明复印于何处)。 5.1.2 填写《首营品种审批表》并附上述资料,依据市场对该首营品种的接受程度、销售能力及资料审核情况,决定是否统一销售(或试销),并在《首营药品审批表》上签署具体的意见后,送质量管理人员和企业负责人进行审批。 5.1.3 质量管理人员如对资料有其他要求的,由采购员负责向厂家索取,资料完备后再送质量管理人员审批。 5.2 质量管理人员审核程序和要求: 5.2.1 检查资料是否齐全。 5.2.2 验证资料的真实性。 5.2.3 审核资料的合法性: 5.2.3.1 证明文件是否有效。 5.2.3.2 药品包装、标签和说明书是否符合法律、法规要求。 5.2.3.3 药品说明书的内容是否与国家食品药品监督管理部门批准的内容一致。 5.2.3.4 首营品种是否超出生产企业的生产范围和本企业经营范围。 5.2.4 资料审查符合规定的,在《首营药品审批表》上签署“审核合格,请企业负责人审批”的具体意见;凡首营品种超出生产企业的生产范围或本企业的经营范围、没有有效的证明
首营企业和首营品种审核程序 1.目的:通过规范首营企业和首营品种的质量报验和审批程序,保证药品的购进质量,确保企业经营行为的合法性。 2.适应范围:适应于首营企业和首营品种的质量审核。 3.职责分工: 3.1采购员负责供货方选择、首营企业和首营品种资料的索要及资料的初审; 3.2质量管理部负责首营企业和首营品种的审核; 3.3财务部负责对首营品种价格和利润的审核以及核对供货企业所开票据与首营审核的相关资料相符; 3.4企业法定代表人负责对首营企业和首营品种的审批。 4.程序: 4.1供货方的选择按《药品购进程序》的相关规定执行。 4.2首营企业的审核:对首次发生业务活动的药品生产或经营企业,除按选择供货方的条件进行评价考察外,还应填报“首营企业审批表”。 4.2.1 首先由采购员向供货单位索要相关的资料,并加盖其公章原印章: A.《药品生产许可证》或者《药品经营许可证》复印件(带企业原印章); B.营业执照及其年检证明复印件(带企业原印章); C.《药品生产质量管理规范》认证证书或者《药品经营质量管理规范》认证证 书复印件; D.相关印章、随货同行单(票)样式; E.开户户名、开户银行及账号; F.《税务登记证》和《组织机构代码证》复印件。 4.2.2对与本企业进行业务联系的供货方销售人员,应进行合法资格的验证,索取以下相关证明资料: A.加盖供货方原印章并有法定代表人印章或签字的法人授权委托书原件;委托 书应明确规定授权范围及有效期。 B.药品销售人员的身份证复印件。 4.2.3 采购员对首营企业的资料初审合格后,报质量部,由质量部负责人进行审核,审核合格的将首营企业的信息录入系统中,并打印出“首营企业审批表”,报质量副总经理批准后,采购员方可与供货单位签订购销合同和“质量保证协议书”。 4.3首营品种的审核:从药品生产企业首次购进的药品,应填报“首营品种审批表”。 4.3.1首先由采购员向药品生产企业索取首营品种的有关资料,包括:
首营企业和首营品种审 核制度 Standardization of sany group #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#
1. 目的:加强公司经营质量管理,确保从具有合法资格的企业购进合法和质量可靠的药品。 2.适应范围:适用于公司对首营企业合法资格、质量信誉和首营品种合法性、质量可靠性的审核工作。 3.定义: 3.1首营企业:购进药品时,与本企业首次发生供需关系的药品生产或经营企业。 3.2首营品种:本企业向某一药品生产企业首次购进的药品(含新规格、新剂型、新包装等)。 4.职责: 4.1药品采购部门负责药品供应厂商的选择和评价。 4.2质量管理部负责首营企业和首营品种质量审核。 4.3公司主管经理负责首营企业、首营品种的审批。 5.工作内容: 5.1首营企业的审核 5.1.1对首营企业应进行包括合法资格和质量信誉的审核。审核内容包括: ①索取并审核加盖首营企业原印章的《药品生产(经营)许可证》、《营业执照》、质量管理体系认证证书复印件以及有供货单位法定代表人签字或盖章的企业法定代表人授权委托书原件、药品销售人员身份证复印件、岗位证书、质量保证协议书等资料的完整性、真实性及有效性。
②审核是否超出有效证照所规定的生产(经营)范围和经营方式。 ③经营特殊管理药品的首营企业,还必须审核其经营特殊管理药品的合法资格,索取加盖首营企业原印章的药品监督管理部门的批准文件。 5.1.2对首营企业资料审核还不能确保其质量保证能力时,药品采购部门应会同质量管理部进行实地考察,并重点考察其质量管理体系是否满足药品质量的要求等。 5.1.3首营企业的审核由采购部门填写《首营企业审批表》,质量管理部在一个工作日内审核完成,报公司主管质量负责人批准后,方可购进。 5.1.4首营企业审核的记录和有关资料,按《资料档案管理程序》有关规定要求归档保存。 5.2首营品种的审核 5.2.1对首营品种应进行合法性和质量基本情况的审核,审核内容包括: ①直接从生产企业购进药品应审核加盖供货单位原印章的合法证照、药品生产批准文件、法定的药品质量标准、若有商品名称则要提供同意其使用该名称的批件、商标注册证批件、价格批文、所购进批号的出厂检验报告书和药品的包装、标签、说明书实样等资料的完整性、真实性及有效性。 ②生物制品应审核加盖供货单位质检机构原印章的中国药品生物制品检定所出具的对该品种的《药品检验报告书》及所购批号的出厂检验报告书。
1. 目的:加强公司经营质量管理,确保从具有合法资格的企业购进合法和质量可靠的药品。 2.适应范围:适用于公司对首营企业合法资格、质量信誉和首营品种合法性、质量可靠性的审核工作。 3.定义: 首营企业:购进药品时,与本企业首次发生供需关系的药品生产或经营企业。 首营品种:本企业向某一药品生产企业首次购进的药品(含新规格、新剂型、新包装等)。 4.职责: 药品采购部门负责药品供应厂商的选择和评价。 质量管理部负责首营企业和首营品种质量审核。 公司主管经理负责首营企业、首营品种的审批。 5.工作内容: 首营企业的审核 对首营企业应进行包括合法资格和质量信誉的审核。审核内容包括: ①索取并审核加盖首营企业原印章的《药品生产(经营)许可证》、《营业执照》、质量管理体系认证证书复印件以及有供货单位法定代表人签字或盖章的企业法定代表人授权委托书原件、药品销售人员身份证复印件、岗位证书、质量保证协议书等资料的完整性、真实性及有效性。 ②审核是否超出有效证照所规定的生产(经营)范围和经营方式。
③经营特殊管理药品的首营企业,还必须审核其经营特殊管理药品的合法资格,索取加盖首营企业原印章的药品监督管理部门的批准文件。 对首营企业资料审核还不能确保其质量保证能力时,药品采购部门应会同质量管理部进行实地考察,并重点考察其质量管理体系是否满足药品质量的要求等。 首营企业的审核由采购部门填写《首营企业审批表》,质量管理部在一个工作日内审核完成,报公司主管质量负责人批准后,方可购进。首营企业审核的记录和有关资料,按《资料档案管理程序》有关规定要求归档保存。 首营品种的审核 对首营品种应进行合法性和质量基本情况的审核,审核内容包括: ①直接从生产企业购进药品应审核加盖供货单位原印章的合法证照、药品生产批准文件、法定的药品质量标准、若有商品名称则要提供同意其使用该名称的批件、商标注册证批件、价格批文、所购进批号的出厂检验报告书和药品的包装、标签、说明书实样等资料的完整性、真实性及有效性。 ②生物制品应审核加盖供货单位质检机构原印章的中国药品生物制品检定所出具的对该品种的《药品检验报告书》及所购批号的出厂检验报告书。 ③进口药品应审核加盖有供货经营单位质检机构原印章《进口药品注册证》、《进口药品检验报告书》复印件。 ④进口预防性生物制品、血液制品审核加盖供货经营单位质量检验机构原印章《生物制品进口批件》、《进口药品检验报告书》复印件。
首营企业和首营品种审核制度一:首营企业: 1.“首营企业”指购进药品时,与本公司首次发生供需关系的药品生产或经营企业。? 2.采购部和质量管理部对首营企业应进行包括资格和质量保证能力的审核。审核内容包括:?索取并审核加盖有首营企业原印章的《药品生产(经营)许可证》、营业执照、GMP或GSP认证证书及有法人代表签章的企业法人授权委托书原件、药品销售人员身份证明等资料的完整性、真实性和有效性;? 3.?审核是否超出有效证照所规定的生产(经营)范围和经营方式。? 4.对首营企业资料审核还不能确保其质量保证能力时,应组织进行实地考察,并重点考察其质量管理体系是否满足药品质量的要求等。? 5.首营企业审核按《首营企业审核程序》执行,审核合格的企业方可成为公司合格的供应商。? 6.首营企业资料经审批后由采购部归档保存。? 二、首营品种? 1、“首营品种”指本公司向某一药品生产企业首次购进的药品(含新规格、新剂型、新包装等)。? 2、?对首营品种应进行合法性和质量基本情况的审核。审核内容包括:?
3、?索取并审核加盖有供货单位原印章的合法证照、药品生产批文、质量标准、说明书、价格批文、所购进批号药品的出厂检验合格报告书和药品的最小包装等资料的完整性、真实性及有效性;? 4、了解药品的性能、用途、检验方法、储存条件以及质量状况;? 5、审核药品是否符合供货单位《药品生产许可证》规定的生产范围,严禁采购超生产范围的药品。? 6、当生产企业原有经营品种发生规格、剂型或包装改变时,应按首营品种重新审核。? 7、首营品种审核方式:由采购部填写《首营品种审批表》,经采购部经理、质量管理部经理和主管副总经理审核批准后,方可购进。? 8、首营品种审批按《首营品种审核程序》执行。 9、首营品种资料经审批后由采购部进行归档保存。?
首营企业和首营品种审核程序 1.目的:通过规范首营企业和首营品种的质量报验和审批程序,保证药品的购进质量,确保企业经营行为的合法性。 2.适应范围:适应于首营企业和首营品种的质量审核。 3.职责分工: 3.1采购员负责供货方选择、首营企业和首营品种资料的索要及资料的初审; 3.2质量管理部负责首营企业和首营品种的审核; 3.3财务部负责对首营品种价格和利润的审核以及核对供货企业所开票据与首营审核的相关资料相符; 3.4企业法定代表人负责对首营企业和首营品种的审批。 4.程序: 4.1供货方的选择按《药品购进程序》的相关规定执行。 4.2首营企业的审核:对首次发生业务活动的药品生产或经营企业,除按选择供货方的条件进行评价考察外,还应填报“首营企业审批表”。 4.2.1 首先由采购员向供货单位索要相关的资料,并加盖其公章原印章: A.《药品生产许可证》或者《药品经营许可证》复印件(带企业原印章); B.营业执照及其年检证明复印件(带企业原印章); C.《药品生产质量管理规范》认证证书或者《药品经营质量管理规范》认证证 书复印件; D.相关印章、随货同行单(票)样式; E.开户户名、开户银行及账号;
F.《税务登记证》和《组织机构代码证》复印件。 4.2.2对与本企业进行业务联系的供货方销售人员,应进行合法资格的验证,索取以下相关证明资料: A.加盖供货方原印章并有法定代表人印章或签字的法人授权委托书原件;委托 书应明确规定授权范围及有效期。 B.药品销售人员的身份证复印件。 4.2.3 采购员对首营企业的资料初审合格后,报质量部,由质量部负责人进行审核,审核合格的将首营企业的信息录入系统中,并打印出“首营企业审批表”,报质量副总经理批准后,采购员方可与供货单位签订购销合同和“质量保证协议书”。 4.3首营品种的审核:从药品生产企业首次购进的药品,应填报“首营品种审批表”。 4.3.1首先由采购员向药品生产企业索取首营品种的有关资料,包括: A.药品生产批准证明文件复印件(带企业原印章); B.药品质量标准复印件(带企业原印章); C.药品小包装,标签,说明书样本; D.药品检验报告书(带质量检验原印章); E.生物制品批签发合格证书复印件(带企业原印章) F.供审核用的样品; G.药品的物价批文(带企业原印章); 4.3.2 采购员对首营品种的资料初审合格后,报质量部,由质量部负责人进行审核,审核合格的将首营品种的信息录入系统中,并打印出“首营品种审批表”,报质量副总经理批准后,采购员方可并编制采购计划,首营品种首次进货时应附当批出厂检验报告。 4.4.“首营企业审批表”由质量管理员统一存放于供货方质量档案中,“首营品种审批表”由质量管理员与产品的相关资料一起建立产品质量档案,统一存放于产品质量档案中。