第三节分子的性质
第二课时
【学习目标】
1.范德华力、氢键及其对物质性质的影响
2.能举例说明化学键和分子间作用力的区别
3.例举含有氢键的物质
【学习过程】
【知识梳理】
二、范德华力及其对物质性质的影响
范德华力:分子间普遍存在的作用力,又叫分子间作用力。范德华力很弱,约比化学键小l一2数量级。
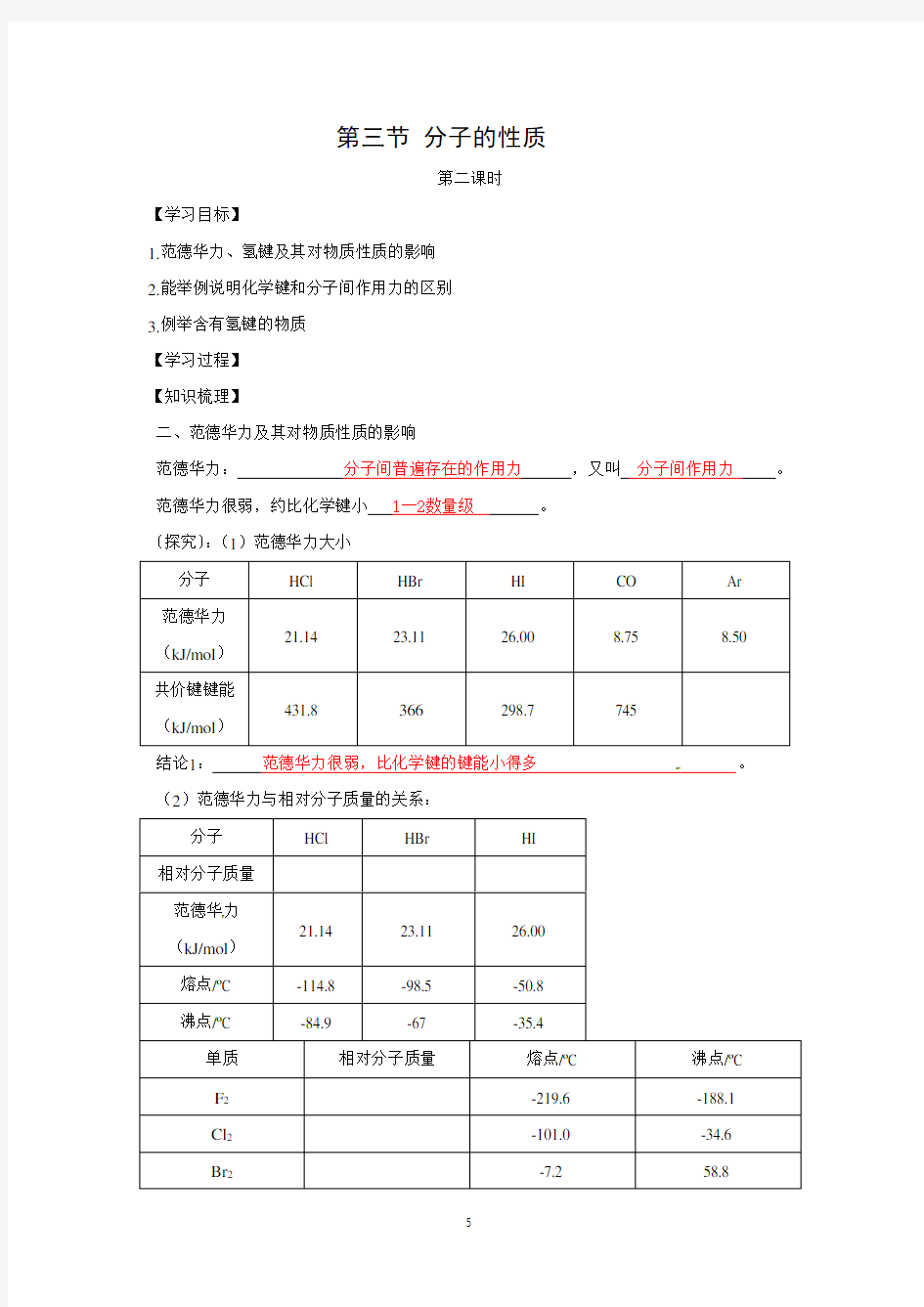
〔探究〕:(1)范德华力大小
分子HCl HBr HI CO Ar
范德华力
21.14 23.11 26.00 8.75 8.50
(kJ/mol)
共价键键能
431.8 366298.7 745
(kJ/mol)
结论1:范德华力很弱,比化学键的键能小得多。(2)范德华力与相对分子质量的关系:
分子HCl HBr HI
相对分子质量
范德华力
21.14 23.11 26.00
(kJ/mol)
熔点/oC -114.8 -98.5 -50.8
沸点/oC -84.9 -67 -35.4
单质相对分子质量熔点/oC 沸点/oC
F2-219.6 -188.1
Cl2-101.0 -34.6
Br2-7.2 58.8
I2113.5 184.4
结论2:相对分子质量越大,范德华力越大。
(3)范德华力与分子的极性的关系:
分子相对分子质量分子的极性熔点/oC 沸点/oC
CO 28 -205.05 -191.49
N228 -210.00 -195.81
结论3:分子的极性越大,范德华力越大。
三、氢键及其对物质性质的影响
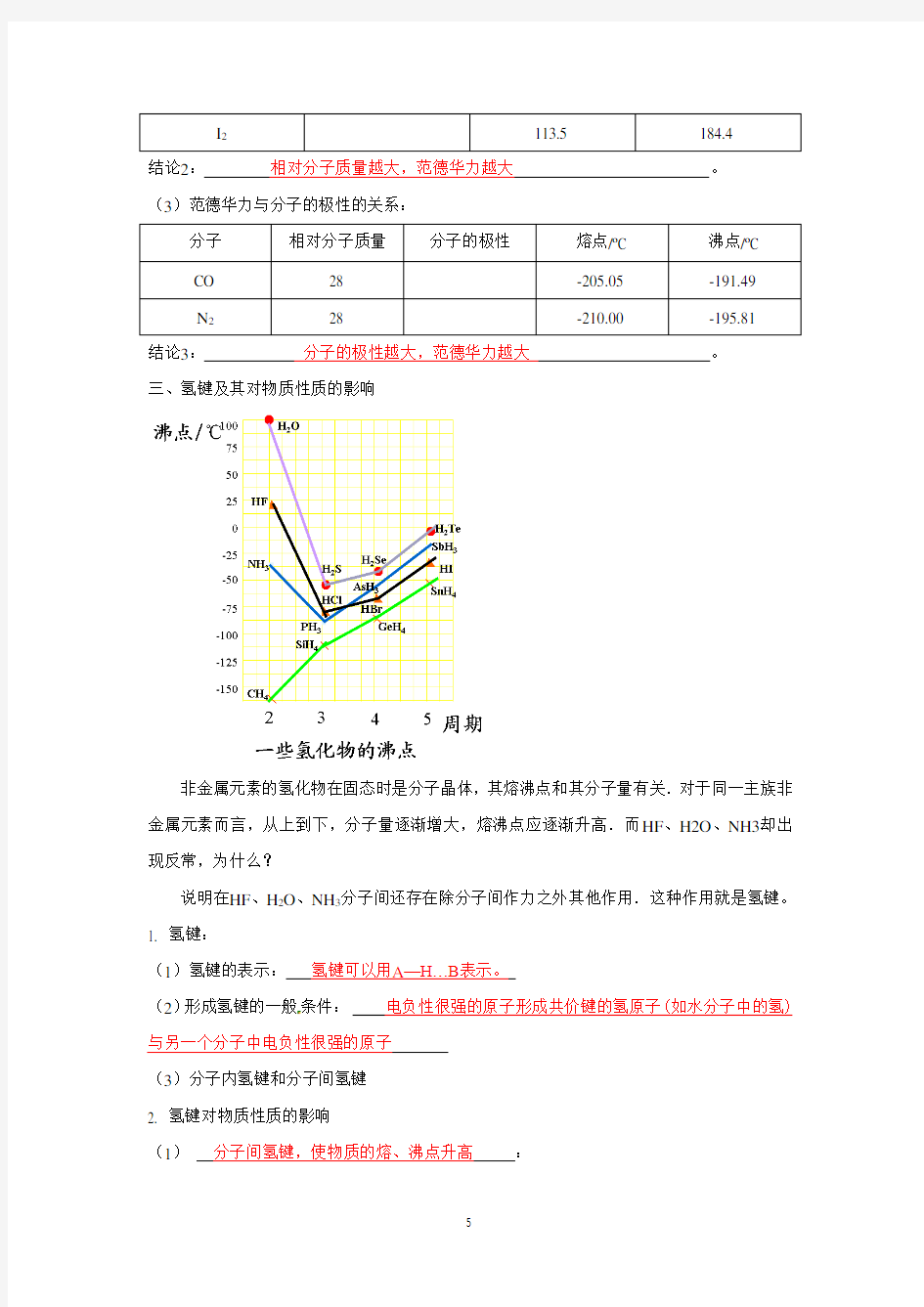
非金属元素的氢化物在固态时是分子晶体,其熔沸点和其分子量有关.对于同一主族非金属元素而言,从上到下,分子量逐渐增大,熔沸点应逐渐升高.而HF、H2O、NH3却出现反常,为什么?
说明在HF、H2O、NH3分子间还存在除分子间作力之外其他作用.这种作用就是氢键。
1. 氢键:
(1)氢键的表示:氢键可以用A—H…B表示。
(2)形成氢键的一般条件:电负性很强的原子形成共价键的氢原子(如水分子中的氢)与另一个分子中电负性很强的原子
(3)分子内氢键和分子间氢键
2. 氢键对物质性质的影响
(1)分子间氢键,使物质的熔、沸点升高:
(2)分子间内氢键,使物质的熔、沸点降低:
思考:氢键是否属于“化学键”?它与化学键、分子间作用力(范德华力)有什么关系?
化学键>氢键>范德华力
【典题解悟】
例1. 下列物质的沸点,从高到低的顺序正确的是()
A.HI>HBr>HCl>HF
B.CI4>CBr4>CCl4>CF4
C.NaCl>Na Br>KBr
D.Na>Mg>Al
解析:HI、HBr、HCl三个分子结构相似,相对分子质量依次减小,范德华力依次减弱,熔、沸点依次变小,而HF中还存在氢键,故HF的熔、沸点反常,为最大,则沸点大小顺序为HF>HI>HBr>HCl;而CI4、CBr4、CCl4、CF4结构相似,相对分子质量依次减小,范德华力依次减弱,熔、沸点依次变小;NaCl、NaBr、KBr中存在离子键,离子所带电荷相同,离子间距依次变大,故离子键的作用力依次变小,沸点依次变小;Na、Mg、Al是金属,它们的原子最外层价电子数依次为1、2、3,Na+、Mg2+、Al3+半径依次变小,故金属键的作用力依次增大,沸点依次变大。
答案:BC
例2. 下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
解析:A选项与化学键有关,水加热到很高的温度都难以分解说明O—H键能大,不易
答案:B
【当堂检测】
1.当SO3晶体熔化或气化时,下列各项中发生变化的是()
A.分子内化学键B.分子间距离C.分子构型D.分子间作用力
2.下列说法正确的是()()A.氢键是一种化学键
B.甲烷可与水形成氢键
C.乙醇与水分子之间既有范德华力又有氢键
D.碘化氢的沸点比氯化氢高的原因是碘化氢分子存在氢键
3.关于氢键,下列说法正确的是()
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
4.水分子间由于氢键的存在,易发生缔合现象,可把水写成(H2O)n。在冰中的n值为5,即每个水分子都被其他4个水分子包围形成变形四面体。如右图所示的(H2O)5单元是由无限个这样的四面体通过氢键相互连接成一个庞大的分子晶体即冰。下列有关叙述正确的是()A、2mol冰中有4mol氢键
B、1mol冰中有4mol氢键
C、平均每个水分子只有2个氢键
D、平均每个水分子只有5/4个氢键
5.下列化合物中氢键最强的是( )
A.CH3OH B.HF C.H2O D.NH3
6.下列现象中,其原因与氢键存在无关的是( )
A、水的熔沸点比较高
B、HCl的熔沸点比HF高
C、NH3极容易溶于水
D、邻位羟基苯甲醛的沸点比对位羟基苯甲醛沸点低
7.下列说法正确的是( )
A.含有极性键的分子一定是极性分子
B.范德华力就是分子间的万有引力
C、氢键就是氢原子和其他原子形成的化学键
D、氢键的作用力大小介于范德华力和化学键之间
8.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
A.液溴和苯分别受热变为气体
B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化
D.食盐和葡萄糖分别溶解在水中
9. H2O与H2S结构相似,都是V型的极性分子,但是H2O的沸点是100℃,H2S的沸点是—60.7℃。引起这种差异的主要原因是()
A.范德华力
B.共价键
C.氢键
D.相对分子质量
10. 干冰熔点很低是由于()。
A.CO2是非极性分子
B.C=O键的键能很小
C.CO2化学性质不活泼
D.CO2分子间的作用力较弱
参考答案
1.BD
2.C 3.C 4.A 5.B 6.C 7.D 8.A 9.C 10.D