
Chapter 10 Conditional stability constant
and complexometric titration
教学要求
1. 了解分析化学中EDTA 及其螯合物的分析特性;
2. 掌握络合平衡的副反应系数和条件稳定常数的计算;
3. 了解金属离子指示剂的作用原理、指示剂的选择原则及常用的金属离子指示剂
的使用条件;
4. 熟悉络合滴定曲线、化学计量点和滴定突跃;
5. 了解络合滴定的应用及计算。
课时分配(8学时)
1. EDTA :络合滴定最重要的滴定剂,条件稳定常数(3学时)
逐级稳定常数,不稳定常数,累积稳定常数,副反应系数,酸效应和酸效应系数,条件稳定常数
2. 络合滴定原理,滴定干扰的消除 (3学时)
金属指示剂,络合滴定曲线,突跃,滴定干扰及消除,掩蔽和络合掩蔽剂 3. 络合滴定方式 (2学时) 返滴定,置换滴定
以络合剂与金属离子间的络合物形成反应为基础的滴定叫络合滴定(complexometric titration or complexometry)。沉淀滴定和络合滴定都看作是酸碱滴定, 即广义酸和广义碱之间的滴定。
10.1 EDTA:络合滴定最重要的滴定剂
EDTA 是乙二胺四乙酸(ethylenediamine tetraacetic acid)的英文缩写,通常用H 4Y 代表其化学式。H 4Y 本身在水中的溶解度不大(295K 时, 每100g 水中溶解0.02 g), 作为滴定剂常用其二钠盐Na 2H 2Y·2H 2O(295K 时, 每100g 水中溶解11.1 g)。图10.1给出了EDTA 负四价阴离子(Y 4-)的结构, 它以其2个氨基氮原子和4个羧基氧原
第10章
条件稳定常数和络合滴定
子与金属离子配位形成六齿配位的螯合物。EDTA 在络合滴定中得到广泛应用, 是基于与金属离子形成的螯合物具有以下特点:
1. 普遍性 由于结构中存在6个可以提供孤对电子的配位原子, EDTA 几乎能与所有金属离子形成稳定的螯合物。
2. 组成确定 大多数金属离子的配合物中, 金属与EDTA 按1:1配位, 计算十分方便。
3. 可溶性 EDTA 与金属离子形成的配合物易溶于水。
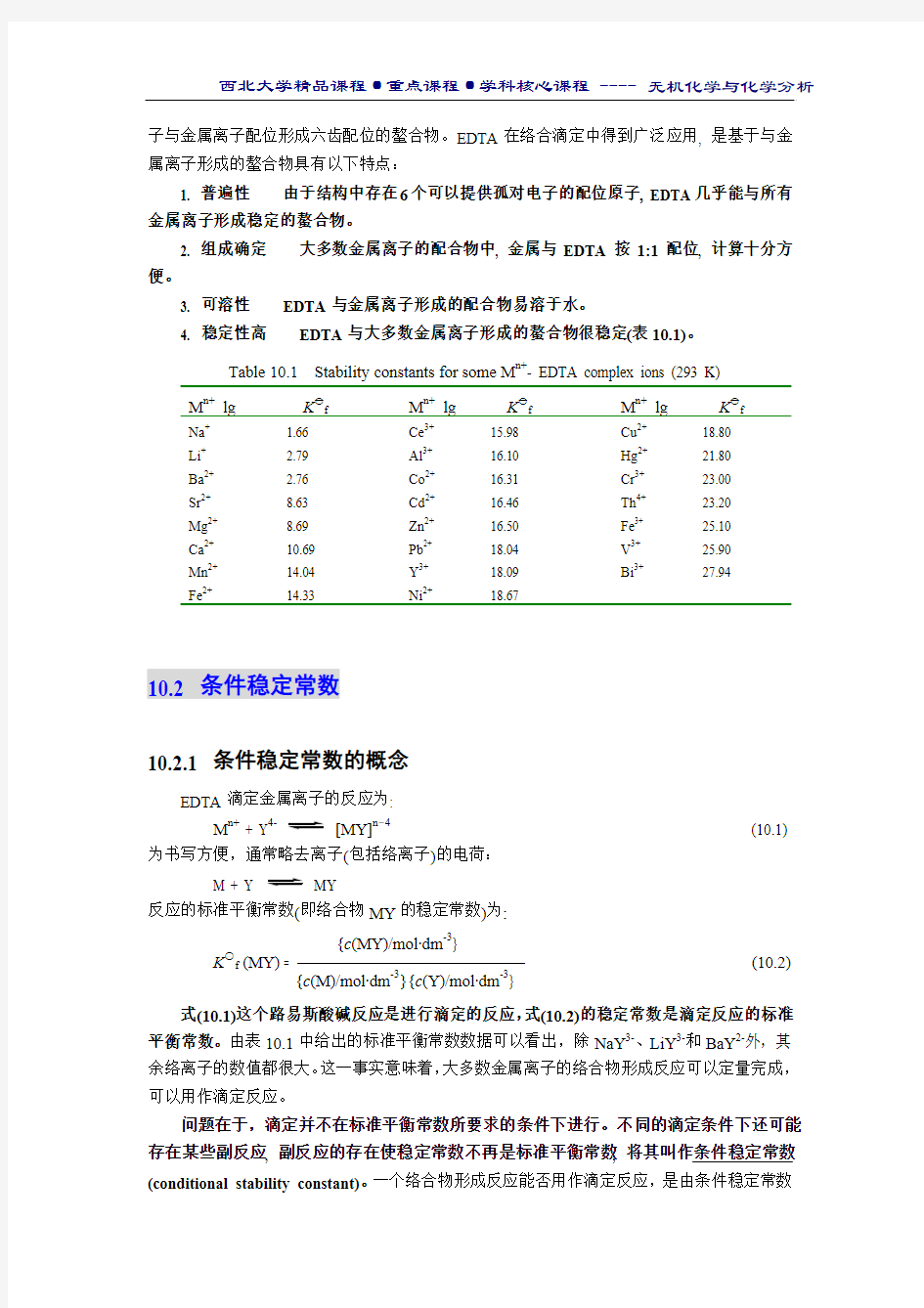
4. 稳定性高 EDTA 与大多数金属离子形成的螯合物很稳定(表10.1)。 Table 10.1 Stability constants for some M n+- EDTA complex ions (293 K)
M n+ lg K ○一
f
M n+ lg K ○一
f
M n+ lg K ○一
f
Na + Li + Ba 2+ Sr 2+ Mg 2+ Ca 2+ Mn 2+ Fe 2+
1.66
2.79 2.76 8.63 8.69 10.69 14.04 14.33
Ce 3+ Al 3+ Co 2+ Cd 2+ Zn 2+ Pb 2+ Y 3+ Ni 2+
15.98 16.10 16.31 16.46 16.50 18.04 18.09 18.67
Cu 2+ Hg 2+ Cr 3+ Th 4+ Fe 3+ V 3+ Bi 3+
18.80 21.80 23.00 23.20 25.10 25.90 27.94
10.2 条件稳定常数
10.2.1 条件稳定常数的概念
EDTA 滴定金属离子的反应为: M n+ + Y 4- n -4 (10.1) 为书写方便,通常略去离子(包括络离子)的电荷: M + Y
MY
反应的标准平衡常数(即络合物MY 的稳定常数)为:
{c (MY)/mol·dm -3}
K ○一
f
(MY) = —————————————— (10.2) {c (M)/mol·dm -3}{c (Y)/mol·dm -3}
式(10.1)这个路易斯酸碱反应是进行滴定的反应,式(10.2)的稳定常数是滴定反应的标准平衡常数。由表10.1中给出的标准平衡常数数据可以看出,除NaY 3-、LiY 3-和BaY 2-外,其余络离子的数值都很大。这一事实意味着,大多数金属离子的络合物形成反应可以定量完成,可以用作滴定反应。
问题在于,滴定并不在标准平衡常数所要求的条件下进行。不同的滴定条件下还可能存在某些副反应, 副反应的存在使稳定常数不再是标准平衡常数, 将其叫作条件稳定常数(conditional stability constant)。一个络合物形成反应能否用作滴定反应,是由条件稳定常数
决定的。溶液酸度是影响滴定的最重要的条件, 本章只介绍不同酸度条件下的条件稳定常数。
10.2.2 EDTA的酸效应
1. EDTA的离解平衡EDTA(H4Y)在高酸度溶液中以H6Y2+的形式存在, 多出的两个质子分别键合于两个氨基N原子上(注意, N原子上有孤对电子)。六元酸H6Y2+在水溶液中存在六级电离平衡:
H6Y2+(aq) + H2O(l) H3O+ + H5Y+(aq) H5Y+(aq) + H2O(l) H3O+ + H4Y(aq) H4Y(aq) + H2O(l) H3O+ + H3Y-(aq) H3Y-(aq) + H2O(l) H3O+ + H2Y2-(aq) H2Y2-(aq) + H2O(l) H3O+ + HY3-(aq) HY3-(aq) + H2O(l) H3O+ + Y4-(aq) K○一1 = 10-0.9 K○一2 = 10-1.6 K○一3 = 10-2.07 K○一4 = 10-2.75 K○一5 = 10-6.42 K○一6 = 10-10.34
上述电离平衡表明, EDTA在水溶液中总是以H6Y2+,H5Y+,H4Y,H3Y- , H2Y2-,HY3-和Y4-等7种型体存在。各型体浓度随溶液pH值变化而变化, 您可以想象, c(H6Y2+)随pH值升高而下降, c(Y4+)随pH值升高而上升, 其他5种形体的浓度随pH值升高先升后降。图8.2中我们看到过H2C2O4类似的变化趋势。
2. EDTA的酸效应和酸效应系数Y4-与H3O+离子发生如下反应:
Y4-(aq) + H3O+(aq) 3-(aq) + H2O(l) (10.3) 该副反应消耗了部分Y4-离子, 导致EDTA参加主反应(10.1)的能力下降, 这一现象叫作EDTA的酸效应。酸效应的大小用酸效应系数a(EDTA)衡量:
c(EDTA)
a(EDTA) = —————
c(Y4-)
式中c(EDTA)是平衡系统中未参与配位的EDTA各型体浓度之和,c(Y4-)是Y4-离子的平衡浓度。酸效应系数只与溶液的酸度有关, 溶液的酸度越高(c(Y4-)值越小), 酸效应系数越大。表10.2给出不同pH溶液中的lg a(EDTA)。
Table 10.2 lg a(EDTA) values as a function of pH
pH lg
a(EDTA) pH lg
a(EDTA)
0.0
1.0
2.0
3.0
4.0
5.0
6.0 23.64
18.01
13.51
10.60
8.44
6.60
4.65
7.0
8.0
9.0
10.0
11.0
12.0
3.32
2.26
1.29
0.45
0.07
0.00
10.2.3 与酸效应有关的条件稳定常数
由表10.2可知,pH≥12.0时, a(EDTA) = 1, 即
c(Y4-) = c(EDTA)/1 = c(EDTA)
或者说, 平衡系统中存在的EDTA几乎全部以Y4-这种型体存在。
当pH值低于12.0时,表10.1中的稳定常数数据已不再反映实际平衡状态, 显然需要寻
求特定pH条件下的平衡常数了。这种在特定pH条件下的平衡常数就是一种条件平衡常数,
符号为K(MY’)。“’”加在Y的右上角, 表示相关的副反应是Y发生的副反应(见反应10.3),
而不是金属离子M发生的副反应。
K(MY’)与K○一f(MY)的关系为:
1
K(MY’) = K○一f(MY) × —————(10.4)
a(EDTA)
或lg K(MY’) = lg K○一f(MY)-lg a(EDTA) (10.5)
【例题10.1】由BiY-的标准稳定常数计算pH=0.0时的条件稳定常数lg K(BiY’)。
解答: 由表10.1和表10.2查得:
lg K○一f (BiY) = 27.94, lg a(EDTA) = 23.64
代入式(10.5)得:lg K(BiY’) = 27.94 -23.64 = 4.30
4. EDTA的酸效应曲线上例的计算表明, 酸度升高至一定程度时, 表10.1中稳定性
最大的络合物BiY-也变得如此不稳定, 以致不再能用EDTA滴定Bi3+。为了适于滴定, 只能
让K(MY’)等于或者高于某一最小值。
反应能否用于滴定不但与条件平衡常数有关,而且与被滴定金属离子的浓度有关。通
常将式(10.6)作为EDTA准确滴定单一金属离子的判别式:
lg[{c(M)/mol·dm-3}·K(MY’)]≥6.0 (10.6)
式中的c(M)代表被滴定金属离子的浓度。如果c(M) = 0.01 mol·dm-3,上述判别式可写为: lg K(MY’)≥8.0 (10.7)
该式的含义是,滴定浓度为0.01 mol·dm-3的金属离子时,条件稳定常数的最小值为8.0。
尽管K(MY’)的最小值对所有金属离子的滴定都相同,但与之对应的pH值却各不不同。
由式(10.5)和式(10.7)可计算相应的lg a(EDTA),进而由表10.2查得能用于进行滴定的最低
pH值。
【例题10.2】试计算EDTA络合滴定法滴定Zn2+离子的最低pH值。
解答: (1) 将表10.1中查得的lg K○一f(MY)值和条件式(10.7)限定的lg K(MY’)值代入式(10.5)得:
8.0 = 16.5-lg a(EDTA)
lg a(EDTA) = 16.5-8.0 = 8.5
(2) 由表10.2查得对应的pH值约为4.0。这意味着, pH值低于4.0时, 不能用EDTA准确滴定Zn2+离子。
以最低pH值对lg K○一f(MY)或对lg a(EDTA)作图, 得到的曲线叫酸效应曲线或林邦曲线
(图10.2)。由曲线可方便地查得各种金属离子能以EDTA 滴定法进行测定的最低pH 。不难发现, 最低pH 值升高的顺序与表10.1中络合物稳定性降低的顺序相一致。
Figure 10.2 The acid-effect curve for the titration of M n+(aq) with EDTA.
10.3 络合滴定原理
10.3.1 滴定曲线
这里介绍一种最简单的络合滴定曲线,目的是让您将络合滴定与第8章介绍过的酸碱滴定联系在一起。以EDTA 滴定Ca 2+离子的滴定曲线(图10.3)为例, 横坐标为滴定剂EDTA 的加入量(滴定百分数),纵坐标为Ca 2+离子浓度的负对数(pCa)。5条曲线分别是用不同pH 值的条件稳定常数的计算结果绘制的。其特征说明如下:
1. 在不同pH 条件下得到不同的曲线,反映了EDTA 酸效应对pM 的影响。在化学计量点之前的c (Ca 2+)与酸效应无关,因而多条曲线重合在一起;化学计量点和化学计量点之后的计算均以条件稳定常数为依据,不同的曲线源于不同的K (CaY’)。
2. 滴定的突跃范围(包括突跃范围的大小和突跃范围所在pM 区间)随pH 不同而变化:突跃范围随pH 升高而扩大,而且向pM 值增大的区间移动。
10.3.2 金属指示剂
1. 作用原理和选择指示剂的条件
金属指示剂(metal indicator)是能与金属离子形成有色络合物的一类有机配位试剂, 其作用原理可通过铬黑T 指示剂在滴定终点发生的颜色变化作说明。铬黑T(简称EBT)的结构式以及它与金属离子的配位方式见图(10.4)。
EBT本身在pH=8~11的溶液中显蓝色, 而与Ca2+、Mg2+等离子形成的络合物呈酒红色。在指示剂存在的条件下, 金属离子溶液在开始滴定之前显示络合物的酒红色,滴定过程中该颜色一直保持到EDTA的加入量接近化学计量点的理论量。这种情况下, 未与指示剂配位的游离金属离子几乎全部形成了EDTA络合物,继续加入EDTA将夺走铬黑T配合物中的金属离子而将铬黑T游离出来, 溶液由红色变为蓝色, 指示滴定终点到达。
M(EBT) + EDTA M(EDTA) + EBT (10.8)
(酒红色) (蓝色)
金属指示剂不仅具有配位功能,而且常是多元弱酸或弱碱。像酸碱指示剂一样,随溶液pH的变化而显示不同的颜色。铬黑T是个三元弱酸,第二、第三级电离平衡和相应型体的颜色为:
H2In-2-3-
(红色) (蓝色) (橙色)
pH<6 pH=8~11 pH>12
显然, 铬黑T在pH<6和pH>12的溶液中不能用作上述滴定的指示剂,因为在这样的pH区间内, 指示剂本身的颜色与指示剂配合物的颜色没有显著差别。由上述讨论不难得出合适的指示剂应当具备的基本条件:
1) 配合物MIn的条件稳定常数必须小于M(EDTA)的条件稳定常数, 否则, 如式(10.8)那样的竞争反应将不可能向右进行。
2) 显色配合物(MIn)与指示剂(In)本身的颜色应显著不同。
3) 指示剂必须在滴定突跃范围内变色, 突跃范围太小时, 将严重限制选择指示剂的余地。
金属指示剂大多是具有双键的化合物, 易受日光、空气、氧化剂的作用而分解。为了避免指示剂变质, 往往将指示剂与中性盐配成固体混合物使用。有时可在配制的指示剂溶液中加入盐酸羟胺或抗坏血酸, 以防止指示剂氧化。配好的指示剂一般不宜久置。
10.4 滴定干扰的消除
EDTA能与多种金属离子形成配合物,溶液中存在的两种或多种金属离子时, 其他离子可能对待测离子的测定造成干扰, 从而影响测定。在许多情况下, 这种干扰可通过下列方法消除。
1. 选择合适的酸度以分别滴定假定溶液中存在M1和M2两种金属离子, 同时假定c(M1) =c(M2), K(M1Y’)>K(M2Y’)。加入EDTA时, M1将先于M2被滴定。如果K(M1Y’)与K(M2Y’)的值相差足够大, 在M1的滴定定量完成之后, EDTA才与M2反应,即M1和M2可以分别进行滴定。△lg K(MY’)越大, 进行分别滴定的可能性就越大。
2. 掩蔽干扰离子以分别滴定若被测离子与干扰离子的△lg K(MY’)值太小, 或者干扰离子比待测离子与EDTA形成更稳定的配合物,选择酸度以分别滴定的方法不再适用。在这种情况下, 需要利用掩蔽剂来降低干扰离子的浓度以消除干扰。几种常用的掩蔽方法是:
1) 络合掩蔽法掩蔽剂使用某种络合剂,它与干扰离子形成的络合物比EDTA与干扰离子形成的络合物更稳定,但却不与被测离子形成稳定配合物。例如,用EDTA滴定水中的Ca2+和Mg2+以测定水的硬度时, Fe3+、Al3+等离子的存在对测定有干扰。若加入三乙醇胺使之与Fe3+、Al3+生成更稳定的配合物,则Fe3+、Al3+等离子为三乙醇胺掩蔽而不再干扰测定。又如,在Al3+和Zn2+两种离子共存的系统中加入NH4F, 使Al3+生成更稳定的[AlF6]3-络离子而被掩蔽,因而在pH=5~6的条件下可以用EDTA滴定Zn2+离子。
2) 沉淀掩蔽法掩蔽剂使用只与干扰离子形成沉淀的化学试剂, 即选择性沉淀剂。例如,在Ca2+和Mg2+离子共存的系统中加入NaOH使pH>12,待Mg2+生成Mg(OH)2沉淀后, 再加入钙指示剂用EDTA滴定Ca2+离子。
3) 氧化还原掩蔽法此法通过氧化还原反应变更干扰离子的氧化态以消除其干扰。例如,用EDTA滴定Bi3+,Zr4+,Th4+等离子时, 溶液中存在的Fe3+离子对测定有干扰。加入抗坏血酸或羟胺可将Fe3+还原为Fe2+。由于Fe2+-EDTA络合物的稳定性比Fe3+-EDTA小得多(见表10.1),从而使干扰被消除。
3. 干扰离子的预先分离用前两类方法均不能满意地消除干扰时, 需要将干扰离子预先分离。例如,钴、镍离子的混合物中测定Ni2+和Co2+离子时, 事先需要通过离子交换法进行分离。又如,磷矿物中通常含大量氟组分,F-离子的存在严重干扰某些离子(如Al3+和Ca2+,前者与F-离子形成稳定的配合物, 后者则生成CaF2沉淀)的测定。为消除F-离子造成的干扰, 通常在酸化和加热条件下使F-以HF形式挥发而离开系统。
4. 其它方法例如选用其他滴定剂。
10.5 络合滴定方式
采用不同滴定方式是扩大络合滴定应用范围的一条重要途径。第8章提到的4种滴定方式在络合滴定中均适用。
1. 直接滴定(direct titration)用滴定剂直接滴定待测离子的方式叫直接滴定。直接滴定迅速方便、引入的误差小,但不是任何场合都能采用。例如, 待测离子不与滴定剂形成络合物(如SO42-, PO43-),或者不形成稳定的络合物(如Na+);待测离子虽能与滴定剂形成具有一定稳定性的络合物, 但难以找到合适的指示剂(如EDTA滴定Ba2+);待测离子与滴定剂反应速率太慢(如EDTA与Al3+和Cr3+的反应)。
2. 间接滴定(indirect titration)待测离子不形成络合物或不形成稳定络合物的情况下, 可考虑采用间接滴定法。例如,PO43-与EDTA不形成络合物, 如果先加入准确量的过量Bi(NO3)3使之生成BiPO4沉淀,再用EDTA滴定过量的Bi3+离子,不难计算出PO43-的含量。又如,Na+的EDTA络合物不稳定(见表10.1),如果加入醋酸铀酰锌使之生成具有确定化学组成的NaZn(UO2)3(Ac)9·x H2O沉淀, 则可将沉淀分离, 洗净, 溶解后用EDTA滴定Zn2+离子。
3. 返滴定(back titration)直接滴定法面临的后两种困难可通过返滴定方式解决。即先加入准确量的过量滴定剂, 使待测离子与滴定剂反应完全后, 再用金属离子的标准溶液返滴过量的滴定剂。例如用EDTA测定Al3+离子。由于Al3+离子形成一系列羟基络合物,这种络合物与EDTA的反应太缓慢, 因而无法进行直接滴定。如果先加入准确量的过量EDTA, 并
在加热条件下使之反应完全,则可用Cu2+或者Zn2+标准溶液返滴过量的EDTA。又如用EDTA 滴定Ba2+时选不到合适的指示剂,如果加入准确量的过量EDTA,再用Mg2+离子标准溶液滴定剩余的EDTA,就可采用滴定Mg2+的指示剂铬黑T。
4. 置换滴定(substitution titration) 相关的置换反应分两类:
M + M’L ML + M’
MY + L + Y
式中略去了物种可能携带的电荷。前一个反应是待测金属离子(M)置换络合物中金属离子(M’)的反应, M’是实际被滴定的离子。后一个反应是另一个配位体(L)置换EDTA络合物中EDTA的反应, 实际被滴定的是EDTA。对置换出来的金属离子或EDTA进行滴定, 进而计算待测离子含量的方法叫置换滴定法。
置换滴定法不但可以扩大络合滴定的适用范围, 而且是提高滴定选择性的一种有效途径。除此之外, 还可利用置换滴定原理改善指示剂指示滴定终点的敏锐性。下边分别举几个例子作说明。
Ag+的EDTA络合物不稳定, 不能用EDTA直接滴定。如果将待测的Ag+离子溶液注到[Ni(CN)4]2-溶液中, 则可置换出后者中的Ni2+离子:
2 Ag+(aq) + [Ni(CN)4]2-(aq) [Ag(CN)2]-(aq) + Ni2+(aq)
在pH值为10的氨缓冲溶液中以紫脲酸胺作指示剂,用EDTA滴定置换出的Ni2+,即可求得Ag+的含量。
测定合金中的Sn时, 可先加入过量滴定剂使Sn4+和干扰离子Pb2+、Zn2+、Cd2+、Bi3+等一起生成EDTA络合物, 然后用Zn2+的标准溶液滴定以除去过量的EDTA,这样一种操作相当于前述的返滴定。接下来加入NH4F将SnY中的EDTA释放出来,再用Zn2+标准溶液滴定释放出来的EDTA, 即可求得Sn4+的含量。上述干扰离子均不形成稳定的氟络合物, 从而大大提高了滴定Sn4+的选择性。
用EDTA滴定Ca2+离子时, 铬黑T在滴定终点显色不灵敏。如果在溶液中加入少量MgY,则发生下述置换反应:
MgY(aq) +Ca2+(aq)CaY(aq) + Mg2+(aq)
置换出来的Mg2+离子与铬黑T形成酒红色络合物Mg(EBT)。滴定过程中加入的EDTA先与Ca2+起反应, 达到滴定终点时夺取Mg(EBT)中的Mg2+, 显示出游离铬黑T的蓝色。由于滴定前加入的MgY和最后生成的MgY等量,因而MgY的加入不影响滴定结果。
·基础化学· 【课程名称】无机化学与化学分析(Inorganic Chemistry and Chemical Analysis)【课号】041026 【所属院系】化学与化学工程系 【课程总学时】75学时 【教学对象】 1、适合化学教育、化工工艺、环境科学专业的本科学生 2、预备知识:高中化学 【教学目的与课程性质、任务】 性质:无机化学与化学分析是化学教育专业、化工工艺专业、环境科学专业的必修专业基础课。 任务:使学生初步掌握一些化学基本理论;牢固掌握元素化学知识,掌握分析化学的基本原理和基础知识;熟练掌握化学基本技能;提高分析和解决问题的能力;培养严谨的科学态度。为学习后续课程,进行化学研究工作打下良好基础。 【教学内容及学时分配】 第一章原子结构(4学时) 1.1 氢原子的波动力学模型 1.2 轨道概念的图形描述 1.3 多电子原子轨道的能级和基态原子核外电子的排布 1.4 周期表与原子结构 1.5 原子参数 第二章化学键与分子结构(6学时) 2.1 化学键的定义 2.2 离子键理论 2.3 路易斯结构式 2.4 价层电子对互斥理论 2.5 价键理论 2.6 分子轨道理论 2.7 金属键理论 2.8 分子间作用力 第三章化学反应速率的表示方法(4学时) 3.1 化学反应速率的表示方法 3.2 影响化学反应速率的因素 第四章化学热力学的初步概念与化学平衡(6学时) 4.1 热化学 4.2 熵和熵变 4.3 自由能 4.4 标准平衡常数
·教学大纲·第五章酸和酸碱反应(2学时) 5.1 布朗斯特酸碱 5.2 路易斯酸碱 第六章氧化还原反应(4学时) 6.1 基本概念 6.2 氧化还原反应方程式的配平 6.3 埃灵罕母图 6.4 电极电势 6.5 电势数据的图示法 6.6 影响氧化还原反应的动力学因素 第七章配位化合物(4学时) 7.1 相关的定义和命名 7.2 化学键理论 7.3 异构现象和立体化学 7.4 配合物的稳定性 第八章酸碱平衡和酸碱滴定法(8学时) 8.1 弱酸、碱水溶液的质子转移平衡 8.2 溶液H3O+的计算 8.3 水解 8.4 缓冲溶液 8.5 酸碱滴定原理 8.6 滴定方式和应用 第九章重量分析法和沉淀滴定法(8学时) 9.1 沉淀-溶解平衡 9.2 重量分析法 9.3 沉淀滴定法 第十章配位滴定法(4学时) 10.1 副反应系数和条件稳定常数 10.2 配位滴定原理 10.3 干扰的消除和滴定方式 第十一章氧化还原滴定法(4学时) 11.1 氧化还原平衡 11.2 滴定曲线和指示剂 11.3 待测组分的预报处理 11.4 重要的氧化还原滴定法 第十二章S区元素(2学时) 12.1 单质 12.2 化合物
《文化遗产概论》 一、课程名称:文化遗产概论 二、课程类型:本科学科平台课 三、适用对象:考古、文博专业一年级本科生,文保专业二年级本科生 四、计划课时:36 五、学分:2 六、任课教师:刘军民、魏女 七、课程简介: 《文化遗产概论》是一门以文化遗产及其发展为主要讲解对象的、理论与方法相结合的课程。课程内容分为两大部分:第一部分主要讲述文化遗产在中国的发展、中外文化遗产保护管理理念比较、文化遗产价值传承研究进展等;第二部分主要讲传统意义上的文物与文物学的概念和内涵、中国文物学发展简史和中国几种主要文物种类的基本知识讲解,包括瓷器、青铜器、玉器,主要让学生了解这些文物种类的常识性内容,如概念、分类、特点等。 八、课程的主要内容 1.课程的主要内容:见后附的大纲 2.课程要求 (1)必须熟悉我国有关文物管理的法律、法规。 (2)重视文化遗产与其他学科(如考古学、历史学、博物馆学等)的关系,不能孤立的学习文化遗产; (3)树立正确的文化遗产研究思路,重视文化遗产的历史、艺术、科技、文化、社会、经济等综合价值。 第一部分 第一章文化遗产及相关概念 第一节文化遗产 第二节文化景观 第三节大遗址 第二章中国文化遗产保护发展历程 第一节理念变迁历程
第二节保护利用现状 第三节存在问题 第三章外国文化遗产保护的启示 第一节欧美国家 第二节亚洲国家 第三节启示及适用性分析 第四章考古遗址及其保护 第一节考古遗址属性 第二节考古遗址价值 第三节考古遗址与区域关系 第四节大遗址及其保护 第五章世界文化遗产与申遗 第一节申遗的意义 第二节申遗工作流程 第三节中国的世界遗产 第四节世界文化遗产相关研究 第六章其他文化遗产保护 第一节工业遗产保护 第二节建筑遗产保护 第三节传统村落保护 第四节非物质遗产保护 第二部分第一章文物与文物学(4个课时) 第一节什么是“文物学” 一、“文物”的概念与内涵 二、“文物学”的概念与内涵 第二节中国文物学简介 一、何谓“文物学” 二、文物学研究的内容及特点 第一章思考题:
《文物分析技术实践》 一、课程名称:文物分析技术实践 二、课程类型:专业选修课程 三、适用对象:文物保护技术专业三年级本科生 四、计划课时:36 五、学分:2 六、任课教师:凌雪孙凤 七、课程简介: 本门课程主要是在学生了解文物分析技术理论课程的基础上,利用学院实验教学示范中心现有的仪器设备,首先介绍超景深三维视频显微系统、偏光显微镜、金相显微镜、扫描电子显微镜、X射线荧光光谱仪、显微红外光谱仪、X射线衍射光谱仪、便携式拉曼光谱仪、热重示差同步分析仪、气相色质谱联用仪、离子色谱仪的仪器构造及使用注意事项以及测试前样品的准备与处理,然后上机进行操作性实践。 通过本门课程的学习,培养学生如何规范使用和操作仪器,加深学生对理论内容的理解,并提高学生实际动手的实验技能。 考核形式:实践课程论文 八、课程的主要内容 实践一超景深三维显微系统的使用(4课时) 一、仪器构造及使用注意事项 二、样品准备及处理 三、实际操作训练 实践二偏光显微镜的使用(2课时) 一、仪器构造及使用注意事项 二、样品准备及处理 三、实际操作训练
实践三金相显微镜的使用(2课时) 一、仪器构造及使用注意事项 二、样品准备及处理 三、实际操作训练 实践四扫描电子显微镜的使用(4课时) 一、仪器构造及使用注意事项 二、样品准备及处理 三、实际操作训练 实践五X射线荧光光谱仪的使用(4课时) 一、仪器构造及使用注意事项 二、样品准备及处理 三、实际操作训练 实践六显微红外光谱仪的使用(4课时) 一、仪器构造及使用注意事项 二、样品准备及处理 三、实际操作训练 实践七X射线衍射光谱仪的使用(4课时) 一、仪器构造及使用注意事项 二、样品准备及处理 三、实际操作训练 实践八便携式拉曼光谱仪的使用(4课时) 一、仪器构造及使用注意事项 二、样品准备及处理 三、实际操作训练 实践九热重示差同步分析仪的使用(2课时)
重庆大学研究生院文件 重大校研[2013] 13号 关于印发《重庆大学学术期刊论文研究生奖励部分 实施细则(试行)》的通知 各学部、学院: 为充分调动研究生进行科技创新和科学研究的积极性,加快我校科研事业的发展,学校根据《重庆大学科技奖励办法(试行)》(重大校〔2013〕40号)和《重庆大学人文社科科研奖励办法(试行)》(重大校〔2013〕57号)文件精神,制定了《重庆大学学术期刊论文研究生奖励部分实施细则(试行)》,现印发给你们,请遵照执行。 附件:重庆大学学术期刊论文研究生奖励部分实施细则 (试行) 重庆大学研究生院 2013年4月23日
附件 重庆大学学术期刊论文研究生奖励部分实施细则 (试行) 依据重大校〔2013〕40号及〔2013〕57号文件要求,教师与研究生合作发表的学术期刊论文研究生奖励部分,由研究生院负责核定和发放奖励比例的40%。为推动此项工作的顺利开展,特制定实施细则如下: 一、奖励条件 1.我校研究生(含博士、硕士)自2012年6月1日起正式发表或检索的期刊论文(自然科学类学术期刊论文须被相应数据库检索,人文社科类学术期刊论文须正式发表)。 2.教师与研究生合作发表的论文,作者排序学生第一或学生第二教师第一,教师是通信作者,署名单位重庆大学排名第一,按照不低于40%的比例进行奖励,研究生单独发表的论文按40%比例奖励。 3.《SCIENCE》、《NATURE》及姊妹刊物(研究性刊物)上发表的学术论文,署名单位重庆大学排名第二的按排名第一标准40%奖励,排名第三及以后的按排名第一标准20%奖励。论文认定按SCIE最新分区标准(中科院版)。 二、奖励标准 1.自然科学类学术期刊论文奖励标准 教师与研究生合作发表的论文,按照一定比例(学生比例不低于40%,)进行奖励,研究生院负责奖励比例40%的发放。
第八章 酸碱平衡和酸碱滴定 8.1 (a )θb K (F -) = θw K /θa K (HF) = 10-14/6.8×10-4 = 1.5×10-11 (b )θa K (NH 4+) =θw K /θb K (NH 3) = 10-14/ 1.8×10-5 = 5.6×10-10 8.2根据θa K ·θb K = θw K θb K (HPO 42-) = θw K /θa K (H 2PO 4-) = 10-14/ 6.2×10-8 = 1.6×10-7 >> 4.2×10-13 即θb K (HPO 42-) >> θa K (HPO 42-),也就是说,HPO 42-的水解作用远大于其自身的离解作用,所以Na 2HPO 4水溶液呈碱性。 8.3 (a) 水合是H 2O 分子以其偶极的一端在离子周围取向,H 2O 分子作为整体参与反应;而 水解是H 2O 分子被撕裂产生OH ﹣或H +,再与离子结合。 (b) 缓冲容量是指维持系统pH 大体恒定的条件下,缓冲溶液能够中和外来酸或外来碱的量;缓冲范围是指能够起缓冲作用的pH 区间。 (c) 滴定终点是指示剂的实际变色点;而化学计量点指滴定剂与被滴定物之间按照化学计量关系完全反应时所达到的点。 8.4此缓冲溶液NaC 2H 3O 2的浓度为: c (NaC 2H 3O 2)/ mol·dm -3 = 5.00.822.25÷ = 0.622 根据公式:pH = θa p K ﹣lg ()()33dm mol /dm mol /--??共轭碱酸c c 得 pH =﹣lg(1.8×10-5)﹣lg ()()3 2323232/O H NaC /O H HC --??dm mol c dm mol c = ﹣lg(1.8×10-5)﹣lg 622.0550.0 = 4.80 8.5根据公式:pH = θa p K ﹣lg ()()33dm mol /dm mol /--??共轭碱酸c c 得 pH = 5.09 =﹣lg(1.8×10-5 )﹣lg ()()32323232dm mol /O H NaC dm mol /O H HC --??c c 得: c (NaC 2H 3O 2)/ mol·dm -3 = 0.550 m(NaC 2H 3O 2)/g = c(NaC 2H 3O 2)/ mol·dm -3×V/dm 3×M(NaC 2H 3O 2)/g·mol - = 0.550×0.300×82.0 = 14.0 8.6 (a) 当加入0.0060mol HCl 时,溶液中HC 2H 3O 2 和NaC 2H 3O 2的浓度分别为: c (HC 2H 3O 2)/ mol·dm -3 = 3-330.300dm mol 006.0dm mol 0.250dm 300.0+?? = 0.270
西北大学文化遗产学院本科教学大纲 专业:文物保护技术 课程名称:文物分析技术 周学时:2 总学时:36 授课班级:本科三年级 任课教师:凌雪、孙凤
《文物分析技术》 一、课程名称:文物分析技术 二、课程类型:跨专业选修课 三、适用对象:文物保护技术专业及其他,三年级 四、计划学时:36课时 五、学分:2 六、任课教师:凌雪、孙凤 七、课程简介: 本门课程主要通过文物研究和保护中常用现代科技分析技术基本原理、特点、样品处理过程等的讲授,并结合具体事例的介绍,培养学生学会如何利用现代分析技术来研究和解决文物研究与保护问题的思维能力。 考核形式:闭卷考试。 八、课程主要内容: 第一章绪论(4课时) 1.1 文物 1.1.1 什么是文物 1.1.2 文物的分类 1.2 现代仪器分析概述 1.2.1 仪器分析与化学分析 1.2.2 仪器分析的类型 1.2.3 仪器分析的一般过程与基本特点 1.2.4 分析仪器 1.2.5 仪器的主要性能指标 1.2.6 仪器分析方法的校正 1.2.7 计量学与误差 1.3 电磁辐射的基础知识 1.3.1 电磁辐射 1.3.2 电磁辐射的波粒二象性 1.3.3 电磁辐射与物质的作用过程 1.3.4 光谱的产生与光谱的分类
1.4 现代分析技术在文物研究中的应用 1.4.1 文物研究中的分析技术与仪器分析 1.4.2 文物研究中的分析技术的特点 1.5 试样的采取与调制 1.5.1 取样的原则 1.5.2 样品的采取和前处理 教学重点及难点: 重点:电磁辐射与物质的作用过程; 文物研究中的分析技术的特点。 难点:电磁辐射的波粒二象性。 思考题: 1、什么是仪器分析?仪器分析有哪些种类? 2、仪器分析的一般过程是什么?有何特点? 3、怎么描述电磁辐射? 4、电磁辐射与物质有哪些作用过程? 5、什么是文物? 6、简述现代分析技术在文物研究中的特点。 7、现代分析技术在文物研究中应用在哪些方面?请举例说明。 8、取样的原则是什么?对不同的样品如何进行前处理? 第二章文物的影像结构分析技术(4课时)2.1 X光照相技术与CT扫描技术 2.1.1 X光照相技术与CT扫描技术的基本原理 2.1.2 X光照相技术与CT扫描技术的特点 2.1.3 样品处理 2.1.4 X光照相技术与CT扫描技术的应用实例 2.2 红外成像技术 2.2.1 红外成像技术的基本原理 2.2.2 红外成像技术的特点 2.2.3 样品处理 2.2.4 红外成像技术的应用实例
西北大学权威学术期刊(a、b类)认定目录(人文社科类2014年7月1日实施) 一、A类期刊:含一种国内期刊和一个国际期刊索引收录期刊 1、中国社会科学(中、英文版) 2、SSCI(社会科学引文索引)1、2区收录的学术期刊 二、B类期刊50种:含45种国内期刊,两个国际期刊索引、三种文摘 1、国内期刊:《中国社会科学内部文稿》《马克思主义研究》《哲学研究》 《中国哲学史》《自然辩证法研究》《自然科学史研究》 《世界宗教研究》《中国语文》《文学评论》《文学遗产》 《中国现代文学研究丛刊》《中国翻译》《外国文学评论》 《外语教学与研究》《历史研究》《中国史研究》 《近代史研究》《世界历史》《考古》 《考古学报》 《文物》《政治学研究》 《世界经济与政治》《国际问题研究》 《中国法学》 《法学研究》《经济研究》《世界经济》《中国工业 经济》 《数量经济 技术经济研究》《管理世界》(短 论不算)《管理科学学报》 《中国软科学》《中国行政管理》 《新闻与传播研 究》《中国图书馆学报》《教育研究》 《文艺研究》 《电影艺术》《美术研究》《体育科学》《社会学研 究》《民族研究》《心理学报》《地理学报》(中文
版) 2、学术文摘:《新华文摘》、《中国社会科学文摘》、《高等学校文科学 术文摘》(均须转摘2500字以上) 3、国际期刊索引:SSCI(社会科学引文索引)3、4区和 A&HCI(艺术和人 文科学引文索引)收录的学术期刊 注: 1、 除SSCI和 A&HCI索引收录期刊外,不含上述各期刊的英文版。 2、 在《求是》、《中国高等教育》、《人民日报》(理论版)、 《光明日报》(理论版\理论与实践版)发表的2500字以上学术论文,由论文作者通过本单位向社科处提出B类期刊认定申请,经专家评议通过的,认定为B类期刊论文。 三、C类期刊 1、被CSSCI来源期刊目录当年收录的学术期刊(含外文版)。 2、被人大复印资料全文转载的学术论文。 3、被社会科学与人文科学会议录索引(Conference Proceedings Citation Index - Social Sciences & Humanities,简称CPCI-SSH)全文收录的学术论文。 4、发表在港澳台重要学术刊物的论文,以及以外文撰写在国外相 关专业期刊发表的学术论文,由论文作者通过本单位向社科处提出认定申请,经社科处组织专家评议通过,认定为C类期刊论文。 5、以第一署名人在国家级重点学科和国家级重点研究基地、国家 一级学会正式出版的连续性、专业性出版物发表的论文,由论文作者通过本单位向社科处提出认定申请,经社科处组织专家评议通过,认定为C类期刊论文。 6、《日语学习与研究》、《文物保护与考古科学》、《现代广 告》(学术版)、《世界美术》、《西亚非洲》等期刊。
第 4 章 化学反应速率与反应动力学的初步概念 一、 基本要求 1. 初步了解化学反应速率、速率方程、碰撞理论、过渡状态理论和活化能的概念; 2.理解并会用浓度、温度、催化剂诸因素解释其对化学反应速率的影响; 3.初步掌握阿仑尼乌斯公式的应用,会用其求算指定反应活化能及某温度下的反应速率; 4.理解反应分子数和反应级数的概念,会进行有关基元反应的简单计算; 5.初步掌握零级、一级和二级反应的特征。 二、 要点 1.反应速率 单位时间内反应物或生成物浓度改变量的正值。又有平均速率和瞬时速率之分。 2.碰撞理论 1918年Lewis 运用气体分子运动论的成果提出的一种反应速率理论。它假设: ① 原子、分子或离子只有相互碰撞才能发生反应,即碰撞是反应的先决条件; ② 只有少部分碰撞能导致化学反应,大多数反应物微粒碰撞后发生反弹而与 化学反应无缘。 3.有效碰撞 能导致化学反应发生的碰撞,反之则为无效碰撞。 4.活化能 对于基元反应,活化分子的平均能量与反应物分子平均能量之差,常用E a 表示;对于复杂反应,E a 的直接物理意义就会含糊了,因此,由实验求得的E a 也叫作“表现活化能”。 5.过渡状态理论 20世纪30年代,在量子力学和统计力学发展基础上,由Eyring 等人提出的另一种反应速率理论。它认为反应物并不只是通过简单碰撞就能变成生成物,而是要经过一个中间过渡状态,即反应物分子首先形成活化络合物,通常它是一种短暂的高能态的“过渡区物种”,既能与原来的反应物建立热力学的平衡,又能进一步解离变为产物。 6.基元反应 亦称为简单反应或元反应。 指反应物分子在有效碰撞中一步直接转化为产物的反应。 7.复杂反应 亦称非基元反应。即由两个或多个基元反应步骤完成的反应。 8.速率方程 化学反应速率υ同反应物、产物浓度c 的函数关系式 υ = f (c A 、c B …) 经验表明,不少反应其速率方程具有 g B f A υc kc ?=
《彩绘类文物保护专题》 一、课程名称:彩绘类文物保护专题 二、课程类型:方向课 三、适用对象:文物保护学一年级硕士 四、计划课时:36 五、学分:2 六、任课教师:王丽琴 七、课程简介: 该课程为文物保护学专业硕士研究生学科方向课。彩绘类文物是文物的一个重要类别,通常是在某种基质材料上施加彩绘制作而成。由于彩绘的存在,增加了文物的价值,但同时也增加了对其保护的难度。通过该课程的学习,使研究生了解中国古代彩绘的制作材料、制作工艺、主要病变及其产生原因,掌握该类文物材质分析的现代仪器分析方法、保护材料、保护方法和和保护技术。 八、课程的主要内容与考核: (一)课程的主要内容 第一章古代彩绘的制作材料及制作工艺研究——以古建油饰彩画为例第一节古建油饰彩画制作材料及工艺 第二节古建油饰彩画分析技术路线 第三节古建油饰彩画文物分析案例 第二章正交设计法及在文物保护中的应用 第一节正交设计法在科学试验中的意义 第二节正交设计法简介 第三节正交设计的基本原理 第四节正交试验的结果分析 第五节文物保护实验条件优选案例设计 第三章秦始皇兵马俑保护的最新进展 第一节秦兵马俑彩绘的结构及成分分析 第二节秦兵马俑彩绘残留物的GC-MASS分析 第三节秦兵马俑彩绘的考古现场保护材料最新进展
第四章莫高窟壁画的主要病害及保护现状 第一节莫高窟壁画的主要病害 第二节莫高窟及其壁画的保护 第五章其他彩绘类文物保护 第六章光导纤维反射光谱法在彩绘文物保护领域中的应用第一节光导纤维技术简介 第二节光导纤维反射光谱仪 第三节光导纤维反射光谱技术在彩绘文物保护领域中的应用第七章有机高分子保护材料及其改性研究 第一节文物防水保护材料 第二节文物加固保护材料 第三节紫外线吸收剂改性文物保护材料 第四节纳米材料改性文物保护材料 第五节位阻胺改性文物保护材料 (二)考核方式 论文考查
附件: 国家级(核心)学术期刊参考名录(试行)(参考自2008版北京大学中文核心期刊要目总览) 第一编哲学、社会学、政治、法律 综合性人文、社会科学类 1 中国社会科学 2 北京大学学报.哲学社会科学版 3 中国人民 大学学报 4 学术月刊 5北京师范大学学报.社会科学版 6 文史哲 7 学术研究 8 江海学刊 9 复旦学报.社会科学版 10 吉林大学社会 科学学报 11 社会科学 12 社会科学战线 13 江苏社会科学 14 南京大学学报.哲学、人文科学、社会科学 15 南开学报.哲学社 会科学版 16 河北学刊 17 厦门大学学报.哲学社会科学版 18 浙江学刊 19 浙江大学学报.人文社会科学版 20 浙江社会科学 21 天津社会科学 22 社会科学研究 23 中山大学学报.人文社 会科学版 25 求是学刊 26 人文杂志 27 江西社会科学 28 湖南师范大学社会科学学报 29 四川大学学报.哲学社会科学版 30 学习与探索 31 江汉论坛 32 华东师范大学学报.哲学社会科学版 33 南京师大学报.哲学社会科学版 35. 求索36 郑州大学学报.哲 学社会科学版 37 东北师大学报.哲学社会科学版 38 清华大学学报.哲学社会科学版 39 中州学刊 40 南京社会科学 41 河 南大学学报.社会科学版 42 上海交通大学学报.哲学社会科学版 43 甘肃社会科学44 思想战线 45 山东社会科学 46 西北师 大学报.社会科学版 47 社会科学辑刊 48 福建论坛.人文社会科 学版 49 西南师范大学学报.人文社会科学学版(改名为:西南大学学报.社会科学版) 50 学术界 51 陕西师范大学学报.哲学社会科学 版 52 广东社会科学 53 国外社会科学 54 西安交通大学学报.社会科学版 55 河南师范大学学报.哲学社会科学版 56 学术 交流 57 东岳论丛 58 东南学术 59 学海 60 学术论坛 61 武汉大学学报.人文科学版62 山东大学学报.哲学社会科学版 63 兰州大学学报.社会科学版 63 兰州大学学报.社会科学版 64 探索
天津大学无机化学考试试卷(上册)答案 一、填表题(20分) 1. (g) 2CO2 (g) (?r H m<0),在密闭容器中达到平衡: 2. 反应2CO (g) + O 3. 4. 5. 在0.1mol?L-1NH3?H2O中加入下列物质,写出NH3?H2O的解离度α和pH值变化趋势 二、填空题(20分) 1. 随着溶液的pH值增加,下列电对Cr2O72-/Cr3+、Cl2/Cl-、MnO4-/MnO42-的E值将分别减小、 不变、不变。 2. MgO晶体比金属Mg的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比SiF4晶 体的硬度大;I2晶体比NaI晶体在水中的溶解度小。 3. 健康人血液的pH值为7.35~7.45。患某种疾病的人的血液pH可暂时降到5.90,此时血液中c(H+)为正常状态的28~35 倍。 4. 已知B2轨道的能级顺序为σ1sσ*1sσ2sσ*2sπ2pyπ2pzσ2pxπ*2pyπ*2pzσ*2px,则B2的分子轨道分布式为
(σ1s )2(σ*1s )2(σ2s )2(σ*2s )2(π2py )1(π2pz )1,成键数目及名称两个单电子π键,价键结构式为 。 5. 根据E θ(PbO 2/PbSO 4) >E θ(MnO 4-/Mn 2+) >E θ(Sn 4+/Sn 2+),可以判断在组成电对的六种物质中,氧化性最 强的是 PbO 2 ,还原性最强的是 Sn 2+ 。 6. 表示θm r H ?=θ m f H ?(AgBr, s)的反应式为 Ag(s) + 1/2 Br 2(l) → AgBr(s) 。 7. 用电对MnO 4-/Mn 2+,Cl 2/Cl -组成的原电池,其正极反应为 MnO 4- + 8H + + 5e → Mn 2+ + 4H 2O ,负极反 应为 2 Cl - -2 e → Cl 2 ,电池的电动势等于0.15V ,电池符号为(-)Pt,Cl 2(p θ)|Cl -‖MnO 4-,Mn 2+,H +|Pt(+)。(E θ4;E θ(Cl 2/Cl -)=1.36V ) 8. 下列各溶液浓度均为0.1 mol ?L -1,按pH 值从小到大顺序排列NH 4NO 3, NH 4F, NH 4OAc, KCN, Na 2CO 3。 KCN, NH 4F, NH 4OAc, NH 4NO 3, Na 2CO 3。 (已知K θ(NH 3?H 2O)=1.8×10-5, K θ(HF)=6.6×10-4, K θ(HCN)=6.2×10-10, K θ(HOAc)=1.8×10-5, θ1K (H 2CO 3)=4.4×10-7, θ2K (H 2CO 3)=4.8×10-11) 9. 已知V E A /θ:Cr 2O 72- +1.36 Cr 3+ -0.41 Cr 2+ -0.86 Cr ,则E θ(Cr 2O 72- / Cr 2+)= 0.917 V ,Cr 2+能否发生歧化反应 不能 。 10. 已知氨水溶液中,c(OH -)=2.4×10-3 mol ?L -1, 则此氨水的浓度为0.32 mol ?L -1。(K θ(NH 3?H 2O)=1.8×10-5) 11. 因为SnCl 2强烈水解,在配制其溶液时应加入HCl ,水解反应式为 SnCl 2+H 2O Sn(OH)Cl+HCl 。 12. K θ、θi K 、Δχ分别用来衡量 反应限度的大小、 电解质强弱 、 键的极性 。 13. HF 的沸点比HI 高,主要是由于 HF 中存在氢键 。 14. 物质NaCl 、MgO 、Na 2O 、KCl 的熔点由低到高的顺序是KCl 、NaCl 、Na 2O 、MgO 。 15. 在元素周期表中,同一主族自上而下,元素第一电离能的变化趋势是逐渐 减小 ,因而其金属性依次 增强 ;在同一周期中自左向右,元素的第一电离能的变化趋势是逐渐 增大 ,元素的金属性逐渐 减弱 。 三、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画×) (10分) 1. 乙烷裂解生成乙烯:C 2H 6 (g) C 2H 4 (g) + H 2 (g) 。在实际生产中常在恒温恒压下采用加入过 量水蒸汽的方法来提高乙烯的产率,这是因为随着水蒸汽的加入,同时以相同倍数降低了p (C 2H 6)、 p (C 2H 4)、p (H 2),使平衡向右移动。………………………………………………………………………( √ ) 2. 波函数ψ表明微观粒子运动的波动性,其数值可大于零,也可小于零,2 ψ表示电子在原子核外空间出现的几率密度。…………………………………………………………………………………….…..(√ ) 3. 因为I - 的极化率大于Cl -,所以θsp K (AgI) <θsp K (AgCl)。 ……………………………………………( √ ) 4. 在298K 时,最稳定纯态单质的θ θθm m f m f S G H ,,??均为零。…………………………………….. ( × ) 5. Δr G m 代数值越小,K θ就越大,反应进行得越完全。……………………………………..…………….. ( × ) 6. 在相同温度下,纯水或0.1 mol ?L -1HCl 或0.1 mol ?L -1NaOH 溶液中,水的离子积都相同。………. ( √ ) 7. 在氧化还原反应中,如果两个电对的电极电势相差越大,反应就进行得越快。…………………. ( × ) 8. 当溶液中含有多种离子均可与沉淀剂发生沉淀反应时,溶度积小的对应离子一定先沉淀。……. ( × ) 9. 溶度积规则适用于任何难溶电解质,质量作用定律只适用于基元反应。………………………. ( √ ) 10. 偶极矩可衡量分子极性大小,极化率可衡量分子变形性大小,晶格能可衡量离子晶体的稳定性。( √ )
《西北史前考古》 一、课程名称:《西北史前考古》 二、课程性质:专业选修课 三、适用对象:(专业、年级)文化遗产学院考古专业本科生 四、计划学时:36 五、学分:2 六、任课教师:陈洪海、郭梦 七、课程简介: “西部考古之一——西北史前考古”,地域包括今之甘肃、青海、宁夏、新疆四省区全部及陕西、内蒙古两省区之一部,时间为被中原文化直接统治之前,内容为西北地区史前环境下的文化(在时间、空间、内涵方面)关系的演化。本课不是资料堆砌,而着重于对已有资料的分析研究,让学生清楚西北史前考古的研究现状,并在发现问题、分析问题、解决问题的能力方面有所培养。 八、课程的主要内容 本课程教学内容共有四讲。第一讲西北史前考古绪论主要目的是厘清西北、史前两个空间、时间上的概念,并介绍这一地区史前考古学的田野调查和研究工作的历史。第二讲甘青地区史前文化,通过期中作业的形式,促使学生自学掌握此部分内容。第三讲围绕二次扰乱葬、火葬、尸骨摆放姿势、男女合葬墓、特殊随葬品等西北地区史前时期的特殊埋葬习俗展开深入讨论,目的是从葬俗窥见史前人群交往、流变的信息。第四讲新疆史前考古,在使学生掌握新疆史前主要考古学文化的基础上,对岩画、青铜器、游牧经济、人种组成等具有地域特色的专题展开深入讨论。 第一讲西北史前考古绪论 第一节西北地区空间概念 1.西北地区的地理范围:甘、青、新、宁,陕西西部、内蒙中西部。 2.西北地区的自然环境单元: 黄土分布区:陇山、六盘山为界分作东西两部分,乌鞘岭西界。 青藏高原区:东部河谷地带、西部高原草地、高山 蒙新荒漠区:冲、洪积平原、戈壁荒漠、沙漠地带、绿洲、草原。
3.西北地区全新世环境的变迁:7500-3500气候最适宜期,三部曲。 4.西北地区的文化环境单元:陇东、甘青、新疆三区域。 第二节史前时期的时间概念 1.史前期的开始时间 2.史前期的结束时间:汉通西域之前 第三节西北史前考古历史的回顾 1.外国学者的早期探险活动以及科学考察:斯文-赫定、安特生。 2.我国学者建国前的科学考察:夏鼐 3.五、六十年代西北地区的考古学进展 4.八十年代以前的发现与研究 5.八十年代以来的进展 第二讲甘青地区的史前文化 通过完成期中作业的方式,自学此章节内容。 第三讲甘青地区史前葬俗 第一节葬俗的内容 1.位置:墓地位置、地形地貌、墓葬布局 2.形制:平面形状、立体结构、方向、制作方法 3.葬具:种类(棺、椁)、质料(石、木、土坯)、形状、制法 4.葬式:人数(单人、多人)、次数(一次、二次)、性别、年龄、姿势(躯体的仰、俯、侧,四肢的伸直与弯曲) 5.随葬品:种类、数量、摆放位置 第二节二次扰乱葬辨析 1.发现与认识过程 2.辨析的标准 3.统计分析结果 第三节火葬墓研究 1.火葬墓的发现 2.火葬墓存在的时间和分布范围 3.火葬墓与二次扰乱葬
S C I各领域国际顶尖学 术期刊一览 SANY GROUP system office room 【SANYUA16H-
SCI各领域国际顶尖学术期刊一览 中国科学院科技情报中心将各领域的SCI期刊按影响因子大小分成四个区,其中一区和二区为高影响因子论文,三区为中等影响因子论文,四区为低影响因子论文。其中,一区和二区的一小部分杂志被列为顶尖学术期刊(Top Journal)。 要比较各校在高水平的杂志的论文发表情况,可以根据顶尖杂志的名单和一区二区的杂志名单,查询ISI网站,谁好谁差,一比就知,无需争辩,一目了然。 以下为各领域顶尖学术期刊的详细名单 分区中文分类刊名简称 1 地学 ACTA ASTRONOM 1 地学 ADV GEOPHYS 1 地学 AM J SCI 1 地学 B AM METEOROL SOC 1 地学 CLIM DYNAM
1 地学 J CLIMATE 1 地学 J PETROL 1 地学 LIMNOL OCEANOGR 1 地学 QUATERNARY SCI REV 1 地学 REV GEOPHYS 1 地学 TELLUS B 2 地学 AM MINERAL 2 地学 CHEM GEOL 2 地学 EARTH PLANET SC LETT 2 地学 GEOCHIM COSMOCHIM AC 2 地学 GEOLOGY 2 地学 GEOPHYS RES LETT 2 地学 J GEOPHYS RES 2 地学 J ATMOS SCI 2 地学 MON WEATHER REV 1 地学天文 ANNU REV ASTRON ASTR
《秦汉魏晋南北朝考古》 一、课程名称: 中文名称:秦汉魏晋南北朝考古 英文名称:Archaeology of Qin, Han, Wei, Jin, Southern and Northern dynasties 二、课程性质:专业核心课 三、适用对象:考古学专业,二年级本科生 四、计划课时:54课时(18周,每周3学时,其中秦汉考古10周课,魏晋南北 朝考古8周课)。 五、学分:3 六、任课教师:任萌、李雨生 七、课程简介: 秦汉魏晋南北朝考古为西北大学文化遗产学院考古系考古学专业本科必修课程,主要教授从秦统一至隋再度统一中国期间中国境内考古学文化的面貌与发展变化情况,分秦汉和魏晋南北朝两部分,分别由任萌和李雨生讲授。 秦汉部分课程的课程任务是是学生能够总体了解秦汉时期都城、地方性城邑、交通和边防设施、帝王陵墓、中小型墓葬、工商业、农业、出土文献以及边疆地区考古学文化和中外文化交流的基本知识,同时要求学生能够认识和理解秦汉时期考古学文化在中国文化发展过程中的地位,以及在当时世界文明圈的地位和影响。修完秦汉考古之后,魏晋南北朝部分呈现出跟大一统时代考古较为不同的面貌,通过课程学习,学生将初步了解并掌握汉唐之间考古材料的地区性和过渡性特征。 八、课程的主要内容 第一章秦汉考古导论 【教学目的】通过本章学习,了解秦汉时期的基本历史、文化、社会背景和时代特征,秦汉考古的研究简史,秦汉考古的分期、分区等内容。掌握秦汉时期时代特征形成的原因,秦汉考古分期、分区的主要观点及依据。 【教学重点与难点】本章重点是秦汉时期的时代特征、秦汉考古的分期与分区,难点是如何理解秦汉时期的政治经济制度与考古学文化的关系,不同分期分区观点的主要依据。
国家权威学术期刊参考名录 《中国社会科学》、《哲学研究》、《中国法学》、《法学研究》、《民族研究》、《世界民族》、《求是》、《国际问题研究》、《人民日报》理论版、《解放军报》理论版、《光明日报》理论版、《自然辩证法通讯》、《马克思主义研究》、《国际共运史研究》、《中共党史研究》、《高校理论战线》、《自然辩证法研究》、《政治学研究》、《社会学研究》、《世界宗教研究》、《孔子研究》、《中国行政管理》、《新华文摘》、《人民大学复印资料》、《国际社会科学杂志》、《中国人才》、《经济法制》、《党建研究》、《中国青年研究》、《科学社会主义研究》、《法学》、《法学评论》、《中国人口科学》、《史学月刊》、《中国党政干部论坛》、《哲学动态》、《中国科技论坛》、《当代世界与社会主义》、《道德与文明》、《社会学研究》、《社会》、《社会学》、《人口研究》、《中国人口科学》、《宏观经济管理》。 《中国语文》、《文学评论》、《文学遗产》、《文艺研究》、《外国文学评论》、《外语教学与研究》、《中国翻译》、《辞书研究》、《文艺理论研究》、《古代语研究》、《红楼梦学刊》、《中国现代文学研究丛刊》、《民族语文》、《文艺理论与批评》、《方言》、《民族文学研究》、《外国文学研究》、《中国语言学报》、《外国语》、《外语界》、《现代外语》、《美学与艺术学研究》、《语文建设》、《语文研究》、《语言研究》、《当代语言学》、《当代作家评论》《鲁迅研究月刊》、《文艺争鸣》、《新文学史料》、《中国比较文学》、《电影艺术》、《民族文学》、《明清小说研究》、《中国藏学》、《西藏研究》、《语言与翻译》、《回族研究》、《蒙古语言文学》、《中国民族教
第十二章 s区元素 Chapter 12 s Block 教学要求 1.了解s区元素的物理性质和化学性质,能够解释Li的标准电极电势为什么最低,能解释碱金属与水、醇和液氨反应的不同; 2.了解主要元素的矿物资源及单质的制备方法,特别注意钾和钠制备方法的不同; 3.了解s区元素的氢化物、氧化物、氢氧化物的性质,特别注意氢氧化物的碱性变化规律; 4.了解s区元素的重要盐类化合物,特别注意盐类溶解性的热力学解释; 5.会用离子极化理论解释碳酸盐分解规律; 6.了解对角线规则和锂、铍的特殊性。 课时分配(4学时) 1.概述和单质:2学时 2.化合物:2学时 3.对角线规则:1学时 12.1 概述 alkaline metals alkaline earth matals lithium beryllium sodium magnesium potassium calcium rubidium strontium caesium barium francium radium 注意它们在周期表中的位置。所有性质的产生和变化规律皆由此而来。 s区属元素最外层电子组态分别为ns1和ns2,由于受到内层电子的强烈屏蔽, 核对最外层电子的控制较松弛。因而单质的化学性质都非常活泼, 容易失去各自的ns电子分别形成+1价和+2价阳离子, 其氧化态与各自的族号相对应。 12.2 单质 12.2.1 物理和化学性质
Some properties of the alkali metals, M, and their ions, M + property Li Na K Rb Cs ground state electronic configuration atomic (metallic) radius, r (M)/pm ionic radius, r (M +)/pm melting point, mp/℃ boiling point, bp/℃ first ionization energy, I 1/kJ·mol -1 density at 20℃, d /g·cm 3 hardness a flame color standard electrode potential, E ○一 /V [He]2s 1 152 59 180.54 1347 520.2 0.534 0.6 carmine -3.040 [Ne]3s 1 186 99 97.81 883.0 495.8 0.971 0.4 yellow -2.713 [Ar]4s 1 227 138 63.65 773.9 418.8 0.862 0.5 violet -2.924 [Kr]5s 1 248 149 39.05 687.9 403.0 1.532 0.3 bluish red -2.924 [Xe]6s 1 265 170 28.4 678.5 375.7 1.873 0.2 blue -2.923 a On the Mohs scale, hardnesses of ten minerals range from that of talc(0) to diamond(10). Some properties of the alkaline earth metals, M, and their ions, M 2+ property Be Mg Ca Sr Ba ground state electronic configuration atomic (metallic) radius, r (M)/pm ionic radius, r (M 2+)/pm melting point, mp/℃ boiling point, bp/℃ first ionization energy, I 1/kJ·mol -1 density at 20℃, d /g·cm 3 hardness a flame color standard electrode potential, E ○一/V [He]2s 2 111 27 1278 2970 899.4 1.85 ~5 none -1.85 [Ne]3s 2 160 72 648.8 1090 737.7 1.74 2.0 none -2.356 [Ar]4s 2 197 100 839 1483.6 589.7 1.55 1.5 orange-re d -2.84 [Kr]5s 2 215 113 769 1383.9 549.50 2.54 1.8 scarlet -2.89 [Xe]6s 2222 136 729 1637 502.8 3.60 ~2 green -2.92 a See footnote to Table 12.1. ★ 两族金属单质主要讲述规律性 ★ 单质的化学以其还原性为特征 (1) 与氧、硫、氮、卤素反应,形成相应的化合物,特别要注意氧化物的多样性 (2) 两族金属被水氧化的反应分别为: 2 M(s ) + 2 H 2O(l ) = 2 M +(aq ) + 2 OH -(aq ) + H 2(g ) (M = 碱金属) M(s ) + 2 H 2O(l ) = M +(aq ) + 2 OH -(aq ) + H 2(g ) (M = 碱土金属) 实验室利用金属钠与水的反应干燥烃类和醚类有机溶剂,但 金属钠不能用来干燥醇类 溶剂。 这是因为钠的还原性是如此之强, 以致能将醇分子中的氢原子还原为H 2,例如与乙醇的反应: 2 CH 3CH 2OH(l ) + 2 Na(s ) NaOCH 2CH 3(sln ) + H 2(g ) ● 同一族自上而下性质的变化有规律
《文物分析技术》 一、课程名称:文物分析技术 二、课程类型:跨专业选修课 三、适用对象:文物保护技术专业三年级本科生 四、计划课时:36 五、学分:2 六、任课教师:凌雪、孙凤 七、课程简介: 本门课程主要通过文物研究和保护中常用现代科技分析技术基本原理、特点、样品处理过程,并结合具体应用事例进行讲述。主要有七章内容,其中绪论主要介绍现代仪器分析概述、现代分析技术在文物研究中的作用与特点以及试样的采取与调制等基本内容;文物的影像结构分析技术主要讲述X光照相技术与CT扫描技术、红外成像技术、中子照相技术和多光谱成像技术;文物的微观分析技术主要介绍光学显微镜和电子显微镜;文物的化学元素组成分析技术主要包括原子吸收光谱、原子发射光谱、X射线荧光光谱、中子活化分析法;文物的物质结构分析技术主要包含红外吸收光谱、紫外可见吸收光谱、X射线衍射、激光拉曼光谱;文物其他分析技术包括热分析技术、表面分析技术、质谱法、色谱分离法等;最后是文物分析技术存在的问题及其展望。 通过本门课程的学习,培养学生学会如何利用现代分析技术来研究和解决文物研究与保护问题的思维能力。 考核形式:闭卷考试 八、课程的主要内容 第一章绪论(4课时) 第一节文物 一、什么是文物 二、文物的分类 第二节现代仪器分析概述
一、仪器分析与化学分析 二、仪器分析的类型 三、仪器分析的一般过程与基本特点 四、分析仪器 五、仪器的主要性能指标 六、仪器分析方法的校正 七、计量学与误差 第三节电磁辐射的基础知识 一、电磁辐射 二、电磁辐射的波粒二象性 三、电磁辐射与物质的作用过程 四、光谱的产生与光谱的分类 第四节现代分析技术在文物研究中的应用 一、文物研究中的分析技术与仪器分析 二、文物研究中的分析技术的特点 第五节试样的采取与调制 一、取样的原则 二、样品的采取和前处理 思考题: 1、什么是仪器分析?仪器分析有哪些种类? 2、仪器分析的一般过程是什么?有何特点? 3、怎么描述电磁辐射? 4、电磁辐射与物质有哪些作用过程? 5、什么是文物? 6、简述现代分析技术在文物研究中的特点。 7、现代分析技术在文物研究中应用在哪些方面?请举例说明。 8、取样的原则是什么?对不同的样品如何进行前处理? 第二章文物的影像结构分析技术(4课时)第一节X光照相技术与CT扫描技术