
第三专题取代基对药物性质的影响
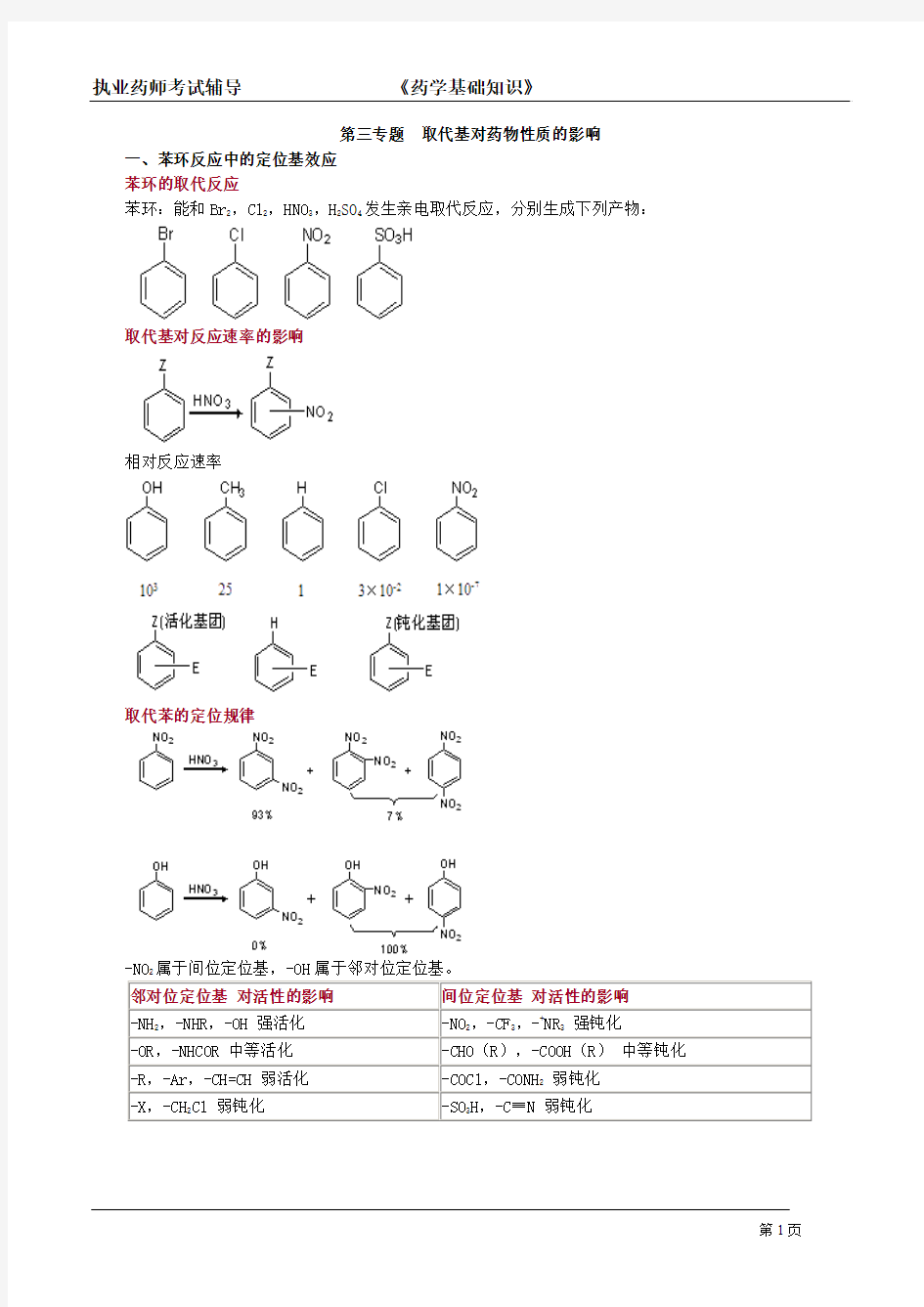
一、苯环反应中的定位基效应
苯环的取代反应
苯环:能和Br2,Cl2,HNO3,H2SO4发生亲电取代反应,分别生成下列产物:
取代基对反应速率的影响
相对反应速率
取代苯的定位规律
-NO2属于间位定位基,-OH属于邻对位定位基。
格列本脲又名优降糖,第二代磺酰脲类口服降糖药,比第一代吸收更快,血浆蛋白结合率更高,作用更强,毒性更低。
二、取代基的吸电子和给电子效应
由于成键原子间电负性不同或共轭效应,使成键电子对偏向一方而发生极化,产生了吸电子基团或供电子基团。
基团没有连接在双键上(无共轭效应):
吸电子基:-NO2 > -N+(CH3)3 > -CN > -F > -Cl> -Br > -I > -OCH3 > -C6H5 > -H
供电子基:-C(CH3)3 > -CH(CH3)2 >-CH2CH3 > -CH3 >-H
基团直接连接在双键上(有共轭效应):
吸电子基顺序参照苯环邻对位、间位取代基。
局麻药的构效关系:
苯环是局麻作用的必需结构,可为芳环或芳杂环,以苯环作用最常见且作用较强。
脂类药物苯环上对位引入供电子基团,如氨基、烷氧基时,局麻作用增强,反之减弱。
三、取代基的亲脂性和亲水性
中药化合物的亲脂性和亲水性
1. 生物碱:一类存在于生物体内分子中含有氮原子的有机化合物的总称;一般具有碱性,可与酸成盐。游离生物碱具亲脂性;生物碱盐具亲水性。
2. 苷类:一类经水解后可产生糖和非糖两部分的化合物。非糖部分叫苷元。苷具亲水性,苷元具亲脂性。
3. 挥发油:一类可随水蒸气蒸馏出来的与水不相混溶的油状液体的总称。具有香味或特殊气味的中药往往都含有挥发油。挥发油具亲脂性。
以上三类为主要的有效成分类型。
4. 糖类:中药中普遍存在的成分类型,包括单糖、低聚糖、多糖。单糖是糖的基本单位;低聚糖、多糖是由多个单糖脱水缩合而成的,它们的亲水性都很好。
5. 有机酸:泛指分子中有羧基的化合物。在植物中多以金属离子或生物碱盐的形式存在。按分子大小又分为小分子有机酸和大分子有机酸。前者极性大,有亲水性;后者极性小,有亲脂性。
6. 树脂:植物组织中树脂道的分泌物。性脆,受热时先软化而后变为液体,燃烧时发生浓烟并有明火。树脂有亲脂性。
7. 氨基酸、蛋白质和酶:
氨基酸:分子中含有氨基的羧酸。构成蛋白质的多为α-氨基酸。为亲水性。
蛋白质、多肽:多种α-氨基酸通过肽键首尾相连而成的高分子化合物。
酶:有机体内具有催化作用的蛋白质,其催化作用具有专属性,如特定的酶可催化水解特定的苷。酶的性质和蛋白质相同。
8. 鞣质:一类分子较大、结构复杂的多元酚类化合物。可与蛋白质结合成难溶于水的鞣酸蛋白。为亲水性物质。
9. 植物色素:植物中具有颜色的成分的总称。依溶解性又分为水溶性和脂溶性色素;前者主要指一些有颜色的苷、花青素,后者主要包括叶绿素、胡萝卜素等。
10. 油脂和蜡:油脂为一分子甘油和三分子脂肪酸脱水结合形成的酯。常温下为液体。蜡为高级不饱和脂肪酸和一元醇生成的酯。主要在植物茎、叶的表面。常温下为固体。均为亲脂性成分。
可使药物亲脂性增加的基团是
A.氨基
B.羟基
C.羧基
D.烃基
E.磺酸基
【正确答案】D
可使药物亲水性增加的基团是
A.苯基
B.羟基
C.酯基
D.烃基
E.卤素
【正确答案】B
可使药物亲水性增加的基团是
A.苯基
B.羟基
C.酯基
D.烃基
E.卤素
【正确答案】B
化学成分的极性
1. 影响化合物极性的因素:
(1)化合物分子母核大小(碳数多少):分子大、碳数多,极性小;分子小、碳数少,极性大。
(2)取代基极性大小:在化合物母核相同或相近情况下,化合物极性大小主要取决于取代基极性大小。
常见基团极性大小顺序如下;酸>酚>醇>胺>醛>酮>酯>醚>烯>烷。
判断下列各组化合物极性大小
甲砜霉素为氯霉素的合成类似物。将氯霉素中的硝基用强吸电子基甲砜基取代后,抗菌活性增强,水溶性加大。但抗菌谱与氯霉素相似。临床用于呼吸道感染、尿路感染、败血症、脑炎和伤寒等,副反应较少。
A.卤素
B.巯基
C.烃基
D.酰胺
E.酯
易与生物大分子形成氢键
【正确答案】D
强吸电子基团,影响电荷分布和脂溶性
【正确答案】A
可改变分子的解离程度、分配系数,增加位阻
【正确答案】C
强吸电子基团,影响电荷分布和脂溶性
【正确答案】A
可改变分子的解离程度、分配系数,增加位阻【正确答案】C
关键质量属性关和键工艺参数(CQA&CPP) 1、要求: 生产工艺风险评估的重点将由生产工艺的关键质量属性(CQA)和关键工艺参数(CPP)决定。 生产工艺风险评估需要保证能够对生产工艺中所有的关键质量属性(CQA)和关键工艺参数(CPP)进行充分的控制。 2、定义: CQA关键质量属性:物理、化学、生物学或微生物的性质或特征,其应在适当的限度、范围或分布内,以保证产品质量。 CPP关键工艺参数:此工艺参数的变化会影响关键质量属性,因此需要被监测及控制,确保产产品的质量。 3、谁来找CQA&CPP 3.1 Subject Matter Experts(SME)在某一特定领域或方面(例如,质量部门,工程学,自动化技术,研发,销售等等),个人拥有的资格和特殊技能。 3.2 SME小组成员:QRM负责/风险评估小组主导人、研发专家、技术转移人员(如适用)、生产操作人员、工程人员、项目人员、验证人员、QA、QC、供应商(如适用)等。 3.3 SME小组能力要求矩阵: 4、如何找CQA&CPP 4.1 在生产工艺中有很多影响产品关键质量属性的因素,每个因素都存在着不同的潜在的风险,必须对每个因素充分的进行识别分析、评估,从而来反映工艺的一些重要性质。
4.2 列出将要被评估的工序步骤。工艺流程图,SOP或批生产记录可以提供这些信息。评估小组应该确定上述信息的详细程度来支持风险评估。 例:
文件资源:保证在评估之前已经具备所有必要的文件。 良好培训:保证在开展任何工作之前所有必要的风险评估规程、模板和培训已经就位。 评估会议:管理并规划所有要求的风险评估会议。 例:资料需求单 ICH Q8(R2)‐ QbD‐系统化的方法、 ICHQ9‐质量风险管理流程图 CQA&CPP风险评估工具‐FMEA
第一章药物分析与药品质量标准 一、基本要求 1.掌握:药物分析的性质和任务,药品的定义和特殊性,药品质量和稳定性研究的目 的与内容,药品标准制定的方法和原则。 2.熟悉:药品标准,中国药典的内容和进展,主要国外药典的内容。 3.了解:药品质量管理规范,药品检验的基本程序。 二、基本内容 本章内容涵盖《药物分析》第7版的绪论和第一章药品质量研究内容与药典概况。 (一)基本概念 药物( drugs)是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应证或者功能主治、用法和用量的物质。 药品( medicinal products)通常是指由药物经一定的处方和工艺制备而成的制剂产品,是可供临床使用的商品。药物通常比药品表达更广的内涵。 药品是用于治病救人、保护健康的特殊商品,具有以下特殊性:①治病与致病的双重性; ②严格的质量要求性;(爹社会公共福利性。 药物分析(pharmaceutical analysis)是研究药物质量规律、发展药物质量控制方法的科学。 药物分析是药学科学的重要分支学科,是药学研究的重要技术手段,任务就是对药物进行全面的分析研究,确立药物的质量规律,建立合理有效的药物质量控制方法和标准,保证药品的质量稳定与呵控,保障药品使用的安全、有效和合理。 (二)药品标准 药品标准(也俗称为药品质量标准)系根据药物自身的理化与生物学特性,按照批准的来源、处方、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。 国家药品标准,是指国家食品药品监督管理局( SFDA)颁布的《中华人民共和国药典》、药品注册标准和其他药品标准,其内容包括质量指标、检验方法以及生产工艺等技术要求。国家药品监督管理部门组织药典委员会,负责国家药品标准的制定和修订。国家药品标准是药品生产、供应、使用、检验和药政管理部门共同遵循的法定依据。 药品标准的内涵包括:真伪鉴别、纯度检查和品质要求三个方面,药品在这三方面的综
药物理化性质和药效的 关系 文件管理序列号:[K8UY-K9IO69-O6M243-OL889-F88688]
(药物的溶解度、分配系数、解离度和官能团对药效的影响,)在对于结构非特异性药物,药物的理化性质直接影响药物的活性。药物的理化性质主要有药物的溶解度、分配系数和解离度。 一、药物的溶解度和分配系数对药效的影响 在人体中,大部分的环境是水相环境,体液、血液和细胞浆液都是水溶液,药物要转运扩散至血液或体液,需要溶解在水中,要求药物有一定的水溶性(又称为亲水性)。而药物在通过各种生物膜(包括细胞膜)时,这些膜是由磷脂所组成的,又需要其具有一定的脂溶性(称为亲脂性)。由此可以看出药物亲水性或亲脂性的过高或过低都对药效产生不利的影响。 在药学研究中,评价药物亲水性或亲脂性大小的标准是药物的脂水分配系数,用P来表示,其定义为:药物在生物非水相中物质的量浓度与在水相中物质的量浓度之比。
由于生物非水相中药物的浓度难以测定,通常使用在正辛醇中药物 的浓度来代替。C org 表示药物在生物非水相或正辛醇中的浓度;C W 表示药 物在水中的浓度。P值越大,则药物的脂溶性越高,为了客观反映脂水分配系数的影响,常用其对数lgP来表示。 药物分子结构的改变对药物脂水分配系数的影响比较大。影响药物的水溶性因素比较多,当分子中官能团形成氢键的能力和官能团的离子化程度较大时,药物的水溶性会增大。相反若药物结构中含有较大的脂环等非极性结构时,则导致药物的脂溶性增大。 各类药物因其作用不同,对脂溶性有不同的要求。如:作用于中枢神经系统的药物,需通过血脑屏障,应具有较大的脂溶性。吸人性的全身麻醉药属于结构非特异性药物,其麻醉活性只与药物的脂水分配系数有关,最适lgP在2左右。 二、药物的解离度对药效的影响 有机药物多数为弱酸或弱碱,在体液中只能部分解离,以解离的形式(离子型,脂不溶)或非解离的形式(分子型,脂溶)同时存在于体液中。通常药物以非解离的形式被吸收,通过生物膜,进入细胞后,在膜内的水介质中解离成解离形式而起作用。
实验室制取氧气及其性质实验报告 实验者: 实验日期: 一、实验目的: 1、掌握实验室制取氧气的方法 2、掌握氧气的性质 二、实验器材:导气管,试管,集气瓶,酒精灯,水槽,燃烧匙 三、实验药品:氯酸钾,二氧化锰,木炭,硫粉,红磷,铁丝 四、实验原理:2KClO 3 2KCl+3O 2 五、实验步骤: 安装如图组装仪器。 查:检查装置气密性 ,双手握住试管,观察玻璃管内水柱变化。 装:将药品装入试管,在试管口放一小团棉花,装好带导管的软木塞。 定:将试管固定在铁架台,试管夹应夹在离试管口1/3处,试管口应向下。 点:点燃酒精灯,先来回移动,使试管均匀受热,然后将火焰集中在药品处加热。 收:采用排水法收集氧气,理由是氧气不溶于水。收集四瓶氧气。 离:收集满氧气后,先将导管移开水槽。 熄:再用灯帽熄灭酒精灯。 六、氧气性质实验操作: 1、观察氧气的颜色和气味:无色无味,能使带火星的木条复燃。 2、娶一小块木炭,在酒精灯上烧至发红,然后将木炭插入集气瓶内。 观察现象:剧烈燃烧,发出白光,放出热量,说明集气瓶中有纯净的氧气存在。反应完后,向集气瓶中加入澄清石灰水,振荡后,现象为澄清石灰水变浑浊,说明木炭跟氧气反应后产生CO 2。 化学方程式为:C +O 2CO 2 3、用细铁丝螺旋绕在燃烧匙是,另一端绕一根火柴,点燃火柴,待火柴燃烧尽时,立即放入留有水,充满氧气的集气瓶中。 观察现象:红热的铁丝剧烈燃烧,火星四射,放出大量热,生成黑色固体。化学方程式为: 3Fe +2O 2 Fe 3O 4 4、取少量硫粉在燃烧匙上,在酒精灯上加热,硫粉熔化,迅速将燃烧匙伸进充满氧气的集气瓶中。 S +O 2 SO 2 5、取少量磷粉在燃烧匙上,在酒精灯上加热至发红,迅速将燃烧匙伸进充满氧气的集气瓶中。 观察现象:剧烈燃烧,发出明亮光辉,放出热量,生成白烟。化学方程式为: 4P +5O 22P 2O 5
1.药物分析的任务是什么? ①.药物成品的化学检验工作 ②.药物生产过程的质量控制 ③.药物贮存过程的质量考察 ④.临床药物分析工作 2.高效液相色谱法检查药物的杂质方法有几种? ①.内标法加校正因子测定供试品中某个杂质含量 ②.外标法测定供试品中某个杂质含量 ③.加校正因子的主成分自身对照法 ④.不加校正因子的主成分自身对照法 ⑤.面积归一法 3.杂质有哪些来源和途径? 来源; ①.从药物生长过程中引入 ②.由药物储藏过程中引入 途径:在合成药的生产过程中,未反应完全的原料、反应的中间体和副产物,在精致时未能完全出去,就会成为产品中的杂质。药品在储藏过程中,在外界条件的影响下,或因微生物的作用,可能发生水解、氧化、分解、异构化、晶型转变、聚合、潮解和发霉等变化,产生有光的杂质。具有酚羟基、巯基、亚硝基、醛基以及长链共轭多烯等结构的药物,在空气中易被氧化,引起药物变色、失效甚至产生毒性的氧化产物等。 4.铁盐检查法中加入硫酸铵的目的是什么? 加入氧化剂过硫酸铵,一方面可以氧化供试品中Fe2+成Fe3+,同时可防止光线导致的硫氰酸铁还原货分解褪色。 5.为什么标准铅液、标准铁液、标准砷液都要事先配制成储备液存放,用时稀释?铅离子、铁离子和亚砷酸根离子在低浓度、近中性溶液中易水解,故先配成高浓度的酸性储备液,使其稳定。用时稀释即可。 6.薄层色谱法检查杂质的类型有哪几种? ①.选用实际存在的待检杂质对照品法 ②.选用可能存在的某种物质作为杂质对照品 ③.高低浓度对比法 ④.在检查条件下,不允许有杂质斑点。 7.用对照法检查杂质,应注意哪些方面的平行? 供试液的处理和对照液的处理在所用试剂、反应条件、反应时间、实验顺序登方面要相同,以保证结果的可比性。 8.重金属检查的常用四种方法反别在什么情况下应用? 第一法(硫代乙酰胺法):适用于无需有机破坏,在酸性条件下可溶解的,无色的药物的重金属检查。 第二法(炽灼破坏后检查重金属):适用于含芳香环、杂环以及不溶于水稀酸及乙醇的有机药物的重金属检查。 第三法(硫化钠法):适用于溶于碱而不溶于稀酸或在稀酸中生成沉淀的药物。第四法(微孔滤膜法):适用于含2~5μg重金属杂质及有色供试液的检查。 9.制定杂质检查项目和限量的原则是什么? 凡是影响疗效和对人体健康有害的杂质均应制定相应的检查项目和限量。
个人经验较浅,试着对关键质量属性进行一个小总结。 是否关键质量属性,每一个剂型、品种、规格,都不一样,应该经过适当的评估(从安全性、有效性上)。以下答案可能具有偏颇性 详细请查看原文,原文不定期更新关键属性 欢迎大家讨论补充 先说定义: 关键质量属性(Critical Quality Attributes, CQA):(备注1) 指物质(药品或活性成分)具备的直接或间接影响物质安全、鉴别、强度、纯度的物理,化学,微生物方面特性。关键质量属性确定的标准是基于药品在不符合该质量属性时对患者所造成危害(安全性和有效性)的严重程度。 关键工艺参数:(备注2) 简单来说:影响药品关键质量属性的工艺参数 复杂来说:Critical Process Parameter (CPP): A process parameter whose variability has an impact on a critical quality attribute and therefore should be monitored or controlled to ensure the process produces the desired quality. ICH Q8 Pharmaceutical Development。 我们来看看常见质量属性以及为什么这些属性是或者不是关键质量属性(重点考虑安全性和有效性) 一、外观:(非CQA) 属性目标:让患者容易接受的颜色和形状,无目视观察到的片剂缺陷。 理由:颜色,形状和外观与安全性和有效性无直接关系。因此,它们不是关键。做为质量属性的原因是因为长得好看的东西更容易让人接受...例如小孩吃糖喜欢卡通状的。这是一个看脸的世界。 二、气味:(非CQA) 属性目标:不要那么难闻。 理由:一般来说,可觉察的气味与安全性和有效性无直接关系,但气味可影响患者可接受性并导致投诉。如果药品中使用的药物和辅料都有难闻气味或者在药品生产工艺中使用有机溶剂,则应该在药品研发阶段设定好适量的矫味剂。 三、尺寸大小(CQA) 属性目标:便于吞咽、使用(仿制药考虑与参比制剂一致) 理由:药品(片剂、胶囊、栓剂等)的尺寸大小与吞咽性、可使用性有关;因此,它是关键。为比较容易吞咽、使用和患者接受及遵守治疗方案。仿制药关注药品大小和体积与参比制剂类似。 四、刻痕和分割性(CQA) 属性目标:便于使用(片剂可分割一半计量) 理由:部分理由同上,在药品设计阶段依据临床使用要求制定,涉及剂量问题,影响患者使用的有效性与安全性。 五、脆碎度(非CQA) 属性目标:避免破碎带来的外观影响投诉,仿制药关注符合参比制剂的质量标准以及药典或者已上市药品标准。理由:除了按照药典或者已上市药品标准以为,该属性尽量减少上市后有关片剂外观的投诉。该目标脆碎度将不影响患者的安全性或有效性。 六、鉴别(制剂非CQA 原料药CQA) 属性目标:确定是否是这货- - 理由: 对于制剂来说,虽然鉴别是安全性和有效性的关键,但该CQA可通过质量管理体系得到有效控制(物料放行),
药物分析试题及答案 第一章药品质量研究的内容与药典概况(含绪论) 一、填空题 1.中国药典的主要内容由凡例、_正文、附录、引索四部分组成。 2.目前公认的全面控制药品质量的法规有 GLP、GMP、GSP、GCP。 3.“精密称定”系指称取重量应准确至所取重量的千分之一;“称定”系指称取重量应准确至所取重量的百分之一;取用量为“约”若干时,系指取用量不得超过规定量的±10% 。 4.药物分析主要是采用化学或物理化学、生物化学等方法和技术,研究化学结构已知的合成药物和天然药物及其制剂的组成、理化性质、真伪鉴别、纯度检查以及有效成分的含量测定等。所以,药物分析是一门研究与发展药品质量控制的方法性学科。 5.判断一个药物质量是否符合要求,必须全面考虑三者_鉴别、检查、含量测定_的检验结果。 6.药物分析的基本任务是检验药品质量,保障人民用药_ 合理、有效、安全_、的重要方面。 二、选择题 1.《中国药典》从哪年的版本开始分为三部,第三部收载生物制品,首次将(生物制品规程)并入药典 (A)1990版 (B)1995版 (C)2000版(D)2005版 (E)2010版 2. ICH(人用药品注册技术要求国际协调会)有关药品质量的技术要求文件的标识代码是() (A)E(药品有效性的技术要求) (B)M(药品的综合技术要求) (C)P (D)Q (E)S (药品安全性的技术要求) 3.《药品临床试验质量管理规范》可用()表示。 (A)GMP(药品生产质量管理规范) (B)GSP(药品经营质量管理规范) (C)GLP(药品非临床研究质量管理规范) (D)GAP(中药材生产质量管理规范(试行))(E)GCP 4.目前,《中华人民共和国药典》的最新版为() (A)2000年版 (B)2003年版(C)2010年版 (D)2007年版 (E)2009年版 5.英国药典的缩写符号为()。
水泥基本性质实验报告 篇一:建筑材料水泥试验报告 建筑材料水泥试验报告 1. 实验目的 1.1.掌握水泥各种技术性质定义 .通过试验进一理解水灰比、掺和料对水泥强度的影响。 1. 2.学会操作水泥强度和与外加剂相容性的实验方法。 1. 3.了解水泥安定性、凝结时间的测试方法。 2. 实验内容 2.1.水泥与外加剂相容性实验 1.实验原理相容性的概念: 对于混凝土外加剂与水泥适应性的定义,普遍认为:依据混凝土外加剂应用技术规范,将经过检验符合标准的某种外加剂掺入按规定可以使用该品种外加剂的水泥中,用该水泥所配制的混凝土或砂浆若能够产生应有的效果,就认为该水泥与这种外加剂是适应的;相反,如果不能产生应有的效果,则该水泥与这种外加剂不适应。 选用PO42.5水泥300g,水87g(水灰比相同),减水剂掺量不同,分别测定水泥净浆流动度(mm)。画出减水剂掺量与净浆流动度之间的关系曲线并进行分析。 2.主要设备水泥净浆搅拌机、水平玻璃板、湿布、截锥圆模、电子称、钢尺等。 3.实验步骤
我们组负责的是减水剂掺量1.8%的水泥的净浆流动度: (1)将截锥圆模置于水平玻璃板上,先用湿布擦拭截锥圆模内壁和玻璃板,然后将湿布覆盖它们的上方。 (2)称量300g水泥,倒入用湿布擦拭过的搅拌锅内。 (3) 称量5.4g减水剂,加入搅拌锅。然后称量87g水,加入搅拌锅,搅拌3min。 (4)将拌好的净浆迅速诸如截锥圆模内,刮平,将截锥圆模按垂直方向迅速提起,30s以后量取相互垂直的两直径,并去它们的平均值作为次胶凝材料净浆的流动度。 其它减水剂掺量的实验步骤类似。 2.2.水泥胶砂强度实验 1.实验原理 选用PO42.5水泥,改变水灰比和粉煤灰的掺量。测定不同龄期的抗压、抗折强度,并对其结果进行分析。其重量比为:水泥:标准砂=1:3。水灰比分别为:0.45、0.50、0.55。粉煤灰掺量(内掺):10%、20%。水泥用量450g,标准砂用量1350g。 2.实验仪器 电子称、搅拌机、伸臂式胶砂振动台、可拆卸的三联模、水泥电动抗折实验机、压力实验机和抗压夹具等。 3.实验步骤 我们组负责的是10%、28天水泥胶砂强度的测量。胶砂的制备: (1)分别称量粉煤灰45g,水泥405g,标准砂1350g,水
药物分析学 药物分析学是药学学科下设的二级学科,是我国高等教育药学专业教学计划中规定设置的一门主要专业课程,也是我国执业药师考试中指定考试的专业课程之一。本课程主要介绍药品质量标准及其制订和药品质量检验的基本知识,通过本课程的学习为从事药品质量检验和新药的研究开发工作奠定基础。 第一节药物分析的性质和任务 药物分析学是药品全面质量控制的一个重要学科,它主要运用物理学、化学、生物化学的方法与技术研究、解决化学结构已经明确的合成药物或天然药物及其制剂的质量控制问题,也研究有代表性的中药制剂和生化制剂的质量控制方法。因此,药物分析学是一门研究与发展药品质量控制的“方法学科”,是药学学科的重要组成部分。 药物分析学科和药物分析工作者的任务,除了药品的常规理化检验以及药品质量标准的研究和制订外,尚需深入到生物体内过程并进行综合评价的动态分析研究中;所采用的分析方法应该更加准确、灵敏、专属和快速,并力求向自动化、最优化和智能化方向发展。 第二节药物分析与药品质量标准 一、我国药品质量标准体系 我国药品质量标准体系包括:法定标准和非法定标准;临时性标准和正式标准;内部标准和公开标准等。其中,法定标准又可分为中国药典、局颁标准和地方标准等三级药品标准。 (一)法定药品质量标准 我国现行的法定的药品质量标准体系包括:中华人民共和国药典、国家药品监督管理局药品标准、省(自治区、直辖市)药品标准,人们习称为“三级标准”体系。 中华人民共和国药典,简称为中国药典。是由国家药典委员会主持编纂、国家食品药品监督管理局批准并颁布实施。中国药典是我国记载药品标准的法典,是国家监督管理药品质量的技术标准。凡生产、销售和使用质量不符合药典标准规定的药品均为违法行为。 国家食品药品监督管理局标准(简称局颁标准),系由国家食品药品监督管理局批准并颁布实施的药品标准 省(自治区、直辖市)药品标准,系由各省、自治区、直辖市的卫生行政部门〔卫生厅(局)〕批准并颁布实施的药品标准,属于地方性药品标准(简称地方标准),主要收载具有地方性特色的药品标准。 (二)临床研究用药品质量标准 该标准仅在临床试验期间有效,并且仅供研制单位与临床试验单位使用,属于非公开的药品标准。
醇酚的性质实验报告 篇一:实验六酚的性质与鉴定 实验六酚的性质与鉴定 一、实验目的 1、熟悉酚的基本性质; 2、掌握酚的鉴别方法。 二、实验原理 酚的分子中,由于羟基中的氧原子与苯环形成P-π共轭,电子云向苯环偏移,溶于水后可以电离出氢离子,显示弱酸性。 但是苯酚的酸性比碳酸弱。若将苯酚钠与碳酸钠溶液反应,可以析出苯酚。用这种方法可以分离苯酚。 苯酚可以和NaOH反应,但不与NaHCO3反应。 利用醇、酚与NaOH和NaHCO3反应性的不同,可鉴别和分离酚和醇。 苯酚与溴水在常温下可立即反应生成2,4,6-三溴苯酚白色沉淀。反应很灵敏,很稀的苯酚溶液就能与溴水生成沉淀。故此反应可用作苯酚的鉴别和定量测定。
(白色) 酚类可以与FeCl3溶液反应显色,用于鉴别酚类。苯酚可以用于制备酚酞。 棕红色蓝紫色 三、实验器材 仪器:试管、试管架、试管夹、酒精灯、pH试纸 无机试剂: NaOH(5%),饱和溴水, NaHCO3(5%,饱和),的Na2CO3(5%), 5%FeCl3 ,HCl(5%)溶液; 有机试剂:苯酚 四、实验步骤 1、酚的溶解性和弱酸性 将0.2 g的苯酚放在试管中,加入3mL水,振荡试管后观察是否溶解。用玻璃棒蘸1滴溶液,以广泛pH试纸测定其酸碱性。然后再加热试管,直到苯酚全部溶解。 将上述溶液分装在3支试管中,冷却后出现浑浊,在其中一支试管中加入2~3滴5%的NaOH溶液,观察是否溶解。再滴加5%的盐酸,有何变化?在另2支试管中分别加入5%
的NaHCO3溶液和5%的Na2CO3溶液,观察是否溶解。 2、酚类与FeCl3溶液的显色反应 在试管中加入1%苯酚0.5mL,再加入1~2滴1% FeCl3溶液,观察和记录各试管中所显示的颜色。 3、与溴水的反应 在1支试管中加入2滴苯酚饱和水溶液,再加2 mL水稀释,在另一只试管中加入2 mL自来水,然后在两只试管中逐滴加入饱和溴水,比较两只试管中的现象。写出反应方程式。 五、思考题 1、如何鉴别醇和酚? 2、举例说明具有什么结构的化合物能与FeCl3溶液发生显色反应? 3、为什么苯酚比苯和甲苯容易发生溴代反应? 篇二:有机化学实验十一醇、酚的鉴定 实验十一醇、酚的鉴定 一.实验目的: 1. 进一步认识醇类的性质; 2比较醇,酚之间的化学
关键质量属性(Critical Quality Attributes, CQA):指物质(药品或活性成分)具备的直接或间接影响物质安全、鉴别、强度、纯度的物理,化学,微生物方面特性。关键质量属性确定的标准是基于药品在不符合该质量属性时对患者所造成危害(安全性和有效性)的严重程度。关键工艺参数: 简单来说:影响药品关键质量属性的工艺参数 复杂来说: Critical Process Parameter (CPP): A process parameter whose variability has an impact on a critical quality attribute and therefore should be monitored or controlled to ensure the process produces the desired quality. ICH Q8 Pharmaceutical Development。 我们来看看常见质量属性以及为什么这些属性是或者不是关键质量属性(重点考虑安全性和有效性) 一、外观:(非CQA) 属性目标:让患者容易接受的颜色和形状,无目视观察到的片剂缺陷。 理由:颜色,形状和外观与安全性和有效性无直接关系。因此,它们不是关键。做为质量属性的原因是因为长得好看的东西更容易让人接受 例如小孩吃糖喜欢卡通状的。这是一个看脸的世界。 二、气味:(非CQA) 属性目标:不要那么难闻。 理由:一般来说,可觉察的气味与安全性和有效性无直接关系,但气味可影响患者可接受性并导致投诉。如果药品中使用的药物和辅料都有难闻气味或者在药品生产工艺中使用有机溶剂,则应该在药品研发阶段设定好适量的矫味剂。 三、尺寸大小(CQA) 属性目标:便于吞咽、使用(仿制药考虑与参比制剂一致) 理由:药品(片剂、胶囊、栓剂等)的尺寸大小与吞咽性、可使用性有关;因此,它是关键。为比较容易吞咽、使用和患者接受及遵守治疗方案。仿制药关注药品大小和体积与参比制剂类似。 四、刻痕和分割性(CQA) 属性目标:便于使用(片剂可分割一半计量) 理由:部分理由同上,在药品设计阶段依据临床使用要求制定,涉及剂量问题,影响患者使用的有效性与安全性。 五、脆碎度(非CQA) 属性目标:避免破碎带来的外观影响投诉,仿制药关注符合参比制剂的质量标准以及药典或者已上市药品标准。 理由:除了按照药典或者已上市药品标准以为,该属性尽量减少上市后有关片剂外观的投诉。该目标脆碎度将不影响患者的安全性或有效性。 六、鉴别(制剂非CQA原料药CQA) 属性目标:确定是否是这货 理由:对于制剂来说,虽然鉴别是安全性和有效性的关键,但该CQA可通过质量管理体系得到有效控制(物料放行),并在药品放行时进行监测。制剂的处方和工艺参数不影响特性。对于原料药来说,鉴别是CQA,影响安全性和有效性,原料药的处方和工艺参数影响该属性。 七、含量(CQA) 属性目标:具有治疗效果(剂量范围内),或符合药典或者已上市药品质量标准。 理由:含量差异将影响安全性和有效性;因此,含量是关键。 八、含量均匀度、片重差异、装量差异(CQA)
药物分析的性质和任 务
药物分析的性质和任务 药物分析是我国药学专业中规定设置的一门主要专业课程,是整个药学科学领域中一个重要的组成部分。 药品不同于一般产品,是用于防病、治病、诊断疾病、增强机体抵抗力的持殊商品。为了保证用药的安全、合理和有效,在药品的研制、生产、供应以及临床使用过程中部应该执行严格的科学管理制度,并采用各种有效的分析方法,物理学的、化学的、物理化学的、生物学的乃至微生物学的方法等,对药品进行严格的分析检验,从而对各个环节全面地保证、控制与研究提高药品的质量,实现药品的全面质量控制。因此药品质量的全面控制不是某一个单位或部门的工作,所涉及的整个内容也不是一门课程可以单独完成的,而是一项涉及多方面、多学科的综合性工作。药物分析是其中的一个重要方面。它主要运用化学、物理化学或生物化学的方法和技术研究化学结构已经明确的合成药物或天然药物及其制剂的质量控制方法,也研究有代表性的中药制剂和生化药物及其制剂的质量控制方法。因此,药物分析是一门研究与发展药品质量控制的“方法学科”。 为了全面控制药品的质量,药物分析工作应与生产单位紧密配合,积极开展药物及其制剂在生产过程中的质量控制,严格控制中间体的质量,并发现影响药品质量的主要工艺,从而优化生产工艺条件,促进生产和提高质量;也应与供应管理部门密切协作,注意药物在贮藏过程中的质量与稳定性考察,以便采取科学合理的贮藏条件和管理方法,保证药品的质量。值得重视的是,药品质量的优劣和临床用药是否合理会直接影响临床征象和临床疗效。所以,配合医疗需要,开展体内药物分析是十分重要的。研究药物进入体内的变化,如药物
在体内的吸收、分布、排泄和代谢转化过程,有利于更好地指导临床用药,减少药物的毒副作用。研究药物分子与受体之间的关系,也可为药物分子结构的改造,合成疗效更好、且毒性更低的药物提供信息。 随着整个药学科学事业日新月异的迅速发展,各相关学科对药物分析提出了新的要求。药剂学的剂型研究不再是一般的片剂、胶囊剂或注射剂。我国自70年代末、80年代初开始口服缓、控释制剂和靶向制剂的研究.现己进入释药系统(drugdeliv。ry syMem,DDs)的研究开发时代。对于这些制剂质量标准的研究和制订,以及生物利用度和药代动力学的研究,必须采用灵敏度高、专属性好的分析方法。随着改革开放的深入发展,国际、国内知识产权的保护措施正日益制约着专利品种的仿制,市场竞争也威胁着非保护品种生产的低水平重复,新药研究与开发要求多学科的协作,当然也离不开现代分析手段的辅助。天然产物或中药的活性成分的化学结构的确定,必须采用多种结构分析方法,进行综合的波谱解析。研制能参与国际市场竞争的中草药新药和新制剂,要求高质量和稳定可靠的原料,要求对原料和成品有科学可控的质量标准,对于中成药质量的综合评价更应运用现代分离分析技术和计算机技术,药物分析起着重要作用。现代生物技术所研制的生化药物和基因工程药物可能含有与非基因产品不同的有害物质,在检测方法上,大都采用适合于肽、蛋白质、多糖等大分子化合物的现代色谱、光谱综合性方法。至于新药研制过程中所研究的药动学、生物利用度、药物体内分布、及其在体内的代谢转化,乃至代谢物的分离鉴定,更离不开现代分离分析技术和方法作为“眼睛”。 因此.摆在药物分析学科和药物分析工作者面前的迫切任务,不再仅仅是静态的常规检验,而要深入到工艺流程、反应历程、生物体内代谢过程和综合评
化学性质实验报告 有机实验报告 糖、氨基酸和蛋白质的鉴定 一、糖的鉴定 糖类化合物:又称碳水化合物,是多羟基醛或多羟基酮及其缩聚物和某些衍生物的总称,一般由碳、氢与氧三种元素所组成。 实验目的: (1)进一步了解糖的化学性质;(2)掌握鉴定糖的方法及其原理。 (一)-萘酚试验(molish)糖类化合物一个比较普遍的定性反应是molish反应。即在浓硫酸存在下,糖与-萘酚(molish试剂)作用生成紫色环。 实验方法 取3支试管,编号,分别加入0.5 ml 0.5%的各待测糖水溶液,滴入2滴molish试剂( -萘酚的乙醇溶液),摇匀。把试管倾斜450,沿管壁慢慢加入约1ml浓硫酸(切勿摇 动),小心竖直后仔细观察两层液面交界处的颜色变化。硫酸在下层,试液在上层样品:葡萄糖、蔗糖及淀粉 解释: 糖被浓硫酸脱水生成糠醛或糠醛衍生物,后者进一步与 -萘酚缩合生成紫红色
物质,在糖液和浓硫酸的液面间形成紫色环。 (二) fehling试验 (1)实验原理 fehling试剂:含有硫酸铜和酒石酸钾钠的氢氧化钠溶液。 硫酸铜与碱溶液混合加热,生成黑色的氧化铜沉淀。若同时有还原糖存在,则产生黄色或砖红色的氧化亚铜沉淀。为防止铜离子和碱反应生成氢氧化铜或碱性碳酸铜沉淀,fehling试剂中需加入酒石酸钾钠,它与cu2+形成的酒石酸钾钠络合铜离子是可溶性的络离子。 (2)操作方法 取4支试管,编号,分别加入fehling试剂i和ii 各0.5ml。摇匀并置于水浴中微热后,分别加入5滴待测糖溶液,振荡后置于沸水浴中加热2 ~ 3min,取出冷却,观察颜色变化及有无沉淀析出。fehling试剂 i:称取3.5 g硫酸铜溶于100 ml蒸馏水中, 得淡蓝色的 fehling试剂 i。 fehling试剂 ii:将17g酒石酸钾钠溶于20ml热水中,然后加入20 ml含 5 g naoh的水溶液,稀释至100 ml得无色透明的 fehling试剂 ii。 样品:葡萄糖、果糖、蔗糖及麦芽糖 解释: 硫酸铜与碱溶液混合加热,生成黑色的氧化铜沉淀。若同时有还原糖存在,则产生黄色或砖红色的氧化亚铜沉淀。 (三) benedict试验
药品关键质量属性(CQA)分析 关键质量属性(Critical Quality Attributes, CQA): 指物质(药品或活性成分)具备的直接或间接影响物质安全、鉴别、强度、纯度的物理,化学,微生物方面特性。关键质量属性确定的标准是基于药品在不符合该质量属性时对患者所造成危害(安全性和有效性)的严重程度。 关键工艺参数: 简单来说:影响药品关键质量属性的工艺参数 复杂来说:Critical Process Parameter (CPP): A process parameter whose variability has an impact on a critical quality attribute and therefore should be monitored or controlled to ensure the process produces the desired quality. ICH Q8 Pharmaceutical Development。 我们来看看常见质量属性以及为什么这些属性是或者不是关键质量属性(重点考虑安全性和有效性) 物理质量属性: 1.外观:(非CQA) 属性目标:让患者容易接受的颜色和形状,无目视观察到的缺陷。 理由:颜色,形状和外观与安全性和有效性无直接关系。因此,它们不是关键。做为质量属性的原因是因为长得好看的东西更容易让人接受...例如小孩吃糖喜欢卡通状的。这是一个看脸的世界。 2.气味:(非CQA) 属性目标:不要那么难闻。 理由:一般来说,可觉察的气味与安全性和有效性无直接关系,但气味可影响患者可接受性并导致投诉。如果药品中使用的药物和辅料都有难闻气味或者在药品生产工艺中使用有机溶剂,则应该在药品研发阶段设定好适量的矫味剂。 3.鉴别(制剂非CQA 原料药 CQA) 属性目标:确定是否是这货- - 理由: 对于制剂来说,虽然鉴别是安全性和有效性的关键,但该CQA可通过质量管理体系得到有效控制(物料放行),并在药品放行时进行监测。制剂的处方和工艺参数不影响特性。 对于原料药来说,鉴别是CQA,影响安全性和有效性,原料药的处方和工艺参数影响该属性。 4.尺寸大小(CQA) 属性目标:便于吞咽、使用(仿制药考虑与参比制剂一致) 理由:药品(片剂、胶囊、栓剂等)的尺寸大小与吞咽性、可使用性有关;因此,它是关键。为比较容易吞咽、使用和患者接受及遵守治疗方案。仿制药关注药品大小和体积与参比制剂类似。 5.刻痕和分割性(CQA)
实验室制取氢气及其性质实验报告 实验者:实验日期: 一、实验目的: 1、掌握实验室制取氢气的方法 2、掌握氢气的性质 二、实验器材:导气管,试管,酒精灯,水槽,启普发生器 三、实验药品:锌粒,稀硫酸,氧化铜 四、实验原理:Zn+H2SO4 H2+ZnSO4 五、实验步骤: 安装如图组装仪器。 查:检查装置气密性,方法是,开启旋塞,向球形漏斗中加水,当水充满容器下部的半球体时关闭旋塞,继续加水,使水上升到球形漏斗中。静置片刻,观察水面是否下降,如下降说明漏气。漏气处可能是容器上气体出口处的橡皮塞、导气管上的旋塞或球形漏斗与容器接触的磨口处。如漏气应塞紧橡皮塞或在磨口处涂一薄层凡士林。 装:锌粒由容器上的气体出口加入,加固体前应在容器的球体中加入一定量的玻璃棉,以防固体掉入半球体中。液体试剂从球形漏斗口注入,注液方法与上述注水方法相同。液体的量以反应时刚刚浸没固体为宜。打开气体出口的活塞,开始反应,收集氢气。 收:采用排水法收集氢气,理由是氢气不溶于水。 离:收集满氢气后,先将导管移开水槽。 六、氢气性质实验操作: 1、氢气的纯度检验:收集一试管氢气,集满氢气的试管用拇指堵住管口,管口朝下,立即移近酒精灯火焰,点燃试管里的氢气。点火后,根据声音判断氢气是否纯净,如果听到的是尖锐的爆鸣声,则表示氢气不纯,必须重新收集进行检验,直至听到“噗”的声音,才表明收集的氢气已经纯净,可以使用。重新收集氢气检验时,应另换一支试管进行操作,若仍使用原试管,要先用拇指堵住试管口一会儿,然后再去收集氢气进行点火验纯。 2、吹泡泡实验:将出气导管上沾上肥皂水,可以观察到不断有泡泡冒出并升空,这说明氢气的密度比空气轻。 3 的烧杯壁上有小水珠出现,并放出热量。反应方程式:2H2 +O 2H2O 4、氢气还原氧化铜:先往试管内加入氧化铜,把氢气导气管伸入试管底部,先通入氢气一段时间(是为了把氧气清除,否则加热后氧化铜会与氧气反应,影响试验)再加热试管,使氢气还原氧化铜,看到黑色氧化铜全部变成红色时,停止加热,继续通入氢气(若先停止通氢气,则收集氢气处的水会倒吸入试管内,使热试管炸裂 化),待试管冷却后,停止通氢气。反应方程式:CuO+H2Cu+H2O 装置如图:
FDA发布咀嚼片关键质量属性指导原则(中英文对照) I. INTRODUCTION I.引言 This guidance provides manufacturers of chewable tablets for human use with the Center for Drug Evaluation and Research’s (CDER) current thinking on the critical quality attributes that should be assessed during the development of these drug This guidance also provides recommendations about submitting developmental, manufacturing, and labeling information for chewable tablets that must be approved by CDER before they can be distributed. The recommendations in this guidance apply mainly to new drug applications(NDAs), abbreviated new drug applications (ANDAs),3 and certain chemistry, manufacturing, and controls (CMC) supplements to these some of there commendations about the submission of developmental information may also apply to investigational new drug applications (INDs). The recommendations about assessing critical quality attributes apply to all chewable tablets for human use, including non-application products. 本指南向生产者提供了药品审评研究中心(CDER)对人用咀嚼片在研发过程中应评估的关键质量属性的当前想法2。该指南也提供了必须向CDER提交并被其批准的咀嚼片的研发、生产及说明书信息的建议。该指南的这些建议主要针对新药申请(NDAs)、仿制药申请(ANDAs)3和一些化学、生产和质控(CMC)补充申请4。某些建议同样适合于研究性新药申请(即新药临床申请,INDs)。关于评估关键质量属性的建议适用于所有人用咀嚼片,包括非申请产品。 Ingeneral, FDA’s guidance documents do not establish legally enforceableresponsibi lities. Instead, guidances describe the Agency’s current thinking ona topic and should be viewed only as recommendations, unless specificregulatory or statutory requirements are cited. The use of the word should inAgency guidances means that something is suggested or recommended, but notrequired. 通常,FDA的指导文件不具有法律强制性,指南中描述的主题仅代表FDA机构目前的看法,只作为建议,除非是引用具体的法规或条例要求。建议或推荐使用该指导原则,但不是必须的。 II. BACKGROUND II.背景 Chewabletablets are an immediate release (IR) oral dosage form intended to be chewedand then swallowed by the patient rather than swallowed whole. They should be designed to have a pleasanttaste and be easily chewed and swallowed. Chewable tablets should be safe and easy
药物分析的性质和任务 药物分析是我国药学专业中规定设置的一门主要专业课程,是整个药学科学领域中一个重要的组成部分。 药品不同于一般产品,是用于防病、治病、诊断疾病、增强机体抵抗力的持殊商品。为了保证用药的安全、合理和有效,在药品的研制、生产、供应以及临床使用过程中部应该执行严格的科学管理制度,并采用各种有效的分析方法,物理学的、化学的、物理化学的、生物学的乃至微生物学的方法等,对药品进行严格的分析检验,从而对各个环节全面地保证、控制与研究提高药品的质量,实现药品的全面质量控制。因此药品质量的全面控制不是某一个单位或部门的工作,所涉及的整个内容也不是一门课程可以单独完成的,而是一项涉及多方面、多学科的综合性工作。药物分析是其中的一个重要方面。它主要运用化学、物理化学或生物化学的方法和技术研究化学结构已经明确的合成药物或天然药物及其制剂的质量控制方法,也研究有代表性的中药制剂和生化药物及其制剂的质量控制方法。因此,药物分析是一门研究与发展药品质量控制的“方法学科”。 为了全面控制药品的质量,药物分析工作应与生产单位紧密配合,积极开展药物及其制剂在生产过程中的质量控制,严格控制中间体的质量,并发现影响药品质量的主要工艺,从而优化生产工艺条件,促进生产和提高质量;也应与供应管理部门密切协作,注意药物在贮藏过程中的质量与稳定性考察,以便采取科学合理的贮藏条件和管理方法,保证药品的质量。值得重视的是,药品质量的优劣和临床用药是否合理会直接影响临床征象和临床疗效。所以,配合医疗需要,开展体内药物分析是十分重要的。研究药物进入体内的变化,如药物在体内的吸收、分布、排泄和代谢转化过程,有利于更好地指导临床用药,减少药物的毒副作用。研究药物分子与受体之间的关系,也可为药物分子结构的改造,合成疗效更好、且毒性更低的药物提供信息。 随着整个药学科学事业日新月异的迅速发展,各相关学科对药物分析提出了新的要求。药剂学的剂型研究不再是一般的片剂、胶囊剂或注射剂。我国自70年代末、80年代初开始口服缓、控释制剂和靶向制剂的研究.现己进入释药系统(drugdeliv。ry syMem,DDs)的研究开发时代。对于这些制剂质量标准的研究和制订,以及生物利用度和药代动力学的研究,必须采用灵敏度高、专属性好的分析方法。随着改革开放的深入发展,国际、国内知识产权的保护措施正日益制约着专利品种的仿制,市场竞争也威胁着非保护品种生产的低水平重复,新药研究与开发要求多学科的协作,当然也离不开现代分析手段的辅助。天然产物或中
三、问答题: 1、何谓前药原理?前药原理能改善药物的哪些性质?举例说明 答:前药(pro drug)原理系指用化学方法将有活性的原药转变成无活性衍生物,在体经酶促或非酶促反应释放出原药而发挥疗效。 改善药物吸收,增加稳定性,增加水脂溶性,提高药物的作用选择性,延长药物作用时间,清除不良味觉,配伍增效等。 普罗加比(Pargabide)作为前药的意义。普罗加比在体转化成氨基丁酰胺,成GABA(氨基丁酸)受体的激动剂,对癫痫、痉挛状态和运动失调有良好的治疗效果。由于氨基丁酰胺的极性太大,直接作为药物使用,因不能透过血脑屏障进入中枢,即不能达到作用部位,起到药物的作用。为此作成希夫碱前药,使极性减小,可以进入血脑屏障。 2、吩噻嗪类药物的构象关系。 (1)吩噻嗪环2位引入吸电子基团,使作用增强。 (2)2位引入吸电子基团,例如氯丙嗪2位有氯原子取代,使分子有不对称性,10位侧链向含氯原子的苯环方向倾斜是这类抗精神 药的重要结构特征。 (3)吩酚噻嗪母核上10位氮原子与侧链碱性氨基之间相隔3个碳原子时,抗精神病作用强,间隔2个碳原子,例如异丙嗪缺乏抗精神病活性。 (4)侧链末端的碱性基团,可为脂肪叔氨基,也可为哌啶基或哌嗪基。以哌嗪侧链作用最强。 3、举例说明如何对青霉素的结构进行改造,得到耐酸.耐酶和抗菌谱广的半合
成抗生素,并说明设计思路。 第一类是耐酸青霉素,研究中发现PenicillinV的6位侧链的酰胺基上是苯氧甲基(C6H5OCH2-),苯氧甲基是吸电子基团,可降低羰基氧原子的电子云密度,阻止了羰基电子向b-酰胺环的转移,所以对酸稳定。根据此原理在6位侧链酰胺基α-位引入吸电子基团,设计合成了耐酸青霉素,如:非奈西林。(结构见下表) 第二类是耐酶青霉素。青霉素产生耐药性的原因之一是细菌(主要是革兰阳性菌)产生的b-酰胺酶使青霉素发生分解而失效。发现三苯甲基青霉素具较大的空间位阻,可以阻止药物与酶的活性中心作用,从而保护了分子中的b -酰胺环。根据这种空间位阻的设想,合成侧链上有较大的取代基的青霉素衍生物,如甲氧西林对青霉素酶稳定。另外在6a-位引入甲氧基或甲酰胺基,对b-酰胺酶的进攻形成位阻可增加b-酰胺环的稳定性而得到耐酶抗生素,如替莫西林。 第三类是广谱青霉素,在青霉素的侧链导入α-氨基,得到氨苄西林,由于α-氨基的引入改变了分子的极性,使药物容易透过细菌细胞膜,故扩大了抗菌谱,对革兰氏阳性、阴性菌都有强效。用羧基和磺酸基代替氨基,如羧苄西林,磺苄