
RNAi 沉默survivin 基因对胰腺癌细胞增殖、凋亡和细胞周期的影响
田维军 赵金伟 宋晓斌 (吉林省人民医院急诊外科,吉林 长春 130021)
〔摘 要〕 目的 应用RNA i 技术沉默胰腺癌细胞株中survivin 基因对肿瘤细胞凋亡、细胞周期和增殖的变化。方法 靶向survivin 的RNA i 载体转染胰腺癌细胞,W estern 印迹检测基因沉默效果,MTT 法和流式细胞术检测细胞增殖、凋亡及细胞周期。结果 survivin 基因沉默效率可达85%;
MTT 检测显示,干扰组survivin 沉默细胞增殖抑制与非特异性质粒对照组相比显著增高(P <0101)。流式细胞术显示,干扰组细胞凋亡百分率显著
高于非特异性质粒对照组(P <0101);G 2/M 期显著高于非特异性质粒对照组(P <0101或P <0105),而S 期则显著降低(P <0105)。结论 survivin 基因沉默可引起胰腺癌细胞周期阻滞,促进细胞凋亡,抑制细胞增殖。
〔关键词〕 RNA i;survivin;细胞凋亡;细胞周期;胰腺癌
〔中图分类号〕 R73914 〔文献标识码〕 A 〔文章编号〕 100529202(2010)022*******
第一作者:田维军(19622),男,副主任医师,主要从事肿瘤治疗的研究。
胰腺癌的发生、发展以及侵袭、转移是多基因参与、多步骤发生的过程,其中生存素(survivin )是一类在胰腺癌的发生、发展中起非常重要作用的癌基因〔1〕,其参与细胞多种重要生物学过程,包括基因转录调控、胚胎发生、细胞分化、肿瘤形成和转移等〔1,2〕。survivin 在胚胎期表达丰富,而在成熟组织中则表达极少或缺失,但在病理情况下,包括胰腺癌的很多恶性肿瘤组织中均发现有survivin 的高水平表达,并且其表达量与肿瘤恶性程度及转移能力呈正相关〔1,3〕。survivin 的过表达和激活不仅与预后不良密切相关,而且能影响肿瘤细胞对化疗药物的敏感性,是胰腺癌基因治疗的潜在靶点之一
〔4,5〕
。本研究选择
survivin 分子作为干扰靶点,检测沉默该基因后对胰腺癌细胞
凋亡和细胞周期的影响,为进一步研究survivin 基因在肿瘤细胞生物学特性及免疫抑制中的作用构建技术平台。
1 材料与方法
111 主要试剂 人胰腺癌细胞株PC 23购自中国科学院上海
生物研究所细胞库,以含10%胎牛血清(Hycl one 公司)的
DME M (Gibco 公司)培养基,37℃,5%C O 2孵箱(S ANY O )培养。
转染试剂L i pofecta m ine
T M
2000(美国Gibco 公司),ECL 化学发光试剂盒(美国Pierce 公司),小鼠抗人单克隆survivin 抗体
(Santa Cruz 公司)。干扰质粒pGenesil 22、非特异性si RNA (武
汉市晶赛生物工程技术有限公司),pGensil 2si RNA 2survivin 质粒由本室构建。Annexin 2V 凋亡检测试剂盒购自美国BD 公司。
112 细胞培养与细胞转染 转染前1d 将对数生长期的胰腺
癌细胞株PC 23以2×105
个/孔接种于6孔培养板,细胞铺板在
2m l 含血清、不含抗生素的DME M 培养基中,24h 内、细胞融合
达40%~60%时进行转染,将si RNA 2L i pofecta m ine T M 2000复合体加到培养板中(转染方法按试剂盒说明书操作),转染体系为
500μl,si RNA s 终浓度为100n mol/L 。
113 W estern 印迹检测基因沉默效果 收集细胞,用P BS 缓冲
液漂洗3次,加入200μl 细胞裂解液混匀、冰浴30m in 。
15000r/m in 离心10m in,以Lowry ′s 法行总蛋白定量分析。制
备12%分离胶、5%积层胶,上样,在8V /era 电压条件下行S DS
聚丙烯酰胺电泳,待溴酚蓝进入分离胶时,将电压提高到15V /
era 。电泳结束后,将分离出的蛋白质转至硝酸纤维素膜上(M illi pore,US A ),5%脱脂奶粉的T BS 溶液封闭2h,鼠抗人单
克隆一抗和β2actin 室温孵育2h,二抗室温孵育115h,EC L 试剂盒显色,拍照,比较各组灰度变化。分为si RNA 干扰组、si R 2
NA 干扰对照组(用非特异si RNA 2L i pofecta m ine T M
2000复合体
转染)、空载体组(以空白载体复合体转染)、未转染对照组(以等量培养基处理)作为对照,观察各组干扰效果。
114 MTT 法检测细胞增殖 将各组细胞以2000个/孔的密
度接种于96孔板,体积200μl/孔。分别于转染后24、48、72h 进行MTT 检测,酶标仪测定570μm 处OD 值,连续测定3d 。每个时间点设5个复孔,根据吸光度值绘制曲线,比较各组细胞生长速度变化。分为si RNA 干扰组和非特异性转染对照组。
115 流式细胞仪检测细胞周期和细胞凋亡 分别于转染后24、48、72h 收集细胞,冷P BS 洗涤2次,-20℃预冷的70%乙
醇固定48h,1200r/m in 离心10m in 弃上清,1000μl P BS 重悬加10mg/m l RNase 20μl 混匀,37℃水浴45m in,P BS 洗
Rnase,100μl P BS 重悬,100μl P I 4℃避光染色1h 。流式细胞
仪测定荧光强度,Cell Q uest 分析软件进行细胞周期DNA 含量分析,确定细胞周期分布。细胞凋亡的检测采用Annexin V 细胞凋亡检测试剂盒,实验操作按说明书进行。每组细胞重复3个样本,分为si RNA 干扰组和非特异性转染对照组。
116 统计学分析 数据均以x ±s 表示,采用统计软件SPSS 1610分析。2 结 果
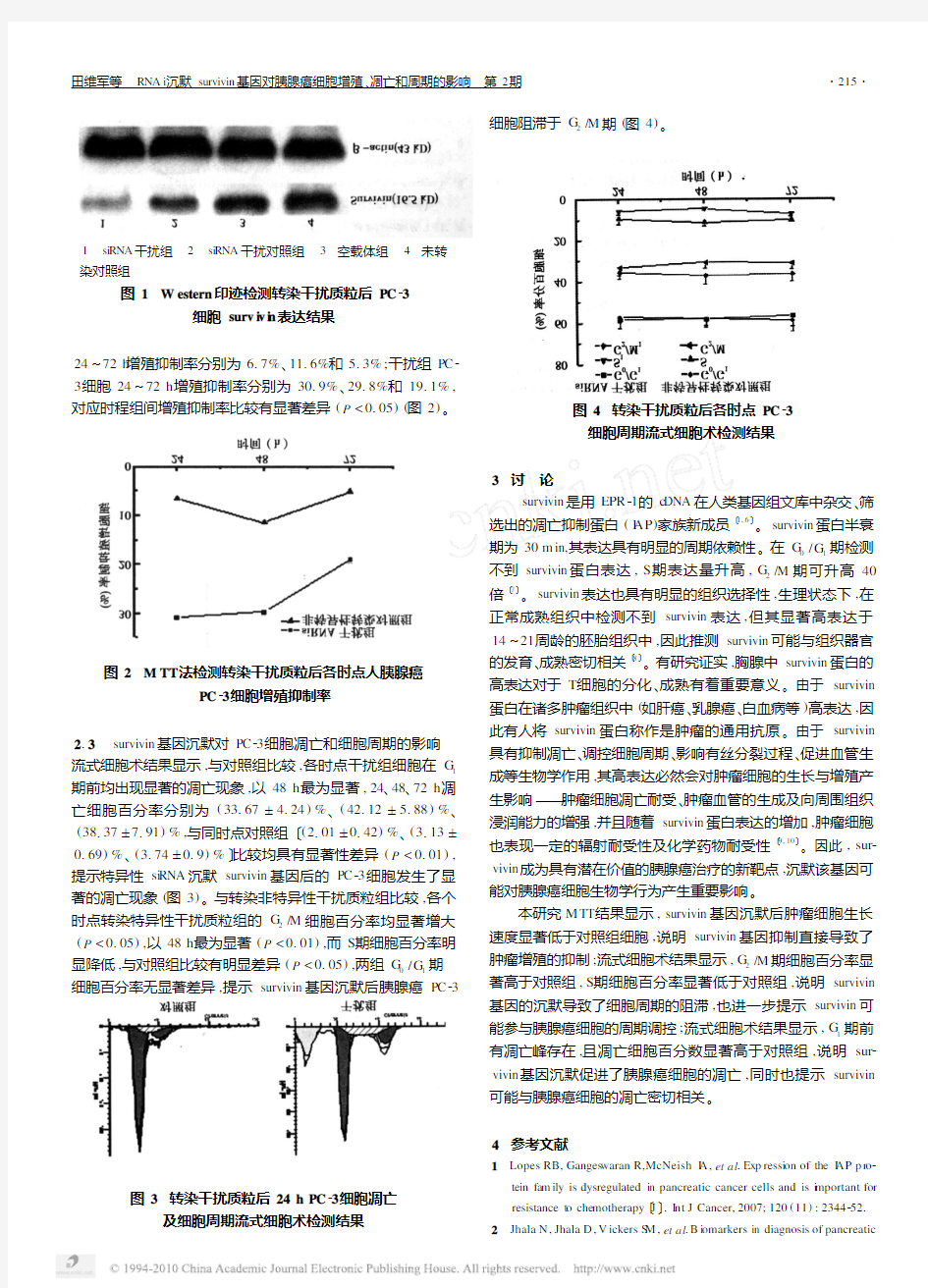
211 W estern 印迹检测si RNA 抑制survivin 基因的效果 空载
体组及si RNA 干扰对照组survivin 表达未受抑制,与未转染对照组比较无显著差异;而干扰组survivin 表达与对照组相比则明显受到抑制,干扰效率达到85%以上,说明RNA i 载体构建有效,能够有效地抑制转染细胞中survivin 的表达(图1)。
212 survivin 基因沉默对PC 23细胞增殖的影响 M TT 检测结
果显示,PC 23细胞行survivin 基因干扰后0~72h,较相同时间点对照组细胞吸光度A 值降低;其中24、48h 干扰组PC 23细胞吸光度A 值明显低于对照组(P <0105)。对照组PC 23细胞
?412?中国老年学杂志2010年1月第30卷
1 si RNA 干扰组 2 si RNA 干扰对照组 3 空载体组 4 未转
染对照组
图1 W estern 印迹检测转染干扰质粒后PC 23
细胞surv i v i n 表达结果
24~72h 增殖抑制率分别为617%、1116%和513%;干扰组PC 23细胞24~72h 增殖抑制率分别为3019%、2918%和1911%,
对应时程组间增殖抑制率比较有显著差异(P <0105)(图2)
。
图2 M TT 法检测转染干扰质粒后各时点人胰腺癌
PC 23细胞增殖抑制率
213 survivin 基因沉默对PC 23细胞凋亡和细胞周期的影响
流式细胞术结果显示,与对照组比较,各时点干扰组细胞在G 1期前均出现显著的凋亡现象,以48h 最为显著,24、48、72h 凋
亡细胞百分率分别为(33167±4124)%、(42112±5188)%、
(38137±7191)%,与同时点对照组〔(2101±0142)%、(3113±0169)%、(3174±019)%〕比较均具有显著性差异(P <0101),
提示特异性si RNA 沉默survivin 基因后的PC 23细胞发生了显著的凋亡现象(图3)。与转染非特异性干扰质粒组比较,各个时点转染特异性干扰质粒组的G 2/M 细胞百分率均显著增大(P <0105),以48h 最为显著(P <0101),而S 期细胞百分率明显降低,与对照组比较有明显差异(P <0105),两组G 0/G 1期图3 转染干扰质粒后24h PC 23细胞凋亡
及细胞周期流式细胞术检测结果
细胞百分率无显著差异,提示survivin 基因沉默后胰腺癌PC 23
细胞阻滞于G 2/M 期(图4)。
图4 转染干扰质粒后各时点PC 23细胞周期流式细胞术检测结果
3 讨 论
survivin 是用EPR 21的c DNA 在人类基因组文库中杂交、筛
选出的凋亡抑制蛋白(I A P )家族新成员〔1,6〕
。survivin 蛋白半衰
期为30m in,其表达具有明显的周期依赖性。在G 0/G 1期检测不到survivin 蛋白表达,S 期表达量升高,G 2/M 期可升高40倍〔7〕。survivin 表达也具有明显的组织选择性,生理状态下,在正常成熟组织中检测不到survivin 表达,但其显著高表达于
14~21周龄的胚胎组织中,因此推测survivin 可能与组织器官
的发育、成熟密切相关〔8〕。有研究证实,胸腺中survivin 蛋白的高表达对于T 细胞的分化、成熟有着重要意义。由于survivin 蛋白在诸多肿瘤组织中(如肝癌、乳腺癌、白血病等)高表达,因此有人将survivin 蛋白称作是肿瘤的通用抗原。由于survivin 具有抑制凋亡、调控细胞周期、影响有丝分裂过程、促进血管生成等生物学作用,其高表达必然会对肿瘤细胞的生长与增殖产生影响———肿瘤细胞凋亡耐受、肿瘤血管的生成及向周围组织浸润能力的增强,并且随着survivin 蛋白表达的增加,肿瘤细胞也表现一定的辐射耐受性及化学药物耐受性〔9,10〕。因此,sur 2
vivin 成为具有潜在价值的胰腺癌治疗的新靶点,沉默该基因可
能对胰腺癌细胞生物学行为产生重要影响。
本研究M TT 结果显示,survivin 基因沉默后肿瘤细胞生长速度显著低于对照组细胞,说明survivin 基因抑制直接导致了肿瘤增殖的抑制;流式细胞术结果显示,G 2/M 期细胞百分率显著高于对照组,S 期细胞百分率显著低于对照组,说明survivin 基因的沉默导致了细胞周期的阻滞,也进一步提示survivin 可能参与胰腺癌细胞的周期调控;流式细胞术结果显示,G 1期前有凋亡峰存在,且凋亡细胞百分数显著高于对照组,说明sur 2
vivin 基因沉默促进了胰腺癌细胞的凋亡,同时也提示survivin
可能与胰腺癌细胞的凋亡密切相关。
4 参考文献
1 Lopes RB,Ganges waran R,McNeish I A ,et al 1Exp ressi on of the I A P p r o 2
tein fa m ily is dysregulated in pancreatic cancer cells and is i m portant for resistance t o che motherapy 〔J 〕1I nt J Cancer,2007;120(11):234425212 Jhala N,Jhala D,V ickers S M ,et al 1B i omarkers in diagnosis of pancreatic
?
512?田维军等 RNA i 沉默survivin 基因对胰腺癌细胞增殖、凋亡和周期的影响 第2期
carcinoma in fine 2needle as p irates 〔J 〕1Am J Clin Pathol,2006;126(4):572291
3 Guan HT,Xue XH,W ang XJ,et al 1Knockdown of survivin exp ressi on by
s mall interfering RNA supp resses p r oliferati on of t w o human cancer cell lines 〔J 〕1Chin Med Sci J,2006;21(2):115291
4 Zhu K,Q in H,Cha SC,et al 1Survivin DNA vaccine generated s pecific
antitumor effects in pancreatic carcinoma and ly mphoma mouse models
〔J 〕1Vaccine,2007;25(46):79552611
5 W atanabe T,Tot oki Y,Toyoda A,et al 1Endogenous si RNA s fr om natural 2
ly for med ds RNA s regulate transcri p ts in mouse oocytes 〔J 〕1Nature,2008;453(7194):5392431
6 Mari oni G,Dalessandr o E,Bert olin A,et al 1Survivin multifaceted activity
in head and neck carcinoma:current evidence and future therapeutic challenges 〔J 〕1Acta O t olaryngol,2009;25:1261
7 L i F,Ambr osini G,Chu EY,et al 1Contr ol of apop t osis and m it otic s p indle
checkpoint by survivin 〔J 〕1Nature,1998;396(6711):580241
8 Zamparese R,Pannone G,Sant or o A,et al 1Survivin exp ressi on in renal
cell carcinoma 〔J 〕1Cancer I nvest,2008;26(9):9292351
9 Gi m enez 2Bonafe P,Tort osa A ,Perez 2Tomas R 1Overcom ing drug resist 2
ance by enhancing apop t osis of tumor cells 〔J 〕1Curr Cancer D rug Tar 2gets,2009;9(3):3202401
10 Bhanot U ,Heydrich R,M ller P,et al 1Survivin exp ressi on in pancreatic
intraep ithelial neop lasia (Pan I N ):steady increase al ong the devel op 2mental stages of pancreatic ductal adenocarcinoma 〔J 〕1Am J Surg Pathol,2006;30(6):754291
〔2009203205收稿 2009205230修回〕
(编辑 牛铁兵)
刺五加苷对D 2半乳糖致衰老模型大鼠免疫功能的影响
孟宪军 杨 平 张 丽1
(沈阳农业大学食品学院,辽宁 沈阳 110161)
〔摘 要〕 目的 研究刺五加苷对D 2半乳糖(D 2gal )致衰老模型大鼠免疫功能的影响。方法 以不同浓度刺五加苷作用D 2gal 致衰老模型大鼠后,计算脏器指数,MTT 比色法测定T 淋巴细胞增殖功能,EL I S A 法测定白介素22(I L 22)、白介素26(I L 26)、肿瘤坏死因子α(T NF 2α)浓度。结果 刺五加苷改善D 2gal 致衰老大鼠免疫功能具有浓度依赖性。结论 刺五加苷能改善衰老大鼠免疫功能,延缓免疫衰老。
〔关键词〕 刺五加苷;衰老;白介素22;白介素26;肿瘤坏死因子α
〔中图分类号〕 R967 〔文献标识码〕 A 〔文章编号〕 100529202(2010)022*******
1 沈阳军区总医院北陵分院
第一作者:孟宪军(19602),男,教授,博士生导师,主要从事五加属植物
深加工及其作用机制研究。
免疫功能下降已成为机体衰老的特征表现之一,引起衰老的因素都会导致免疫系统功能下降,从而发生感染、癌症及自身免疫性疾病等,使正常寿命明显缩短。刺五加药性温和,自古就被视为具有抗衰老作用的良药,汉代《神农本草经》已将它列为无毒、久服可以轻身、延年益寿而无害的上品,苷类是五加属植物的有效生物活性成分。虽然现代研究证实,刺五加提取物能调节免疫功能〔1〕
,纠正自由基代谢紊乱,抗动脉硬化
〔2〕
、抗
疲劳
〔3〕
,提高机体对有害剌激的抵抗能力等作用,但未见刺五
加苷(CG )对免疫衰老影响方面的报道。本实验通过建立D 2半乳糖(D 2gal )致衰老大鼠模型,研究CG 延缓衰老的作用,并从免疫学角度探究其延缓衰老的机制。
1 材料与方法
111 材料 CG 由湖南九汇现代中药有限公司生产,D 2gal 由Sig ma 公司生产,噻唑蓝(MTT )和二甲基亚砜(DMS O )由上海
生工生物工程有限公司生产,白介素22(I L 22)、I L 26、肿瘤坏死因子2
α(T NF 2α)检测试剂盒购于北京晶美生物技术有限公司,其他试剂为国产分析纯。
112 仪器 DS 2671型天平(上海寺冈电子有限公司);紫外分
光光度仪:Beck man640型;高速式离心机(上海医学仪器厂TG L 2
16G 型);恒温水浴箱(上海天平仪器厂H WC 252型);电子天平(上海第二天平仪器厂MA 型);X W 290型振荡混合器(上海医科
大学仪器厂);酶联测定仪(美国B i otec 公司E LX 2800型)。
113 方法
11311 衰老造模的建立 采用清洁级S D 大鼠40只(实验中
死亡1只)体重为200~300g,鼠龄3~4个月,雌雄各半,饮用清洁水,标准饲料喂养,腹腔注射D 2gal 生理盐水
100mg ?kg -1
?d
-1
,连续给药56d 。开始注射2w 后,将大鼠
随机分为5组,除中浓度组7只外,各组8只,每日按照
10m l/kg 灌胃。①对照组:注射生理盐水,生理盐水灌胃;②模
型组:注射D 2gal,生理盐水灌胃;③低浓度组:注射D 2gal,316g ?kg -1?d -1CG 灌胃;④中浓度组:注射D 2gal,712g ?kg -1?
d -1
CG 灌胃;⑤高浓度组:注射D 2gal,1414g ?kg
-1
?d -1CG 灌
胃。末次灌胃给药后24h,处死动物,测定各项指标。
11312 脏器指数的计算 脏器指数(g/100g )=脏器重量(g )×100/大鼠体重(g )。
11313 T 淋巴细胞增殖功能的测定 采用M TT 比色法测定。
11314 血清I L 22、I L 26、T NF 2α浓度的测定 采用E L I S A 法。
114 统计学处理 采用SPSS1310统计软件,数据以±s 表
示,进行单因素方差分析。
2 结 果
211 CG 对衰老大鼠脏器指数的影响 与对照组相比,模型组
?
612?中国老年学杂志2010年1月第30卷
细胞周期和细胞凋亡类基因 G0 G1 转变(G0 to G1 transition) 1: mdm4 G1/S 特异转录,有丝分裂细胞周 期(G1/S-specific transcription in mitotic cell cycl e) 1: gfi1 G1/S 转变, 有丝分裂细胞周 期(G1/S transition of mitotic cell cycle) 19: bca t1 ccnd1 ccne1 cdc34 cdc7 cdca5 cdk4 cdkn3 cul1 c ul2 cul3 cul4a cul5 gspt1 lats2 pml ppp6c rcc1 sk p2 G1/S 转变检控 点(G1/S transition checkpoint) 4: dlg1 hus1 nbn p ura G1 期(G1 phase) 2: cdc42 rb1 G1 期, 有丝分裂细胞周 期(G1 phase of mitotic cell cycle) 10: anapc2 cd c23 cdk6 cdkn1c dnaja2 e2f1 map3k11 taf1 taf1l tbr g4
G1 特异转录,有丝分裂细胞周 期(G1-specific transcription in mitotic cell cycle) 1: gfi1b G2/M转变, 有丝分裂细胞周 期(G2/M transition of mitotic cell cycle) 10: ana pc10 anapc4 anapc5 birc5 ccnb1 cdk2 dnm2 khdrbs1 l ats1 tpd52l1 G2/M转变DNA 损伤检控 点(G2/M transition DNA damage check-point) 1: brsk 1 G2 期, 有丝分裂细胞周 期(G2 phase of mitotic cell cycle) 4: cenpf ches 1 gtse1 kpna2 M期(M phase) 2: ilf3 rb1 M期, 有丝分裂细胞周 期(M phase of mitotic cell cycle) 4: cdc25b dlg7 mphosph6 mphosph9 M期特异微管过 程(M phase specific microtubule process) 1: kpna2
实验14 细胞凋亡的诱导和检测 20世纪60年代人们注意到细胞存在着两种不同形式的死亡方式:凋亡(apoptosis)和坏死(necrosis)。细胞坏死指病理情况下细胞的意外死亡,坏死过程细胞膜通透性增高,细胞肿胀,核碎裂,继而溶酶体、细胞膜破坏,细胞容物溢出,细胞坏死常引起炎症反应。 细胞凋亡apoptosis一词来源于古希腊语,意思是花瓣或树叶凋落,意味着生命走到了尽头,细胞到了一定时期会像树叶那样自然死亡。凋亡是细胞在一定生理或病理条件下遵守自身程序的主动死亡过程。凋亡时细胞皱缩,表面微绒毛消失,染色质凝集并呈新月形或块状靠近核膜边缘,继而核裂解,由细胞膜包裹着核碎片或其他细胞器形成小球状凋亡小体凸出于细胞表面,最后凋亡小体脱落被吞噬细胞或邻周细胞吞噬。凋亡过程中溶酶体及细胞膜保持完整,不引起炎症反应。细胞凋亡时的生化变化特征是核酸切酶被激活,染色体DNA被降解,断裂为50~300 kb长的DNA片段,再进一步断裂成180~200bp整倍数的寡核苷酸片断,在琼脂糖凝胶电泳上呈现“梯状”电泳图谱(DNA Ladder)。细胞凋亡在个体正常发育、紫稳态维持、免疫耐受形成、肿瘤监控和抵御各种外界因素干扰等方面都起着关键性的作用。 1.细胞凋亡的检测方法 凋亡细胞具有一些列不同于坏死细胞的形态特征和生化特征,据此可以鉴别细胞的死亡形式。细胞凋亡的机制十分复杂,一般采用多种方法综合加以判断,同时不同类型细胞的凋亡分析方法有所不同,方法选择依赖于具体的研究体系和研究目的(表?)。
形态学观察方法:利用各种染色法可观察到凋亡细胞的各种形态学特征: (1)DAPI时常用的一种与DNA结合的荧光染料。借助于DAPI染色,可以观察细胞核的形态变化。 (2)Giemsa染色法可以观察到染色质固缩、趋边、凋亡小体形成等形态。 (3)吖啶橙(AO)染色,荧光显微镜观察,活细胞核呈黄绿色荧光,胞质呈红色荧光。凋亡细胞核染色质呈黄绿色浓聚在核膜侧,可见细胞膜呈泡状膨出及凋亡小体。 (4)吖啶橙(A())/溴化乙啶(EB)复染可以更可靠地确定凋亡细胞的变化,AO只进入活细胞,正常细胞及处于凋亡早期的细胞核呈现绿色;EB只进入死细胞,将死细胞及凋亡晚期的细胞的核染成橙红色。 (5)台盼蓝染色对反映细胞膜的完整性,区别坏死细胞有一定的帮助,如果细胞膜不完整、破裂,台盼蓝染料进入细胞,细胞变蓝,即为坏死。如果细胞膜完整,细胞不为台盼蓝染色,则为正常细胞或凋亡细胞。使用透射电镜观察,可见凋亡细胞表面微绒毛消失,核染色质固缩、边集,常呈新月形,核膜皱褶,胞质紧实,细胞器集中,胞膜起泡或出“芽”及凋亡小体和凋亡小体被临近巨噬细胞吞噬现象。 (6)木精-伊红(HE)染色是经典的显示细胞核、细胞质的染色方法,染色结果清晰。发生凋亡的细胞经HE染色后,其细胞大小的变化及特征性细胞核的变化:染色质凝集、呈新月形或块状靠近核膜边缘,晚期核裂解、细胞膜包裹着核碎片“出芽”凸出于细胞表面形成凋亡小体等均可明显显示出来。 DNA凝胶电泳:细胞发生凋亡或坏死,其细胞DNA均发生断裂,细胞小分子 质量DNA片段增加,高分子DNA减少,胞质出现DNA片段。但凋亡细胞DNA断裂点均有规律的发生在核小体之间,出现180~200 bp DNA片段,而坏死细胞的DNA断裂点为无特征的杂乱片段,利用此特征可以确定群体细胞的死亡,并可与坏死细胞区别。
细胞凋亡与衰老 (作者:___________单位: ___________邮编: ___________) 【关键词】细胞凋亡;衰老 衰老是指增龄过程中机体出现的多器官渐进性功能减退,其确切机制并不清楚,有多种学说,如自由基学说、端粒学说和细胞凋亡学说等。以啮齿类动物为研究对象,肌肉、脑、心脏等多种衰老组织中均存在细胞凋亡异常〔1〕。细胞凋亡参与多种与衰老相关的病理过程,如骨质疏松、阿尔茨海默病等。目前细胞凋亡在衰老中的作用成为国内外研究热点,本文就二者的最新研究进展作综述。 1 细胞凋亡 细胞凋亡涉及一系列基因的激活、表达及调控,是机体为更好地适应环境采取的主动死亡,其参与许多重要生命活动,如胚胎发育、免疫防御和维持组织稳态等,对维持细胞增殖与死亡的平衡有重要意义。 1.1 细胞凋亡途径 1.1.1 外源性途径又称死亡受体途径,是由膜受体介导的细胞死亡过程。死亡受体是属于肿瘤坏死因子受体超家族的跨膜受体,其中研究较透彻的是Fas/FasL系统。Fas广泛分布于胸腺、肝、心、肾等
组织细胞表面。当Fas与其配体FasL结合后发生多聚化,与胞浆内死亡结构域结合蛋白(FADD)结合,活化胞浆caspase8,再活化凋亡执行者caspase3,水解蛋白质,启动核酸内切酶剪切DNA,造成凋亡。这是发育过程和免疫系统中最主要的凋亡途径。通过该途径可清除发育过程及免疫反应中活化的淋巴细胞。增龄过程中Fas表达呈上升趋势。衰老大鼠胸腺细胞和脾细胞凋亡速度加快,可能造成衰老机体免疫功能下降。 1.1.2 内源性途径以线粒体为核心,又称线粒体途径。该途径凋亡信号来自体内各种应激,如DNA损伤、氧化应激、紫外线、生长因子缺乏等。凋亡信号引起前凋亡蛋白Bax活化,Bax诱导线粒体释放细胞色素c(Cyt c)。进入胞质的Cyt c与凋亡蛋白激活因子(Apaf1)、caspase9前体组成凋亡体,激活caspase9,再活化caspase3引起细胞凋亡。线粒体也可释放凋亡诱导因子(AIF)和内切核酸酶G进入胞浆,二者转移到细胞核,断裂DNA。随着年龄增长,内源性凋亡途径逐渐变得活跃。 1.1.3 内质网应激介导的细胞凋亡内质网(ER)参与蛋白质合成及翻译后加工修饰。当非折叠或错折叠蛋白质在ER内堆积超过处理能力时,引起ER应激。ER应激的一个后果是细胞凋亡。位于ER膜上的Bak、Bax发生构象变化形成多聚体,使Ca2+进入ER,活化caspase12,引起下游级联反应,活化caspase9和caspase3。机体具有应对ER应激的保护措施,如使翻译起始因子eIF2去磷酸化,减少蛋白质合成。但衰老机体应对ER应激能力降低,eIF2磷
细胞凋亡的检测 细胞凋亡与坏死是两种完全不同的细胞凋亡形式,根据死亡细胞在形态学、生物化学和分子生物学上的差别,可以将二者区别开来。细胞凋亡的检测方法有很多,下面介绍几种常用的测定方法。 一、细胞凋亡的形态学检测 根据凋亡细胞固有的形态特征,人们已经设计了许多不同的细胞凋亡形态学检测方法。 1 光学显微镜和倒置显微镜 (1)未染色细胞:凋亡细胞的体积变小、变形,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体。 贴壁细胞出现皱缩、变圆、脱落。 (2)染色细胞:常用姬姆萨染色、瑞氏染色等。凋亡细胞的染色质浓缩、边缘化,核膜裂解、染色质分割 成块状和凋亡小体等典型的凋亡形态。 2 荧光显微镜和共聚焦激光扫描显微镜 一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。 常用的DNA特异性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258), DAPI。三种染料与DNA的结合是非嵌入式的,主要结合在DNA的A-T碱基区。紫外光激发时发射明亮的蓝色荧光。 Hoechst是与DNA特异结合的活性染料,储存液用蒸馏水配成1mg/ml的浓度,使用时用PBS稀释成终浓度为2~5mg/ml。 DAPI为半通透性,用于常规固定细胞的染色。储存液用蒸馏水配成1mg/ml的浓度,使用终浓度一般为0.5 ~1mg/ml。 结果评判:细胞凋亡过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;Ⅱb期的细胞核裂解为碎块,产生凋亡小体(图1)。
第六章细胞的生命历程 第3节细胞的衰老和凋亡教学设计 一、教材分析 细胞像生物体一样也要经历出生、生长、成熟、繁殖、衰老、死亡的过程,所以细胞的分裂、分化、衰老、死亡是生命的必然。那么个体衰老与细胞衰老的关系呢?细胞衰老有哪些表现呢?细胞衰老的原因是什么?细胞的衰老和凋亡是生命活动中必不可少的过程,衰老和凋亡有什么关系?这一连串的问题构成本节内容的主线。对于细胞衰老和凋亡的学习,能使学生对细胞的整个生命过程有个完整的认识。同时细胞衰亡机制的研究与生物科技的发展息息相关。对细胞衰 亡知识的学习,有助于培养学生的科学兴趣,培养学生的创新意识。 二、教学目标 1.知识与技能 (1)个体衰老与细胞衰老的关系。 (2)描述细胞的衰老的特征和原因。 (3)简述细胞凋亡的含义及与细胞坏死的区别。 2.过程与方法 (1)培养学生联系实际灵活应用知识的能力。 (2)学会进行与社会老龄化相关问题的分析。 3?情感态度与价值观 (1)探讨细胞的衰老和凋亡与人体健康的关系,关注老年人健康状况和生活状况
(2)通过有关衰老问题的讨论,树立科学的发展观。 三、教学重点难点 学习重点:1?细胞衰老的概念及特征。2?细胞凋亡的含义。 学习难点:细胞衰老与细胞凋亡的区别和联系。 四、学情分析 学生已经学习了细胞的增殖、分化的内容,对本节的内容已经有了初步的认识和理解,明确了细胞的分化、衰老和凋亡是一个自然的生命过程。本节的内容接近现实生活,可利用现实生活中的例子加以说明,培养学生知识的应用能力和知识的迁移能力。 五、课型:新授课教学方法:教学基本环节:情境导入、展示目标→合作探究、精讲点拨→反思总结、当堂检测→布置作业及预习 六、课前准备布置学生在课前预习细胞衰老与凋亡内容。教师制作课件。 七、课时安排:1课时 八、教学过程 【情景导入、展示目标】 教师展示刘德华的电影一一童梦奇缘的剧照:谁曾经没有幻想过一夜长大?谁又在垂暮之年没有产生过如果生命可以重来的念头?但是如果真的有那么一种方式,可以让你体验一下一夜长大的感觉,你会为此付出青春的代价嘛? 问题1:人的一生必然要经历哪些生命历程:出生→生长→成熟→繁殖→→的生命历程。(学生思考回答)
细胞凋亡的几种检测方法 1、形态学观察方法 (1)HE(苏木精—伊红染色法)染色、光镜观察:凋亡细胞呈圆形,胞核深染,胞质浓缩,染色质成团块状,细胞表面有“出芽”现象。 (2)丫啶橙(AO)染色,荧光显微镜观察:活细胞核呈黄绿色荧光,胞质呈红色荧光。凋亡细胞核染色质呈黄绿色浓聚在核膜内侧,可见细胞膜呈泡状膨出及凋亡小体。 (3)台盼蓝染色:如果细胞膜不完整、破裂,台盼蓝染料进入细胞,细胞变蓝,即为坏死。如果细胞膜完整,细胞不为台盼蓝染色,则为正常细胞或凋亡细胞。此方法对反映细胞膜的完整性,区别坏死细胞有一定的帮助。 (4)透射电镜观察:可见凋亡细胞表面微绒毛消失,核染色质固缩、边集,常呈新月形,核膜皱褶,胞质紧实,细胞器集中,胞膜起泡或出“芽”及凋亡小体和凋亡小体被临近巨噬细胞吞噬现象。 2、DNA凝胶电泳 细胞发生凋亡或坏死,其细胞DNA均发生断裂,细胞内小分子量DNA片断增加,高分子DNA减少,胞质内出现DNA片断。但凋亡细胞DNA断裂点均有规律的发
生在核小体之间,出现180-200bpDNA片断,而坏死细胞的DNA断裂点为无特征的杂乱片断,利用此特征可以确定群体细胞的死亡,并可与坏死细胞区别。正常活细胞DNA 电泳出现阶梯状(LADDER)条带;坏死细胞DNA电泳类似血抹片时的连续性条带 3、酶联免疫吸附法(ELISA)核小体测定 凋亡细胞的DNA断裂使细胞质内出现核小体。核小体由组蛋白及其伴随的DNA片断组成,可由ELISA法检测。 检测步骤 1、将凋亡细胞裂解后高速离心,其上清液中含有核小体; 2、在微定量板上吸附组蛋白体’ 3、加上清夜使抗组蛋白抗体与核小体上的组蛋白结合‘ 4、加辣过氧化物酶标记的抗DNA抗体使之与核小体上的DNA结合’ 4、加酶的底物,测光吸收制。 用途 该法敏感性高,可检测5*100/ml个凋亡细胞。可用于人、大鼠、小鼠的凋亡检测。该法不需要特殊仪器,
细胞周期与细胞凋亡检测试剂盒(PI法) 产品简介: Leagene细胞周期与细胞凋亡检测试剂盒(Cell Cycle and Apoptosis Analysis Kit)是一种采用经典的碘化丙啶染色(PI staining)方法进行细胞周期与细胞凋亡分析的检测试剂盒。碘化丙啶(Propidium Iodide, PI)是一种可以嵌合到双链DNA和RNA的碱基对中与直接和的荧光染料,无碱基特异性。碘化丙啶与双链DNA结合后可以产生荧光,并且荧光强度和双链DNA的含量成正比。细胞内的DNA被Propidium Iodide染色后,可以用流式细胞仪对细胞进行DNA含量测定,然后根据DNA含量的分布情况,可以进行细胞周期和细胞凋亡分析。 碘化丙啶染色后,假设G0/G1期细胞的荧光强度为1,那么含有双份基因组DNA的G2/M期细胞的荧光强度的理论值为2,正在进行DNA复制的S期细胞的荧光强度为1-2之间。凋亡细胞由于细胞核发生浓缩以及发生DNA片段化(DNA fragmentation)导致部分基因组DNA片断在染色过程中丢失,因此凋亡细胞碘化丙啶染色后呈现明显的弱染,即荧光强度小于1,在流式检测的荧光图上出现所谓的sub-G1峰,即凋亡细胞峰。 细胞凋亡时,流式细胞检测可呈现亚二倍体核型的特征,根据光散射的特点,PI染色可以区分细胞凋亡和细胞坏死的细胞峰型。细胞凋亡时,出现凋亡细胞皱缩、染色质浓缩、核碎裂,产生凋亡小体,使细胞的前向光散射低于正常。在细胞凋亡的早期,细胞对前向角光散射的能力显著降低,对侧向光散射的能力增加或没有变化。在细胞凋亡的晚期,前向和侧向光散射的信号均降低。细胞坏死时细胞多表现为细胞肿胀,因此前向光散射高于正常,对侧向光散射高于正常。 Leagene Cell Cycle and Apoptosis Analysis Kit经常用于培养的贴壁或悬浮细胞的细胞周期与细胞凋亡检测,亦可用于区分细胞凋亡和细胞坏死。该试剂盒检测细胞含量范围一般为0.1~1×106之间。 主要成分:
(完整)常见细胞凋亡检测的方法与注意事项 编辑整理: 尊敬的读者朋友们: 这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)常见细胞凋亡检测的方法与注意事项)的内容能够给您的工作和学习带来便利。同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。 本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)常见细胞凋亡检测的方法与注意事项的全部内容。
常见细胞凋亡检测的方法与注意事项 大家常把细胞凋亡和细胞坏死混淆,其实两者是不同的细胞死亡形式,大家可以在死亡细胞的形态、生化和分子指标上将二者区分开来,细胞凋亡检测的方法不少,这里就总结下几种常用的检测方法. 细胞凋亡检测更多详情,点击查看不可不知的细胞检测方法——MTT 一、细胞凋亡的形态学检测 根据凋亡细胞固有的形态特征,人们已经设计了许多不同的细胞凋亡形态学检测方法。 1 光学显微镜和倒置显微镜 (1) 未染色细胞:凋亡细胞的体积变小、变形,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体。 贴壁细胞出现皱缩、变圆、脱落. (2)染色细胞:常用姬姆萨染色、瑞氏染色等.凋亡细胞的染色质浓缩、边缘化,核膜裂解、染色质分割 成块状和凋亡小体等典型的凋亡形态。 2 荧光显微镜和共聚焦激光扫描显微镜 一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。 常用的DNA特异性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258), DAPI。三种染料与DNA的结合是非嵌入式的,主要结合在DNA的A-T碱基区。紫外光激发时发射明亮的蓝色荧光。 Hoechst是与DNA特异结合的活性染料,储存液用蒸馏水配成1mg/ml的浓度,使用时用PBS稀释成终浓度为2~5mg/ml。 DAPI为半通透性,用于常规固定细胞的染色。储存液用蒸馏水配成1mg/ml的浓度,使用终浓度一般为0.5 ~1mg/ml。 结果评判:细胞凋亡过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;Ⅱb期的细胞核裂解为碎块,产生凋亡小体(图1)。 3 透射电子显微镜观察 结果评判:凋亡细胞体积变小,细胞质浓缩。凋亡Ⅰ期(pro—apoptosis nuclei)的细胞核内染色质高度盘绕,出现许多称为气穴现象(cavitations)的空泡结构(图2);Ⅱa期细胞核的染色质高度凝聚、边缘化;细胞凋亡的晚期,细胞核裂解为碎块,产生凋亡小体。 图2
细胞凋亡检测,细胞凋亡实验步骤,检测方法 一、定性和定量研究 只定性的研究方法:常规琼脂糖凝胶电泳、脉冲场倒转琼脂糖凝胶电泳、形态学观察(普通光学显微镜、透射电镜、荧光显微镜) 进行定量或半定量的研究方法:各种流式细胞仪方法、原位末端标记法、ELISA 定量琼脂糖凝胶电泳。 二、区分凋亡和坏死 可将二者区分开的方法:琼脂糖凝胶电泳,形态学观察(透射电镜是是区分凋亡和坏死最可靠的方法),Hoechst33342/PI双染色法流式细胞仪检测,AnnexinV/PI双染色法流式细胞仪检测等。 不能将二者区分开的方法:原位末端标记法、PI单染色法流式细胞仪检测等。 三、样品来源不同选择 组织:主要用形态学方法(HE染色,透射电镜、石蜡包埋组织切片进行原位末端标记,ELISA或将组织碾碎消化做琼脂糖凝胶电泳)。 四、细胞凋亡检测 1、早期检测: 1) PS(磷脂酰丝氨酸)在细胞外膜上的检测 2)细胞内氧化还原状态改变的检测 3)细胞色素C的定位检测 4) 线粒体膜电位变化的检测 2、晚期检测: 细胞凋亡晚期中,核酸内切酶在核小体之间剪切核DNA,产生大量长度在 180-200 bp 的DNA片段。 对于晚期检测通常有以下方法: 1) TUNEL(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记) 2) LM-PCR Ladder (连接介导的PCR检测) 3) T elemerase Detection (端粒酶检测) 3、生化检测: 1)典型的生化特征:DNA 片段化 2)检测方法主要有:琼脂糖凝胶电泳、原位末端标记(TUNEL)等 3)TUNEL(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记) 4)通过DNA末端转移酶将带标记的dNTP (多为dUTP)间接或直接接到DNA 片段的3’-OH端,再通过酶联显色或荧光检测定量分析结果。可做细胞悬液、福尔马林固定或石蜡处理的组织、细胞培养物等多种样本的检测。 4、LM-PCR Ladder (连接介导的PCR检测) 当凋亡细胞比例较小以及检测样品量很少(如活体组织切片)时,直接琼脂糖电泳可能观察不到核DNA的变化。通过LM-PCR,连上特异性接头,专一性地扩增梯度片段,从而灵敏地检测凋亡时产生梯度片段。此外,LM-PCR 检测是半定量的,因此相同凋亡程度的不同样品可进行比较。如果细胞量很少,还可在分离提纯DNA后,用32P-ATP和脱氧核糖核苷酸末端转移酶(TdT)使DNA标记,
细胞凋亡与坏死是两种完全不同的细胞凋亡形式,根据死亡细胞在形态学、生物化学和分子生物学上的差别,可以将二者区别开来。细胞凋亡的检测方法有很多,下面介绍几种常用的测定方法。 一、细胞凋亡的形态学检测 根据凋亡细胞固有的形态特征,人们已经设计了许多不同的细胞凋亡形态学检测方法。 1 光学显微镜和倒置显微镜 (1)未染色细胞:凋亡细胞的体积变小、变形,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体。 贴壁细胞出现皱缩、变圆、脱落。 (2)染色细胞:常用姬姆萨染色、瑞氏染色等。凋亡细胞的染色质浓缩、边缘化,核膜裂解、染色质分割 成块状和凋亡小体等典型的凋亡形态。 2 荧光显微镜和共聚焦激光扫描显微镜 一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。 常用的DNA特异性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258), DAPI。三种染料与DNA的结合是非嵌入式的,主要结合在DNA的A-T碱基区。紫外光激发时发射明亮的蓝色荧光。 Hoechst是与DNA特异结合的活性染料,储存液用蒸馏水配成1mg/ml的浓度,使用时用PBS稀释成终浓度为2~5mg/ml。 DAPI为半通透性,用于常规固定细胞的染色。储存液用蒸馏水配成1mg/ml的浓度,使用终浓度一般为0.5 ~1mg/ml。 结果评判:细胞凋亡过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;Ⅱb期的细胞核裂解为碎块,产生凋亡小体(图1)。 3 透射电子显微镜观察 结果评判:凋亡细胞体积变小,细胞质浓缩。凋亡Ⅰ期(pro-apoptosis nuclei)的细胞核内染色质高度盘绕,出现许多称为气穴现象(cavitations)的空泡结构(图2);Ⅱa期细胞核的染色质高度凝聚、边缘化;细胞凋亡的晚期,细胞核裂解为碎块,产生凋亡小体 二、磷脂酰丝氨酸外翻分析(Annexin V法) 磷脂酰丝氨酸(Phosphatidylserine, PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中(图3)。Annexin-V是一种分子量为35~36KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin-V 进行荧光素(FITC、PE)或biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。 碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。因此将Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。
第六章第3节《细胞的衰老和凋亡》教学计划李艳2011/10/17 16:32:18 宁夏固原市西吉二中30 0 一、教材分析 细胞像生物体一样也要经历出生、生长、成熟、繁殖、衰老、死亡的过程,所以细胞的分裂、分化、衰老、死亡是生命的必然。那么个体衰老与细胞衰老的关系呢?细胞衰老有哪些表现呢?细胞衰老的原因是 什么?细胞的衰老和凋亡是生命活动中必不可少的过程,衰老和凋亡有什么关系?这一连串的问题构成本节内容的主线。对于细胞衰老和凋亡的学习,能使学生对细胞的整个生命过程有个完整的认识。同时细胞衰 亡机制的研究与生物科技的发展息息相关。对细胞衰亡知识的学习,有助于培养学生的科学兴趣,培养学 生的创新意识。 二、教学目标 1.知识与技能 (1)个体衰老与细胞衰老的关系。 (2)描述细胞的衰老的特征和原因。 (3)简述细胞凋亡的含义及与细胞坏死的区别。 2.过程与方法 (1)培养学生联系实际灵活应用知识的能力。 (2)学会进行与社会老龄化相关问题的分析。 3.情感态度与价值观 (1)探讨细胞的衰老和凋亡与人体健康的关系,关注老年人健康状况和生活状况 (2)通过有关衰老问题的讨论,树立科学的发展观。 三、教学重点难点 学习重点:1.细胞衰老的概念及特征。2.细胞凋亡的含义。 学习难点:细胞衰老与细胞凋亡的区别和联系。 四、学情分析 学生已经学习了细胞的增殖、分化的内容,对本节的内容已经有了初步的认识和理解,明确了细胞的分化、衰老和凋亡是一个自然的生命过程。本节的内容接近现实生活,可利用现实生活中的例子加以说明, 培养学生知识的应用能力和知识的迁移能力。 五、课型:新授课教学方法:教学基本环节:情境导入、展示目标→合作探究、精讲点拨→反思总结、 当堂检测→布置作业及预习 六、课前准备 布置学生在课前通过上网、查报纸杂志、看电视等途径收集与细胞衰老与凋亡有关的资料。教师制作课件。 七、课时安排:1课时 八、教学过程 【情景导入、展示目标】 教师展示“问题探讨”老年人晨练图片:随着社会的发展,人民生活水平的提高,医疗的完善等,人的寿命 在延长,老年人的比例上升。那如何能延缓衰老,保持身体健康显得尤其重要。 问题1:人的一生必然要经历哪些生命历程:出生→生长→成熟→繁殖→→的生命历程。(学生思考回答) 对于人的一生来说,出生,衰老,死亡都是非常重要,活细胞也一样。衰老和死亡是细胞不可忽视的部分。今天我们来学习第六章第3节《细胞的衰老和凋亡》的内容。 小组讨论:完成问题2和问题3 (3分钟) 问题2:我们学过的单细胞生物有:(举一例) 单细胞生物的衰老(= 或≠)细胞的衰老。 问题3:人的生命系统结构层次有哪些?
组织中的细胞周期和凋亡检测方法之一--PI法 schoman 无论是肿瘤或其它正常新鲜组织均可用PI(碘化丙啶)的方法来检测,这是一种常见而且便宜的方法。主要操作步骤如下: 1、组织块用0.25%胰酶消化30min-1h。 2、200-400目筛网过滤细胞,获得单细胞悬液。 3、75%乙醇(-20度预冷)固定细胞1h。 4、加入PI(终浓度50ug/ml)和无DNA酶污染的RNA酶(终浓度50ug/ml)1ml染色30min-1h。 5、流式细胞仪检测细胞周期和凋亡。 注意事项: 1、组织消化后使细胞形成单个细胞悬液是本检测方法的关键。如组织难以消化,可加入适量胶原酶。另外,消化前,用剪刀将组织剪成小块也不要忘了。 2、细胞可尽量的多准备(at least 100 thousand),这样流式检测方便,结果可靠。 3、每次消化的时间等条件应尽量一致,否则使实验结果CV值偏大。 4、细胞用乙醇固定后可以访置48小时(4度保存)后检测,便于无法立即检测的实验者,对实验结果基本没有影响。 其它也有一些检测凋亡的方法,均有商品化试剂盒。在此不赘述。yanzishenyang:我看相关的说明:碘化丙啶(propidium iodide,PI)检测早期死亡细胞膜通透性状态的不同是区分细胞凋亡和坏死的一个重要指标,凋亡细胞在进入最终溶解阶段前,胞膜通透性无明显改变,相对分子质量大的与DNA 结合的荧光染料(如PI)不能时入凋亡细胞内,而相对分子质量小的荧光染料(如Hoechest 3342或33258等)仍能被细胞摄取。应用流式细胞仪或荧光显微镜可区分和坏死细胞,细胞内DNA出现Hoechest 3342标记而不出现PI标记的为凋亡细胞。 偶得细胞是用PI染色的,经过流氏细胞仪检测出现一个亚二倍体峰,是否能和坏死区别?因为偶用的作用细胞的蛋白本身可以造成细胞膜的损伤,所以PI可以进入细胞,这是否意味着我检测的结果无法区分凋亡和坏死? hdhdhd0000:用PI法识别凋亡时,有一种方法叫SUB-G1法,这种方法需要在染PI前加入适量的破膜剂(磷酸盐-枸橼酸盐缓冲盐),我们称之为PC液,它会让晚期凋亡所形成的DNA小碎片部分出膜而使胞内的DNA总含量减少,从而使流式上的DNA直方图的G0/G1峰前出现一个亚二倍体峰,也就是SUB-G1峰(凋亡峰)! 用荧光2的面积做直方图可以清楚的看见凋亡峰,但是要区分APo和Nec需要少量的经验,而在荧光2高度图上,因为是用的是对数,所以可以把凋亡和坏死拉开,凋亡峰在不同的细胞周期特异性细胞凋亡时,都特异性的出现在10的2次方荧光道数处,坏死在10的1次方处,从而可以清楚的分清它们。 核染色剂(核染料) yuanaiyu:用流式细胞仪测脑组织细胞悬液中细胞线粒体的膜电位,需先将细胞与细胞碎片区分开来,现考虑用一种亲细胞核的染料将细胞分选出来,已尝试用过PI,但pI分子量大,过分破坏细胞膜而影响了线粒体膜电位。请问有没有一种小分子的核染料,既能进入细胞核又对对细胞膜的影响很小?何处能买到?
流式细胞技术检测细胞周期分布 1) 已转染miRNA mimics的细胞培养达到85%融合时,用胰酶消化细胞。1000 rpm,离心5min,收集细胞沉淀; 2) 已消毒的PBS重悬细胞,1000 rpm/min,离心5 min,收集细胞。重复此步骤2次,以除去胰酶; 3) 加入预冷的70%乙醇固定细胞过夜; 4) 第二天1000rpm,离心5 min,收集细胞沉淀,PBS重悬两次,以除去乙醇; 5) 离心后加入500ul PBS重悬细胞,加入碘化丙锭(PI)染色液(含50mg/L PI,1g/L Triton X-100,100g/L RNase)混匀,4℃避光孵育30min。 6)流式细胞仪FACStar (美国BD公司) 检测。接收的信号经Cellquest软件处理,对检测细胞的荧光强度进行分析。实验重复3次。 2.11流式细胞技术检测细胞凋亡水平 1) 已转染BART6-3p mimics的细胞培养达到85%融合时,将上清培养液收集至离心管内;常常 2)PBS清洗贴壁细胞3次,用胰酶消化细胞(注意:消化时不可过度),收集于第一步的离心管内; 3) 1000 rpm离心5min,弃上清收集细胞,PBS轻轻重悬后,加入195 ulAnnexin V-FITC结合液,吹打混匀,重悬细胞,加入5ul Annexin V,轻轻混匀。避光室温孵育15min; 4) 加入10 ul PI染色液,轻轻混匀,避光孵育; 空白:Annexin V—FITC结合液200ul 双染:185ul结合液+5 ulAnnexin V—FITC+10ul PI 单染:195ul结合液+5ul Annexin V—FITC 190ul结合液+10PI 5) 进行流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。
细胞凋亡的检测方法 一、细胞凋亡概念: 细胞凋亡是指为维持内环境的稳定,有基因控制的细胞自主的程序性死亡。 细胞凋亡不是一件被动的过程,而是主动过程,它涉及一系列基因的激活、表达以及调控等的作用;它并不是病理条件下,自体损伤的一种现象,而是为更好地适应生存环境而主动争取的一种死亡过程。 细胞凋亡与胚胎发育、自身免疫耐受、肿瘤发生、病毒感染等生理、病理过程密切相关,近年来一直是生物医学领域各专业的研究热点。选择合适的凋亡检测方法是研究细胞凋亡研究的关键。 二、细胞凋亡的检测方法: 1. 磷酯酰丝氨酸(PS)外翻法(Annexin V 法) 在凋亡细胞中,磷酯酰丝氨酸 (PS) 从质膜内侧转移到外侧,暴露在细胞外环境中。 荧光基团或荧光蛋白标记的膜联蛋白V 可与暴露在质膜外侧的PS 结合,用于识别凋亡细胞。碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI 能够透过细胞膜而使细胞核红染。因此将Annexin-V 与PI 匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。 应用实例:以FITC Annexin V/ PI Apoptosis Kit 为例子 2. Caspase-3活性的检测: 半胱氨酸蛋白酶caspase 家族蛋白的激活是凋亡进程中的一个必要的决定性事件。其中caspase-3的激活在凋亡信号传导的许多途径中发挥着关键的作用。Caspase-3正常以酶原(32KDa )的形式存在于胞浆中,在凋亡的早期阶段,它被激活,活化的Caspase-3由两个大亚基(17KDa )和两个小亚基(12KDa )组成, 图1. 使用10 μM 喜树碱处理Jurkat 细胞4 小时作为阳性实验组(右图),同时设置未处理组做阴性对照(左图)。使用FITC Annexin V/ PI Apoptosis Kit 对以上两组细胞进行相应的实验处理,流式细胞仪进行观察。
6、3《细胞的衰老和凋亡》教案设计 导入 每个生物个体都要经历出生、生长、成熟、繁殖、衰老直至最后的死亡,生物体内的细胞也是一样,要经过增殖、分化、衰老和凋亡。前面我们已经学习了细胞的增殖和细胞的分化,今天我们就来学习第三节,细胞的衰老和凋亡。 问题一:婴儿体内有没有衰老细胞为什么老人表现出衰老,但是婴儿却没有表现出衰老 答案:有。老人体内的衰老细胞非常多,而婴儿体内很少。 个体衰老与细胞衰老的关系有什么关系呢 对于单细胞生物体来说,因为是整个生物体是由一个细胞构成的,因此细胞的衰老或死亡就是个体的衰老或死亡。但对于多细胞生物体来说,组成生物体的细胞总是在不断更新着,总有一部分细胞处于衰老或走向死亡的状态,也有一些是幼嫩的细胞,但从总体上看,个体衰老的过程也是组成个体的细胞普遍衰老的过程。 一、个体衰老与细胞衰老的关系 1.单细胞生物体 2.多细胞生物体 现在请同学们想一下,在45十以后,我们来参加同学聚会,你的同学会有变化吗大家现在就来想一下我们老了之后会变成什么样 答案:(1)那时候,我们的头发都会变白,这主要是由于人体内酶的活性降低。黑色素是酪氨酸酶催化酪氨酸造成的,酶的活性降低,黑色素合成减少。 (2)那时候,我们脸上可能已经出现了老年斑。这主要是由于色素的积累。 (3)大家有没有发现老年人特别怕冷。在冬天的时候,我们年轻人只穿了2-3 件衣服,但是老年人却要穿4-5件衣服。主要是由于人体的能量主要是由于呼吸 作用提供的,呼吸作用减弱了,人体得到的热能就少了。而人体的呼吸作用主 要是在线粒体内进行的,所以衰老的细胞线粒体的数量也是减少的。 (4)大家有没有注意到老年人的皮肤皱巴巴的,这主要是由于什么原因呢 这主要是由于老年人体内的水分减少的原因。而体内许多化学反应都要在水中 进行,所以水分的减少,必然导致人体的新陈代谢的减慢。 (5)有的老人还会出现“救生圈”,这也主要是由于老年人新陈代谢减慢的引 起的。在吃进相同的食物后,他们消耗能量的能力下降了,自然就化成脂肪堆 积了。 总结:个体衰老是由于细胞的衰老引起的,现在就让我们来总结一下细胞衰老的特点: 二、细胞衰老的特征 (1)水分减少,体积变小,新陈代谢速度减慢。 (2)酶的活性降低。头发会变白,这主要是由于人体内酶的活性降低。黑色素是酪氨酸酶催化酪氨酸造成的,酶的活性降低,黑色素合成减少 (3)细胞的通透性有所改变,使物质的运输功能下降 (4)细胞核体积变大,核膜内折,染色质收缩,染色加深 (5)线粒体内呼吸速率变慢
细胞周期与细胞凋亡检测试剂盒 产品简介: 碧云天生产的细胞周期与细胞凋亡检测试剂盒(Cell Cycle and Apoptosis Analysis Kit)是一种采用经典的碘化丙啶染色(Propidium staining,即PI staining)方法进行细胞周期与细胞凋亡分析的检测试剂盒。 碘化丙啶(Propidium,简称PI)是一种双链DNA的荧光染料。碘化丙啶和双链DNA结合后可以产生荧光,并且荧光强度和双链DNA的含量成正比。细胞内的DNA被碘化丙啶染色后,可以用流式细胞仪对细胞进行DNA含量测定,然后根据DNA含量的分布情况,可以进行细胞周期和细胞凋亡分析。 碘化丙啶染色后,假设G0/G1期细胞的荧光强度为1,那么含有双份基因组DNA的G2/M期细胞的荧光强度的理论值为2,正在进行DNA复制的S期细胞的荧光强度为1-2之间。凋亡细胞由于细胞核发生浓缩以及发生DNA片段化(DNA fragmentation)导致部分基因组DNA片断在染色过程中丢失,因此凋亡细胞碘化丙啶染色后呈现明显的弱染,即荧光强度小于1,在流式检测的荧光图上出现所谓的sub-G1峰,即凋亡细胞峰。 细胞发生凋亡时,由于胞浆和染色质浓缩、核碎裂,产生凋亡小体,使细胞的光散射性质发生变化。在细胞凋亡的早期,细胞对前向角光散射的能力显著降低,对侧向光散射的能力增加或没有变化。在细胞凋亡的晚期,前向和侧向光散射的信号均降低。因此可通过流式细胞仪测定细胞光散射的变化观察细胞凋亡情况。 本试剂盒通常应用于培养的贴壁或悬浮细胞的细胞周期与细胞凋亡检测。如果用于组织的细胞周期与细胞凋亡检测,则必须把组织消化成单细胞状态,才可以进行检测。 本试剂盒足够检测50个样品,每个样品的细胞数量可以为10-100万。 保存条件: -20oC保存,一年有效。C1052-2碘化丙啶染色液(20X)需避光保存。本试剂盒可4oC保存,一个月内有效。 注意事项: 本试剂盒需使用流式细胞仪进行检测。 需自备PBS和70%乙醇,PBS (C0221A)可以向碧云天订购。 荧光染料均存在淬灭问题,保存和使用过程中请尽量注意避光,以减缓荧光淬灭。 碘化丙啶对人体有刺激性,请注意适当防护。 本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。 为了您的安全和健康,请穿实验服并戴一次性手套操作。 使用说明: 1.细胞样品的准备: a.对于贴壁细胞:小心收集细胞培养液到一离心管内备用。用胰酶消化细胞,至细胞可以被轻轻用移液管或枪头吹打下来 时,加入前面收集的细胞培养液,吹打下所有的贴壁细胞,并轻轻吹散细胞。再次收集到离心管内。1000g左右离心3-5分钟,沉淀细胞。对于特定的细胞,如果细胞沉淀不充分,可以适当延长离心时间或稍稍加大离心力。小心吸除上清,可以残留约50微升左右的培养液,以避免吸走细胞。加入约1毫升冰浴预冷的PBS,重悬细胞,并转移到1.5毫升离心管内。再次离心沉淀细胞,小心吸除上清,可以残留约50微升左右的PBS,以避免吸走细胞。轻轻弹击离心管底以适当分散细胞,避免细胞成团。 b.对于悬浮细胞:1000g左右离心3-5分钟,沉淀细胞。对于特定的细胞,如果细胞沉淀不充分,可以适当延长离心时间或 稍稍加大离心力。小心吸除上清,可以残留约50微升左右的培养液,以避免吸走细胞。加入约1毫升冰浴预冷的PBS,重悬细胞,并转移到1.5毫升离心管内。再次离心沉淀细胞,小心吸除上清,可以残留约50微升左右的PBS,以避免吸走细胞。轻轻弹击离心管底以适当分散细胞,避免细胞成团。
1.细胞周期 a.取生长状态良好的细胞,用0.25%胰酶消化为单个细胞,用正常培养基重悬计数, 接种于60mm的皿,每个皿大约接种细胞1X10^6个。37°C 5% CO2培养1-2天。 b.当细胞融合度大约80%,细胞处于对数增长期时,用0.25%胰酶消化为单个细胞, 1100转离心3分钟。 c.去掉上清,DPBS洗1次,每次6mL,1100转离心3分钟。 d.去掉上清,0.5mL冰冷的DPBS重悬成单个细胞后,逐滴加入70%冰乙醇6mL,边加 边晃动,4度冰箱过夜(乙醇固定作用比较慢,最好多放几天,最好一周内继续做下面的步骤)。 e.1800转离心5分钟,弃上清,用6mL DPBS清洗两次,1800转离心5分钟。 f.用0.5mL PBS重悬(如果细胞过多,可用更多PBS重悬,然后取0.5mL),加入2uL Rnase (100mg/mL),终浓度为(400mg/mL),室温作用30分钟。 g.加入10uL PI,避光孵育15分钟,可上流式细胞仪检测。 2.Annexin V- FITC/PI测细胞凋亡。 a.取生长状态良好的细胞,用0.25%胰酶消化为单个细胞,用正常培养基重悬计数, 接种于6孔板,每个孔大约接种细胞5X10^5个。37°C 5% CO2培养1-2天。 b.当融合度大约80%,细胞处于对数增长期时,用0.25%胰酶消化为单个细胞,每个 孔用一个15ml离心管单独收集,1000转离心3分钟。 c.用2ml DPBS重悬细胞,1000转离心3分钟。 d.用2ml 1 X Banding Buffer重悬细胞,并且计数,1000转离心3分钟。 e.用1 X Banding Buffer重悬细胞,使细胞密度为1X10^6个/ml。取100ul到一个新的 流式管中。 f.选取正常的细胞三管为补偿管,①双阴性-正常细胞,不加入任何抗体。②Annexin V- FITC补偿管,加入Annexin V- FITC抗体5ul。③PI补偿管,加入PI抗体5ul。 g.样本管为处理过的细胞,对照组为正常细胞,分别加入Annexin V-FITC抗体5ul和 PI抗体5ul。避光室温15min。 h.加入400ul 1 X Binding Buffer。尽快上流式细胞仪检测。
流式细胞仪检测细胞凋亡:PI单染色法 基本原理 其原理主要是根据细胞凋亡时在细胞、亚细胞和分子水平上所发生的特征性改变。这些改变包括细胞核的改变、细胞器的改变、细胞膜成分的改变和细胞形态的改变等,其中细胞核的改变最具特征性,主要包括以下几个方面: 1. 细胞核的改变:由于凋亡细胞核的改变,造成各种染色体荧光染料对凋亡细胞DNA可染性发生改变。研究表明,用各种染色体荧光染料对经固定的凋亡细胞进行染色,其DNA可染性降低。许多学者把这种DNA可染性的降低认为是凋亡细胞的标志之一。 2. 光散射特性:凋亡细胞形态上的改变影响它们的光散射特性。在流式细胞仪上,前散射光与细胞的大小有关,而侧散射光反映的是光在细胞内的折射作用,与细胞内的颗粒多少有关。在细胞凋亡时,细胞固缩,体积变小,故前散射光降低,这一特性往往被认为是凋亡细胞的特点之一。此外细胞凋亡时由于染色体降解,核破裂形成,细胞内颗粒往往增多,故凋亡细胞侧散射光常增加。细胞坏死时,由于细胞肿胀,其前散射光增大;侧散射光在细胞坏死时也增大,因此可根据前散射光和侧散射光区别凋亡细胞和坏死细胞。但需要注意的是,根据前散射光和侧散射光判断凋亡细胞的可靠性受被检测细胞形态上的均一性和核胞浆比率影响很大。因此在某些淋巴细胞凋亡中,用光散射特性检测凋亡的可靠性较好,而在肿瘤细胞凋亡中,其可靠性就较差。根据光散射特性检测凋亡细胞最主要的优点是可以将光散射特性与细胞的表面免疫荧光分析结合起来,用以区别经这些特殊处理发生选择性凋亡的淋巴细胞亚型。也可用于活细胞的分类。 试剂与仪器 PBS溶液; PI染液:将PI溶于PBS(pH7.4)中,终浓度为100ug/ml。用棕色瓶4℃避光保存。 70%乙醇 400目筛网 流式细胞仪 实验步骤 1. 收集细胞{数目约(1~ 5)×106个/mL},500 ~ 1000 r/min离心5min,弃去培养液。 2. 3ml PBS洗涤1次。 3. 离心去PBS,加入冰预冷的70%的乙醇固定,4℃,1—2小时。 4. 离心弃去固定液,3mlPBS重悬5min。 5. 400目的筛网过滤1次,500—1000r/min离心5min,弃去PBS。 6. 用1ml PI染液染色,4℃避光30min。 7. 流式细胞仪检测:PI用氩离子激发荧光,激光光波波长为488nm,发射光波波长大于630nm,产生红色荧光分析PI荧光强度的直方图也可分析前散射光对侧散射光的散点图。 8. 结果判断:在前散射光对侧散射光的散点图或地形图上,凋亡细胞与正常细胞相比,前散射光降低,而侧散射光可高可低,与细胞的类型有关;在分析PI荧光的直方图时,先用门技术排除成双或聚集的细胞以及发微弱荧光的细胞碎片,在PI荧光的直方图上,凋亡细胞在G1/G0期前出现一亚二倍体峰。如以G1/G0期所在位置的荧光强度为1.0,则一个典型的凋亡细胞样本其亚二倍体峰的荧光强度为0.45,可用鸡和鲑鱼的红细胞的PI荧光强度做参照标准,两者分别为0.35和0.7,可以确保在两者之间的不是细胞碎片而是完整的细胞。 注意事项 细胞凋亡时,其DNA可染性降低被认为是凋亡细胞的标志之一,但这种DNA可染性降低也可能是因为DNA含量的降低,或者是因为DNA结构的改变使其与染料结合的能力发生改变所致。在分析结果时应该注意。