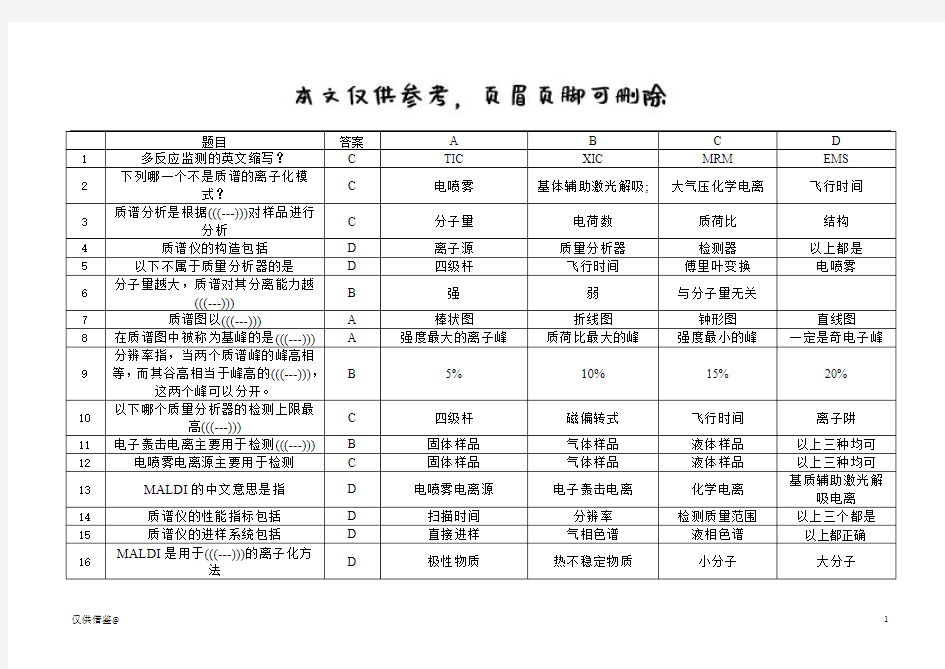
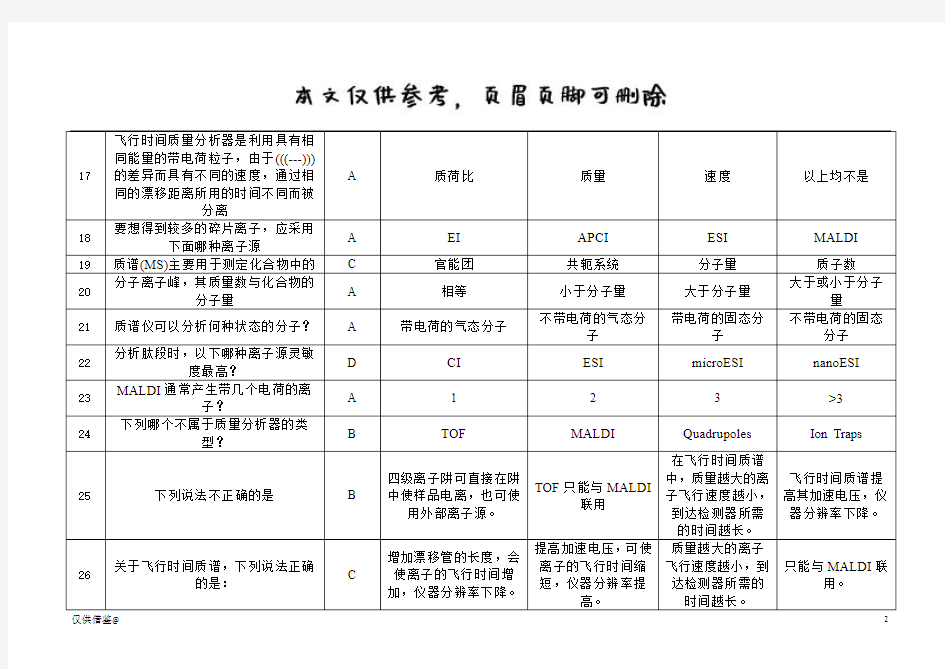
仅供借鉴@ 1
仅供借鉴@ 2
仅供借鉴@ 3
仅供借鉴@
仅供借鉴@
名词解释 蛋白质组学:是研究与基因对应的蛋白质组的学科。指一种基因组所表达的全套蛋白质,即包括一个基因组、一种细胞或组织,乃至一种生物所表达的全部蛋白质。 双向电泳原理:双向一般是指第一向为等点聚焦(IEF),根据蛋白质等电点进行分离;第二向为SDS凝胶电泳(SDS-PAGE),根据蛋白质的相对分子量进行分离。 三步纯化策略:第一步粗提,浓缩,稳定蛋白,去除蛋白酶,使用梯度洗脱来增加捕获步骤的速度和容量;第二步中度纯化,去除主要杂质,一般需要连续梯度洗脱; 第三步精纯,最终去除痕量杂质,如目标蛋白的结构变体。 高效液相色谱:是一种以高压输出液体为流动相的色谱技术。在技术上采用高压输液泵、高效固定相和高灵敏度检测器,克服了经典液相色谱固定相柱效低,分析周期 长的缺点,具有分析速度快、分离效率高、检出极限地的特点。 吸附色谱:吸附色谱系色谱法之一种,利用固定相吸附中对物质分子吸附能力的差异实现对混合物的分离,吸附色谱的色谱过程是流动相分子与物质分子竞争固定相吸 附中心的过程。 PCR扩增:即聚合酶链式反应,是体外酶促合成特异DNA片段的一种方法,由高温变性、低温退火(复性)及适温延伸等反应组成一个周期,循环进行,使目的DNA 得以迅速扩增,具有特异性强、灵敏度高、操作简便、省时等特点。 基因组文库:基因文库是指整套由基因组DNA片段插入克隆载体获得的分子克隆的总和。 广义的基因文库指来于单个基因组的全部DNA克隆,理想情况下应含有这一 基因组的全部DNA序列(遗传信息),这种基因文库常通过鸟枪法获得。 狭义的基因文库有基因组文库和cDNA文库之分。 cDNA文库:按构建基因文库的类似方法对cDNA进行克隆,获得的克隆总称。 基因芯片:基因芯片又叫DNA芯片(DNA chip),DNA微阵列(DNA microarray), DNA集微芯片(DNA microchip),寡核苷酸阵列(oligonucleotide array)是一种将核酸分子杂交原理与微电子技术相结合而形成的高新生物技术。将靶标样品核酸或探针中的任一方按阵列形式固定在固相载体(硅片、尼龙膜、聚丙烯膜、硝酸纤维素膜、玻璃片等)上,另一方用荧光分子标记后,加样至微阵列上杂交,然后用荧光扫描或摄像技术记录,通过计算机软件分析处理,获得样品中大量的基因序列和表达信息。 基因敲除(gene knock out):又称基因打靶(gene targeting),是指用外源的DNA与受体细
蛋白质组学相关试题及答案 1…Proteome(蛋白质组):由一个细胞或者组织的基因组所表达的全部相应的蛋白质,称为蛋白质组。 Proteomics(蛋白质组学):指应用各种技术手段来研究蛋白质组的一门新兴学科,即研究细胞在不同生理或病理条件下蛋白质表达的异同,对相关蛋白质进行分类和鉴定。更重要的是蛋白质组学的研究要分析蛋白质间相互作用和蛋白质的功能. 2…. Mass Spectrometer(质谱仪):质谱仪是一个用来测量单个分子质量的仪器,但实际上质谱仪提供的是分子的质量与电荷比(m/z or m/e)。分离和检测不同同位素的仪器。即根据带电粒子在电磁场中能够偏转的原理,按物质原子、分子或分子碎片的质量差异进行分离和检测物质组成的一类仪器。质谱仪最重要的应用是分离同位素并测定它们的原子质量及相对丰度。 3. Proteome sample holographic preparation(蛋白组样品的全息制备):(1)keep protein information(2)adapted to separation and identification methods(3)different samples,different extraction.蛋白质样品制备是蛋白质组研究的第一步,也是最关键的一步。因为这一步会影响蛋白质产量、生物学活性、结构完整性。因此要用最小的力量使细胞达到最大破坏程度同时保持蛋白质的完整性。 原则是,保持蛋白质的所有信息;选择合适的分离和鉴定方法;对于不同的样品要用不同的提取方法。 4.Post translational modification(蛋白质翻译后修饰) 肽链合成的结束,并不一定意味着具有正常生理功能的蛋白质分子已经生成。已知很多蛋白质在肽链合成后还需经过一定的加工(processing)或修饰,由几条肽链构成的蛋白质和带有辅基的蛋白质,其各个亚单位必须互相聚合才能成为完整的蛋白质分子。 5.De novo sequencing(从头测序) unknow peptide从头测序为蛋白质组研究提供了一种不用借助于任何蛋白质序列数据库信息,直接解读串联质谱数据的方法。其基本算法主要由4个部分组成:质谱图的构建、离子类型的确定、测序算法以及打分算法。
蛋白质组学蛋白质组学相关技术及发展文献综述 蛋白质组学相关技术及发展文献综述张粒植物学211070161概念及相关内容1994年澳大利亚Macquaie大学的Wilkins和Williams等在意大利的一次科学会议上首次提出了蛋白质组proteome这个概念该英文词汇由蛋白质的“prote”和基因组的“ome”拼接而成并且最初定义为“一个基因组所表达的蛋白质”1。然而这个定义并没有考虑到蛋白质组是动态的而且产生蛋白的细胞、组织或生物体容易受它们所处环境的影响。目前认为蛋白质组是一个已知的细胞在某一特定时刻的包括所有亚型和修饰的全部蛋白质2。蛋白质组学就是从整体角度分析细胞内动态变化的蛋白质组成、表达水平与修饰状态了解蛋白质之间的相互作用与联系提示蛋白质的功能与细胞的活动规律。2蛋白质组学的分类蛋白质组学从其研究目标方面可分为表达蛋白质组学和结构蛋白质组学。前者主要研究细胞或组织在不同条件或状态下蛋白质的表达和功能这将有助于识别各种特异蛋白3目前蛋白质组学的研究在这方面开展的最为广泛其运用技术主要是双相凝胶电泳Two-dimensional gel electrophoresis2DE技术以及图像分析系统当对感兴趣的蛋白质进行分析时可能用到质谱。由于蛋白质发生修饰后其电泳特性将发生改变这些技术可以直接测定蛋白质的含量并有助于发现蛋白质翻译后的修饰如糖基化和磷酸化等4。结构蛋白质组学的目标是识别蛋白质的结构并研究蛋白质间的相互作用。近年来酵母双杂交系统是研究蛋白质相互作用时常用的方法同时研究者也将此方法不断改进5。有研究者最近发现在研究蛋白质相互作用时通过纯化蛋白复合物并用质谱进行识别是很有价值的4。3蛋白质组学相关技术目前蛋白质组学研究在表达蛋白质组学方面的研究最为广泛其分析通常有三个步骤第一步运用蛋白质分离技术分离样品中的蛋白质第二步应用质谱技术或N末端测序鉴定分离到的蛋白质第三步应用生物信息学技术存储、处理、比较获得的数据。3.1蛋白质分离技术这类技术主要是电泳其中应用最多的是双向电泳技术其他还有SDS-PAGE、毛细吸管电泳等。除了电泳外还有液相色谱通常使用高效液相色谱HPLC和二维液相色谱2D-LC。另外还有用于蛋白纯化、除杂的层析技术、超离技术等。 3.1.1双相凝胶电泳双相凝胶电泳two-dimensional gel elec—trophoresis2DE这是最经典、最成熟的蛋白质组分离技术产生于20世纪70年代中叶但主要的技术进步如实验的重复性、可操作性蛋白质的溶解性、特异性等是在近lO年取得的。它根据蛋白质不同的特点分两相分离蛋白质。第一相是等电聚焦IEF电泳根据蛋白质等电点的不同进行分离。蛋白质是两性分子根据其周围环境pH可以带正电荷、负电荷或静电荷为零。等电点pI是蛋白质所带静电荷为零时的pH周围pH小于其pI时蛋白质带正电荷大于其pI时蛋白质带负电荷。IEF时蛋白质处于一个pH梯度中在电场的作用下蛋白质将移向其静电荷为零的点静电荷为正的蛋白将移向负极静电荷为负的将移向正极直到到达其等电点如果蛋白质在其等电点附近扩散那么它将带上电荷重新移回等电点。这就是IEF的聚焦效应它可以在等电点附近浓集蛋白从而分离电荷差别极微的蛋白。pH梯度的形成最初是在一个细的包含两性电解质的聚丙烯酰胺凝胶管中进行。在电流的作用下两性电解质可形成一个pH梯度。但由于两性电解质形成的pH梯度不稳定、易漂移、重复性差80年代以后研究人员研制了固定pH梯度的胶条IPG。此种胶条的形成需要一些能与丙烯酰胺单体结合的分子每个含有一种酸性或碱性缓冲基团。制作时将一种含有不同酸性基团的此分子溶液和一种含有不同碱性基团的此分子溶液混合两种溶液中均含有丙烯酰胺单体和催化剂不同分子的浓度决定pH的范围。聚合时丙烯酰胺成分与双丙烯酰胺聚合形成聚丙烯酰胺凝胶。第二相是SDS聚丙烯酰胺凝胶电泳SDS-PAGE根据蛋白质的分子量不同进行分离。此相是在包含SDS的聚丙烯酰胺凝胶中进行。SDS是一种阴离子去污剂它能缠绕在多肽骨架上使蛋白质带负电所带电荷与蛋白质的分子量成正比在SDS聚丙烯酰胺凝胶中蛋白质分子量的对数与它在胶中移动的距离基本成线性关系。SDS-PAGE装置有水平和垂直两种形式垂直装置可同时跑多块胶如Amersham pharmacia Biotech的Ettan DALT II系统可同时跑12块胶提高了操作的平行性。经过2DE
蛋白质组学课程试题 简答题(每题10分) 1、自由流电泳分离蛋白质的机理及其优缺点。 自由流电泳(CFFE)是在无固相支持介质的薄的矩形分离中,以缓冲液为分离介质进行生物大分子或不溶性颗粒及细胞等物质的分离纯化技术。在CFFE中,分离介质在两块平行的矩形板组成的分离腔内形成层流(两板之间的距离通常介于0.5-3.0mm)分离腔的两侧为正负电极室。被分离物质由一口径很小的输入口进入分离介质中,形成一细带,在垂直于液流的方向上加上均匀的电场后,样品中各种组分由于各自电泳迁移率的差异而各自向与所带电荷符号相反的电极以不同的速度迁移,相同电泳迁移率的物质则迁移为一窄带,在到达分离腔出口处由分级手机器收集。 优点:CFFE是一个连续的而不是分批进行的分离过程。同时由于它不使用有机溶剂、高盐溶液,及硅胶或凝胶等支持介质,分离调节相当温和,对有活性的生物材料的分离纯化提供了十分合适的分离环境。 缺点:因自由流电泳是完全无载体的液相电泳,因此除了电泳本身所固有的影响因素外(如:焦耳热,电动力学变形),还有层流(流体力学变形)以及一些综合因素的影响(电流体力学变形等),且这些过程常常互相关联,使整个过程变得极其复杂。重力对自由流电泳会产生影响。颗粒沉降、小滴沉降和热对流是影响自由流电泳的三种重力现象,在微重力条件下这些现象几乎消失,这使CFFE的放大在空间有可能得到实现。 2、质谱仪的组成及其主要技术指标。 质谱仪一般由进样装置、离子化原、质量分析器、离子检测器、数据分析系统组成。其中,离子化原用来待分析的分子转化成气态离子。在质量分析器中,不同荷质比m/z离子在一个随时间变化的电场作用下分离。离子检测器用来接受在质量分析器中分离的带有不同荷质比的离子检测m/z值以及不同m/z的离子密度。 主要技术指标包括:灵敏度,分辨率,准确度,稳定性,质量范围,动态范围 3、蛋白质组学定量分析方法的主要原理。 蛋白质组学定量分析主要包括两种方法: 1、建立在2-DE基础上的电泳方法:其原理是通过比较通过比较蛋白质在不同胶上的染色强度来进行相对定量。提供蛋白质表达水平的信息。 2、利用质谱检测技术:对来自不同样品的肽段标上一个内部标准,使得可以识别不同样品来源的肽段,以质谱峰的信号强度就可以作为定量的依据。 4、请列举预测蛋白质相互作用的方法。 1、酵母双杂交法:主要原理是将可能存在相互作用的蛋白之一与Gal4的DB结构域融合。另外一个与Gal4的AD结构域的酸性区域融合。如果在两个待测蛋白之间存在相互作用, 那么分别位于这两个融合蛋白上的DB 和AD就能重新形成有活性的转录激活因子, 从而激活相应基因的转录与表达。通过对报道基因表达产物的检测, 反过来可判别作为“诱饵”和“猎物”的两个蛋白质之间是否存在相互作用。 2、免疫共沉淀法:免疫共沉淀是一种比较经典的蛋白质相互作用方法,其实验比较简单。裂解细胞后,加入抗体,抗原被沉淀下来后洗涤,去除非特异性亲和再分析结合复合体。目前常使用Pull-down实验结合免疫共沉淀可以对可能的蛋白质相互作用进行验证。 3、高通量质谱蛋白质鉴定:使用一分子标签如FLAG标记把蛋白,使融合蛋白在细胞内过表达。通过免疫亲和(FLAG抗体)捕获到抽提物中把蛋白形成的蛋白质复合物。SDS-PAGE分离复合体各组分,胰酶酶切后,进行质谱分析。此法适合于分析天然状态下细胞内浓度较低的蛋白质,但是如果蛋白质浓度过高则背景较强,产生假阳性。 4、串联亲和纯化(tandem affinity purification, TAP):该技术核心是设计一个双重分子标签,包括A蛋白(IgG binding protein)、TEV蛋白酶切位点、钙调素结合蛋白。将TAP标签构建到靶蛋白上,然后在宿主细胞内表达融合蛋白,表达水平接近把蛋白的天然状态。可以与把蛋白相互作用的其他蛋白质结合到融合蛋白上,形成复合体。细胞裂解物和IgG基质温浴在一起,通过A蛋白复合物结合在IgG上。冲洗后,加入TEV蛋白酶,洗脱复合物。在Ca2+存在的情况下,洗脱液与包被钙调素的温育在一起,复合物就结合在珠子上。进一步洗去杂质后,加入EGTA鳌合,复合物脱落。SDS-PAGE分离复合体各组分,胰酶切割后进行质谱分析。该方法检测到的蛋白质相互作用更加接近自然条件下蛋白质的性质,包括浓度,定位和翻译后修饰。适合于
蛋白质组学技术在农业生物科研领域、疾病机理机制研究、药物研究、海洋环境、植物胁迫机制研究等方面具有广泛应用。蛋白组学的研究通常遵循以下思路: 蛋白质组学研究思路 图 1 蛋白质组学研究思路 一、蛋白质组学在农业生物科研领域的应用 蛋白质组学技术在农业生物科研领域的应用为作物生长发育、病虫害防治、遗传育种、畜牧兽医学疾病诊断和治疗等方面发挥重要的作用,为现代农业发展开辟新途径。 1 .蛋白质组学在农作物研究中的应用 农业是我国人口赖以生存的基础,而提高粮食产量和品质则是农业发展的关键。蛋白质组学关键技术在作物遗传育种、品系鉴定、品质改良、逆境胁迫应答等关键环节的应用,为农业作物的进一步开发利用提供巨大的参考价值。蛋白质组学可系统研究农作物在特定环境或某个发育阶段的组织和器官中蛋白质的表达变化,有助于作物发育过程机制的理解。 Jia等人利用SWATH等技术对四种玉米组织中的蛋白质进行定量分析:包括未成熟雌穗,未成熟雄穗,授粉后20天的幼胚和14日龄幼苗的根。在玉米的4种组织中总共鉴定到4551个蛋白质,其中在雌穗,雄穗,幼胚和幼根中分别鉴定到3916、3707、3702和2871种蛋白质。利用生物信息学技术将蛋白质组和转录组进行关联分析,并且进一步分析组织特异性高表达的基因和蛋白,以了解玉米组织结构和器官发生的调节机制,为研究玉米发育生物学研究提供了新的线索。相关成果2017年发表在Journal of Proteome Research上。
图 2 实验流程图 文献来源:Jia HT, Sun W, Li MF, et al. An integrated analysis of protein abundance, transcript level and tissue diversity to reveal developmental regulation of maize [J]. J. Proteome Res, December 18, 2017. 2.蛋白质组学在食品科学中的应用 在食品安全研究中,蛋白组学的出现为食品科学的研究指明了方向,同时也为食品科学的研究奠定了良好的发展平台。蛋白质组学在粮油食品、肉类食品、水产食品、乳品食品等方面的应用,不仅可以提高食品安全,并且在改善食品制作以及储存条件的同时,还可以提高食品的口感以及营养程度。 在热处理过程中,肉类的主要成分蛋白质会发生结构性变形,如氧化、降解、变性和聚集。蛋白质的这些变化对最终肉制品的质量、颜色、嫩度和风味有重要影响,并最终影响适口性和可接受性。Tian等人利用2-DE等技术手段研究了在加热中心温度为72℃时用不同的烹饪方法,例如水浴烹饪-WB、短时欧姆烹饪-STOH和长时间欧姆烹饪-LTOH,对牛肉的颜色、烹饪损失、剪切值和蛋白质组变化的影响。蛋白质组学分析表明,欧姆烹饪的烹饪损失、剪切值显著低于水浴烹饪(P<0.05)。利用2-DE蛋白组学技术成功鉴定到STOH和WB烹饪样品之间的17个差异蛋白质,并鉴定出LTOH和WB样品之间的13个差异蛋白质。大多数差异蛋白是肌原纤维和肌浆蛋白,可能与肉质的变化相关。WB烹饪可改变蛋白质溶解度并降低2-DE图像中的蛋白质斑点强度。应用欧姆烹饪会产生更高质量的牛肉产品,并减少烹饪时间。相关成果2016年发表在Innovative Food Science & Emerging Technologies上。
蛋白质组学与分析技术课复习思考 一、名词解释 1、蛋白质组学: 蛋白质组学是研究与基因对应的蛋白质组的学科,蛋白质组(proteome)一词,源于蛋白质(protein)与基因组(genome)两个词的杂合,意指“一种基因组所表达的全套蛋白质”,即包括一种细胞乃至一种生物所表达的全部蛋白质。 2、二维(双向)电泳原理: 根据蛋白质的等电点和相对分子质量的特异性将蛋白质混合物在第一个方向上按照等电点高低进行分离,在第二个方向上按照相对分子质量大小进行分离。二维电泳分离后的蛋白质点经显色,通过图象扫描存档,最后是呈现出来的是二维方向排列的,呈漫天星状的小原点,每个点代表一个蛋白质。 3、三步纯化策略: 第一步:粗提。纯化粗样快速浓缩(减少体积) 和稳定样品(去除蛋白酶) 最适用层析技术: 离子交换/疏水层析 第二步:中度纯化。去除大部分杂质 最适用层析技术: 离子交换/疏水层析 第三步:精细纯化。达到最终纯度(去除聚合物,结构变异物) 最适用层析技术:凝焦过滤/离子交换/疏水层析/反相层析 4、高效纯化策略 在三步纯化蛋白质过程中,同时考虑到纯化的速度、载量、回收率及分辨率的纯化策略。5、离子交换色谱: 离子交换色谱中的固定相是一些带电荷的基团,这些带电基团通过静电相互作用与带相反电荷的离子结合。如果流动相中存在其他带相反电荷的离子,按照质量作用定律,这些离子将与结合在固定相上的反离子进行交换。固定相基团带正电荷的时候,其可交换离子为阴离子,这种离子交换剂为阴离子交换剂;固定相的带电基团带负电荷,可用来与流动相交换的离子就是阳离子,这种离子交换剂叫做阳离子交换剂。阴离子交换柱的功能团主要是-NH2,及-NH3 :阳离子交换剂的功能团主要是-SO3H及-COOH。其中-NH3 离子交换柱及-SO3H离子交换剂属于强离子交换剂,它们在很广泛的pH范围内都有离子交换能力;-NH2及-COOH 离子交换柱属于弱离子交换剂,只有在一定的pH值范围内,才能有离子交换能力。离子交换色谱主要用于可电离化合物的分离,例如,氨基酸自动分析仪中的色谱柱,多肽的分离、蛋白质的分离,核苷酸、核苷和各种碱基的分离等。 6、吸附色谱 吸附色谱系色谱法之一种,利用固定相吸附中对物质分子吸附能力的差异实现对混合物的分离,吸附色谱的色谱过程是流动相分子与物质分子竞争固定相吸附中心的过程。洗脱次序∶一般为正相,即:极性低的先被洗脱。 7、PCR扩增 PCR技术(polymerase chain reaction)技术能把单个目的基因大量扩增,这个方法必须在已知基因序列或已知该基因所翻译的氨基酸序列。进而推断出因序列的情况下使用。PCR 的每次扩增循环包括三步:1)变性,在高温下把双链靶DNA拆开;2)在较低的温度下使
蛋白质组学相关试题及答案 解释 1. Proteome(蛋白质组):由一个细胞或者组织的基因组所表达的全部相应的蛋白质,称为蛋白质组。 2. Proteomics(蛋白质组学):指应用各种技术手段来研究蛋白质组的一门新兴学科,即研究细胞在不同生理或病理条件下蛋白质表达的异同,对相关蛋白质进行分类和鉴定。更重要的是蛋白质组学的研究要分析蛋白质间相互作用和蛋白质的功能. 3. Mass Spectrometer(质谱仪):质谱仪是一个用来测量单个分子质量的仪器,但实际上质谱仪提供的是分子的质量与电荷比(m/z or m/e)。分离和检测不同同位素的仪器。即根据带电粒子在电磁场中能够偏转的原理,按物质原子、分子或分子碎片的质量差异进行分离和检测物质组成的一类仪器。质谱仪最重要的应用是分离同位素并测定它们的原子质量及相对丰度。 4. Proteome sample holographic preparation(蛋白组样品的全息制备):(1)keep protein information (2)adapted to separation and identification methods (3)different samples,different extraction. 蛋白质样品制备是蛋白质组研究的第一步,也是最关键的一步。因为这一步会影响蛋白质产量、生物学活性、结构完整性。因此要用最小的力量使细胞达到最大破坏程度同时保持蛋白质的完整性。原则是,保持蛋白质的所有信息;选择合适的分离和鉴定方法;对于不同的样品要用不同的提取方法。 5. Post translational modification(蛋白质翻译后修饰) 肽链合成的结束,并不一定意味着具有正常生理功能的蛋白质分子已经生成。已知很多蛋白质在肽链合成后还需经过一定的加工(processing)或修饰,由几条肽链构成的蛋白质和带有辅基的蛋白质,其各个亚单位必须互相聚合才能成为完整的蛋白质分子。 6. De novo sequencing(从头测序) 从头测序为蛋白质组研究提供了一种不用借助于任何蛋白质序列数据库信息,直接解读串联质谱数据的方法。其基本算法主要由4个部分组成:质谱图的构建、
第35卷 第1期2011年1月 南京林业大学学报(自然科学版) J o u r n a l o f N a n j i n g F o r e s t r y U n i v e r s i t y (N a t u r a l S c i e n c e E d i t i o n ) V o l .35,N o .1 J a n .,2011 h t t p ://w w w .n l d x b .c o m [d o i :10.3969/j .i s s n .1000-2006.2011.01.024] 收稿日期:2009-12-31 修回日期:2010-10-26 基金项目:国家自然科学基金项目(31000287);江苏省高校自然科学基础研究项目(10K J B 220002) 作者简介:甄艳(1976—),副教授,博士。*施季森(通信作者),教授。E -m a i l :j s h i @n j f u .e d u .c n 。 引文格式:甄艳,施季森.质谱技术在蛋白质组学研究中的应用[J ].南京林业大学学报:自然科学版,2011,35(1):103-108. 质谱技术在蛋白质组学研究中的应用 甄 艳,施季森 * (南京林业大学,林木遗传与生物技术省部共建教育部重点实验室,江苏 南京 210037) 摘要:随着蛋白质组学研究的迅速发展,质谱技术已成为应用于蛋白质组学研究中的强有力工具和核心技术。质谱技术的先进性在于为蛋白质组学研究提供的通量和分子信息。笔者重点概述了基于质谱路线的蛋白质组学研究,介绍了基于质谱的定量蛋白质组学﹑翻译后修饰蛋白质组学、定向蛋白质组学、功能蛋白质组学以及基于串联质谱技术的蛋白质组学数据解析的研究 进展。 关键词:质谱;蛋白质组学;定量蛋白质组学;翻译后修饰;定向蛋白质组学;功能蛋白质组学中图分类号:Q 81 文献标志码:A 文章编号:1000-2006(2011)01-0103-06 A p p l i c a t i o n o f m a s s s p e c t r o m e t r y i n p r o t e o m i c s s t u d i e s Z H E NY a n ,S H I J i s e n * (K e y L a b o r a t o r y o f F o r e s t G e n e t i c s a n d B i o t e c h n o l o g y M i n i s t r y o f E d u c a t i o n , N a n j i n g F o r e s t r y U n i v e r s i t y ,N a n j i n g 210037,C h i n a ) A b s t r a c t :W i t ht h e r a p i d d e v e l o p m e n t o f p r o t e o m i c s ,m a s s s p e c t r o m e t r y i s m a t u r i n g t o b e a p o w e r f u l t o o l a n dc o r e t e c h -n o l o g y f o r p r o t e o m i c s s t u d i e s d u r i n g t h e r e c e n t y e a r s .T h e s u p e r i o r i t y o f m a s s s p e c t r o m e t r y l i e s i n p r o v i d i n g t h e t h r o u g h -p u t a n d t h e m o l e c u l a r i n f o r m a t i o n ,w h i c hn o o t h e r t e c h n o l o g y c a n b e m a t c h e di np r o t e o m i c s .I nt h i s r e v i e w ,w e m a d e a g l a n c e o n t h e o u t l i n e o f m a s s s p e c t r o m e t r y -b a s e d p r o t e o m i c s .A n dt h e nw e a d d r e s s e d o n t h e a d v a n c e s o f d a t a a n a l y s i s o f m a s s s p e c t r o m e t r y -b a s e dp r o t e o m i c s ,q u a n t i t a t i v em a s ss p e c t r o m e t r y -b a s e dp r o t e o m i c s ,p o s t -t r a n s l a t i o n a l m o d i f i c a t i o n s b a s e d m a s s s p e c t r o m e t r y ,t a r g e t e d p r o t e o m i c s a n df u n c t i o n a l p r o t e o m i c s b a s e d -m a s s s p e c t r o m e t r y . K e yw o r d s :m a s ss p e c t r o m e t r y ;p r o t e o m i c s ;q u a n t i t a t i v ep r o t e o m i c s ;p o s t -t r a n s l a t i o n m o d i f i c a t i o n ;t a r g e t e d p r o -t e o m i c s ;f u n c t i o n a l p r o t e o m i c s 蛋白质组学(P r o t e o m i c s )是从整体水平上研究细胞内蛋白质的组成、活动规律及蛋白质与蛋白质的相互作用,是功能基因组学时代一门新的学科。目前蛋白质组学的研究主要有两条路线:一是基于双向电泳的蛋白质组学;二是基于质谱的蛋白质组学,其中基于双向电泳的蛋白质组学研究路线最终也离不开质谱技术的应用。自20世纪80年代末,两种质谱软电离方式即电喷雾电离(e l e c t r o s p r a y i o n i z a t i o n ,E S I )和基质辅助激光解析离子化(m a -t r i x a s s i s t e d l a s e r d e s o r p t i o n i o n i z a t i o n ,M A L D I )的发明和发展解决了极性大、热不稳定蛋白质和多肽分 析的离子化和分子质量大的测定问题[1] ,蛋白质组学研究中常用的质谱分析仪包括离子阱(i o n t r a p ,I T ),飞行时间(t i m e o f f l i g h t ,T O F ),串联飞行时间(T O F -T O F ),四级杆/飞行时间(q u a d r u p o l e /T O F h y b r i d s ),离子阱/轨道阱(I T /o r b i t r a ph y b r i d ) 和离子阱/傅里叶变换串联质谱分析仪(I T /F o u r i e r t r a n s f o r m i o n c y c l o t r o nr e s o n a n c em a s s s p e c t r o m e t e r s h y b r i d s ,I T /F T M S ),这些质谱仪具有不同的灵敏度、分辨率、质量精确度和产生不同质量的M S /M S 谱[2] 。质谱作为蛋白质组学研究的一项强有力的工具日趋成熟,并作为样品制备及数据分析的信息学工具被广泛地应用。因此,有学者指出质谱技术 已在蛋白质组学研究中处于核心地位[3] 。目前在通量及所包含的分子信息内容上,基于质谱的蛋白质组学技术在细胞生物学研究中可以鉴定和量化
蛋白质组学复习资料 一、名词解释 1、蛋白质组学:蛋白质组学是研究与基因对应的蛋白质组的学科,蛋白质组(proteome)一词,源于蛋白质(protein)与基因组(genome)两个词的杂合,意指“一种基因组所表达的全套蛋白质”,即包括一种细胞乃至一种生物所表达的全部蛋白质。 2、二维(双向)电泳原理:根据蛋白质的等电点和相对分子质量的特异性将蛋白质混合物在第一个方向上按照等电点高低进行分离,在第二个方向上按照相对分子质量大小进行分离。二维电泳分离后的蛋白质点经显色,通过图象扫描存档,最后是呈现出来的是二维方向排列的,呈漫天星状的小原点,每个点代表一个蛋白质。 3、三步纯化策略: 第一步:粗提。纯化粗样快速浓缩 (减少体积) 和稳定样品 (去除蛋白酶) 最适用层析技术: 离子交换/疏水层析 第二步:中度纯化。去除大部分杂质 最适用层析技术: 离子交换/疏水层析 第三步:精细纯化。达到最终纯度(去除聚合物,结构变异物) 最适用层析技术:凝焦过滤/离子交换/疏水层析/反相层析 4、高效纯化策略:在三步纯化蛋白质过程中,同时考虑到纯化的速度、载量、回收率及分辨率的纯化策略。 5、离子交换色谱:离子交换色谱中的固定相是一些带电荷的基团,这些带电基团通过静电相互作用与带相反电荷的离子结合。如果流动相中存在其他带相反电荷的离子,按照质量作用定律,这些离子将与结合在固定相上的反离子进行交换。固定相基团带正电荷的时候,其可交换离子为阴离子,这种离子交换剂为阴离子交换剂;固定相的带电基团带负电荷,可用来与流动相交换的离子就是阳离子,这种离子交换剂叫做阳离子交换剂。阴离子交换柱的功能团主要是-NH2,及-NH3 :阳离子交换剂的功能团主要是-SO3H及-COOH。其中-NH3 离子交换柱及-SO3H离子交换剂属于强离子交换剂,它们在很广泛的pH范围内都有离子交换能力;-NH2及-COOH 离子交换柱属于弱离子交换剂,只有在一定的pH值范围内,才能有离子交换能力。离子交换色谱主要用于可电离化合物的分离,例如,氨基酸自动分析仪中的色谱柱,多肽的分离、蛋白质的分离,核苷酸、核苷和各种碱基的分离等。 6、吸附色谱:吸附色谱系色谱法之一种,利用固定相吸附中对物质分子吸附能力的差异实现对混合物的分离,吸附色谱的色谱过程是流动相分子与物质分子竞争固定相吸附中心的过程。洗脱次序∶一般为正相,即:极性低的先被洗脱。 7、PCR扩增:PCR技术(polymerase chain reaction)技术能把单个目的基因大量扩增,这个方法必须在已知基因序列或已知该基因所翻译的氨基酸序列。进而推断出因序列的情况下使用。PCR的每次扩增循环包括三步:1)变性,在高温下把双链靶DNA 拆开; 2)在较低的温度下使引物与靶DNA互补; 3)在中间温度下,在DNA多聚酶作用下,引物按模板DNA延长。典型的PCR包括30~50循环,如此重复循环,使被扩增的靶核苷酸以几何级数扩增。 8、基因组文库 基因文库是指整套由基因组DNA片段插入克隆载体获得的分子克隆这总和。 广义的基因文库指来于单个基因组的全部DNA克隆,理想情况下应含有这一基因组的全部DNA序列(遗传信息),这种基因文库常通过鸟枪法获得。 狭义的基因文库有基因组文库和cDNA文库之分。基因文库可用于研究基因的结构、功能和筛选基因工程的目的基因。 9、cDNA文库:以mRNA为模板,经反转录酶催化,在体外反转录成cDNA,与适当的载体(常用噬菌体或质粒载体)连接后转化受体菌,则每个细菌含有一段cDNA,并能繁殖扩增,这样包含着细胞全部mRNA信息的cDNA克隆集合称为该组织细胞的cDNA 文库。真核生物基因组DNA庞大,复杂度是mRNA和蛋白质的100倍左右,而且含有大量的重复序列,和不被表达的间隔子。这是从染色体DNA出发材料直接克隆目的基因的主要困难。而从mRNA出发的cDNA克隆比基因组克隆要简单得多。 10、基因芯片 基因芯片又叫DNA芯片(DNA chip),DNA微阵列(DNA microarray), DNA集微芯片(DNA microchip),寡核苷酸阵列(oligonucleotide array)。 是一种将核酸分子杂交原理与微电子技术相结合而形成的高新生物技术。 将靶标样品核酸或探针中的任一方按阵列形式固定在固相载体(硅片、尼龙膜、聚丙烯膜、硝酸纤维素膜、玻璃片等)上,另一方用荧光分子标记后,加样至微阵列上杂交,然后用荧光扫描或摄像技术记录,通过计算机软件分析处理,获得样品中大量的基因序列和表达信息。 11、基因敲除:基因敲除(gene knock out),又称基因打靶(gene targeting),是指用外源的DNA与受体细胞基因组中顺序相同或非常相近的基因发生同源重组,整合至受体细胞基因组中并得以表达的一种外源DNA导入技术。对一个结构已知但功能未知的基因,从分子水平上设计实验,将该基因敲除,或用其他顺序相近基因取代,然后从整体观察实验动(植)物,推测相应基因的功能。 12、同源建模:是一种蛋白质结构预测方法,具体指是利用同同源蛋白质结构为模板来预测未知蛋白质的结构。同源性大于50%时,结果比较可靠;30~50%之间,其结果需要参考其它蛋白的信息。同源性小于30%时,人们一般采用折叠识别方法。同源性更小时,从无到有法更有效。 13、Gene:合成有功能的蛋白质或RNA所必需的全部DNA(部分RNA病毒除外),即一个基因不仅包括编码蛋白质或RNA的核酸序列,还应包括为保证转录所必需的调控序列。 14.genome:细胞或生物体中,一套完整单体的遗传物质的总和,即某物种单倍体的总DNA。对于二倍体高等生物来说,其配子的DNA总和即一组基因组,二倍体有两份同源基因组。 15.Protein:生物体中广泛存在的一类生物大分子,由核酸编码的α氨基酸之间通过α氨基和α羧基形成的肽键连接而成的肽链,经翻译后加工而生成的具有特定立体结构的、有活性的大分子。 16.exon:外显子(expressed region)是真核生物基因的一部分,它在剪接(Splicing)后仍会被保存下来,并可在蛋白质生物合成过程中被表达为蛋白质。 17.蛋白质组学研究的两条途径:一条是类似基因组学的研究,即力图"查清"人类大约3万到4万多基因编码的所有蛋白质,建立蛋白质组数据库,即组成蛋白质组学研究;另一条途径,则是着重于寻找和筛选引起2个样本之间的差异蛋白质谱产生的任何有意义的因素,揭示细胞生理和病理状态的进程与本质,对外界环境刺激的反应途径,以及细胞调控机制,同时获得对某些关键蛋白的定性和功能分析,即比较蛋白质组学研究。 18.组成蛋白质组学研究(结构蛋白质组学) 这是一种针对有基因组或转录组数据库的生物体或组织、细胞,建立其蛋白质或亚蛋白质组(或蛋白质表达谱)及其蛋白质组连锁群的一种全景式的蛋白组学研究,从而获得对有机体生命活动的全景式认识。 应该认识到,全基因组研究的发端和升温,是由于大规模基因组测序技术的实现和其后高通量的基因芯片技术的发展所推动的。而蛋白质组迄今还不具备相应的技术基础,且大规模的高通量DNA研究是建立在4种碱基及其配对性质的相对单一和简
蛋白质组学及其主要技术 朱红1 周海涛2 (综述) 何春涤1, (审校) (1.中国医科大学附属第一医院皮肤科,辽宁沈阳110001; 2.北京大学深圳医院核医学 科,广东深圳518036) 【摘要】蛋白质组是指一种细胞、组织或有机体所表达的全部蛋白质。蛋白质组学是以蛋白质组为研究对象的新兴学科,近年来发展迅速,已成为后基因组时代的研究热点。目前,蛋白质组学研究技术主要包括:样品的制备和蛋白质的分离、蛋白质检测与图像分析、蛋白质鉴定及信息查询。本文就蛋白质组学概念及主要技术进行综述。 【关键词】蛋白质组,蛋白质组学 1蛋白质组学的概念 随着人类基因组测序计划的完成,人们对生命科学的研究重点由结构基因组转向功能基因组,1994年Wilkins和Williams首先提出蛋白质组一词[1],蛋白质组是指一种细胞、组织或有机体所表达的全部蛋白质。从基因到蛋白质存在转录水平、翻译水平及翻译后水平的调控,组织中mRNA丰度与蛋白质丰度不完全符合[2]。蛋白质复杂的翻译后修饰、蛋白质的亚细胞定位或迁移、蛋白质-蛋白质相互作用等也无法从DNA/mRNA水平来判断。因此,只有将功能基因组学与蛋白质组学相结合,才能精确阐明生命的生理及病理机制。 蛋白质组学是以蛋白质组为研究对象,对组织、细胞的整体蛋白进行检测,包括蛋白质表达水平、氨基酸序列、翻译后加工和蛋白质的相互作用,在蛋白质水平上了解细胞各项功能、各种生理、生化过程及疾病的病理过程等[3,4]。蛋白质组学有两种研究策略。一种是高通量研究技术,把生物体内所有的蛋白质作为对象进行研究,并建立蛋白质数据库,从大规模、系统性的角度来看待蛋白质组学,更符合蛋白质组学的本质。但是,由于剪切变异和翻译后修饰,蛋白质数量极其庞大,且表达随空间和时间不断变化,所以分析生物体内所有的蛋白质是一个耗时费力,难以实现的理想目标。另一种策略是研究不同状态或不同时期细胞或组织蛋白质组成的变化,主要目标是研究有差异蛋白质及其功能,如正常组织与肿瘤组织间的差异蛋白质,寻找肿瘤等疾病标记物并为其诊断治疗提供依据。 2蛋白质组学的常用技术 2.1样品的制备和蛋白质的分离技术 2.1.1样品的制备样品制备包括细胞裂解与蛋白质溶解,以及去除核酸等非蛋白质成分。 激光捕获显微切割(Laser-captured microdissection, LCM)[5]技术可大量获得足够用于蛋白质组学研究的单一细胞成分,避免其他蛋白成分对电泳结果的干扰。尤其是肿瘤的蛋白质组学研究常用LCM技术来获取单一的肿瘤细胞。 2.1.2蛋白质的分离技术 ①双向凝胶电泳(Two-dimensional electrophoresis, 2-DE):双向电泳方法于 l975年由O'Farrell[6]首先提出,根据蛋白质等电点和分子量的差异,连续进行成垂直方向的两次电泳将其分离。 第一向为等电聚焦(Isoelectric focusing,IEF)电泳,其基本原理是利用蛋白质分子的等电点不同进行蛋白质的分离。较早出现的IEF是载体两性电解质pH梯度,即在电场中通过两性缓冲离子建立pH梯度;20世纪80年代初建立起来的固相pH梯度(Immobilized pH gradients,IPG)IEF,是利用一系列具有弱酸或弱碱性质的丙烯酰胺衍生物形成pH梯度并参与丙烯酰胺的共价聚合,形成固定的、不随环境电场条件变化的pH梯度。IPG胶实验的重复
《蛋白质组学》 考试时间:120分钟 考试总分:100分 遵守考场纪律,维护知识尊严,杜绝违纪行为,确保考试结果公正。 1、自由流电泳分离蛋白质的机理及其优缺点。( ) 2、质谱仪的组成及其主要技术指标。( ) 3、蛋白质组学定量分析方法的主要原理。( ) 4、请列举预测蛋白质相互作用的方法。( ) 5、系统生物学研究的主要流程是什么?( ) 姓名:________________ 班级:________________ 学号:________________ --------------------密----------------------------------封 ----------------------------------------------线-------------------------
6、试述如何应用2D-PAGE进行差异蛋白质组学的研究,并分析其优缺点。() 7、Proteome(蛋白质组)() 8、Proteomics(蛋白质组学)() 9、Mass Spectrometer(质谱仪)() 10、Post translational modification(蛋白质翻译后修饰)() 11、De novo sequencing(从头测序)() 12、Tandem mass spectrometry(串联质谱)()
13、Peptide mass fingerprint(肽指纹谱)() 14、Peptide sequence tag 肽序列标签() 15、Post-source decay(源后衰变)() 16、Neutral loss scan 中性丢失扫描() 17、Matrix-assisted laser desorption/ionization基质辅助激光解吸电离技术 (MALDI)() 18、论述蛋白质组学与基因组学的区别和联系。() 19、简述与传统的分离技术相比较,PF-2D的优点。()
2013——2014第一学期蛋白质组学试题 一名词解释(6分题,共30分) 1. 基因组:生物细胞中的全部基因。 蛋白质组:生物细胞中由全套基因编码控制的蛋白质 2. 基因组学:是研究生物基因组和如何利用基因的一门学问。提供基因组信息以及相关数据系统利用,试图解决生物,医学,和工业领域的重大问题。 蛋白质组学:研究蛋白质组中蛋白质表达与功能变化的科学。可视为分子生物学的大规模筛选技术,目的在于归类细胞中的蛋白质的整体分布,鉴定并分析感兴趣的个别蛋白,最终阐明它们的关系与功能。 3. 质谱:被分析样品经离子化,成为分子离子及其碎片,后利用离子在电场或磁场中的运动性质,把离子按其质量与所带电荷比(m/z)的大小依次排列并记录下来成为质量波谱,称为质谱。 质谱分析:是通过对样品分子的离子质量和强度进行测定来分析样品成分和结构的一种分析方法。 4. MALDI与ESI MALDI:即基质辅助激光解吸电离,在波长为775-1250nm的真空紫外光辐射下光致电离和解吸作用使生物分子电离为分子离子和含有结构信息的碎片。 ESI:即电喷雾电离,采用强静电场(3-5kV),以喷雾形式使液体样品形成高度荷电的雾状小液滴,小液滴经过反复的溶剂挥发-液
滴分裂后,产生多种质子化离子。 两者均属于软电离技术。 5. SDS-PAGE:聚丙烯酰胺凝胶电泳(PAGE),在聚丙烯酰胺凝胶系统中加入十二烷基硫酸钠(SDS)构成SDS-PAGE系统用于分离蛋白质,蛋白电泳迁移率取决于其分子量,而与形状及所带电荷无关。 2-D:即双向凝胶电泳,根据蛋白质的等电点和分子质量的差异使之在二相平面上分开 是目前使用最广泛的蛋白质组学分离技术。 二简答题(6分题,共30分) 1 简述CHIP技术的原理 被剪切,与所研究蛋白相关的DNA片断被选择性免疫沉淀;相关DNA 片断被纯化,顺序被测定。 2 简述ICAT技术的原理 ICATS是一种蛋白质组学定量研究常见方法,ICAT试剂结构,包括3个部分,SH反应集团, biotin标签,同位素 其原理是来源不同处理的蛋白质分别用重型ICAT试剂和轻型ICAT试剂标记,标记后等量混合,胰蛋白酶酶切,亲和纯化得到ICAT标记的多肽,质谱分析,依据MS质谱峰图强度进行定量,MS/MS鉴定肽段。