
玻璃的性质
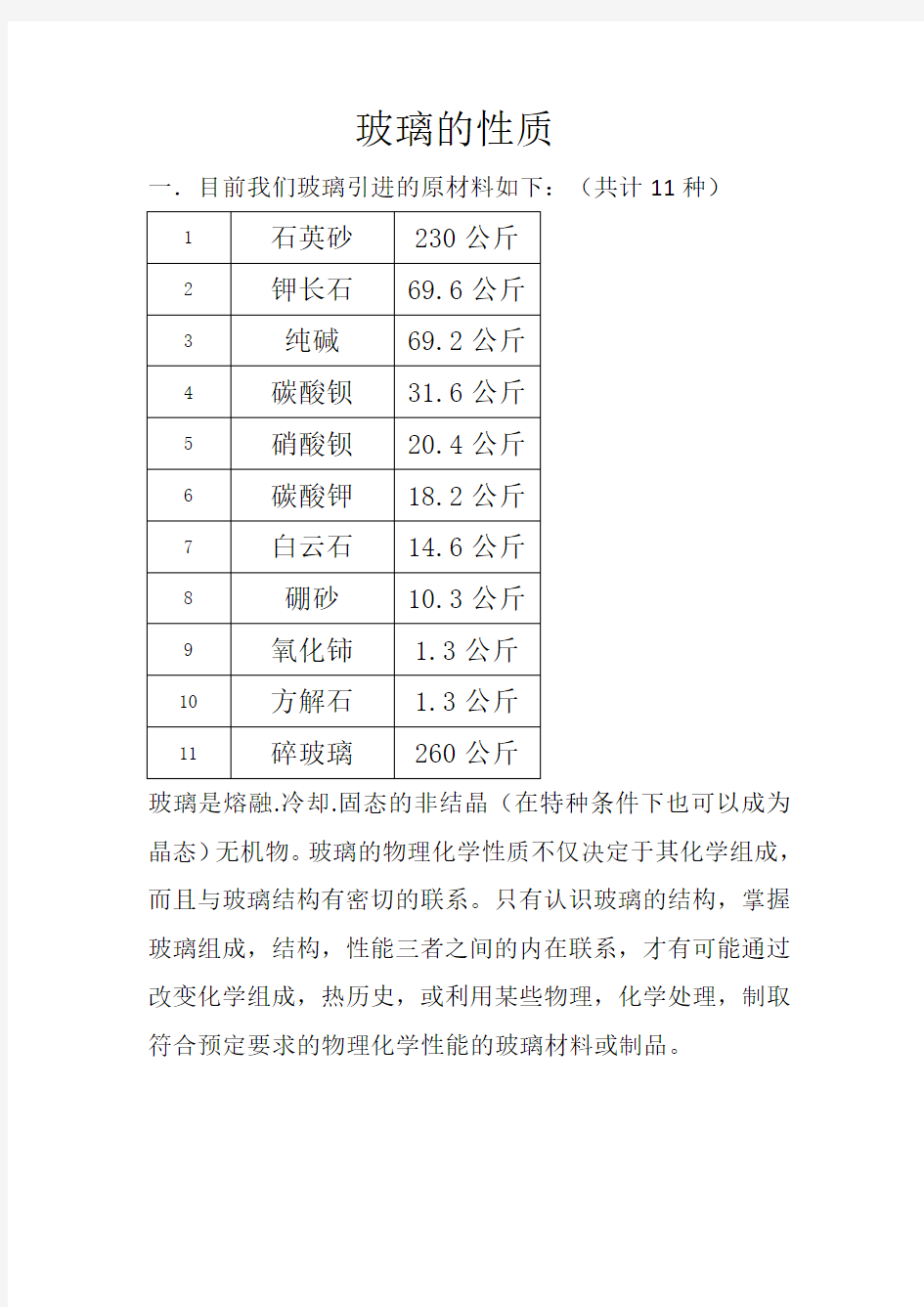
一.目前我们玻璃引进的原材料如下:(共计11种)
1 石英砂230公斤
2 钾长石69.6公斤
3 纯碱69.2公斤
4 碳酸钡31.6公斤
5 硝酸钡20.4公斤
6 碳酸钾18.2公斤
7 白云石14.6公斤
8 硼砂10.3公斤
9 氧化铈 1.3公斤
10 方解石 1.3公斤
11 碎玻璃260公斤
玻璃是熔融.冷却.固态的非结晶(在特种条件下也可以成为晶态)无机物。玻璃的物理化学性质不仅决定于其化学组成,而且与玻璃结构有密切的联系。只有认识玻璃的结构,掌握玻璃组成,结构,性能三者之间的内在联系,才有可能通过改变化学组成,热历史,或利用某些物理,化学处理,制取符合预定要求的物理化学性能的玻璃材料或制品。
二.玻璃的主要性质。
(1)粘度:粘度是玻璃的最主要物理性质之一。在整个玻璃生产工艺过程(熔融,澄清,冷却,成形,退火)所制度的一系列温度制度往往是以此为依据的。
粘度是液态或熔体内部的分子在移动时相互之间的内摩擦力,内摩擦力越大,则分子移动越困难。也就是粘度越大。玻璃的粘度和温度有着密切的关系,温度升高时,粘度随之下降,但是这种变化没有一定的比例关系,通常在高温阶段,粘度的降低速度缓慢,而在低温段则急剧增加。
(2)析晶性能:玻璃是一种非晶态物质,但在一定的条件下,玻璃具有向晶态转化的倾向。在玻璃生产中一般不希望玻璃析晶,因为析晶会造成外观上的缺陷,失去玻璃原有的性质,不能加工成型。析晶是玻璃的缺陷。
(3)光学性能:玻璃对辐射的透射率取决于玻璃中的杂质含量。不含氧化铁的透明玻璃大约能透过90%以上的可见辐射,仅有小部分辐射被玻璃真正吸收,大部分为玻璃两个表面的反射所损失。
(4)密度:玻璃的密度主要决定于玻璃的化学组成,分子量越大的氧化物含量越高时,玻璃的密度也越大。如石英玻璃由SiO2所组成,它的密度最小,约2.2g/立方厘米,而含大量氧化铅的玻璃密度可达6.5g/立方厘米。我们目前生产的钠钙硅玻璃的密度为2.46g/立方厘米。
(5)热膨胀系数:大部分物体受热以后都要膨胀,玻璃也不例外。物体受热后膨胀的大小由它们的线膨胀系数和体膨胀系数来表明的。玻璃的膨胀系数取决于玻璃的化学组成,系数提高。而增加SiO2,B2O3,AL2O3的含量,就能降低膨胀系数。我们生产的玻璃膨胀系数为:92x10-7/℃。
(6)电性能:在常温下玻璃是绝缘体。但是随着温度的上升,玻璃的导电性迅速提高,到了熔融状态,玻璃变成了良导体。利用玻璃在常温下的低电导率可制造照明灯泡,电真空器件等。
(7)强度:玻璃的机械强度,一般用耐压强度,抗折强度,抗张强度,抗冲击强度等来表示。玻璃之所以得到广泛应用,其原因之一就是它的耐压强度很高,硬度也高。然而,由于它的抗折强度和抗张强度不高,并且脆性较大,使玻璃的应用受到了一定的限制。
(8)化学稳定性:玻璃表面抵抗周围介质如水,酸,碱,盐,气体以及大气的污染等化学侵蚀作用的能力称为玻璃的化学稳定性。
三.玻璃的9种含量
AL2O3(三氧化二铝) 2.7%
Fe2O3(三氧化二铁)409ppm
CaO(氧化钙) 2.1%
MgO(氧化镁) 1.1%
SiO2(二氧化硅)69.8%
B2O3(氧化硼) 1.1%
BaO(氧化钡)9.2%
K2O(氧化钾) 3.8%
Na2O(氧化钠)8.2%
(1)引入二氧化硅的作用:是提高玻璃的熔制温度,粘度,化学稳定性,硬度和机械强度,同时它能降低玻璃的热膨胀系数和密度。
(2)引入三氧化二铝的作用:能降低玻璃的结晶倾向,提高玻璃的化学稳定性,热稳定性,机械强度,硬度和折射率,减轻玻璃对耐火材料的侵蚀。但是AL2O3能提高玻璃的粘度,所以含量控制在1-3.5%,一般不超过10%。
(3)引入氧化钙的作用:作用稳定剂。增加玻璃的化学稳定性和机械强度。含量高时会增加玻璃的结晶倾向。
(4)引入氧化镁的作用:可使玻璃形成时硬化速度变慢,降低玻璃的析晶倾向,提高玻璃的化学稳定性。
(5)引入氧化硼的作用:降低玻璃的膨胀系数,提高玻璃的热稳定性和化学稳定性。改善玻璃的光泽,加速玻璃的澄清和降低玻璃的结晶能力。
(6)引入氧化钡的作用:增加玻璃的折射率,密度,光泽和化学稳定性。但是含量较高时会使澄清困难。
(7)引入氧化钠的作用:降低玻璃的热稳定性,化学稳定性和机械强度。但是含量超过18%时可增加玻璃的热膨胀系数。所以不可引入过多。
(8)引入氧化钾的作用:能降低玻璃的析晶倾向,增加玻璃的透明度和光泽度。
(9)Fe2O3:应控制在0.1%以下,它是玻璃的有害成分,主要影响玻璃的透光性,在熔制中影响玻璃液的透热性。
玻璃的熔制过程
玻璃的熔制是玻璃制造最重要的过程之一。玻璃的溶制是指加热过程中的粉末变成玻璃体,从而能用它来形成玻璃制品。绝大多数的玻璃缺陷是由于玻璃制造过程中的疏忽和缺陷造成的。所以对玻璃的溶制过程应该注意,玻璃的熔制过程是一个很复杂的过程,它有一系列的物理的,化学的,物理和化学的变化和反应。
配合料进入玻璃熔窖后,经过加热产生一系列的物理化学变化,成为符合某种玻璃成形工艺指标的均匀玻璃液,这一过程称为溶制。对玻璃的熔制过程中每种粉料在加热时各有其形成玻璃的某些特点,而这些特点正是与粉料的化学组成有关。
(1)硅酸盐的形成
硅酸盐生产反应在很大程度上是在固态状态下进行的,配合料在加热过程中发生了一系列的物理化学变化,有大量的气体物质挥发出来,我们的是11%气体挥发掉。粉料变为烧结物质,它是由硅酸盐和硅氧所组成的。对大数玻璃来讲,这期间温度需要900度左右来完成。
(2)玻璃形成
在上面基础上,继续加热的结果。烧结的物质开始熔融,易熔的低温共熔物首先融化,在融化的同时,硅酸盐与硅氧相互溶解。硅酸盐形成阶段生成的硅酸钠,硅酸钙,硅
酸铝,硅酸镁以及反应后剩余的SiO2开始熔融,它们之间相互溶解和扩散,在此阶段结束时烧结物质变得透明了,其中没有未起作用的粉末粒子或所谓的未熔透物质。但是此时玻璃液中仍包含有大小气泡,而玻璃本身的化学组成和性质也是不均一的,在玻璃液中也还有许多所谓条纹,大多数玻璃的这个阶段是在1200-1250度完成。
由于石英砂粒熔解和扩散速度比其他各种硅酸盐熔解和扩散速度低的多,所以玻璃形成过程的速度实际上取决石英砂粒的熔解扩散速度。为了加快砂粒在硅酸盐熔体中的熔解,除了选用颗粒直径比较小,形状带有菱角的石英砂外,还可以通过提高熔化温度,加入一定量的助熔剂来达到。
(3)玻璃的澄清
玻璃形成阶段结束时,玻璃中还残留许多气泡和条纹,继续加热时玻璃液的粘度就会降低,消除玻璃液中可见气泡的过程,叫玻璃液的澄清。消除玻璃液中可见气泡的办法使气泡漂浮于玻璃液的表面而除去。气泡向上漂浮的速度决定于气泡的大小和玻璃液的黏度。气泡增大,上升的速度就加快。玻璃液的黏度和气泡的上升速度成反比,黏度越大,气泡上升就越慢,因此,降低玻璃液的黏度,就有利气泡的排除。为了加快玻璃的澄清左右,除了在配合料中加入某些澄清剂外,一般都采取提高玻璃液的温度的措施。
(4)玻璃液的均化
玻璃液长时间处在高温状态下,使它各部分的化学组成趋于相同。由于玻璃中各组分扩散的结果,玻璃液中的条纹就会消失,而玻璃液就会变的均匀一致了。这种均匀性往往是以玻璃液各部分的折射率是否相同来表征的。大多数玻璃的这个阶段是在温度稍低于澄清阶段的温度是完成的。
加快玻璃液均化的方法,一是提高玻璃液的温度,用以加强分子的扩散运动,降低玻璃液的黏度;二是对玻璃液进行搅拌。
(5)玻璃的冷却
在高温区进行澄清和均化后的玻璃液温度很高,流动性过大,不适合于玻璃的形成操作,需要将它进行冷却,逐步降低玻璃的温度,使玻璃液的黏度增加到适合于成型的需要。玻璃液温度降低的数值,随着玻璃的成分和成型方法的不同而变化,通常是比最高温度是降低了200-300度,使玻璃液的黏度达到成形式所需要的数值。
玻璃的基本性质 玻璃网2009-8-27 20:12:41 (一)表观密度:玻璃的表观密度与其化学成分有关,故变化很大。而且随温度升高而减小。普通硅酸盐玻璃的表观密度在常温下大约是2500kg/m3。 (二)力学性质:玻璃的力学性质决定于化学组成、制品形状、表面性质和加工方法。凡含有未熔杂物、结石、节瘤或具有微细裂纹的制品,都会造成应力集中,从而急剧降低其机械强度。在建筑中玻璃经常承受弯曲、拉伸、冲击和震动,很少受压,所以玻璃的力学性质的主要指标是抗拉强度和脆性指标。玻璃的实际抗拉强度为30~60MPa。普通玻璃的脆性指标(弹性模量与抗拉强度之比E/R拉)为1300~1500(橡胶为0.4~0.6)。脆性指标越大,说明脆性越大。 (三)热物理性质:(1)玻璃的导热性很差,在常温时其导?热系数仅为铜的1/400,但随着温度的升高将增大。另外,它还受玻璃的颜色和化学组成的影响.(2)玻璃的热膨胀性决定于化学组成及其纯度,纯度越高热膨胀系数越小。(3)玻璃的热稳定性决定于玻璃在温度剧变时抵抗破裂的能力。玻璃的热膨胀系数越小,其热稳定性越高。玻璃制品越厚、体积越大,热稳定性越差。因此须用热处理方法提高制品的热稳定性。 (四)化学稳定性:玻璃具有较高的化学稳定性,但长期遭受侵蚀性介质的腐蚀,也能导致变质和破坏。 (五)玻璃的光学性能:玻璃既能透过光线,又能反射光线和吸收光线,所以厚玻璃和多层重叠玻璃,往往是不易透光的:玻璃反射光能与投射光能之比称为反射系数。反射系数的大小决定于反射面的光滑程度、折射率、投射光线入射角的大小、玻璃表面是否镀膜及膜层的种类等因素。 玻璃吸收光能与投射光能之比称为吸收系数;透射光能与投射光能之比称为透射系数。反射系数、透射系数和吸收系数之和为l00%。普通3mm厚的窗玻璃在太阳光垂直投射的情况下,反射系数为7%,吸收系数为8%.透射系数为85%。 将透过3mm厚标准透明玻璃的太阳辐射能量作为1.0,其它玻璃在同样条件下透过太阳辐射能的相对值称为遮蔽系数。遮蔽系数越小说明通过玻璃进入室内的太阳辐射能越少,冷房效果越好,光线越柔和。
各元素性质 各元素性质 序号符 号 中 文 读 音 原子 量 外层电 子 常见 化合 价 分类英文名英文名音标其它 1H氢轻11s11、-1主/非/ 其 Hydrogen['haidr?d??n]最轻 2He氦害41s2主/非/ 稀 Helium['hi:li?m]最难液化 3Li锂里72s11主/碱Lithium['liθi?m]活泼 4Be铍皮92s22主/碱 土 Beryllium[be'rili?m]最轻碱土金属元素 5B硼朋10.82s2 2p13主/类Boron['b?:r?n]硬度仅次于金刚石的非金属元素 6C碳探122s2 2p22、4、 -4 主/非/ 其 Carbon['kɑ:b?n]硬度最高 7N氮蛋142s2 2p3-3 1 2 3 4 5 主/非/ 其 Nitrogen['naitr?d??n] 空气中含量最多的元 素 8O氧养162s2 2p4-2、-1、2主 / 非 / 其 Oxygen['?ksid??n]地壳中最多 9F氟福192s2 2p5-1主 / 非 / 卤 Fluorine['flu?ri:n] 最活泼非金属,不能 被氧化 10Ne氖乃202s2 2p6主 / 非 / 稀 Neon['ni:?n] 稀有 气体 11Na钠那233s11主Sodium['s?udi?m]活泼
/碱 12Mg镁每243s22主 / 碱 土 Magnesium[mæɡ'ni:zi?m] 轻金 属之 一 13Al铝吕273s2 3p13主 / 金 / 其 Aluminum[,ælju'minj?m] 地壳 里含 量最 多的 金属 14Si硅归283s2 3p24主 / 类 Silicon['silik?n] 地壳 中含 量仅 次于 氧 15P磷林313s2 3p3-3、3、5主 / 非 / 其 Phosphorus['f?sf?r?s] 白磷 有剧 毒 16S硫留323s2 3p4-2、4、6主 / 非 / 其 Sulfur['s?lf?] 质地 柔 软, 轻。 与氧 气燃 烧形 成有 毒的 二氧 化硫 17Cl氯绿35.53s2 3p5-1、1、3、 5、7 主 / 非 / 卤 Chlorine['kl?:ri:n] 有毒 活泼
常州优威复合材料有限公司 玻璃钢围栏基本情况介绍 玻璃钢围栏是以拉挤玻璃钢为结构型材配合玻璃钢模压制品组合而成,是性价比最高的围栏, 它具轻质高强,经久耐用,外形美观,安全防盗,不需维护等优点。 玻璃钢围栏的基本组成:由玻璃钢方管或是圆管作为基础的框架结构,使用玻璃钢格栅板作为主要的防护面,然后使用使用各种连接件将各部分连接在一起。 常见的玻璃钢护栏有以下几种结构: 一、采用50-4方管作立柱和上横档,30×20圆管作中横档,波形板作踢脚板,上横档与立柱之间通玻璃钢联结件辅以胶粘剂和插销联成一体,在立柱上中横档相应部位打圆孔,将圆管穿于孔中,并用玻璃钢插销在圆管垂直方向插在立柱中;波形板通过不锈钢抽芯铆钉或塑料铆钉与立柱连接。 二、采用60-4.7方管作立柱,50-4方管作横档,波形板作踢脚板,50-4方管穿在60-4.7方管当中,在配以玻璃钢插销。其它连接参照结构一。 立柱的安装可采用三种形式:1、通过膨胀螺栓固定于基础的侧面;2、在基础的相应部位设预留孔,安装时立柱插于。其中,再用水泥砂浆填平;3、在基础的相应部位预埋铁板,其上焊接竖向铁板,立柱与竖向铁板通过螺丝固定。 玻璃钢护栏的特点:和金属护栏相比,玻璃钢护栏具有耐腐蚀、耐老化、使用寿命长的优点。质量轻、强度高,即使受到超过自抗冲击力的限制,也不会发生不可还原变形或是损坏。 颜色多样,有绿色、黄色、灰色等多种,由于质量轻,所以无论是安装还是切割都十分方便。性能综合全面,经济效益高。 玻璃钢围栏采用玻璃钢为材质,其成型工艺是将浸渍过树脂胶液的连续增强材料等在牵引力的作用下,通过成型模具的挤压,并在模具中和加热系统中受热固化成型,其拥有以下特点:耐腐蚀,不生锈;轻质高强;抗疲劳;颜色鲜艳;抗老化,使用寿命长;优良的电绝缘性能。 根据其优点,玻璃钢围栏的用途也比较广泛:楼梯踏步护栏;平台及走道护栏;化工储罐护栏及化工厂;公路中间及两边护栏,铁路两边护栏;石油操作平台护栏;公园、园林绿化护栏;住宅、小区、别墅护栏;污水处理池护栏;海岸护栏。 常州优威复合材料有限公司主要从事复合材料的研发及生产,如玻璃钢拉挤制品、模压制品(BMC/SMC )、手糊制品等,为相关行业的客户提供高性能、高品质的产品,是集研发、生产、销售为一体的专业复合材料企业。
第8章玻璃的光学性质 玻璃的光学性质是指玻璃的折射、反射、 吸收和透射等性质。玻璃常用作透光材料,因 此对其光学性质的研究在理论上和实践上都具有重要意义。 玻璃是一种高度透明的物质,可以通过调整成 分、着色、光照、热处理、光化学反应以及涂膜等物理和化学方法,获得一系列重要光学性能,以满足各种光学材料对特定的光性能和理化性能的要求。 玻璃的光学性能涉及范围很广。本章仅在可见光范围内(包括近紫外和近红外)讨论玻璃的折射率、色散、反射、吸收和透射(玻璃的着色和脱色在第9章中介绍)。 为了便于讨论玻璃的光学性质,先简略介绍光的本质。外来能源激发物质中的分子或原子,使分子或原子中的外层电子,由低能态跃迁到高能态,当电子跳回到原来状态时,吸收的能量便以光的形式对外产生辐射,此过程就叫发光。光是一种电磁波,具 有一定的波长和频率,且以极高的速度在空间传播(光速约为3 x 108m/s)。可见光、紫外线、红外线以及其他电磁辐射的波长频率范围见图8-1。 从图8-1中可看出,可见光在整个电磁波中只是很窄的一个波段(390~770nm)。在这一狭窄的波段内,存在着各种不同的色光,包括红、橙、黄、绿、青、蓝、紫等光谱。常说的“白光”应该当作“全色光”来理解。棱镜把太阳光分解为七色颜色光的相应波段,每一波段人眼看来是单一的色,叫做单色光,但它不是单一的值,只不过人眼区别颜色的能力有限,看不出单色复杂性而已。 8.1玻璃的折射率 当光照射到玻璃时,一般产生反射、透过和吸收。这 三种基本性质与折射率有关。 玻璃的折射率可以理解为电磁波在玻璃中传播速度的降低(以真空中的光速为准) 。如 果用折射率来表示光速的降低,则: n C/V (8-1 )频率/Hz 图8-1电磁波的频率和波长范围 紫外线 10 波长/nm 「一射线 Xi肘线 无线电腔 幽色
元素周期律 物质熔、沸点高低的判断 1.根据物质在相同条件下的状态。一般熔、沸点:固>液>气, 如:碘单质>汞>CO 2 2.同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。 3.在原子晶体中和离子晶体中,子半径之和越小,熔沸点越高。反之越低。 如熔点:金刚石(C—C)>碳化硅(Si—C)>晶体硅(Si—Si)。 如熔点:KF>KCl>KBr>KI,CaO>KCl。 4.分子晶体中,分子晶体分子间作用力越大(相对原子质量越大)熔沸点越高,反之越低。(具有氢键的分子晶体,熔沸点反常地高,如:H2O>H2Te>H2Se>H2S)。 5.组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸 点越高。如:CH 4<SiH 4 <GeH 4 <SnH 4 。 6.同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔沸点降低。如: CH 3(CH 2 ) 3 CH 3 (正)>CH 3 CH 2 CH(CH 3 ) 2 (异)>(CH 3 ) 4 C(新)。 非金属性强弱判断 1.同周期中,由左到右,随核电荷数的增加,非金属性增强;同主族中,由上到下,随核电荷数的增加,非金属性减弱; 2.依据最高价氧化物的水化物酸性的强弱:酸性越强,其元素的非金属性也越强;3.依据其气态氢化物的稳定性:稳定性越强,非金属性越强; 4.与氢气化合的条件:条件要求越低,非金属性越强; 5.与盐溶液之间的置换反应(以强制弱); 6.与同种物质反应,观察产物的化合价; 例:2Cu+S =Cu 2S Cu+Cl 2 =CuCl 2 所以,Cl的非金属性强于S。 金属性强弱判断 1.同周期中,从左向右,随着核电荷数的增加,金属性减弱;同主族中,从上到下,随着核电荷数的增加,金属性增强; 2.依据最高价氧化物的水化物碱性的强弱:碱性越强,其元素的金属性也越强;3.依据金属活动顺序表(极少数例外); 4.常温下与水、酸反应的剧烈程度;越剧烈,金属性越强。 5.用电化学的方法,在原电池中为负极的金属性强; 6.与盐溶液之间的置换反应以及高温下与金属氧化物间的置换反应(以强制弱);7.金属阳离子得电子能力越强,金属性越弱。;
玻璃钢基本性能 概述 玻璃钢是一种用途广泛的纤维复合材料,是以玻璃纤维为增强材料,以合成树脂为基体复合而成的新型工程材料. 玻璃钢的基本性能十分复杂.不同的玻璃纤维和不同的合成树脂所组成的玻璃钢的性能是不相同的,即使采用同一牌号的玻璃纤维和同一牌号的树脂,只要其间的配比不同,其性能(包括力学、物理、化学方面的性能和静态、动态方面的性能)就不会相同.充分了解玻璃钢的基本性能,才能合理地进行玻璃钢结构设计,用其所长,避其所短.玻璃钢的基本力学性能(包括静态和动态的力学性能)是进行玻璃钢结构设计的重要依据.静态力学性能一般是指玻璃钢在某一初始阶段的力学性能,其中最重要的是强度和弹性性能,动态力学性能与时间有关,例如蠕变、疲劳等是玻璃钢材料随着时间延续,在持久载荷或交变载荷作用下所反映出来的特性;冲击性能则是材料在极短的时间内承受载荷的特性.一般玻璃钢工程结构设计大都是选用静态力学性能参数进行设计.但如果不考虑动态力学性能的影响,很可能十分危险.在选用静态力学性能参数的同时,必须充分考虑动态力学性能对实际结构的影响,选择合适的安全系数. 玻璃钢的主要力学性能大致有如下特点: (1)强度和弹性性能的可设计性.因玻璃钢是由玻璃纤维和合成树脂组成的,所以人们可以通过改变这两个组分材料的配比,和改变玻璃纤维的分布方向,在一定范围内获得不同强度和弹性性能的玻璃钢.例如,对于单向受结构,可以采用单向铺层方式,即可将单向玻璃布或玻璃纤维沿受力方向铺设.这种单向铺层方式能够在纤维方向获得很高的强度,而在垂直于纤维方向,则没有多余的强度储备.又如,对于双向受力的结构;可以采用双向铺层和多向铺层方式,并根据双向受力的大小,采用不同双向纤维量分布.对不同方向选用适当的纤维用量,不仅可以使玻璃钢在不同方向具有不同的强度值,也可以使其具有不同的弹性模量. 上述特点所表现出来的强度和弹性的可设计性,使得从事结构设计的研究者也同时参与到材料的设计中去了,这对于结构设计是十分重要的. (2)各向异性性能,玻璃钢在不同方向上具有不同的力学性能,因此是一种各向异性材料. 玻璃钢是由若干个单层板层合起来,构成一个多层的层合板(壳)结构.每一个单层板在
玻璃的特性 一、玻璃的力學性質 玻璃的理論抗拉強度極限為12000Mpa,實際強度只有理論強度的1/300——1/200,一般為30——60Mpa,玻璃的抗壓強度約為700——1000Mpa。玻璃中的各種缺陷造成了應力集中或薄弱環節,試件尺寸越大缺陷存在的越多。缺陷對抗拉強度的影響非常顯著,對抗壓強度的影響較小。工藝上造成的外來雜質和波筋(化學不均勻部分)對玻璃的強度有明顯影響。在—50——+70℃範圍內玻璃的強度基本不變。 脆性是玻璃的主要缺點。玻璃的脆性指標為1300——1 500(橡膠為0.4——0.6,鋼為400——460,混凝土為4200——9350)。E越大說明脆性越大。玻璃的脆性也可以根據衝擊試驗來確定。 在實際應用中玻璃製品經常受到彎曲、拉伸和衝擊應力,較尐受到壓縮應力。玻璃的力學性質主要指標是抗拉強度和脆性指標。 二、玻璃的光學性質 光學性質是玻璃最重要的物理性質。 光線照射到玻璃表面可以產生透射,反射和吸收三種情況。光線透過玻璃稱為透射,光線被玻璃阻擋,按一定角度反射出來稱為反射,光線通過玻璃後,一部分光能量損失在
玻璃內部稱為吸收。 玻璃中光的透射隨玻璃厚度增加而減尐。玻璃中光的反射對光的波長沒有選擇性,玻璃中光的吸收對光的波長有選擇性。可以在玻璃中加入尐量著色劑,使其選擇吸收某些波長的光,但玻璃的透光性降低。還可以改變玻璃的化學組成來對可見光、紫外線、紅外線、X射線、和γ射線進行選擇吸收。 三、玻璃的熱工性質 玻璃的比熱與其化學組成有關,在室溫範圍內其比經熱的範圍為0.33——1.05×103J/(kg·K)。表7—1玻璃的導熱係數 普通玻璃的導熱係數在室溫下約為0.75W/(m·k)。玻璃的導熱係數約為銅的1/400,是導熱係數較低的材料。當發生溫度變化時,玻璃產生的熱應力很高。在溫度劇烈變化時玻璃會產生碎裂,玻璃的急熱穩定性比急冷穩定性要強一些。 四、玻璃的化學性質 玻璃具有較高的化學穩定性,它可以抵抗除氫氟酸以外所有酸類的侵濁,矽酸鹽玻璃一般不耐鹼。玻璃遭受侵蝕性介質腐蝕,也能導致變質和破壞。 大氣對玻璃侵蝕作用實質上是水氣、二氧化碳、二氧化
各元素物理化学性质 序号符 号 中 文 读音 原子 量 外层 电子 常见化 合价 分类英文名英文名音标其它 1 H 氢轻 1 1s1 1、-1 主/非 /其 Hydrogen ['haidr?d??n] 最轻 2 He 氦害 4 1s2 主/非 /稀 Helium ['hi:li?m] 最难液化 3 Li 锂里7 2s1 1 主/碱Lithium ['liθi?m] 活泼 4 Be 铍皮9 2s2 2 主/碱 土 Beryllium [be'rili?m] 最轻碱土金属元素 5 B 硼朋10.8 2s2 2p1 3 主/类Boron ['b?:r?n] 硬度仅次于金刚石 的非金属元素 6 C 碳探12 2s2 2p2 2、4、-4 主/非 /其 Carbon ['kɑ:b?n] 沸点最高 7 N 氮蛋14 2s2 2p3 -3 1 2 3 4 5 主/非 /其 Nitrogen ['naitr?d??n] 空气中含量最多的 元素 8 O 氧养16 2s2 2p4 -2、-1、2 主/非 /其 Oxygen ['?ksid??n] 地壳中最多 9 F 氟福19 2s2 2p5 -1 主/非 /卤 Fluorine ['flu?ri:n] 最活泼非金属,不能 被氧化 10 Ne 氖乃20 2s2 2p6 主/非 /稀 Neon ['ni:?n] 稀有气体 11 Na 钠那23 3s1 1 主/碱Sodium ['s?udi?m] 活泼 12 Mg 镁每24 3s2 2 主/碱 土 Magnesium [mæɡ'ni:zi?m] 轻金属之一 13 Al 铝吕27 3s2 3p1 3 主/金 /其 Aluminum [,ælju'minj?m] 地壳里含量最多的 金属 14 Si 硅归28 3s2 3p2 4 主/类Silicon ['silik?n] 地壳中含量仅次于 氧 15 P 磷林31 3s2 3p3 -3、3、5 主/非 /其 Phosphorus ['f?sf?r?s] 白磷有剧毒 16 s 硫留32 3s2 3p4 -2、4、6 主/非 /其 Sulfur ['s?lf?] 质地柔软,轻。与氧 气燃烧形成有毒的 二氧化硫 17 Cl 氯绿35.5 3s2 3p5 -1、1、3、 5、7 主/非 /卤 Chlorine ['kl?:ri:n] 有毒活泼 18 Ar 氩亚40 3s2 3p6 主/非 /稀 Argon ['ɑ:ɡ?n] 稀有气体,在空气中 含量最多的稀有气 体 19 K 钾假39 4s1 1 主/碱Potassium [p?'tæsj?m] 活泼,与空气或水接触发生反应,只能储存在煤油中 20 Ca 钙盖40 4s2 2 主/碱 土 Calcium ['kælsi?m] 骨骼主要组成成分
常见化学元素的性质特征或结构特征 一、氢元素 1.核外电子数等于电子层数的原子; 2.没有中子的原子; 3.失去一个电子即为质子的原子; 4.得一个电子就与氦原子核外电子排布相同的原子; 5.质量最轻的原子;相对原子质量最小的原子;形成单质最难液化的元素; 6.原子半径最小的原子; 7.形成的单质为相同条件下相对密度最小的元素; 8.形成的单质为最理想的气体燃料; 9.形成酸不可缺少的元素; 二、氧元素 1.核外电子数是电子层数4倍的原子; 2.最外层电子数是次外层电子数3倍的原子; 3.得到两个电子就与氖原子核外电子排布相同的原子; 4.得到与次外层电子数相同的电子即达到8电子稳定结构的原子; 5.地壳中含量最多的元素; 6.形成的单质是空气中第二多的元素; 7.形成的单质中有一种同素异形体是大气平流层中能吸收太阳光紫外线的元素; 8.能与氢元素形成三核10电子分子(H2O)的元素; 9.能与氢元素形成液态四核18电子分子(H2O2)的元素; 10.在所有化合物中,过氧化氢(H2O2)中含氧质量分数最高;
11.能与氢元素形成原子个数比为1:1或1:2型共价液态化合物的元素; 12.能与钠元素形成阴、阳离子个数比均为1:2的两种离子化合物的元素; 三、碳元素 1.核外电子数是电子层数3倍的原子; 2.最外层电子数是次外层电子数2倍的原子; 3.最外层电子数是核外电子总数2/3的原子; 4.形成化合物种类最多的元素; 5.形成的单质中有一种同素异形体是自然界中硬度最大的物质; 6.能与硼、氮、硅等形成高熔点、高硬度材料的元素; 7.能与氢元素形成正四面体构型10电子分子(CH4)的元素; 8.能与氢元素形成直线型四核分子(C2H2)的元素; 9.能与氧元素形成直线型三核分子(CO2)的元素。 四、氮元素 1.空气中含量最多的元素; 2.形成蛋白质和核酸不可缺少的元素; 3.能与氢元素形成三角锥形四核10电子分子(NH3)的元素; 4.形成的气态氢化物(NH3)能使湿润的蓝色石蕊试纸变红的元素; 5.能与氢、氧三种元素形成酸、碱、盐的元素; 6.非金属性较强,但形成的单质常用作保护气的元素。 五、硫元素 1.最外层电子数是倒数第三层电子数3倍的原子;
玻璃钢(FRP)亦称作GRP,即纤维强化塑料,一般指用玻璃纤维增强不饱和聚脂、环氧树脂与酚醛树脂基体。以玻璃纤维或其制品作增强材料的增强塑料,称谓为玻璃纤维增强塑料,或称谓玻璃钢。由于所使用的树脂品种不同,因此有聚酯玻璃钢、环氧玻璃钢、酚醛玻璃钢之称。质轻而硬,不导电,机械强度高,回收利用少,耐腐蚀。可以代替钢材制造机器零件和汽车、船舶外壳等 采用玻璃钢复合材料的概念是指一种材料不能满足使用要求,需要由两种或两种以上的材料复合在一起,组成另一种能满足人们要求的材料,即复合材料。例如,单一种玻璃纤维,虽然强度很高,但纤维间是松散的,只能承受拉力,不能承受弯曲、剪切和压应力,还不易做成固定的几何形状,是松软体。如果用合成树脂把它们粘合在一起,可以做成各种具有固定形状的坚硬制品,既能承受拉应力,又可承受弯曲、压缩和剪切应力。这就组成了玻璃纤维增强的塑料基复合材料。由于其强度相当于钢材,又含有玻璃组分,也具有玻璃那样的色泽、形体、耐腐蚀、电绝缘、隔热等性能,象玻璃那样,历史上形成了这个通俗易懂的名称“玻璃钢”,这个名词是由原国家建筑材料工业部部长赖际发同志于1958 年提出的,由建材系统扩至全国。玻璃钢的含义就是指玻璃纤维作增强材料、合成树脂作粘结剂的增强塑料,国外称玻璃纤维增强塑料。随着我国玻璃钢事业的发展,作为塑料基的增强材料,已由玻璃纤维扩大到碳纤维、硼纤维、芳纶纤维、氧化铝纤维和碳化硅纤维等,无疑地,这些新型纤维制成的增强塑料,是一些高性能的纤维增强复合材料,再用玻璃钢这个俗称就无法概括了。考虑到历史的由来和发展,通常复合材料,这样一个名称就较全面了。
优点 轻质高强 相对密度在1.5~2.0之间,只有碳钢的1/4~1/5,可是拉伸强度却接近,甚至超过碳素钢,而比强度可以与高级合金钢相比。因此,在航空、火箭、宇宙飞行器、高压容器以及在其他需要减轻自重的制品应用中,都具有卓越成效。某些环氧FRP的拉伸、弯曲和压缩强度均能达到400Mpa以上。 耐腐蚀 FRP是良好的耐腐材料,对大气、水和一般浓度的酸、碱、盐以及多种油类和溶剂都有较好的抵抗能力。已应用到化工防腐的各个方面,正在取代碳钢、不锈钢、木材、有色金属等。 电性能好 是优良的绝缘材料,用来制造绝缘体。高频下仍能保护良好介电性。微波透过性良好,已广泛用于雷达天线罩。 热性能良好 FRP热导率低,室温下为1.25~1.67kJ/(m·h·K),只有金属的1/100~1/1000,是优良的绝热材料。在瞬时超高温情况下,是理想的热防护和耐烧蚀材料,能保护宇宙飞行器在2000℃以上承受高速气流的冲刷。 可设计性好 (1)可以根据需要,灵活地设计出各种结构产品,来满足使用要求,可以使产品有很好的整体性。 (2)可以充分选择材料来满足产品的性能,如:可以设计出耐腐的,耐瞬时高温的、产品某方向上有特别高强度的、介电性好的,等等。 工艺性优良 (1)可以根据产品的形状、技术要求、用途及数量来灵活地选择成型工艺。 (2)工艺简单,可以一次成型,经济效果突出,尤其对形状复杂、不易成型的数量少的产品,更突出它的工艺优越性。 缺点 1.弹性模量低 FRP的弹性模量比木材大两倍,但比钢(E=2.1E5)小10倍,因此在产品结构中常感到
化学元素的一些特殊性质 高中化学 2011-05-02 19:55 一.周期表中特殊位置的元素 ①族序数等于周期数的元素H、Be、Al、Ge。 ②族序数等于周期数2倍的元素C、S。 ③族序数等于周期数3倍的元素O。 ④周期数是族序数2倍的元素Li、Ca。 ⑤周期数是族序数3倍的元素Na、Ba。 ⑥最高正价与最低负价代数和为零的短周期元素C。 ⑦最高正价是最低负价绝对值3倍的短周期元素S。 ⑧除H外,原子半径最小的元素F。 ⑨短周期中离子半径最大的元素P。 二.常见元素及其化合物的特性 ①形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最大的元素C。 ②空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素N。 ③地壳中含量最多的元素、气态氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素O。 ④最轻的单质的元素H ;最轻的金属单质的元素Li 。 ⑤单质在常温下呈液态的非金属元素Br ;金属元素Hg 。 ⑥最高价氧化物及其对应水化物既能与强酸反应,又能与强碱反应的元素Be、Al、Zn。
⑦元素的气态氢化物和它的最高价氧化物对应水化物能起化合反应的元素N;能起氧化还原反应的元素S。 ⑧元素的气态氢化物能和它的氧化物在常温下反应生成该元素单质的元素S。 ⑨元素的单质在常温下能与水反应放出气体的短周期元素Li、Na、F。 ⑩常见的能形成同素异形体的元素C、P、O、S。 ? (2011-04-30 20:09:45) ? (2011-04-30 20:04:35) ? (2011-04-29 09:58:50) ? (2011-04-07 17:33:15) ?(2011-04-06 17:32:47) ? (2011-04-06 16:00:54) ? (2011-04-05 19:26:15) ? (2011-04-04 12:10:35) ? (2011-03-21 10:57:34) ? (2010-05-26 20:21:19)
玻璃钢 玻璃钢(FRP)亦称作GFRP,即纤维强化塑料,一般指用玻璃纤维增强不饱和聚酯、环氧树脂与酚醛树脂基体。以玻璃纤维或其制品作增强材料的增强塑料,称谓为玻璃纤维增强塑料,或称谓玻璃钢,注意与钢化玻璃区别开来。由于所使用的树脂品种不同,因此有聚酯玻璃钢、环氧玻璃钢、酚醛玻璃钢之称。质轻而硬,不导电,性能稳定.机械强度高,回 收利用少,耐腐蚀。可以代替钢材制造机器零件和汽车、船舶外壳等。 玻璃钢学名玻璃纤维增强塑料,俗称FRP(Fiber Reinforced Plastics),即纤维增强复合塑料。根据采用的纤维不同分为玻璃纤维增强复合塑料(GFRP),碳纤维增强复合塑料(CFRP),硼纤维增强复合塑料等。它是以玻璃纤维及其制品(玻璃布、带、毡、纱等)作为增强材料,以合成树脂作基体材料的一种复合材料。纤维增强复合材料是由增强纤维和基体组成。纤维(或晶须)的直径很小,一般在10μm以下,缺陷较少又较小,断裂应变约为千分之三十以内,是脆性材料,易损伤、断裂和受到腐蚀。基体相对于纤维来说,强度、模量都要低很多,但可以经受住大的应变,往往具有粘弹性和弹塑性,是韧性材料。 中文名玻璃钢外文名GFRP称谓玻璃纤维增强塑料俗称FRP 原理 复合材料的概念是指一种材料不能满足使 用要求,需要由两种或两种以上的材料复合在一起,组成另一种能满足人们要求的材料,即复合材料。例如,单一种玻璃纤维,虽然强度很高,但纤维间是松散的,只能承受拉力,不能承受弯曲、剪切和压应力,还不易做成固定的几何形状,是松软体。如果用合成树脂把它们粘合在一起,可以做成各种具有固定形状的坚硬制品,既能承受拉应力,又可承受弯曲、压缩和剪切应力。这就组成了玻璃纤维增强的塑料基复合材料。由于其强度相当于钢材,又含有玻璃组分,也具有玻璃那样的色泽、形体、耐腐蚀、电绝缘、隔热等性能,象玻璃那样,历史上形成了这个通俗易懂的名称“玻 璃钢”,这个名词是由原国家建筑材料工业部部长赖际发同志于1958 年提出的,由建材系 统扩至全国。玻璃钢的含义就是指玻璃纤维作增强材料、合成树脂作粘结剂的增强塑料,国外称玻璃纤维增强塑料。随着我国玻璃钢事业的发展,作为塑料基的增强材料,已由玻璃纤维扩大到碳纤维、硼纤维、芳纶纤维、氧化铝纤维和碳化硅纤维等,无疑地,这些新型纤维制成的增强塑料,是一些高性能的纤维增强复合材料,再用玻璃钢这个俗称就无法概括了。考虑到历史的由来和发展,通常采用玻璃钢复合材料,这样一个名称就较全面了。 分类 玻璃钢产品分类:
元素的性质呈现周期性变化的根本原因-碱金属元素的性质-卤 族元素的性质及递变规律 卤族元素的性质及递变规律 (1)相似性: ①卤素原子最外层都有七个电子,易得到一个电子形成稀有气体元素的稳定结构,因此卤素的负价均为-1价。氯、溴、碘的最高正价为+7价,有的还有+1、+3、+5价,其最高价氧化物及水化物的化学式通式分别为X2O7和HXO4(F除外) ②卤族元素的单质均为双原子分子(X2);均能与H2化合: H 2+X2=2HX;均能与水不同程度反应,其通式(除F2外)为:H2O+X2 HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。 (2)递变性: ①原子序数增大,原子的电子层数增加,原子半径增大,元素的非金属性减弱。 ②单质的颜色逐渐加深从淡黄绿色→黄绿色→深红棕色→紫黑色,状态从气→气→液→固,溶沸点逐渐升高;得电子能力逐渐减弱,单质的氧化性逐渐减弱,与氢气化合由易到难,与水反应的程度逐渐减弱。 ③阴离子的还原性逐渐增强。 ④氢化物的稳定性逐渐减弱。 ⑤最高正价含氧酸的酸性逐渐减弱(氟没有含氧酸)。
元素的性质: 由于核外电子排布的周期性变化,使元素表现出不同的性质。元素性质与原子结构密切相关,主要与原子核外电子排布,特别是最外层电子数有关。 碱金属元素的性质: (1)元素性质同:均为活泼金属元素,最高正价均为+1价异:失电子能力依次增强,金属性依次增强 (2)单质性质同:均为强还原性(均与O2、X2等非金属反应,均能与水反应生成碱和氢气。),银白色,均具轻、软、易熔的特点异:与水(或酸)反应置换出氢依次变易,还原性依次增强,密度趋向增大,熔沸点依次降低,硬度趋向减小 (3)化合物性质 同:氢氧化物都是强碱。过氧化物M2O2具有漂白性,均与水反应产生O2;异:氢氧化物的碱性依次增强。 注:①Li比煤油轻,故不能保存在煤油中,而封存在石蜡中。②Rb,Cs比水重,故与水反应时,应沉在水底。③与O2反应时,Li为 Li2O;Na可为Na2O,Na2O2;K,Rb,Cs的反应生成物更复杂。
铂系元素化学性质 2016-04-19 12:28来源:内江洛伯尔材料科技有限公司作者:研发部 铂系元素铂系元素包括钌、铑、钯、锇、铱、铂6 铂系元素。其中钌、铑、钯的密度约为12 g.cm-3,称为轻铂系金属;锇、铱、铂的密度约为22 g.cm-3金属称为重铂系金属。铂系元素在自然界几乎完全以单质状态存在,高度分散于各种矿石之中,并共生在一起。铂系元素都是稀有金属,它们在地壳中的含量都很小。铂系金属价格昂贵,它们和银、金被称为贵金属。 铂系金属的化学性质表现在以下几个方面: 1、铂系金属对酸的化学稳定性比所有其它各族金属都高。钌和锇,铑和铱对酸的化学稳定性最高,不仅不溶于普通强酸,也不溶于王水中。例如: 3Pt+4HNO3+18HCl→3H2[PtCl6]+4NO+8H2O 钯和铂都能溶于王水,钯还能溶于浓硝酸和热硫酸中。例如: Pd+4HNO3→Pd(NO3)2+2NO2+2H2O 2、在有氧化剂存在时,铂系金属与碱一起熔融,都可以转变成可溶性的化合物。例如: Ru+2KOH+KClO3→ K2RuO4+KCl+H2O 3、铂系金属不和氮作用。室温下对空气、氧等非金属都是稳定的,不作用。高温下才能与氧、硫、磷、氟、氯等非金属作用,生成相应的化合物。室温下只有粉状的锇在空气中会慢慢地被氧化,生成挥发性的四氧化锇OsO4,OsO4的蒸气化,生成挥发性的四氧化锇OsO4,OsO4的蒸气没有颜色,对呼吸道有剧毒,尤其有害于眼睛,会造成暂时失明。 4、铂系金属都有一个特性,即很高的催化活性,金属细粉的催化活性尤其大。大多数铂系金属能吸收气体,特别是氢气。锇吸收氢气的能力最差,钯吸收氢气的能力最强。常温下,钯溶解氢的体积比为1700,在真空中常温下,钯溶解氢的体积比为1:700,在真空中把金属加热到373K,溶解的氢就完全放出。氢在把金属加热到373K,溶解的氢就完全放出。氢在铂中的溶解度很小,但铂溶解氧的本领比钯强,钯吸收氧的体积比为1:0.07,而铂溶解氧的体积钯吸收氧的体积比为1:
玻璃从性质作用上来讲可以分成的几类 一、平板玻璃 平板玻璃是指未经其他加工的平板状玻璃制品,也称白片玻璃或净片玻璃。按生产方法不同,可分为普通平板玻璃和浮法玻璃。平板玻璃是建筑玻璃中生产量最大、使用最多的一种,主要用于门窗,起采光(可见光透射比85%90%)、围护、保温、隔声等作用,也是进一步加工成其他技术玻璃的原片。 平板玻璃按其用途可分为窗玻璃和装饰玻璃。根据国家标准《普通平板玻璃》(GB4871—1995)和《浮法玻璃》(GB11614—89)的规定,玻璃按其厚度可分为以下几种规格: 引拉法生产的普通平板玻璃:2mm、3mm、4mm、5mm四类。 浮法玻璃:3mm、4mm、5mm、6mm、8mm10mm、12mm七类。 引拉法生产的玻璃其长宽比不得大于2.5,其中2、3mm厚玻璃尺寸不得小于400mm×300mm,4、5、6mm厚玻璃不得小于600mm×400mm。浮法玻璃尺寸一般不小于1000mm×1200mm,5、6mm最大可达3000mm×4000mm。 按照国家标准,平板玻璃根据其外观质量进行分等定级,普通平板玻璃分为优等品、一等品和二等品三个等级。浮法玻璃分为优等品、一级品和合格品三个
等级。同时规定,玻璃的弯曲度不得超过0.3%。 二、安全玻璃 安全玻璃是指与普通玻璃相比,具有力学强度高、抗冲击能力强的玻璃。其主要品种有钢化玻璃、夹丝玻璃、夹层玻璃和钛化玻璃。安全玻璃被击碎时,其碎片不会伤人,并兼具有防盗、防火的功能。根据生产时所用的玻璃原片不,安全玻璃具有一定的装饰效果。 (一)钢化玻璃 钢化玻璃又称强化玻璃。它是用物理的或化学的方法,在玻璃表面上形成一个压应力层,玻璃本身具有较高的抗压强度,不会造成破坏。当玻璃受到外力作用时,这个压力层可将部分拉应力抵销,避免玻璃的碎裂,虽然钢化玻璃内部处于较大的拉应力状态,但玻璃的内部无缺陷存在,不会造在成破坏,从而达到提高玻璃强度的目的。 钢化玻璃是平板玻璃的二次加工产品,钢化玻璃的加工可分为物理钢化法和化学钢化法。 (二)、夹丝玻璃 夹丝玻璃也称防碎玻璃或钢丝玻璃。它是由压延法生产的,即在玻璃熔融状态下将经预热处理的钢丝或钢丝网压入玻璃中间,经退火、切割而成。夹丝玻璃
常见矿物物理性质及鉴定特征 自然金:物理性质:颜色和条痕均为金黄色,金属光泽、无解理;硬度2 -3,比重15.6-18.3,纯金为19.3,具有延展性。鉴定特征:金黄色、强金属光泽、比重大、富延展性;在空气中不氧化、化学性质稳定,只溶于王水。 自然硫:物理性质:硫黄色,条痕白色至淡黄色,晶面呈金刚光泽,断口 油脂光泽,透明至半透明。鉴定特征:黄色、油脂光泽、硬度小、性脆,有硫臭味,易溶于CS2,易燃、火焰呈蓝紫色。 石墨:物理性质:铁黑至钢灰色,条痕光亮黑色,金属光泽,隐晶集合体 呈土状者光泽暗淡,不透明。性软,有滑腻感,易污染手指。鉴定特征:铁黑色、条痕亮黑色,一组极完全解理,硬度小、染手。与辉钼矿相似,但辉钼矿具更强的金属光泽、比重稍大,在涂釉瓷板上辉钼矿的条痕色黑中带绿,而石墨的条痕不带绿色。 辉铜矿(Cu2S):物理性质:新鲜面铅灰色,风化表面黑色,常带锖色;条 痕暗灰色;金属光泽,不透明。解理{110}不完全,硬度2.5-3,比重5.5-5.8,略具延展性。鉴定特征:铅灰色,硬度小、弱延展性,小刀刻划可留下光亮沟痕。 方铅矿(PbS):物理性质:铅灰色、条痕黑色,金属光泽。有平行{100} 三组完全解理解理面互相垂直。鉴定特征:铅灰色,黑色条痕,强金属光泽,立方体完全解理,硬度小、比重大。有Pb的被膜反应,溶于HNO ,并 3白色沉淀。 有PbSO 4 闪锌矿(ZnS):物理性质:颜色变化大,从无色到浅黄、棕褐至黑色,随 成分中铁含量的增加而变深,亦有绿、红黄等色、系由微量元素引起;条痕由白色至褐色,松脂光泽至半金属光泽,透明至半透明,具平行{110}的六组完全解理,硬度3.5-4、比重3.9-4.2,不导电。鉴定特征:颜色变化大,可据晶形、多组解理、硬度小鉴别。 辰砂(HgS):物理性质:鲜红色,表面呈铅灰色之锖色;鲜红色条痕;金 刚光泽,半透明。鉴定特征:鲜红色的颜色和条痕,比重大。 黄铜矿(CuFeS2):物理性质:黄铜黄色,表面常有蓝、紫褐色的斑状锖 色;绿黑色条痕;金属光泽,不透明,硬度3-4,比重4.1-4.3,性脆。鉴定特征:黄铜矿与黄铁矿相似,可以其较深的黄铜黄色及较低的硬度区别;以其脆性与自然金区别。 斑铜矿(Cu5FeS4):物理性质:新鲜面呈暗铜红色,风化面常呈暗紫或蓝
卤素元素的化学性质实验报告 一、教学目标 (一)掌握Cl2、Br2、I2的氧化性及Cl-、Br-、I-还原性。 (二)掌握卤素的歧化反应 (三)掌握次氯酸盐、氯酸盐强氧化性 (四)了解氯化氢HCl气体的实验室制备方法 (五)了解卤素的鉴定及混合物分离方法 二、教学的方法及教学手段 讲解法,学生实验法,巡回指导法 三、教学重点 1、区别Cl 2、Br2、I2的氧化性及Cl-、Br-、I-还原性。 2、卤素的歧化反应 3、次氯酸盐、氯酸盐强氧化性 四、教学难点 区别Cl2、Br2、I2的氧化性及Cl-、Br-、I-还原性;卤素的歧化反应;次氯酸盐、氯酸盐的强氧化性 五、实验原理 卤素系ⅦA族元素,包括氟、氯、溴、碘、砹,其价电子构型ns2np5,因此元素的氧化数通常是—1,但在一定条件下,也可以形成氧化数为+1、+3、+5、+7的化合物。卤素单质在化学性质上表现为强氧化性,其氧化性顺序为:F2 > Cl2 > Br2 > I2。所以,Br-能被Cl2氧化为Br2,在CCl4中呈棕黄色。I2能被Cl2、Br2氧化为I2,在CCl4中呈紫色。 卤素单质溶于水,在水中存在下列平衡: X2 + H2O === HX + HXO 这就是卤素单质的歧化反应。卤素的歧化反应易在碱性溶液中进行,且反应产物随着温度和碱液浓度的不同而变化。 卤素的含氧酸有多种形式:HXO、HXO2、HXO3、HXO4。随着卤素氧化数的升高,
其热稳定性增大,酸性增强,氧化性减弱。如氯酸盐在中性溶液中没有明显的强氧化性,但在酸性介质中表现出强氧化性,其次序为:BrO3- > ClO3- > IO3-。次氯酸及其盐具有强氧化性。 HCl的还原性较弱,制备Cl2,必须使用氧化性强的KMnO4、MnO2来氧化Cl-。若使用MnO2,则需要加热才能使反应进行,且可控制反应的速度。 六、仪器与药品 试管及试管夹、量筒(1mL)、酒精灯、滴瓶(5mL)、试剂瓶(500mL)、烧杯(250mL) KBr、KCl、KI、CCl4、H2SO4(浓)、NaOH、NaClO、MnSO4、HCl (浓)、KClO3、AgNO3、溴水、品红、酒精、浓氨水、碘伏水、pH试纸、KI-淀粉试纸、醋酸铅试纸、蓝色石蕊试纸。 七、实验内容 (一)卤素单质的氧化性 ①取几滴KBr溶液于试管中,再加入少量CCl4,滴加氯水,振荡,仔细观察CCl4层颜色的变化; ②取几滴KI溶液于试管中,再加入少量CCl4,滴加氯水,振荡,仔细观察CCl4层颜色的变化; ③取几滴KI溶液于试管中,再加入少量CCl4,滴加溴水,振荡,仔细观察CCl4层颜色的变化; 结论: 1、反应现象: 2、反应方程式包括: 3、卤素单质的氧化性顺序:__________________________________ 。 (二)Cl-、Br-、I-的还原性 ①往干燥试管中加入绿豆粒大小的KCl晶体,再加入0.5mL浓硫酸(浓硫酸不要沾到瓶口处),微热。观察试管中颜色变化,并用湿润的pH试纸检验试管放出的气体。 ②往干燥试管中加入绿豆粒大小的KBr晶体,再加入0.5mL浓硫酸(浓硫酸不要
玻璃钢制品 生活中随处可见的多以金属制品、木材制品、塑料制品、石材制品为主。玻璃钢制品相对于以上几种制品还是比较少见的,但是在许多领域玻璃钢制品已经逐步涉及并渐渐取代这些传统的制品。玻璃钢是一种新型的复合材料,具备着传统的金属、塑料、石材、木材、玻璃等所不具备的性能,并且综合了这些传统制品的优点。 玻璃钢制品的简介: 玻璃钢制品也被叫做玻璃钢复合材料制品,之所以被称谓是复合材料,是因为玻璃钢不是由一种单一的材料制作而成的,而是由两种或者两种以上不同的材料互相组合制作而成的。单一的材料满足不了条件,就可以选择合适的材料加以辅助从而制作出一种新型的产品。这也是玻璃钢制品性能很全面的主要原因。 玻璃钢制品的性能: 1、耐酸碱、耐腐蚀:具有很强的耐腐蚀性能是所有玻璃钢制品所共有的特点,也是最突出的性能之一。 2、耐磨、耐老化:能够在恶劣的腐蚀性环境或是其它一些磨损很大的场合中长期使用。 3、耐高温、阻燃:相对于极易燃烧的木材和导热性很差的金属,玻璃钢这个优点是一个新的突破。 4、不导电、安全性高:玻璃钢制品本身都是绝缘体,不导电、不导热,安全性能极高。 5、使用寿命长:玻璃钢制品的受用寿命一般都在50年以上。 玻璃钢制品的分类: 1、生活类 在日常生活中,玻璃钢制品的用途也十分广泛,如家居生活中的玻璃钢桌子、玻璃钢柜子、玻璃钢椅子、玻璃钢门窗等一些玻璃钢家具。社区花园中的玻璃钢护栏、玻璃钢走道、玻璃钢楼梯踏板,玻璃钢雕塑等等。 2、工业类 在工业中,玻璃钢制品以玻璃钢格栅、玻璃钢化粪池、玻璃钢管道为主,其中格栅板的应用范围最为广泛,如电镀厂、造船厂、化工厂、污水处理厂、电镀设备厂等都使用玻璃钢板材来代替传统的金属板材。再如海上的石油操作平台,玻璃钢操作平台同样以其自身优越的性能取代了金属操作平台。除了以上的三种制品,还有玻璃钢电缆沟盖板、玻璃钢冷却塔、玻璃钢罐、玻璃钢风机、玻璃钢汽车配件等等。 3、环保类 如果将玻璃钢制品进行归类,肯定是属于环保一类的,因为大部分的玻璃钢制品
玻璃的性质 一.目前我们玻璃引进的原材料如下:(共计11种) 1 石英砂230公斤 2 钾长石69.6公斤 3 纯碱69.2公斤 4 碳酸钡31.6公斤 5 硝酸钡20.4公斤 6 碳酸钾18.2公斤 7 白云石14.6公斤 8 硼砂10.3公斤 9 氧化铈 1.3公斤 10 方解石 1.3公斤 11 碎玻璃260公斤 玻璃是熔融.冷却.固态的非结晶(在特种条件下也可以成为晶态)无机物。玻璃的物理化学性质不仅决定于其化学组成,而且与玻璃结构有密切的联系。只有认识玻璃的结构,掌握玻璃组成,结构,性能三者之间的内在联系,才有可能通过改变化学组成,热历史,或利用某些物理,化学处理,制取符合预定要求的物理化学性能的玻璃材料或制品。
二.玻璃的主要性质。 (1)粘度:粘度是玻璃的最主要物理性质之一。在整个玻璃生产工艺过程(熔融,澄清,冷却,成形,退火)所制度的一系列温度制度往往是以此为依据的。 粘度是液态或熔体内部的分子在移动时相互之间的内摩擦力,内摩擦力越大,则分子移动越困难。也就是粘度越大。玻璃的粘度和温度有着密切的关系,温度升高时,粘度随之下降,但是这种变化没有一定的比例关系,通常在高温阶段,粘度的降低速度缓慢,而在低温段则急剧增加。 (2)析晶性能:玻璃是一种非晶态物质,但在一定的条件下,玻璃具有向晶态转化的倾向。在玻璃生产中一般不希望玻璃析晶,因为析晶会造成外观上的缺陷,失去玻璃原有的性质,不能加工成型。析晶是玻璃的缺陷。 (3)光学性能:玻璃对辐射的透射率取决于玻璃中的杂质含量。不含氧化铁的透明玻璃大约能透过90%以上的可见辐射,仅有小部分辐射被玻璃真正吸收,大部分为玻璃两个表面的反射所损失。 (4)密度:玻璃的密度主要决定于玻璃的化学组成,分子量越大的氧化物含量越高时,玻璃的密度也越大。如石英玻璃由SiO2所组成,它的密度最小,约2.2g/立方厘米,而含大量氧化铅的玻璃密度可达6.5g/立方厘米。我们目前生产的钠钙硅玻璃的密度为2.46g/立方厘米。