
知识点总结三·金属的腐蚀与防护
知识点1·金属的腐蚀
1. 金属腐蚀的概念
(1)金属的腐蚀是指金属或合金与周围环境中的物质发生化学反应而腐蚀损耗的现象。 (2)金属腐蚀的实质:金属原子失去电子被氧化的过程,M -ne - === M n+(M 表示金属) (3)金属腐蚀的类型:化学腐蚀和电化学腐蚀
表1 化学腐蚀与电化学腐蚀
2. (1)化学腐蚀:4Fe + 3O 2 + 2nH 2O === 2Fe 2O 3·nH 2O (2)电化学腐蚀:吸氧腐蚀和析氢腐蚀
① 吸氧腐蚀
通常情况下,在潮湿的空气中,钢铁的表面凝结了一层溶有氧气的水膜,这层水膜、铁和铁中存在少量碳单质形成了无数微小的原电池。这些微小的原电池遍布钢铁表面。当周围环境呈若酸性或中性时,发生“吸氧腐蚀”。 负极: ; 正极: 。 总反应: 。
上述电化学腐蚀中吸收氧气,故称为吸氧腐蚀。
② 析氢腐蚀
当钢铁表面水膜呈较强的酸性时,正极析出氢气发生“析氢腐蚀” 负极: ; 正极: 。 总反应: 。
上述电化学腐蚀会生成氢气,故称为析氢腐蚀。 (3)铁锈的生成
铁锈的主要成分:Fe 2O 3·nH 2O
钢铁在中性或弱酸性条件下发生吸氧腐蚀后,生成的氢氧化亚铁会进一步被O 2氧化,生成氢氧化铁,氢氧化铁部分脱水生成Fe 2O 3·nH 2O (铁锈的主要成分)。
主要的化学方程式: 4Fe(OH)2+ 2H 2O+O 2==4Fe(OH)3
2Fe(OH)3== Fe 2O 3 · nH 2O+(3-n)H 2O
知识点2·金属的防护
1. 金属防护的原理
金属腐蚀的实质是金属原子失去电子被氧化的过程。防止金属被腐蚀,就是阻断金属发生氧化反应的途径。 2. 金属防护的常用方法: (1)改变金属组成或结构
如:将铬、镍加入普通钢里制成不锈钢。 (2)在金属表面覆盖保护层
原理:隔绝金属与外界空气、电解质溶液的接触。这样的表面保护常用的方法主要有金属表面涂层保护和镀层保护。 如:在钢铁表面涂上油漆或油脂、覆盖塑料、镀锌等。 (3)电化学防护法
金属的电化学防护是利用电化学原理来保护金属,防止金属腐蚀。
知识点3·金属腐蚀快慢的规律
1. 对同一电解质溶液来说,腐蚀速率的快慢:电解原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀 > 有防腐措施的腐蚀(或者:电解池的阳极 > 原电池负极 > 化学腐蚀 > 原电池正极 > 电解池阴极)
2. 对同一金属来说,在同一溶液中腐蚀速率的快慢:强电解质溶液中 > 若电解质溶液中 > 非电解质溶液中
3. 活动性不同的两种金属,活动性差别越大,腐蚀越快。
4. 对同一种电解质溶液来说,电解质溶液浓度越大,金属腐蚀越快。
5. 纯度越高的金属,腐蚀的速率越慢。
6. 不纯的金属或合金,在潮湿空气中的腐蚀速率远大于在干燥、隔绝空气条件下的腐蚀速率。 防腐措施由好到坏的顺序:
外接电源的阴极保护法 > 牺牲阳极的阴极保护法 > 有一般防腐条件的保护法 > 无防腐条件
补充你的知识点或写出你的疑惑:
化学能与电能的转化·练习题
一、选择题
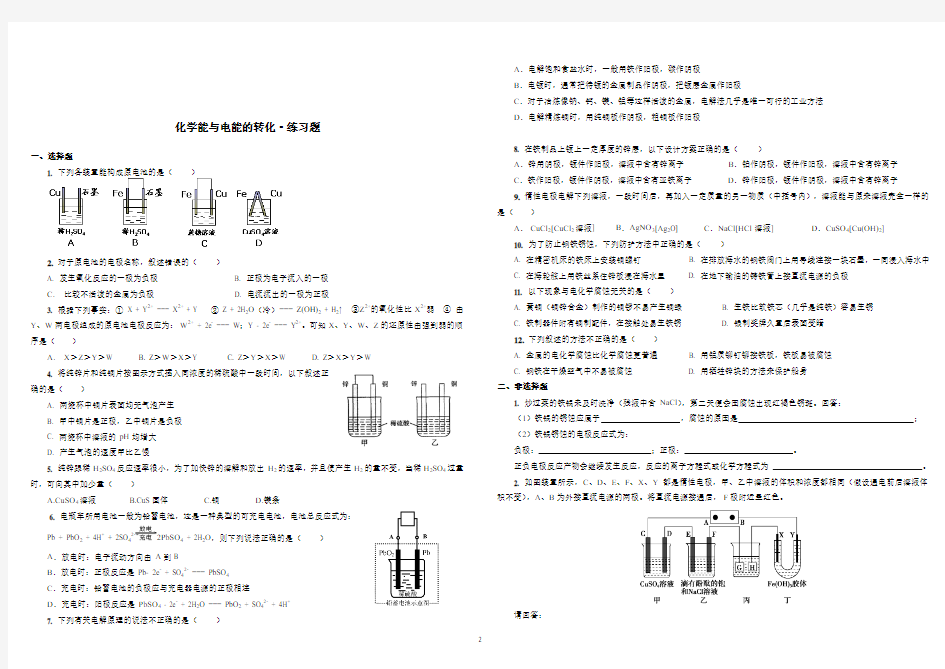
1. 下列各装置能构成原电池的是()
2.对于原电池的电极名称,叙述错误的()
A. 发生氧化反应的一极为负极
B. 正极为电子流入的一极
C.比较不活泼的金属为负极
D. 电流流出的一极为正极
3. 根据下列事实:① X + Y2+ === X2+ + Y ② Z + 2H2O(冷)=== Z(OH)2 + H2↑ ③Z2+的氧化性比X2+弱④由Y、W两电极组成的原电池电极反应为:W2+ + 2e- === W;Y - 2e- === Y2+。可知X、Y、W、Z的还原性由强到弱的顺序是()
A.X>Z>Y>W
B. Z>W>X>Y
C. Z>Y>X>W
D. Z>X>Y>W
4. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正
确的是()
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大
D. 产生气泡的速度甲比乙慢
5. 纯锌跟稀H2SO4反应速率很小,为了加快锌的溶解和放出H2的速率,并且使产生H2的量不变,当稀H2SO4过量时,可向其中加少量()
A.CuSO4溶液
B.CuS固体
C.铜
D.镁条
6. 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
Pb + PbO2 + 4H+ + 2SO42-2PbSO4 + 2H2O,则下列说法正确的是()
A.放电时:电子流动方向由A到B
B.放电时:正极反应是Pb- 2e- + SO42- === PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4 - 2e- + 2H2O === PbO2 + SO42- + 4H+
7. 下列有关电解原理的说法不正确的是()
A.电解饱和食盐水时,一般用铁作阳极,碳作阴极
B.电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极
C.对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法
D.电解精炼铜时,用纯铜板作阴极,粗铜板作阳极
8. 在铁制品上镀上一定厚度的锌层,以下设计方案正确的是()
A.锌用阴极,镀件作阳极,溶液中含有锌离子B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子D.锌作阳极,镀件作阴极,溶液中含有锌离子
9.惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(中括号内),溶液能与原来溶液完全一样的是()
A.CuCl2[CuCl2溶液] B.AgNO3[Ag2O] C.NaCl[HCl溶液] D.CuSO4[Cu(OH)2]
10. 为了防止钢铁锈蚀,下列防护方法中正确的是()
A. 在精密机床的铁床上安装铜螺钉
B. 在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中
C. 在海轮舷上用铁丝系住锌板浸在海水里
D. 在地下输油的铸铁管上接直流电源的负极
11. 以下现象与电化学腐蚀无关的是()
A. 黄铜(铜锌合金)制作的铜锣不易产生铜绿
B. 生铁比软铁芯(几乎是纯铁)容易生锈
C. 铁制器件附有铜制配件,在接触处易生铁锈
D. 银制奖牌久置后表面变暗
12.下列叙述的方法不正确的是()
A. 金属的电化学腐蚀比化学腐蚀更普遍
B. 用铝质铆钉铆接铁板,铁板易被腐蚀
C. 钢铁在干燥空气中不易被腐蚀
D. 用牺牲锌块的方法来保护船身
二、非选择题
1. 炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。回答:
(1)铁锅的锈蚀应属于,腐蚀的原因是;
(2)铁锅锈蚀的电极反应式为:
负极:;正极:。
正负电极反应产物会继续发生反应,反应的离子方程式或化学方程式为。
2. 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
请回答:
(1)B 极是电源的 ,一段时间后,甲中溶液颜色 。
(2)若甲、乙装置中的C 、D 、E 、F 电极均只有一种单质生成时,对应单质的物质的量之比为 。 (3)现用丙装置给铜件镀银,则H 应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。 (4)若将C 电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是 。 答案: 一、选择题
BD 、C 、D 、C 、C 、D 、A 、D 、B 、C 、D 、B 二、非选择题 1.
(1)电化学腐蚀;铁锅材料为铁合金,其中铁和少量碳及NaCl 残液构成原电池; (2)2Fe -4e -=2Fe 2+,2H 2O +O 2+4e -=4OH -,Fe 2++2OH -=Fe(OH)2↓, 4Fe(OH)2+O 2+2H 2O =4Fe(OH)3,2Fe(OH)3+(n -3)H 2O =Fe 2O 3·nH 2O 2.
解析:(1)F 极附近呈红色,说明F 是阴极,E 是阳极,则A 为正极,B 为负极。甲中因Cu 2+放电使溶液颜色变浅。丁中Y 极附近颜色变深,说明Fe(OH)3胶粒向阴极移动,即Fe(OH)3胶粒带正电荷。(2)C 、D 、E 、F 的电极产物分别为O 2、Cu 、Cl 2、H 2,由于电路中通过的电量相等,所以其物质的量之比为1∶2∶2∶2。(3)乙中溶液pH =13,生成n (NaOH)=0.1 mol·L -1×0.5 L =0.05 mol ,电路中通过的电子的物质的量为0.05 mol ,所以丙中镀件上析出银的质量为0.05 mol ×108 g·mol -1=5.4 g 。(4)当活泼金属作阳极时,金属先于溶液中的阴离子放电而溶解,故甲中发生反应的离子方程式为Fe +Cu 2+=====电解
Fe 2++Cu 。
答案:(1)负极 逐渐变浅 氢氧化铁胶体粒子带正电荷 (2)1∶2∶2∶2
(3)镀件 AgNO 3 5.4 g 变小
(4)Fe +Cu 2+
=====电解
Cu +Fe 2+
选修三知识点 第一章原子结构与性质 1能级与能层 ⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。 能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错。说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而
是指这样顺序填充电子可以使整个原子的能量最低。 (2)能量最低原理现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。 (3)泡利(不相容)原理:基态多电子原子中,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli)原理。 (4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund)规则 洪特规则特例:当p、d、f轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。 4.基态原子核外电子排布的表示方法 (1)电子排布式①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K:1s22s22p63s23p64s1。 ②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如K:[Ar]4s1。 ③外围电子排布式(价电子排布式) (2)电子排布图(轨道表示式)是指将过渡元素原子的电子排布式中符合上一周期稀有气体的原子的电子排布式的部分(原子实)或主族元素、0族元素的内层电子排布省略后剩下的式子。每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。如基态硫原子的轨道表示式为 二.原子结构与元素周期表
Unit 3词汇: 1.abuse n./v. 滥用;虐待 drug abuse 吸毒 be badly abused 被虐待 abuse of power 滥用权力 2. stress n. 压力;重音v. 加压力于;使紧张 lay/put/place stress on 把重点放在……上;强调 under the stress of 为……所迫 stress the importance of 强调……的重要性 单项填空 Things can easily go wrong when people are under ________. A.stress B.weight C.load D.strength Some schools _____________ ____(重视)foreign language education 3. ban v. 禁止;取缔n. 禁令 be banned from doing sth. 被禁止做某事there be a ban on... 禁止;禁令 4. quit v. 停止(做某事);离开 quit doing sth. 停止做某事 quit office/one's job 离职 quit oneself of sth.=be quit of sth. 摆脱某事单项填空 He decided to ________ the position after quarreling with the manager. A.stop B.block C.loosen D.quit 5. effect n. 结果;效力 have a good/bad effect on 对……有好/坏的影响 be of no effect 没效果;无用 take effect(法律)生效;(药)奏效 bring/put ...into effect 实施 come/go into effect 生效 in effect 事实上;在实施;生效 side effect 副作用 6. desperate adj. 不顾一切的;绝望的 be desperate for 极需要……;极向往……be desperate to do sth. 非常想做某事do sth. desperately 拼命地做某事 in desperation 绝望地;不顾一切地;拼命地7. disappointed adj. 失望的;沮丧的 be disappointed about/at/in... 对……感到失望 be disappointed to do 做某事失望 be disappointed that... 感到失望…… be disappointing 令人失望的 disappoint sb. 使某人失望 to one's disappointment 令人失望的是 8 ashamed adj. 感到惭愧;羞耻的 be ashamed that... 对……感到羞耻;感到羞愧的是 feel/be ashamed of 对……感到惭愧 feel/be ashamed for sb. 替某人感到羞愧 be ashamed to do sth. 耻于做某事 be ashamed of oneself 为自己感到惭愧 It's a shame that... ……遗憾 What a shame that... ……多么遗憾 (1)She ____________________________ (因考试不及格而感到羞愧). (2)I ________________________(不好意思寻求帮助). (3)________________(真是太遗憾了)that you can’t stay with us. 9.due to由于…… (不置于句首) be due to do sth. 预期做某事 be due for sth. 应有;得到 be due to (doing) sth./ sb. 归因于(做)某事/某人 1)The meeting_______________________(预定到3点钟才开始). (2)His absence_______________________(因为暴雨). 10. be/become addicted to 对……有瘾。后接doing addict oneself to 沉迷于;醉心于addiction to... 对……上瘾;习惯于 a video game addict 游戏迷 (1)He ______________________(对毒品已严重上瘾了). (2)Kids ________________________(迷上电脑游戏)are often upset.
第三章 水溶液中的离子平衡 一、弱电解质的电离 1、定义:电解质:在水溶液中或熔化状态下能导电的化合物, 非电解质 :在水溶液中或熔化状态下都不能导电的化合物 强电解质 : 在水溶液里全部电离成离子的电解质 弱电解质: 在水溶液里只有一部分分子电离成离子的电解质 。 ! 2、电解质与非电解质本质区别: 电解质——离子化合物或共价化合物 非电解质——共价化合物 注意:①电解质、非电解质都是化合物 ②SO 2、NH 3、CO 2等属于非电解质 ③强电解质不等于易溶于水的化合物(如BaSO 4不溶于水,但溶于水的BaSO 4全部电离,故BaSO 4为强电解质)——电解质的强弱与导电性、溶解性无关。 3、影响电离平衡的因素: A 、温度:电离一般吸热,升温有利于电离。 B 、浓度:浓度越大,电离程度 越小 ;溶液稀释时,电离平衡向着电离的方向移动。 C 、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会 减弱 电离。 D 、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。 4、电离方程式的书写:用可逆符号 弱酸的电离要分布写(第一步为主) 5、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。叫做电离平衡常数,(一般用Ka 表示酸,Kb 表示碱。 ) — 表示方法:AB A ++B - Ki=[ A +][ B -]/[AB] 6、影响因素: a 、电离常数的大小主要由物质的本性决定。 b 、电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。 C 、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。如:H 2SO 3>H 3PO 4>HF>CH 3COOH>H 2CO 3>H 2S>HClO 二、水的电离和溶液的酸碱性 1、水电离平衡:: 水的离子积:K W = c[H +]·c[OH -] 25℃时, [H +]=[OH -] =10-7 mol/L ; K W = [H +]·[OH -] = 1*10-14 注意:K W 只与温度有关,温度一定,则K W 值一定 ; 物质 单质 @ 化合物 电解质 非电解质: 非金属氧化物,大部分有机物 。如SO 3、CO 2、C 6H 12O 6、CCl 4、CH 2=CH 2…… 强电解质: 强酸,强碱,大多数盐 。如HCl 、NaOH 、NaCl 、BaSO 4 弱电解质: 弱酸,弱碱,极少数盐,水 。如HClO 、NH 3·H 2O 、Cu(OH)2、H 2 O …… 混和物 纯净物
高中化学选修三知识点总结 第一章原子结构与性质 1、电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图。离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小。 2、电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q. 3、原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7。 4、原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子。 5、原子核外电子排布原理: (1)能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道;
(2)泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子;(3)洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同。 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1 6、根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。 根据构造原理,可以将各能级按能量的差异分成能级组如图⑵所示,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。基态原子核外电子的排布按能量由低到高的顺序依次排布。 7、第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号I1表示,单位为kJ/mol。 (1)原子核外电子排布的周期性 随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化: 每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到 ns2np6的周期性变化.
Part 1. Warming up Part 2. Pre-reading, reading and comprehending 1.I thought,at the time,that this was just a story but then I witnessed it with my own eyes many time.我当时认为这只是个故事,但是后来我却多次亲眼目睹了这样的事情。 witness vt.目睹;目击;为……作证 句型witness to (doing/having done) sth.证明某事;证实做了某事 Police are appealing to any driver who may have witnessed the accident.警方正呼吁曾目睹这事故的司机出面作证。 The 1980s witnessed increasing unemployment throughout Europe.20世纪80年代是全欧洲失业日益加剧的年代。 Her principal was called to witness to her good character.她的校长被传唤来证明她优良的品质。The driver witnessed to having seen the man enter the building.司机作证说,他看到此人进入那栋建筑物。 n.证据;目击者 He has been a witness to a terrible murder.他目击了一起残忍的凶杀事件。 His good health is a witness to the success of the treatment.他身体健康证明这种疗法是成功的。 2.One afternoon I arrived at the station, as I was sorting out my accommodation, I heard a loud noise coming from the bay. 归纳总结 accommodation n.住处;停留处;和解,调解;(pl.)住宿,膳宿 (1)make accommodations for...为……提供膳宿 book accommodation at a hotel向旅馆预订房间 arrange sb.’s accommodation给某人安排住处 (2)accommodate vt.向……提供住宿(或膳宿);容纳;为……提供空间;考虑到;顾及;帮忙;给……提供方便;顺应,适应(新情况) accommodate...to=adapt...to使……适应 accommodate oneself to=adapt (oneself) to适应;顺应 accommodate sb.with sth.=supply sb.with sth. 即学即用 (1)客座艺术家们只好自掏腰包支付食宿费用。 Guest artists have to pay for their own accommodations and meals. (2)旅馆房间不足。The hotel accommodation is scarce. (3)这幢房子可容纳两家人居住。The house can accommodate two families (4)银行将提供一笔贷款给你。The bank will accommodate you with a loan. (5)你必须使自己适应形势。You will have to accommodate yourself to the situation. 3.We ran down to the shore in time to see an enormous animal opposite us throwing itself out of the water and then crashing down again. 搭配opposite to…在……的对面;与……相反 I sat opposite to him during the meal. 吃饭的时候我坐在他的对面。 The result was opposite to what we expected. 结果与我们所预料的正好相反。see...doing... 看见……正在做……;throwing itself out of the water and then crashing down again在句中作宾语补足语,与宾语an enormous animal存在逻辑上的主谓关系,所以用现在分词形式。 I saw the little child crossing the street.我看见那个小孩儿在过马路。 (1)在感官动词see, hear, look at, notice, observe, feel, find等及使役动词have, make, leave, keep, get等后既可以用不定式也可以用动词-ing形式作宾语补足语。不定式(不带to)表示过程或动
高一化学必修三知识点归纳 【原子结构与性质】 1能级与能层 ⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。 能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错。说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。 (2)能量最低原理现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。 (3)泡利(不相容)原理:基态多电子原子中,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli)原理。 (4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund)规则 洪特规则特例:当p、d、f轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。 4.基态原子核外电子排布的表示方法 (1)电子排布式①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K:1s22s22p63s23p64s1。 ②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如K:[Ar]4s1。 ③外围电子排布式(价电子排布式) (2)电子排布图(轨道表示式)是指将过渡元素原子的电子排布式中符合上一周期稀有气体的原子的电子排布式的部分(原子实)或主族元素、0族元素的内层电子排布省略后剩下的式子。每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。如基态硫原子的轨道表示式为 二.原子结构与元素周期表 1.一个能级组最多所容纳的电子数等于一个周期所包含的元素种类2n2。但一个能级组不一定全部是能量相同的能级,而是能量相近的能级。 2.元素周期表的分区 (1)根据核外电子排布 确定元素在周期表中位置的方法 ?若已知元素序数Z,找出与之相近上一周期的惰性气体的原子序数R,先确定其周期数。再根究Z—R的值,确定元素所在的列,依照周期表的结构数出所在列对应的族序数。 ③若已知元素的外围电子排布,可直接判断该元素在周期表中的位置。如:某元素的外围电子排布为4s24p4,由此可知,该元素位于p区,为第四周期ⅥA族元素。即能层为其周期数,最外层电子数为其族序数,但应注意过渡元素(副族与第Ⅷ族)的能层为其周期数,外围电子数应为其纵列数而不是其族序数(镧系、锕系除外)。 (2)主族元素价电子数=族序数,副族元素IIIB--VIII族价电子数=族序数IB,IIB价电子的最外层数=族序数 (3)各区元素化学性质及原子最外层电子排布特点 S区ns1-2p区ns2np1-6、d区(n-1)d1-9ns1-2、ds区(n-1)d10ns1-2 三.元素周期律
Unit 3 词汇: 1.abuse n./v.滥用;虐待 drug abuse 吸毒 be badly abused 被虐待 abuse of power 滥用权力 2.stress n. 压力;重音 v. 加压力于;使紧张 lay/put/place stress on 把重点放在??上;强调 under the stress of 为??所迫 stress the importance of 强调??的重要 性 单项填空 Things can easily go wrong when people are under ________. A . stress B.weight C.load D.strength Some schools _________________( 重视)foreign language education 3.ban v. 禁止;取缔n. 禁令 be banned from doing sth.被禁止做某事 there be a ban on... 禁止;禁令 4. quit v. 停止 (做某事 );离开 quit doing sth.停止做某事 quit office/one's job离职 quit oneself of sth. = be quit of sth. 摆脱某事 单项填空 He decided to ________ the position after quarreling with the manager. A . stop B . block C . loosen D. quit 5. effect n. 结果;效力 have a good/bad effect on 对??有好 / 坏的 影响 be of no effect 没效果;无用 take effect(法律 )生效; (药 )奏效 bring/put ...into effect 实施 come/go into effect 生效 in effect 事实上;在实施;生效 side effect 副作用 6. desperate adj. 不顾一切的;绝望的 be desperate for 极需要??;极向往?? be desperate to do sth. 非常想做某事 dosth. desperately 拼命地做某事in desperation 绝望地;不顾一切地;拼命地7. disappointed adj. 失望的;沮丧的 be disappointed about/at/in... 对??感到失望 be disappointed to do 做某事失望 be disappointed that... 感到失望?? be disappointing 令人失望的 disappoint sb. 使某人失望 to one's disappointment 令人失望的是 8 ashamed adj. 感到惭愧;羞耻的 be ashamed that... 对??感到羞耻;感到羞愧的是 feel/be ashamed of 对??感到惭愧 feel/be ashamed for sb. 替某人感到羞愧 be ashamed to do sth. 耻于做某事 be ashamed of oneself 为自己感到惭愧 It's a shame that...遗憾?? What a shame that...多么??遗憾 (1)She ____________________________ (因考试不及格而感到羞愧). (2)I________________________( 不好意思 寻求帮助 ). (3)________________( 真是太遗憾了 )that you can’t stay with us. 9.due to 由于??(不置于句首 ) be due to do sth. 预期做某事 be due for sth. 应有;得到 be due to (doing) sth./ sb.归因于(做)某事/某人 1)The meeting_______________________( 预定到 3 点钟才开始 ). (2)His absence_______________________( 因为暴雨). 10.be/become addicted to 对??有瘾。后接 doing addict oneself to 沉迷于;醉心于 addiction to... 对??上瘾;习惯于 a video game addict 游戏迷 (1)He ______________________( 对毒品已严重上瘾了 ). (2)Kids ________________________( 迷上电脑游戏 )are often upset. 11. be/get/become accustomed to习惯
高中化学选修3知识点全部归纳(物质的结构与性质) ▼第一章原子结构与性质. 一、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义. 1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小. 电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q. 原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7. 2.(构造原理) 了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布. (1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子. (2).原子核外电子排布原理. ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道. ②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子. ③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1. (3).掌握能级交错图和1-36号元素的核外电子排布式. ①根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。 ②根据构造原理,可以将各能级按能量的差异分成能级组如图⑵所示,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。基态原子核外电子的排布按能量由低到高的顺序依次排布。 3.元素电离能和元素电负性 第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号I1表示,单位为kJ/mol。 (1).原子核外电子排布的周期性. 随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化. (2).元素第一电离能的周期性变化. 随着原子序数的递增,元素的第一电离能呈周期性变化: ★同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属的第一电离能最小; ★同主族从上到下,第一电离能有逐渐减小的趋势.
化学选修三知识点总结 第一章原子结构与性质. 一、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义. 1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小. 电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q. 原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7. 2.(构造原理) 了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布. (1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子.
(2).原子核外电子排布原理. ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道. ②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子. ③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1. (3).掌握能级交错图和1-36号元素的核外电子排布式. ①根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。 ②根据构造原理,可以将各能级按能量的差异分成能级组如图⑵所示,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。基态原子核外电子的排布按能量由低到高的顺序依次排布。 3.元素电离能和元素电负性 第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号I1表示,单位为kJ/mol。 (1).原子核外电子排布的周期性.
U3(选修六) 1.abuse n. ○1滥用,妄用;虐待,辱骂○2弊病,陋习 vt. 滥用,妄用,虐待 e.g. He abused his power while in office.他在职时滥用权力。 Those captives were physically abused.那些俘虏遭受了肉体上的摧残 drug abuse 滥用毒品 child abuse 虐待儿童 abuse one’s position / power滥用职权/权利 abuse a privilege滥用特权 2. stress 1)n.○1压力; 重音,重读 be under (the) stress (of) 在压力下 suffer from stress遭受压力 The stresses and strains of modern life现代生活的压力和紧张. ○2强调, 重要性 e.g. Some school lay / put /place stress on foreign language education. 2)vt. 加压力于; 重读; 强调 e.g. He stressed the importance of the task. 3.ban 1)n.禁令,禁止 a ban on sth 2)vt.禁止, 取缔 ban sb. from (doing) sth. 颁布禁令 Put/impose a ban 颁发/解除禁令 lift a ban确立禁令 e.g. Our government has put/ imposed a ban on plastic bags. 4. due to 归因于, 归功于 e.g. The accident is due to your careless driving. 那意外事故归因于你驾驶不小心。be due to do sth定于某时做某事 e.g. He is due to speak at the meeting tomorrow(可以被caused by 所代替) The train is due in five minutes.(预定的,预期的) My rent isn’t due till Wednesday.(到期的,立即支付的) In due course 在适当的时候 after due consideration经适当考虑之后
高中化学选修3知识点总结 主要知识要点: 1、原子结构 2、元素周期表和元素周期律 3、共价键 4、分子的空间构型 5、分子的性质 6、晶体的结构和性质 (一)原子结构 1、能层和能级 (1)能层和能级的划分 ①在同一个原子中,离核越近能层能量越低。 ②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。 ③任一能层,能级数等于能层序数。 ④s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍。 ⑤能层不同能级相同,所容纳的最多电子数相同。 (2)能层、能级、原子轨道之间的关系 每能层所容纳的最多电子数是:2n2(n:能层的序数)。
2、构造原理 (1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。 (2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。 (3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、 E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。 原子轨道的能量关系是:ns<(n-2)f <(n-1)d <np (4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目。 根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8个电子;次外层不超过18个电子;倒数第三层不超过32个电子。 (5)基态和激发态 ①基态:最低能量状态。处于最低能量状态的原子称为基态原子。 ②激发态:较高能量状态(相对基态而言)。基态原子的电子吸收能量后,电子 跃迁至较高能级时的状态。处于激发态的原子称为激发态原子。 ③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和放出 (激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原 子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或利用特征谱线鉴定 元素。 3、电子云与原子轨道
化学必修一知识点总结
作者:日期:
从实验学化学一、化学实验安全 1、 (1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。 (2 )烫伤宜找医生处理。 (3)浓酸撒在实验台上,先用Na2CD 3 (或Na HCO 3)中和,后用水冲擦干净。浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀NaHZ O 3溶液淋洗,然后请医生处理。 (4 )浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。(5 )钠、磷等失火宜用沙土扑盖。 (6)酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。 二.混合物的分离和提纯 分离和提纯的方法 分离的物质 应注意的事项 应用举例 过滤用于固液混合的分离一贴、二低、三靠如粗盐的提纯 蒸馏提纯或分离沸点不同的液体混合物防止液体暴沸,温度计水银球的位置,
如石油的蒸馏中冷凝管中水的流向如石油的蒸馏
萃取利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶 质从它与另一种溶剂所组成的溶液中提取出来的方法选择的萃取 剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂用四氯化碳萃取溴水里的溴、碘 分液分离互不相溶的液体打开上端活塞或使活塞上的凹槽与漏斗 上的水孔,使漏斗内外空气相通。打开活塞,使下层液体慢慢流出,及时关闭活塞,上层液体由上端倒出如用四氯化碳萃取溴水里的溴、碘后再分液蒸发和结晶用来分离和提纯几种可溶性固体的混合物加热蒸发皿 使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热分离NaCI和KN03昆合物 三、离子检验 离子所加试剂现象离子方程式 C I —AgN03、稀HN 03 产生白色沉淀Cl— + A g+二AgClJ SO42-稀HCI、BaC12 白色沉淀SO42-+Ba2 += Ba S 04; 四、除杂 注意事项:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去。 五、物质的量的单位——摩尔 1. 物质的量(n)是表示含有一定数目粒子的集体的物理量。 2.摩尔(mol ):把含有6. 0 2 X 1 0 2 3个粒子的任何粒子集体计量为1摩
选修6 Unit 1 Art 核心单词 1. faith n. 信任;信念;信心 常用结构: break one’s faith with sb. 对某人不守信用 keep faith with sb. 守信于某人 lose faith in 不再信任 have faith in 相信; 信任 in good/bad faith 真心诚意/虚情假意 After repeated failure, he lost faith in himself.不断的失败之后,他对自己失去了信心。 Faith can remove mountains. 信仰能移山。 Never break faith, or you will lose all your friends. 不要背信弃义,否则你将失去所有的朋友。 2. aim n. 目标;目的 vi.&vt. 瞄准;(向某方向)努力 What is your aim in life?你生活的目标是什么? 常用结构: take aim (at) 瞄准…… aim at 向……瞄准;旨在,针对 aim high 胸怀大志;心气很高 He aimed the gun at the enemy officer.他用枪瞄准了敌人的军官。 Our factory must aim at developing new models of machines.我们的工厂必须致力于研制新型机械。 3. consequently adv.&conj. 所以,因而(=therefore) Mr Foster has never been to China. Consequently he knows very little about it. 福斯特先生从未去过中国,所以对中国了解得很少。 联想拓展 be consequent on/upon 因……引起的; consequence n. 后果;结果;重要性 be of consequence 重要的 as a consequence=as a result 结果 in consequence 由于 as a consequence of=as a result of作为……的结果 in consequence of 由于;作为……的结果 He is a man of great consequence. 他是一个重要的人物。 4. possession n. (尤作复数)所有;财产 常用结构: in possession of sth.拥有/占有某物 in the possession of/in one’s possession 被……拥有 take/gain/get/have possession of sth.拥有某物 When his father died, he came into possession of a large fortune. 父亲死后,他拥有了一大笔遗产。 The people had to gather up their few possessions and escape from the hills. 人们不得不收拾仅有的财产,逃下山去。联想拓展 possess vt. 拥有;具有;支配 5. concentrate
高中化学选修3知识点总结 二、复习要点 1、原子结构 2、元素周期表和元素周期律 3、共价键 4、分子的空间构型 5、分子的性质 6、晶体的结构和性质 (一)原子结构 1、能层和能级 (1)能层和能级的划分 ①在同一个原子中,离核越近能层能量越低。 ②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。 ③任一能层,能级数等于能层序数。 ④s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍。 ⑤能层不同能级相同,所容纳的最多电子数相同。 (2)能层、能级、原子轨道之间的关系 每能层所容纳的最多电子数是:2n2(n:能层的序数)。 2、构造原理 (1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。 (2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。
(3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。原子轨道的能量关系是:ns<(n-2)f <(n-1)d <np (4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目。 根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8个电子;次外层不超过18个电子;倒数第三层不超过32个电子。 (5)基态和激发态 ①基态:最低能量状态。处于最低能量状态的原子称为基态原子。 ②激发态:较高能量状态(相对基态而言)。基态原子的电子吸收能量后,电子跃迁至较高能级时的状态。处于激发态的原子称为激发态原子。 ③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和放出(激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或利用特征谱线鉴定元素。 3、电子云与原子轨道 (1)电子云:电子在核外空间做高速运动,没有确定的轨道。因此,人们用“电子云”模型来描述核外电子的运动。“电子云”描述了电子在原子核外出现的概率密度分布,是核外电子运动状态的形象化描述。 (2)原子轨道:不同能级上的电子出现概率约为90%的电子云空间轮廓图称为原子轨道。s电子的原子轨道呈球形对称,ns能级各有1个原子轨道;p电子的原子轨道呈纺锤形,n p能级各有3个原子轨道,相互垂直(用p x、p y、p z表示);n d能级各有5个原子轨道;n f能级各有7个原子轨道。 4、核外电子排布规律 (1)能量最低原理:在基态原子里,电子优先排布在能量最低的能级里,然后排布在能量逐渐升高的能级里。 (2)泡利原理:1个原子轨道里最多只能容纳2个电子,且自旋方向相反。 (3)洪特规则:电子排布在同一能级的各个轨道时,优先占据不同的轨道,且自旋方向相同。 (4)洪特规则的特例:电子排布在p、d、f等能级时,当其处于全空、半充满或全充满时,即p0、d0、f0、p3、d5、f7、p6、d10、f14,整个原子的能量最低,最稳定。 能量最低原理表述的是“整个原子处于能量最低状态”,而不是说电子填充到能量最低的轨道中去,泡利原理和洪特规则都使“整个原子处于能量最低状态”。 电子数 (5)(n-1)d能级上电子数等于10时,副族元素的族序数=n s能级电子数 (二)元素周期表和元素周期律 1、元素周期表的结构 元素在周期表中的位置由原子结构决定:原子核外的能层数决定元素所在的周期,原子的价电子总数决定元素所在的族。 (1)原子的电子层构型和周期的划分 周期是指能层(电子层)相同,按照最高能级组电子数依次增多的顺序排列的一行元素。即元素周期表中的一个横行为一个周期,周期表共有七个周期。同周期元素从左到右(除稀有气体外),元素的金属性逐渐减弱,非金属性逐渐增强。 (2)原子的电子构型和族的划分 族是指价电子数相同(外围电子排布相同),按照电子层数依次增加的顺序排列的一列元素。即元素周期表中的一个列为一个族(第Ⅷ族除外)。共有十八个列,十六个族。同主族周期元素从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。 (3)原子的电子构型和元素的分区 按电子排布可把周期表里的元素划分成5个区,分别为s区、p区、d区、f区和ds区,除ds区外,区的名称来自按构造原理最后填入电子的能级的符号。 2、元素周期律