
晶体的类型与性质
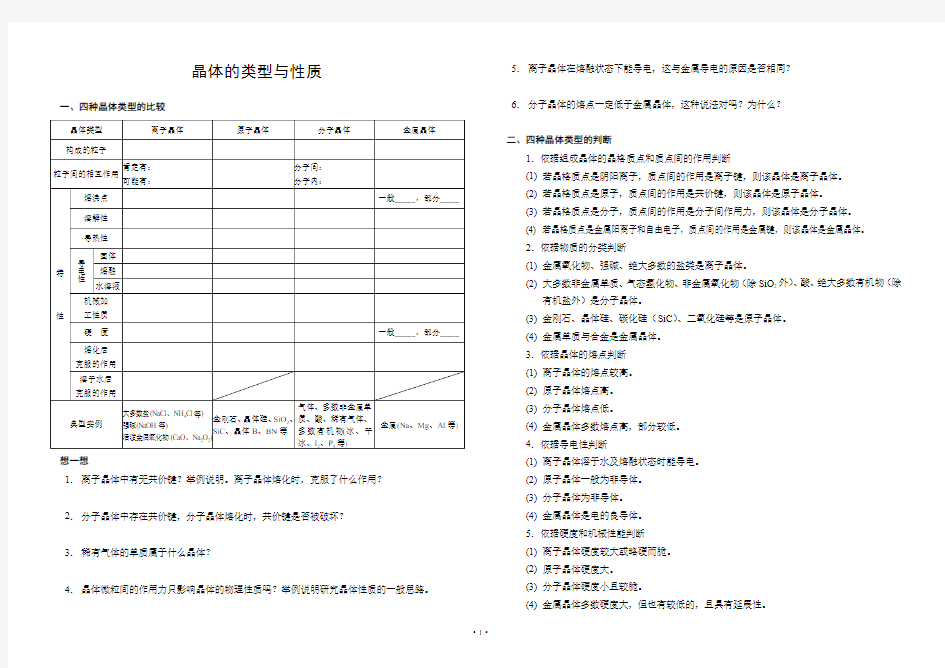
一、四种晶体类型的比较
想一想
1.离子晶体中有无共价键?举例说明。离子晶体熔化时,克服了什么作用?
2.分子晶体中存在共价键,分子晶体熔化时,共价键是否被破坏?
3.稀有气体的单质属于什么晶体?
4.晶体微粒间的作用力只影响晶体的物理性质吗?举例说明研究晶体性质的一般思路。
5.离子晶体在熔融状态下能导电,这与金属导电的原因是否相同?
6.分子晶体的熔点一定低于金属晶体,这种说法对吗?为什么?
二、四种晶体类型的判断
1.依据组成晶体的晶格质点和质点间的作用判断
(1)若晶格质点是阴阳离子,质点间的作用是离子键,则该晶体是离子晶体。
(2)若晶格质点是原子,质点间的作用是共价键,则该晶体是原子晶体。
(3)若晶格质点是分子,质点间的作用是分子间作用力,则该晶体是分子晶体。
(4)若晶格质点是金属阳离子和自由电子,质点间的作用是金属键,则该晶体是金属晶体。
2.依据物质的分类判断
(1)金属氧化物、强碱、绝大多数的盐类是离子晶体。
(2)大多数非金属单质、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除
有机盐外)是分子晶体。
(3)金刚石、晶体硅、碳化硅(SiC)、二氧化硅等是原子晶体。
(4)金属单质与合金是金属晶体。
3.依据晶体的熔点判断
(1)离子晶体的熔点较高。
(2)原子晶体熔点高。
(3)分子晶体熔点低。
(4)金属晶体多数熔点高,部分较低。
4.依据导电性判断
(1)离子晶体溶于水及熔融状态时能导电。
(2)原子晶体一般为非导体。
(3)分子晶体为非导体。
(4)金属晶体是电的良导体。
5.依据硬度和机械性能判断
(1)离子晶体硬度较大或略硬而脆。
(2)原子晶体硬度大。
(3)分子晶体硬度小且较脆。
(4)金属晶体多数硬度大,但也有较低的,且具有延展性。
三、物质熔沸点高低的比较规律
物质熔沸点的高低与构成该物质的晶体类型及晶体内部质点间的作用有关,其规律如下:
(1)不同晶体类型的熔沸点高低规律
一般为:原子晶体>离子晶体>分子晶体。金属晶体的熔沸点有的很高(如钨),有的很低(如Hg)。
(2)同属原子晶体
可通过比较原子半径的大小确定熔沸点的高低,一般半径越小,熔沸点越高(原子半径越小,键长越______,键能越_____)。
例如:金刚石(C—C)>二氧化硅(Si—O)>碳化硅(Si—C)>晶体硅(Si—Si)
(3)同属离子晶体
离子所带电荷越高,离子半径越小,则离子键越强,熔沸点越高。
例如:MgO>CaO NaCl>KCl>RbCl>CsCl
(4)同属金属晶体
金属阳离子所带电荷越高,半径越小,金属键越强,熔沸点越高。
例如:Al>Mg>Na。
(5)同属分子晶体
分子间作用力越强,沸点越高。
①组成和结构相似的分子晶体,一般相对分子质量越大,分子间作用力越强,沸点越高。
例如:I2>Br2>Cl2>F2。
②组成和构成不相似的物质,分子的极性越大,沸点越高。
例如:CO>N2。
③同分异构体之间
a.一般是支链越多,沸点越低。
例如:正戊烷>异戊烷>新戊烷。
b.结构越对称,沸点越低。
例如:邻二甲苯>间二甲苯>对二甲苯。
④若分子间有氢键,则分子间作用力比结构相似的同类晶体大,故沸点较高。
例如:HF>HI>HBr>HCl H2O>H2Te>H2Se>H2S
⑤根据在相同条件下物质的状态不同,
例如:固体>液体>气体S>Hg>O2 P2O5>H2O>CO2 五、离子晶体中的特例
1.离子晶体中不一定都含有金属元素,如NH4Cl是离子晶体。
2.离子晶体的熔点不一定低于原子晶体,如MgO是离子晶体,熔点是2800℃;而SiO2是原子晶体,熔点是1732℃,MgO的熔点高于SiO2的熔点。
3.离子晶体中一定含离子键,可能含其他化学键,如NaOH、Na2O2、NH4Cl等。
4.由金属元素和非金属元素组成的晶体不一定是离子晶体,如AlCl3是由金属元素Al和非金属元素Cl组成的分子晶体。含有金属离子的晶体不一定是离子晶体,如金属晶体中含有金属阳离子。
六、用均摊法确定晶体的化学式
均摊是指每个图形平均拥有的粒子数目。求晶体中粒子个数比的方法是:
1.处于顶点的粒子,同时为8个晶胞所共有,每个粒子有1/8属于该晶胞;
2.处于棱上的粒子,同时为4个晶胞共有,每个粒子有1/4属于该晶胞;
3.处于面上的粒子,同时为2个晶胞共有,每个粒子有1/2属于该晶胞;
4.处于晶胞内部的粒子,则完全属于该晶胞。
例如:右图晶体的一个晶胞中,有c粒子:
1
1214
4
?+=个,有d粒子:
11
864
82
?+?=个;c∶d = 1∶1,晶体的化学式为cd或dc。
七、中学阶段需要掌握的几种晶体模型
1.氯化钠晶体(离子晶体)
在氯化钠晶体中:
(1) 与每个Na+等距紧邻的Cl-有_______个,与每个Cl-等距紧邻的Na+
有______个。
(2) 与每个Na+等距紧邻的Na+有_____个,与每个Cl-等距紧邻的Cl-有
______个。
(3) 每个氯化钠晶胞中独立占有______个Na+,______个Cl-,即_______
个NaCl。
(4) Na+与其等距紧邻的6个Cl-围成的空间构型为__________________。
(5) 晶胞边长a与离子半径(
Na
r
+
、
Cl
r
-
)之间的关系为_____________________。
(6) 相距最近的两Na+之间的距离为____________________,相距最近的两Cl-之间的距离为______________________。
(7) NaCl晶体密度ρ、NaCl的摩尔质量M与离子半径(
Na
r
+
、
Cl
r
-
)之间的关系______________________________。
2.氯化铯(离子晶体) 在氯化铯晶体中:
(1) 与每个Cs +
等距紧邻的Cl -
有______个,与每个Cl -
等距紧邻的Cs +
有_______个。
(2) 与每个Cs +
等距紧邻的Cs +
有______个,与每个Cl -
等距紧邻的Cl -
有_______个。
(3) 每个氯化铯的晶胞中独立占有______个Cs +
,______个Cl -
,即_______个CsCl 。 (4) 晶胞边长a 与离子半径(Cs r +、Cl r -)之间的关系____________。
(5) CsCl 晶体密度ρ、CsCl 的摩尔质量M 与离子半径(Cs r +、Cl r -)之间的关系 ________________________________。
3.干冰(分子晶体) 在干冰的晶体中:
(1) 与每个CO 2分子等距紧邻的CO 2分子有_______个。 (2) 平均每个CO 2晶胞中含________个CO 2分子。 (3) 取晶体中4个CO 2分子,形成一个最小的正方形,
用笔描出该正方形。 4.金刚石(原子晶体) 在金刚石的晶体结构中:
(1) 每个碳原子与周围的4个碳原子形成四条碳碳单键,这5个碳
原子形成的是_________结构。两条C —C 键的夹角为10928'?(类似甲烷)。
(2) 晶体中最小的环为6原子环,但6个碳原子不在同一平面上。 5.二氧化硅(原子晶体)
(1) 晶体中重复单元是硅氧四面体,每个硅原子与4个氧原
子相连,即每个氧原子又与2个硅原子相连,所以在SiO 2的晶体中硅、氧原子个数比为_________。 (2) 在SiO 2的晶体结构中最小环上有_______个原子。 (3) 每n mol SiO 2晶体中,Si —O 键数目为_________mol 。
6.石墨
(1) 石墨是一种混合型晶体,层内存在________键,层间以________________结合。 (2) 在层内每个C 原子通过共价单键与另_______个C 原子结构,构成正六边形。 (3) 同层内,每个正六边形实际占有________个C 原子,平均每个正六边形占有______个
C —C 单键,其关系式为_________________________________________。 思考:12g 石墨晶体中正六边形数目有__________________个。
【巩固练习A】
1.(上海市高考题)下列物质的晶体中,不存在分子的是()。
A.二氧化硅B.二氧化硫C.二氧化碳D.二硫化碳
2.(春季高考题)离子晶体不可能具有的性质是()。
A.较高的熔沸点B.良好的导电性C.溶于极性溶剂D.坚硬而易粉碎
3.石英玻璃是将纯石英在1723℃高温下熔化,冷却后形成的玻璃体。关于石英玻璃的结构和性质的叙述中正确的是()。
A.石英玻璃属于原子晶体
B.石英玻璃能抵抗一切酸的腐蚀
C.石英玻璃的结构类似于液体
D.石英玻璃能抵抗碱的腐蚀
4.下列物质呈固态时必定是分子晶体的是()。
A.非金属氧化物B.非金属单质C.金属氧化物D.无机含氧酸
5.(辽宁省测试题) 下列物质属于原子晶体的化合物是()。
A.金刚石B.氧化铝C.二氧化硅D.干冰
6.(全国高考题) 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是()。
A.SO2和SiO2 B.CO2和H2O C.NaCl和HCl D.CCl4和KCl
7.(上海市高考题) 水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同。有关玻璃态水的叙述正确的是()。
A.水由液态变为玻璃态,体积缩小B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态D.玻璃态水是一种特殊的分子晶体
8.自然界中,由下列各组元素形成的化合物中,既有原子晶体,又有分子晶体的是()。
A.H O Si B.Ca H C C.H N O D.H Cl O
9.(天津市高考理科综合题) 关于氢键,下列说法正确的是()。
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致【巩固练习B】
1.(2006年北京东城区二模) 下列说法正确的是()。
A.含有非极性键的化合物其分子一定是非极性分子
B.原子晶体中只存在非极性共价键
C.冰是水分子通过氢键作用而形成的分子晶体
D.若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
2.(2006年清华附中一模) 下列关于晶体的说法正确的是()。
A.晶体中只要有阳离子就一定有阴离子
B.离子晶体发生状态变化时需要克服离子键
C.原子晶体的熔点一定比金属晶体的高
D.构成分子晶体的粒子一定含有共价键
3.(2005年南通市一模) 用N A表示阿伏加德罗常数,下列说法正确的是()。
A.乙烯和丙烯的混合物1.4g中含有0.1N A个碳原子
B.6.8g熔融的KHSO4中含有0.1N A个阳离子
C.23.4g NaCl晶体中含有0.1N A个如图所示的结构单元
D.60g 石英晶体中含有4N A个硅氧四面体
4.(2005年南昌调研测试) 下列有关性质判断正确的是()。
A.沸点:HBr < HCl B.熔沸点:CH3CH2Br < C2H5OH
C.熔点:Li < Na < K D.密度:氨水> 水
5.(2004年高考上海卷) 有关晶体的下列说法中正确的是()。
A.晶体中分子间作用力越大,分子越稳定B.原子晶体中共价键越强,熔点越高C.冰熔化时水分子中共价键发生断裂D.氯化钠熔化时离子键未被破坏6.(2005年高考上海卷) 下列说法错误的是()。
A.原子晶体中只存在非极性共价键
B.分子晶体的状态变化,只需克服分子间作用力
C.金属晶体通常具有导电、导热和良好的延展性
D.离子晶体在熔化状态下能导电
7.(2005年高考全国卷II) 下列说法正确的是()。
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
8. (2006年1月海淀一中模拟) NaCl 为六面体型晶体,若使离子间距扩大2倍,晶体密度变
为原来的( )。
A .116
B .18
C .
1
4
D .
12
9. 最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于
这三种元素都是常见元素,从而引起广泛关注。该新型超导晶体的一个晶胞(碳原子用小●球表示,镍原子用大○球表示,
球表示)如右图所示,则该晶体的化学式为( )。 A .Mg 2CNi 3
B .Mg
C 2Ni
C .MgCNi 2
D .MgCNi 3
10. (2006年徐州模拟) 已知CsCl 晶体的密度为ρg ·cm -
3,N A 为阿伏加德罗常数,相邻的两
个Cs +
的核间距为a cm (如右图所示),则CsCl 的相对分子质量可表示为( )。
A .3A N 8a ρ
B .3A N 6
a ρ
C .
3
A N 4
a ρ
D .3A N a ρ
11. 下列物质:①水晶 ②冰醋酸 ③氧化钙 ④白磷 ⑤晶体氩 ⑥氢氧化钠 ⑦铝 ⑧金
刚石 ⑨过氧化钠 ⑩碳化钙 ○
11碳化硅 ○12干冰 ○13过氧化氢 (1) 属于原子晶体的化合物__________________。 (2) 直接由原子构成的晶体__________________。 (3) 直接由原子构成的分子晶体___________________。
(4) 由极性分子构成的晶体是_____________,含有非极性键的离子晶体是_____________,
属于分子晶体的单质是_______________。
(5) 在一定条件下能导电而不发生化学变化的是______________,受热熔化后化学键不发
生变化的是________________,受热熔化后需克服共价键的是_____________。 (6) 同种分子间能形成氢键的是________________。
12. (南京市质检题) 氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业
上曾普遍采用高纯硅与纯氮在1300℃反应获得。 (1) 氮化硅晶体属于____________晶体(填晶体类型)。
(2) 已知氮化硅的晶体结构中,原子间都以单键相连,且N 原子和N 原子、Si 原子和Si
原子不直接相连,同时每个原子都满足8电子稳定结构。请写出氮化硅的化学式:_______________。
(3) 现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅。
反应的化学方程式为:____________________________________________________。
13. C 60、金刚石和石墨的结构模型如图(甲)、(乙)、(丙)所示(石墨仅表示出其中的一层
结构):
(1) C 60、金刚石和石墨三者的关系互为_____________。
A .同分异构体
B .同素异形体
C .同系物
D .同位素
(2) 固态时,C 60属于___________晶体(填“离子”、“原子”或“分子”),C 60分子中含有
双键的数目是_____________,1 mol C 60与F 2加成时最多消耗____________mol F 2。 (3) 硅晶体的结构跟金属石相似,1mol 硅晶体中含有硅硅单键的数目约是___________N A
个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子,二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是____________。 (4) 石墨层状结构中,平均每个正六边形占有的碳原子数是____________。
14. (2005年高考全国卷I) 甲、乙、丙、丁为前三周期元素形成的粒子,它们的电子总数相等。
已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1) 丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是
_____________________________________________________________。
(2) 乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:
_____________________________________________________________。
(3) 在一定条件下,甲与O 2反应的化学方程式是___________________________________。 (4) 丁的元素符号是__________,它的原子结构示意图为_________________。 (5) 丁的氧化物的晶体结构与_______________的晶体结构相似。
(6)