
分析化学复习题
(课程代码 252402)
一、填空题
1、定量分析的过程通常包括_______________________________________________;定量分析的精密量器是指_____________________________________________。
2、配位滴定法中常见的滴定方式包括_______________________________________。
3、0.02000 mol·L-1的K2Cr2O7标准溶液(Mr=294.18)对Fe 2O3(M r=159.67)的滴定度为
_____________________________________________________;已知试样中As2S3(M r =246.0)的质量分数为0.2000,则换算成BaSO4(M r =233.39)的质量分数为____________________________。
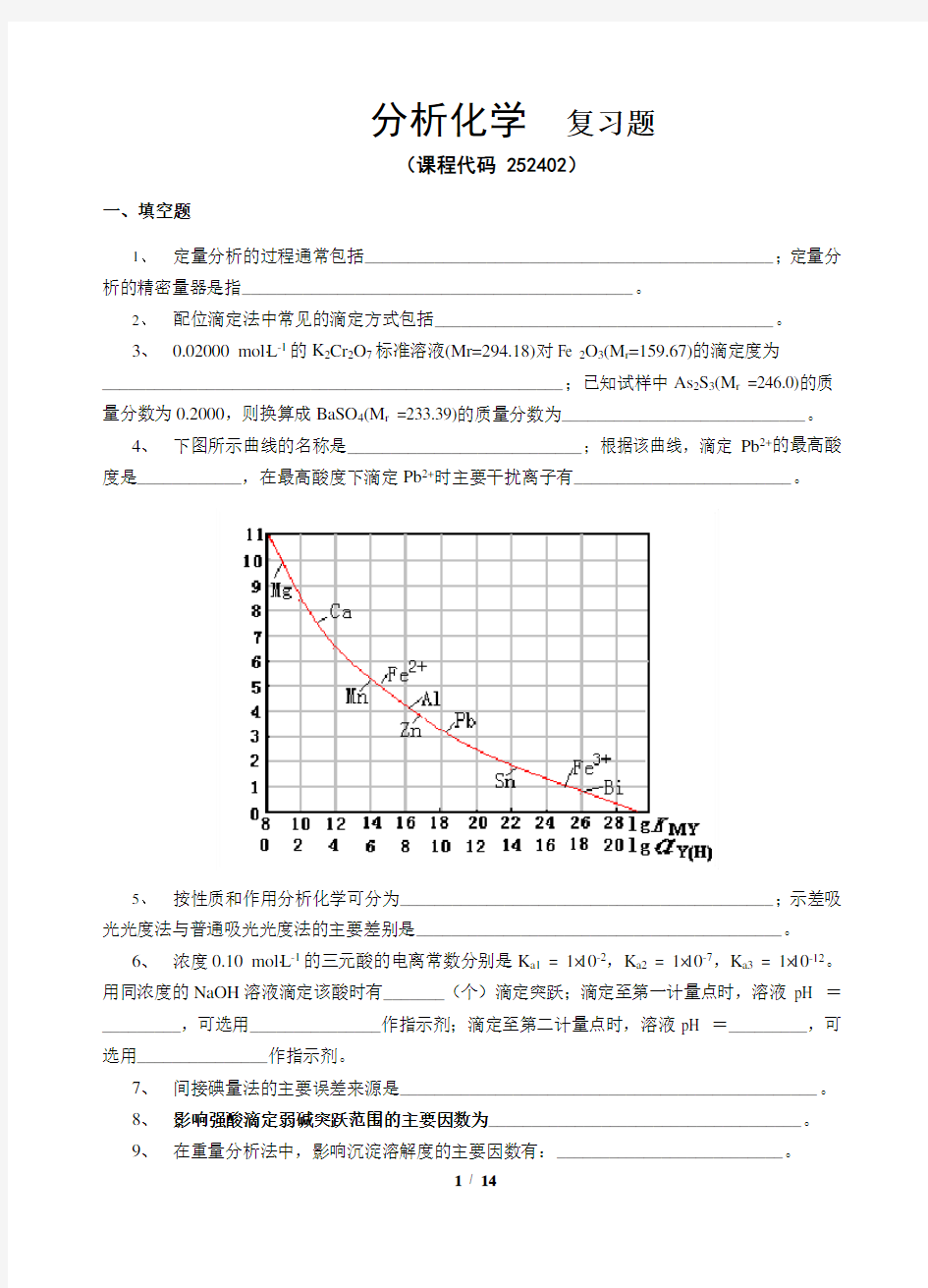
4、下图所示曲线的名称是___________________________;根据该曲线,滴定Pb2+的最高酸度是____________,在最高酸度下滴定Pb2+时主要干扰离子有_________________________。
5、按性质和作用分析化学可分为___________________________________________;示差吸光光度法与普通吸光光度法的主要差别是__________________________________________。
6、浓度0.10 mol·L-1的三元酸的电离常数分别是K a1 = 1×10-2,K a2 = 1×10-7,K a3 = 1×10-12。用同浓度的NaOH溶液滴定该酸时有_______(个)滴定突跃;滴定至第一计量点时,溶液pH =_________,可选用_______________作指示剂;滴定至第二计量点时,溶液pH =_________,可选用_______________作指示剂。
7、间接碘量法的主要误差来源是________________________________________________。
8、影响强酸滴定弱碱突跃范围的主要因数为____________________________________。
9、在重量分析法中,影响沉淀溶解度的主要因数有:__________________________。
10、晶形沉淀的沉淀条件主要包括_______________________________________________;莫尔(Mohr)法所用的标准溶液和指示剂分别为__________________________________________。
11、精密度与准确度的关系是____________________________________________________。
12、0.10mol·L-1H3PO4的物料平衡式为_________________________________________。
13、浓度为0.10 mol·L-1的二元碱的电离常数分别是K b1 = 1×10-3,K b2 = 1×10-6。用同浓度的HCl标准溶液滴定该碱时有_______(个)滴定突跃;滴定至终点时,溶液pH =_________,可选用_____________作指示剂。
14、弱酸的平衡常数每增加10倍,强碱滴定弱酸的突跃范围将__________________________;佛尔哈德(V olhard)法所使用的标准溶液和指示剂分别为______________________________。
15、检验系统误差的方法主要有_________________________________________;碘量法测量铜样品时,所用的标准溶液和指示剂分别为__________________________________。
16、分光光度计的主要部件分别为_________________________________________;普通光度法中使用的参比溶液主要有____________________________________。
17、影响沉淀纯度的因素主要有_______________________________________________;晶形沉淀的沉淀条件主要包括______________________________________________。
18、影响醋酸滴定突跃的主要因素有______________________________________;高锰酸钾测量钙时,所用的标准溶液和指示剂分别为______________________________________________。
19、NaOH水溶液的电荷平衡式为_________________________________________________。
20、在重量分析法中,沉淀的类型主要有_______________________________。
21、重铬酸钾法测量亚铁所用的标准溶液和指示剂分别为_____________________________。
22、显著性检验的方法有_______________________________________________________。
23、0.10 mol·L-1HAc水溶液的质子平衡式_______________________________________。
24、浓度每增加10倍,强酸滴定强碱的突跃范围将__________________________;法扬司法(Fajans)法所用的标准溶液和指示剂分别为_____________________________________________。
25、减小偶然误差的方法通常是_________________________________________________。
26、分光光度计的主要作用是__________________________________________________。
27、非晶形沉淀的沉淀条件主要包括_______________________________________________。
28、吸光光度法分析中使用的参比溶液主要有___________________________________。
二、单项选择题(从四个选项中选择一个最佳答案)
1、EDTA能够广泛用于滴定分析的原因是()。
A、EDTA能金属离子形成稳定配合物,配位比一般是1:1
B、EDTA与金属离子配位时,一般能形成颜色更深的螯合物
C、EDTA与金属离子形成的配合物大多带电荷,能溶于水
D、A和C
2、用EDTA测定水中Ca和Mg总量时,常用指示剂及其终点颜色变化是()。
A、铬黑T,红变蓝
B、钙指示剂,红变蓝
C、二甲酚橙,红变亮黄
D、铬黑T,蓝变红
3、在滴定分析测定中,属偶然误差的是()。
A、滴定管中有气泡
B、滴定终点超过计量点
C、滴定管最后一位数读不准确
D、试样未经充分混匀
4、下列表达式正确的是()
A、C(1/5 HCl)=2.5C(HCl).
B、5C(1/5 HCl)=C(HCl)
C、C(1/5 HCl)=C(HCl)
D、C(1/5 HCl)=5C(HCl)
5、关于重铬酸钾法测量亚铁含量,下列叙述正确的是()。
A、可在HCl介质中进行
B、使用自身指示剂
C、其标准溶液应进行标定
D、有诱导效应存在
6、只考虑酸度影响,下列叙述正确的是()。
A、酸效应系数越大,络合物的稳定性越高
B、.酸度越小,酸效应系数越大
C、酸度越大,酸效应系数越大
D、酸效应系数越大,滴定突跃越大
7、关于目视比色法,下列叙述正确的是()。
A、.比较入射光的强度
B、比较待测溶液所的吸光度
C、只适用于真溶液
D、比较一定厚度溶液的颜色深浅
8、在分光光度法中,待测物浓度的相对误差△C/C的数值()。
A、与吸光度A成反比
B、与透光度的绝对误差成反比
C、与透光度T成反比
D、在T=0.15~0.65时,是符合误差要求的
9、分析纯的下列试剂“不可以当”基准物质的是()。
A、K2Cr2O7
B、邻苯二甲酸氢钾
C、FeSO4·7H2O
D、硼砂
10、用0.10 mol·L-1的HCl溶液滴定同浓度NH3H2O(K b=1.80×10-5)时,最佳指示剂为()。
A、甲基橙(pk HIn=3.4)
B、中性红(pk HIn=7.0)
C、甲基红(pk HIn=5.0)
D、酚酞(pk HIn=9.1)
11、用KMnO4法滴定Fe2+时,Cl-被氧化的速度加快,这种情况称( )。
A、催化反应
B、自动催化反应
C、诱导效应
D、副反应
12、朗伯-比耳定律适用于()。
A、复合光
B、胶体体系
C、单色光
D、浓度较高的溶液
13、用最简式计算得0.10 mol·L-1弱酸HA溶液的pH = 4.0, 则该若酸的pKa等于( )。
A、4.0
B、5.0
C、5.5
D、4.5
14、某矿石中锰含量在0.1%以下,要求测定结果的相对误差为2%左右,选用下述何种方法
测定较为适宜()
A、EDTA-配位滴定
B、邻二氮杂菲-分光光度法
C、过氧化氢-高锰酸钾
D、高碘酸钾-分光光度法
15、间接碘量法中加入淀粉指示剂的适宜时间是()
A、滴定开始之前
B、标准溶液滴定了近50%时
C、滴定至接近计量点
D、标准溶液滴定了近75%时
16、对于某特定的酸碱体系而言,离解常数的数值()
A、取决于该体体系的pH
B、取决于该体系的总浓度c
C、取决于体系的酸度和总浓度c
D、取决于酸碱的本性、温度和溶剂
17、标定盐酸溶液常用的基准物质是()。
A、硼砂
B、MgSO4·7H2O
C、CaCO3
D、邻苯二甲酸氢钾
18、关于重铬酸钾法测定铁含量,下列叙述正确的是()。
A、可在HCl介质中进行
B、使用特殊指示剂
C、其标准溶液很不稳定
D、有诱导效应存在
19、关于吸光光度法,下列叙述正确的是()。
A、比较入射光的强度
B、比较待测溶液所产生的吸光度
C、适用任何分散系
D、比较一定厚度溶液的颜色深浅
20、分析纯的下列试剂可以当基准物质的是()。
A、KMnO4
B、邻苯二甲酸氢钾
C、FeSO4·7H2O
D、MgSO4·7H2O
21、用0.10 mol·L-1的NaOH溶液滴定同浓度HAc(K a=1.80×10-5)时,最佳指示剂为()。
A、甲基橙(pK HIn=3.4)
B、百里酚酞(pK HIn=10.0)
C、甲基红(pK HIn=5.0)
D、酚酞(pK HIn=9.1)
22、用KMnO4法滴定草酸钠+时,下列说法合理的是( )。
A、用二苯胺磺酸钠为指示剂
B、属自动催化反应
C、可以在常温下进行滴定
D、可在HCl介质中进行
23、用配位(络合)滴定法测定石灰石中CaO的含量,经四次平行测定,得x=27.50%,若真实含量为27.30%,则27.50%-27.30%=+0.20%,称为( )。
A、绝对偏差
B、绝对误差
C、相对偏差
D、相对误差
24、在滴定分析测定中,属系统误差的是()。
A、滴定管中有气泡
B、滴定终点超过计量点+0.1%
C、滴定管最后一位数读不准确
D、试样未经充分混匀
25、标定NaOH溶液常用的基准物质是()。
A、硼砂
B、MgSO4·7H2O
C、CaCO3
D、邻苯二甲酸氢钾
26、测定CaCO3的含量时,加入一定量过量的HCl标准溶液与其完全反应,过量部分HCl
用NaOH标准溶液滴定,此滴定方式属( )。
A、直接滴定方式
B、间接滴定方式
C、置换滴定方式
D、返滴定方式
27、某矿石中锰含量在10%左右,何种方法测定较为适宜()。
A、BaSO4-重量分析法
B、铋酸钠-氧化还原滴定法
C、溴酸钾-分光光度法
D、高碘酸钾-分光光度法
28、在用邻苯二甲酸氢钾标定氢氧化钠时,得到以下五个数据:0.1021,0.1018,0.1010,0.1020,
0.1021mol·L-1.查表得n=5时,Q0.90=0.64,从而判断可以弃舍的数据是()
A、0.1021
B、0.1018
C、0.1010
D、0.1020
29、用K2Cr2O7法测Fe2+的过程中,加入H3PO4的主要目的是()。
A、同Fe3+形成稳定的无色化合物,减少黄色对终点的干扰
B、减小Fe3+/Fe2+的电极电位数值,增大突跃范围
C、提高酸度,使滴定趋于完全
D、A和B
30、用同一KMnO4标准溶液滴定体积相等的FeSO4和H2C2O4溶液,耗用的标准溶液体积相
等,则FeSO4与H2C2O4两种溶液的浓度之间的关系为( )。
A、2c(FeSO4)=c(H2C2O4)
B、c(FeSO4)=2c(H2C2O4)
C、c(FeSO4)=c(H2C2O4)
D、5c(FeSO4)=c(H2C2O4)
31、用重量法测定试样中的砷,首先使其形成Ag3AsO4沉淀,然后转化为AgCl,并以此为称量形式,则用As2O3表示的换算因数是( )。
A、M (As2O3)/M (AgCl)
B、2M (As2O3)/3M (AgCl)
C、3M (AgCl)/M (As2O3)
D、M (As2O3)/6M (AgCl)
32、以下有关随机误差的论述正确的是( )。
A. 正误差出现概率大于负误差
B. 负误差出现概率大于正误差
C. 正负误差出现的概率相等
D. 大小误差出现的概率相等
33、滴定分析中,对化学反应的主要要求是( )。
A、反应必须定量完成
B、反应必须有颜色变化
C、反应必须是1:1的计量关系
D、反应必须用基准物的溶液作滴定剂
34、滴定管可估读到±0.01mL,若要求滴定的相对误差小于0.1%,至少应耗用体积mL()。
A 、10 B、20 C、30 D、40
35、欲配制1000mL 0.1mol·L-1 HCl溶液,应取浓盐酸(12mol·L -1) ()。
A、0.84mL
B、8.4mL
C、1.2 mL
D、12 mL
36、测定试样中CaO的质量分数,称取试样0.9080g,滴定耗去EDTA标准溶液20.50mL,以下结果表示正确的是( )。
A、10%
B、10.1%
C、10.08%
D、10.077%
三、判断题(正确的打“√”,错误的打“×”)
1、某溶液的吸光度为A0,若将浓度增加一倍,则其吸光度等于2A0。()
2、酸碱溶液的平衡关系主要包括MBE、CBE和PBE。()
3、随机误差的大小和正负不可知,但可平行测定多次取其算术平均值而加以减少。( )
4、一个分析过程的相对标准偏差越小,该则分析过程越可靠。()
5、可疑值通常是所测得的数据中的最大值或最小值。( )
6、用Q检验法可以检验两组平均值之间是否存在较大的系统误。( )
7、对照试验可有效地消除溶剂和同存其他试剂对测定结果的影响。( )
8、分析测定的精密度高并不一定能保证其准确度高。()
9、指示剂的选择原则是:变色敏锐、用量少。()
10、待测组分的浓度越大,氧化还原滴定曲线的滴定突跃越大。( )
11、偶然误差的大小和正负不可预知,但能用一定的方法加以消除。( )
12、回收试验可有效地消除溶剂和同存其他试剂对测定结果的影响。( )
13、校正仪器可检验所用的分析仪器是否存在明显的系统误差。( )
14、为保证分析的准确度,沉淀形式因与称量形式一致。()
15、用硼砂标定盐酸溶液一般用甲基红作指示剂。( )
16、直接碘量法中应在接近化学计量点时,加入淀粉指示剂。()
17、为保证所取样品具有代表性,取样的方式必须采用随机取样。()
18、用t-检验法可以检验两组平均值之间是否存在较大的系统误差。( )
19、空白试验可有效地消除溶剂和同存其他试剂对测定结果的影响。( )
20、为保证分析的准确度,必须采用大样分析法。()
21、从化学结构来看,酸碱指示剂通常是一些有机的弱酸碱。()
22、条件稳定常数的数值越大,配位滴定曲线的突跃范围越小。.( )
23、EDTA的酸效应系数取决于其浓度和溶液的酸度。()
24、酸碱滴定所选用的指示剂取决于其滴定曲线的突越范围。()
25、由于系统误差的大小和正负可预知,因此总能用一定的方法加以校正和消除。( )
26、一个分析过程的相对误差越小,该则分析过程的重现性越好。( )
27、用F-检验法可以检验平均值和真值之间是否存在明显的系统误差。 ( )
28、氧化还原滴定中,两电对的条件电极电势相差越大,滴定的突跃范围越大。.( )
29、酸式滴定管一般用于盛酸性溶液和氧化性溶液,但不能盛放碱性溶液。( )
30、已记载的实验数据不可撕掉或涂改,有错误时,可划去并加以注明。( )
31、用100mL 容量瓶准确量取100.00mL 某标准溶液。( )
32、称取FeSO 4·7H 2O 常用差减法进行。( )
33、1227(Fe/K Cr O )0.005585g mL T -=?,如果一次滴定中消耗了20.00mLK 2Cr 2O 7标准溶液,则被测物质中铁的质量为0.1117g 铁。( )
34、无机试样溶解,最常用的处理方法有酸溶法、碱溶法和熔融法;有机试样的分解,通常采干式灰化法和湿式消化法。( )
35、土壤样品采集后,必须风干、粉碎、过筛,以增加其均匀程度,也便于以后的处理。( )
36、同一分析试样在多次重复测定时,平均值与真实值之间的符合程度,叫精密度。( )
37、用来直接配制标准溶液的物质称为基准物质,KMnO 4是基准物质。( )
38、偶然误差是由某些难以控制的偶然因素所造成的,因此是无规律可循的。( )
39、为消除系统误差,使用滴定管时,每次均应从零刻度或稍下位置开始滴定。( )
40、.所谓化学计量点和滴定终点是同一个概念。( )
41、所谓终点误差是由于操作者终点判断失误或操作不熟练而引起的。( )
42、凡是优级纯的物质都可用于直接法配制标准溶液。( )
43、测量的准确度要求较高时,容量瓶在使用前应进行体积校正。( )
44、用浓溶液配制稀溶液的计算依据,是稀释前后溶质的物质的量不变。( )
45、在没有系统误差的前提条件下,总体平均值就是真实值。( )
46、用Q 检验法舍弃一个可疑值后,应对其余数据继续检验,直至无可疑值为止。( )
47.测定的精密度好,但准确度不一定好,消除了系统误差后,精密度好的,结果准确度就好。( )
48、分析测定结果的偶然误差可通过适当增加平行测定次数来减免。( )
49、 标准偏差可以使大偏差能更显著地反映出来。( )
50、 偏差与误差一样有正负之分,但平均偏差恒为正值。 ( )
51、 为了提高测定结果的精密度,每完成一次滴定,都应将标准溶液加至零刻度附近。( )
四、计算题
1、用某新方法测定试样中Fe 2O 3的质量百分数,九次平行测定结果(%)分别为:
17.54,17.52,17.08,17.56,17.54,17.56,17.50,17.58,17.59
试按定量分析的要求,以95%的置信度,报告试样中Fe2O3的测定结果。
2、以邻二氮杂菲为显色剂吸光光度法测定含铁试样。用试剂空白为参比溶液,在510nm处,选1.0cm比色皿,测得待测溶液的透光率为6.0%,已知ε=1.1×104 L·mol-1·cm-1。为减少测量误差,改用示差分光光度法进行测定,问需要多大浓度的Fe2+标准溶液作为参比溶液,才能使分析待测溶液的相对误差最小?
3、含H2SO4(Mr=98.07)和H3PO4(Mr=98.00)的混合液两份(体积均为25.00mL),分别用0.1018mol·L-1的NaOH标准溶液滴定。第一份以甲基橙(pK HIn=3.4)作指示剂,需25.18mL滴至终点;第二份以酚酞(pK HIn=9.1)作指示剂,需35.22mL到达终点。试求混合液中每种酸的浓度?(已知H3PO4的K a1= 10-2.12,K a2= 10-7.21,K a3= 10-12.7)。
4、称取土样1.000g溶解后,将其中的磷沉淀为磷钼酸铵,用20.00mL 0.1000mol·L-1NaOH溶解沉淀,过量的NaOH用0.2000mol·L-1HNO37.50mL滴至酚酞终点,计算土样中w(P)、w(P2O5)。
已知:H3PO4+12MoO42-+2NH4++22H+=(NH4)2HPO4·12MoO3·H2O+11H2O
(NH4)2HPO4·12MoO3·H2O+24OH-=12 MoO42-+ HPO42-+2NH4++13H2O
5、某碱试样可能有NaOH、Na2CO3、NaHCO3或它们的混合物(同存杂质不影响测定)。称取试样0.6000克,以酚酞为指示剂,用0.1000 mol·L-1的HCl标准溶液滴定至无色,用去30.00mL;接着加入甲基橙指示剂,继续用HCl标准溶液滴定至橙色,又消耗20.00mL。试分析试样的组成并求各组分的质量分数。(NaOH=40.00,Na2CO3=106.0,NaHCO3=84.01)。
6、在25.00mL含Ni2+、Zn2+的溶液中加入50.00mL,0.01500mol·L-1EDTA溶液,用0.01000mol·L-1 Mg2+返滴定过量的EDTA,用去17.52mL,然后加入二巯基丙醇解蔽Zn2+,释放出EDTA,再用去22.00mLMg2+溶液滴定。计算原试液中Ni2+、Zn2+的浓度。
7、称取硫酸镁样品0.2500g,以适当方式溶解后,以0.02115mol·L-1EDTA标准溶液滴定,用去24.90mL,计算EDTA溶液对MgSO4·7H2O的滴定度及样品中MgSO4的质量分数。
8、以K2Cr2O7标准溶液滴定0.4000g褐铁矿,若用K2Cr2O7溶液的体积(以mL为单位)与试样中Fe2O3的质量分数相等,求K2Cr2O7溶液对铁的滴定度。
9、不纯CaCO3试样0.2500g(不含干扰测定的组分),加入25.00mL 0.2600mol·L-1 HCl溶解,煮沸除去CO2,用0.2450mol·L-1 NaOH溶液返滴定过量酸,消耗6.50mL,计算试样中CaCO3的质量分数。(M CaCO3=100.09)
10、不纯Sb2S30.2513g,将其置于氧气流中灼烧,产生的SO2通入FeCl3溶液中,使Fe3+还原至Fe2+,然后用0.02000mol/L KMnO4标准溶液滴定Fe2+,消耗溶液31.80mL。计算试样中Sb2S3的质量分数。若以Sb计,质量分数又为多少?[M(Sb2S3)=339.68;M(Sb)=121.76]
11、CN-可用EDTA间接滴定法测定。已知一定量过量的Ni2+与CN-反应生成Ni(CN)42-,过
量的Ni2+以EDTA标准溶液滴定,Ni(CN)42-并不发生反应。取12.70mL含CN-的试液,加入25.00mL 含过量Ni2+的标准溶液以形成Ni(CN)42-,过量的Ni2+需与10.10mL 0.01300mol·L-1 EDTA完全反应。已知39.30mL 0.01300 mol·L-1EDTA与上述Ni2+标准溶液30.00mL完全反应。计算含CN-试液中CN-的物质的量浓度。
12、某有色络合物的摩尔吸收系数ε为2.5?103 L·mol-1·cm-1,在510 nm处,用2cm比色皿,以试剂空白为参比,浓度为0.0010%的水溶液的透光率为42.0%,求此有色络合物的摩尔质量。
参考答案
一、填空题
1、取样、前处理、试样分解、分析测定、数据处理与结果报道。滴定管、移液管、容量瓶和分析天平。
2、直接、返滴定、置换和间接滴定法。
3、0.009580 g/mL。0.5692。
4、Ringbong或林邦曲线。pH=3.2。Sn、Fe和Bi。
5、定性分析、结构分析和定量分析。所使用的参比溶液的不同,普通光度法一般以试剂空白为参比,而示差法则以浓度稍低于待测溶液的标准溶液作为参比溶液。
6、有2(个)滴定突跃;pH = 4.5;甲基红或甲基橙。溶液pH = 9.5。可选用酚酞。
7、注意防止单质碘的升华与碘离子被空气氧化。
8、弱碱的浓度和解离平衡常数。
9、溶度积常数、温度、溶剂、各种副反应。
10、稀溶液、热溶液、不断搅拌、进行陈化。AgNO3标准溶液和K2C r O4指示剂。
11、精密度是保证准确度的前提,准确度高,精密度必须高;但精密度高,准确度不一定高。
12、[PO43-] +[H3PO4]+[H2PO4-]+[HPO42-]=0.1。
13、有1(个)滴定突跃。溶液pH = 9.5。可选用酚酞。
14、将增大1个pH单位。[NH4Fe(SO4)2]和KSCN标准溶液。
15、对照试验、空白试验、回收试验、显著性检验等。淀粉指示剂和Na2S2O3标准溶液。
16、光源、单色器、吸收池和检测系统。溶剂空白、试剂空白、试样空白和显色空白。
17、共沉淀和后沉淀(继沉淀)。稀溶液、热溶液、不断搅拌、陈化。
18、醋酸的浓度和解离平衡常数。高锰酸钾标准溶液和自身指示剂。
19、[H]+[Na+]=[OH-]。
20、晶形沉淀、凝乳状沉淀和非晶形沉淀。
21、重铬酸钾标准溶液和二苯胺磺酸钠指示剂。
22、F检验和t检验。
23、[OH-]+[Ac-]=[H+]。
24、增大2个pH 单位。AgNO 3标准溶液和吸附指示剂。
25、相同条件下多次测量后取其平均值。
26、测定溶液的吸光度或透光率。
27、浓热溶液中、防止胶体形成、不能陈化、趁热过滤。
28、溶剂空白、试液空白、试剂空白和显色空白。
二、单项选择题
1、D
2、A
3、C
4、D
5、A
6、C
7、D
8、D
9、C 10、C 11、C 12、C 13、D 14、D 15、C 16、D
17、A 18、A 19、B 20、B 21、D 22、C 23、B 24、B
25、D 26、D 27、B 28、C 29、D 30、B 31、D 32、C
33、A 34、B 35、B 36、C
三、判断题(正确的打“√”,错误的打“×”)
1、×
2、√
3、√
4、√
5、 √
6、×
7、√
8、√
9、× 10、×
11、 × 12、× 13、√ 14、× 15、 √ 16、√ 17、 √ 18、√
19、 √ 20、× 21、√ 22、× 23、× 24、√ 25、 √ 26、×
27、 √ 28、√ 29、√ 30、√ 31、× 32、√ 33、 √ 34、√
35、√ 36、× 37、× 38、× 39、√ 40、× 41、× 42、× 43、√ 44、√ 45、 √ 46、√ 47、√ 48、√ 49、√ 50、√ 51√
四、计算题
1、解:实验数据17.08为可疑值,因为
根据Q 检验法,该数据应舍去。 3分
因此,有效的实验数据只有8次:
0.95,9
17.0827.50
(17.08)17.5917.080.820.44
Q Q -=-=>=
17.50+17.52+17.54+17.54+17.56+ 17.56+ 17.58+17.59717.55 20.02 x s ====
分
217.550.02 3x μ=±=±分分
2、解:欲使分析待测溶液的相对误差最小,T =36.8%。要将T=6.0%要调到36.8% ,
3、解:依题意可得
4、解:P%=
%065.0%100000.197.3024)100050.72000.0100000.201000.0(=???-? P 2O 5%=%15.097
.3029.141%065.0=?? 5、解:根据双指示剂法测定混合碱的原理,
因为V 甲基橙< V 酚酞,可知该混合碱为Na 2CO 3和NaOH 。
341(35.2225.18)0.101898.001000(H PO ) 425.0010004.007(g L ) 1 ρ--?
?==?分分241[25.18(35.2225.18)]0.101898.0710002(H SO ) 425.0010003.023(g L ) 1 ρ---???==?分分36.8% 6.13( 36.0%S T =则标尺放大的倍数应为:
倍) 分设选作参比液的透光率为,有:100 6.13, 16.3% 3S S T T ==%解得, 分54lg lg16.3%7.1610/ 41.110 1.0
S S T C mol L b ε---∴===???分
(30.0020.00)0.100040.00()0.066670.60001000NaOH ω-??==? 2320.000.1000106.0()0.35330.60001000Na CO ω??==?
6、解: Ni 2+~Zn 2+~Mg 2+~EDTA 2+2+2+2+EDTA EDTA Ni Zn Mg Mg ()c c V c V c V +=-
2+2+-1Ni Zn 50.000.015000.0100017.520.02299(mol L )25.00
c c ?-?+== 解蔽Zn 2+后,2+2+2+Zn Mg Mg c V
c V = 2+-1Zn 0.0100022.000.008800(mol L )25.00
c ?== ) 故 c(Ni 2+)=0.02299-0.008800=0.01419(mol·L -1)
7、解: MgSO 4·7H 2O ~ Mg 2+ ~ EDTA
424242MgSO 7H O MgSO 7H O MgSO 7H O m n M ???=?
= 42EDTA EDTA MgSO 7H O c V M ??=0.02115×24.90×10-3×246.5=0.1298g 4242MgSO 7H O
1MgSO 7H O/EDTA EDTA 0.12980.005213(g mL )24.90
m T V ?-?===? 444242MgSO MgSO MgSO 7H O MgSO 7H O
120.50.12980.06345()246.5M m m g M ??=?=?= 4
4MgSO MgSO 0.063450.25380.2500
m w m ===样 8、解:232327227227Fe Fe O Fe O Fe
K Cr2O /Fe K Cr O K Cr O 2M m M m T V V ?==
因为 2323227Fe O 3Fe O K Cr O V 10m w m -=
?样= 所以,23
227Fe O 3K Cr O 10m m V -=?样
∴227233Fe K Cr O /Fe Fe O 210M T m M -=??样=3104000.07
.15985.552-??? =2.798×10-4(g·ml -1)
9、解:CaCO 3~2HCl ,NaOH ~HCl 333HCl HCl NaOH NaOH CaCO CaCO CaCO 00
1()2100%100%1(0.26000.025000.24500.0065)100.092100%0.2500
98.24%
c V c V M n M w m m -=?=??-??=?= 10、解:2+23246Sb S ~2Sb~3SO ~6Fe ~KMnO 5
234Sb S 550.020000.03180 5.30010(mol)66
n cV -==??=? 2343Sb Sb S 22 5.30010 1.06010(mol)n n --==??=?
234Sb S 5.30010339.68100%71.64%0.2513
w -??=?= 3Sb 1.06010121.76100%51.36%0.2513
w -??=?= 11、解: 因为Ni 2+~EDTA
2+2+2+2+
1Ni EDTA Ni Ni Ni 39.300.01300
10000.01703(mol L )30.001000
n n c V V -?==== 2+2+2+''4Ni Ni Ni 25.000.01703 4.25810(mol)1000
n c V -==?=? ''4EDTA EDTA EDTA 10.100.01300 1.31310(mol)1000
n c V -=?=?=? -2+''3EDTA CN Ni 4() 1.17810
(mol)n n n -=-=? ---31CN CN CN 1.178100.09276(mol L )12.70
1000
n c V --?===
12、解:根据A = εbc ,可得比色皿中络合物的浓度为: 5-13lg 42.0%7.5410 mol L 2.5102
A c b ε--===????? 因此,有色络合物的摩尔质量为: -150.0010%1000133 g mol 7.5410m M c -?=
==??