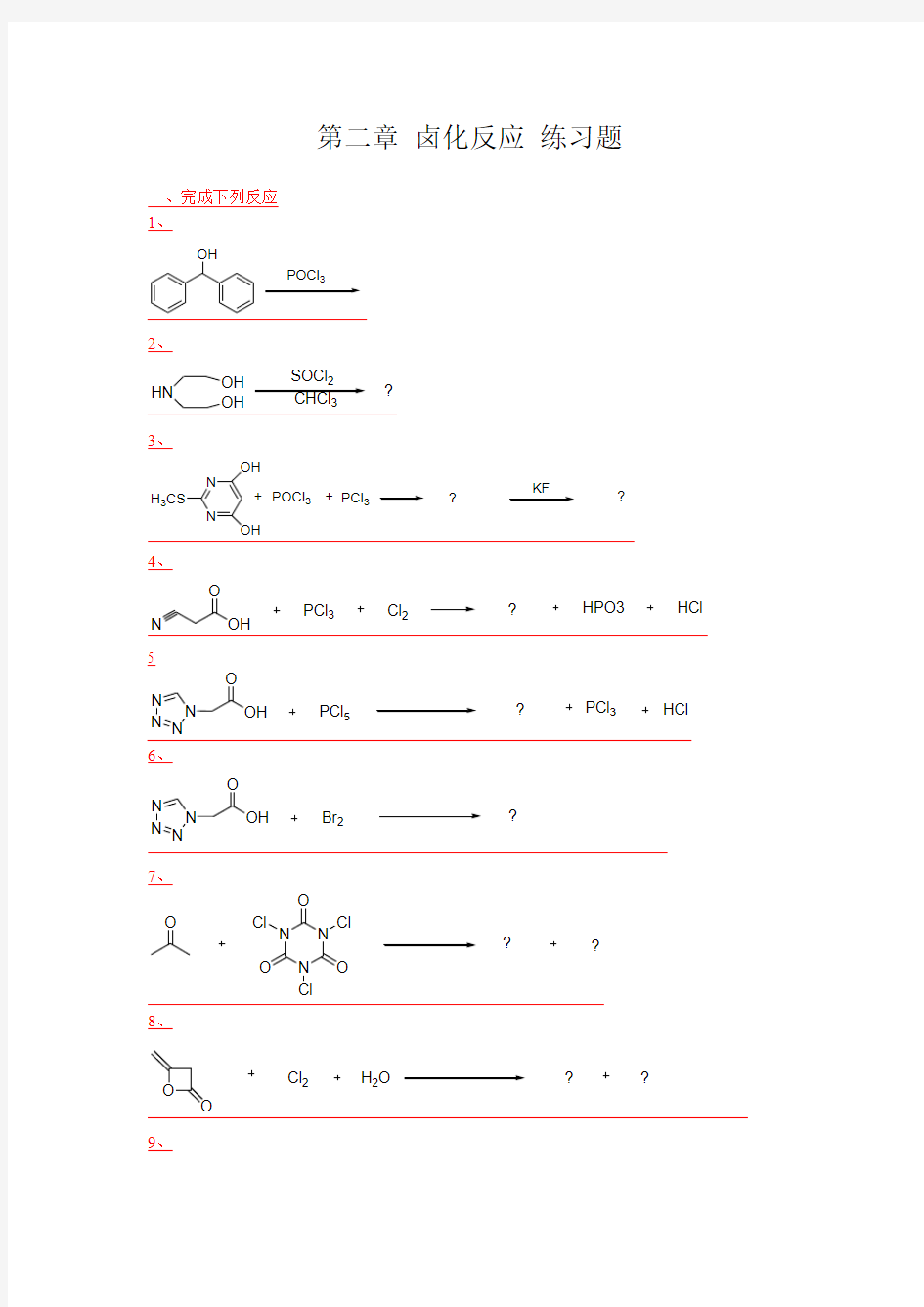
第二章 卤化反应 练习题
一、完成下列反应 1、
OH
POCl 3
2、
HN
OH
OH SOCl 2CHCl 3
?
3、
N
N
H 3CS
OH OH
+POCl 3+PCl 3
KF
?
?
4、
N
O
OH
PCl 3
Cl 2
HPO3
HCl
?
5
N
N N
N OH
O
PCl 5
PCl 3
HCl
?
6、 N
N N
N OH
O
Br 2
?
7、 O
N N N O
O
O Cl
Cl Cl ?
?
8、
O
O
Cl 2
H 2O
?
?
9、
Cl
O (HCOH)3
ZnCl 2
?
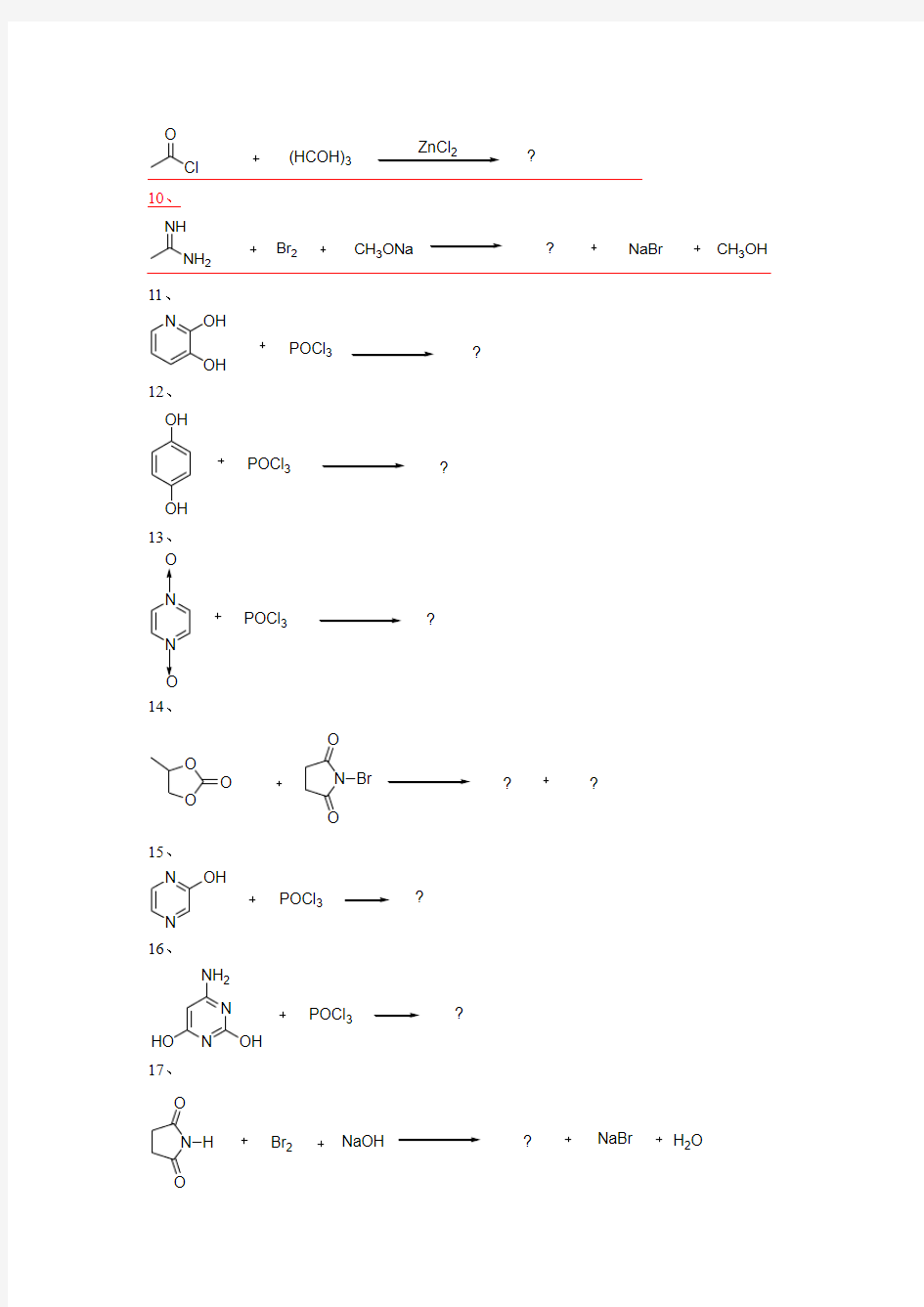
10、
NH 2
NH Br 2
CH 3ONa
NaBr
CH 3OH
?
11、 N
OH OH
POCl 3
?
12、 POCl 3
OH
OH
?
13、 N N
POCl 3
O O
?
14、
O
O
O N O
O Br
?
?
15、 N
N OH
POCl 3
?
16、
POCl 3
N
N
OH
HO NH 2
?
17、
N O O
H Br 2
NaOH
NaBr
H 2O
?
18、
N O O
H NaOCl
CH 3COONa
H 2O
CH 3OOH
?
19、
O
OH
O Cl
S
O Cl
HCl
SO 2
?
20、 N H
O
NaClO
NaOH
?
21、
O
O
O N O
O Br
?
?
22、
S
N O O
Br
?
?
23、
POCl 3
N
N OH
NH 2?
24、
O
Cl 2
NaCN
?
?
25、
OH
O SOCl 2
HCl
SO 2
?
26、
NO 2
Cl Cl
KF
KCl
?
27、
2
+Br 2+HgO
+HgBr 2
+H 2O
?
28
、
SO 2Cl 2
Co(Ⅱ)/C 6H 6/85℃
?
29、
+
CF 3OF
CFCl 3
-78℃
+
CF 3OH
?
30、
31、
C 6H 5CH CHCH 3
NBS
?
32、
CH 3(CH 2)5CHO
Br 2/O
O (C 2H 5)2O
?
33
N N OH
OH
F
POCl 3
?
34
ClCH 2CH 2OH
KF
?
35 OH
COOH
Cl 2C 6H 5Cl
?
N H
H COOH
+
CF 3OF
CFCl 3
-78℃
+
CF 3OH
?
36
CH 2CN
Br 2
?
37
S
COOH COOCH 2
SOCl 2
?
38 CHCOOH
(H 3C)2HC
Cl
PCl 5
?
39
O
COCH 3
OH
I 2,CaCl 2,CaO
CHCl 3,CH 3OH
?
40
H 3CO
CH 3
O
Br 2
?
41 N N H 3CO H 3CO
OH
OH
POCl 3PCl 5
?
42
H 3C
S
OH
O CH 3O SOCl 2
?
43
H 3C
O
OH
CH 3N
SOCl 2?
44、
N H
N H
O 2S
O NH NaClO
?
45、 N
NO 2
PCl 3
CHCl 3 HCl
?
46、
O
O 2N
Br
O
HCl
HBr
?
47、
S
S
O 2N
NO 2
Cl 2
HNO 3HCl
?
48、
O
O 2N
O
Br 2
HAC
HBr
?
49、
N N S
OH O
POCl 3
?
50、
OH O
O
Cl 2CH 2Cl 2
NaOH,CaCl 2
?
?
51、 NH 2
Cl F
NaNO 2
CuCl
?
52、
HCl N
NH 2
NaNO 2Cu 2Cl 2
?
53、 Cl
SO 3H
HSO 3Cl
OH
Cl 2
?
?
?
54、
OH
Cl 2
Cl
NO 2
?
?
55、
OCH 2CH NHC O
CH 3
CH 2
Br 2CCl 4
?
56
CH 2
Br 2/hr
?
57
N
CH 3Cl 2,NaCO 3
CCl 4
?
58
O
NBS
?
59
CH 3COCH 2COOC 2H 5
SOCl 2
?
60 N
H 3C
H 3C O
CH 2OH
SOCl 2
?
61、
HO OH
O
O SOCl 2DMF
Cl 2FeCl 3
??
62、
COOH
H 2N
NH 2
ICl, HCl
?
63、
C OH Cl
SOCl 2
?
64
N S
O CH 3
O
OSi(CH 3)3
O
O
H H H N COOSi(CH 3)3
H 2N
O
PCl 5
?
65
O 2N
CH 3
O Br 2C 6H 5Cl
?
66
O
O CH 3
CH 3H 3C CH 3
CH 3
NBS
?
67
C COOH CH 2CH 2Br
SOCl 293%
?
68
N
N COOCH 3NH 2
SO 2Cl 2
?
COOH
O 2N
SOCl 2
?
70
CH 3CH 2CH 2CH 2OH
HCl
?
71 CH 2CH CH 2OH
Br 2
?
72
HOCH 2CH 2
HOCH 2CH 2
NH
SOCl 2
?
73
CH=CH
N
CH=CH
Br 2CCl 4
?
74、
O
O
OH
I 2 / CaO
THF / MeOH
AcOK Me 2CO
?
?
75、
N
N OH POCl 3
?
76、
OCH 2CH OH CH 3
SOCl 2
?
77、
H 3CO
H 3CO
COCH 3
Br 2,AlCl 3
?
78、
NH 2
COOCH 3Br 2,HCl
?
79、
COOH
PCl 3
?
80、 COOCH 3
OCH 3
NHCOCH 3
Cl 2CH 3COOH
?
81、
NO 2
Br 2,Fe
?
82、 HO
O O Cl
SOCl 2,ref 83%
?
83、
S Me
O
O O
Br 2,HOAC 87%
?
84、 COOH
NO 2
+SO 2HCl
SOCl 2
++?
85、
N
SCH 2COOH
++PCl 5HCl
HPO 3
?
+
O
2Cl 2
2HCl
++?
87、 COOH
CH 3
CH 3
+SOCl 2
HCl
SO 2++?
88、 H 3OC
COOH
OCH 3
++SO 2Cl 2
SO 2HCl
?
+
89、
OH
O COCl 2
?
90、 OH
Cl 2
?
91、 CH 3
Cl
Cl2
HF
?
?
92、
O
O Cl 2
?
93、 N
OH SOCl 2
?
94、
CH 3CH 2COOH
SO 2Cl 2
SOCl 2
?
?
H 2N
COCH 3
Cl 2CH 3COOH
Br 2CHCl 3
?
?
96、 Br
NO 2
Br 2
?
97、 OH
NO 2
Br 2
?
98、 CH 2=CHCHO
Br 2CCl 4
?
99、 COCl
Cl 2FeCl 3
?
100、
Cl
CH 3
Cl
Cl 2,PCl 3紫外线
?
101、 (CH 2O)n
ClSO 3H HCl
?
102、
H 2C CHCH 2OH
Br 2
?
103、
O 2N
NO 2
COOH
SOCl 2
?
104、
CH 2CN
Br 2
?
105、
CCl 4AlCl 3
?
106、
O
O
TfO
LiBr/acetone 50o
C 90%
?
107、
O
CH 3
OTs
ZnI 2
?
108、
S
N H
N O
N OH
SO 2Cl 2/CH 2Cl
2
reflux 90%
?
109、
O Cl
HO
O
SOCl 2reflux 83%
?
110、
OH
PPh 3 Br
EtOH
?
111、
HO
COOK
OH
HBr/AcOH CH 3OH
H 2/Pd-C
??
112、
86%
HO
OH
HOH 2C HOH 2C
HCl (g)
?
113、
Br
H
COOH H
SOCl 2 ,C 6H 6
?
114、
N C OH O
+
Cl C Cl O
?
115、
COOH
N H
CF 3
PCl 5
?
116、
N H
S
O
POCl 3PhNMe 2reflux, 93%
?
117、
O
MeOOC
HO
Br 2
?
118、
NH 2
S N O
O
1.IPy 2BF 4,CH 2Cl 2
2.TFAA, THF
81%
?
119、
N NH O
Me
Me
NBS/BPO CHCl 3
?
二、设计目标化合物的合成路线 1、合成3-溴甲苯
Br
CH 3
2、用给出的原料合成最终产物
CH 3CH 2CH 2Br
H 3CC CCH 2CH 2CH 3
3、用给出的原料合成最终产物
CH 3CH CH 2
H 2C H
C CH 2
OHOHOH
4、用给出的原料合成最终产物
O CH 3
O CH 3CH 3
5、用给出的原料合成最终产物
Cl
Br Cl
三、用语言叙述下列人名反应或写出其反应的代表式或举例解释此人名反应。 1、Dalton 反应:
2、Hunsdriecke 反应:
3、Kochi 改良法:
4、Barton 改良法:
5、Finkelstein 反应:
6、Sandmeyer 反应:
7、Gattermann 反应:
8、Schiemann 反应:
四、写出下列缩写所代表的结构式或名称
1、NBA ;
2、NBS ;
3、NCS ;
4、NIS ;
5、TCC ;
6、HCA ;
7、THF ;
8、LTA ;
9、HMPA ,HMPTA ;
五、排序
1、在烃的卤代反应中卤素的活性顺序:F 2;Cl 2;Br 2 ;
2、以下负离子都是亲核试剂,其碱性的大小次序为:
NH 2- ; RO - ; HO - ; CH 3COO - ;I -
3、氢卤酸亲核能力的大小顺序为: HCl ;HBr ; HF ; HI ;
4、按S N 1反应的速度大小排序:
CHBrCH 3
;
CH 2Br
;
CH 2CH 2Br
5、将下列化合物按消去HBr 难易次序排序:
CH 3C Br CH 2CH 3
H 3C ;
CH 3CHCHCH 3
CH 3
Br
;
CH 3CHCH 2CH 2Br CH 3
;
六、写出下列反应的反应机理 1、
Cl 2/CCl 4
Me 3C
H
H
C Cl Me CH 2Me H
Me 3C
H CMe 3
2、
OAc
NIS
I
OAc
OH
H 2O
3、
Cl
O O
H
Oxone,
HCl
aq. DMF
4、
Me
HO
Br 2/AcOH
Me HO
H
Br
Br
5、
PhthN
CO 2Me
Cl 2CCl 4
O H PhthN
Cl
O
《化学反应进行的方向》知识点整理《化学反应进行的方向》知识点整理 (一)自发过程与非自发过程: 不借助外力可以自动进行的过程称为自发过程,而 必须在外力的作用下才能进行的过程为非自发过程。 说明: 1、体系有着趋于从能量高的状态变为能量低的状态的过程,此时体系对外界做功或放出能量这一经验规律 就是能量判据。能量判据又称焓判据,即△H 0的反应有自发进行的倾向,焓判据是判断化学反应进行方向的判 据之一。 2、多数能自发进行的化学反应是放热反应。即反应物的总能量大于生成物的总能量。但并不是放热反应都 能自发进行,也不是讲吸热反应就不能自发进行。某些 吸热反应也能自发进行,如氯化铵与氢氧化钡晶体的反应,还有一些吸热反应在高温下也能自发进行。 3、混乱度:表示体系的不规则或无序状态。混乱度的增加意味着体系变得更加无序。熵是热力学上用来表 示混乱度的状态函数,符号为S,单位为:Jmol-1K-1 。体系的无序性越高,即混乱度越高,熵值就越大。 4、在相同条件下,不同物质的熵值不同,同一物质在不同状态时的熵值大小也不一样,一般而言:固态时
熵值最小,气态时熵值最大。 5、熵变:化学反应中要发生物质的变化或物质状态的变化,因此存在混乱度的变化,叫做熵变,符号:△S △S=S产物-S反应物。在密闭条件下,体系由有序自发地转变为无序的倾向熵增 6、自发过程的熵判据:在与外界隔离的体系中,自发过程将导致体系的熵增大,这一经验规律叫做熵增原理,是判断化学反应方向的另一判据熵判据。 7、判断某一反应能否自发进行,要研究分析:焓判据和熵判据对反应方向的共同影响。 (二)化学反应进行的方向: 在一定的条件下,一个化学反应能否自发进行,既可能与反应的焓变有关,又可能与反应的熵变有关。在温度、压力一定的条件下,化学反应的方向是熵变和焓变共同影响的结果,反应的判据是:DH-TDS(T为热力学温度,均为正值)。 DH-TDS0,反应能自发进行; DH-TDS=0,反应达到平衡状态; DH-TDS0,反应不能自发进行。 即:在温度、压力一定的条件下,自发反应总是向DH-TDS0的方向进行,直至达到平衡状态。 说明:
第一章卤化反应 Halogenation Reaction 概述 ?不饱和烃的卤加成反应 ?烃类的卤取代反应 ?羰基化合物的卤取代 ?醇、酚和醚的卤置换反应 ?羧酸的卤置换反应 ?其它官能团化合物的卤置换反应 第一节不饱和烃的卤加成 ?不饱和烃和卤素的加成反应(X-X) ?不饱和羧酸的卤内酯化反应(X-OR) ?不饱和烃和次卤酸(酯)、N-卤代酰胺的反应(X-OH、X-OR、X-Nu) ?卤化氢对不饱和烃的加成反应(H-X) ?不饱和烃的硼氢化-卤解反应(BH3-H)
一、不饱和烃与卤素的加成反应(X-X) 卤素与烯烃加成 卤素与烯烃加成-机理 (1)有稳定碳正离子的基团(供电子基团)可增加离子对形式机理,增加 同向加成产物比例。 (2) Cl的极化性比溴小,不易形成桥氯正离子,同向加成更明显。 (3)立体空间结构受底物空间构型和位阻的影响。 (4)加成过程中可能有重排、消除反应发生,以正离子稳定性为动力。(邻基参与重排) (5)亲核性溶剂影响加成产物,提高卤负离子浓度有利影响加成主产物。 (6)添加氧化剂将卤负离子氧化为分子,可影响加成产物。 (7)过硫酸氢钾(oxone)与氯化钠或溴化钠可迅速释放出Cl和Br,原位反应。 (8)除离子型加成外,自由基加成适合含吸电子基团的双键。 卤素与炔烃加成 二、不饱和羧酸的卤内酯反应(X-OR)
三、不饱和烃和次卤酸(酯)、N-卤代酰胺的反应(X-OH、X-OR、 X-Nu) 次卤酸及其酯为卤化剂 N-卤代酰胺为卤化剂 包括:N-溴(氯)代乙酰胺(NBA、NCA) N-溴(氯)代丁二酰亚胺(NBS、NCS) 次卤酸及其酯为卤化剂 (1)卤化剂(X-OH) :烯烃→β-卤醇(马氏定位) (2)次卤酸具有氧化性,需要新鲜制备。 方法:将Cl2或Br2在中性或含汞盐的碱性水溶液反应而成。也可以采用次氯酸盐在中性或弱酸性条件下进行。 (3)次卤酸酯(ROX), 机理与次卤酸相同,可在非水溶液中进行,得到β-卤醇衍生物。 N-卤代酰胺为卤化剂
药物合成卤化反应习 题
精品文档 收集于网络,如有侵权请联系管理员删除 题库 第一章 卤化反应 1 卤化反应在有机合成中的应用?为什么常用一些卤代物作为反应中间体? 2 归纳下常用的氯化剂、溴化剂都有哪些?它们的主要理化性质及应用范围? 3 根据反应历程的不同,讨论一下卤化反应的类型、机理及对反应的影响。 (1) 卤素对双键的离子型加成 (2) 芳香环上的取代 (3) 方向化合物侧链上的取代 (4) 卤化氢对醇羟基的置换 (5) NBS 的取代反应 4 比较X 2、HX 、HOX 对双键的离子型加成反应的机理又何异同点。怎样判断加成方向 5 在-OH 得置换反应中各种卤化剂各有何特点?他们的应用范围如何? 6 预测Br 2/CCl 4于下列各种烯烃进行溴化反应的相对速度的次序。 CH 2=CH 2 (CH 3)2C=CH 2 HOOC-CH=CH-COOH (CH 3)2C=C(CH 3)2 CH 3CH 2=CH 2 CH 2=CH-CN 7 根据反应机理,指出下列反应的产物应属何种构型?(如苏式、赤式、R 、S 等) 8 解释下列反应机理 9 对比下列反应的条件有何不同?结合反应机理加以说明: H 3C CH CH 2 H 3C CH 2CH 2Br H 3C CHBr CH 3 CH 3CH 3 CH 2Cl Cl RH 2C CH CH 2RH 2C CH CH 2 RH 2C C CH 2OH (1)(2)(3) 10 在对氯氯苄ClC6H4CH2C1的植被中有如下两种路线,如按1进行需要什么条件?2发有何特点?讨论他们的优缺点。 11 下列反应选用何种氯化剂为好?说明原因。 H 3C C CH CH 3CH 3H 3C HC CH COOH H 3C C CH CH 2Br CH 3 H 3C HC CH COCl (1)(2)(3) (4) (5)(6)(7) HO (CH 2)6OH IH 2C (CH 2)4CH 2OH H 2C HC (CH 2)6COOH H 2C C (CH 2)6 COOH Br H 2C (CH 2)6COOH Cl CH 2CH 2COOH H 3CCO CH 2CHCOBr H 3CCO CH 2OH H 3CO CH 2Cl H 3CO N COCl Cl Cl N COOH HO OH N COOH Cl Cl N COCl HO OH 12 完成下列反应,写出主要的试剂及反应条件:
第五章卤代烷 烷烃中的氢被卤素取代的产物称卤代烷(Haloalkane)。 根据碳的种类,一级、二级、三级卤代烷。 RCH2X R2CHX R3CX 伯、仲、叔卤代烷 卤素数,一卤、二卤、多卤代烷。 一.命名 1.普通(习惯)命名 简单卤代烷 一卤代烷,烷基卤化物。 F CH3CH2CH2Cl (CH3)2CHBr (CH3)3CI 正丙基氯异丙基溴叔丁基碘环己基氟 n-propyl chloride isopropyl bromide tert-butyl iodide cyclohexyl fluoride 多卤代烷,特殊名称: CHCl3CHI3 CCl4 氯仿碘仿四氯化碳 chloroform iodoform carbon tetrachloride 2.IUPAC命名
卤素作取代基, I > Br > Cl > F > R 3-甲基-2-氯戊烷 (3R, 5R)-3,5-二甲基-5-溴辛烷 2-chloro-3-methylpentane (3R, 5R)-5-bromo-3,5-dimethyloctane (1R, 2R)-1-溴-2-碘环己烷 (1R, 2R)-1-bromo-2-iodocyclohexane 二.一卤代烷的制法 1.烃的卤化 C H 2 CH 3CH 2CH C CH 2CH 3 CH 3CH 3CH 3CHCHCH 2CH 3 3 2Cl
少数烃 2.烯烃加成 3.醇的卤代 三.一卤代烷的化学性质 C -X :极性大,键能小。 易进行反应。 1. 取代反应 亲核试剂进攻带正电的碳,原有的基团被取代离去, 称亲核取代反应(Nucleophilic Substituition Reaction ),S N 。 Nucleophile Substrate Product Leaving group RCH=CH 2 HX C CH 3 R H ROH HX RX Nu -+R-X R-Nu +X - Nu -C
化学反应进行的方向 【教学目标】 1、了解反应的自发性与反应过程中能量变化及熵值变化的关系; 2、能够用熵增原理判断化学反应进行的方向。 【教学重难点】 能够用熵增原理判断化学反应进行的方向 【教学过程设计】 〖引入〗水往低处流,而不会自发的向上流;一般在室温下,冰块会融化,铁器在潮湿空气中会生锈,甲烷与氧气的混合气体遇明火就燃烧,这些过程都是自发的。这些不用借助于外力就可以自动进行的自发过程的共同特点是,体系会对外部做功或释放热量,即体系趋向于从高能状态转变为低能状态。那是否就意味着放热反应自发进行,吸热反应就是非自发进行呢? 〖副板书〗在25℃和1.01×105Pa时, 2N2O5(g)== 4NO2(g)+O2(g) ?H=56.7 kJ/mol (NH4)2CO3(s)== NH4 HCO3(s)+NH3(g) ?H=74.9 kJ/mol 〖分析〗不难看出,上述两个反应都是吸热反应,显然只根据反应热(焓变)来判断反应进行的方向是不全面的。那么究竟如何来判断反应的自发性呢? 科学家根据体系存在着力图使自身能量趋于“最低”和由“有序”变为“无序”的自然现象,提出了互相关联的能量判据和熵判据,为最终解决反应自发性问题提供了必要的依据。 〖讲解〗除自发的化学反应外,还有一类自发过程,例如放在同一密闭容器中的气体或液体物质(也包括能够挥发的固态物质)的蒸汽,不需要外界的任何作用,气态物质会通过分子的扩散自发地形成均匀混合物。这种现象可以推广到相互接触的固体物质体系,经过长期放置后,人们能够找到通过扩散而进入的另一种固体中的原子或分子(这种现象可以作为纯物质难以保存的最本质的解释)。又如把硝酸铵溶于水虽然要吸热,它却能够自发地向水中扩散。为了解释这样一类与能量状态的高低无关的过程的自发性,人们提出在自然界还存在着另一种能够推动体系变化的因素,即在密闭条件下,体系有由有序自发地转变为无序的倾向。因为与有序体系相比,无序体系“更加稳定”,可以采取更多的存在方式。以扑克牌为例,经过多次的洗牌之后,严格按照花色和序号排列的机会与花色序号毫无规律的混乱排列的机会相比,大概要相差几十个数量级。科学家把这种因素称作熵。〖板书〗熵: 1、概念:描述体系混乱度的物理量 2、符号:S 3、单位:J?mol-1?K-1 4、熵判据:在与外界隔离的体系中,自发过程将导致体系的熵增大,这个原
第二章 卤代烃 一.卤代烃的结构特点:卤素原子是卤代烃的官能团。C —X 之间的共用电子对偏向X , 形成一个极性较强的共价键,分子中C —X 键易断裂。 二.卤代烃的物理性质 (1)溶解性:不溶于水,易溶于大多数有机溶剂。 (2)状态、密度:CH 3Cl 常温下呈气态,C 2H 5Br 、CH 2Cl 2、CHCl 3、CCl 4常温下呈液态且密度> 1 g/cm 3 。(一氯代烃的密度都小于水) 三.卤代烃的化学性质(以CH 3CH 2Br 为例) 1.取代反应 ①条件:强碱的水溶液,加热 ②化学方程式为: 2.消去反应 (1)实质:从分子中相邻的两个碳原子上脱去一个卤化氢分子,从而形成不饱和化合物。 例如: CH 3CH 2Cl : +NaOH ――→醇△ NaCl +CH 2===CH↑+H 2O (2)卤代烃的消去反应规律 ①没有邻位碳原子的卤代烃不能发生消去反应,如CH 3Br 。 ②有邻位碳原子,但邻位碳原子上不存在氢原子的卤代烃也不能发生消去反应。例如: 。
③有两个相邻碳原子,且碳原子上均带有氢原子时,发生消去反应可能生成不同的产物。例: CH 3—CH===CH —CH 3+NaCl +H 2O (3)二元卤代烃发生消去反应时要比一元卤代烃困难些。有些二元卤代烃发生消去反应后可在 有机物中引入三键。例如:CH 3—CH 2—CHCl 2+2NaOH ――→醇△ CH 3—C≡CH+2NaCl +2H 2O 四.消去反应与水解反应的比较 反应类型 反应条件 键的变化 卤代烃的结构特点 主要生成物 水解反应 NaOH 水溶液 C —X 与H —O 键断裂C —O 与H —X 键生成 含C —X 即可 醇 消去反应 NaOH 醇溶液 C —X 与C —H 键断裂 (或—C≡C—) 与H —X 键生成 与X 相连的C 的邻位C 上有H 烯烃或炔烃 特别提醒 (1)通过卤代烃的水解反应可在碳链上引入羟基;通过卤代烃的消去反应可在碳链上引入碳碳双键或碳碳三键。 五.检验卤代烃分子中卤素的方法(X 表示卤素原子) 1.实验原理 R —X +H 2O ――→NaOH △ R —OH +HX HX +NaOH===NaX +H 2O HNO 3+NaOH===NaNO 3+H 2O AgNO 3+NaX===AgX↓+NaNO 3 根据沉淀(AgX)的颜色可确定卤素:AgCl(白色)、AgBr(浅黄色)、AgI(黄色)。 2.实验步骤 (1)取少量卤代烃;(2)加入NaOH 水溶液;(3)加热;(4)冷却;(5)加入稀HNO 3酸化; (6)加入AgNO 3溶液,观察沉淀的颜色。 即RX ――→加NaOH 水溶液△R —OH NaX ――→加稀HNO 3酸化R —OH HX
第二章 卤化反应 练习题 一、完成下列反应 1、 OH POCl 3 2、 HN OH OH SOCl 2CHCl 3 ? 3、 N N H 3CS OH OH +POCl 3+PCl 3 KF ? ? 4、 N O OH PCl 3 Cl 2 HPO3 HCl ? 5 N N N N OH O PCl 5 PCl 3 HCl ? 6、 N N N N OH O Br 2 ? 7、 O N N N O O O Cl Cl Cl ? ? 8、 O O Cl 2 H 2O ? ? 9、
Cl O (HCOH)3 ZnCl 2 ? 10、 NH 2 NH Br 2 CH 3ONa NaBr CH 3OH ? 11、 N OH OH POCl 3 ? 12、 POCl 3 OH OH ? 13、 N N POCl 3 O O ? 14、 O O O N O O Br ? ? 15、 N N OH POCl 3 ? 16、 POCl 3 N N OH HO NH 2 ? 17、 N O O H Br 2 NaOH NaBr H 2O ?
18、 N O O H NaOCl CH 3COONa H 2O CH 3OOH ? 19、 O OH O Cl S O Cl HCl SO 2 ? 20、 N H O NaClO NaOH ? 21、 O O O N O O Br ? ? 22、 S N O O Br ? ? 23、 POCl 3 N N OH NH 2? 24、 O Cl 2 NaCN ? ? 25、 OH O SOCl 2 HCl SO 2 ? 26、
3 卤化 反应 在有机化合物中建立碳-卤键的反应称为卤化反应。意义:在药物分子中引入卤素可改善其药理活性;卤化物是药物合成重要的中间体,可从卤素进行多种官能团转化;卤素可作为烯烃等官能团的保护基,可提高合成的选择性。 3.1不饱和烃与含卤物种的加成卤化 含卤物种主要包括卤素和卤化氢。 3.1.1卤素对不饱和烃的加成反应 (1)对烯烃的加成 氟与烯烃的加成过于剧烈,产物复杂,实用意义不大;二碘化物对光极为敏感,稳定性差,在药物合成中也不常用。而氯和溴对烯烃的加成在药物合成上较为重要。 氯和溴对烯烃的加成反应为亲电加成机理,是脂肪族碳碳p键的典型反应之一。这种加成主要包括两步反应:亲电试剂加成到亲核性的p键上得到一个碳正离子(或环鎓离子);得到的碳正离子(或环鎓离子)与亲核试剂反应。参与第二步反应的亲核试剂一般是与亲电试剂相关的负离子,比如溴离子、氯离子等,也可以是亲核性的溶剂,如水或乙酸等。 ①反应机理 碳碳双键上的亲电加成。
②立体化学 氯和溴对烯烃的加成反应的立体化学较为复杂, 与底物结构、反应条件和加成物有关。 反式加成:一般情况下,溴对烯烃的亲电加成反应会经过三员环过渡态(中间体),当这种中间体在反应条件下比较稳定时,可发生反式亲电加成。 cis-和trans-2-丁烯的立体专一性反式加成: 由于两个溴原子分别从双键的相反方向加成,所以得到立体专一产物。 顺式加成:氯加到双键上有时也可得到顺式加成产物,这类反应一般在非极性溶剂中发生,如茚氯化生成cis-1,2-二氯茚。 有几项因素决定了这个氯化加成的立体化学,其一,反应物是氯而不是溴;其二,底物分子的双键处在芳环的共轭位置;其三,反应在非极性溶剂薪 小?lt;/p>
课题:化学反应进行的方向及判断依据 设计者:浙江省磐安中学周岚岚 2010年6月1日 设计意图:让学生先从生活中的自发过程实例出发,展示有关情境图片,指出自发过程是“在一定条件下无需外界帮助就能自动进行的过程。”从中得出自发过程能发生的规律:1、能量趋于“最低”的趋势2、“有序”变为“无序”的规律。然后请学生找能自发进行的反应,同时介绍几个吸热反应,从所举的例子中找到影响化学反应自发进行因素:1、能量降低- 放热反应(焓变△H<0)2、混乱度增大(熵变△S 2011-2012学年高二化学选修4(人教版)同步练习第二章 第四节化学反应进行的方向 一.教学内容: 化学反应进行的方向 二.重点、难点: 1.能利用焓变和熵变说明反应进行的方向 2.熵判据既是本节的重点,也是难点 三.具体内容: (一)自发过程和自发反应 1.自发过程 2.自发反应 3.举例 (二)反应熵变与反应方向 1.熵 2.熵变 3.反应的自发过程与熵变 (三)焓变与熵变对反应方向的共同影响 1.焓和熵的关系 2.焓变和熵变的影响 3.化学反应方向的判据 4.对反应方向判据的讨论 【典型例题】 [例1]试判断用于汽车净化的一个反应2NO(g)+2CO(g)=N2(g)+2CO2(g)在298K、100kPa下能否自发进行? 已知:在298K、100kPa下该反应的△H=-113.0kJ·mol-1, △S=-145.3J·mol-1·K-1 答案:可以自发进行。 解析:考察利用公式计算判断自发反应过程。 [例2]已知在298.15K、100kPa下石灰石分解反应: CaCO3(s)=CaO(s)+CO2(g)△H=+178.3kJ·mol-1△S=+160.4J·mol-1·K-1,试判断反应的自发性及自发进行的最低温度。 答案:非自发反应;1112K。 解析:考察基本公式的转化应用。 [例3]碳铵「(NH4)2CO3」在室温下就能自发的分解产生氨气,对其说法中正确的是() A.碳铵分解是因为生成易挥发的气体,使体系的熵增大 B.碳铵分解是因为外界给予了能量 C.碳铵分解是吸热反应,根据能量判断不能自发分解 D.碳酸盐都不稳定,都能自发分解 答案:A 解析:考察反应方向的基本判断。 [例4]下列过程属于熵增加的是() A.一定条件下,水由气态变成液态 B.高温高压条件下使石墨转变成金刚石 C.2N2O5(g)=4NO2(g)+O2(g) D.散落的火柴的无序排列 答案:CD 解析:有关熵的判断。 [例5]下列反应是自发进行的吸热反应的是() A.NaOH+HCl=NaCl+H2O B.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) C.2CO+O2点燃 2CO2 D.C(s)+H2O(g)高温 CO(g)+H2(g) 第一章 卤化反应练习题 一、举例说明或解释以下人名反应。 1. Dalton 反应 2. Hunsdriecke 反应 3. Kochi 改良法 4. Barton 改良法 5. Finkelstein 反应 6. Sandmeyer 反应 7. Gattermann 反应 8. Schiemann 反应 二、请选出下列反应的主产物。 OH POCl 3 1. ( ) Cl A. Cl Cl Cl B. C. D. OH Cl Cl HN OH OH SOCl 23 2.( ) N Cl OH OH A.HN Cl Cl B.HN Cl OH C.N Cl Cl Cl D. N H 3CS OH OH +POCl 3+PCl 3 KF ( )( ) 3. N N H 3CS OH OH N N H 3CS OH OH A. B.C. D.N N H 3CS Cl Cl N N H 3CS Cl Cl N N H 3CS Cl Cl N N H 3CS OH F N N H 3CS Cl Cl N N H 3CS F F Cl F F N O OH PCl 3 Cl 2 4.( ) A. B. C. D.N O Cl N O OH N O Cl Cl Cl N O OH Cl N N OH O PCl 5 5. ( ) A. B. C. D.N N N N Cl O N N N N Cl O N N N N OH O N N N N OH O Cl Cl Cl N N N OH O Br 2 6. ( ) N N N N OH O Br A. B. C. D.N N N N OH O Br N N N N Br O Br N N N N OH O Br Br O N N N O O O Cl Cl Cl 7. ( ) ( ) O N N N O O O H Cl Cl Cl A. B.C. D.O N N H N O O O H Cl Cl O N N H N O O O H Cl Cl HN N H N O O O H Cl O Cl Cl O O Cl 2 H 2O 8. ( ) ( ) A. B. C. D. HO Cl O O Cl Cl Cl O O Cl O Cl Cl Cl O Cl HO Cl O O Cl Cl Cl O (HCOH)3 ZnCl 2 9. ( ) O O Cl A. B. C. D. O O O O Cl O O OH Cl 第一章 卤化反应 1、归纳本章所用的氯化剂、溴化剂都有哪些?它们的主要理化性质及应用范围? 2、下列反应是以1-丙烯为原料分别合成化合物(1)和(2),指出这两条合成路线的反应 条件,并对比这两条路线有何不同?结合反应机理加以解释: H 3C C H CH 2 H 3C C CH 2Br H 3C H CH 3 Br H H (1) (2) 3、下列反应是以甲基苯为原料分别合成化合物(1)和(2),指出这两条合成路线的反应 条件,并对比这两条路线有何不同?结合反应机理加以解释: CH 3 CH 3 Cl CH 2Cl (1) (2) 4、完成下列反应,写出主要的试剂及反应条件: OH COOH OH COCl (1) (2) (3) (4) CH 3 CBr 3 CH 3COOH FCH 2COOH O COOH O I 5、完成下列反应,写出其主要生成物: H3C C CH CH3 H3Ca(OCl)2/HOAc/H2O (1) (2) (3) HC CH2 NBS/H2O (CH3)2C=CHCH2CH=CH CH2=CH-COO-CH=CH 6、比较下列不同结构的烯烃进行卤化反应的难易,并陈述原因。CH3CH=CH2、HOOCCH=CHCOOH、(CH3)2CH=CH2、CH2=CH2、(CH3)2CH=CH(CH3)2 7、写出△5-甾体烯与溴加成的主要产物,并简述原因。 8、为了得到α-卤代醛,最经典的方法是将醛转化成烯醇,然后再和卤素反应。写出下列制 备α-溴代醛的反应机理。 CH3(CH2)5CHO Ac2O/AcOK CH3(CH2)4 Br2/H2O (95%) CH3(CH2)4CHCHO Br 《化学反应进行的方向》教学设计 一、教材分析与学情分析 本节课内容介绍了“焓判据、熵判据及自由能判据(△G=△H-T△S)”知识,有一定难度。人教版教材将本节内容安排在学生学习了化学反应及其能量变化、化学反应速率、化学平衡之后以知识介绍的方式呈现出来,让学生了解焓变只与初末状态有关而与途径无关,决定反应进行方向的因素不是单一的焓变,熵变也是决定因素之一。 教材从学生已有的知识和生活经验出发,分四个层次就化学反应的方向进行了介绍。第一,以学生熟悉的爬山方式,介绍焓变与途径无关,再以自发进行的放热反应为例,介绍化学反应有向能量降低的方向自发进行的倾向——焓判据;以生活现象为例,说明混乱度(熵)增加是自然界的普遍规律,也是化学反应自发进行的一种倾向——熵判据。第二,用实例说明单独运用上述判据中的任一种,都可能出现错误,都不是全面的。第三,要正确的判断化学反应的方向,需要综合考虑焓变和熵变的复合判据。第四,简单介绍了自由能判据的结论性内容。 二、教学目标 1、知识与技能: (1)理解判断化学反应方向的焓判据及熵判据; (2)能用焓变和熵变说明化学反应的方向; 2、过程与方法: 通过学生已有知识及日常生活中的见闻,构建化学反应方向的判据。学会运用比较、归纳、概括等方法对信息进行加工,构建新知识。 3、情感态度与价值观: (1)激发学生的学习兴趣,培养学生从微观的角度理解化学反应,培养学生尊重科学、严谨求学、勤于思考的态度,树立透过现象看本质的唯物主义观点。 (2)通过本节内容的学习,体会事物的发展、变化常常受多种因素的制约,要全面分析问题。 三、教学的重点和难点 焓判据、熵判据、自由能判据与化学反应方向的关系 四、教学方法 1、应用讨论交流的方法调动学生的积极性,充分发挥学生的想象力; 2、启发学生学会归纳、概括,对信息进行加工,得出结论; 3、注重从学生已有知识及日常生活的经验上构建新知识。 五、教学过程 第五章 卤代烷烃§5.1 卤代烷烃的分类和命名§5.2 一卤代烷烃的结构和物理性质§5.3 一卤代烷烃的化学性质§5.4 亲核取代反应的机理 §5.5 一卤代烷的制法 Chapter 5 Haloalkanes 卤代烃是烃分子中一个或多个氢原子被子卤素(F、Cl、Br、I)取代的衍生物,它在自然界中存在极少,绝大多数是人工合成的。 比比皆是的聚氯乙烯制品,千家万户使用的冰箱中的致冷剂、防火必备的四氯化碳灭火剂等到处都是卤代烃。 卤代烃也是实验室中最常用的有机化合物,它经常起着从一种化合物变成另一种化合物的桥梁作用,是有机合成中经常用到的化合物。 人们在使用卤代烃的同时,也带来了严重的污染问题,六六六被禁用,DDT被取缔。近年来,科学家证明臭氧层空洞的形成与使 用氟氯烃有关。 可见,只有掌握卤代烃的性质及其反应规律,才能驾驭其上,造福于人类。 §5.1卤代烷的分类和命名 一元卤代烃二元卤代烃多元卤代烃 (1)按卤代烷分子中所含卤原子数目的多少 C 2H 5I CH 2CH 2Br Br CH 2CH 2Cl Cl 2(2)按卤原子所连接碳原子的种类:伯卤代烃 仲卤代烃叔卤代烃 R -C H 2-X R R C H-X R R C -X R 1、卤代烷的分类 2、卤代烷的命名 (1)习惯命名法 烷基名称+卤原子名称 CH 3CH CH 2Cl CH 3C CH 3CH 3CH 3 Br 异丁基氯叔丁基溴 (2)系统命名法 选母体:看成是烷烃的卤素衍生物,根据主链的碳原子 数称为“某”烷。 定编号:遵循最低系列原则;当连有两个取代基且其 一为卤原子时,应给卤原子较大的编号。 写取代基:按立体化学中的次序规则顺序列出CH 3-CH-CH-CH 3 Cl CH 3CH 3C CH CH 3CH 2CH 3 Cl Cl 1 2 3 4 5戊烷 3-甲基-2,2-二氯丁烷4 3 2 12-甲基-3-氯 化学反应进行的方向习 题 https://www.doczj.com/doc/338416491.html,work Information Technology Company.2020YEAR 化学反应进行的方向课后作业 1. 下列说法正确的是(A) A. 放热反应不一定是自发进行的反应 B. 吸热反应一定是非自发进行的 C. 自发进行的反应一定容易发生 D. 反应速率快的一定是自发进行的 2. 能用能量判据判断下列过程的方向的是(A) A. 水总是自发地由高处往低处流 B. 放热反应容易自发进行,吸热反应不能自发进行 C. 有序排列的火柴散落时成为无序排列 D. 多次洗牌以后,扑克牌的毫无规律的混乱排列的几率大 3. 对于化学反应方向的确定,下列说法正确的是(AB) A. 在温度、压力一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 B. 温度、压力一定时,放热的熵增加反应一定能自发进行 C. 反应焓变是决定反应能否自发进行的唯一因素 D. 固体的溶解过程与焓变有关 4. 下列反应中,在高温下不能自发进行的是(A) A. B. C. D. 5. 高温时空气中的和会反应生成NO而污染大气: 。试通过计算说明在1200℃的条件下,此反应能否正向自发进行估算自发进行的最低温度是多少(已知△H=,△S= )。 分析:1200℃=1473K。 (1)由化学反应能否自发进行的判据△H-T△S可知, 若△H-T△S<0,反应能自发进行 若△H-T△S=0,反应达到平衡状态 若△H-T△S>0,反应不能自发进行 该反应的△H-T△S= <0 所以,该反应在1200℃时能自发进行。 (2)反应要自发进行,必须△H-T△S<0。 即 反应自发进行的最低温度: 。 答案:(1)1200℃能自发进行(2)自发进行的最低温度是 6. 当铁丝加热后放入氧气中可观察到的现象是_____________,说明这个反应是_____________反应(填“吸热”或“放热”),说明单质铁的稳定性___________ __(填“强”或“弱”)于产物。 分析:铁丝加热后放入氧气中,可以发生反应,因为反应放出大量的热,使铁丝产生红热现象,最后燃烧,火星四射,生成黑色的。反应后生成的比铁单质更稳定。 答案:铁丝红热、火星四射、有黑色固体生成;放热;弱 【精选试题】 1. 吸热反应一定是 A. 非自发的化学反应 B. 释放能量 C. 贮存能量 D. 反应需要加热 2. 过程的自发性的作用是 第五章卤化 第一节概述 一、卤化反应及其重要性 向有机化合物分子中引入卤素(X)生成C-X键的反应称为卤化反应。按卤原子的不同,可以分成氟化、氯化、溴化和碘化。卤化有机物通常有卤代烃、卤代芳烃、酰卤等。在这些卤化物中,由于氯的衍生物制备最经济,氯化剂来源广泛,所以氯化在工业上大量应用;溴化、碘化的应用较少;氟的自然资源较广,许多氟化物具有较突出的性能,近年来人们对含氟化合物的合成十分重视。 卤化是精细化学品合成中重要反应之一。通过卤化反应,可实现如下主要目的:(1)增加有机物分子极性,从而可以通过卤素的转换制备含有其它取代基的衍生物,如卤素置换成羟基、氨基、烷氧基等。其中溴化物中的溴原子比较活泼,较易为其它基团置换,常被应用于精细有机合成中的官能团转换。 (2)通过卤化反应制备的许多有机卤化物本身就是重要的中间体,可以用来合成染料、农药、香料、医药等精细化学品。 (3)向某些精细化学品中引入一个或多个卤原子,还可以改进其性能。例如,含有三氟甲基的染料有很好的日晒牢度;铜酞菁分子中引入不同氯、溴原子,可制备不同黄光绿色调的颜料;向某些有机化合物分子中引入多个卤原子,可以增进有机物的阻燃性。 二、卤化类型及卤化剂 卤化反应主要包括三种类型:即卤原子与不饱和烃的卤加成反应、卤原子与有机物氢原子之间的卤取代反应和卤原子与氢以外的其他原子或基团的卤置换反应。 卤化时常用的卤化剂有:卤素单质、卤素的酸和氧化剂、次卤酸、金属和非金属的卤化物等,其中卤素应用最广,尤其是氯气。但对于F2,由于活性太高,一般不能直接用作氟化剂,只能采用间接的方法获得氟衍生物。 上述卤化剂中,用于取代和加成卤化的卤化剂有:卤素(Cl2、Br2、I2)、氢卤酸和氧化剂(HCl+NaClO、HCl+NaClO3、HBr+NaBrO、HBr+NaBrO3)及其他卤化剂(SO2Cl2、SOCl2、HOCl、COCl2、SCl2、ICl)等,用于置换卤化的卤化剂有HF、KF、NaF、SbF3、HCl、PCl3、HBr等。 第二节取代卤化 取代卤化是合成有机卤化物最重要的途径,主要包括芳环上的取代卤化、芳环侧链及脂肪烃的取代卤化。取代卤化以取代氯化和取代溴化最为常见。 一、芳环上的取代卤化 影响因素及反应条件的选择 《化学反应进行的方向》教学设计 〖教学目标〗 知识与技能:了解反应的自发性与反应过程中能量变化及熵值变化的关系;能用焓变和熵变说明化学反应的方向。 过程与方法:通过联系日常生活中的见闻以及自然界的普遍变化规律,引导学生理解判断反应自发进行的两个因素,使学生构建化学反应方向的判据,学会从现象分析到理论探究的科学方法,学会运用比较、归纳、概括等方法对信息进行加工,构建新知识。 情感态度与价值观:体会事物的发展、变化常常受多种因素的制约,学会全面分析问题。 〖教学重点〗焓变和熵变与化学反应方向的关系 〖教学难点〗焓变和熵变与化学反应方向的关系 〖教学方法〗讨论交流、分析、概括、归纳 〖教学过程〗 教师活动 学生活动 设计意图 【课的引入】汽车尾气中的主要污染物是NO 和CO,是大气污染物。人们提出通过以下反应来处理汽车尾气以减轻污染。 2NO(g)+2CO(g)=N2(g)+2CO2(g), 这个方案是否可行? 【讲述】上述问题是化学反应的方向的问题。反应进行的快慢、限度和方向是化学反应原理的三个重要组成部分。通过前三节的学习和讨论,我们已经初步解决了反应的快慢和限度问题,这节课我们来讨论化学反应进行的方向问题。 【提问】举例说说生活中我们见过的一些自发过程,就是在一定条件下不需外力作用就能自动进行的过程。 【提问】从能量的角度分析同学们提到的这些过程有什么共同特点? 【追问】阅读教材中提供的热化学反应方程式,结合前面总结的特点尝试总结规律:判断某一过程能能否自发进行的依据。 【讲述】科学家根据体系存在着力图使自身能量趋于“最低”的自然现象,提出了焓判据为反应方向的判断提供了必要的依据。 【板书】一、反应方向的焓判据 【指出】多数自发进行的化学反应是放热反应,但也有不少吸热反应能自发进行。如:硝酸铵溶于水要吸热,室温下冰块的溶解要吸热……阅读教材中提供的热化学反应方程式,努力分析这些吸热反应能够自发进行的共同 化学反应进行的方向 【学习目标】 1、了解放热反应的自发性和某些吸热过程的自发性; 2、能用焓变和熵变判断化学反应的方向。 【要点梳理】 要点一、自发过程与自发反应 1、自发过程 ①含义:在一定条件下,不用借助外力就可以自发进行的过程。 ②分类 a.体系趋向于从高能状态转变为低能状态(体系对外部做功或者释放热量)。 b.在密闭条件下,体系有从有序自发转变为无序的倾向。 ④实例 a.自然界中,水由高处往低处流,而不会自动从低处往高处流。 b.物理学中,电流总是从电位高的地方向电位低的地方流动。 c.日常生活中,气温升高,冰雪自动融化。 2、自发反应 在给定的条件下,可以自发进行到显著程度的反应。 3、自发过程和自发反应的特点 ①具有方向性,如果某个方向的反应在一定条件下是自发的,则其逆方向的反应在该条件下肯定不自发,如铁器暴露于潮湿的空气中会生锈是自发的,而铁锈变为铁在该条件下肯定不是自发的。 ②要想使非自发过程发生,则必须对它做功,如利用水泵可使水从低处升到高处,通电可将水分解生成氢气和氧气。 4、自发过程和自发反应的应用 自发过程和自发反应可被利用来完成有用功。如向下流动的水可推动机器,甲烷可在内燃机中被用来做功,锌与CuSO4溶液的反应可被设计成原电池,可根据氢气的燃烧反应设计成燃料电池等。 要点诠释:过程的自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率。 如涂有防锈漆和未涂防锈漆的钢制器件,其发生腐蚀过程的自发性是相同的,但只有后者可以实现。 要点二、化学反应进行方向的判据 1、焓判据 ①概念:体系总是趋向于从高能状态转化为低能状态(这时体系往往会对外部做功或释放能量),该判据又称能量判据。 ②应用:由焓判据知,放热过程(ΔH<0)常常是容易自发进行的。 ③焓判据的局限性 2N2O5 (g)==4NO2 (g)+O2 (g) ΔH=+56.7 kJ·mol-1 (NH4)2CO3 (s)==NH4HCO3 (s)+NH3(g) ΔH=+74.9 kJ·mol-1 以上两个反应都是吸热反应,但是也可以自发进行。因此焓变是影响反应自发进行的因素,但不是唯一因素。 2、熵判据 ①熵 a.概念:表示体系的不规则或无序状态程度的物理量,熵的符号为S,单位J/(mol·K)。 b.实质:用来描述体系的“混乱度”,是物质的一个状态函数,熵值越大,体系的混乱度越大。 c.影响熵大小的因素 Ⅰ.同一条件下,不同的物质熵值不同。 Ⅱ.同一物质的熵与其聚集状态及外界条件有关。一般地,对同一物质而言:S (g)>S (1)>S (s)。 ②熵判据 a.熵增原理 在与外界隔离的体系中,自发过程的体系趋向于由有序转变为无序,导致体系的熵增大,这一经验规律叫做熵增原理。在用来判断过程的方向时,就称为熵判据。 b.应用:由熵判据知,熵增(ΔS>0)的过程常常是自发进行的。 第一章 卤化反应 1 卤化反应在有机合成中的应用?为什么常用一些卤代物作为反应中间体? 2 归纳下常用的氯化剂、溴化剂都有哪些?它们的主要理化性质及应用范围? 3 根据反应历程的不同,讨论一下卤化反应的类型、机理及对反应的影响。 (1) 卤素对双键的离子型加成 (2) 芳香环上的取代 (3) 方向化合物侧链上的取代 (4) 卤化氢对醇羟基的置换 (5) NBS 的取代反应 4 比较X 2、HX 、HOX 对双键的离子型加成反应的机理又何异同点。怎样判断加成方向 5 在-OH 得置换反应中各种卤化剂各有何特点?他们的应用范围如何? 6 预测Br 2/CCl 4于下列各种烯烃进行溴化反应的相对速度的次序。 CH 2=CH 2 (CH 3)2C=CH 2 HOOC-CH=CH-COOH (CH 3)2C=C(CH 3)2 CH 3CH 2=CH 2 CH 2=CH-CN 7对比下列反应的条件有何不同?结合反应机理加以说明: H 3C CH CH 2 H 3C CH 2CH 2Br H 3C CHBr CH 3 CH 3CH 3 CH 2Cl Cl RH 2C CH CH 2RH 2C CH CH 2 RH 2C C CH 2 OH (1)(2)(3) 8 下列反应选用何种氯化剂为好?说明原因。 H3C C CH CH3 3 H3C HC CH COOH H3C C CH CH 2Br 3 H3C HC CH COCl (1) (2) (3) (4) (5) (6) (7)HO(CH2)6OH IH2C(CH2)4CH2OH H2C HC(CH2)6COOH H2C C(CH2)6COOH Br H2C(CH2 )6 COOH CH2CH2COOH H3CCO CH2CHCOBr H3CCO CH2OH H3CO CH2Cl H3CO Br N COCl Cl Cl N COOH HO OH N COOH Cl Cl N COCl HO OH 9 完成下列反应,写出主要的试剂及反应条件: OH COOH OH COCl (1) (2) (3) (4) CH3CF3 CH3COOH FXH2COOH O COOH O I 10完成下列反应,写出其主要生成物 H3C C CH CH3 H322 (1) (2) (3) (4) (5) HC CH2 NBS/H2O CH3C CH 22 OH48%HBr CH2CH=CHCH2CH=CHBr CH2=CH-COO-CH-CH2 (CH3)2C=CHCH2CH=CH2 24 《化学反应进行的方向》知识点整理 《化学反应进行的方向》知识点整理 (一)自发过程与非自发过程:不借助外力可以自动进行的过程称为自发过程,而必须在外力的作用下才能进行的过程为非自发过程。说明: 1、体系有着趋于从能量高的状态变为能量低的状态的过程,此时体系对外界做功或放出能量这一经验规律就是能量判据。能量判据又称焓判据,即△H< 0的反应有自发进行的倾向,焓判据是判断化学反应进行方向的判据之一。 2、多数能自发进行的化学反应是放热反应。即反应物的总能量大于生成物的总能量。但并不是放热反应都能自发进行,也不是讲吸热反应就不能自发进行。某些吸热反应也能自发进行,如氯化铵与氢氧化钡晶体的反应,还有一些吸热反应在高温下也能自发进行。 3、混乱度:表示体系的不规则或无序状态。混乱度的增加意味着体系变得更加无序。熵是热力学上用来表示混乱度的状态函数,符号为S,单位为:Jmol-1K-1 。体系的无序性越高,即混乱度越高,熵值就越大。 4、在相同条件下,不同物质的熵值不同,同一物质在不同状态时的熵值大小也不一样,一般而言:固态时熵值最小,气态时熵值最大。 5、熵变:化学反应中要发生物质的变化或物质状态的变化,因此存在混乱度的变化,叫做熵变,符号:△S △S=S产物-S反应物。在密闭条件下,体系由有序自发地转变为无序的倾向熵增 6、自发过程的熵判据:在与外界隔离的体系中,自发过程将导致体系的熵增大,这一经验规律叫做熵增原理,是判断化学反应方向的另一判据熵判据。 7、判断某一反应能否自发进行,要研究分析:焓判据和熵判据对反应方向的共同影响。 (二)化学反应进行的方向:在一定的条件下,一个化学反应能否自发进行,既可能与反应的焓变有关,又可能与反应的熵变有关。在温度、压力一定的条件下,化学反应的方向是熵变和焓变共同影响的结果,反应的判据是:DH-TDS(T为热力学温度,均为正值)。 DH-TDS<0,反应能自发进行; DH-TDS=0,反应达到平衡状态; DH-TDS>0,反应不能自发进行。即:在温度、压力一定的条件下,自发反应总是向DH-TDS<0的方向进行,直至达到平衡状态。说明: 1、在判断反应的方向时,应同时考虑焓变和熵变这两个因素。 2、在温度、压强一定的条件下,化学反应化学反应进行的方向练习题
第一章 卤化反应练习题
第一章-卤化反应作业和答案
《化学反应进行的方向》教学设计
第5章 卤代烷
化学反应进行的方向习题
卤化反应
《化学反应进行的方向》教学设计
化学反应进行的方向(知识点总结)
一、卤化反应
化学反应进行的方向知识点整理