
高考化学综合题专练∶铁及其化合物推断题附答案解析
一、铁及其化合物
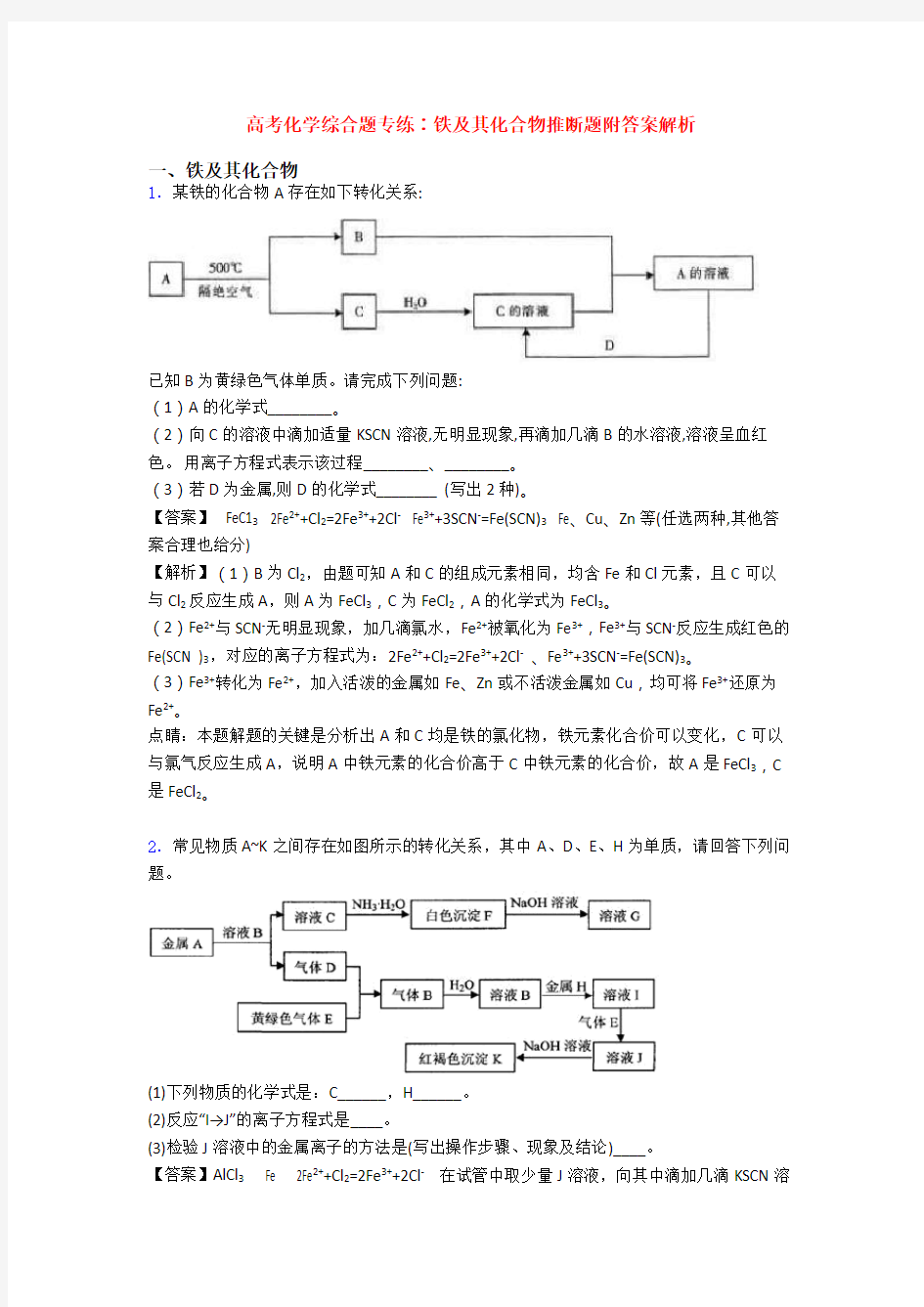
1.某铁的化合物A存在如下转化关系:
已知B为黄绿色气体单质。请完成下列问题:
(1)A的化学式________。
(2)向C的溶液中滴加适量KSCN溶液,无明显现象,再滴加几滴B的水溶液,溶液呈血红色。用离子方程式表示该过程________、________。
(3)若D为金属,则D的化学式________ (写出2种)。
【答案】 FeC13 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 Fe、Cu、Zn等(任选两种,其他答案合理也给分)
【解析】(1)B为Cl2,由题可知A和C的组成元素相同,均含Fe和Cl元素,且C可以与Cl2反应生成A,则A为FeCl3,C为FeCl2,A的化学式为FeCl3。
(2)Fe2+与SCN-无明显现象,加几滴氯水,Fe2+被氧化为Fe3+,Fe3+与SCN-反应生成红色的Fe(SCN )3,对应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3。
(3)Fe3+转化为Fe2+,加入活泼的金属如Fe、Zn或不活泼金属如Cu,均可将Fe3+还原为Fe2+。
点睛:本题解题的关键是分析出A和C均是铁的氯化物,铁元素化合价可以变化,C可以与氯气反应生成A,说明A中铁元素的化合价高于C中铁元素的化合价,故A是FeCl3,C 是FeCl2。
2.常见物质A~K之间存在如图所示的转化关系,其中A、D、E、H为单质,请回答下列问题。
(1)下列物质的化学式是:C______,H______。
(2)反应“I→J”的离子方程式是____。
(3)检验J溶液中的金属离子的方法是(写出操作步骤、现象及结论)____。
【答案】AlCl3 Fe 2Fe2++Cl2=2Fe3++2Cl-在试管中取少量J溶液,向其中滴加几滴KSCN溶
液,振荡,若溶液变为红色,则说明J溶液含有Fe3+
【解析】
【分析】
溶液C与氨水反应生成白色沉淀F,白色沉淀F与氢氧化钠溶液反应生成溶液G,说明G 为NaAlO2,F为Al(OH)3,金属A与溶液B反应生成气体D,金属A为Al,气体D和黄绿色气体E(Cl2)反应生成气体B,气体B溶于水,溶液B与金属H反应生成溶液I,根据后面红褐色沉淀,得到金属H为Fe,则B为HCl,溶液C为AlCl3,则D为H2,溶液I为FeCl2,溶液J为FeCl3,K为Fe(OH)3。
【详解】
(1)根据前面分析得到物质的化学式是:C为AlCl3,H为Fe;
(2)反应“I→J”是Fe2+与Cl2反应生成Fe3+和Cl-,其离子方程式是2Fe2++Cl2=2Fe3++2Cl-;
(3)检验J溶液中的金属离子的方法是主要是用KSCN溶液检验铁离子,变红,说明溶液中含有铁离子。
3.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A_____________、B___________、C______________、
F_____________、 H____________、乙______________
(2)写出下列反应化学方程式:
反应①_________________________________________________
反应⑤_________________________________________________
反应⑥_________________________________________________
【答案】Na Al Fe FeCl2 Fe(OH)3 Cl2 2Na + 2H2O=2NaOH + H2↑ 2FeCl2 + Cl2=2FeCl3 FeCl3+ 3NaOH =Fe(OH)3↓+ 3NaCl
【解析】
【分析】
【详解】
金属单质A的焰色为黄色,则A为Na;反应①为Na与水反应生成NaOH和H2,则物质D
为NaOH ,气体为H 2;金属B 与NaOH 反应生成H 2,则金属B 为Al ;黄绿色气体为Cl 2,反应②为H 2与Cl 2化合成HCl ,则气体丙为HCl ,物质E 为盐酸;金属C 与盐酸反应生成F ,F 与Cl 2反应生成物质G ,G 与NaOH 反应得红棕色沉淀,则金属C 为Fe ,F 为FeCl 2,G 为FeCl 3;
(1)A 、B 、C 、F 、H 、乙的化学式依次为Na 、Al 、Fe 、FeCl 2、Fe(OH)3、Cl 2。
(2)反应①的化学方程式为2Na+2H 2O=2NaOH+H 2↑;
反应⑤的化学方程式为Cl 2+2FeCl 2=2FeCl 3;
反应⑥的化学方程式为FeCl 3+3NaOH=Fe(OH)3↓+3NaCl 。
4.A 、B 、C 、D 均为中学化学中常见的物质,它们之间转化关系如图(部分产物和条件已略去),请回答下列问题:
(1)若A 为CO 2气体,D 为NaOH 溶液,则B 的化学式为_________。
(2)若A 为AlCl 3溶液,D 为NaOH 溶液,则C 的名称为_________。
(3)若A 和D 均为非金属单质,D 为双原子分子,则由C 直接生成A 的基本反应类型为_________。
(4)若常温时A 为气态氢化物,B 为淡黄色固体单质,则A 与C 反应生成B 的化学方程式为_________。
(5)若A 为黄绿色气体,D 为常见金属,则A 与C 溶液反应的离子方程式为_________。下列试剂不能鉴别B 溶液与C 溶液的是_________(填字母编号)。
a .NaOH 溶液
b .盐酸
c .KSCN 溶液
d .酸性KMnO 4溶液
【答案】NaHCO 3 偏铝酸钠 分解反应 2222H S SO =3S 2H O ++
2322Fe Cl =2Fe 2Cl ++-++ b
【解析】
【分析】
【详解】
(1)若A 为CO 2与过量的D 即NaOH 反应,生成碳酸氢钠;碳酸氢钠溶液与NaOH 反应可得到碳酸钠溶液;碳酸钠溶液又可以与CO 2反应生成碳酸氢钠;所以B 的化学式为NaHCO 3;
(2)若A 为AlCl 3,其与少量的NaOH 反应生成Al(OH)3沉淀,Al(OH)3继续与NaOH 反应生成偏铝酸钠;偏铝酸钠溶液和氯化铝溶液又可以反应生成Al(OH)3;所以C 的名称为偏铝酸钠;
(3)若A ,D 均为非金属单质,且D 为双原子分子,那么推测可能为性质较为活泼的O 2或Cl 2,A 则可能为P ,S 或N 2等;进而,B ,C 为氧化物或氯化物,C 生成单质A 的反应则一定为分解反应;
(4)淡黄色的固体有过氧化钠,硫单质和溴化银;根据转化关系,推测B 为S 单质;那么A 为H 2S ,C 为SO 2,B 为氧气;所以相关的方程式为:2222H S SO =3S 2H O ++;
(5)A 为黄绿色气体则为Cl 2,根据转化关系可知,该金属元素一定是变价元素,即Fe ;那么
B 为FeCl 3,
C 为FeCl 2;所以A 与C 反应的离子方程式为:2322Fe
Cl =2Fe 2Cl ++-++; a .NaOH 与Fe 2+生成白色沉淀后,沉淀表面迅速变暗变绿最终变成红褐色,而与Fe 3+直接
生成红褐色沉淀, a 项可以;
b .盐酸与Fe 2+,Fe 3+均无现象,b 项不可以;
c .KSCN 溶液遇到Fe 3+会生成血红色物质,而与Fe 2+无现象,c 项可以;
d .F
e 2+具有还原性会使高锰酸钾溶液褪色,Fe 3+不会使高锰酸钾溶液褪色,d 项可以;答案选b 。
5.已知A 、B 、C 、D 四种物质均含有铁元素,彼此转化关系如下:
请回答:
(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al 作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C 溶液中应加入__,以防止其转化为D 。检验D 溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
【答案】2Al+Fe 2O 3高温2Fe+Al 2O 3 还原剂 2Fe 2++H 2O 2+2H +=2Fe 3++2H 2O 铁粉(屑) KSCN (或NH 4SCN ) 溶液变红(或呈现血红色)
【解析】
【分析】
氧化铁与铝单质在高温下发生铝热反应,生成A ,则A 为Fe ,铁和水蒸气在高温下反应生成B ,B 为黑色磁性氧化物,则B 为Fe 3O 4,Fe 3O 4中铁元素的化合价含有+2、+3价,与盐酸反应生成FeCl 3和FeCl 2,铁与过量盐酸反应生成FeCl 2,则C 为FeCl 2,FeCl 2与双氧水反应生成FeCl 3,则D 为FeCl 3,据此分析解答。
【详解】
(1)反应①称为铝热反应(属于置换反应),该反应的化学方程式:2Al+Fe 2O 3高温2Fe+Al 2O 3,反应中Al 有0价变为+3价,化合价升高,失电子,被氧化,作还原剂;
(2)反应④为FeCl 2与双氧水反应生成FeCl 3,离子方程式为:2Fe 2++H 2O 2+2H +=2Fe 3++2H 2O ;
(3)C 为FeCl 2,D 为FeCl 3,亚铁离子具有还原性,易被氧化,新配制的FeCl 2溶液中应加入铁粉(屑),以防止其转化为FeCl 3。检验三价铁离子常用试剂是KSCN(或NH 4SCN),三价铁离子遇SCN -变为血红色溶液。
6.某淡黄色固体A (仅含三种元素,式量小于160)可用于制药,为探究其组成和性质,
设计并完成如下实验:
已知:①上述流程中所涉及的反应都充分进行。
②B 、C 、D 均为常见气体。相同情况下气体B 的密度大气体C 。
③黑色固体E 溶于盐酸后滴加KSCN ,无明显现象,加适量氯水后,溶液变红。 请问答:
(1)写出气体B 的电子式__,固体A 的化学式是__。
(2)黑色固体E 与足量浓硝酸反应的离子反应方程式是__。 【答案】
FeC 2O 4 3FeO + 10H + + NO 3- = NO + 3Fe 3+ + 5H 2O 【解析】
【分析】
B 、
C 、
D 均为常见气体说明D 单质为氧气,物质的量为1m 3.2g n=0.1mol M 32g mol -==?,相同情况下气体B 的密度大气体C 则说明B 为二氧化碳,B 与过氧化钠反应,则C 为一氧化碳,气体物质的量为1m V 8.96L n==0.4mol V 22.4L mol
-=?由于生成0.1mol 氧气,根据2CO 2 + 2Na 2O 2 = 2Na 2CO 3 + O 2,因此二氧化碳的物质的量为0.2mol ,CO
物质的量为0.2mol ,黑色固体E 溶于盐酸后滴加KSCN ,无明显现象,说明无铁离子,加适量氯水后,溶液变红,说明原物质为FeO ,则m(FeO) = 28.8g?0.2mol×28 g?mol ?1? 0.2mol×44 g?mol ?1 = 14.4g ,则FeO 物质的量1
m 14.4g n=0.2mol M 71g mol -==?,因此n(Fe): n(C): n(O) = 0.2mol:(0.2mol+0.2mol):(0.2mol+0.2mol+0.2mol×2) =1:2:4,则化学式为FeC 2O 4。
【详解】
⑴气体B 为二氧化碳,其电子式
,根据上面分析得到固体A 的化学式是FeC 2O 4;
故答案为:;FeC 2O 4。 ⑵黑色固体E 即FeO 与足量浓硝酸反应生成硝酸铁、一氧化氮和水,其离子反应方程式是3FeO + 10H + + NO 3- = NO + 3Fe 3+ + 5H 2O ;故答案为:3FeO + 10H + + NO 3- = NO + 3Fe 3+ + 5H 2O 。
7.溴主要以Br - 形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程示意如下。
资料:常温下溴呈液态,深红棕色,易挥发。
(1)酸化:将海水酸化的主要目的是避免___(写离子反应方程式)。
(2)脱氯:除去含溴蒸气中残留的Cl2
①具有脱氯作用的离子是____。
②溶液失去脱氯作用后,补加FeBr2或加入____,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO3-和Br-。再用H2SO4酸化歧化后的溶液得到Br2,其离子反应方程式为____。
(4)探究(3)中所用H2SO4浓度对Br2生成的影响,实验如下:
①B中溶液呈棕红色说明产生了____。
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致;乙同学认为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由;若认为乙同学的分析合理,进一步设计实验方案说明。理由或方案:____。
③酸化歧化后的溶液宜选用的酸是____(填“稀硫酸”或“浓硫酸”)。
【答案】Cl2+2OH-=Cl-+ClO-+H2O Fe2+、Br-铁粉 BrO3-+5Br-+6H+=3Br2+3H2O Br2理由:SO2+Br2+2H2O=2HBr+H2SO4方案:用CCl4萃取颜色很浅的溶液,观察溶液下层是否呈棕红色稀硫酸
【解析】
【分析】
【详解】
(1)海水中溴元素以Br-存在,从海水中提取溴单质,要用Cl2氧化溴离子得到,但海水呈碱性,若不酸化,就会发生反应:Cl2+2OH-=Cl-+ClO-+H2O,影响溴的提取;
(2) ①将溴蒸气的残留的Cl2脱去,可利用氯气有强的氧化性,要加入能与Cl2反应,但不能与Br2反应的物质,如Fe2+、Br-;
②溶液失去脱氯作用后,补加FeBr2或加入还原铁粉,物质具有还原性,脱氯作用就恢复;
(3)用Na2CO3溶液吸收溴,Br2歧化为BrO3-和Br-。再用H2SO4酸化,BrO3-和Br-及H+发生归中反应得到Br2,其离子反应方程式为BrO3- +5Br-+6H+=3Br2+3H2O;
(4)①B中溶液呈棕红色是由于Br2是红棕色物质,产生了Br2;
②若甲同学说法正确,则会发生反应:SO2+Br2+2H2O=2HBr+H2SO4,消耗了溴单质;若乙同学说法正确,则要把颜色很浅的溶液用CCl4萃取,利用CCl4密度比水大,溴单质容易溶于CCl4,观察下层液体颜色否呈棕红色即可;
③歧化后的溶液若用稀硫酸酸化无明显现象,若用浓硫酸酸化,溶液变为红棕色,反应放
出热量,会导致溴单质挥发,所以酸化要用稀硫酸。
8.无水氯化锰()2MnCl 在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe 、Ni 、Pb 等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
I .向粗锰粉中加入盐酸,控制溶液的pH 约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II .向I 的滤液中加入一定量盐酸,再加入22H O 溶液,充分反应后加入3MnCO 固体调节溶液的pH 约为5,过滤;
III .向II 的滤液中通入2H S 气体,待充分反应后加热一段时间,冷却后过滤; IV .浓缩、结晶、过滤、洗涤、脱水得到无水MnCl 2。
各步骤中对杂质离子的去除情况
已知:金属活动性Mn >Fe >Ni >Pb
(1)锰和盐酸反应的化学方程式是_______。
(2)步骤I 中:
①Fe 2+浓度降低,滤渣中存在()3Fe OH 。结合离子方程式解释原因:_______。 ②Pb 2+浓度降低,分析步骤I 中发生的反应为:Pb + 2H + = Pb 2+ + H 2↑、______。
(3)步骤II 中:
①22H O 酸性溶液的作用:_______。
②结合离子方程式说明MnCO 3的作用: _______。
(4)步骤III 通入H 2S 后, Ni 2+不达标而2+Pb 达标。推测溶解度:PbS_____NiS (填“>”或“<”)。
(5)测定无水2MnCl 的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量43NH NO ,使2+Mn 氧化为3+Mn 。待充分反应后持续加热一段时间,冷却后用b mol/L 硫
酸亚铁铵()()4422NH Fe SO ????滴定3+Mn ,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生
的反应为:Fe 2+ + Mn 3+ = Fe 3+ + Mn 2+)
①样品中MnCl 2的质量分数是_____(已知:MnCl 2的摩尔质量是126 g ·mol -1)。 ②“持续加热”的目的是使过量的43NH NO 分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影响”)。
【答案】Mn + 2HCl = MnCl 2 + H 2↑ 空气中的O 2 将部分Fe 2+氧化为Fe(OH)3沉淀,相关的离子方程式为:4Fe 2+ + O 2 + 10H 2O = 4Fe(OH)3↓+ 8H + Pb 2+ + Mn = Pb + Mn 2+ 将剩余Fe 2+氧化为Fe 3+,调节pH 使Fe 3+转化为Fe(OH)3沉淀除去
MnCO 3+2H +=Mn 2++H 2O+CO 2↑,Fe 3++3H 2O 垐?噲?Fe(OH)3+3H + <
0.126bc a
偏高 【解析】
【分析】 制备无水氯化锰的原料是含有Fe ,Ni ,Pb 等金属杂质的粗锰粉,因此制备过程中要将Fe ,Ni ,Pb 等杂质元素去除;第一步将粗锰粉加酸溶解,Fe 溶解后产生Fe 2+,由于其还原性较强,容易被氧气氧化;由于金属活动性Mn >Fe >Ni >Pb ,所以溶液中Pb 2+会与未反应完全的Mn 反应,造成Pb 2+浓度下降;第二步加入过氧化氢,主要是为了将Fe 2+氧化为Fe 3+,便于沉淀法去除;第三步通入H 2S ,是想通过生成硫化物沉淀的方式去除残余的Zn 2+和Pb 2+,由于Pb 的去除达标,而Zn 的仍未达标,所以PbS 的溶解度应该更低。
【详解】
(1)Mn 与盐酸反应的化学方程式为:22Mn 2HCl==MnCl H ++↑;
(2)①将粗锰粉酸浸后,Fe 单质转化为还原性较强的Fe 2+,静置一段时间,Fe 2+会被空气中的氧气氧化,进而生成Fe(OH)3沉淀,相应的离子方程式为:
22234Fe O 10H O=4Fe(OH)8H ++++↓+;
②由于金属活动性Mn >Fe >Ni >Pb ,所以溶液中Pb 2+会与未反应完全的Mn 反应,造成Pb 2+浓度下降,因此与之相关的反应为:22Pb Mn=Pb+Mn +++;
(3)①通过分析可知,过氧化氢的作用是将溶液中的Fe 2+氧化为Fe 3+,便于调节pH 值将其转化为Fe(OH)3沉淀除去;
②通过分析可知,MnCO 3的作用即调节溶液的pH 值以便于Fe 3+沉淀,相关的离子方程式为:2322MnCO 2H =Mn H O CO +++++↑以及()323Fe +3H O Fe OH 3H +++垐?噲?;
(4)通过分析可知,PbS 的溶解度更小;
(5)①由题可知,ag 无水氯化锰中的Mn 2+经过氧化后全部转变为Mn 3+,硫酸亚铁铵与Mn 3+反应时,Mn 3+和Fe 2+按照1:1反应,所以MnCl 2的质量分数为:
2
2
MnCl MnCl bc 126126g/mol 0.126bc 1000===ag ag a a
m n w ??=;
②若不加热,溶液中剩余的硝酸铵会在酸性条件下体现氧化性能与硫酸亚铁铵发生反应,这样会使消耗的硫酸亚铁铵偏大,那么最终求出的纯度也偏大。
9.二氧化铈(CeO 2)是一种重要的稀土氧化物,主要用于多相催化,例如乘用车的废气催化转化器,太阳能电池中的光催化,水分解或污染物的分解等。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO 2、Fe 2O 3、CeO 2、FeO 等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO 2和硫酸铁铵晶体。
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)稀酸A的分子式是_________。
(2)滤液1中加入H2O2溶液的目的是____,滤渣1中加入H2O2溶液的目的是_____。
(3)设计实验证明滤液1中含有Fe2+_______________。
(4)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,该反应的离子方程式为_______。
(5)由滤液2生成Ce(OH)4的离子方程式为__________________。
(6)已知Fe(OH)3的K sp近似值为10-38。常温下,在含有Fe3+杂质的溶液中,为使其除尽应调节溶液pH至少为_____。(通常认为当离子浓度小于1.0×10-5mol·L-1时即视为沉淀完全)
【答案】H2SO4使Fe2+氧化为Fe3+使CeO2还原为Ce3+取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有Fe2+ Fe2+ +2FeO(OH) = Fe3O4 +2H+ 4Ce 3 ++ O2
+12OH-+2H2O =4Ce(OH)4↓ 3
【解析】
【分析】
制备纯净的CeO2和硫酸铁铵晶体,由流程可知,废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO 等物质)中加入A为稀硫酸,FeO转化为FeSO4、Fe2O3转化Fe2(SO4)3存在于滤液1中,滤渣1为CeO2和SiO2;滤液1中加入稀硫酸和铁粉,被Fe2(SO4)3还原为FeSO4,溶液1为FeSO4溶液,加入硫酸铵混合蒸发浓缩、常温晾干后得到硫酸亚铁铵晶体;滤渣1中加入稀硫酸和H2O2,CeO2转化为Ce3+存在于滤液2中,反应为2CeO2+H2O2+3H2SO4=
Ce2(SO4)3+O2↑+4H2O,滤渣2为SiO2;滤液2加入碱并通入氧气将Ce从+3氧化为+4后Ce3+转化为沉淀Ce(OH)4,反应为4Ce 3++O2+12OH﹣+2H2O═4Ce(OH)4↓,加入分解Ce(OH)4得到产品CeO,以此来解答。
【详解】
(1)CeO2不溶于稀硫酸,废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)中SiO2也不溶于酸,加入稀硫酸可将CeO2和SiO2与Fe2O3、FeO分离;
(2)滤液1中加入H2O2溶液的目的是使Fe2+氧化为Fe3+,滤渣1中加入H2O2溶液的目的是还原CeO2为Ce3+;
(3)设计实验证明滤液1中含有Fe2+的方法为:取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有Fe2+;
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,该反应的离子方程式为
Fe2++2FeO(OH)═Fe3O4+2H+;
(5)滤液2为含有Ce 3+的溶液,加入碱并通入氧气将Ce从+3氧化为+4后Ce3+转化为沉淀Ce(OH)4,离子方程式为:4Ce 3++O2+12OH﹣+2H2O═4Ce(OH)4↓;
(6)Fe(OH)3的K sp近似值为10﹣38,Fe3+完全沉淀时c(OH﹣)=
38
3
5
10
10
-
-
=10﹣11mol/L,常温下
c(H+)=
14
11
10
10
-
-
=10﹣3mol/L,为使其除尽应调节溶液pH至少为3。
10.2019年诺贝尔奖授予JohnB.Goodenough等三位科学家,以表彰其在锂电池领域的贡献。磷酸亚铁锂(LiFePO4)用作锂离子电池正极材料,制备方法如图:
(1)制备水合磷酸铁(FePO4·xH2O)固体
①过程Ⅰ,加NaOH溶液调pH=2.0时透明混合溶液中含磷微粒主要是H2PO4-,过程Ⅰ发生的主要离子方程式是____。
②过程Ⅱ“氧化、沉淀”反应生成FePO4沉淀的离子方程式是____。
③进行过程III之前,需确认过程II中无Fe2+,检验试剂为____。
④FePO4·xH2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图:
水合磷酸铁的化学式为____。(x取整数)
(2)制备LiFePO4固体:
在氮气气氛保护下,高温焙烧FePO4、Li2CO3和过量葡萄糖的固体混合物。
①过量葡萄糖作用是____。
②锂离子电池在充电时,电极材料LiFePO4会迁出部分Li+,部分转变为Li(1-x)FePO4。此电极的电极反应为____。
【答案】H3PO4+OH-=H2PO4-+H2O 2H2PO4-+H2O2+2Fe2+=2FePO4↓+2H++2H2O 铁氰化钾溶液FePO4·2H2O 还原剂,把三价铁还原成二价铁 LiFePO4-xe-=xLi++Li(1-x)FePO4
【解析】
【分析】
FeSO4?7H2O在H3PO4中溶解,加入氢氧化钠溶液中和磷酸生成H2PO4-,过程Ⅱ“氧化、沉
淀”反应主要是Fe 2+与H 2O 2 、H 2PO 4-反应生成FePO 4沉淀、H +和H 2O ,再加入氢氧化钠中和
酸,最后得到FePO 4·
xH 2O 。高温焙烧FePO 4、Li 2CO 3和过量葡萄糖的固体混合物得到LiFePO 4固体,铁化合价降低,过量葡萄糖化合价升高,作还原剂。
【详解】
⑴①过程Ⅰ,加NaOH 溶液调pH = 2.0时透明混合溶液中含磷微粒主要是H 2PO 4-,说明过
程Ⅰ主要发生磷酸和氢氧化钠反应生成水和H 2PO 4-,其主要离子方程式是H 3PO 4+OH - = H 2PO 4- + H 2O ;故答案为:H 3PO 4+OH - = H 2PO 4- + H 2O 。
②过程Ⅱ“氧化、沉淀”反应主要是Fe 2+与H 2O 2 、H 2PO 4-反应生成FePO 4沉淀、H +和H 2O ,因此生成FePO 4沉淀的离子方程式是2H 2PO 4-+H 2O 2 +2Fe 2+ = 2FePO 4↓ + 2H ++2H 2O ;故答案
为:2H 2PO 4-+H 2O 2 +2Fe 2+ = 2FePO 4↓ + 2H ++2H 2O 。
③进行过程III 之前,需确认过程II 中无Fe 2+,常用铁氰化钾溶液试剂检验;故答案为:铁氰化钾溶液。
④假设100g FePO 4·
xH 2O 样品受热,得到FePO 4固体80g ,水20g ,根据物质的量比例得到11
80g 20g :1:2151g mol 18g mol --=??,因此水合磷酸铁的化学式为FePO 4·2H 2O ;故答案为:FePO 4·2H 2O 。
⑵①高温焙烧FePO 4、Li 2CO 3和过量葡萄糖的固体混合物得到LiFePO 4固体,铁的化合价降低,则过量葡萄糖化合价升高,作还原剂,主要是将三价铁还原成二价铁;故答案为:还原剂,把三价铁还原成二价铁。
②锂离子电池在充电时,电极材料LiFePO 4会迁出部分Li +,部分转变为Li (1-x)FePO 4。此电极的电极反应为LiFePO 4-xe - = xLi + + Li (1-x)FePO 4;故答案为:LiFePO 4-xe - = xLi + + Li (1-x)FePO 4。