
铝三角
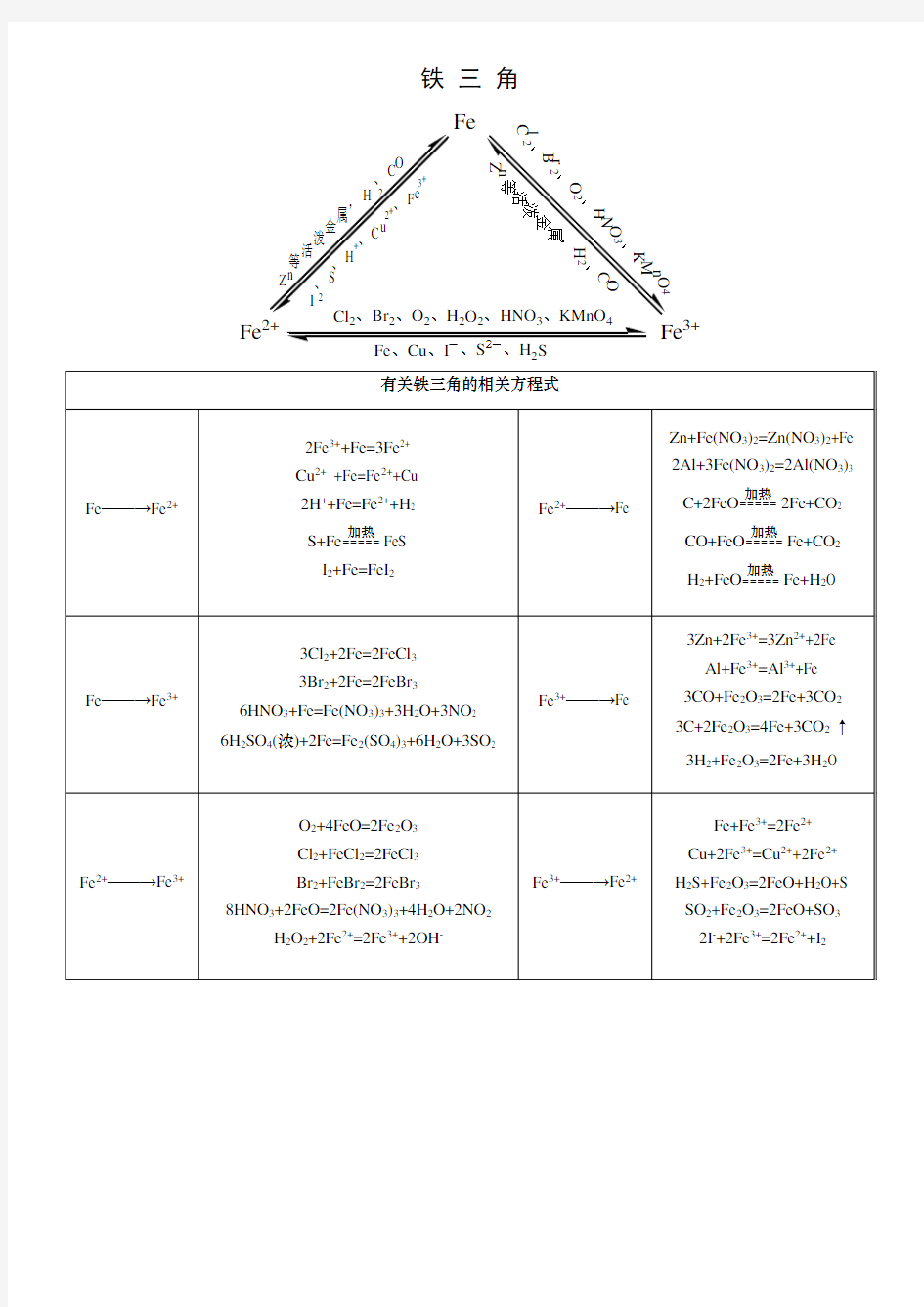
铁 三 角
Fe
Fe 2+
Fe 3+
2
2017高中化学知识点:偏铝酸盐 2017高中化学知识点:偏铝酸盐 偏铝酸盐: 偏铝酸盐是指含有“AlO2-”集团的盐,是铝及其氧化物与强碱反应的产物。 例如Al(OH)3+OH-?AlO2-+2H2O。 偏铝酸盐的性质用离子方程式表示如下:①偏铝酸盐溶液发生水解反应,溶液呈碱性。 ALO2-+2H2O==AL(OH)3+OH- ②偏铝酸盐与酸反应与强酸 发生反应:适量强酸:ALO2-+H+H2O==AL(OH)3 过量强酸:ALO2-+4H+==AL3++2H2O 与弱酸(H2CO3)发生反应:即通入CO2气适量CO2:2ALO2-+CO2+3H2O==2AL(OH)3+CO32- 过量CO2:ALO2-+CO2+2H2O==AL(OH)3+HCO3- ③铝盐与偏铝酸盐溶液反应: AL3++3ALO2-+6H2O==4AL(OH)3 偏铝 酸盐也可以理解为两性物质Al盐偏碱性的盐。 AlO2-+H+(少量)+H2O==Al(OH)3↓ AlO2-+4H+(过量)==Al3++2H2O 偏铝酸盐的性质: 偏铝酸盐的性质用离子方程式表示如下: ①偏铝酸盐溶液发生水解反应,溶液呈碱性。 AlO2-+2H2O==Al(OH)3+OH- ②偏铝酸盐与酸反应与强酸发生反应:
适量强酸:AlO2-+H++H2O==Al(OH)3 过量强酸:AlO2-+4H+==Al3++2H2O 与弱酸(H2CO3)发生反应:即通入适量CO2: 2AlO2-+CO2+3H2O==2Al(OH)3+CO32- 过量CO2:AlO2-+CO2+2H2O==Al(OH)3+HCO3- ③铝盐与偏铝酸盐溶液反应: Al3++3AlO2-+6H2O==4Al(OH)3偏铝酸盐也可以理解为两性物质Al盐偏碱性的盐。 方法与技巧: 偏铝酸盐是在强碱性条件下生成的,所以它的存在环境也是强碱性环境,在离子共存题目中,经常遇到含有AlO2-的情况,遇到这样的题目,我们可以认为该溶液中含有OH-,与很多显酸性的离子不共存。例如:AlO2-与Al3+、Fe3+、NH4+、HCO3-等常见离子不共存。 “铝三角”关系: Al3++3OH-===Al(OH)3↓ Al(OH)3+OH-===AlO2-+2H2O Al3++4OH-===AlO2-+2H2O AlO2-+2H2O+CO2===Al(OH)3↓+HCO3- AlO2-+H++H2O===Al(OH)3↓ AlO2-+4H+===Al3++2H2O 相关高中化学知识点:碳酸钠
铁三角化学方程式专项练习 1.铁在氯气中燃烧; 2.铁在氧气中燃烧______________________________________________; 3.铁和稀盐酸反应; 4.氯化亚铁溶液中通入氯气; 5.氯化铁溶液加入铁粉; 6.铜粉投入氯化铁溶液中; 7.铝和氧化铁发生铝热反应; 8.铁和水蒸气____________________________________________________________ 9.铁在空气中腐蚀_______________________________________________________ 10.氢氧化铁胶体的制备____________________________________________________ __________________________________________________________________________ 11.铁和浓硫酸____________________________________________________________ _________________________________________________________________________ 12.浓硝酸和氧化亚铁_____________________________________________________ _________________________________________________________________________
“ 铝 三 角” 的 图 像 分 析 及 计 算 知识点一、铝三角 1、三角关系:A|3+、AI(0H )3与AIO 2—相互转化的关系 Al * AO 2、铝三角的应用 ① 制取AI(OH )3 常用弱碱与可溶的铝盐反应: A|3+ + 3NH 3 ? HO == AI(OH) 3; +3NM 也可以用偏铝酸盐与弱酸反应: AIO 2- + CQ + 2H 20 == AI(OH) 3 ; + CQ 2- 知识点二、铝的化合物的有关图象 1、基本图象 ①向铝盐溶液中逐滴滴加强碱性溶液直至过量 水又是怎样的图像? 现象:先产生沉淀,后沉淀消失。 AI 3+ + 30H - = AI(OH) 3; 离子方程式: AI(OH) 3 + OH = AIO 2- +2HO 如若将强碱性溶液换成氨水又是怎样的图像? ③向偏铝酸盐溶液中逐滴滴加强酸溶液直至过量 通入CO )又是怎样的图像? 现象: 离子方程式: 2、基本图象的拓展 ①过量O H ②过量H + ⑥0H AI(OH) 3 如若将强碱性溶液换成氨 现象: 将强酸溶液换成弱酸(如 现象: 离子方程式:
①若AICI 3溶液中混有MgC 2,向此溶液中逐滴滴加NaOH 溶液直至过量,发生了什么 反应?图象是怎样的? 现象:开始产生沉淀,之后沉淀部分溶解 写出涉及的离子方程式: M 6+ + 2OH 丄 Mg (OH )2; AI + 3OH — = AI(OH) 3; AI(OH) 3 + OH — = AIO 2— +2HO ② 若AICI 3溶液中除混有外 MgC 2,还混有盐酸,向此 溶液中逐滴滴加NaOH 溶液直至过量,发生的反应有何 不同,图象有什么样的变化? 现象:开始无沉淀,之后产生沉淀,之后沉淀部 分溶解 Mf + 2OH — = Mg (OH )2; AI 3+ + 3OH — = AI(OH) 3; AI(OH) 3 + OH — = AIO 2— +2HO ③ 若AICI 3溶液中除混有MgC 2和盐酸外,还混有NHCI ,向此溶液中逐滴滴加NaOH 溶液直至过量,发生的反应又有何不同,图象又有什么样的变化? 加适量水溶解,再加入KOH 容液,析出 现象: 离子方程式: Mc j + + 2OH — = Mg (OH )2; H + + OH — = H O f W
2Al+3O2=2Al2O3 点燃 2Al+3Cl2 =2AlCl3 点燃 2Al+3Br2=2AlBr3 2Al +2NaOH +2H2O =2NaAlO2+3H2 2Al+Fe2O3=Al2O3+2Fe 高温 4Al+3MnO2=2Al2O3 +3Mn 高温 2Al+3H2SO4=Al2(SO4)2+3H2 2Al+6HCl =3AlCl3+3H2 4Al2O3=4Al +3O2 通电 Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3+2NaOH=2NaAlO2+H2O Al(OH)3+3HCl =AlCl3+3H2O Al(OH)3+NaOH =NaAlO2+2H2O Al2(SO4)3+=2Al(OH)3+3(NH4)2SO4 2Al(OH)3=Al2O3+3H2O Δ NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3 NaAlO2+4HCl=AlCl3+2H2O NaAlO2 +HCl +H2O =NaCl +Al(OH)3 NaAlO2+NaHCO3+H2O =Na2CO3 +Al (OH)3 AlCl3+3NaAlO2+6H2O =4Al(OH)3+3NaCl Al2(SO4)3+6NaHCO3 =2Al(OH)3 +6CO2 +H2O+3Na2SO4 注:NaAlO2有的版本写为:Na[Al(OH)4];生成物有气体而反应物无气体的要标上气标。也很好改写,需注意的是Al2O3、Al、气体等难溶物不能拆成离子形式参考资料:部分修改自百度贴吧 【铝三角】 ①AlCl3 -> Al(OH)3 AlCl3 + 3NaOH == Al(OH)3↓ + 3NaCl Al(3+) + 3OH- == Al(OH)3↓ ②Al(OH)3 -> AlCl3 Al(OH)3 + 3HCl == AlCl3 +3H2O Al(OH)3 + 3H+ == Al(3+) + 3H2O ③Al(OH)3 -> NaAlO2 Al(OH)3 + NaOH == NaAlO2 + H2O Al(OH)3 + OH- == AlO2(-) + H2O ④NaAlO2 -> Al(OH)3 NaAlO2 + HCl +H2O == NaCl + Al(OH)3↓ AlO2(-) + H+ + H2O == Al(OH)3↓ ⑤Al(OH)3 -> Al2O3
高三化学总复习――金属及其化合物知识点总结 5.18一.金属的通性 1.位置:金属元素位于周期表的左下角,最外层电子数大部分少于4个。 2.物理通性:大部分有延展性、金属光泽,都有导热导电性等。 3.化学性质:易失电子,被氧化,金属表现还原性。 4.钠、铝、铁、铜单质的重要性质 钠铝铁铜 与非金属单质O24Na+O2=2Na2O O2+2Na Na2O2 4Al+3O22Al2O33Fe+2O2Fe3O42Cu+O2 2CuO Cl22Na+Cl22NaCl 2Al+3Cl22AlCl32Fe+3Cl22FeCl3 Cu+Cl2 CuCl2 S 2Na+S Na 2 S 2Al+3S Al2S3Fe+S FeS 2Cu+S Cu2S H2O 2Na+2H2O=2NaOH+H2↑2Al+6H 2 O 2Al(OH)3+3H2↑3Fe+4H2O Fe3O4+4H2 不反应 HCl溶液2Na+2HCl=2NaCl+H2↑2Al+6HCl=2AlCl3+3H2↑Fe+2HCl=FeCl2+H2↑不反应NaOH溶液与水反应2Al+2NaOH+2H2O= 2NaAlO2+3H2↑ 不反应不反应 CuSO4溶液2Na+2H2O+CuSO4= Na2SO4+Cu(OH)2↓+H2↑ 较复杂较复杂不反应 制备 2NaCl 2Na+Cl2↑2Al2O34Al+3O2↑Fe2O3+3CO 2Fe+3CO2 CuO+CO Cu+CO2 二.钠及其化合物 1.钠 ⑴钠的物理性质 状态颜色硬度密度熔点导电、导热性 固体银白色较小(比水大)较小(比水小)较低(用酒精灯加热,很快 熔化) 是电和热的良导体 ⑵钠的化学性质 ①钠与非金属单质的反应 A:与氧气:4Na+O2=2Na2O(变暗);O2+2Na Na2O2(燃烧生成淡黄色固体) B:与氯气:2Na+Cl22NaCl; C:与S:2Na+S Na2S ②钠与水的反应(水中先滴入酚酞) 2Na+2H2O=2NaOH+H2↑ 现象概述现象描述原因浮浮在水面钠的密度比水小 游四处游动钠与水反应产生气体 熔融化成银白色小球钠的熔点较低,且该反应放出大量热响发出咝咝的响声钠与水反应剧烈 红溶液由无色变为红色生成了碱性物质
序号①②③④⑤⑥其他 铝三角 ③ Al3+ +4OH — AlO2- +4H + + + 3H+ ⑥ + H ①② ⑤④ +3OH —+OH — Al(OH) 3 化学方程式离子方程式AlCl 3+3NaOH==Al(OH) 3↓ +3NaCl Al 3++3OH -==Al(OH) 3↓ Al (SO ) +6NH ·H O==2Al(OH)↓ +3(NH)SO Al3++3NH·H O==Al(OH)+ 2 4 332 3 4 243234 Al(OH) 322 O Al(OH) 3-2 - 2 +NaOH==NaAlO+2H+OH ==AlO+2H O AlCl 3+4NaOH==NaAlO 2+3NaCl+2H 2O Al 3++4OH -==AlO 2-+2H 2O NaAlO 2 +HCl+H 23 ↓ +NaCl AlO 2-+23 O==Al(OH)+H+H O==Al(OH)↓ 22(足量) +2H 2 O==Al(OH) 3 ↓ 3 AlO 2 - +CO 2 +2H 2 O==Al(OH) 33 -NaAlO +CO+NaHCO↓ +HCO 2NaAlO 2+CO 2(不足) +3H 2O==2Al(OH) 3↓ +Na2CO32AlO - +CO 2+3H 2O==2Al(OH) 2- 23 ↓+CO3 Al(OH) 3+3HCl==AlCl 3+3H2O Al(OH)3+3H+==Al3++3H2O NaAlO 232 O AlO 2 - +4H + ==Al 3+2 +4HCl==AlCl+NaCl+2H+2H O Al 2 O3+6HCl==AlCl3+3H 2O Al 2O3+6H + == 2Al 3+ +3H 2O Al 2O3+2NaOH==2NaAlO2+H2O Al 2O3+2OH - ==2AlO 2-+H2 O AlCl 3 +3NaAlO 223 ↓Al 3+2 - +6H 2 O==4Al(OH) 3 ↓+6H O==4Al(OH)+3AlO
铝三角涉及反应 (1) 2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2 (2) 4Al + 3O2 === 2Al2O3(条件:点燃) [2Al + Fe2O3 === Al2O3 + 2Fe(条件:高温)] (3) 2Al2O3 === 4Al + 3O2↑(条件:电解) (4) 2Al + 3Cl2 === 2AlCl3(条件:点燃) [2Al + 6HCl === 2AlCl3 + 3H2↑] (5) Al2O3 + 2NaOH === 2NaAlO2 + H2O (6) Al2O3 + 6HCl === 2AlCl3 + 3H2O (7) NaAlO2 + HCl + H2O === NaCl + Al(OH)3 ↓ (8) Al(OH)3 + NaOH === NaAlO2 + 2H2O (9) 2Al(OH)3 === Al2O3 + 3H2O(条件:加热) (10)Al(OH)3 + 3HCl === AlCl3 + 3H2O (11)AlCl3 + 3NH3.H2O === Al(OH)3 ↓+ 3NH4Cl [AlCl3 + 3NaOH === Al(OH)3 ↓ + 3NaCl]
(12) NaAlO2 + 4HCl(过) === AlCl3 + NaCl + 2H2O (13)AlCl3+ 3 NaAlO2+ 6 H2O====4 Al(OH)3↓+3NaCl (14)Al2(SO4)3+ 6 NaHCO3==== 2 Al(OH)3↓+ 3 Na2SO4+ 6 CO2↑ (15)2NaAlO2+ CO2(少量)+ 3 H2O ==== 2 Al(OH)3↓+ N a2CO3 (16)NaAlO2+ CO2(过量)+ 2H2O ==== Al(OH)3↓+ NaHCO3 离子方程式: 1 Al3+ + 3OH- = Al(OH)3 ↓ 2 Al(OH) 3 + 3H+ = Al3+ + 3H2O 3 Al(OH)3 + OH- = AlO2- + 2H2O 4 AlO2- + H+ + H2O = Al(OH)3 ↓ 5 Al3+ + 4OH- = AlO2- + 2H2O 6 AlO2-+ 4H+ = Al3+ + 2H2O 2Al+3O2=2Al2O3 点燃 2Al+3Cl2 =2AlCl3 点燃 2Al+3Br2=2AlBr3
镁、铝及其化合物知识点整理 Ⅰ.课标要求 1.通过海水制镁的事例了解镁及化合物的性质. 2.通过合金材料了解铝及化合物的性质. 3.能列举合金材料的重要应用. Ⅱ.考纲要求 1.掌握镁铝及化合物的性质. 2.了解镁铝及化合物在生活.生活中的应用. Ⅲ.教材精讲 一.Mg、Al的化学性质 1.与非金属反应 (1)与O2反应:常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、 铝都有抗腐蚀的性能。镁能在空气中燃烧:2Mg+O 22MgO ,铝在纯氧中燃烧:4Al+ 3O 22Al2O3 (2)与卤素单质、硫等反应:Mg+ Cl 2MgCl2 2Al+ 3Cl 22AlCl3 2Al+ 3S Al2S3 (用于工业制备)Mg+ S MgS [特别提醒]:①镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。镁在空气中燃烧时有三个反应发生:2Mg+O 22MgO 3Mg+N 2Mg3N22Mg+CO 22MgO+C ②燃烧时都放出大量的热,发出耀眼的白光。利用镁的这种性质来制造照明弹。 ③集气瓶底部都要放一些细纱,以防止集气瓶炸裂。 2.与H2O反应
Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气 Mg+2H 2O(沸水)Mg(OH)2+H2↑2A1+6H2O2A1(OH)3+3H2↑ 3.与酸反应置换出H2 Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓H2SO4,冷浓硝酸中发生钝化现象。所以可用铝制容器贮存冷的浓硫酸或浓硝酸。 4.与某些氧化物反应 (1)镁与二氧化碳反应:2Mg+CO 22MgO+C [特别提醒]:“CO2不能助燃”的说法是不全面的,CO2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。 (2)铝热反应:2Al+ Fe2O32Fe+ Al2O3 铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。 [特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3、FeO、Fe3O4、Cr2O3、V2O5、MnO2等。 ②铝热反应的特点是反应放出大量的热,使生成的金属呈液态。 ③要使用没有氧化的铝粉,氧化铁粉末要烘干。 ④KClO3作为引燃剂,也可以用Na2O2代替。实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。 5.与碱反应 镁不与碱反应,铝与碱液反应:2Al+2NaOH+6H 2O2NaAlO2+4H2O+3H2↑ 简写:2Al+2NaOH+2H 2O2NaAlO2+3H2↑ 二.氢氧化铝 1.物理性质:A l(O H)3是几乎不溶于水的白色胶状固体,具有吸附性。 2.化学性质
① 过量OH — ②过量H + ③H + ④OH — ⑤H + ⑥OH — “铝三角”的图像分析及计算 知识点一、铝三角 1、三角关系:Al 3+、Al(OH)3与AlO 2— 相互转化的关系 2、铝三角的应用 ①制取Al(OH)3 常用弱碱与可溶的铝盐反应:Al 3+ + 3NH 3·H 2O == Al(OH)3↓+3NH 4+ 也可以用偏铝酸盐与弱酸反应:AlO 2- + CO 2 + 2H 2O == Al(OH)3↓+ CO 32- 知识点二、铝的化合物的有关图象 1、基本图象 ①向铝盐溶液中逐滴滴加强碱性溶液直至过量 如若将强碱性溶液换成氨水又是怎样的图像? 现象:先产生沉淀,后沉淀消失。 现象: Al 3+ + 3OH - = Al(OH)3↓ 离子方程式: Al(OH)3 + OH - = AlO 2- +2H 2O 如若将强碱性溶液换成氨水又是怎样的图像? ③向偏铝酸盐溶液中逐滴滴加强酸溶液直至过量 将强酸溶液换成弱酸(如通入CO 2)又是怎样的图像? 现象: 现象: 离子方程式: 离子方程式: Al 3+ Al(OH)3 AlO 2—
2、基本图象的拓展 ①若AlCl 3溶液中混有MgCl 2,向此溶液中逐滴滴加NaOH 溶液直至过量,发生了什么反应?图象是怎样的? 现象:开始产生沉淀,之后沉淀部分溶解 写出涉及的离子方程式: Mg 2+ + 2OH - = Mg (OH)2↓ Al 3+ + 3OH - = Al(OH)3↓ Al(OH)3 + OH - = AlO 2- +2H 2O ②若AlCl 3溶液中除混有外MgCl 2,还混有盐酸,向此溶液中逐滴滴加NaOH 溶液直至过量,发生的反应有何不 同,图象有什么样的变化? 现象:开始无沉淀,之后产生沉淀,之后沉淀部 分溶解 H + + OH - = H 2O Mg 2+ + 2OH - = Mg (OH)2↓ Al 3+ + 3OH - = Al(OH)3↓ Al(OH)3 + OH - = AlO 2- +2H 2O ③若AlCl 3溶液中除混有MgCl 2和盐酸外,还混有NH 4Cl ,向此溶液中逐滴滴加NaOH 溶液直至过量,发生的反应又有何不同,图象又有什么样的变化? 现象: 离子方程式: H + + OH - = H 2O Mg 2+ + 2OH - = Mg (OH)2↓ Al 3+ + 3OH - = Al(OH)3↓ NH 4+ + OH - NH 3·H 2O Al(OH)3 + OH - = AlO 2- +2H 2O 【变式训练1】Al 2(SO 4)3和MgSO 4混和, 加适量水溶解,再加入KOH 溶液,析出 的沉淀量(W)与KOH 溶液体积(V)的关系如图, 则Al 2(SO 4)3和MgSO 4的物质的量之比是 A . 2:1 B . 1:2 C . 1:1 D . 1:3 【典型例题】 例1 向30 mL 1 mol·L -1 的AlCl 3溶液中逐渐加入浓度为4 mol·L -1 的NaOH 溶液,若产生0.78 g 白色沉淀,则加入的NaOH 溶液的体积可能为 ( ) A .3 mL B .7.5 mL C .15 mL D .17.5 mL
铝三角 1. Al(OH) 3+3HCl==AlCl 3 +3H 2 O Al 2 (SO 4 ) 3 +6NH 3 ·H 2 O==2Al(OH) 3 ↓+3(NH 4 ) 2 SO 4 Al(OH) 3+3H+==Al3++3H 2 O Al3++3NH 3 ·H 2 O==Al(OH) 3 ↓+3NH 4 + 2. AlCl 3+3NaOH==Al(OH) 3 ↓+3NaCl Al3++3OH-==Al(OH) 3 ↓ 3.AlCl 3+3NaOH==Al(OH) 3 ↓+3NaCl AlCl 3+4NaOH==NaAlO 2 +3NaCl+2H 2 O Al(OH) 3+NaOH==NaAlO 2 +2H 2 O Al3++4OH-==AlO 2 -+2H 2 O 4.NaAlO 2+HCl+H 2 O==Al(OH) 3 ↓+NaCl NaAlO 2+4HCl==AlCl 3 +NaCl+2H 2 O Al(OH) 3+3HCl==AlCl 3 +3H 2 O AlO 2 -+4H+==Al3++2H 2 O 5.Al(OH) 3+NaOH==NaAlO 2 +2H 2 O Al(OH) 3+OH-==AlO 2 -+2H 2 O 6.NaAlO 2+HCl+H 2 O==Al(OH) 3 ↓+NaCl Al 2 O 3 +6HCl==AlCl 3 +3H 2 AlO 2-+H++H 2 O==Al(OH) 3 ↓Al 2 O 3 +2NaOH==2NaAlO 2 +H 2 O NaAlO 2+CO 2 +2H 2 O==Al(OH) 3 ↓+NaHCO 3 AlO 2-+CO 2 +2H 2 O==Al(OH) 3 ↓+HCO 3 - 2NaAlO 2+CO 2 +3H 2 O==2Al(OH) 3 ↓+Na 2 CO 3 2AlO 2-+CO 2 +3H 2 O==2Al(OH) 3 ↓+CO 3 2-
高三化学总复习――金属及其化合物知识点总结 5.18 一.金属的通性1.位置:金属元素位于周期表的左下角,最外层电子数大部分少于4个。 2.物理通性:大部分有延展性、金属光泽,都有导热导电性等。 3.化学性质:易失电子,被氧化,金属表现还原性。 4.钠、铝、铁、铜单质的重要性质 钠铝铁铜 与非 O2 4Na+O 2= 2Na2 O 4Al+3O 2 2Al 2O3 3Fe+2O2 Fe3 O4 2Cu+O 2 2CuO 金属O 2+2Na Na 2O2 单质 Cl 2 2Na+Cl 2 2NaCl 2Al+3Cl 2 2AlCl 3 2Fe+3Cl 2 2FeCl3 Cu+Cl 2 CuCl 2 S 2Na+S Na2 S 2Al+3S Al 2S3 Fe+S FeS 2Cu+S Cu2S H 2O 2Na+2H 2O=2NaOH+H 2↑2Al+6H2O 3Fe+4H 2O 不反应 2Al(OH) 3 +3H 2↑Fe3O4+4H 2 HCl 溶液2Na+2HCl = 2NaCl+H 2↑2Al+6HCl = 2AlCl 3+3H 2↑Fe+2HCl = FeCl 2+H 2↑不反应 NaOH 溶液与水反应2Al+2NaOH+2H 2O=不反应不反应 CuSO 4溶液 2Na+2H 2O+CuSO 4=2NaAlO 2+3H 2↑ 较复杂较复杂不反应 Na2 SO4+Cu(OH) 2↓ +H2↑ 制备 2NaCl 2Na+Cl 2↑2Al 2O3 4Al+3O 2↑Fe2O3+3CO CuO+CO 2Fe+3CO 2 Cu+CO 2 二.钠及其化合物 1.钠 ⑴钠的物理性质 状态颜色硬度密度熔点导电、导热性 固体银白色较小 ( 比水大)较小 ( 比水小)较低(用酒精灯加热,很快 是电和热的良导体熔化) ⑵钠的化学性质 ①钠与非金属单质的反应 A:与氧气: 4Na+O 2= 2Na2O( 变暗 ) ; O2+2Na Na2O2( 燃烧生成淡黄色固体 ) B:与氯气: 2Na+Cl 2 2NaCl ; C:与 S: 2Na+S Na2S ②钠与水的反应(水中先滴入酚酞) 2Na+2HO=2NaOH+H↑ 现象概述现象描述原因浮浮在水面钠的密度比水小 游四处游动钠与水反应产生气体 熔融化成银白色小球钠的熔点较低,且该反应放出大量热响发出咝咝的响声钠与水反应剧烈 红溶液由无色变为红色生成了碱性物质 ③钠与酸的反应:2Na+2H += 2Na++H 2↑
第三章金属及其化合物 重点及难点:1.掌握钠镁铝的重要化合物及性质 2.掌握“铁三角”、“铝三角”的相互转化及定量关系 一.金属的化学性质 绝大多数金属在自然界中以(“化合”或“游离”)态形式存在;金属元素在地壳中含量最多是,其次是; 金属具有共同的物理性质是:不透明、有金属光泽、易导电导热、有延展性。 金属具有的化学性质有:与非金属反应(举例写出反应式,下同);与酸反应;与盐反应。注意:金属元素最外层电子数比较(“多”或“少”),在化学反应中易(“得到”或“失去”),所以金属在反应中表现出(“氧化”或“还原”,下同)性,作为剂。 1.金属与非金属的反应 (1)钠与氧气的反应 ①钠的物理性质:钠是色,很(“软”或“硬”),密度比水(“大”或“小”,下同)比煤油,熔点较(“高”或“低”)。 ②与氧气反应: Na + O2 = ; Na + O2(火焰呈色) ③钠的保存:钠保存在中;原因是; 取用钠的方法是。 (2)其它金属与氧气的反应:铁在空气中会在其表面生成疏松的氧化物,而镁和铝在其表面生成一层致密的氧化保护膜,因而镁和铝具有性。 2.金属与酸和水的反应 (1)与酸的反应:金属活动性顺序表为,位于氢前的金属遇酸时,能置换酸中的氢。 (2)钠与水的反应:反应方程式为。
注意:①钠着火燃烧时,不得用水和CO2灭火,应用扑灭。②钠遇水溶液,钠先与水反应,生成物再与溶质反应。 (3)铁与水蒸气的反应:化学方程式为。 3.铝与氢氧化钠溶液反应 Al与稀盐酸反应的离子方程式为: Al与NaOH溶液反应的离子方程式为: 思考:等质量的铝与足量酸或强碱反应,产生的H2(“前者多”、“后者多”或“一样多”) 二.几种重要的金属化合物 1.钠的重要化合物 (1)氧化钠和过氧化钠 (2)碳酸钠和碳酸氢钠
高中化学新课程标准教材 化学教案( 2019 — 2020学年度第二学期 ) 学校: 年级: 任课教师: 化学教案 / 高中化学 / 高一化学教案 编订:XX文讯教育机构
高一化学必修一知识点:铝三角 教材简介:本教材主要用途为通过学习化学知识和做实验,可以让学生培养自己的严谨精神、提高动手能力、合作沟通能力,本教学设计资料适用于高中高一化学科目, 学习后学生能得到全面的发展和提高。本内容是按照教材的内容进行的编写,可以放心修改调整或直接进行教学使用。 铝是高中化学重要的金属,主要有铝、氧化铝、氢氧化铝。高考化学中铝的考点主要集中的铝及其化合物的两性,即既可以与酸反应,也可以与碱反应。 点击图片可在新窗口打开 铝三角主要体现了铝及其化合物的两性 一、单质铝(al) 铝是一种活泼金属,具有金属的共性,能够与非金属、酸、某些盐反应,同时具有自己特有的性质,可以与碱反应。铝极易失去最外层3个电子形成铝离子:al-3e-=al3+。 1.铝与非金属反应 铝可以与大多数非金属单质反应,如氧气、氯气、硫、溴等,生成相应的氧化物或盐。 4al+3o2点击图片可在新窗口打开2al2o3;2al+3s点击图片可在新窗口打开al2s3;2al+3cl2点击图片可在新窗口打开2alcl3; 2.铝与酸反应
这里所说的酸,主要指稀硫酸和稀盐酸,常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸。注意钝化也属于化学变化。 2al+6hcl=2alcl3+3h2↑;2al+3h2so4=al2(so4)3+3h2↑; 3.铝与强碱反应 大多数金属不与碱反应,与强碱反应,是铝特有的性质,(锌也可以发生类似的反应,了解即可) 2al+2naoh+2h2o==2naalo2+3h2↑;对应离子方程式:2al+2oh-+2h2o==2alo2-+3h2↑; 该反应的本质是铝首先与水反应,生成氢氧化铝与氢气,2al+6h2o=2al(oh)3+3h2↑;然后,氢氧化铝与氢氧化钠反应,2al(oh)3+2naoh=2naalo2+4h2o。在整个过程中,水是氧化剂,而氢氧化钠不是氧化剂。在解答电子转移和电线桥双线桥法的题目中要注意。 4.铝热反应 铝热反应是指铝在高温条件下还原金属氧化物,置换金属单质的一种反应,不是特指与铝与氧化铁的反应。 2al+fe2o3点击图片可在新窗口打开2fe+al2o3, 铝具有较强的还原性,可以还原一些金属氧化物,如氧化钨,二氧化锰等等。 二、氧化铝(al2o3)
铝铁铜=2Na2O 2Al Fe2CuO +2Na Na 2Na+Cl22NaCl 2Al+3Cl22AlCl2Fe+3Cl22FeCl2CuCl 2Na+S Na2Al+3S Al2Fe+S FeS 2Cu+S Cu O O Fe +Cu(OH) +3CO 2Fe+3CO CuO+CO Cu+CO 2NaCl 2Na+Cl4Al+3O =2Na2O(变暗+2Na Na 2Na+Cl22NaCl 2Na+S Na 注意:钠保存在煤油中,而不能保存在汽油、 +4Na Ti+4NaCl
离子化合物离子化合物离子化合物[]Na[][] 溶解度小) 2NaHCO3Na 不反应 3 NaHCO NaOH+CO2=NaHCO 2NaHCO32Na
37 55 4Na+O2=2Na 2Na+O2Na 2K+O2=K2 K+O2KO Rb+O2 Cs+O2CsO 2M+2H=2M+H2↑ 2MCl2M+Cl Na+KCl K+NaCl
2Mg+O22MgO 4Al+3O22Al 剧烈反应、耀眼白光、放出大量热Mg+S MgS 2Al+3S Al2S3 3Mg+N2Mg O Mg(OH) 2Al+2NaOH+2H 2Mg+CO22MgO+C O32Fe+Al 电缆等 Mg+Cl4Al+3O Mg(OH)2Mg+H+Al(OH)3Al +NaOH=NaAlO 2 MgO+H2Al(OH)3Al
图象 +H+Al(OH)3Al O32Fe + Al4Al + 3MnO23Mn + 2Al
原子结构示意图:;常见价态+2,+3价。 ⑵物理性质:纯铁为银白色有金属光泽,有延展性和导热性,能导电,能被磁铁吸引,密度7.86g/cm3,熔点1535℃,沸点2750℃。 ⑶化学性质: 铁能与Cl2、Br2、O2、I2、S等非金属单质反应;与稀硫酸、浓硫酸、硝酸、盐酸等酸反应;与H2O、Fe3+、Cu2+等反应。 ①与铁生成+3价的有:Cl2、Br2、浓硫酸、硝酸等。 ②与铁生成+2价的有:I2、S、稀硫酸、盐酸、Fe3+、Cu2+等。 ③与铁生成Fe3O4的有:O2、H2O等。 2.铁的氧化物 3.铁的氢氧化物 4.亚铁和铁盐的鉴别 5.铁三角 知识拓展: ●Fe3+的性质规律: ⑴水解性: ①Fe3+半径小,所带电荷高,水解能力强。 常温下,Fe3++3H2O Fe(OH)3+3H+
“铝三角”的图像及有关计算 【“铝三角”】 写出有关转化离子方程式。 【图像分析】“铝三角”转化关系中的图象问题 ①向AlCl3溶液中滴加NaOH溶液直到过量 ②向NaOH溶液中滴加AlCl3溶液直至过量
③向NaAlO2溶液中滴加稀盐酸直至过量 ④向AlCl3溶液中滴加稀氨水直至过量 ⑤向稀盐酸中滴加NaAlO2溶液直至过量 ⑥向NaAlO2溶液中通入CO2气体直至过量 例1向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到 的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回 答下列问题: (1)图中A点表示的意义是 (2)图中B点表示的意义是 (3)上述两步反应用总的离子方程式可表示为:
(4)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为 。 (1)生成Al(OH)3沉淀的最大值 (2)Al(OH)3沉淀完全溶解于NaOH溶液成为NaAlO2溶液 (3)Al3++4OH-=AlO2-+2H2O (4)7.5 mL或17.5 mL 例2某研究学习小组对铝热反应实验展开研究。高中教材必修2(人教 版)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发 出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅 《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下: 物质Al Al2O3Fe Fe2O3 熔点/℃660205415351462 沸点/℃246729802750- I.⑴某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该 反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔 合形成铁铝合金。你认为他的解释是否合理?答: _________________(填“合理”或“不合理) ⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属 铝。该实验所用试剂是_______________,反应的离子方程式为 _________________________________。 ⑶实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。 A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液 II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应 还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定 量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液 中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积 (mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问 题: ⑴图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 ___________________。 ⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式 __________; 上述现象说明溶液中_________________结合OH-的能力比_______强 (填离子符号)。
无机推断题复习 1.颜色状态 状态常温下呈液态的特殊物质:H2O、H2O2、C6H6 、C2H6O 、Br2、Hg、等 颜色有色气体:NO2 (红 棕色)、F2(浅黄绿 色)、Cl2(黄绿色); 无色刺激性气体: SO2、NH3、HX(F、 Cl、Br、I);无色无 味气体:H2、N2、 O2、CO2、CO、CH4、 C2H2、NO。 溶液中的有色离子: Cu2+(蓝色)、Fe2+(浅绿 色)、Fe3+(黄色)、MnO4 -[紫(红)色]。Br 2 在水中 显黄(橙)色,在有机溶 剂中显橙(红)色,I2在 水中显黄(褐)色,在有 机溶剂中显紫(红)色。 有色固体:(淡)黄(棕)色固 体:Na2O2、S、FeS2、FeCl3; 黑色固体:MnO2、C、CuO、 FeO、Fe3O4、CuS CuS2; 紫(黑)色固体:KMnO4、I2; (紫)红色固体:Cu Fe2O3Cu2O e(OH)3 Cu;蓝 (绿)色固体: Cu(OH)2CuSO4·5H2O。 有色沉淀:①白色沉淀: H2SiO3、AgCl、BaSO4(不溶 于酸)、BaSO3、Mg(OH)2、 Fe(OH)2、Al(OH)3、BaCO3、 CaCO3、CaSO3、MgCO3等; ②(浅)黄色沉淀:AgBr、 AgI、S;③红褐色沉淀: Fe(OH)3;④蓝色沉淀: Cu(OH)2;⑤黑色沉淀:CuS、 FeS。 2、物质的特征结构 10电子微粒可能为N3-、O2-、F-、OH-、NH2-、Ne、CH4、NH3、H2O、HF、Na+、Mg2+、Al3+、NH4+、H3O+等。 18电子微粒可能为K+、Ca2+、Ar、F2、SiH4、PH3、H2S、HCl、H2O2、N2H4 CH3CH3 CH3F CH3OH HS-、S2-、Cl-、O22-等。 14电子微粒可能为CO、N2 、C22- 常见的正四面体结构有甲烷、CCl4、白磷、NH4+;三角锥形有NH3;直线型的多原子分子可能为CO2。 H的原子核内没有中子。 常见元素中半径最小的是H。 最外层电子数等于电子层数的元 素有 H、Be、Al、Ge等。 最外层电子数是次外层电子数2倍或3倍的元素一定在第二周期常见的原子晶体单质是金刚石和晶体硅 3、特殊的反应现象 燃烧H2+Cl2(苍白色火焰),C2H2(C6H6)+O2(明亮火焰,浓烈黑烟)。 焰色反应Na+(黄色)、K+(紫色)。
钠铝及重要化合物知识点小结(★为必背方程式) 一、钠及其化合物 (一)钠 Na 1、单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比煤油的大。★ 2、单质钠的化学性质: ① 钠与O 2反应 常温下:4Na + O 2=2Na 2O ★(新切开的钠放在空气中容易变暗) 加热时:2Na + O 2==Na 2O 2 ★(钠先熔化后燃烧,发出黄色火焰,生成淡黄色固体Na 2O 2。) 钠在空气中的变化过程:Na ―→Na 2O ―→NaOH ―→Na 2CO 3·10H 2O (结晶)―→Na 2CO 3(风化),最终得到是一种白色粉末。一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na 2O ),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH 易潮解),最终变成白色粉未(最终产物是Na 2CO 3)。 ② 钠与H 2O 反应 2Na +2H 2O =2NaOH +H 2↑ ★离子方程式:2Na + +2H 2O =2Na + +2OH - +H 2↑(注意配平) 实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH 遇酚酞变红”。 ③ 钠与盐溶液反应 如钠与CuSO 4溶液反应,应该先是钠与H 2O 反应生成NaOH 与H 2,再和CuSO 4溶液反应,有关化学方程式: 2Na +2H 2O =2NaOH +H 2↑ CuSO 4+2NaOH =Cu(OH)2↓+Na 2SO 4 总的方程式:2Na +2H 2O +CuSO 4=Cu(OH)2↓+Na 2SO 4+H 2↑ 实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出 K 、Ca 、Na 三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应 ④ 钠与酸反应:2Na +2HCl =2NaCl +H 2↑(反应剧烈) 离子方程式:2Na +2H + =2Na + +H 2↑ 3、钠的存在:以化合态存在。 4、钠的保存:保存在煤油或石蜡中。 5、工业制钠:电解熔融的NaCl :2NaCl(熔融) 2Na + Cl 2↑★ 6、钠的用途:① 在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等; ② 钠钾合金是快中子反应堆的热交换剂; ③ 钠蒸气可作高压钠灯,发出黄光,射程远,透雾能力强。 (二)氧化钠和过氧化钠 1、Na 2O Na 2O + H 2O == 2NaOH , ★ Na 2O + CO 2 == Na 2CO 3, ★ Na 2O + 2HCl == 2NaCl + H 2O .★ 另外:加热时,2Na 2O + O 2 == 2Na 2O 2 2、Na 2O 2:淡黄色固体是复杂氧化物,易与水和二氧化碳反应。 2Na 2O 2 + 2H 2O == 4NaOH + O 2 ★;2Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2 ★(作供氧剂)。 因此Na 2O 2常做生氧剂,同时,Na 2O 2还具有强氧化性,有漂白作用。如实验:Na 2O 2和水反应后的溶液中滴加酚酞,变红后又褪色。 通电 白色固体,是碱性氧化物,具有碱性氧化物的通性:
铝三角 1. Al(OH)3+3HCl==AlCl 3+3H 2O Al 2(SO 4)3+6NH 3·H 2O==2Al(OH)3↓+3(NH 4)2SO 4 Al(OH)3+3H +==Al 3++3H 2O Al 3++3NH 3·H 2O==Al(OH)3↓+3NH 4+ 2. AlCl 3+3NaOH==Al(OH)3↓+3NaCl Al 3++3OH -==Al(OH)3↓ 3.AlCl 3+3NaOH==Al(OH)3↓+3NaCl AlCl 3+4NaOH==NaAlO 2+3NaCl+2H 2O Al(OH)3+NaOH==NaAlO 2+2H 2O Al 3++4OH -==AlO 2-+2H 2O 4.NaAlO 2+HCl+H 2O==Al(OH)3↓+NaCl NaAlO 2+4HCl==AlCl 3+NaCl+2H 2O Al(OH)3+3HCl==AlCl 3+3H 2O AlO 2-+4H +==Al 3++2H 2O 5.Al(OH)3+NaOH==NaAlO 2+2H 2O Al(OH)3+OH -==AlO 2-+2H 2O 6.NaAlO 2+HCl+H 2O==Al(OH)3↓+NaCl Al 2O 3+6HCl==AlCl 3+3H 20 AlO 2-+H ++H 2O==Al(OH)3↓ Al 2O 3+2NaOH==2NaAlO 2+H 2O NaAlO 2+CO 2+2H 2O==Al(OH)3↓+NaHCO 3 AlO 2-+CO 2+2H 2O==Al(OH)3↓+HCO 3- 2NaAlO 2+CO 2+3H 2O==2Al(OH)3↓+Na 2CO 3 2AlO 2-+CO 2+3H 2O==2Al(OH)3↓+CO 32-