
走进化学实验室知识点梳理
【知识与考点】
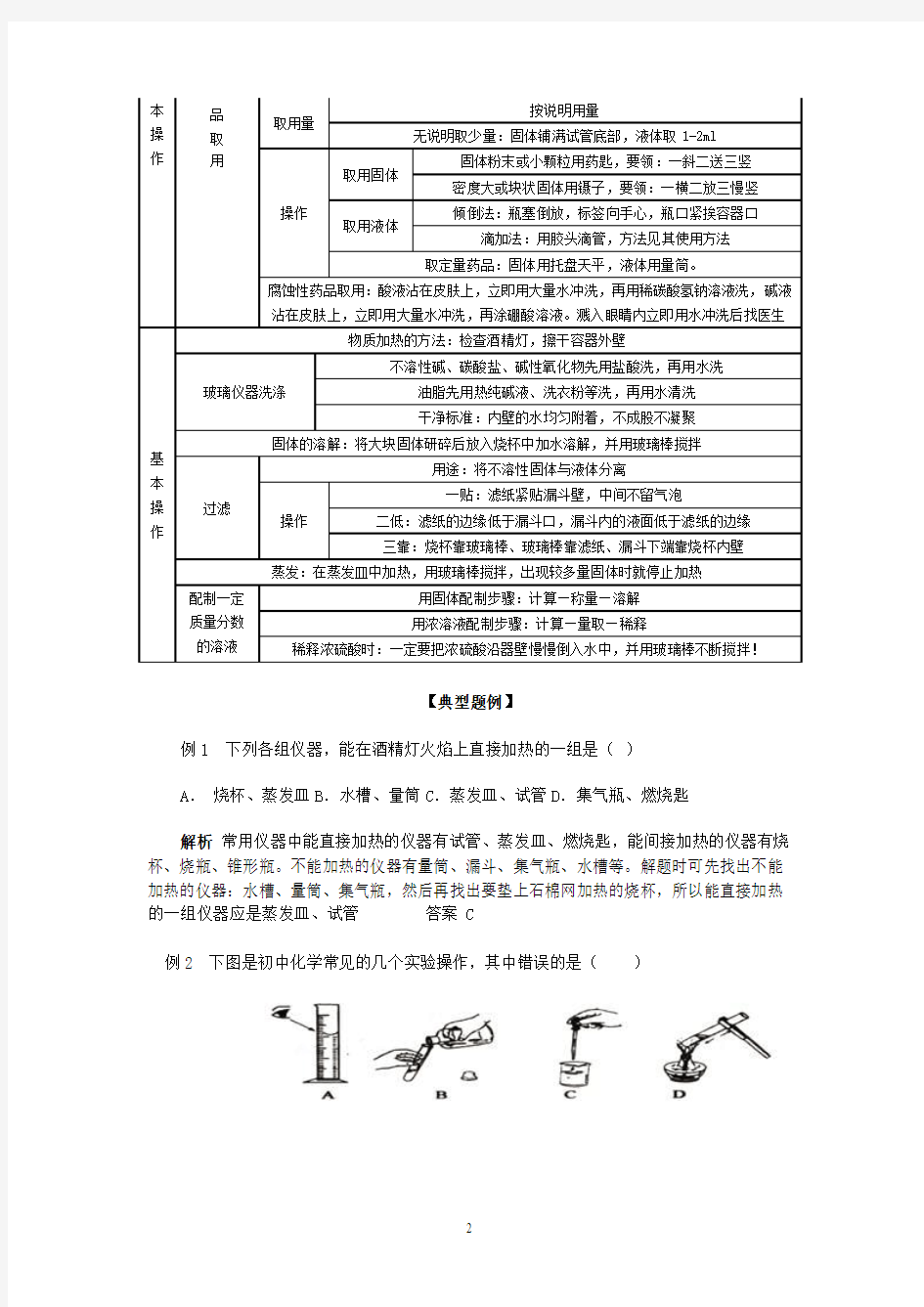
化学实验中常用仪器的名称、用途和使用方法,药品的取用,物质的加热、溶解、过滤和蒸发操作,玻璃仪器的洗涤以及一定质量分数的溶液配制等都是中考热点。
1.考查识图。根据题给仪器图形写仪器名称。
2.考查使用。简述某仪器或基本操作的用途和注意事项等。
3.考查判断。判断某一实验基本操作的正误或实验目的,判断某一操作的先后顺序。
4.考查思维能力。分析反常实验现象的产生原因;预测违规实验操作的后果;判断实验结果的合理性等。
【知识点网络】
【典型题例】
例1 下列各组仪器,能在酒精灯火焰上直接加热的一组是()
A.烧杯、蒸发皿B.水槽、量筒C.蒸发皿、试管D.集气瓶、燃烧匙
解析常用仪器中能直接加热的仪器有试管、蒸发皿、燃烧匙,能间接加热的仪器有烧杯、烧瓶、锥形瓶。不能加热的仪器有量筒、漏斗、集气瓶、水槽等。解题时可先找出不能加热的仪器:水槽、量筒、集气瓶,然后再找出要垫上石棉网加热的烧杯,所以能直接加热的一组仪器应是蒸发皿、试管答案 C
例2 下图是初中化学常见的几个实验操作,其中错误的是()
解析此题考查判断实验操作图正误的实验知识。对照用量筒量取液体、倾倒液体、滴加液体、用试管给液体加热等基本操作要点,可知读取量筒时视线要与凹液面最低处保持水平;倾倒液体时瓶塞倒放,标签向手心,瓶口紧挨容器口;滴加液体时滴管不伸入容器,不碰容器壁;加热液体时试管内液体不超过试管容积的1/3。否则会造成读数错误码、液体外流、标签腐蚀、污染试剂、暴沸飞溅等事故。
答案 A
【巩固练习】
1.(08宜昌市)下列实验操作正确的是(D )
2.(08临沂)右图表示的是某同学用50 mL量筒最取一定体积液体的
操作。请你仔细观察该图,判断量筒内液体的体积实际是
_____________(填大于、等于或小于)25 mL。
3. (08泰州)化学实验过程中要规范操作,注意实验安全,如果发生意外也要冷静处理。下列意外事故的处理方法中,错误的是( )
4.(08江西)化学是一门以实验为基础的科学。
(1)根据图1回答:①写出a的名称;②在连接c和d时,使d较易插入c中的措施是;
(2)采用图2所示操作可能造成的后果之一是
;
(3)利用图3装置(夹持装置未画出)能进行的实验是
;
A.用高锰酸钾制氧气 B.用石灰石与稀盐酸制二氧化碳
C.用锌与稀硫酸制氢气 D.用双氧水与二氧化锰制氧气
(4)图3中的气体发生装置虽然简单,操作方便,但无法控制反应速率。请从图4中选取 (选填序号)与图1中a组装成新的气体发生装置,以达到控制反应速率的目的。
答案 1. D 2. 小于 3. D 4. (1) ①试管②将插入橡皮管的导管一端用水湿润;
(2)压破试管(或刺破手);(3) C、D (4) C
我们周围的空气知识点梳理
【知识与考点】
空气、氧气是化学学习的第一大类物质,空气中氧气含量的测定,化学基本反应类型,混合物、纯净物的分类,氧气的实验室制法,以及空气的污染与防治都是中考命题的热点之一。在中考命题中形式多样,主要考查学生环保意识,对化学基本概念的理解和实验探究能力,考查学生运用知识解决生活、生产中的实际问题的能力。
【知识点网络】
【典型题例】
例1:下列物质适用于实验室测定空气中氧气含量的是()
A.红磷 B.炭 C.硫 D.铁
解析测定空气中氧气含量的原理是:物质和氧气反应,除尽氧气后,测量气体体积的减小量,得出空气中的氧气的体积分数的(21%)如果用炭、硫代替红磷,不但除不尽氧气,更重要的是氧气和炭、硫反应会生成二氧化碳、二氧化硫气体,所以气体的总体积不会变化,也就测不出空气中氧气的体积分数,如果用铁代替红磷,由于铁在空气中不能燃烧,所以也不能用,这里只有选用红磷,红磷和氧气的反应只生成固体,只要红磷足量,就可把氧气反应完,就可测出氧气的体积分数。
答案 A
例2:小明同学加热氯酸钾制氧气,错把高锰酸钾当作二氧化锰放入氯酸钾内,其结果与只加氯酸钾相比,正确的是()
A. 反应速率不变
B. 生成氧气的质量不变
C. 反应速率加快,生成氧气的质量不变
D. 反应速率加快,生成氧气的质量增加
解析当把氯酸钾和高锰酸钾混合加热时,稍微加热高锰酸钾先分解:
2KMnO4△K2MnO4 + MnO2 + O2↑生成的二氧化锰又是氯酸钾分解的催化剂:
2KClO3MnO22KCl+3O2↑,使氯酸钾的反应速率加快,同时高锰酸钾也生成氧气,所以生成的氧气的质量增加。
答案 D
【巩固练习】
1.(08黑龙江)如图所示装置,有洗气、储气等用途,在医院给病人输氧气时,也利用了
类似的装置,并在装置中盛放大约半瓶蒸馏水。以下说法正确的是:
A.b导管连接供给氧气的钢瓶
B.a导管连接病人吸氧气的塑胶管
C.该装置可用来观察是否有氧气输出
D.该装置不能用来观察输出氧气的速度
2.(08黑龙江哈尔滨)下列图示所表的物质属于纯净物的是:
3.(08江苏盐城)通过一年的化学学习,应该知道有多种途径可以制取氧气。如:A.电解水 B.分离空气
C.加热高锰酸钾 D.分解过氧化氢
E.
(1)相信你在E处还可以写出另一种制取氧气的方法;
(2)若用右图装置加热高锰酸钾制取氧气:
写出标号仪器的名称①②;
实验结束,停止加热时要先把导管移出水面,其理由
是,此时发现水槽中的水变成了浅紫红色,你认为产生该现象的原因可能是;
(3)若分解过氧化氢制取氧气,供选用的装置如下:
要得到平稳的氧气流,应选用的发生装置是(选填“甲”或“乙”);
若用丙装置干燥生成的氧气,丙中盛放的液体试剂是,气体应从(选填“a”
或“b”)端导入。
4.(08广东揭阳)研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】H2O2生成O2 的快慢与催化剂种类有关【实验方案】常温下,在两瓶同质量、同浓度的H2O2溶液中,
分别加入相同质量的MnO2和水泥块,测量各生成一瓶(相同
体积)O2 所需的时间。
【进行实验】右图是他们进行实验的装置图,
气体发生装置中A仪器名称是,
此实验中B处宜采用的气体收集方法是。
【结论】该探究过程得出的结论是
。
【反思】H2O2在常温下分解缓慢,加入MnO2 或水泥块后反应明显加快,若要证明MnO2 和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的,是否改变。
H2O2生成O2 的快慢与哪些因素有关?请你帮助他们继续探究。(只要求提出一种影响H2O2生成O2 的快慢的因素以及相关假设和实验方案)
【假设】。
【实验方案】
。
答案 1. C 2. B
3.⑴加热氯酸钾(加热氯酸钾和二氧化锰混合物)等
⑵①试管②集气瓶
以防止水倒吸进入热的试管中,造成试管破裂
试管口没有放一小团棉花,造成高锰酸钾粉末进入水槽(或导管)
⑶甲浓硫酸a
4. 仪器名称:锥形瓶子收集方法:排水集气法
【结论】在相同条件下,H2O2生成O2 的快慢与催化剂种类有关
【反思】质量和化学性质
【假设】浓度或质量分数或温度等
【实验方案】在同温
..
....的H2O2溶液,分别加入质量
..下,取二份质量相等
....的不同浓度
相等
..(其它合理答案给分)
..各收集一瓶气体所需的时间
..的同种催化剂
.....,测量
自然界的水知识点梳理
例1:明明讲浑浊的湖水倒入烧杯中,先加入明矾搅拌溶解,静置一会儿,然后进行过滤,请问:
(1)加明矾的作用是,漏斗下端紧靠烧杯内壁是为了。
(2)操作过程中,他发现过滤速度太慢,原因可能是;
(3)过滤后,观察发现,滤液仍然浑浊,可能的原因是;
(4)改进后再过滤,得到了澄清透明的水,他兴奋的宣布:我终于制得了纯水!对此你的看法是 ,理由是,若要制取纯水,还需要采用的净化方法
是。
分析:本题讨论了用过滤法净化水全过程的基本操作和注意事项。(1)明矾溶于水后生成胶状物,容易吸附杂质,可以促进水中杂质的沉降。在过滤过程中,一定要用玻璃棒来引流,这样不容易流到漏斗外边,漏斗下端紧靠烧杯内壁也是同样原因。(2)过滤速度慢,原因有很多,首先应该检查一下漏斗上的滤纸是否放好,如果有残留的气泡会影响过滤的速度。(3)一般滤液仍然浑浊的原因主要有两条,第一,滤纸破了;第二,滤液高过了滤纸上边缘。(4)过滤的方法只是除去了不溶于水的杂质,要想得到纯水。,还要通过蒸馏法除去可溶性杂质。
答案:(1)吸附杂质防止液体飞溅
(2)滤纸没有紧贴漏斗壁,残留的气泡减缓了过滤的速度。
(3)滤纸被捅破了或液面高过了滤纸上边缘,使得液体从滤纸和漏斗间流过,没有起到过滤作用
(4)不是纯水含有可溶性杂质蒸馏
点评:过滤是化学实验中一个重要的操作,希望同学们一定要多练习几次操作的全过程,记住其要领。
例2:下图是蒸馏红糖水的实验装置,回答下列问题:
(1)指出图中编号的仪器名称:
①:;②:;③:;
④:;⑤:;⑥:。
(2)指出图中错误,并改正。说明理由。
①:;
②:;
③:。
(3)红糖水沸腾时,温度计指示的沸点温度,同时在仪器④内收集
了色液体。
(4)用玻璃棒蘸蒸馏瓶残留的红糖水一滴,把它滴在滤纸上,待水渗入滤纸后,用滴管间歇滴水于红糖水斑点中心,形成多层,因此红糖水的有色物质属于。
(5)由上述实验可知红糖水属于。
分析:这是一道考察基本实验操作的试题。该题中涉及到很多仪器名称,操作中的注意事项。同时该题也隐性的联系与我们生活关系最密切的水。生活的每一滴水都是经过怎样的过程,一步一步被净化的呢?而这道题中就谈到了一个重要的操作──蒸馏。只要我们调动每一根神经,去回忆相关的知识,再认真观察装置图,就能够正确解答。
答案:(1)①蒸馏烧瓶②温度计③冷凝管④锥形瓶⑤尾接管⑥铁架台
(2)①没有石棉网,烧瓶不能直接加热,应添加石棉网
②温度计插得太往下了,应位于支管处,测蒸汽温度
③冷凝水的流向不对,应该逆向流,冷凝效果较好
(3)不固定,无
(4)色环混合物
(5)混合物
【知识与考点】
本单元知识来源于生活,服务于生活,是社会关注的环境问题和能源问题,水的电解实验,氢气的性质,单质、化合物的分类,分子和原子的性质,过滤的操作应用,以及水资源的利用和保护,都是中考命题的热点之一。在中考命题中形式多样,主要考查学生能够利用所学的知识,解决实际生产、生活中的问题,同是关注环境,关注开发新能源对人类的巨大作用。
【典型题例】
解析本题主要考查分子的基本性质与宏观现象的联系。宏观现象或操作可以反映分子的某些性质,同时分子的某些性质又可以解释宏观现象,二者是相互对应的。“100mL酒精和100mL水混合在一起,体积小于200mL”对应分子的基本性质是:分子间有间隙。
答案 B
例2:微观模拟题:通过右图反应示意图回答下列问题:
(1)丙物质属于纯净物中的___________(填物质分类)。
(2)该反应的基本反应类型为_____________反应。
(3)用分子和原子的观点来解释化学反应的实质____________。
解析试题通过模拟图示较为直观、形象地将有关粒子的构成情况展示出来,使本来很抽象的微观概念具体化、形象化。主要考查学生借助图示来分析和解决一些实际问题的能力。甲是由同种分子构成的纯净物,甲的分子又是由不同种原子构成的,发生化学变化后,观察分子和原子的变化情况以及生成物的分子构成。
答案(1)单质(2)分解(3)在化学变化中,分子可以再分,原子不能再分,只是重新组合形成其他物质的分子。
【巩固练习】
1.(08湖北黄石)下图表示物质分子的示意图。图中“●”和“○”分别表示两种含有不同质子数的原子,则图中表示单质的是()
2.(08山东潍坊) 航天员专用的小分子团水具有饮用量少、在人体内储留时间长、排放量少等特点。航天员一次饮用125mL小分子团水,可维持人体6h正常需水量。下列关于小分子团水的说法中正确的是()
A.水分子的化学性质被改变了
B.小分子团水中水分子间没有间隙
C.小分子团水中水分子停止了运动
D.小分子团水的部分物理性质与普通水有所不同
3.(08江苏南通海门)在物质混合、反应等过程中,存在着“1+1≠2”的有趣现象。通常情况下,下列各种混合或反应过程中,“1+1”不等于
...“2”的是()
A.1 g酒精和1 g水混合后的总质量
B.1 g金属铁和1 g稀盐酸反应后溶液的质量
C.1 g饱和食盐水中加入1 g食盐后,所得溶液的质量
D.1 g氢氧化钠溶液和1 g醋酸溶液混合后溶液的质量
4.(08湖北咸宁)18.水是生命之源,保护水资源,防止水污染是每个公民和全社会的责任.下列做法有利于防止水资源污染的是( )
①农业生产中要合理使用农药和化肥②工业废水和生活污水处理达标后再排放
③不用含磷洗衣粉④将海水淡化
A.①②④
B. ②③④
C.①②③
D. ①②③④
5.(08重庆)(1)向容积为250 mL的细颈玻璃仪器A中加水至虚线处,再
滴几滴红墨水,一段时间后,A中的现象是_____________,说明
______________。
(2)继续向A中加酒精至凹液面最低处正好与刻度线相切。塞紧玻璃塞,
将A中液体倒转摇匀,重复2次。静置一段时间后,A中的现象为
______________,说明____________。仪器A细颈部的作用是
_____________________。
6.(08河北省)如图所示的是电解水实验装置。通电一段时间后,在两个试
管中分别收集到气体a和气体b。请回答:
(1)电解水时,将转化为化学能;
(2)气体a为;(3)实验室检验气体b的方法是
答案 1.A 2.D 3.BC 4.C
5.(1)整瓶水变红分子在不断运动
(2)液面低于刻线且距离较远分子间存在间隙便于观察液面变化
6.(1)电能 (2)H2(或氢气) (3)用带火星木条伸入盛有气体b的试管中,观察木条是否复燃
物质构成的奥秘知识点梳理
【知识与考点】
本单元知识中物质与元素、原子、分子以及离子的区别和联系,有关概念内涵的认识,客观与微观的结合均是中考的热点,特别是与之相关的高科技信息题是近几年中考的命题方向;尤其重要的是化学用语---化学式的书写、涵义和根据化学式的有关计算。
在中考命题中形式多样,主要考查元素、原子、分子及离子之间的联系;根据信息要求书写化学式和根据化学式的有关计算等综合性问题,提高学生想像能力和综合分析问题的能力。
【典型题例】
例1 饮用水用氯气(Cl2)消毒会促使一些致癌物质生成。为消除隐患,现已采用高效安全的二氧化氯(ClO2)消毒杀菌。下列对ClO2的叙述中错误的是( )
A.ClO2是一种氧化物
B. ClO2是由氯元素和氧元素组成
C.ClO2中含有氧气
D. 1个ClO2分子由1个氯原子和2个氧原子构成
解析本题从氧化物的概念、物质与分子、原子及元素的关系入手。ClO2是由氯、氧两种元素组成的氧化物,A、B说法正确;“构成”表示微观,讲个数时前后一致,且分子由原子构成,D也正确;ClO2是纯净物,所以不含有氧气,否则就成了混合物。
答案:C
例2 在CO、CO2的混合气体中,氧元素的质量分数为67%,则该混合气体中CO2的质量分数是多少?
解析:假定混合气体的总质量为1,设CO2气体的质量为x。由题意得:
解得:x=0.633 即:x%=63.3%
【巩固练习】
1.(08山东青岛)1911年著名物理学家卢瑟福为探索原子的内部结构进行了实验。在用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔时发现:
(1)大多数α粒子能穿透金箔而不改变原来的运动方向;
(2)一小部分α粒子改变了原来的运动方向;
(3)有极少部分α粒子被弹了回来。
下列对原子结构的认识错误的是()
A.原子核体积很小
B.原子核带正电
C.原子内部有很大的空间
D.原子是实心的球体
2.(08海南省)国家游泳中心—“水立方”的设计灵感于一个“方盆子”,许多“水泡泡”、许多“水分子”。下列关于水分子的说法正确的是 ( )
A.水分子是极小的水滴
B.1个水分子由1个氢分子和1个氧原子构成
C.1个水分子由2个氢原子和1个氧原子构成
D.水分子不能再分
3.(08山东青岛)已知元素周期表中第三周期各元素原子结构示意图如下,请回答:
(1)在化学反应中,钠元素的原子容易失去电子变成________(填“阴”或“阳”)离子;
(2)元素的化学性质与原子结构中的______________数关系密切;
(3)从原子结构方面看:同一周期的元素具有相同的_______________数;
(4)在此周期中,各元素的原子结构呈现的变化规律是:
_______________________________依次递增。
4.(08山东泰安)莽草酸是我国传统的香料——八角茴香的重要成份,也是目前世界上对抗禽流感的良方——“达菲”的原料。请你根据莽草酸的化学式(C7H10O5)计算:
(1)莽草酸中氢元素和氧元素的质量比为;
(2)174 g莽草酸中含有 g碳元素。
答案:1.D2.C
3.(1)阳(2)最外层电子数(3)电子层(3)原子的质子数
4.(1)1︰8 (2)84
质量守恒定律知识点梳理
【知识与考点】
质量守恒定律基本上年年出现在中考试题中,化学方程式的书写,根据化学方程式的计算是历年中考的必出试题。常见题型有选择题、填空题、计算题、探究性学习题等。通常结
合农业生产、日常生活、科学实验等考查学生的计算能力、综合分析能力和灵活运用知识的能力。
【知识点网络】
【典型题例】
例1:著名的发明家诺贝尔经过长期的研究与试验,终于发明了安全炸药—三硝酸甘油脂,三硝酸甘油脂的化学式为C3H5N3O9,这种炸药发生爆炸的反应方程式为 C3H5N3O9 ----- 12CO2↑+10H2O↑+6Ⅹ↑+O2↑
(1)Ⅹ的化学式是
(2)推断Ⅹ的化学式的依据是
解析本题的思维切入点是根据质量守恒定律,反应前后原子的个数不变。
反应前反应后
碳原子个数:12 碳原子个数:12
氢原子个数:20 氢原子个数:20
氦原子个数:12 氦原子个数:0
氧原子个数:36 氧原子个数:36
所以6Ⅹ中共有12个氦原子,Ⅹ化学式为N2
答案:(1) N2 (2)质量守恒定律
例2:某炼铁厂用含氧化铁80%的赤铁矿(主要成分)冶炼生铁。若要炼出1120t含铁95%
的生铁,需要含氧化铁80%的赤铁矿多少吨?
(反应的化学方程式为Fe2O3+3CO 2Fe+3CO2)
解析该题由生成物的质量求反应物的质量。已知生成物质量为1120t· 95%,设赤铁矿石质量为x,则其中氧化铁质量为Ⅹ·80%,根据化学方程式计算即可求得x。
答案:设需要含氧化铁80%的赤铁矿的质量为x
Fe2O3+3CO 2Fe+3CO2
160112
x·80% 1 120 t·95%
答案:需要含有氧化铁80%的赤铁矿的质量为1 900 t
【巩固练习】
1.(08四川达州)某校九年级综合实践活动小组用一定量的溶质质量分数为10%的过氧化氢溶液和二氧化锰来制取氧气,最后所得气体质量与时间的关系如右图所示。
请计算:所用过氧化氢溶液的质量?(要求写出解题过程)
2.(08福建三明)三明市民新水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于
相对原子质量: C 12 O 16 Ca 40
⑴根据质量守恒定律可知,反应中生成二氧化碳的质量为 g。
⑵求该石灰石中碳酸钙的质量分数。
(有关反应的化学方程式为:CaCO 3+2HCl CaCl2+H2O+CO2↑)
3.(08湖北咸宁)请根据下图提示,自编一道简单的计算题,并解答。
自编的题目:
答案:
1.(08四川达州)解:设过氧化氢溶液中过氧化氢的质量为X,则:
2H2O22H2O+O2↑
68 32
X 1.6 g
X=3.4 g
则过氧化氢溶液的质量=34g
答:过氧化氢溶液的质量为34g。
2.(08福建三明)
⑴根据质量守恒定律,二氧化碳的质量为:150 g+12 g-157.6 g = 4.4 g
⑵解:设该石灰石样品中碳酸钙的质量为x。
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
x 198 g
此石灰石中碳酸钙的质量分数为:
答:(略)
3.(08湖北咸宁)自编题目1:多少克锌与足量的盐酸反应产生0.2g氢气?
自编题目2:足量的锌与多少g14.6%的盐酸反应生产0.2g氢气?
自编题目3:多少克锌与多少克14.6%盐酸恰好完全反应生成0.2g氢气?
(只要学生设计的题目合理均可给分)
具体解答过程略(锌: 6.5克盐酸: 50克)
碳和碳的氧化物知识点梳理
【知识与考点】
本单元是中考出题的热点,主要内容有:碳的几种单质的物理性质和化学性质及主要用途,C、CO还原氧化铜的探究实验,实验室制取CO2的反应原理、装置、收集方法,CO2的化
化学 一、明确中考的主要要求 二、把握中考复习的主要环节 三、中考化学试卷的解答要领 四、中考化学冲刺阶段注重整理和思考
中考复习策略 中考渐近,做好最后阶段的化学复习,对巩固学习成果、提高学习成绩,有着至关重要的作用。学生的情绪都难免焦灼与忐忑,都在想着各科的“法子”,寻找着各科的“捷径”,以便能考出一个理想的成绩。各学科复习的基本方法都大致相同,但又存在着各自的特点,各有“巧妙”不同。现就初中化学如何进行考前复习提几点建议,供同学们参考。 一、明确中考的主要要求 明确要求就是要看准方向,关注中考化学考试说明变化,把握复习的深度难度,增强复习的效率。2012年的考试说明与2011年的考试说明相比,考试性质、考试方式、试卷结构、以及考试内容要求,基本上都没有变化。从中我们体会到以下三点: 1. 扎实的化学基础知识是中考要求的“支撑点”。 中考试卷是义务教育阶段的终结性考试,属于水平考试,因此,必然具有明显的基础性。基础题一般占60%左右,许多稳定的考点带有明显的基础性。 2. 领会层次要求是提高复习效率的“着力点”。 《课标》是教师教学的根本依据,也是同学们中考复习的基础依据。《考试说明》中每一章的“知识能力要求”已将其进一步明确,它实际上就是每个知识点应该达到的“程度”。 3. 适应发展是决定中考复习质量的“关键点”。 中考试题既具有相对的稳定性,同时又具有一定的发展性。某些考点将随着当年考试要求的变化作相应的调整。如:基本概念的死记硬背进一步淡化;化学计算在降低计算难度的同时对思维能力的要求
逐步提高。所以指导我们的中考复习方向,学生的知识要灵活掌握、与生活实际相联系,要结合生活实践经验来回答问题。 二、把握中考复习的主要环节 1. 过好教材关 教材是我们平时学习的工具也是中考命题的依据,不论试题的情景如何新颖,答题的知识点基本上都来源于教材,而不可能超出教材的知识水平去编写一些偏题怪题,所以,一定要通读教材,认真思考,按中考考试说明的要求认真落实,并尽量查找自己对基本概念和基本理论理解上的漏洞。历届毕业生的成功经验表明,在复习中根据自己的弱点和盲点有针对性地阅读课本,是总复习中的重要的一环。初中化学知识点零散,复习时化学基础知识要“细”、“实”、“到位” ,粗糙就是“空”、不实等于“零”。教材中的基础知识掌握得好,中考就可以得高分。要明确各知识点的内在联系,形成了知识的系统化,更主要的就是在学生学习的过程中要强迫学生们回归教材。通过这样的复习使初中化学知识系统化、结构化、并在教材基础上进行适当拓宽和加深,再配以适当的习题加深知识的巩固。题中空白填写完后,需要学生加深理解和记忆。学生具有扎实的掌握基础知识,因为这是决战中考的武器,必须磨光擦亮,才能取得中考的胜利。 四类知识复习好 (1)基本概念和基本理论的复习方法:咬文嚼字抓关键、分析比较辨异同、分类归纳成网络。注意对教材中所有的概念做到心中有数,并且分类掌握。通过分析、对比,把握容易混淆的概念之间的本质区别和内在联系。化学用语掌握,对一些现象的解释及问题的解决归结到最后,要能用准确的化学用语表达出来,而且能规范地书写。因此,能熟练、正确、规范地书写元素符号、离子符号、价标符号、化学式、
有机化学知识点归纳(一) 一、同系物 结构相似,在分子组成上相差一个或若干个CH 2原子团的物质物质。 同系物的判断要点: 1、通式相同,但通式相同不一定是同系物。 2、组成元素种类必须相同 3、结构相似指具有相似的原子连接方式,相同的官能团类别和数目。结构相似不一定完全相同,如CH 3CH 2CH 3和(CH 3)4C ,前者无支链,后者有支链仍为同系物。 4、在分子组成上必须相差一个或几个CH 2原子团,但通式相同组成上相差一个或几个CH 2原子团不一定是同系物,如CH 3CH 2Br 和CH 3CH 2CH 2Cl 都是卤代烃,且组成相差一个CH 2原子团,但不是同系物。 5、同分异构体之间不是同系物。 二、同分异构体 化合物具有相同的分子式,但具有不同结构的现象叫做同分异构现象。具有同分异构现象的化合物互称同分异构体。 1、同分异构体的种类: ⑴ 碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。如C 5H 12有三种同分异构体,即正戊烷、异戊烷和新戊烷。 ⑵ 位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。 ⑶ 异类异构:指官能团不同而造成的异构,也叫官能团异构。如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦芽糖等。 ⑷ 其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。 各类有机物异构体情况: ⑴ C n H 2n +2:只能是烷烃,而且只有碳链异构。如CH 3(CH 2)3CH 3、CH 3CH(CH 3)CH 2CH 3、C(CH 3)4 ⑵ C n H 2n :单烯烃、环烷烃。如CH 2=CHCH 2CH 3、 CH 3CH=CHCH 3、CH 2=C(CH 3)2、 、 ⑶ C n H 2n -2:炔烃、二烯烃。如:CH ≡CCH 2CH 3、CH 3C ≡CCH 3、CH 2=CHCH=CH 2 ⑷ C n H 2n -6:芳香烃(苯及其同系物) 、 ⑸ C n H 2n +2O :饱和脂肪醇、醚。如:CH 3CH 2CH 2OH 、CH 3CH(OH)CH 3、CH 3OCH 2CH 3 ⑹ C n H 2n O :醛、酮、环醚、环醇、烯基醇。如:CH 3CH 2CHO 、CH 3COCH 3、CH 2=CHCH 2OH 、 、 、 CH 2—CH 2 CH 2—CH 2 CH 2 CH 2—CH —CH 3 CH 3 CH 3 CH 3 CH 3 CH 3O CH 2—CH —CH 3 CH 2—CH 2 O CH 2 CH 2 CH 2—CH —OH
电化学基础知识点总结 装置特点:化学能转化为电能。 ①、两个活泼性不同的电极; 形成条件:②、电解质溶液(一般与活泼性强的电极发生氧化还原反应); 原 ③、形成闭合回路(或在溶液中接触) 电 负极:用还原性较强的物质作负极,负极向外电路提供电子;发生氧化反应。 池 基本概念: 正极:用氧化性较强的物质正极,正极从外电路得到电子,发生还原反应。 原 电极反应方程式:电极反应、总反应。 理 氧化反应 负极 铜锌原电池 正极 还原反应 反应原理:Zn-2e -=Zn 2+ 2H ++2e -=2H 2↑ 电解质溶液 1.下列变化中,属于原电池反应的是( ) A .在空气中金属铝表面迅速氧化形成保护层 B .镀锌铁表面有划损时,也能阻止铁被氧化 C .红热的铁丝与水接触表面形成蓝黑色保护层 D .铁与稀H 2SO 4反应时,加入少量CuSO 4溶液时,可使反应加速 2.100 mL 浓度为2 mol/L 的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的量,可采用的方法是( ) A .加入适量的6 mol/L 的盐酸 B .加入数滴氯化铜溶液 C .加入适量的蒸馏水 D .加入适量的氯化钠溶液 3.称取三份锌粉,分别盛于甲、乙、丙三支试管中,按下列要求另加物质后,塞上塞子,定时测定生成氢气的体积。甲加入50 mL pH =3的盐酸,乙加入50 mL pH =3的醋酸,丙加入50 mL pH =3的醋酸及少量胆矾粉末。若反应终了,生成氢气的体积一样多,且没有剩余的锌。请用“>”“=”或“<”回答下列各题。 失e -,沿导线传递,有电流产生 溶解 不断 移 向 阳离 子
中考初三化学知识点总结归纳(完整版) 初中化学知识点全面总结(完整版) 第1单元走进化学世界 1、化学是研究物质的组成、结构、性质以及变化规律的基础科学。 2、我国劳动人民商代会制造青铜器,春秋战国时会炼铁、炼钢。 3、绿色化学-----环境友好化学 (化合反应符合绿色化学反应) ①四特点P6(原料、条件、零排放、产品)②核心:利用化学原理从源头消除污染 4、蜡烛燃烧实验(描述现象时不可出现产物名称) (1)火焰:焰心、内焰(最明亮)、外焰(温度最高) (2)比较各火焰层温度:用一火柴梗平放入火焰中。现象:两端先碳化;结论:外焰温度最高 (3)检验产物 H2O:用干冷烧杯罩火焰上方,烧杯内有水雾 CO2:取下烧杯,倒入澄清石灰水,振荡,变浑浊(4)熄灭后:有白烟(为石蜡蒸气),点燃白烟,蜡烛复燃。说明石蜡蒸气燃烧。 5、吸入空气与呼出气体的比较 结论:与吸入空气相比,呼出气体中O2的量减少,CO2和H2O的量增多 (吸入空气与呼出气体成分是相同的) 6、学习化学的重要途径——科学探究 一般步骤:提出问题→猜想与假设→设计实验→实验验证→记录与结论→反思与评价 化学学习的特点:关注物质的性质、变化、变化过程及其现象; 7、化学实验(化学是一门以实验为基础的科学) 一、常用仪器及使用方法 (一)用于加热的仪器--试管、烧杯、烧瓶、蒸发皿、锥形瓶 (二)测容器--量筒 (1)量取液体体积时,量筒必须放平稳。视线与刻度线及量筒内液体凹液面的最低点保持水平。(2)量筒不能用来加热,不能用作反应容器。(3)量程为10毫升的量筒,一般只能读到0.1毫升。 (三)称量器--托盘天平(用于粗略的称量,一般能精确到0.1克。) 注意点:(1)先调整零点 (2)称量物和砝码的位置为“左物右码”。 (3)称量物不能直接放在托盘上。
高中(人教版)《有机化学基础》必记知识点 目录 一、必记重要的物理性质 二、必记重要的反应 三、必记各类烃的代表物的结构、特性 四、必记烃的衍生物的重要类别和各类衍生物的重要化学性质 五、必记有机物的鉴别 六、必记混合物的分离或提纯(除杂) 七、必记有机物的结构 八、必记重要的有机反应及类型 九、必记重要的有机反应及类型 十、必记一些典型有机反应的比较 十一、必记常见反应的反应条件 十二、必记几个难记的化学式 十三、必记烃的来源--石油的加工 十四、必记有机物的衍生转化——转化网络图一(写方程) 十五、煤的加工 十六、必记有机实验问题 十七、必记高分子化合物知识 16必记《有机化学基础》知识点
一、必记重要的物理性质 难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。 苯酚在冷水中溶解度小(浑浊),热水中溶解度大(澄清);某些淀粉、蛋白质溶于水形成胶体溶液。 1、含碳不是有机物的为: CO、CO2、 CO32-、HCO3-、H2CO3、CN-、HCN、SCN-、HSCN、SiC、C单质、金属碳化物等。2.有机物的密度 (1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、酯(包括油脂) (2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯 3.有机物的状态[常温常压(1个大气压、20℃左右)] 常见气态: ①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态 ②衍生物类:一氯甲烷、氟里昂(CCl2F2)、氯乙烯、甲醛、氯乙烷、一溴甲烷、四氟乙烯、甲醚、甲乙醚、环氧乙烷。 4.有机物的颜色 ☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色,常见的如下所示: ☆三硝基甲苯(俗称梯恩梯TNT)为淡黄色晶体; ☆部分被空气中氧气所氧化变质的苯酚为粉红色; ☆2,4,6—三溴苯酚为白色、难溶于水的固体(但易溶于苯等有机溶剂); ☆苯酚溶液与Fe3+(aq)作用形成紫色[H3Fe(OC6H5)6]溶液; ☆淀粉溶液(胶)遇碘(I2)变蓝色溶液; ☆含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。 5.有机物的气味 许多有机物具有特殊的气味,但在中学阶段只需要了解下列有机物的气味: ☆甲烷:无味;乙烯:稍有甜味(植物生长的调节剂) ☆液态烯烃:汽油的气味;乙炔:无味 ☆苯及其同系物:特殊气味,有一定的毒性,尽量少吸入。 ☆C4以下的一元醇:有酒味的流动液体;乙醇:特殊香味 ☆乙二醇、丙三醇(甘油):甜味(无色黏稠液体) ☆苯酚:特殊气味;乙醛:刺激性气味;乙酸:强烈刺激性气味(酸味) ☆低级酯:芳香气味;丙酮:令人愉快的气味 6、研究有机物的方法 质谱法确定相对分子量;红外光谱确定化学键和官能团;核磁共振氢谱确定H的种类及其个数比。 二、必记重要的反应 1.能使溴水(Br2/H2O)褪色的物质
电化学基础知识归纳(含部分扩展内容)(珍藏版) 特点:电池总反应一般为自发的氧化还原反应,且为放热反应(△H<0);原电池可将化学能转化为电能 电极负极:一般相对活泼的金属溶解(还原剂失电子,发生氧化反应) 正极:电极本身不参加反应,一般是电解质中的离子得电子(也可能是氧气等氧化剂),发生还原反应 原电池原理电子流向:负极经导线到正极 电流方向:外电路中,正极到负极;内电路中,负极到正极 电解质中离子走向:阴离子移向负极,阳离子移向正极 原电池原理的应用:制成化学电源(实用原电池);金属防腐(被保护金属作正极);提高化学反应速率;判断金属活性强弱 一次电池负极:还原剂失电子生成氧化产物(失电子的氧化反应) 正极:氧化剂得电子生成还原产物(得电子的还原反应) 放电:与一次电池相同 二次电池规则:正极接外接电源正极,作阳极;负极接外接电源负极,作阴极(正接正,负接负) 充电阳极:原来的正极反应式反向书写(失电子的氧化反应) 原电池阴极:原来的负极反应式反向书写(得电子的还原反应) 化学电源电极本身不参与反应(一般用多孔电极吸附反应物),总反应相当于燃烧反应 负极:可燃物(如氢气、甲烷、甲醇等)失电子被氧化(注意电解质的酸碱性) 电极反应正极:O得电子被还原,具体按电解质不同通常可分为4种 2 燃料电池碱性介质:O+4e-+2H O==4OH- 22 酸性介质:O+4e-+4H+==2H O 22 电解质不同时氧气参与的正极反应固体或熔融氧化物(传导氧离子):O+4e-==2O2- 2 第1页质子交换膜(传导氢离子):O+4e-+4H+==2H O 22
特殊原电池:镁、铝、氢氧化钠,铝作负极;铜、铝、浓硝酸,铜作负极;铜、铁、浓硝酸,铜作负极,等 特点:电解总反应一般为不能自发的氧化还原反应;可将电能转化为化学能 活性电极:阳极溶解(优先),金属生成金属阳离子 阳极惰性电极一般为阴离子放电,失电子被氧化,发生氧化反应 (接电源正极)(石墨、铂等)常用放电顺序是:Cl->OH->高价态含氧酸根(还原性顺序), 发生氧化反应,相应产生氯气、氧气 电解原理电极反应 阴极电极本身一般不参加反应,阳离子放电,得电子被还原,发生还原反应 (接电源负极)常用放电顺序是:Ag+>Cu2+>H+>活泼金属阳离子(氧化性顺序), 相应产生银、铜、氢气 电流方向:正极到阳极再到阴极最后到负极 电子流向:负极到阴极,阳极到正极(电解质溶液中无电子流动,是阴阳离子在定向移动) 离子流向:阴离子移向阳极(阴离子放电),阳离子移向阴极(阳离子放电) 常见电极反应式阳极:2Cl--2e-==Cl↑,4OH--4e-==O↑+2H O或2H O-4e-==O↑+4H+(OH-来自水时适用) 22222 电解池阴极:Ag++e-==Ag,Cu2++2e-==Cu,2H++2e-==H↑或2H O+2e-==H↑+2OH-(H+来自水时适用) 222 电解水型:强碱、含氧强酸、活泼金属的含氧酸盐,如:NaOH、KOH、H SO、HNO、Na SO溶液等 24324 电解溶质型:无氧酸、不活泼金属的含氧酸盐,如:HCl、CuCl溶液等 2 常见电解类型电解溶质+水(放氢生碱型):活泼金属的无氧酸盐,如:NaCl、KCl、MgCl溶液等 2 电解溶质+水(放氧生酸盐):不活泼金属的含氧酸盐,如:CuSO、AgNO溶液等 43 氯碱工业的基础:电解饱和食盐水制取氯气、氢气和氢氧化钠 第2页
初三化学中考考点归纳与点拨 考点1:物质的变化、性质、反应类型 (1)判别物理变化还是化学变化的依据是:有无新物质生成。发光、放热、爆炸既可能是化学变化也可能是物理变化。 (2)物质的色、态、味、熔点、沸点、硬度、密度、溶解度、导热性、导电性、挥发性属于物理性质,在化学变化中才体现出来的性质属于化学性质(如可燃性、氧化性、还原性、酸碱性、腐蚀性、毒性等)。 (3)四种基本反应类型是: 化合(A+B→AB)、分解(AB→A+B)、置换(C+AB→AC+B)、复分解(AB+CD→AD+CB) 氧化还原反应中有关概念的关系 得氧——被氧化——还原剂(C、CO、H2等);失氧——被还原——氧化剂(02、CuO、Fe203等)。 考点2:空气的成分、应用、污染和防治 (1)空气成分及体积分数:N278% 022l%、稀有气体0.94%、C02 0.03%其他杂质气体0.03% (2)应用:氧气(供给呼吸、支持燃烧)、氮气(作保护气等)、稀有气体(作保护气或电光源来产生各种色光,如氖气一一红色光) (3)污染大气的物质是可吸入颗粒(如沙尘)和有害气体(主要是CO、N02、S02),大气污染引发三大环境问题一一温室效应(C02,但C02不是大气污染物)、酸雨(S02)、臭气空洞(氟氯代烃,即氟里昂) (4)三大化石燃料一一天然气、石油、煤(燃烧都会产生C02,石油在驱动汽车、飞机时尾气中有氮氧化物,煤燃烧会产生S02)。氢气是最理想的燃料(取之于水来源丰富、等量燃烧放出热量最大、燃烧产物是水没有污染)但现有技术条件下成本较大。改善能源结构(如开发氢能源、用酒精代替汽油、西气东输用天然气代替煤气等)、控制有害气体的排放等能有效防治气体污染。 考点3:氧气的性质、制法、用途 (1)无色无味气体、不易溶于水,降温可变为淡蓝色液体,甚至变为淡蓝色雪化状同体,氧气通常贮存在蓝色钢瓶中。化学性质见下表。 物质主要现象化学方程式 碳剧烈燃烧、发出白光、放热、生成无色无味能使澄清石灰水变浑浊的气体 C + O2点燃 CO2 硫发出蓝紫色火焰;空气中淡蓝色火焰、放热、生成无色有刺激性气味的气体 S + O2点燃SO2 磷发出白光、放热、生成自烟 4P + 5O2点燃2P2O5 铁剧烈燃烧、火星四射、放热、生成黑色固体 3Fe + 2O2点燃Fe3O4 铝剧烈燃烧、发出耀眼白光、放出大量的热、生成白色固体 4Al + 3O2点燃2Al2O3 镁剧烈燃烧、发出耀眼白光、放出大量的热、生成白色固体(空气中即可燃烧) 2Mg + O2点燃2MgO (2)实验室两种制法: 2KMnO4加热K2MnO4 + MnO2 + O2↑(固固加热型)(查、装、定、点、收、离、熄) 2H2O2 H2O+ O2 ↑ (固液不加热型)(Mn02作催化剂“一变两不变”) MnO2 可用排水法(不易溶于水)或向上捧空气法(密度比空气大,32>29)收集 工业上用分离液态空气的方法得到氧气(氧气的沸点比氮气高.物理变化)。 (3)用途:供给呼吸、支持燃烧 考点4:燃烧、缓慢氧化、自燃和爆炸 燃烧一一即剧烈氧化(在有限空间的急速燃烧会引起爆炸) 氧化
装置特点:化学能转化为电能。 ①、两个活泼性不同的电极; 形成条件:②、电解质溶液(一般与活泼性强的电极发生氧化还原反应); 原 ③、形成闭合回路(或在溶液中接触) 电 负极:用还原性较强的物质作负极,负极向外电路提供电子;发生氧化反应。 池 基本概念: 正极:用氧化性较强的物质正极,正极从外电路得到电子,发生还原反应。 原 电极反应方程式:电极反应、总反应。 理 氧化反应 还原反应 反应原理:Zn-2e -=Zn 2+ 2H ++2e -=2H 2↑ 电极反应: 负极(锌筒)Zn-2e -=Zn 2+ 正极(石墨)2NH 4++2e -=2NH 3+H 2↑ ①、普通锌——锰干电池 总反应:Zn+2NH 4+=Zn 2++2NH 3+H 2↑ 干电池: 电解质溶液:糊状的NH 4Cl 特点:电量小,放电过程易发生气涨和溶液 ②、碱性锌——锰干电池 电极:负极由锌改锌粉(反应面积增大,放电电流增加); 。 正极(PbO 2) PbO 2+SO 42-+4H ++2e -=PbSO 4+2H 2O 负极(Pb ) Pb+SO 42--2e -=PbSO 4 铅蓄电池:总反应:PbO 2+Pb+2H 2SO 4 2PbSO 4+2H 2O 电解液:1.25g/cm 3~1.28g/cm 3的H 2SO 4 溶液 蓄电池 特点:电压稳定。 Ⅰ、镍——镉(Ni ——Cd )可充电电池; 其它蓄电池 Cd+2NiO(OH)+2H 2O Cd(OH)2+2Ni(OH)2 Ⅱ、银锌蓄电池 锂电池 ①、燃料电池与普通电池的区别 不是把还原剂、氧化剂物质全部贮藏在电池内,而是工作时不断从外界输入,同时 燃料 电极反应产物不断排出电池。 电池 ②、原料:除氢气和氧气外,也可以是CH 4、煤气、燃料、空气、氯气等氧化剂。 负极:2H 2+2OH --4e -=4H 2O ;正极:O 2+2H 2O+4e -=4OH - ③、氢氧燃料电池: 总反应:O 2 +2H 2 =2H 2O 特点:转化率高,持续使用,无污染。 废旧电池的危害:旧电池中含有重金属(Hg 2+)酸碱等物质;回收金属,防止污染。 失e -,沿导线传递,有电流产生化学电源简介 放电 充电 放电 放电`
中考化学初三化学知识点总结归纳(完整版) 第1单元走进化学世界 1、化学是研究物质的组成、结构、性质以及变化规律的基础科学。 2、我国劳动人民商代会制造青铜器,春秋战国时会炼铁、炼钢。 3、绿色化学-----环境友好化学 (化合反应符合绿色化学反应) ①四特点P6(原料、条件、零排放、产品)②核心:利用化学原理从源头消除污染 4、蜡烛燃烧实验(描述现象时不可出现产物名称) (1)火焰:焰心、内焰(最明亮)、外焰(温度最高) (2)比较各火焰层温度:用一火柴梗平放入火焰中。现象:两端先碳化;结论:外焰温度最高 (3)检验产物 H2O:用干冷烧杯罩火焰上方,烧杯内有水雾 CO2:取下烧杯,倒入澄清石灰水,振荡,变浑浊 (4)熄灭后:有白烟(为石蜡蒸气),点燃白烟,蜡烛复燃。说明石蜡蒸气燃烧。 5、吸入空气与呼出气体的比较 结论:与吸入空气相比,呼出气体中O2的量减少,CO2和H2O的量增多 (吸入空气与呼出气体成分是相同的) 6、学习化学的重要途径——科学探究 一般步骤:提出问题→猜想与假设→设计实验→实验验证→记录与结论→反思与评价 化学学习的特点:关注物质的性质、变化、变化过程及其现象; 7、化学实验(化学是一门以实验为基础的科学) 一、常用仪器及使用方法 (一)用于加热的仪器--试管、烧杯、烧瓶、蒸发皿、锥形瓶 可以直接加热的仪器是--试管、蒸发皿、燃烧匙 只能间接加热的仪器是--烧杯、烧瓶、锥形瓶(垫石棉网—受热均匀) 可用于固体加热的仪器是--试管、蒸发皿 可用于液体加热的仪器是--试管、烧杯、蒸发皿、烧瓶、锥形瓶 不可加热的仪器——量筒、漏斗、集气瓶 (二)测容器--量筒 量取液体体积时,量筒必须放平稳。视线与刻度线及量筒内液体凹液面的最低点保持水平。 量筒不能用来加热,不能用作反应容器。量程为10毫升的量筒,一般只能读到0.1毫升。 (三)称量器--托盘天平(用于粗略的称量,一般能精确到0.1克。)
装置特点:化学能转化为电能。 ①、两个活泼性不同的电极; 形成条件:②、电解质溶液(一般与活泼性强的电极发生氧化还原反应); 原 ③、形成闭合回路(或在溶液中接触) 电 负极:用还原性较强的物质作负极,负极向外电路提供电子;发生氧化反应。 池 基本概念: 正极:用氧化性较强的物质正极,正极从外电路得到电子,发生还原反应。 原 电极反应方程式:电极反应、总反应。 理 氧化反应 还原反应 反应原理:Zn-2e -=Zn 2+ 2H ++2e -=2H 2↑ 1.下列变化中,属于原电池反应的是( ) A .在空气中金属铝表面迅速氧化形成保护层 B .镀锌铁表面有划损时,也能阻止铁被氧化 C .红热的铁丝与水接触表面形成蓝黑色保护层 D .铁与稀H 2SO 4反应时,加入少量CuSO 4溶液时,可使反应加速 2.100 mL 浓度为2 mol/L 的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的量,可采用的方法是( ) A .加入适量的6 mol/L 的盐酸 B .加入数滴氯化铜溶液 C .加入适量的蒸馏水 D .加入适量的氯化钠溶液 3.称取三份锌粉,分别盛于甲、乙、丙三支试管中,按下列要求另加物质后,塞上塞子,定时测定生成氢气的体积。甲加入50 mL pH =3的盐酸,乙加入50 mL pH =3的醋酸,丙加入50 mL pH =3的醋酸及少量胆矾粉末。若反应终了,生成氢气的体积一样多,且没有剩余的锌。请用“>”“=”或“<”回答下列各题。 (1)开始时,反应速率的大小为__________。 (2)三支试管中参加反应的锌的质量为__________。 (3)反应终了,所需时间为__________。 (4)在反应过程中,乙、丙速率不同的理由是(简要说明)__________。 失e -,沿导线传递,有电流产生
九年级化学知识点总结 一、基本概念 1.物理变化:没有生成其它物质的变化。常伴随的是物质外形、物质状态的改变。 2.化学变化:有其它物质生成的变化。 3.物理性质:物质不需要化学变化就表现出的性质。包括:颜色、状态、气味、熔点、沸点、密度、硬度、溶解性、挥发性、延展性、导电性、吸水性、吸附性等。 4.化学性质:物质在化学变化中表现出来的性质。在描述时常有“会”“能”“可以”等出现。可燃性、氧化性、还原性、活泼性、稳定性、腐蚀性、毒性、金属活动性等。 5.纯净物:只由一种物质组成。可用专门的化学符号表示 6.混合物:由两种或多种物质混合而成的物质。如空气、合金、溶液是混合物。 7.基本反应类型:化合反应:由两种或两种以上物质生成另一种物质的反应(多变一)。分解反应:由一种反应物生成两种或两种以上其他物质的反应(一变多)。置换反应:单质1+化合物1══单质2+化合物2 (化合价改变)。复分解反应:两种化合物互相交换成分,生成另外另外两种化合物的反应。(化合价不变) 8.物质分别是由分子、原子、离子三种微粒构成的,其中分子又是由原子构成的。物质由元素组成。由分子构成的物质,分子是保持物质化学性质的最小粒子。原子是化学变化中的最小粒子。元素的定义:具有相同核电荷数(即核内质子数)的一类原子的总称。 9.原子结构: (1)原子核:居于原子中心,体积极小但质量相当于整个原子质量。它虽小,还可分为带正 电质子和不带电的中子。 (2)电子:带负电,在原子核外很大空间作高速运转。跟原子比较,其质量和体积都可忽略 不计。在原子里,核电荷数=质子数=核外电子数 10.离子:带有电荷的原子或原子团(镁离子和镁原子具有相同的质子数或核电荷数)。 11.稳定结构:①最外层8电子②只有一层为最外层2电子。如:稀有气体原子和离子 12.自然界中的化学元素:(1)地壳中含量前四位的元素依次是氧、硅、铝、铁。空气中含 量最多的元素是氮元素。(2)海水、人体中最多的元素:O 13.化合物的命名: (1)两种元素化合:“某化某”,如MgO氧化镁,NaCl氯化钠,Fe3O4四氧化三铁;(2)金 属与酸根化合:“某酸某”,如CaCO3碳酸钙,CuSO4硫酸铜,NH4NO3硝酸铵。 无机化合物的写法:正价元素在前,负价元素在后(NH3除外) 14.催化剂:在化学变化里能改变其它物质的化学反应速率,而本身的质量和化学性质在化学化 前后都没有变化的物质。催化剂不改变生成物的质量。 15.燃烧的条件: (1)物质具有可燃性;(2)可燃物与氧气接触;(3)温度达到着火点。 16.灭火的方法: (1)清除或隔离可燃物;(2)隔绝氧气(如油锅着火可用锅盖盖灭); (3)降低可燃物的温度至着火点以下(如房屋着火时消防队员用高压水枪灭火)。 17.爆炸:可燃物在有限空间内急速燃烧,在短时间内产生大量热和气体导致爆炸。一切可燃 性气体、粉尘、在遇到明火时都有可能发生爆炸。(也有物理变化的爆炸如车胎爆炸)。 18.质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成各物质的质量总和。 在化学反应前后,肯定不变的是原子的种类、质量和数目、元素的种类和质量、反应前后物质 的总质量。肯定变化的是物质的种类和分子的种类。 19.合金:由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特 性的物质。合金是混合物而不是化合物,合金是金属材料。一般说来,合金的熔点比各成分 低,硬度比各成分大,抗腐蚀性能更好。 20.各元素或原子团的化合价与离子的电荷数相对应。单质中,元素的化合价为0 ;在化合物 里,各元素的化合价的代数和为0。 21.化学符号的意义: a.元素符号:①表示一种元素;②表示该元素的一个原子。 b.化学式:1、宏观意义:①.表示一种物质;②.表示该物质的元素组成;2、微观意义:①. 表示该物质的一个分子;②.表示该物质的分子构成。 c.离子符号:表示离子及离子所带的电荷数 d.化合价符号:表示元素或原子团的化合价。 当符号前面有数字(化合价符号没有数字)时,此时组成符号的意义只表示微观意义。 22.常见的酸根离子:SO42-(硫酸根)、NO3-(硝酸根)、CO32-(碳酸根)、PO43-(磷酸根)、Cl-(氯 离子)、HCO3-(碳酸氢根)、S2-(硫离子)。 23.金属活动性顺序表: K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au (钾、钙、钠、镁、铝、锌、铁、锡、铅、氢、铜、汞、银、铂、金) 说明:(1)越左金属活动性就越强,除K、Ca、Na外,左边的金属可以从右边金属的盐溶液 中置换出该金属来(2)排在氢左边的金属,可以从酸(盐酸或稀硫酸)中置换出氢气;排在 氢右边的则不能。 24.溶液:一种或几种物质分散到另一种物质中,形成均一、稳定的混合物。 固体溶解度是指在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解溶质的质量。 固体溶解度的单位是g。 二、物质部分 1.测定空气中氧气的含量实验中,实验注意事项:A、装置不能漏气;B、集气瓶中预先要加 入少量水;C、红磷要过量;D、待红磷熄灭并冷却后,打开弹簧夹。
高中化学有机化学知识点总结 1.需水浴加热的反应有: (1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解 (5)、酚醛树脂的制取(6)固体溶解度的测定 凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。 2.需用温度计的实验有: (1)、实验室制乙烯(170℃)(2)、蒸馏(3)、固体溶解度的测定 (4)、乙酸乙酯的水解(70-80℃)(5)、中和热的测定 (6)制硝基苯(50-60℃) 〔说明〕:(1)凡需要准确控制温度者均需用温度计。(2)注意温度计水银球的位置。 3.能与Na反应的有机物有:醇、酚、羧酸等——凡含羟基的化合物。 4.能发生银镜反应的物质有:醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。 5.能使高锰酸钾酸性溶液褪色的物质有:(1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的同系物 (2)含有羟基的化合物如醇和酚类物质(3)含有醛基的化合物 (4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等) 6.能使溴水褪色的物质有: (1)含有碳碳双键和碳碳叁键的烃和烃的衍生物(加成)(2)苯酚等酚类物质(取代)(3)含醛基物质(氧化)(4)碱性物质(如NaOH、Na2CO3)(氧化还原――歧化反应)(5)较强的无机还原剂(如SO2、KI、FeSO4等)(氧化) (6)有机溶剂(如苯和苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。) 7.密度比水大的液体有机物有:溴乙烷、溴苯、硝基苯、四氯化碳等。 8、密度比水小的液体有机物有:烃、大多数酯、一氯烷烃。 9.能发生水解反应的物质有 卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐。 10.不溶于水的有机物有:烃、卤代烃、酯、淀粉、纤维素 11.常温下为气体的有机物有:分子中含有碳原子数小于或等于4的烃(新戊烷例外)、一氯甲烷、甲醛。
初中化学中考复习知识点总结 一基本概念: 1、化学变化:生成了其它物质的变化 2、物理变化:没有生成其它物质的变化 3、物理性质:不需要发生化学变化就表现出来的性质 (如:颜色、状态、密度、气味、熔点、沸点、硬度、水溶性等) 4、化学性质:物质在化学变化中表现出来的性质 (如:可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等) 5、纯净物:由一种物质组成 6、混合物:由两种或两种以上纯净物组成,各物质都保持原来的性质 7、元素:具有相同核电荷数(即质子数)的一类原子的总称 8、原子:是在化学变化中的最小粒子,在化学变化中不可再分 、化学式和化合价: (1)化学式的意义:①宏观意义:a.表示一种物质; b.表示该物质的元素组成; ②微观意义:a.表示该物质的一个分子; b.表示该物质的分子构成; ③量的意义:a.表示物质的一个分子中各原子个数比; b.表示组成物质的各元素质量比。 (2)单质化学式的读写 ①直接用元素符号表示的:a.金属单质。如:钾K 铜Cu 银Ag 等; b.固态非金属。如:碳C 硫S 磷P 等 c.稀有气体。如:氦(气)He 氖(气)Ne 氩(气)Ar等 ②多原子构成分子的单质:其分子由几个同种原子构成的就在元素符号右下角写几。 如:每个氧气分子是由2个氧原子构成,则氧气的化学式为O2 双原子分子单质化学式:O2(氧气)、N2(氮气)、H2(氢气) F2(氟气)、Cl2(氯气)、Br2(液态溴) 多原子分子单质化学式:臭氧O3等 (3)化合物化学式的读写:先读的后写,后写的先读 ①两种元素组成的化合物:读成“某化某”,如:MgO(氧化镁)、NaCl(氯化钠) ②酸根与金属元素组成的化合物:读成“某酸某”,如:KMnO4(高锰酸钾)、K2MnO4(锰酸钾)
高中有机化学基础知识点归纳小结 一、重要的物理性质 1.有机物的溶解性 (1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。 (2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。(它们都能与水形成氢键)。 二、重要的反应 1.能使溴水(Br2/H2O)褪色的物质 (1)有机物①通过加成反应使之褪色:含有、—C≡C—的不饱和化合物 ②通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀。 ③通过氧化反应使之褪色:含有—CHO(醛基)的有机物(有水参加反应)注意:纯净的只含有—CHO (醛基)的有机物不能使溴的四氯化碳溶液褪色 ④通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯 (2)无机物①通过与碱发生歧化反应3Br2 + 6OH- == 5Br- + BrO3- + 3H2O或Br2 + 2OH- == Br- + BrO- + H2O ②与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、I-、Fe2+ 2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质 1)有机物:含有、—C≡C—、—OH(较慢)、—CHO的物质苯环相连的侧链碳上有氢原子的苯的同系物(但苯不反应) 2)无机物:与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、Br-、I-、Fe2+ 3.与Na反应的有机物:含有—OH、—COOH的有机物 与NaOH反应的有机物:常温下,易与含有酚羟基 ...、—COOH的有机物反应 加热时,能与卤代烃、酯反应(取代反应) 与Na2CO3反应的有机物:含有酚.羟基的有机物反应生成酚钠和NaHCO3; 含有—COOH的有机物反应生成羧酸钠,并放出CO2气体; 含有—SO3H的有机物反应生成磺酸钠并放出CO2气体。 与NaHCO3反应的有机物:含有—COOH、—SO3H的有机物反应生成羧酸钠、磺酸钠并放出等物质的量的CO2气体。4.既能与强酸,又能与强碱反应的物质 (1)2Al + 6H+ == 2 Al3+ + 3H2↑2Al + 2OH- + 2H2O == 2 AlO2- + 3H2↑ (2)Al2O3 + 6H+ == 2 Al3+ + 3H2O Al2O3 + 2OH-== 2 AlO2- + H2O (3)Al(OH)3 + 3H+ == Al3+ + 3H2O Al(OH)3 + OH-== AlO2- + 2H2O (4)弱酸的酸式盐,如NaHCO3、NaHS等等 NaHCO3 + HCl == NaCl + CO2↑ + H2O NaHCO3 + NaOH == Na2CO3 + H2O NaHS + HCl == NaCl + H2S↑NaHS + NaOH == Na2S + H2O (5)弱酸弱碱盐,如CH3COONH4、(NH4)2S等等 2CH3COONH4 + H2SO4 == (NH4)2SO4 + 2CH3COOH CH3COONH4 + NaOH == CH3COONa + NH3↑+ H2O (NH4)2S + H2SO4 == (NH4)2SO4 + H2S↑ (NH4)2S +2NaOH == Na2S + 2NH3↑+ 2H2O (6)氨基酸,如甘氨酸等 H2NCH2COOH + HCl → HOOCCH2NH3Cl H2NCH2COOH + NaOH → H2NCH2COONa + H2O
第四章电化学基础 第一节原电池 原电池: 1、概念:化学能转化为电能的装置叫做原电池。 2、组成条件:①两个活泼性不同的电极②电解质溶液③电极用导线相连并插入电解液构成闭合回路 3、电子流向:外电路:负极——导线——正极 内电路:盐桥中阴离子移向负极的电解质溶液,盐桥中阳离子移向正极的电解质溶液。 4、电极反应:以锌铜原电池为例: 负极:氧化反应: Zn-2e=Zn2+(较活泼金属) 正极:还原反应: 2H++2e=H2↑(较不活泼金属) 总反应式: Zn+2H+=Zn2++H2↑ 5、正、负极的判断: (1)从电极材料:一般较活泼金属为负极;或金属为负极,非金属为正极。 (2)从电子的流动方向负极流入正极 (3)从电流方向正极流入负极 (4)根据电解质溶液内离子的移动方向阳离子流向正极,阴离子流向负极 (5)根据实验现象①__溶解的一极为负极②增重或有气泡一极为正极 第二节化学电池 1、电池的分类:化学电池、太阳能电池、原子能电池 2、化学电池:借助于化学能直接转变为电能的装置 3、化学电池的分类:一次电池、二次电池、燃料电池 一、一次电池 1、常见一次电池:碱性锌锰电池、锌银电池、锂电池等 二、二次电池 1、二次电池:放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池。
2、电极反应:铅蓄电池 放电:负极(铅): Pb +SO 42--2e ? =PbSO 4↓ 正极(氧化铅): PbO 2+4H + +SO 42-+2e ? =PbSO 4↓+2H 2O 充电:阴极: PbSO 4+2H 2O -2e ? =PbO 2+4H + +SO 42- 阳极: PbSO 4+2e ? =Pb +SO 42- 两式可以写成一个可逆反应: PbO 2+Pb +2H 2SO 4 2PbSO 4↓+2H 2O 3、目前已开发出新型蓄电池:银锌电池、镉镍电池、氢镍电池、锂离子电池、聚合物锂离子电池 三、燃料电池 1、燃料电池: 是使燃料与氧化剂反应直接产生电流的一种原电池 2、电极反应:一般燃料电池发生的电化学反应的最终产物与燃烧产物相同,可根据燃烧反应写出总的电池反应,但不注明反应的条件。,负极发生氧化反应,正极发生还原反应,不过要注意一般电解质溶液要参与电极反应。以氢氧燃料电池为例,铂为正、负极,介质分为酸性、碱性和中性。 当电解质溶液呈酸性时: 负极:2H 2-4e - =4H + 正极:O 2+4e - +4H + =2H 2O 当电解质溶液呈碱性时: 负极: 2H 2+4OH --4e -=4H 2O 正极:O 2+2H 2O +4 e - =4OH ? 另一种燃料电池是用金属铂片插入KOH 溶液作电极,又在两极上分别通甲烷?燃料?和氧气?氧化剂?。电极反应式为: 负极:CH 4+10OH - -8e -? = +7H 2O ; 正极:4H 2O +2O 2+8e? =8OH?。 电池总反应式为:CH 4+2O 2+2KOH =K 2CO 3+3H 2O 3、燃料电池的优点:能量转换率高、废弃物少、运行噪音低 四、废弃电池的处理:回收利用 放电 充电
九年级化学知识点汇总 (空气,氧气) 1、空气中氧气含量的测定:实验现象:①红磷(不能用木炭、硫磺、铁丝等代替)燃烧时有大量白烟生成,②同时钟罩内水面逐渐上升,冷却后,水面上升约1/5体积。若测得水面上升小于1/5体积的原因可能是:①红磷不足,氧气没有全部消耗完②装置漏气③没有冷却到室温就打开弹簧夹。 2、法国化学家拉瓦锡提出了空气主要是由氧气和氮气组成的。 3、空气的成分按体积分数计算,大约是氮气为、氧气为、稀有气体(混 合物)为、二氧化碳为、其它气体和杂质为0.03%。空气的成分以氮气和氧气为主,属于混合物。 4、排放到大气中的有害物质,大致可分为粉尘和气体两类,气体污染物较多是SO2、 CO、NO2,这些气体主要来自矿物燃料的燃烧和工厂的废气。 5、燃烧:可燃物跟空气中的氧气发生的一种发光发热的剧烈的氧化反应。 燃烧的条件是:(1) 与氧气接触(3) 温度达到着火点 灭火的方法:①隔绝空气②温度降低到着火点以下 相同点是:都属于氧化反应,都放出热量。 6、氧气是无色无味,密度比空气略大,不易溶于水,液氧是淡蓝色的。 氧气是一种比较活泼的气体,具有氧化性、助燃性,是一种常用的氧化剂。氧气的用途:①支持燃烧②供给呼吸 氧气的化学性质 ①(黑色)C和O2反应的现象是:在氧气中比在空气中更旺,发出白光。 化学方程式为: ②(淡黄色)S和O2反应的现象是:在空气中火焰,在氧气中的火焰,生成气味的气体SO2。化学方程式为: ③(红色或白色)P和O2反应的现象是:产生大量,(用于发令枪)化学方程式为: ④(银白色)Mg和O2反应的现象是:放出大量的热,同时发出耀眼的光,生成一种白色固体氧化镁。(用于照明弹等)化学方程式为: ⑤(银白色)Fe和O2反应的现象是:剧烈燃烧,火星四射,生成黑色固体Fe3O4,注意点:预先放入少量水或一层沙,防止高温熔化物溅落使集气瓶底部炸裂。 化学方程式为: ⑥氢气的燃烧:发出淡蓝色的火焰。方程式:________________________ ⑦一氧化碳的燃烧:发出蓝色的火焰。方程式:_________________________⑧甲烷的燃烧:发出明亮的蓝色火焰。方程式:____________________ ⑨酒精的燃烧 (水) 1、水在地球上分布很广,江河、湖泊和海洋约占地球表面积的3/4,人体含水约占人体质量的2/3。淡水资源却不充裕,地面淡水量还不到总水量的1%而且分布很不均匀。 2、水的污染来自于①工厂生产中的废渣、废水、废气,②生活污水的任意排放,③农业生产中施用的农药、化肥随雨水流入河中。 3、预防和消除对水源的污染,需采取的措施:①加强对水质的监测,②工业“三废”要经过处理后再排放,③农业上要合理(不是禁止)使用化肥和农药等。 4、电解水实验可证明:水是由氢元素和氧元素组成的;在化学变化中,分子可以分 成原子,而原子却不能再分。写出方程式:_________________________ 5、电解水中正极产生,负极产生,体积比(分子个数比)为,质 量比为,在实验中常加稀H2SO4和NaOH来增强水的导电性。电解水的化学方程式为: 6、硬水指的是含有较多的和的水,我们可以使用肥皂水来区分 硬水和软水,泡沫较多的是软水,泡沫较少的是硬水。 (碳和碳的氧化物) 1、常见的碳的单质有和,以及C60 。金刚石很坚硬;石墨很软,所以可以做铅笔芯,石墨具有,可以做电极,石墨很滑腻,所以可以做高温润滑剂。金刚石和石墨的物理性质有很大差异的原因是:____________________________ 活性炭和木炭具有很强的__________能力,因此可以用来除去异味和吸附色素。 化学性质:在常温下碳的化学性质__________ ①可燃性:木炭在氧气中燃烧。 当氧气充足时,其反应方程式为:__________________________________ 当氧气不充足时,其反应方程式为:________________________________ ②还原性:木炭高温下还原氧化铜反应方程式为____________________ 现象:黑色粉末变红,产生使石灰水变浑浊的气体 木炭高温下还原氧化铁,反应方程式为_____________________________ 高温条件下碳还原二氧化碳生成一氧化碳___________________________ 2、二氧化碳的物理性质:能溶于水,密度比空气的大。加压降温易变为固体“干冰”用途:灭火,温室里作肥料,干冰用于致冷和人工降雨,化工原料 化学性质:(1)通常情况下,CO不支持燃烧,也不能燃烧。 (2)跟水反应:二氧化碳通入水中生成碳酸CO2+H2O=H2CO3