
配合物
配合物一般可分为内界和外界两个组成部分。中心离子和配位体组成配合物的内界,在配合物的化学式中一般用方括号表示内界,方括号以外的部分为外界。
如果在硫酸铜溶液中加入氨水,首先可得到浅蓝色碱式硫酸铜[Cu(OH)2]SO4沉淀,继续加入氨水,则沉淀溶解而得到深蓝色溶液。这是因为加入过量的氨水,NH3分子与Cu2+生成了深蓝色的复杂离子[Cu(NH3)4]2+。
配位数中心离子
2 Ag+,Cu+,Au+
4 Zn2+,Cu2+,Hg2+,Ni2+,Co2+,Pt2+,Pd2+,Si4+,Ba2+
6 Fe2+,Fe3+,Co2+,Co3+,Cr3+,Pt4+,Pd4+,Al3+,Si4+,Ca2+
8(少)Mo4+,W4+,Ca2+,Ba2+,Pb2+
配位键理论又叫配价键理论,其基本要点可归纳为三点:
1.中心离子和配位原子间是以配价键结合的,具有孤对电子的配位原子提供电子对,填入中心离子的外层空轨道形成配位键。
2.中心离子所提供的空轨道在与配位原子成键时必须经杂化,形成数目相等的杂化轨道。这些杂化轨道的能量相同,而且有一定的方向性。它们分别和配位原子的孤对电子轨道在一定方向上彼此接近,发生最大的重叠而形成配位键,这样就形成了各种不同的配位数和不同构型的配合物。
3.中心离子的空轨道杂化时,若有次外层d轨道参加,则形成的配合物属内轨型;若均为最外层轨道参加杂化,则形成的配合物属外轨型。内轨型配合物的配位键更具有共价键性质所以叫共价配键,外轨型配合物的配位键更具有离子键性质所以叫电价配键,但本质上两者均属共价键范畴。
价键理论认为,配合物中心离子和配体之间的化学键有电价配键和共价配键两种,因而配合物也可以分为电价配合物(外轨型)和共价配合物(内轨型)。在电价配合物中,中心离子是依靠库仑静电引力与配位体相结合。这样的结合不影响中心离子的电子层结构。在共价配合物中配位体的孤对电子与中心原子(或离子)空的价电子轨道形成共价σ配键。当中心离子为过渡元素(过渡元素的主要特点是它们的3d、4d、5d轨道都是未充满电子)时,在形成共价配合物时为了空出d轨道以尽可能多形成配键,d电子就被挤到较少轨道中自旋配对。
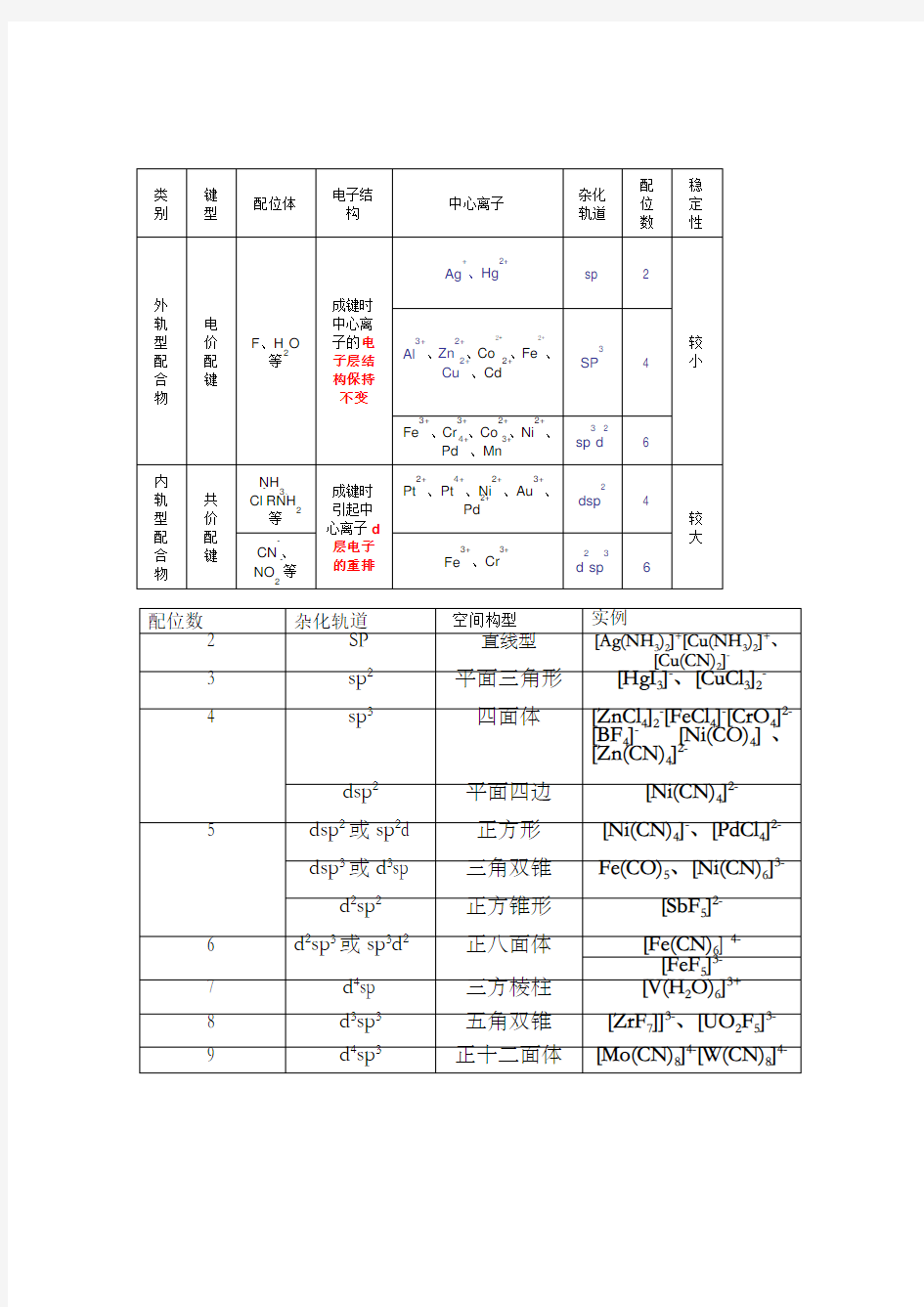
高中化学奥林匹克竞赛辅导 配合物(配位化合物)化学基础 【竞赛要求】 配位键。常见的配合物的中心离子(原子)和常见的配体(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。螯合物及螯合效应。常见的络合剂及常见的配合反应。定性说明配合反应与酸碱反应、沉淀反应、氧化还原反应的联系。配合物几何构型和异构现象的基本概念。配合物的杂化轨道理论。八面体配合物的晶体场理论。Ti(H2O)6的颜色。路易斯酸碱的概念。 1.配合物:由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子 络合物。如[Co(NH3)6]3+、[Cr(CN)6]3–、Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。判断物质是配合物的关键在于物质是否含有配位单元。配合物和复盐的区别:前者一定含有配位键,后者没有配位键,如KCl·MgCl2·6H2O是复盐,不是配合物。 2.配合物的组成: 为外界,内外界(1)配合物的内界和外界:以[Cu(NH3)4]SO4为例,[Cu(NH3)4]2+为内界,SO-2 4 之间是完全电离的。内界是配位单元,外界是简单离子。又如K3[Cr(CN)6]之中,内界是[Cr(CN)6]3–,外界是K+。配合物可以无外界,但不能没有内界,如Ni(CO)4。 (2)中心离子(原子)和配位体: a.中心离子(原子):又称配合物的形成体或中心体,多为过渡金属离子,如Fe3+、Fe2+、Co2+、Ni2+、Cu2+,也有电中性的原子为配合物的中心原子,如Ni(CO)4、Fe(CO)5中的Ni和Fe都是电中性的原子。只要能提供接纳孤对电子的空轨道的离子或原子均可作中心体。 b.配位体:含有孤对电子的阴离子或分子。如NH3、Cl—、CN—等。配位体中直接同中心原子配合的原子,叫做配位原子。如[Cu(NH3)4]2+配阳离子中,NH3是配位体,其中N原于是配位原子。配位原子经常是含有孤对电子的原子。 (3)配位原子和配位数:配体中给出孤对电子与中心体直接形成配位键的原子,叫配位原子。配位单元中,中心体周围与中心体直接形成配位键的配位原子的个数,叫配位数。中心离子的配位数一般为2、4、6、8(配位数为8的较少见),如在[Pt(NH3)6]C14中,配位数为6,配位原子为NH3分子中的6个氮原子。一般说来,配位数大多是中心体电荷数的两倍,如Cu+、Ag+、Au+的配位数均为2,Cu2+、Zn2+的配位数均为4,Fe3+、Cr3+的配位数均为6,但也有例外。配位数与中心体和配体的性质有关:若中心离子的电荷高,半径大,则利于高配位;而配体的电荷高,半径大,则利于低配位。
高中化学竞赛专题练习 配位化合物 1、画出下列配合物可能有的旋光异构体的结构。 (1)[FeCl2(C2O4)en] ;(2) [Co(C2O4)3]3-;(3)[Co(en)2Cl2]+。 2、一些顺式铂的配合物可以作为活性抗癌药剂,如cis-PtCl4(NH3)2、cis-PtCl2(NH3)2、 cis-PtCl2(en)等。实验测得它们都是反磁性物质,试用杂化轨道理论说明它们的成键情况,指出它们是内轨型配合物还是外轨型配合物。 3、已知下列配合物的磁矩,根据价键理论指出各中心离子的价层电子排布、轨道杂化类型、 配离子空间构型,并指出配合物属内轨型还是外轨型。 (1) Mn(CN)63-(μ=2.8 B.M); (2) Co(H2O)62+(μ=3.88 B.M); 4、实验测得配离子Co(NH3)63+是反磁性的,问它属于什么几何构型?根据价键理论判断中心 离子采取什么杂化状态? 5、通过计算说明,在标准状况下金难溶于水,但用氰化钠溶液却可以浸取金矿砂中的金。 已知E°(Au+/Au)=1.69V,E°(O2/OH-)=0.401V,K稳°[Au(CN)2-]=2×1038 6、已知E°(Fe3+/Fe2+)=0.771V,E°(I2/I-)=0.535V,在标准状况下Fe3+可以将I-氧化为单 质I2。通过计算说明在标准状况下,下列反应能否自发进行? 2Fe(CN)63-+2I-=Fe(CN)64-+I2 已知K稳°(Fe(CN)63-)=1.0×1042,K稳°(Fe(CN)64-)=1.0×1035。 7、已知E°(Fe3+/Fe2+)=0.771V,E°(Sn4+/Sn2+)=0.14V,K稳°(FeF3)=1.15×1012。通过计算说明,下列氧化还原反应在标准状态下能否发生。若能发生写出有关的化学反应方程式。 (1)向FeCl3溶液中加入NaF,然后再加SnCl2; (2)向Fe(SCN)3溶液中加入SnCl2(K稳°(Fe(SCN)3)=4.4×105); (3)向Fe(SCN)3溶液中加入KI(E°(I2/I-)=0.535V)。 8、某Ⅷ族不活泼金属A溶于足量的王水生成B的溶液(A的含量为47.60%);将SO2通入B 的溶液中,得到C的溶液(A的含量为57.56%)。已知B、C的组成元素完全相同,且阴离子所带电荷也相同。 (1)通过计算推理,确定A的元素符号; (2)写出所涉及反应的化学方程式。 (3)画出B、C阴离子的空间构型。 9、铝与三乙胺形成的单核配合物是电中性分子,实验测得其氢的质量分数为14.32%,画出 它的立体结构,指出中心原子的氧化态和杂化类型。要给出推理过程。 10、将2,2-联吡啶,冰醋酸和过氧化氢的混合物在75℃时水浴加热3小时后,析出细小的 针状晶体A。A可作为配体与许多过渡金属生成配合物,如与铬形成红紫色配合物B:CrA x Cl y(ClO4)z·H2O,元素分析结果如下:Cr 8.43%、C 38.95%、H 2.94%、Cl 17.25%、N 9.08%、O 23.35%。 (1)若A是双齿配体,易配位形成七元环,写出A的结构式。 (2)确定B的化学式,并计算该化合物的磁矩。 (3)写出B中的配离子所有可能的结构式。
2019-2020年高中化学 2.3.2离子键、配位键与金属键教案鲁教版选修3【教学目标】 1.使学生了解简单配位键的概念及形成实质和配位化合物在生物、化学等领域的广泛应用。 2.配位键的形成条件及简单配位键形成表示 【教学重点】配位键的实质。 【教学难点】配位键的实质。 【教师具备】制作课件、准备实验。 【教学方法】交流研讨、引导探究 【教学过程】 【新课引入】 通过化学必修课程和上一节的学习,你对化学键尤其是共价键和离子键有了一定的了解。那么,除了共价键和离子键,原子之间还有其他的结合方式吗? 【提出问题】实验证明,氨分子能与H+反应生成铵离子(NH4+),其反应可用NH3+ H+= NH4+表示,那么,氨作为一个分子是怎样与H+结合的呢? 实用文档
【学生】学生可以想到NH3分子与H+的结合与我们学习过的共价键、离子键有所不同,可以用电子式写出NH4+的形成。 【讲述】铵离子(NH4+)的形成过程:氨分子中氮原子的2P轨道上有一对没有与其他原子共用的电子,这对电子称为孤对电子,氢离子上具有1S空轨道。在氨分子与氢原子作用时,氨分子的孤对电子进入氢离子的空轨道,与氢共用形成配位键。配位键用“→”表示,箭头指向电子对的接受体。 【展示课件】NH3与H+的形成过程。 【板书】二、配位键: 1. 配位键的含义:是一种特殊的共价键,它是由一个原子单方面提供一对电子与另一个有空轨道的原子(或离子)共用而形成的共价键,称配位共价键,简称配位键。 【活动探究】那么,配位键的形成条件是什么? 【板书】2. 配位键的形成条件 【学生总结】凡一方有空轨道,另一方有未共用电子对的两者就可形成配位键。 进一步得出配位键中提供电子对的原子称电子的给予体;接受电子对的原子称电子对的接受体。让学生回忆配位键的形成过程,总结出配位键的形成条件 【思考】配位键与共价键有何区别? 实用文档
§16-2 配位化合物的同分异构现象 The Isomerism of Complexes 一、总论: 1.Definition:凡是化学组成相同的若干配合物,因原子间的连接方式或空间排列方式的不同而引起的结构和性质不同的现象,称为配合物的同分异构现象(isomerism)。 2.Classification (1) 化学结构异构现象(chemical structure isomerism):化学组成相同,原 子间的连接方式不同而引起的异构现象,称为化学结构异构现象。例如: [Co(NH3)5(NO2)]2+和 [Co(NH3)5(ONO)]2+ (2) 立体异构现象(stereo isomerism):化学组成相同,空间排列不同而引起 的异构现象,称为立体异构现象。例如:Pt(NH3)2Cl2
cis – 二氯·二氨合铂(II) trans - 二氯·二氨合铂(II) 二、化学结构异构现象,大致分为五类: Ionization isomerism, Hydrate isomerism, Linkage isomerism, Coordination isomerism, Polymerization isomerism. 1.Ionization isomerism (1) Two coordination compounds which differ in the distribution of ions between those directly coordinated and counter-ions present in the crystal lattice are called ionization isomers. (2) e.g. [Cr(NH 3)5Br]SO 4 and [Cr(NH 3)5SO 4]Br 2.Hydrate isomerism (Solvent isomerism) (1) Hydrate isomerism is similar to ionization isomerism except that an uncharged ligand changes from being coordinated to a free-lattice position whilst another ligand moves in the opposite sense. (2) e.g. [Cr(H 2O)6]Cl 3 ,[Cr(H 2O)5Cl]Cl 2·H 2O ,[Cr(H 2O)4Cl 2]Cl ·2H 2O 3.Linkage isomerism (1) The first example of this type of isomerism was provided by J φrgensen, W erner’s contemporary. His method of preparation was as follows : A"solution "Cl]Cl )[Co(NH 23N aN O H Cl N H 253???→???→???→? red Co(ONO)]Cl )[(NH A"solution "253cold in stand let ?????→? yellow )]Cl Co(NO )[(NH A"solution "2253H Cl conc heat ???→???→?? (2) It deals with a few ligands (ambidenatate) that are capable of bonding through are type of donor atom in one situation not a different atom in another complex. Some authors refer to this type of isomerism as “structura l i somerism” but inasmuch as all isomerism is basically “structural” , the term linkage isomerism is preferable. (3) e.g. +252SCN]O)[Cr(H and +252NCS]O)Cr(H [ +]SSO )Co(NH [353 and +S]OSO )[Co(NH 253 4.Coordination isomerism (1) This may occur only when the cation and anion of a salt are both complexes, the two isomers differing in the distribution of ligands between the cation and anion (2) e.g. ]Cr(Ox)][)Co(NH [363 and ]][Co(Ox))[Cr(NH 363 ] ][Cr(SCN))[Cr(NH 663 and ](SCN))][Cr(NH (SCN))[Cr(NH 423243 ]PtCl ][)[Pt(NH 643 and ]][PtCl Cl )[Pt(NH 4243
高中化学配合物 TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-
配合物 配合物一般可分为内界和外界两个组成部分。中心离子和配位体组成配合物的内界,在配合物的化学式中一般用方括号表示内界,方括号以外的部分为外界。 如果在硫酸铜溶液中加入氨水,首先可得到浅蓝色碱式硫酸铜[Cu(OH) 2]SO 4 沉 淀,继续加入氨水,则沉淀溶解而得到深蓝色溶液。这是因为加入过量的氨 2+2+ 配位键理论又叫配价键理论,其基本要点可归纳为三点: 1.中心离子和配位原子间是以配价键结合的,具有孤对电子的配位原子提供电子对,填入中心离子的外层空轨道形成配位键。 2.中心离子所提供的空轨道在与配位原子成键时必须经杂化,形成数目相等的杂化轨道。这些杂化轨道的能量相同,而且有一定的方向性。它们分别和配位原子的孤对电子轨道在一定方向上彼此接近,发生最大的重叠而形成配位键,这样就形成了各种不同的配位数和不同构型的配合物。 3.中心离子的空轨道杂化时,若有次外层d轨道参加,则形成的配合物属内轨型;若均为最外层轨道参加杂化,则形成的配合物属外轨型。内轨型配合物的配位键更具有共价键性质所以叫共价配键,外轨型配合物的配位键更具有离子键性质所以叫电价配键,但本质上两者均属共价键范畴。 价键理论认为,配合物中心离子和配体之间的化学键有电价配键和共价配键两种,因而配合物也可以分为电价配合物(外轨型)和共价配合物(内轨型)。在电价配合物中,中心离子是依靠库仑静电引力与配位体相结合。这样的结合不影响中心离子的电子层结构。在共价配合物中配位体的孤对电子与中心原子(或离子)空的价电子轨道形成共价σ配键。当中心离子为过渡元素(过渡元素的主要特点是它们的3d、4d、5d轨道都是未充满电子)时,在形成共价配合物时为了
高中化学奥林匹克竞赛辅导讲座 第9讲络合物(配位化合物)化学基础 【竞赛要求】 配位键。重要而常见的配合物的中心离子(原子)和重要而常见的配位(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。螯合物及螯合效应。重要而常见的络合剂及其重要而常见的配合反应。配合反应与酸碱反应、沉淀反应、氧化还原反应的联系(定性说明)。配合物几何构型和异构现 的颜色。路易斯酸碱的概念。象基本概念。配合物的杂化轨道理论。八面体配合物的晶体场理论。Ti(H2O)+3 6 【知识梳理】 一、配合物基本知识 1、配合物的定义 由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元。凡是含有配位单元的化合物都称作配位化合物,简称配合物,也叫络合物。 [Co(NH3)6]3+,[Cr(CN)6]3–,Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。 [Co(NH3)6]Cl3、K3[Cr(CN)6]、Ni(CO)4都是配位化合物。[Co(NH3)6]、[Cr(CN)6] 也是配位化合物。判断的关键在于是否含有配位单元。 思考:下列化合物中哪个是配合物 ①CuSO4·5H2O②K2P t Cl6 ③KCl·CuCl2 ④Cu(NH2CH2COO)2 ⑤KCl·MgCl2·6H2O ⑥Cu(CH3COO)2 注意:①配合物和配离子的区别 ②配合物和复盐的区别 2、配合物的组成 中心离子 内界单齿配体 配位体多齿配体 配合物螯合配体 外界 (1)配合物的内界和外界 以[Cu(NH3)4]SO4为例: [Cu(NH3)4]2+ SO-2 4 内界外界 内界是配位单元,外界是简单离子。又如K3[Cr(CN)6] 之中,内界是[Cr(CN)6]3–,外界是K+。可以无外界,如Ni(CO)4。但不能没有内界,内外界之间是完全电离的。 (2)中心离子和配位体 中心离子:又称配合物的形成体,多为金属(过渡金属)离子,也可以是原子。如Fe3+、Fe2+、Co2+、Ni2+、Cu2+、Co等,只要能提供接纳孤对电子的空轨道即可。 配位体:含有孤对电子的阴离子或分子。如NH3、H2O、Cl-、Br-、I-、CN-、CNS-等。
《配位化合物》作业参考解析 1. 下列说法正确的是 A. 配合物的内界和外界之间主要以共价键相结合 B. 中心原子与配体之间形成配位键 C. 配合物的中心原子都是阳离子 D. 螯合物中不含有离子键 【B】A、D:一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C:中心原子可以是阳离子,也可以是中性原子,例如[Ni(CO)4];B:中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。 2. 下列配合物命名不正确的是 A. [Co(H2O)(NH3)3Cl2]Cl 氯化二氯·三氨·一水合钴(Ⅲ) B. [Cr(NH3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ) C. K[Co(NO2)3Cl3] 三硝基·三氯合钴(Ⅲ)酸钾 D. H2[PtCl6] 六氯合铂(Ⅳ)酸 【C】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。对于C中的配合物而言,NO2-以N原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的先后顺序,Cl-离子在前,NO2-离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。 3. 下列配离子具有正方形或者八面体形结构,其中CO32-最有可能作为双齿配体的是 A. [Co(NH3)4(CO3)]+ B. [Co(NH3)5(CO3)]+ C. [Pt(en)(NH3)(CO3)] D. [Pt(en)2(NH3)(CO3)]2+ 【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体结构时,配位数为6,形成6个配位键。B:[Co(NH3)5(CO3)]+ 配离子中,已有5个氨作为配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO32-离子只能是单齿配体,这样就形成了6个配位键;C:[Pt(en)(NH3)(CO3)] 配合物中,乙二胺(en)为双齿配体,形成2个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了4个配位键;D:[Pt(en)2(NH3)(CO3)]2+ 配离子中,乙二胺(en)为双齿配体,2个en形成4个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了6个配位键;A:[Co(NH3)4(CO3)]+ 配离子中有4个氨为配体,形成4个配位键,因此CO32-离子必须是双齿配体,这样就形成了4个配位键,如果CO32-离子是单齿配体,那么配离子的配位数为5,这与题意不符。 4. 下列分子或者离子的中心原子发生了dsp2杂化的是 A. BF3 B. [Zn(NH3)4]2+ (μ = 0 ) C. [Ni(CN)4]2-(μ = 0 ) D. 【C】A:BF3分子为正三角形,中心原子B发生sp2杂化;[Zn(NH3)4]2+ (μ = 0 )的配位数为4,中心原子提供4个杂化空轨道,由于Zn2+离子的价层电子排布为3d10,d轨道已经全部排满电子,因此只会发生sp3杂化,形成四个杂化轨道;D:NH4+离子是正面体结构,因此中心原子N原子发生了sp3杂化;C:[Ni(CN)4]2-(μ = 0 )的配位数为4,中心原子提供4个杂
2011-2012学年鲁教版化学必修1同步练习 第二章第二节电解质 一. 教学内容: 第二章第二节电解质 二. 教学目的 1、了解电离、电解质、离子反应、离子方程式的含义 2、知道酸、碱、盐发生电离 3、通过实验事实认识离子反应及其发生条件能正确书写常见反应的离子方程式 4、了解常见离子的检验方法 三. 教学重点、难点 1、电解质的概念 2、通过实验事实认识离子反应及其发生条件,能正确书写常见反应的离子方程式 四. 知识分析 (一)电解质的电离 、金属导电:含有自由移动的电子 b、化合物(熔融或水溶液):含有自由移动的离子 1、电离: (1)定义:一些物质溶解于水或受热熔化而离解成自由移动离子的过程。 (2)条件:溶于水或熔化 2、电离方程式:用符号来表示电离过程的式子,叫电离方程式。 练习:写出电离方程式 H2SO4=2H++SO42-B a(O H)2=Ba2++2OH- Fe2(SO4)3=2Fe3++3SO42-(NH4)2CO3=2NH4++CO32- 3、酸:电离出的阳离子全部是H+的化合物叫做酸 碱:电离出的阴离子全部是OH-的化合物叫做碱 盐:电离时,生成金属离子(或铵根离子)和酸根离子的化合物。 4、电解质与非电解质:
a、写出CH3COOH、H2CO3的电离方程式(多元弱酸分步电离): CH3COOH?CH3COO-+H+ H2CO3?HCO3-+H+HCO3-?H++CO32- b、写出NH3?H2O、Fe(OH)3的电离方程式: NH3?H2O?NH4++OH-Fe(OH)3?Fe3++3OH- 练一练: (1)下列物质中属于强电解质的是(),弱电解质的是(),非电解质的是() A、KI B、乙醇 C、氨水 D、蔗糖 E、HClO F、硫酸氢钠 G、NH3?H2O H、液氯 I、CO2 J、硝酸 K、Na2O (2)下列电离方程式错误的是() A、Al2(SO4)3=2Al3++3SO42- B、NH3?H2O =NH4++OH- C、NaHCO3=Na++HCO32- D、H2SO4=2H++SO42- (3)下列叙述正确的是() A、NaCl在电流的作用下电离出Na+、Cl— B、溶于水后电离出H+的化合物是酸 C、HCl溶于水能导电,但液态HCl不导电 D、导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里的自由移动的离子数目多 (4)把0.05mol的NaOH固体分别加入下列100ml溶液中,溶液的导电能力变化不大的是() A、自来水 B、0.5mol/L盐酸 C、0.5mol/L醋酸 D、0.5mol/LNH4Cl溶液 答案:(1)AFJK;GE;BDI (2)C (3)C (4)BD 小结: 1、电解质必须是本身电离出离子 2、常见的强电解质: 强酸:HCl HNO3H2SO4 强碱:NaOH KOH Ca(OH)2Ba(OH)2 盐:NaCl K2SO4KClO3 FeCl3 金属氧化物:CaO Na2O 常见的弱电解质: 弱酸:CH3COOH H2CO3HClO 弱碱:NH3?H2O H2O
1、配位化合物 (1)概念:金属离子或原子与某些分子或离子以配位键结合而形成的化合物称为配位化合物,简称配合物。 作为电子对接受体的金属离子或原子称为中心离子(原子),又称配合物的形成体,作为电子对给予体的分子或离子称为配体。 [Cu(H2O)4]2+的空间结构为平面正方形。 (2)配合物的结构 [Cu(NH3)4]SO4为例说明。 注意:离子型配合物是由内界和外界组成,内界由中心离子和配体组成。 (3)配合物的命名: 例如:[Cu(NH3)4]SO4硫酸四氨合铜 练习:对下列配合物进行命名 [Cu(NH3)4]Cl2K3[Fe(SCN)6] Na3[AlF6] 3、几种常见的配合物 实验:硫酸四氨合铜的制备。 现象:向CuSO4溶液中加入氨水,生成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液。再加入乙醇,析出深蓝色的晶体。 有关反应的离子方程式为:Cu2++2NH3·H2O=Cu(OH)2↓+2OH- Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- 蓝色沉淀深蓝色溶液 在[Cu(NH3)4]2+里,中心离子是Cu2+,配体是NH3,NH3分子的氮原子给出孤电子对,以配位键形成了[Cu(NH3)4]2+: [Cu(NH3)4]2+的空间结构为平面正方形。 实验:硫氰化铁的制备。向氯化铁溶液中滴加硫氰化钾溶液。 现象:形成血红色溶液。有关反应的化学方程式为:FeCl3+3KSCN=Fe(SCN)3+3KCl
Fe(SCN)3呈血红色,它是一种配合物。上述实验可用于鉴定溶液中存在Fe3+。 呈血红色的是一系列配合物:Fe(SCN)2+、Fe(SCN)2+、Fe(SCN)3、Fe(SCN)4-、Fe(SCN)52-、Fe(SCN)63-,配位数从1~6。 注意:配位键的强度有大有小,因而有的配合物很稳定,有的不很稳定。许多过渡金属离子对多种配体具有很强的结合力,因而,过渡金属配合物远比主族金属配合物多。 [随堂练习] 1.铵根离子中存在的化学键类型按离子键、共价键和配位键分类,应含有() A.离子键和共价键B.离子键和配位键 C.配位键和共价键D.离子键答案:C 2.下列属于配合物的是() A.NH4Cl B.Na2CO3·10H2O C.CuSO4·5H2O D.Co(NH3)6Cl3 答案:CD 3.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是() ①H2O ②NH3③F-④CN-⑤CO A.①②B.①②③ C.①②④D.①②③④⑤答案:D 4.配合物在许多方面有着广泛的应用。下列叙述不正确的是() A.以Mg2+为中心的大环配合物叶绿素能催化光合作用 B.Fe2+的卟啉配合物是输送O2的血红素 C.[Ag(NH3)2]+是化学镀银的有效成分 D.向溶液中逐滴加入氨水,可除去硫酸锌溶液中的Cu2+ 答案:D 5.下列微粒:①H3O+②NH4+③CH3COO-④NH3⑤CH4中含有配位键的是() A.①②B.①③ C.④⑤D.②④答案:A 6.下列不属于配位化合物的是() A.六氟和铝酸钠B.氢氧化二氨合银(银氨溶液)C.六氰合铁酸钾D.十二水硫酸铝钾答案:D 7.指出配合物K2[Cu(CN)4]的配离子、中心离子、配位体、配位数及配位原子。 8.亚硝酸根NO2-作为配体,有两种方式。其一是氮原子提供孤对电子与中心原子配位;另一是氧原子提供孤对电子与中心原子配位。前者称为硝基,后者称为亚硝酸根。 [Co(NH3)5NO2]Cl2就有两种存在形式,试画出这两种形式的配离子的结构式。
第2课时配位键 1.了解简单配位键的概念及形成实质和配位化合物在生物、化学等领域的广泛应用。 2.知道配位键的形成条件及简单配位键的形成表示。 一、配位键的含义 氨分子中,氮原子的三个未成对电子分别与一个氢原子的电子配对形成共价键,氮原子上还存在未成键的①孤对电子,形成铵根离子时,氨分子中的②孤对电子所在的轨道将与H+的1s空轨道重叠,使③孤对电子为氮原子、氢原子所共用,从而形成一种新的化学键叫④配位键。N中,4个N—H键性质⑤相同。 二、配位键的形成条件 形成配位键的一方(如A)是能够提供⑥孤对电子的原子,另一方(如B)是具有⑦能够接受孤对电子的空轨道的原子。配位键通常用符号⑧A→B表示。配位键与共价键的差别是形成配位键的共用电子对是由⑨一方提供而不是⑩双方共同提供的。 三、配位化合物 ①向硝酸银溶液中加入氨水,首先形成白色难溶物,继续加入氨水,难溶物溶解,得到一种称为氢氧化 二氨合银的物质,其化学式为[Ag(NH3)2]OH,其中含有的配位键可表示为H3N → Ag+。 ②向硫酸铜溶液中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到一种称为硫酸四氨合 铜的物质,其化学式为[Cu(NH3)4]SO4,其中含有的配位键可表示为H3N → Cu2+。 1.配位键与共价键有什么区别? 【答案】共价键是成键原子分别提供一个电子成键,配位键是配体提供一对电子,受体提供空轨道成键。 2.配位键是电子云重叠形成的吗? 【答案】不是;配位键是孤对电子的电子云与空轨道重叠形成的。 3.为什么过渡金属容易形成配位键? 【答案】因为过渡金属有空轨道。 1.在N中存在4个N—H共价键,则下列说法正确的是( )。
高中化学烃和卤代烃知识点总结 高中化学烃和卤代烃知识点总结大全1.烃的分类 1.基本概念[有机物] 含碳元素的化合物称为有机化合物,简称有机物.说明有机物一定是含有碳元素的化合物(此外,还含有H、O、N、S、P等),但含有碳元素的化合物却不一定是有机物,如CO、CO2、H2CO3、碳酸盐、CaC2等少数物质,它们的组成和性质跟无机物很相近,一般把它们作为无机物.有机物种类繁多的原因是碳原子最外层有4个电子,不仅可与其他原子形成四个共价键,而且碳原子与碳原子之间也能以共价键(碳碳单键、碳碳双键、碳碳叁键)形成含碳原子数不同、分子结构不同的碳链或环状化合物.[烃] 又称为碳氢化合物,指仅由碳和氢两种元素组成的一大类化合物.根据结构的不同,烃可分为烷烃、烯烃、炔烃、芳香烃等.[结构式] 用一根短线代表一对共用电子对,并将分子中各原子用短线连接起来,以表示分子中各原子的连接次序和方式的式子.如甲烷的结构式为:乙烯的结构式为: H-C-H H H H-C=C-H [结构简式] 将有机物分子的结构式中的CC键和CH键省略不写所得的一种简式.如丙烷的结构简式为CH3CH2CH3,乙烯的结构简式为CH2=CH2,苯的结构简式为等.[烷烃] 又称为饱和链烃.指分子中碳原子与碳原子之间都以CC单键(即1个共用电子对)结合成链状,且碳原子剩余的价键全部跟氢原子相结合的一类烃.烷即饱和的意思.CH4、CH3CH3、CH3CH2CH3等都属于烷烃.烷
烃中最简单的是甲烷.[同系物] 结构相似,在分子组成上相差一个或若干个CH2原子团的有机物,互称同系物.说明判断有机物互为同系物的两个要点;①必须结构相似,即必须是同一类物质.例如,碳原子数不同的所有的烷烃(或单烯烃、炔烃、苯的同系物)均互为同系物.由于同系物必须是同一类物质,则同系物一定具有相同的分子式通式,但分子式通式相同的有机物不一定是同系物.由于同系物的结构相似,因此它们的化学性质也相似.②在分子组成上相差一个或若干个CH2原子团.由于同系物在分子组成上相差CH2原子团的倍数,因此同系物的分子式不同.由同系物构成的一系列物质叫做同系列(类似数学上的数列),烷烃、烯烃、炔烃、苯的同系物等各自为一个同系列.在同系列中,分子式呈一定规律变化,可以用一个通式表示.[取代反应] 有机物分子里的原子或原子团被其他原子或原子团所代替的反应,叫做取代反应.根据有机物分子里的原子或原子团被不同的原子或原子团[如-X(卤原子)、-NO2(硝基),-SO3H(磺酸基),等等]所代替,取代反应又分为卤代反应、硝化反应、磺化反应,等等.①卤代反应.如:CH4 + C12 CH3C1 + HCl(反应连续进行,可进一步生成CH2C12、CHCl3、CCl4) (一NO2叫硝基) ②硝化反应.如:③磺化反应.如:(一SO3H叫磺酸基) [同分异构现象与同分异构体] 化合物具有相同的分子式,但具有不同的结构式的现象,叫做同分异构现象.具有同分异构现象的化合物互为同分异构体.说明同分异构体的特点:①分子式相同,相对分子质量相同,分子式的通式相同.但相对分子质量相同的化合
配位键疑难释疑 配位键及配位化合物知识尽管在教材中所占内容不多,但它常常与化学键、轨道杂化及物质性质等内容结合在一起设计问题,因而明晰配位键的本质、存在、形成条件等相关内容具有很重要的意义。 一、配位键与共价键的本质是否相同 原子之间形成共价键时,若共用电子对只是由一方原子提供电子,而非来 自双方原子,这样的共价键就称为配位键,故配位键一定是共价键,也就具有 共价键的特征:方向性与饱和性,所以说配位键与共价键没有本质上的差异。共价键不一定是配位键,关键是看共用电子对的来源是一个成键原子还是两个 成键原子提供的,若是由成键的一个原子单方面提供的则为配位键,若是由成 键双方原子共同提供的则是普通共价键,所以说配位键与共价键只是在形成过 程上有所不同而已。如浓氨水与盐酸反应生成氯化铵,因氨气分子中的 氮原子有一对孤电子,氢离子有空轨道,故H+与氨气通过配位键结合成铵根离 子,尽管铵根离子中4个氮氢键的形成过程不同,但实验证明 这4个氮氢键的性质完全相同,没有任何差异,这也进一步证明配位键与共价 键是没有本质区别的。 二、形成配位键有何条件 配位键是一种特殊的共价键,并不是任意的两个原子相遇就能形成。它要求成键的两个原子中一个原子A有孤对电子,另一个原子B有接受孤对电子的“空轨道”,所以配位键的表示方法为A →B,A称为配体,B称为中心原子或离子。有时为了增强成键能力,中心原子或离子B利用能量相近的空轨道进行杂化后,再来接收以配体原子A的孤电子对。配位键既可以存在于分子中(如H2SO4等),又可以存在于离子之中(如铵根离子、水合氢离子等),如图所示:
、例1:气态氯化铝(Al 2Cl 6 )是具有配位键的化合物,分子中原子之间的关系 如图示,请在图中标出你认为是配位键的斜线加上箭头。 解析:配位键是指成键双方一方提供空轨道一方提供孤对电子。C1元素最外层有7个电子通过1个共用电子对就可以形成8电子稳定结构。所以氯化铝(A12Cl6)中与两个铝形成共价健的氯原子中,有一条是配位键,氯原子提供电子,铝提供空轨道。 答案: 三、含有配位键的化合物就是配位化合物吗 配位化合物一般指由过渡金属的原子或离子(价电子层的部分d轨道和s、p 轨道是空轨道)与含有孤对电子的分子(如CO、NH3、H2O)或离子(如Cl-、CN-、 2 NO等)通过配位键结合形成的化合物。显然含有配位键的化合物就不一定是配位化合物,如上述提到的硫酸及铵盐等化合物中尽管有配位键,但由于没有过渡金属的原子或离子,故它们也就不是配位化合物。当然含有过渡金属离子的化合物也不一定是配位化合物,如氯化铁、硫酸锌等化合物就不是配位化合物。现以配位化合物[Co(NH3)6]Cl3为例说明配位化合物的结构与名称
配位键、配位化合物 【学习目标】 1.通过阅读课本P 41-P 42能够说出配合物、配位键、配合体的含义。区分外界,内界及配位数。 2.通过阅读课本P 42-P 43能够复述硫酸铜与氨水反应的实验现象及正确书写方程式; 3.学生结合配合物的性质,能利用现象确定配合物的结构式,并正确表示配位键; 4.学生结合配位键、共价键、σ键的区分与联系,能进行相关计算。 【重点难点】 重点:配位化合物的定义、组成及表示方法。硫酸铜与氨水反应的实验现象及方程式书写。 难点:方程式书写、配合物的标识号及相关计算。 【导学流程】 一.基础感知 1.配合物的结构(右图)和性质 (1)向CuSO 4中逐滴加入氨水,开始的现象为 ,继 续滴加,现象为 。写出相应的离子方程 式: 、 。所形成的配位化合物的化学 式为 。配位数为: ,中心离子是 ,配体是 .Cu 2+与NH 3之间形成的化 学键称为: , 提供孤电子对, 提供空轨道。 2.配合物的性质应用 (1)用过量的硝酸银溶液处理含有0.01 mol 氯化铬(CrCl 3·6H 2O)的水溶液,,生成0.02 mol AgCl 沉淀。(已知其配合物中配体的个数为:6)此氯化铬最可能是 。 3.配合物的相关计算 (1)仿照并类比课本P 42 [Cu(NH 3)4]2+的书写方法来写出[Cu(H 2O)4]2+的配位键的表示方法。 (2)气态氯化铝(Al 2Cl 6)是具有配位键的化合物,分子中原子间成键的关系如右图所示.请 将图中,你认为是配位键的斜线上加上箭头。 (3)Zn 的氯化物与氨水反应可形成配合物[Zn(NH 3)4]Cl 2,1mol 该配合物中含有 σ键的数目为 _____。 (4)过渡金属配合物Ni(CO)n 的中心原子价电子数与配体提供电子总数之和为 18,则n =__________。CO 与N 2结构相似,则1mol 该配合物含有的σ键的数目为 _____。
第 二章 烃和 卤代烃 (1)状态:常温下含有1~4个碳原子的烃为气态烃,随碳原子数的增多,逐渐过渡到液态、固态。 (2)沸点:①碳原子数的增多,沸点逐渐升高。②同分异构体之间,支链越多,沸点越低。 (3)在水中的溶解性:均难溶于水。 3、化学性质 (1)甲烷 化学性质相当稳定,跟强酸、强碱或强氧化剂(如KMnO 4)等一般不起反应。 ① 化反应 甲烷在空气中安静的燃烧,火焰的颜色为淡蓝色。 CH 4(g )+2O 2(g )CO 2(g )+2H 2O (l ) ②取代反应:(注意:条件为光照) 第一步:CH 4+Cl 2 CH 3Cl+HCl 第二步:CH 3Cl+ Cl 2 CH 2Cl 2+HCl 第三步:CH 2Cl 2+ Cl 2CHCl 3+HCl 第四步:CHCl 3+Cl 2CCl 4+HCl 常温下,只有CH 3Cl 是气态,其余均为液态,CHCl 3俗称氯仿,CCl 4又叫四氯化碳 再如:CH 3CH 3+Cl 2――→光照 CH 3CH 2Cl +HCl (2)乙烯 ①加成反应 与卤素单质Br 2加成 :CH 2=CH 2+Br 2→CH 2Br —CH 2Br 与H 2加成:CH 2=CH 2+H 2 催化剂 △ CH 3—CH 3 与卤化氢加成:CH 2=CH 2+HX →CH 3—CH 2X 与水加成 :CH 2=CH 2+H 2O ?? →?催化剂 CH 3CH 2OH (工业制乙醇的方法) ②氧化反应 常温下被氧化,如将乙烯通入酸性高锰酸钾溶液,溶液的紫色褪去。
易燃烧 :CH 2=CH 2+3O 2??→ ?点燃 2CO 2+2H 2O 现象(火焰明亮,伴有黑烟) ③加聚反应(口诀:双键变单键,两边添横线,横线加括号,“n ”右下边) 例如: n CH 2=CH 2――→催化剂 (3)烯烃的顺反异构 ①.顺反异构:由于碳碳双键不能旋转,导致分子中原子或原子团在空间的排列方式不 同所产生的异构现象。顺-2-丁烯 反-2-丁烯 ②.顺式结构:两个相同的原子或原子团排列在双键的同一侧。 ③.反式结构:两个相同的原子或原子团排列在双键的两侧。 (4)二烯烃的加成反应 ①分子中含有两个双键的链烃叫做二烯烃,二烯烃可用通式C n H 2n -2(n ≥3,且为正整数)表示。 ②单键和双键交替的二烯烃为典型的二烯烃,1,3-丁二烯是最重要的代表物,其与溴按1∶1发生加成反应时有两种情况: ①1,2-加成 +Br 2― → ②1,4-加成 +Br 2― → (5)乙炔的化学性质与乙烯相似 实验室制法: ①反应原理:CaC 2+2H 2O ―→Ca(OH)2+C 2H 2↑ ②收集方法:用排水法(因密度略小于空气,不能用向下排空气法) 三、苯及其同系物 1.苯的物理性质
专题十九:烃第一部分:考点 一、甲烷及烷烃的结构和性质 1、甲烷的分子结构 (1)组成与结构 名称 分子式电子式结构式分子模型 甲烷CH4 (2)空间结构 分子结构示意图结构特点及空间构型 具有正四面体结构,其中,4个C-H键的长 度和强度相同,夹角相等;碳原子位于正四 面体的中心,4个氢原子位于4个顶点。 2、甲烷的性质 (1)物理性质:无色无味气体,难溶于水,密度比空气小 (2)化学性质 ①在空气中燃烧(氧化反应):安静的燃烧,火焰呈淡蓝色,放出大量的热。 ②与酸性KMnO4溶液——溶液不褪色
③与氯气反应(取代反应):有油状物质生成,产生少量白雾,试管气体颜色逐渐变浅,最终变为 无色。 甲烷的氯代反应需注意: 1、反应条件为光照,在室温或暗处,二者均不发生反应,也不能 用阳光直射,否则会爆炸; 2、反应物必须用卤素单质,单质的水溶液均不与甲烷反应; 3、该反应是连锁反应,产物是五种物质的混合物,其中HCl的量 最多; 甲烷在光照条件下与氯气反应生成的4中取代产物的比较: 分子结构CCl4是正四面体,其余均不正,但都是四面体; 俗名CHCl3:氯仿,CCl4:四氯化碳; 状态常温下,CHCl3是气体,其余均为液体; 溶解性均不溶于水,CHCl3和CCl4是工业上重要的溶剂; 密度CHCl3比水轻,其他均比水重。 ④高温分解:工业制炭黑 (3)存在和用途 ①甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。 ②天然气是一种高效、低耗、污染小的清洁能源,还是一种重要的化工原料。 3、烷烃 (1)概念:仅含有碳和氢两种元素的有机物称为烃。烃分子中的每个碳原子形成四个共价键,且碳原子之间只以单键结合成链状,剩余价键均与氢原子结合,使每个碳原子的化合价都达到饱和,这样的
专题十九:烃 第一部分:考点 一、甲烷及烷烃的结构和性质 1、 甲烷的分子结构 (1) 组成与结构 (2) 空间结构 具有正四面体结构,其中,度和强度相同,面体的中心, 2、 甲烷的性质 (1) 物理性质:无色无味气体,难溶于水,密度比空气小 (2) 化学性质 ① 在空气中燃烧(氧化反应):安静的燃烧,火焰呈淡蓝色,放出大量的热。 点燃 ② 与酸性KMnO 4溶液——溶液不褪色 ③ 与氯气反应(取代反应):有油状物质生成,产生少量白雾,试管内气体颜色逐渐变浅,最终变 为无色。 光照 光照 光照 光照
甲烷在光照条件下与氯气反应生成的4中取代产物的比较: ④高温分解:高温工业制炭黑 (3)存在和用途 ①甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。 ②天然气是一种高效、低耗、污染小的清洁能源,还是一种重要的化工原料。 3、烷烃 (1)概念:仅含有碳和氢两种元素的有机物称为烃。烃分子中的每个碳原子形成四个共价键,且碳原子之间只以单键结合成链状,剩余价键均与氢原子结合,使每个碳原子的化合价都达到饱和,这样的烃叫饱和烃,也成为烷烃。 ①烷烃的碳碳键为饱和键,碳原子为饱和碳原子 ②烷烃中的碳原子并不在一条直线上,而是呈锯齿状,如图所示: ③烷烃分子中失去一个或几个氢原子所剩余的部分称为烃基,用-R表示。 ④1mol的-CH3含有9mol电子,1mol的CH4含有10mol电子。 (2)通式:(n为整数)。符合此通式的烃一定是烷烃。 (3)烷烃的性质 ①物理性质 递变性: 烷烃的熔沸点较低,且随碳原子数的增加,烷烃的熔沸点逐渐升高; 常温下由气态(n≤4)逐渐过渡到液态(5≤n≤16)、固态(n≥17),但新戊烷的沸点是9.5℃,