
综合实验——分析化学部分
补钙制剂中Ca 含量的测定(共12课时)
钙片的主要成分为碳酸钙、甘露醇、乳糖、淀粉、维生素d 、甜橙香精、柠檬酸、阿斯马甜(含苯丙氨酸)、苋菜红。钙主要以碳酸钙形式存在,可与HCl 发生反应而溶解。钙的测定方法有酸碱滴定法(返滴定)、络合滴定法(直接滴定)和氧化还原滴定法(间接滴定)以及原子吸收光谱法、电化学分析法等。本实验欲采用三种滴定分析方法进行测定,并对各种方法的有略加以比较。
方法Ⅰ 酸碱滴定法测定补钙制剂中Ca 的含量
——返滴定法
一、实验目的
1. 学习用酸碱滴定方法测定CaCO 3的原理及指示剂选择。
2. 巩固滴定分析基本操作。 二、实验原理
补钙制剂中钙主要以碳酸钙形式存在,可与HCl 发生反应而溶解
2322CaCO 2H Ca CO H O ++
+→+↑+ 过量的酸可用标准NaOH 回滴,据实际与CaCO 3反应标准盐酸体积求得钙片中Ca 含量,以Ca 质量分数表示。 三、试剂
浓HCl (A .R ),NaOH (A .R ),0.1%甲基橙。
四、实验方法
(1)0.1mo l ·L -1
NaOH 配制:称2gNaOH 固体于小烧杯中,加H 2O 溶解后移至试剂瓶中用蒸馏水稀释至500mL ,加橡皮塞,摇匀。
(2)0.1 mo l ·L -1HCl 配制:用量筒量取浓盐酸4.5mL 于500mL 试剂瓶中,用蒸馏水稀释至500mL ,加盖,摇匀。
(3)酸碱标定:
A.HCl 标准溶液的标定:准确称取基准Na 2CO 3 0.15~0.2g 3份于锥形瓶中,分别加入20~30mL 煮沸去CO 2并冷却的去离子水,摇匀,温热使溶解,后加入1~2滴甲基橙指示剂,用以上配制的HCl 溶液滴定至橙色为终点,计算HCl 溶液的精确浓度。
B.NaOH 标准溶液的标定:准确移取NaOH 标准溶液25mL 于250mL 的锥形瓶中,加2d 甲基橙指示剂,此时溶液呈黄色,用HCl 滴定标准溶液滴定至在加下半滴HCl 后溶液由黄色变为橙色,即为终点,计算NaOH 溶液的精确浓度。平行滴定三次。
(4)Ca 含量测定:准确称取0.20~0.25g 钙片三份,于3个锥形瓶内,用酸式滴定管逐滴加入已标定好的HCl
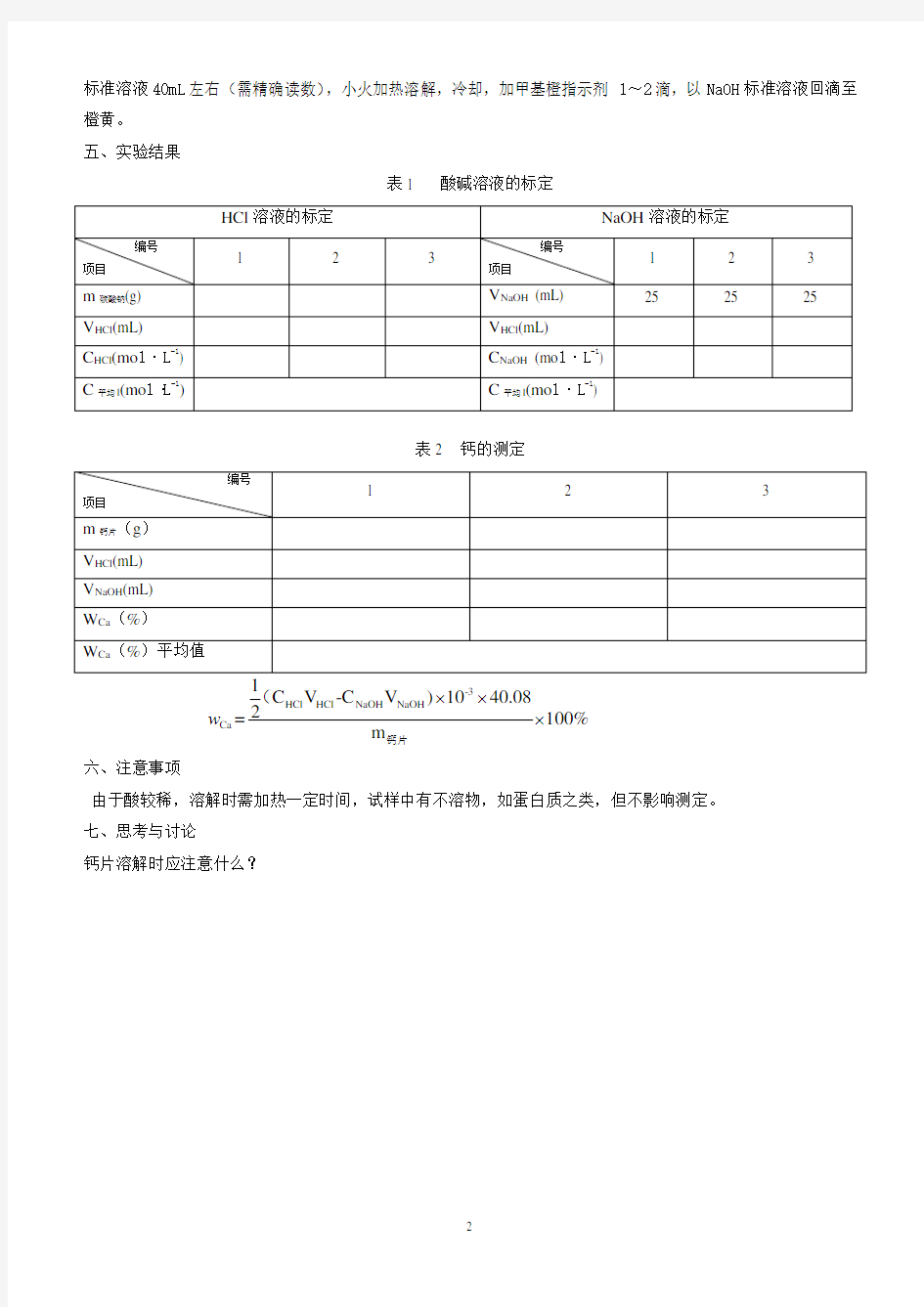
标准溶液40mL 左右(需精确读数),小火加热溶解,冷却,加甲基橙指示剂1~2滴,以NaOH 标准溶液回滴至橙黄。 五、实验结果
表1 酸碱溶液的标定
表2 钙的测定
-3HCl HCl NaOH NaOH Ca C V -C V )1040.082=100%m w ???钙片
(
六、注意事项
由于酸较稀,溶解时需加热一定时间,试样中有不溶物,如蛋白质之类,但不影响测定。 七、思考与讨论 钙片溶解时应注意什么?
方法Ⅱ配合滴定法测定补钙制剂中Ca的含量
——直接滴定法
一、实验目的
1.进一步巩固掌握配合滴定分析的方法与原理。
2.学习使用配合掩蔽排除干扰离子影响的方法。
3.训练对实物试样中某组分含量测定的一般步骤。
二、实验原理
钙片的主要成分为碳酸钙、甘露醇、乳糖、淀粉、维生素d、甜橙香精、柠檬酸、阿斯马甜(含苯丙氨酸)、苋菜红。样品经盐酸溶解后,在pH=10,用铬黑T作指示剂,EDTA可直接测量Ca2+的含量:
Ca2++ H2Y2-===== CaY2-+ 2H+
三、试剂
1. 6mo l·L-1HCl,
2.铬黑T指示剂,
3.NH4Cl-NH3·H2O缓冲溶液(pH=10),
4.乙二胺四乙酸二钠盐
5.CaCO3基准试剂。
四、实验步骤
(1)0.01 mo l·L-1EDTA标准溶液的配制:
称取1g分析纯的乙二胺四乙酸二钠溶于100mL温水中,溶解后稀释至250mL,摇匀,如混浊应过滤后使用。贮存于聚乙烯塑料瓶中为佳。
(2)Ca2+标准溶液的配制:
准确称取碳酸钙基准物质0.23~0.27g于烧杯中,盖上表面皿。从烧杯嘴中滴加1:1HCl,至碳酸钙恰好全部溶解,定量转移到250mL容量瓶中,用水稀释至刻度,摇匀。
(3)EDTA标准溶液浓度的标定:
用移液管吸取钙标准溶液25mL于250mL锥形瓶中,滴加1:1氨水调pH=10.0,加氨缓冲溶液10mL,加3d铬黑T指示剂,用EDTA标准溶液滴定至溶液由酒红色恰变为纯蓝色,即达终点。根据消耗的EDTA标准溶液的体积,计算其浓度。平行测定三次。
(4)Ca含量的测定:准确称取0.45~0.55g钙片(使Ca浓度在0.01 mo l·L-1左右)于烧杯中,用水润湿后,小心滴加6 mo l·L-1HCl 4~5mL,微热至完全溶解(少量有机物不溶),冷却,转移至250mL容量瓶,稀释至接近刻度线,滴加水至刻度线摇匀。
吸取试液25mL置于250mL锥形瓶中,加氨缓冲溶液调pH=10,再多加10mL,摇匀。加3d铬黑T指示剂,用EDTA标准溶液滴定至溶液由酒红色恰变纯蓝色,即达终点,根据EDTA消耗的体积计算Ca2+的含量,w Ca。平行测定三次。
四、实验数据记录与处理
2+Ca EDTA EDTA
C =
V
-3EDTA EDTA Ca C V 1040.08
=100%m w ???钙片
五、思考与讨论
1. EDTA 标准溶液和Ca 2+
标准溶液的制备方法有何不同?
2. 试解释本实验中用铬黑T 指示剂,用EDTA 标准溶液滴定至溶液由酒红色变纯蓝色。
3. 配合滴定中为什么要加入缓冲溶液?
方法Ⅲ 高锰酸钾法测定补钙制剂中Ca 的含量
——间接滴定法
一、实验目的
1. 学习间接氧化还原测定Ca 的含量。
2. 巩固沉淀分离、过滤洗涤与滴定分析基本操作。 二、实验原理
利用钙片中的Ca 2+与草酸盐形成难溶的草酸盐沉淀,将沉淀经过滤洗涤分离后溶解,用高锰酸钾法测定C 2O 42-含量,换算出Ca 的含量,反应如下:
222424Ca C O CaC O +-
+==↓
24244224CaC O H SO CaSO H C O +==+
22244225H C O 2MnO 6H 2Mn +10CO 8H O -
++++→↑+
5Ca 2+ ~ 2MnO 4-
某些金属离子(Ba 2+,Sr 2+,Mg 2+,Pb 2+,Cd 2+ 等)与C 2O 42-能形成沉淀对测定Ca 2+有干扰。 三、试剂
1. KMnO 4;
2. 5%(NH 4)2C 2O 4;
3. 10%NH 3H 2O ,浓盐酸,
4. 1 mo l ·L -1
H 2SO 4, 5. 1:1HCl , 6. 0.2%甲基橙, 7. 0.1 mo l ·L -1
AgNO 3 8. 草酸钠基准试剂 四、实验方法
1. 0.02 mo l ·L -1KMnO 4溶液的配制:称取KMnO 4固体约0.8 g 溶于250mL 水中,盖上表面皿,加热至沸并保持微沸状态1h ,冷却后,用微孔玻璃漏斗过滤。滤液贮存于棕色瓶中备用。
2. KMnO 4溶液的标定:准确称取约0.10g ~0.13gNa 2C 2O 4基准物质3份,分别置于250mL 的锥形瓶中,加50mL 水溶解,加入15mL1 mo l ·L -1
的硫酸溶液,在水浴上加热到75~85℃.趁热用高锰酸钾标准溶液滴定。开始滴定时反应速度较慢,待溶液中产生了Mn 2+后,滴定速度可加快,直到溶液呈微红色并持续半分钟不褪色即为终点。计算KMnO 4溶液浓度,平行测定三分。
3.补钙制剂中钙含量的测定:准确称取钙片0.20~0.25g 两份(每份含钙约0.05g ),分别放在250mL 烧杯中,加1:1HCl 3mL ,加H 2O 10mL ,加热溶解,会有白色不溶物不影响测定。然后加入2~3滴甲基橙,溶液呈红色,逐滴加入10%氨水,不断搅拌,直至变黄,趁热逐滴加入50mL 5%草酸胺溶液,将溶液放置在低温电热板上(或在水浴上)陈化30min ,冷却后沉淀过滤、洗涤,直至无Cl -离子。然后,将带有沉淀的滤纸铺在先前用来进行沉淀的烧杯内壁上,用1 mo l ·L -1
H 2SO 450mL 把沉淀由滤纸洗入烧杯中,再用洗瓶吹洗1~2次。然后,稀释溶液至体积约为100mL ,加热至70~80℃,用KMnO 4标准溶液滴定至溶液呈浅红色,再把滤纸推入溶液中,若溶液褪色,则继续滴定,直到出现淡红色30s 不褪色即为终点。计算Ca 的质量分数。
五、实验记录与数据处理
224
4Na C O KMnO EDTA
m 25
134C =V ?
44-3KMnO KMnO Ca 5
C V 1040.082=100%m w ???钙片
六、思考与讨论
1. 为什么沉淀要洗至无Cl -
离子为止?
2. 如果将带有CaC 2O 4沉淀的滤纸一起投入烧杯,以硫酸处理后再用KMnO 4滴定,这样操作对结果有什么影响?
实验九食品中钙含量的测定 钙是人体内非常重要的元素之一,钙参与整个生长.发育过程并与各种有机物结合在一起,体内钙总重的99%存在于骨组织及牙齿内,婴儿,学龄前儿童、孕妇和哺育期母亲都需要足够的钙,因此,测定食品中的钙具有非常重要的营养学意义。 一、实验目的:掌握络合滴定法测钙含量的原理,熟练其操作过程。 二、实验原理:钙与氨羧络合剂能定量地形成金属络合物,其稳定性较钙与指示剂所形成的络合物为强。在适当的pH值范围内,以氨羧络合剂EDTA滴定,在达到等当点时,EDTA 就自指示剂络合物中夺取钙离子,使溶液呈现游离指示剂的颜色(终点)。根据EDTA络合剂用量可计算钙的含量。 三、仪器与试剂与材料: 仪器: 碱式滴定管25mL,10mL;万分之一天平;电炉;凯式烧瓶等 试剂: 1)三乙醇胺(75%)和水(1:1) 2)2mol/L氢氧化钠:称取80g氢氧化钠用水溶于1000mL。 3)10%盐酸羟氨。 4)混合消化液:硝酸+高氯酸=(4+1) 5)钙指示剂: 称取0.2g钙指示剂,20g氯化钠于研钵中,充分研细,混合均匀. 6)镁溶液: 1gMgSO4.7H2O溶于200mL水中 7)1%甲基红指示剂。 8)20%氢氧化钠溶液。 9)EDTA溶液:准确称取4.50gEDTA二钠盐用水稀释至1000mL,储存于聚乙烯瓶中4℃保存。标定:准确称取0.2~0.25gCaCO3放入250mL烧杯中,用少量水润湿,盖上表面皿,从烧杯嘴处慢慢加入1:1HCl溶液5mL溶解冷却后,将溶液转入250mL容量瓶中,用水定容至刻度摇匀。移取上述溶液25.00mL于250mL三角瓶中,加水25mL和2mL镁溶液,再加5mL20%NaOH,和20mg钙指示剂,摇匀后用0.01mol/LEDTA溶液滴定至溶液由红色变蓝色即为终点。记录消耗的0.01mol/LEDTA溶液体积,同时做三份平行样。 计算:CEDTA (mol/L) = EDTA CO C CaCO V M W ? ? 25 250 1000 3 3 a 材料:奶粉等 四、实验步骤:
氯化钙含量测定 所用药剂: PH=10缓冲液、铬黑T指示剂、4mol/l盐酸溶液、lEDTA标准贮备液、l碳酸钙标准液、EDTA标准液的标定。 流程图: 称取氯化钙加入20ml纯水加入5mlPH=10缓冲液 加入3滴铬黑T指示剂用EDTA溶液滴定计算。 (操作过程放入250ml磨口锥形瓶中) 公式:氯化钙=C×V××100÷G C—EDTA浓度、V—消耗EDTA体积、G氯化钙的质量 所需药剂配方: 1、PH=10缓冲液:称取氯化钠溶于143ml氨水中,用纯水稀释至 250ml。盛于250ml试剂瓶中冷藏0—4℃,密封保存,保存期3个月。 2、铬黑T指示剂:称取铬黑T溶于100ml三乙醇胺中,置于棕色 瓶中塞紧。避光保存,期限3个月。 3、4mol/l盐酸溶液:吸取36ml浓盐酸溶于少量水中,加水稀释 至100ml,摇匀装入100ml试剂瓶中。室温25℃,通风保存,期限半年。 4、lEDTA标准贮备液配方:称取乙二胺四乙酸二钠溶于少量水中, 移入容量瓶中稀释至1000ml,置于聚乙烯瓶中。室温避光保存,期限1个月。
5、l碳酸钙标准液配方:将碳酸钙在105℃下干燥2小时,置于 干燥器中冷却至室温,称取置于500ml烧杯中,用水湿润,逐滴加入4mol/l盐酸溶液至碳酸钙完全溶解,加入200ml水,煮沸数分钟驱除二氧化碳,冷至室温,移入容量瓶中定溶至1000ml,此溶液1ml含钙。室温保存,期限3个月。 6、EDTA标准液的标定:吸取20ml碳酸钙标准液,30ml纯水于 250ml锥形瓶中,加5ml PH=10缓冲液和3滴铬黑T指示剂,立即用EDTA标准液滴定,开始滴定时速度宜稍快,接近终点时宜稍慢,并充分振荡,滴定至紫色消失刚出现亮蓝色即为终点。记录消耗ETDA溶液体积。计算公式:C=C1×C2÷V1 公示中C1—碳酸钙标准液的浓度、C2—碳酸钙标准液的体积、V1消耗EDTA标准液的体积。
补钙为什么要补充维生素d 钙和维生素d是我们人体不可分割的,在当今时代都是这样的。如今的父母都是希望自己的孩子能够茁壮的成长,所以一定要在补钙的时候也是要增加维生素d这样才能更有效的促进人 体的吸收。那么,补钙为什么要补充维生素d? 1、先了解下钙和维生素D对人体的作用 钙是构成人体的重要组成部分,占人体重量的百分之1.5到百分之2,其中百分之99存在骨骼和牙齿中。钙对维生素神经兴奋性、血液凝固、肌肉收缩和舒张、腺体的分泌有着很总要的作用,并对多种酶有激活作用。钙主要受甲状旁腺素、降钙素与1.25-(OH)D3的共同调节,钙的吸收也需要一定的磷,磷缺乏也会影响钙的吸收。 维生素D主要与甲状旁腺共同作用,维持血钙的水平稳定,它是钙磷代谢重要的调节因子之一,维持着钙和磷的正常水平,
这对正常骨骼的矿化、肌肉收缩、神经传导以及体内所有细胞的功能都是必须的,同时维生素D还具有免疫调节功能,可以改变机体对感染的反应。 2、婴儿时期需要补充钙剂和维生素D吗? 答案是肯定的,婴儿时期是处于快速生长发育期,对维生素D的需求来那个相对较大,母乳中的维生素D的水平比较低,维生素D既可以由膳食供给,又可以经暴露日光的皮肤合成。如果小婴儿缺乏钙同时也缺乏维生素D,那么就会出现骨质软化症和佝偻病,表现出多汗、易惊生长手足抽搐。久而就会出现骨质软化便会导致乒乓球头颅,肋缘外翻、串珠、手镯、X或者O型腿。 3、每个时期的婴幼儿该如何添加钙剂和维生素D呢? 一般来说,0-6个月的孩子,纯母乳喂养每天需要钙三百毫克,人工喂养的婴儿考虑到非母乳来源钙吸收率比较低,固定为每天四百毫克。这时候的维生素D的含量为固定的一天一粒,也
食品安全国家标准 食品中钙的测定 1范围 本标准规定了食品中钙含量测定的火焰原子吸收光谱法二滴定法二电感耦合等离子体发射光谱法和电感耦合等离子体质谱法三 本标准适用于食品中钙含量的测定三 第一法火焰原子吸收光谱法 2原理 试样经消解处理后,加入镧溶液作为释放剂,经原子吸收火焰原子化,在422.7n m处测定的吸光度值在一定浓度范围内与钙含量成正比,与标准系列比较定量三 3试剂和材料 除非另有规定,本方法所用试剂均为优级纯,水为G B/T6682规定的二级水三 3.1试剂 3.1.1硝酸(H N O3)三 3.1.2高氯酸(H C l O4)三 3.1.3盐酸(H C l)三 3.1.4氧化镧(L a2O3)三 3.2试剂配制 3.2.1硝酸溶液(5+95):量取50m L硝酸,加入950m L水,混匀三 3.2.2硝酸溶液(1+1):量取500m L硝酸,与500m L水混合均匀三 3.2.3盐酸溶液(1+1):量取500m L盐酸,与500m L水混合均匀三 3.2.4镧溶液(20g/L):称取23.45g氧化镧,先用少量水湿润后再加入75m L盐酸溶液(1+1)溶解,转入1000m L容量瓶中,加水定容至刻度,混匀三 3.3标准品 碳酸钙(C a C O3,C A S号471-34-1):纯度>99.99%,或经国家认证并授予标准物质证书的一定浓度的钙标准溶液三 3.4标准溶液的配制 3.4.1钙标准储备液(1000m g/L):准确称取2.4963g(精确至0.0001g)碳酸钙,加盐酸溶液(1+1)
溶解,移入1000m L容量瓶中,加水定容至刻度,混匀三 3.4.2钙标准中间液(100m g/L):准确吸取钙标准储备液(1000m g/L)10m L于100m L容量瓶中,加硝酸溶液(5+95)至刻度,混匀三 3.4.3钙标准系列溶液:分别吸取钙标准中间液(100m g/L)0m L,0.500m L,1.00m L,2.00m L, 4.00m L,6.00m L于100m L容量瓶中,另在各容量瓶中加入5m L镧溶液(20g/L),最后加硝酸溶液(5+95)定容至刻度,混匀三此钙标准系列溶液中钙的质量浓度分别为0m g/L二0.500m g/L二1.00m g/L二2.00m g/L二4.00m g/L和6.00m g/L三 注:可根据仪器的灵敏度及样品中钙的实际含量确定标准溶液系列中元素的具体浓度三 4仪器设备 注:所有玻璃器皿及聚四氟乙烯消解内罐均需硝酸溶液(1+5)浸泡过夜,用自来水反复冲洗,最后用水冲洗干净三4.1原子吸收光谱仪:配火焰原子化器,钙空心阴极灯三 4.2分析天平:感量为1m g和0.1m g三 4.3微波消解系统:配聚四氟乙烯消解内罐三 4.4可调式电热炉三 4.5可调式电热板三 4.6压力消解罐:配聚四氟乙烯消解内罐三 4.7恒温干燥箱三 4.8马弗炉三 5分析步骤 5.1试样制备 注:在采样和试样制备过程中,应避免试样污染三 5.1.1粮食二豆类样品 样品去除杂物后,粉碎,储于塑料瓶中三 5.1.2蔬菜二水果二鱼类二肉类等样品 样品用水洗净,晾干,取可食部分,制成匀浆,储于塑料瓶中三 5.1.3饮料二酒二醋二酱油二食用植物油二液态乳等液体样品 将样品摇匀三 5.2试样消解 5.2.1湿法消解 准确称取固体试样0.2g~3g(精确至0.001g)或准确移取液体试样0.500m L~5.00m L于带刻度消化管中,加入10m L硝酸二0.5m L高氯酸,在可调式电热炉上消解(参考条件:120?/0.5h~120?/1h二升至180?/2h~180?/4h二升至200?~220?)三若消化液呈棕褐色,再加硝酸,消解至冒白烟,消化液呈无色透明或略带黄色三取出消化管,冷却后用水定容至25m L,再根据实际测定需要稀释,并在稀释液中加入一定体积的镧溶液(20g/L),使其在最终稀释液中的浓度为1g/L,混匀备用,此为试样
可溶性氯化物中氯含量的测定(佛尔哈德Volhard返滴定法) 一、实验目的 1. 学习NH4SCN标准溶液的配制和标定。 2. 掌握用佛尔哈德返滴定法测定可溶性氯化物中氯含量的原理和方法。 二、实验原理 在含Cl-的酸性试液中,加入一定量过量的Ag+标准溶液,定量生成AgCl沉淀后,过量Ag+以铁铵矾作指示剂,用NH4SCN标准溶液回滴,由Fe(SCN)2+络离子的红色来指示滴定终点。主要包括下列沉淀反应和络合反应: Ag++Cl-= AgCl↓(白色) Ksp= 1.8×10-10 Ag++SCN-= AgSCN↓(白色) Ksp= 1.0×10-12 Fe3++SCN-= Fe(SCN)2+(白色) K1= 138 指示剂用量大小对滴定有影响,一般控制Fe3+浓度为0.015mol·L-1为宜。 滴定时,控制氢离子浓度为0.1~1mol·L-1,剧烈摇动溶液,并加入硝基苯(有毒)或石油醚保护AgCl沉淀,使其与溶液隔开,防止AgCl沉淀与SCN-发生交换反应而消耗滴定剂。 测定时,能与SCN-生成沉淀或生成络合物,或能氧化SCN-的物质均有干扰。PO43-,AsO3-4,CrO42-等离子,由于酸效应的作用而不影响测定。 佛尔哈德法常用于直接测定银合金和矿石中的银的质量分数。 三、主要试剂 1. AgNO3(0.1 mol·L-1):见摩尔法实验。 2. NH4SCN(0.1mol·L-1):称取 3.8g NH4SCN,用500mL水溶解后转入试剂瓶中。 3. 铁铵矾指示剂溶液(400g·L-1) 4. HNO3(1+1):若含有氮的氧化物而呈黄色时,应煮沸去除氮化合物。 5. 硝基苯 6. NaCl试样:见实验33。 四、实验步骤 1. NH4SCN溶液的标定 用移液管移取AgNO3标准溶液25.00mL于250mL锥形瓶中,加入5mL(1+1)HNO3,铁铵矾指示剂1.0mL,然后用NH4SCN溶液滴定。滴定时,剧烈振荡溶液,当滴至溶液颜色为淡红色稳定不变时即为终点。平行标定3份。计算NH4SCN溶液浓度。 2.试样分析 准确称取约2g NaCl试样于50mL烧杯中,加水溶解后,定量转入250mL容量瓶中,稀释至刻度,摇匀。
分类号:BF86 市场报/2001年/06月/15日/第C03版/ 医药保健 《钙与生命》——补钙的指南 吉荫桐 中国人普遍缺钙,这直接影响身体健康,严重者导致百病缠身。卫生部1992年提出“全民补钙、刻不容缓”。许许多多人开始重视补钙。钙普遍成为医院与药店最畅销品之一。多数药厂纷纷生产钙片,全国迄今已出现有213个品种,但良莠不齐;有的吸收率很低, 甚至是零。患者服用一年无任何效果。有人又服用过量,负面影响很大,精神萎靡,体力衰竭。本人不久前,在报刊上曾写过几篇研讨补钙的稿件,自认为是个业余研究者。近日,两次听到白丽教授关于“钙与生命”的讲座,方知这是一门大学问,我原来所写的不过是点滴的常识。白丽女士是位资深学者,为宣传现代钙科学研究成果,其忘我执著之信念、辛劳奔走之行动,令人感动。两次讲课仅只5个小时,她热情地以最快的语言速度,希冀尽其所知全部传授给台下听众,听者动容,掌声迭起。随后,我又阅读了这部她的《钙与生命》专著,实在获益匪浅。 “人,一个健康的人,自精子与卵子相结合的瞬间开始,其孕育、分娩、发育、成长, 直到年老寿终。每时每刻都在钙的参与下而完成正常的生理功能。钙是一种金属元素,在所有构成人体的无机元素中,钙是人体内最活跃的元素之一,又是人体内含量最高的矿物质成份,占正常人体体重的1.5%—2%,约为1200克。其中99%用以构成人体的骨骼和牙齿,另外1%存在血液和细胞软组织中,尽管这部分只占人体钙总量的1%,但钙元素在体内分布是无所不在的。人体的各个部位,各个器官,从骨骼到肌肉、血液;从细胞膜到细胞质、细胞核都有钙的存在。钙有效地维持人体循环、呼吸、消化、血液、神经、内分泌、生殖、泌尿、免疫等系统的生理作用。这些系统的生理功能正常与否,钙起着至关重要的调节作用。换句话说,有钙的存在,才能维持正常的生命。” 这段简洁的阐述是本书开宗明义第一章,扼要地向读者介绍了钙在人体内绝不能缺,缺了钙就要认真及时补。 接着,作者从医学理论与30年临床经验总结中,以较长的篇幅,就下述几个最基本的问题做了较详细的论述:钙代谢的平衡是人体健康的重要条件;钙在人体内的吸收与排泄;钙的生理功能;钙平衡与骨骼的生长发育;钙在调节体内酸碱平衡的作用;钙与健康;缺钙的现状与原因。 我们最关心的是,缺钙会导致哪些疾病?众人容易脱口而出的是骨质疏松、骨质增生以及骨刺、骨折,其实何止这些?缺钙之后,各种疾病缓慢发展,是个十分漫长的过程而不易发觉,可能几年、几十年逐渐无形中,引起动脉硬化、高血压、高血脂、糖尿病、结石、五脏功能衰弱;消化功能疾病、免疫功能低下、皮肤病、肌肉痉挛、性功能明显下降、老年痴
鸡蛋壳中钙离子含量的测定 一.实验目的 1 ?学习固体试样的酸溶方法; 2. 掌握络合滴定法测定蛋壳中钙方法原理; 3. 了解络合滴定中,指示剂的选用原则和应用范围。 二.实验原理 1鸡蛋的主要成分是碳酸钙,含钙量约90—98% 2.EDTA滴定原理:在pH>12.5时,Mg2+生成Mg(OH)2沉淀,在用沉淀掩蔽镁 离子后,用EDTA单独滴定钙离子。钙指示剂与钙离子显红色,灵敏度高,在 pH=12~13滴定钙离子,终点呈指示剂自身的蓝色。 其变色原理为: 滴定前Ca + In (蓝色)==Caln (红色) 滴定中Ca + 丫 == CaY 滴定时Caln (红色)+ 丫 == CaY + In (蓝色) 三.实验试剂及仪器 1. 1 HCI溶液1:1 HCl溶液5 ml 40g/L NaOH溶液钙指示剂三乙醇胺溶 液乙二胺四乙酸二钠CaCO3优级纯 2. 50 mL小烧杯100 ml容量瓶250ml锥形瓶*3 ; 500mL试剂瓶 钙指示剂 四.实验步骤 1、鸡蛋壳的溶解:称取0.22~0.23g左右鸡蛋壳洗净取出内膜,烘干,研碎称量其质量,然后将其放入50 mL小烧杯中,加入5ml 1 : 1 HCI溶液,微火加热将其溶解,冷却,然后将小烧杯中的溶液转移到100ml容量瓶中,定容摇匀。 2、(1)EDTA标准溶液的标定: a. 浓度为0.0200 mol/L的EDTA标准溶液的配置:称取EDTA二钠盐4.0000g 溶解于温水中,冷却后加入到试剂瓶中,稀释到500ml,摇匀。 b. 0.020 mol/L钙标准溶液的配置:准确称取0.2~0.22克的分析纯CaCO3固体试剂,置于50 ml烧杯中,先用少量水润湿,然后加1:1 HCl溶液2—3 ml,将溶液定量转移到100 ml容量瓶中,用去离子水稀释到刻线,摇匀。根据称取的CaCO3 质量计算出钙离子标准溶液的浓度。 c. EDTA标准溶液的标定:用移液管吸取25.00ml钙离子标准溶液,于250ml锥形瓶中,加入5 ml 40g/L NaOH溶液及少量钙指示剂,摇匀后,用EDTA溶液滴定至溶液由酒红色恰变为纯蓝色,即为终点,记下消耗的EDTA体积V1。按照以上方法重复滴定3次,要求其相对平均偏差不大于0.2 %,根据标定时消耗的EDTA溶液的体积计算它的准确浓度。 (2)Ca2+的滴定:用移液管移取25.00ml待测溶液于锥形瓶中,调节溶液pH 为12~13,充分摇匀,加入5滴钙指示剂,用EDTA标准溶液滴定至溶液由酒红色变为纯蓝色为终点,记下体积V2,重复滴定3次,记录消耗EDTA溶液的体积。
《食品安全国家标准食品中钙的测定》(征求意见稿) 编制说明 一、标准起草的基本情况 为贯彻落实《食品安全法》及其实施条例,依据国家卫生和计划生育委员会(原卫生部)办公厅和农业部办公厅《关于印发2010年食品安全国家标准清理整顿工作方案的通知》(卫办监督发[2010]106号)和《国家卫生计生委办公厅关于印发食品安全国家标准整合工作方案的通知》(国卫办食品函〔2014〕386号)要求,食品安全国家标准审评委员会秘书处委托由广东疾病预防控制中心负责开展《食品中钙的测定》检测方法整合修订工作,主要涉及GB 5413.21-2010、GB/T23375 -2009、GB/T14610-2008、GB/T5009.92-2003、GB/T 9695.13-2009、NY 82.19-1988等。广东省疾病预防控制中心承担该项国标修改工作后,成立了由广东省疾病预防控制中心由李少霞、蔡文华、胡曙光、苏祖俭、梁旭霞、罗建波、梁春穗、黄伟雄、张学武、深圳市疾控中心刘桂华、林凯、姜杰、清远市疾控中心何健飞、中山出入境检验检疫局李蓉、叶少媚、李云松、李浩洋、广东仙乐制药有限公司黄舒丽、纪锐琳等组成的工作小组,于2014年下半年开展了实验室方法研究实验,并对我省主要食品中钙的本底值进行测定,工作小组研究讨论了相关实验结果和检测数据,对《GB 5009.90-2003 食品中钙的测定》等方法作了一定的补充修改,初步形成修订该国家标准的征求意见稿及编制说明。供讨论。 二、标准的重要内容及主要修改情况 钙是生物必需的元素。对人体而言,无论肌肉、神经、体液和骨骼中,都有用Ca2+结合的蛋白质。钙是人类骨、齿的主要无机成分,也是神经传递、肌肉收缩、血液凝结、激素释放和乳汁分泌等所必需的元素。钙约占人体质量的1.4%,参与新陈代谢,每天必须补充钙;人体中钙含量不足或过剩都会影响生长发育和健康。钙在维持人体的正常生理机能、预防疾病方面具有非常重要的作用。食品是人体补充营养元素的主要途径。 目前我国发布的食品中钙的检测方法为GB5009.92-2003、GB 5413.21-2010、GB/T23375 -2009等,主要为火焰原子吸收光谱法,电感耦合等离子体原子发射光谱法,滴定法。本标准整合修订还参考了国内外相关法律、法规和标准,收集了国内外相关参考文献,通过综合分析比较,样品前处理方式保留干灰化法和湿消解法,增加高压密闭罐消解法和微波消解法,测定方法则保留了火焰原子吸收分光光度法、电感耦合等离子体原子发射光谱法和滴定法。其中火焰原子吸收光谱法灵敏度高、抗干扰强、仪器国产化、测试成本低,为实际工作最常采用,本文对其进行了方法学参数确认,具体实验结果如下: (1)不同酸浓度对火焰原子吸收测钙的吸光度是有一定的影响。当样液中硝酸的体积浓度达到1%时,钙吸光度已出现较明显的降低;盐酸及高氯酸的体积浓度达到2%时,钙吸光度值也出现明显降低的现象;故在测定钙时,消化结束后赶酸应尽可能彻底,或在满足灵敏度要求的前提下加大稀释倍数,以达到降低酸对钙测定值的影响。此外,硫酸加入容易导致钙以硫酸钙的形式形成沉淀而造成损失,因此,在样品处理的各个步骤都应避免采用硫酸。 (2)镧作释放剂可以消除磷酸、铝、硫酸盐、磷酸盐和硅酸盐等对测定钙的干扰。不同镧溶液浓度对测定的影响不同,试验表明,当样液中镧的浓度在0.2-2.0g/L范围时,钙的测定值有最强吸收,故可根据实际需要在此范围选择合适的镧溶液浓度。
牛奶中钙的测定 在人们的日常生活中,牛奶已经很普及了。牛奶中除不含纤维素外,几乎含有人体所需各种营养物质,其蛋白质含量为3.5%~4%,脂肪含量为3%~4%,碳水化合物为4%~6%,并且奶中钙、磷、钾等微量元素含量也极丰富。其中,钙对人体是很重要的。 一、钙的相关知识 钙是人体内最重要的、含量最多的矿物元素,约占体重的2%。广泛分布于全身各组织器官中,其中约99%分布于骨骼和牙齿中,构成骨盐并维持它们的正常生理功能;约1%分布在体液(即肌体的软组织和细胞的外液)中,其含钙量虽少,却对体内的生理和生化反应起着重要的调节作用。1.1 钙在人体内的基本作用: 钙是人体内的一种微量元素,它在体内的含量虽然微乎其微,但是它的作用是巨大的。直接的作用是钙能维持调节机体内许多生理生化过程,调节递质释放,增加内分泌腺的分泌,维持细胞膜的完整性和通透性,促进细胞的再生,增加机体抵抗力。间接的作用就比较具体繁多,例如钙可以使骨骼粗壮,使肌肉发达,使人精神饱满,维持体内酸碱适中、水和电解质平衡等。钙还可以消除炎症、净化血液、强力解毒、健美皮肤并能抑制有害病菌的入侵等。钙使人体保持上述状况,实际上是人体抵抗力强的一种综合表现。举例来说,钙能预防治疗感冒的原因有三方面:⑴钙能降低毛细血管的通透性;⑵钙能抑制病菌的生存;⑶钙能增强人体对环境冷暖变化的适应能力。具体来说,钙有以下功能: (1)维持血管的正常通透性 体液中钙含量降低,毛细血管通透性增强,血液中的成分可以渗出血管外,这就是某些过敏性疾病的发病机制。注射钙制剂,可以降低毛细血管通透性,过敏性疾病即可缓解。 (2) 抑制神经肌肉的兴奋性 钙离子有降低神经骨骼肌兴奋性的作用。血钙浓度低到每10 0毫升血7毫克以下时,神经骨骼肌兴奋性增强,可以出现手足搐搦症或惊厥。这时静脉推注钙制剂,提高血钙浓度,惊厥即可停止。 (3)参与肌肉的收缩 肌浆里的钙与骨骼肌收缩有直接关系,对维持心肌的正常收缩也起重要作用。如果钙浓度过高,可以减弱肌紧张,引起心跳减慢或心脏停跳。
补钙对孩子的作用 钙对孩子的成长非常重要,但是家长也不能盲目给孩子补钙,过量补钙会对孩子的成长造成影响,家长应该选择一些信得过的品牌的牛奶,因奶粉中含有孩子成长所需要的优质钙。 钙对于强壮骨骼和牙齿、促进神经和肌肉功能、帮助血液凝固和激活将食物转化为能量的酶都具有重要作用。专家介绍,中国汉族传统的饮食中奶制品摄入不足,是导致很多孩子钙入量不足的原因。 孩子每天需要多少钙 中国营养学会建议,两三岁的孩子每天需要600毫克钙。孩子到4岁后,他对钙的需求量要增加到每天800毫克。 最佳钙食物来源 由于产品的品牌不同,水果或蔬菜的大小不同,它的含钙量也会有一些差异。 100毫升酸奶:118 毫克。 120毫升强化钙的橙汁:175 毫克。 100克瑞士干酪:725毫克。
100克契达干酪:720 毫克。 100毫升牛奶:104毫克。 半袋强化牛奶:150毫克。 100克豆腐:138毫克。(豆腐种类不同,含钙量也不同。这里指的是北豆腐或老豆腐的含钙量。) 100克青豆:200毫克。 100克油菜:140毫克。 100克苋菜:180毫克。 补钙要记得补维生素D 美国儿科学会建议补充维生素D的时间比国内儿科医生建议的时间更长,包括整个儿童时期和青少年时间,剂量任为400IU/天。 维生素D有助于人体吸收钙这样的矿物质,强壮骨骼与牙齿。维生素D 也被称为“阳光维生素”,因为在阳光照射下,人体可以自己合成这种维生素。但维生素D 的合成会受到南北方差异,季节差异,天气差异,烟雾、云、皮肤颜色深、SPF为8以上的防晒霜的影响,因此,最好确保你的孩子能每天从食物中(强化D的鲜奶、配方奶等)获取200国际单位的维生素D。如果遇到南方梅雨季节,或者是北方寒冷季节,无法在户外通过晒太阳获得维生素D,可以考虑适当补充一些维生素D 。 维生素D的一些最佳食物来源
实验一食品中钙、镁、铁含量测定 [实验目的和要求] 1、了解有关食品样品分解处理方法; 2、掌握食品样品中测定钙、镁、铁方法; 3、掌握实际样品中干扰排除方法。 [实验内容] 1、固体样品、液体样品的制备; 2、EDTA溶液标定; 3、采用络合滴定法测定试样中钙、镁含量; 4、邻二氮菲光度法测定试样中铁含量。 [主要仪器与试剂] 仪器:烘箱、坩埚、电炉、250mL容量瓶、50mL容量瓶、烧杯、移液管、锥形瓶、滴定管、铁架台、玻璃棒等。 试剂:0.005mol/L EDTA溶液,20%NaOH,pH=10氨性缓冲溶液,1:3三乙醇胺,1:1 HCl,钙指示剂:配成1:100氯化钠固体粉末,基准物质CaCO3,1g/L铬黑T指示剂:称取0.1g铬黑T溶于75mL三乙醇胺和25mL乙醇中,10μg/mL铁标准溶液,0.15%邻二氮菲,10%盐酸羟胺,1mol/LNaAc溶液。 实验二离子对HPLC对环境水中痕量NO3-和NO2-的分离测定 [实验目的和要求] 1、学习离子对高效液相色谱分析无机离子的原理。 2、了解离子对高效液相色谱与离子色谱的异同。 3、掌握现代高效色谱分析仪器的操作及应用。 [实验内容] 1、配制试剂和缓冲溶液,并调pH值; 2、配制硝酸根和亚硝酸根标准溶液; 3、设定高效液相色谱分析参数; 4、硝酸根和亚硝酸根标准溶液及环境水样品经0.45 μm滤纸过滤后进行液相色谱分析。 [主要仪器与试剂] 仪器:电子天平、容量瓶、各种量程移液枪、离心机、C18反相色谱柱(150 x 2.00 mm i.d., 5 μm)、C18 保护柱(10mm)、0.45μm液相色谱滤纸、高效液相色谱流动相过滤装置、高效液相色谱仪(Agilent 1200 HPLC)。
补钙的时机与钙剂的选择 如何判断宝宝缺钙? 宝宝身体内缺钙的主要原因是缺乏维生素D,维生素D可以促进钙的吸收和利用。当宝宝体内维生素D不足时,钙的吸收就会减少。宝宝骨骼的生长发育受到了影响,便出现了“佝偻病”'也就是大家通常所说的“缺钙”。 判断宝宝是否缺钙可从以下几个方面观察: 1·出汗 缺少维生素D 会使宝宝出现与室温、季节无关的多汗,出汗又多在入睡后的后半夜,多为头部出汗。宝宝因汗多而头痒,躺着时喜欢磨头止痒,时间久了,后脑勺处的头发被磨光了,就形成枕秃圈(医学上称环形脱发)。 2·精神烦躁 宝宝烦躁磨人、不听话、爱哭闹、对周围环境不感兴趣、不如以往活泼、脾气怪等。 3·睡眠不安 宝宝不易入睡,易惊醒、夜惊、早醒,醒后哭闹难止。 4·出牙晚 正常宝宝4~8个月开始出牙,而有的“缺钙”宝宝到1岁半时仍未出牙。 5·前囟门闭合晚 正常宝宝1岁半前囟门闭合,“缺钙”宝宝则前囟门宽大,闭
合延迟。 6·其他骨骼异常表现 方颅;肋缘外翻;胸部肋骨上有像算盘珠子一样的隆起,医学上称作“肋骨串珠”;胸骨前凸或下缘内陷,医学上称作“鸡胸”和“漏斗胸”;当宝宝站立或行走时,由于骨头较软,身体的重力使宝宝的两腿向内或向外弯曲,就是所谓的“X”形腿或“O”形腿。 7·免疫功能差 宝宝容易发生上呼吸道感染、肺炎、腹泻等疾病。 爸爸妈妈如果观察到宝宝在以上项目中占了2~3项以上,就要带宝宝去医院,明确宝宝是否患了佝偻病.,以便及时治疗。什么时候开始补钙?要持续到什么时候为止?饮食正常的宝宝也要补钙吗? 在宝宝生长发育迅速期,需要补充鱼肝油,以保证食物中钙有效地吸收。宝宝从出生后2~4周就要加服维生素D,预防“缺钙”了。每天需要维生素D的剂量推荐是400~800国际单位,一直持续到2岁左右,如果2岁时正值冬天,则延长到冬天结束。 对饮食正常的宝宝,鱼肝油的补充也是必要的。在维生素D 摄入适量的情况下,为了满足宝宝每天钙的需要量,可以补充一些钙剂,尤其是人工喂养的宝宝。补充钙剂的时间与补充维生素D基本相同,维生素D一定要及时补充,钙稍晚1~2个月补充也可以,尤其是母乳喂养的宝宝。对于母乳喂养的宝宝,如果饮食中含钙量高,不额外补充钙剂也是可以的,但鱼肝油不补通常
EDTA法测补钙剂中的钙含量 一、实验原理 钙制剂一般用酸溶解后调节pH=12-13,减少Mg2+干扰。以钙指示剂为指示剂,指示剂与钙离子生成酒红色络合物,当用EDTA注定终点时,游离出指示剂,溶液呈现蓝色。 二、主要试剂和仪器 试剂: EDTA(0.01mol/L):称取2g EDTA二钠盐于250ml的烧杯中,加水溶解后稀释至500ml,储于聚乙烯瓶中备用。 CaCO 3标准溶液(0.01mol/L):准确称取基准物质CaCO 3 0.25g左右,先用 少量水润湿,再逐滴加入2mol/L HCl至恰好完全溶解,转移到250ml容量瓶中,水稀释至刻度。 NaOH (5mol/L)。 HCl (2mol/L)。 仪器:分析天平,研钵等 三、实验步骤 1.EDTA浓度的标定 准确移取25.00ml CaCO 3 标准溶液3份分别于250ml锥形瓶中,加2mlNaOH 溶液,钙指示剂30mg,EDTA滴定至蓝色。 2.钙制剂中钙含量的测定 将洁净的纸片放入研钵中,再将药片放入研钵中研磨。准确称取0.2-0.4g 研碎了的药片,加入2mol/L HCl约10ml,加热溶解完全。加蒸馏水继续蒸发除去过量的酸至pH=6-7,转移到250ml容量瓶中,蒸馏水定容,摇匀。准确移取上述溶液25.00ml于250ml锥形瓶中,加入NaOH溶液5ml,蒸馏水25ml,摇匀,加入钙指示剂30mg,用0.01mol/L EDTA标准溶液滴至蓝色。记录消耗
EDTA的含量。 四、数据处理 根据滴定所耗体积计算钙的含量。将结果与补钙剂中所标示的含量进行对比分析。 由公式得出关系: 五、实验结果 1.新盖中盖高钙片中钙含量测定 V EDTA (ml) C EDTA(mol/L) 平均C EDTA(mol/L) 相对偏差平均相对偏差 1 21.55 0.1116 0.1115 0.09% 0.03% 2 21.58 0.1114 -0.09% 3 21.57 0.1115 0 V EDTA (ml) W CaCO3平均W CaCO3相对偏差平均相对偏差 1 12.90 51.95% 51.98% 0.06% 0.04% 2 12.92 52.03% -0.1% 3 12.90 51.95% 0.06% 注:在测定EDTA浓度时m CaCO3=0.2407g,在测定药品中该含量时m药=0.2771g 根据该药说明书,每2.5g药片含CaCO31.25g,即 W CaCO3=50% 2. 凯思立D3钙含量的测定 V EDTA (ml) C EDTA (mol/L) 平均C EDTA(mol/L) 相对偏差平均相对偏差 1 26.99 0.00935 0.00937 -0.21% 0.25% 2 26.85 0.00940 0.30% 3 26.92 0.00937 0 V EDTA (ml) W CaCO3平均W CaCO3相对偏差平均相对偏差
第7卷 第8期 食品安全质量检测学报 Vol. 7 No. 8 2016年8月 Journal of Food Safety and Quality Aug. , 2016 *通讯作者: 李卫群, 高级工程师, 主要研究方向为光谱分析。E-mail: lwq@https://www.doczj.com/doc/424868450.html, *Corresponding author: LI Wei-Qun, Senior Engineer, Hangzhou Wahaha Group Co., Ltd., Hangzhou 310018, China. E-mail: lwq@https://www.doczj.com/doc/424868450.html, 微波消解-原子吸收法测定食品中的钙含量 李卫群*, 汪涓涓, 徐玲玲, 朱 慧 (杭州娃哈哈集团有限公司, 杭州 310018) 摘 要: 目的 建立微波消解-原子吸收法测定食品中钙含量的方法。方法 采用微波消解法对样品进行前处理, 在检测样品中加入氯化镧(8 g/L)屏蔽剂, 用火焰原子吸收法进行检测。比较经消解后样品中不同的硝酸浓度对钙含量测定结果的影响, 探究微波消解法测定食品中钙含量时结果偏低的原因。结果 经微波消解后, 样品中的硝酸含量大于0.5%时, 会导致钙含量的检测结果偏低。经湿法消解处理的样品, 其加标回收率在97.2%~106.0%之间, 经微波消解法处理的样品, 其加标回收率在96.8%~104.0%之间。将采用上述两种消解方法处理的样品的钙含量检测结果进行比较, 测定值间的相对误差为1.64%~3.08%, 在可接受范围内。结论 微波消解-原子吸收法可以用于食品中钙含量的检测。 关键词: 微波消解法; 原子吸收法; 钙含量 Determination of calcium content in food by microwave digestion-atomic absorption spectrometry LI Wei-Qun *, WANG Juan-Juan, XU Ling-Ling, ZHU Hui (Hangzhou Wahaha Group Co ., Ltd., Hangzhou 310018, China ) ABSTRACT: Objective To establish a method for determination of calcium content in foods by microwave digestion-atomic absorption spectrometry. Methods The samples were pretreated with microwave digestion and detected by flame atomic absorption spectrometry with lanthanum chloride (8 g/L) as screening agent. The effects of different concentrations of nitric acid in sample after digestion on the determination of calcium content were compared for exploring the causes of lower calcium content detected by atomic absorption spectrometry with microwave digestion. Results The detection results of calcium content were lower when the concentration of nitric acid residue in samples was larger than 0.5% after microwave digestion. The recoveries of samples treated by wet digestion were between 97.2%~106.0% and the samples treated by microwave digestion were between 96.8%~104.0%. The detection results of calcium content from above methods were compared and the relative errors (RE) were between 1.64%~3.08%, which were in the acceptable range. Conclusion Microwave digestion-atomic absorption spectrometry can be used for the detection of calcium content in foods. KEY WORDS: microwave digestion method; atomic absorption spectrometry; calcium content 1 引 言 钙是人体的必需元素之一, 是构成骨骼与牙齿的重 要成份, 在调节细胞代谢、维持肌肉收缩和保证神经传导 等方面都有重要作用。缺钙将可能导致严重的疾病, 但是过量补钙则会影响铁和锌的吸收[1]。因此, 准确测定食品
儿童补钙重要性 儿童补钙食谱 一、适合4个月—1岁宝宝的补钙食谱 1、蛋花豆腐羹 原料:鸡蛋、南豆腐、骨汤150克、小葱末等。 制法:鸡蛋打散,豆腐捣碎,骨汤煮开;下入豆腐小火煮,适当进行调味,并撒入蛋花,最后点缀小葱末。 营养分析:鸡蛋、豆腐不仅含有丰富的钙,吃起来也又软又嫩,特别适合 给还不太会咀嚼的6个月左右的小宝贝吃。 2、鱼菜米糊 原料:米粉(或乳儿糕),鱼肉和青菜各15-25克,食盐少许。 制法:将米粉酌加清水浸软,搅为糊,入锅,旺火烧沸约8分钟;将青菜、鱼肉洗净后,分别剁泥共入锅中,续煮至鱼肉熟透,调味后即成。 营养分析:鱼肉中富含钙,不仅能够促进宝贝长个子,为骨骼发育添砖加瓦,还可促进脑发育,满足身体对多种营养素的需求,不妨经常给4个月以上 的宝贝做一些吃。 二、适合2岁—3岁宝宝的补钙食谱 1、松子毛豆炒干丁 原料:松子200克,香干4片,毛豆50克,姜末适量,色拉油25克, 枸杞子10克,精盐、糖、味精、麻油、高汤适量。 制作:将松子入锅上火炒香备用。毛豆用滚水烫熟后再经冷水冲洗,沥水 备用。香干切成小丁,胡萝卜切成碎未,枸杞子冲洗干净备用。色拉油入锅, 油热后爆姜末出香味,再倒入香干、枸杞子调味,煸炒少许时间,倾入毛豆, 拌炒均匀,放入调料和适量高汤。收汤后,洒上松子拌匀,出锅。淋上麻油,
盛入盘中放上装饰菜即成。 2、鱼松 原料:黄鱼肉750克、料酒50克,盐75克,葱、姜各15克,大料2粒,味精少许,麻油25克。 制作:鱼肉去皮,洗净后切7厘米长鱼段,葱切段,姜切片。将鱼段放在 盘内,加葱段、姜片、花椒、大料、料酒,上笼用旺火蒸20分钟取出,拣去 调料、控干水分,顺着纹理撕成丝。炒勺置火上,放入油,油热投入鱼丝,加盐、味精,炒至鱼肉水分干时,改小火边炒边揉,至鱼肉发松发亮时即成。 三、适合4—6岁宝宝的补钙食谱 1、海带拌腐竹 原料:水发腐竹200克,水发海带200克,熟猪瘦肉100克,胡萝卜25克,黄瓜40克,麻油15克,熟豆油25克,酱油、醋、盐、味精、蒜瓣、芝 麻酱、香葱各适量。 制作:腐竹切寸长丝,入开水中焯透,捞出过凉,沥净水。海带、胡萝卜、黄瓜洗净后,均切寸长细丝,熟瘦肉切丝,香葱、蒜瓣各适量,切末。将各种 丝料配备码好入盘内,洒上香葱末,上桌时加入全部调料,拌匀即食。 2、油菜海米豆腐羹 原料:豆腐750克,油菜125克,海米30克,植物油75克,麻油10克,味精7.5克,盐8克,水淀粉20克,葱花10克。 制作:豆腐切成1.5厘米见方的丁,海米用开水泡发后切成碎沫,油菜摘 洗干净切碎。将油放入锅内,热后下入葱花炝锅,投入豆腐、海米末,翻炒几 下再放油菜,炒透后加入盐,勾芡,最后放入味精和麻油即成。
. 班级11 化本学号11111314145 周聪聪(合作者司腾达)日期5月14 实验名称:食品中钙、镁、铁含量测定(指导师:刘爱丽) 一、研究背景(前言) 人体中含有许多元素,这些元素对人体起着至关重要的作用,每种元素都是不可缺少的,而人体中的元素来源就是来自食物,所以,对食物中含有哪些元素,以及元素的含量的测定是至关重要的一个研究。钙、镁、铁等无机元素是人体生长和新陈代谢过程中必不可少的营养元素,人体中缺少这些元素就会导致人体发生各种生长障碍,尤其对儿童和老人表现得更为突出【1】。钙素有“生命元素”之称,除影响人体的骨骼、牙齿外,还有调节心率、控制炎症和水肿、维持酸碱平衡、调节激素分泌,激发某些酶的活性、参与神经和肌肉活动以及神经递质的释放等作用,对维持身体健康、促进身体发育具有十分重要的作用。镁是人体维持正常生活所必需的微量元素,也是很多生化代谢过程中必不可少的一种元素,特别对与氧化磷酸化有关的酶系统的生物活性极为重要【2】。 近年来,随着人们生活水平的提高,各种补铁、补钙的营养保健品和药品应运而生。一些医学专家指出,对人体最好的进补方式是食物进补,本实验作为食物中营养元素含量系剐研究中的一部分,重点研究了大豆中铁、钙、镁的含量,以期对人们选择饮食提供指导。
(1)了解有关食品样品分解处理方法。 (2)掌握食品样品中测定钙、镁、铁方法。 (3)掌握实际样品中干扰排除方法。 (4)运用所学过的知识设计有关食品样品中钙、镁、铁综合测试方案,提高分析问题和解决问题的能力。 三、实验原理 样品(蔬菜、豆类、饮料、牛奶)经烘干、粉碎、灰化、灼烧、酸提取后,可采用络合滴定法,在碱性( pH=12)条件下,以钙指示剂指示终点,以EDTA 为滴定剂,滴定至溶液由紫红色变蓝色,计算试样中钙含量。另取一份试液,用氨性缓冲溶液控制溶液pH = 10,以铬黑T为指示剂,用EDTA 滴定至溶液由紫红色变蓝色为终点,与钙含量差减得镁含量。试样中铁等干扰可用适量的三乙醇胺掩蔽消除。可用邻二氮菲光度法测定铁的含量。 四、实验部分 1、主要药品和仪器设备 药品:0.005mo l/L EDTA 溶液,20% NaOH,pH = 10氨性缓冲溶液,1: 3三乙醇胺,1: 1HCl,钙指示剂:配成1:100氯化钠固体粉末,1g /L铬黑T指示剂:称取0. 1g铬黑T溶于75mL三乙醇胺和25mL乙醇中,基准物质CaCO3,10ug /mL 铁标准溶液,0. 15% 邻二氮菲,10% 盐酸羟胺,1mo l/L NaAc溶液。 仪器:锥形瓶、250ml容量瓶、50 ml容量瓶、酸式滴定管、坩埚
钙制剂中钙含量的测定 ——EDTA法 一、实验原理 钙制剂中主要成份为碳酸钙、淀粉等,用(I+I)HCl将其溶解即可。而含钙乳钦料、奶粉等样品处理则需用马福炉高温灼烧后.再用(1+1)HCl溶解. 本实验中EDTA滴定法测定钙含量时.在pH=lO条件下,以铬蓝黑R为指示剂,并加入少量三乙醇胺来掩蔽样品中的Fe3+等干扰离子,用EDTA标准溶液来滴定Ca2+. 二、试剂仪器 仪器:滴定管,2.OmL移液管, 25mL锥形瓶,漏斗,电炉,电子天平 试剂: l EDTA滴定法 NaOH,20%三乙醇胺,20%NaOH.钙指示剂,0.002mol/L EDTA,蒸馏水 三. 实验步骤 1.样品处理 钙制剂处理方法:准确称取1克左右钙制剂,加蒸馏水定容至100mL容量瓶中,摇匀。 2.EDTA滴定法操作步骤 常量法:准确移取上述试液5.OOmL,加入20%三乙醇胺5mL,蒸馏水30mL,20%NaOH 5ml,适量的钙指示剂,用EDTA标准溶液滴至溶液由粉红色变为蓝色即为终点。
微量法:用移液管准确移取上述试液2.OmL,加入lmL 20%三乙醇胺,5mL 蒸馏水,1ml 20%NaOH溶液,5滴0.5%铬蓝黑R,用0.01mol/L EDTA标准溶液滴至溶液粉红变为蓝色即为终点(3.000mL微型滴定管及2.00mL移液管等仪器均己校正)。 计算钙含量: 四、实验结果与教据处理 1.二种滴定法潮定的结果对照 用叭滴定法(包括常量法和微量法)测定了一批钙制剂及加钙钦品中的钙含量,二种方法的所得结果见表1. 表EDTA滴定法(常量法和微量法)测定钙含量的结果 样品名称EDTA滴定法(常量) mg/100g EDTA滴定法(微量) mg/100g 如;CAO ---------- ---------- 如;CACO3 ---------- ---------- 如;CAC2 ---------- ---------- 2.二种滴定法的回收率 选取了CAO和CACO3测定了二种滴定法的回收率,EDTA法(常量)的回收率为98.4%-99%,EDTA滴定法(微量)的回收率为95.9%-98.7%.符台分析方法的要求。(表2)