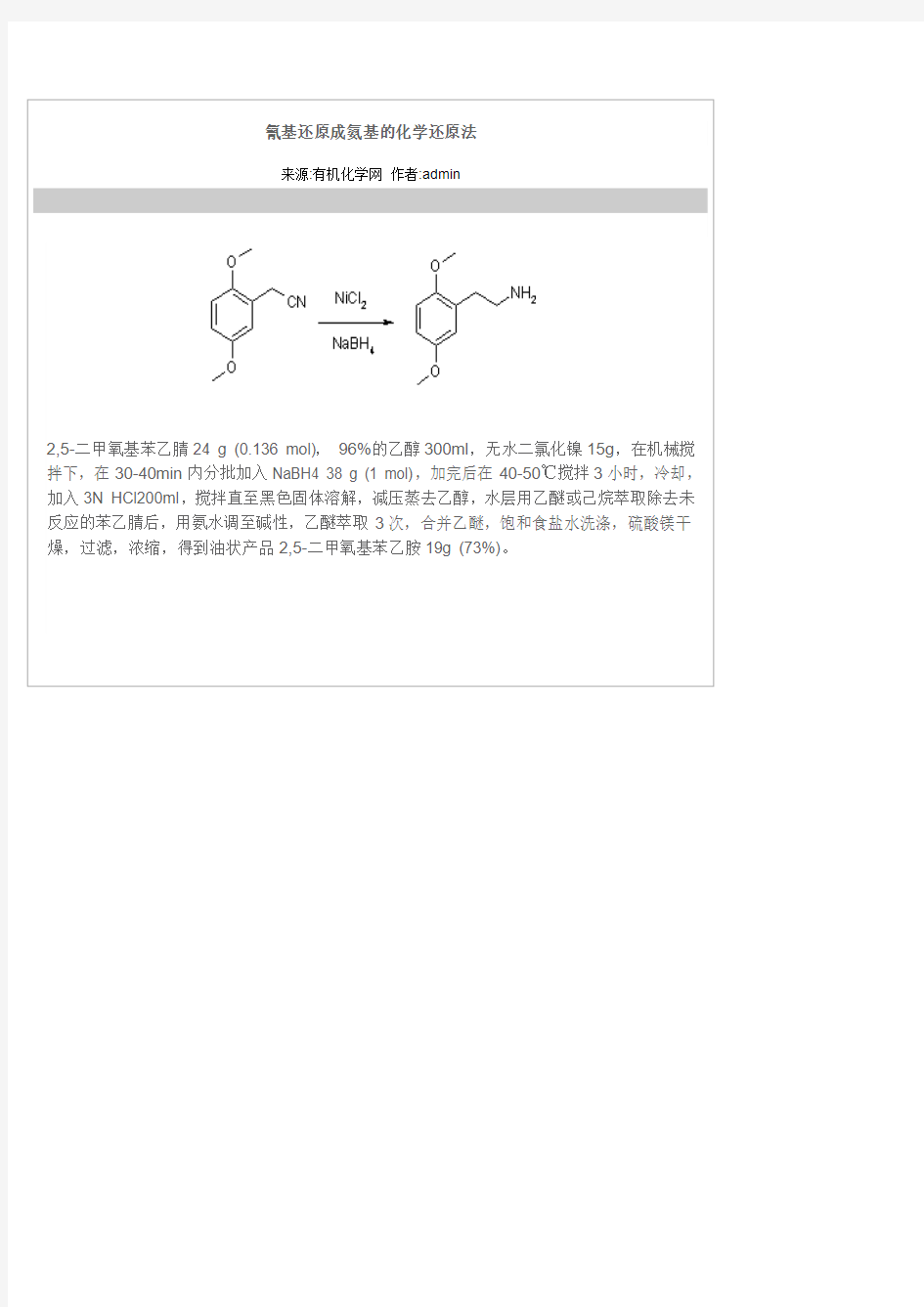
氰基还原成氨基的化学还原法
来源:有机化学网作者:admin
2,5-二甲氧基苯乙腈24 g (0.136 mol),96%的乙醇300ml,无水二氯化镍15g,在机械搅拌下,在30-40min内分批加入NaBH4 38 g (1 mol),加完后在40-50℃搅拌3小时,冷却,加入3N HCl200ml,搅拌直至黑色固体溶解,减压蒸去乙醇,水层用乙醚或己烷萃取除去未反应的苯乙腈后,用氨水调至碱性,乙醚萃取3次,合并乙醚,饱和食盐水洗涤,硫酸镁干燥,过滤,浓缩,得到油状产品2,5-二甲氧基苯乙胺19g (73%)。
三、氧化还原反应 1、准确理解氧化还原反应的概念 1.1 氧化还原反应各概念之间的关系 (1)反应类型: 氧化反应:物质所含元素化合价升高的反应。 还原反应:物质所含元素化合价降低的反应。 氧化还原反应:有元素化合价升高和降低的反应。 (2)反应物: 氧化剂:在反应中得到电子(化合价降低)的物质-----表现氧化性 还原剂:在反应中失去电子(化合价升高)的物质-----表现还原性 (3)产物: 氧化产物:失电子被氧化后得到的产物-----具有氧化性 还原产物:得电子被还原后得到的产物-----具有还原性 (4)物质性质: 氧化性:氧化剂所表现出得电子的性质 还原性:还原剂所表现出失电子的性质 注意:a.氧化剂还原剂可以是不同物质,也可以是同种物质 b氧化产物、还原产物可以是不同物质,也可以是同种物质 C.物质的氧化性(或还原性)是指物质得到(或失去)电子的能力,与物质得失电子数目的多少无关(5)各个概念之间的关系如下图 1.2 常见的氧化剂与还原剂 (1)物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。 ①元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如+7价的Mn和+6价的S ②元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如0价的S和+4价的S ③元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如-2价的S (2)重要的氧化剂 ①活泼非金属单质,如F2、Cl2、Br2、O2等。 ②元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐等,如MnO2,NO2;浓H2SO4,HNO3;
实验名称:水热法制备纳米TiO2 水热法属于液相反应的范畴,是指在特定的密闭反应器中采用水溶液作为反应体系,通过对反应体系加热、加压而进行无机合成与材料处理的一种有效方法。在水热条件下可以使反应得以实现。在水热反应中,水既可以作为一种化学组分起反应并参与反应,又可以是溶剂和膨化促进剂,同时又是一种压力传递介质,通过加速渗透反应和控制其过程的物理化学因素,实现无机化合物的形成和改进。 水热法在合成无机纳米功能材料方面具有如下优势:明显降低反应温度(100-240℃);能够以单一步骤完成产物的形成与晶化,流程简单;能够控制产物配比;制备单一相材料;成本相对较低;容易得到取向好、完美的晶体;在生长的晶体中,能均匀地掺杂;可调节晶体生成的环境气氛。 一.实验目的 1.了解水热法的基本概念及特点。 2.掌握高温高压下水热法合成纳米材料的方法和操作的注意事项。 3.熟悉XRD操作及纳米材料表征。 4.通过实验方案设计,提高分析问题和解决问题的能力。 二.实验原理 水热法的原理是:水热法制备粉体的化学反应过程是在流体参与的高压容器中进行,高温时,密封容器中有一定填充度的溶媒膨胀,充满整个容器,从而产生很高的压力。为使反应较快和较充分的进行,通常还需要在高压釜中加入各种矿化物。 水热法一般以氧化物或氢氧化物(新配置的凝胶)作为前驱物,他们在加热过程中溶解度随温度的升高而增加,最终导致溶液过饱和并逐步形成更稳定的氧化物新相。反应过程的驱动力是最后可溶的的前驱物或中间产物与稳定氧化物之间的溶解度差。 三.实验器材 实验仪器:10ml量筒;胶头滴管;50ml烧杯;高压反应釜;烘箱;恒温磁力搅拌器。 实验试剂:无水TiCl4;蒸馏水;无水乙醇。 四.实验过程 1.取10mL量筒, 50mL的烧杯洗净并彻底干燥。 2.取适量冰块放入烧杯中,并加入一定的蒸馏水形成20mL的冰水混合物,用恒温磁力搅拌器搅拌,速度适中。
溶剂热法是在水热法的基础上发展起来的,指密闭体系如高压釜内,以有机物或非水溶媒为溶剂,在一定的温度和溶液的自生压力下,原始混合物进行反应的一种合成方法。它与水热反应的不同之处在于所使用的溶剂为有机物而不是水。水热法往往只适用于氧化物功能材料或少数一些对水不敏感的硫属化合物的制备与处理,涉及到一些对水敏感(与水反应、水解、分解或不稳定)的化合物如Ⅲ一V族半导体、碳化物、氟化物、新型磷(砷)酸盐分子筛三维骨架结构材料的制备与处理就不适用,这也就促进了溶剂热法的产生和发展。 为有机溶剂而不是水。在溶剂热反应中,通过把一种或几种前驱体溶 的比较活泼,反应发生,产物缓慢生成。该过程相对简单而且易于控
制,并且在密闭体系中可以有效的防止有毒物质的挥发和制备对空气敏感的前驱体。 另外,物相的形成、粒径的大小、形态也能够控制,而且,产物的分散性较好。在溶剂热条件下,溶剂的性质(密度、粘度、分散作用)相互影响,变化很大,且其性质与通常条件下相差很大,相应的,反应物(通常是固体)的溶解、分散过及化学反应活性大大的提高或增强。这就使得反应能够在较低的温度下发生。 水热法(Hydrothermal)是19 世纪中叶地质学家模拟自然界成矿作用而开始研究的。1900 年后科学家们建立了水热合成理水热法论,以后又开始转向功能材料的研究。目前用水热法已制备出百余种晶体。水热法又称热液法,属液相化学法的范畴。是指在密封的压力容器中,以水为溶剂,在高温高压的条件下进行的化学反应。水热反应依据反应类型的不同可分为水热氧化、水热还原、水热沉淀、水热合成、水热水解、水热结晶等。其中水热结晶用得最多。在这里简单介绍一下它的原理: 水热结晶主要是溶解———再结晶机理。首先营养料在水热介质里溶解,以离子、分子团的形式进入溶液。利用强烈对流(釜内上下部分的温度差而在釜内溶液产生) 将这些离子、分子或离子团被输运到放有籽晶的生长区(即低温区) 形成过饱和溶液,继而结晶。溶剂热法(Solvothermal)是将反应物按一定比例加入溶剂,然后放到高压釜中以相对较低的温度反应。在这种方法中,溶剂处在高于其临界点的温度和压力下,可以溶解绝大多数物质,从而使常规条件下不能发生的反应可以进行,或加速进行。溶剂的作用还在于它可以在
化学还原法制备石墨烯的研究进展近年来,研究人员利用多种方法开展了石墨烯的制备工作,主要包括化学剥离法、金属表面外延法、SiC表面石墨化法和化学还原法等[1]。目前应用最广泛的合成方法是化学还原法。石墨烯在氧化的过程中会引入一些化学基团,如羧基(-COOH)、羟基(-OH)、羰基(-C = O)和环氧基(-C-O-C)等,这些基团的生成改变了C-C之间的结合方式,导致氧化石墨烯的导电性急剧下降,并且使具有的各种优异性能也随之消失。因此,对氧化石墨烯进行还原具有非常重要的意义,主要是先将氧化石墨烯分散(借助高速离心、超声等)到水或有机溶剂中形成稳定均相的溶胶,再按照一定比例用还原剂还原,得到单层或者多层石墨烯。还原得到的石墨烯有望在电子晶体管、化学传感器、生物基因测序以及复合材料等众多领域广泛应用。 目前,制备氧化石墨烯的技术已经相当成熟,其层间距(0.7~1.2 nm)较原始石墨烯层间距大,更有利于将其他物质分子插入。研究表明氧化石墨烯表面和边缘有大量的羟基、羧基等官能团,很容易与极性物质发生反应,得到改性氧化石墨烯。氧化石墨烯的有机改性可使其表面由亲水性变为亲油性,表面能降低,从而提高与聚合物单体或聚合物之间的相容性,增强氧化石墨烯与聚合物之间的粘接性。如果使用适当的剥离技术(如超声波剥离法、静电斥力剥离法、热解膨胀剥离法、机械剥离法、低温剥离法等),那么氧化石墨烯就能很容易的在水溶液或有机溶剂中分散成均匀的单层氧化石墨烯溶液,使利用其反应得到石墨烯成为可能。氧化还原法最大的缺点是制备的石墨烯有一定的缺陷,因为经过强氧化剂氧化得到的氧化石墨烯,并不一定能被完全还原,可能会损失一部分性能,如透光性、导热性,尤其是导电性,所以有些还原剂还原后得到的石墨烯在一定程度上存在不完全性,即与严格意义上的石墨烯存在差别。但氧化还原方法价格低廉,可以制备出大量的石墨烯,所以成为目前最常用制备石墨烯的方法。
编订:__________________ 单位:__________________ 时间:__________________ 化学还原反应的危险性及预防措施(正式) Deploy The Objectives, Requirements And Methods To Make The Personnel In The Organization Operate According To The Established Standards And Reach The Expected Level. Word格式 / 完整 / 可编辑
文件编号:KG-AO-2771-98 化学还原反应的危险性及预防措施 (正式) 使用备注:本文档可用在日常工作场景,通过对目的、要求、方式、方法、进度等进行具体、周密的部署,从而使得组织内人员按照既定标准、规范的要求进行操作,使日常工作或活动达到预期的水平。下载后就可自由编辑。 如硝基苯在盐酸溶液中被铁粉还原成苯胺、邻硝基苯甲醚在碱性溶液中被锌粉还原成邻氨基苯甲醚、使用保险粉、硼氢化钾、氢化锂铝等还原剂进行还原等。 还原过程的危险性分析及防火要求: (1)无论是利用初生态还原,还是用催化剂把氢气活化后还原,都有氢气存在(氢气的爆炸极限为4%—75%),特别是催化加氢还原,大都在加热、加压条件下进行,如果操作失误或因设备缺陷有氢气泄漏,极易与空气形成爆炸性混合物,如遇着火源即会爆炸。所以,在操作过程中要严格控制温度、压力和流量;车间内的电气设备必须符合防爆要求。电线及电线接线盒不宜在车间顶部敷设安装;厂房通风要好,应采
用轻质屋顶、设置天窗或风帽,以使氢气及时逸出;反应中产生的氢气可用排气管导出车间屋项,并高于屋脊2m以上,经过阻火器向外排放;加压反应的设备应配备安全阀,反应中产生压力的设备要装设爆破片;安装氢气检测和报警装置。 (2)还原反应中所使用的催化剂雷氏镍吸潮后在空气中有自燃危险,即使没有着火源存在,也能使氢气和空气的混合物引燃形成着火爆炸。因此,当用它们来活化氢气进行还原反应时,必须先用氮气置换反应器内的全部空气,并经过测定证实含氧量降到标准后,才可通人氢气;反应结束后应先用氮气把反应器内的氢气置换干净,才可打开孔盖出料,以免外界空气与反应器内的氢气相遇,在雷氏镍自燃的情况下发生着火爆炸,雷氏镍应当储存于酒精中,钯碳回收时应用酒精及清水充分洗涤,过滤抽真空时不得抽得太干,以免氧化着火。 (3)固体还原剂保险粉、硼氢化钾、氢化铝锂等都是遇湿易燃危险品,其中保险粉遇水发热,在潮湿空
2006年9月贵金属 Sep. 2006 第27卷第3期Precious Metals V ol. 27, No. 3 乙二醇水热还原法制备纳米银 徐惠,曲晓丽,翟钧,王毅,史建新(兰州理工大学石油化工学院,甘肃兰州 730050)Preparation of Silver Nanoparticles by Hydrothermal Reduction of Ethylene Glycol XU Hui, QU Xiaoli, ZHAI Jun, WANG Yi, SHI Jianxin ( College of Petrochemical Engineering, Lanzhou University of Technology, Lanzhou, Gansu 730050, China ) Abstract:Ethylene glycol was used as the solvent and reductant for preparation of silver nanoparticles with the method of hydrothermal reduction. The structure of the particles was characterized by X-ray diffraction(XRD), transmission electron microscopy(TEM) and UV-Vis adsorption spectrum. The results indicated that the silver nanoparticles have fcc polycrystalline structure and the mean diameter is about 30nm. The absorption peak is about 380nm. The influences of dispersant and water content on the size of silver particles were also studied. Keywords: Metal materials; Silver nanoparticles; Ethylene glycol; Hydrothermal reduction 摘要:利用乙二醇在高温下的还原特性,在水热条件下制备了纳米银粒子,并通过透射 电镜、X射线衍射、紫外吸收光谱对其结构进行了表征。研究结果表明:所制备的纳米银 具有面心立方相的多晶结构,平均粒径在30nm左右,紫外吸收峰的位置在380 nm左右。 分散剂和体系中含水量对纳米银的粒径有一定影响。 关键词:金属材料;纳米银微粒;乙二醇;水热还原 中图分类号:O614.122 文献标识码: A 文章编号:1004-0676(2006)03-0022-03 纳米材料的制备是当前材料研究的一个热点课题,由于介观效应,纳米材料表现出独特的物理、化学性质,如小尺寸效应、量子尺寸效应、表面效应和宏观量子隧道效应而不同于常规材料的热、光、电、磁、催化和敏感等特性[1]。纳米银是一种十分有用的材料,在电学、光学和催化等众多方面具有优异的性能,现已广泛应用于陶瓷材料、环保材料和涂料等领域,因此纳米银粒的制备和性能研究越来越受到研究人员的极大关注[2~4]。 近年来,纳米银制备技术迅速发展,方法多种多样。按实施状态可分为乳液法、溶液法、气相法;按反应条件分为还原法、光照法、超声法、加热法、电解法;此外,γ射线辐射法也逐渐应用于纳米银的制备工艺中。上述方法各具特点,其中化学还原法因为所需实验条件简单、易于控制而得到很好应用[5,6],但其通常所用的还原剂如肼、硼氢化钠、甲醛等均带有一定的毒性、从而对环境造成污染。自从发现乙二醇在高温下具有还原特性以来,利用该特性还原标准电极电势偏低的物 收稿日期:2005-10-31 基金项目:甘肃省自然科学基金项目资助(ZS032-B25-023)。 作者简介:徐惠,女,教授, 主要从事纳米金属的制备及性能研究工作。 E-mail: xuhui@https://www.doczj.com/doc/422988988.html,
Vol.25No.2安徽工业大学学报第25卷第2期April2008J.ofAnhuiUniversityofTechnology2008年4月 文章编号:1671-7872(2008)02-0120-03 化学还原法制备银纳米颗粒 晋传贵1a,姜山1a,陈刚1b,2 (1.安徽工业大学a.材料科学与工程学院;b.冶金与资源学院,安徽马鞍山243002;2.马鞍山钢铁股份有限公司技术中心,安徽马鞍山243000) 摘要:在70℃时采用聚乙烯吡咯烷酮(PVP)和氢氧化钠的混合水溶液,利用葡萄糖还原硝酸银制备了银纳米颗粒。采用X射线衍射(XRD)、能量分散谱(EDS)和扫描电子显微镜(SEM)对所制备的银纳米颗粒进行了表征。结果表明该法制备的银颗粒为纯的银纳米颗粒,呈球形,粒径分布集中在20~50nm之间。 关键词:银;纳米颗粒;化学还原法 中图分类号:O614.122文献标识码:A PreparationofSilverNanoparticlesbyChemicalReductionMethod JINChuan-gui1a,JIANGShan1a,CHENGang1b,2 (1.AnhuiUniversityofTechnologya.SchoolofMaterialsScienceandEngineering;b.SchoolofMetallurgyandResources,Maanshan243002,China;2.TechnologyCenter,Ma'anshanIron&SteelCo.Ltd.,Ma'anshan243000,China) Abstract:SilvernanoparticlesarepreparedbyreductionofaqueoussolutionofAgNO3inthepresenceofpolyvinylpyrrolidone(PVP)andNaOHatthetemperatureof70℃,glucosewasusedforthereductionagent.ThesilvernanoparticleswerecharacterizedbyusingX-raydiffraction(XRD),energydispersivespectrometer(EDS)andscanningelectronmicroscope(SEM).Theresultsshowedthatthesilvernanoparticlesproducedbythismethodarepureandsphericalwithnarrow-dispersedsizedistributionrangingfrom20nmto40nm. Keywords:silver;nanoparticles;chemicalreductionmethod 银纳米颗粒由于其优良的传热导电性、表面活性、表面能和催化性能,在电子、催化、光学等领域具有很大的潜在应用价值[1-2],越来越受到广泛的关注。近年来,银纳米颗粒制备技术迅速发展,制备方法多种多样。按反应条件,主要包括还原剂还原[3]、光照、电极电解、超声电化学法[4]、辐射化学还原法、微乳液法[5]等。这些方法有的工艺控制难度大、产物不稳定;有的设备较为复杂,难以批量化生产。化学还原法因其设备简单、操作方便,成为制备超细银粉的主要方法。本研究采用聚乙烯吡咯烷酮(PVP)作保护剂和价格低廉、还原能力温和的葡萄糖作还原剂,用简单工艺制备银纳米颗粒。 1实验 称取15g葡萄糖和5gPVP,配制成300mL混合水溶液,利用氢氧化钠溶液调节其pH值至11;称取6g硝酸银配制成100mL水溶液。在恒温水浴锅中将上述溶液加热至70℃,将硝酸银溶液以30滴/min的速度均匀地滴加到葡萄糖混合溶液中,搅拌15min得到黑色悬浊液。将此悬浊液离心分离,所得固体沉淀用去离子水和无水醇各洗涤3遍,于50℃下真空干燥,得黑色粉末试样。采用日本理学Rigaku公司的D/Max-2500型X射线衍射仪表征样品的晶型和粒度;采用扫描电子显微镜(philips-xl-30)附属能谱仪测定样品成收稿日期:2007-09-18 基金项目:863项目资助(2006AA03Z466) 作者简介:晋传贵(1966-),男,安徽无为人,教授,博士。
还原反应 一、C还原氧化铜 1、实验装置 2、操作: (1)将炭和氧化铜混合均匀,放入大试管中高温加热 (2)将生成的气体通入澄清石灰水 (3)看到明显的现象后,先将导管移出石灰水,在停止加热(防止倒吸使试管炸裂) 3、现象及化学方程式 黑色固体逐渐变为红色 大试管 C + 2CuO ==== 2Cu + CO2 澄清石灰水变浑浊 小试管 CO2 + Ca(OH)2 ==== CaCO3 +H2O 思考:1CO2外,还可能有CO,生成该气体的化学方程式: C + CO==== 2 CO 2、该实验设计的缺陷:缺少尾气处理装置 相关化学反应:2Fe2O3 + 3C ==== 4Fe + 3CO2 2FeO + C ==== 2Fe + CO2 CO2 + C ==== 2CO 高温 高温 高温 高温 高温 高温
二、H2还原氧化铜 实验装置: 1、操作顺序:氢——灯——灯——氢(先通氢气的目的:排尽试管中的空气,防止加热时爆炸) 2、现象:黑色粉末逐渐变为红色,试管内壁出现水雾 3、实验结论:氢气和氧化铜加热条件下反应生成铜和水 H22O + Cu 三、CO还原氧化铜 实验装置:
1、操作步骤:先通CO 再加热(排尽试管内空气,防止加热时爆炸)。看到明显现象后,先停止加热,再停止通入CO A 、黑色固体逐渐变为红色: 2+ Cu 2、现象及化学方程式 B 、澄清石灰水变浑浊:CO 2 3 +H 2O C 、气体燃烧,产生蓝色火焰:2 3、结论:2+ Cu 还原性 4、通过该实验可得到CO 的性质 可燃性 5、装置C 的作用:进行尾气处理(防止气体污染空气) 必修一:第二章 自然环境中的物质运动和能量交换
【摘要】铬是环境中主要污染物,含铬废水如不加以有效的处理,对环境和人体都会造成极大的危害。含铬废水的处理方法很多,本文主要介绍了化学还原沉淀法处理含铬废水,结合试验,研究了原液ph值、还原剂投放量对铬离子还原的影响,获得了化学还原沉淀法处理含铬废水的最佳参数值。 【关键词】化学还原沉淀法;含铬废水;原液ph值;还原剂;去除率 铬是环境中一种主要的污染物,其化合物主要以cr(ⅱ)、cr(ⅲ)和cr(ⅵ)的形式存在,但以cr(ⅲ)和cr(ⅵ)的化合物最为常见。在环境监测中,通常以总铬和cr(ⅵ)的质量浓度来衡量环境中水质的污染程度。其毒性则以cr(ⅵ)最强。目前,对于含铬废水的处理积累了许多有效的方法,包括物理法、化学法、物理化学法及生物法。其中,主要以化学法为主,占实际工程应用的很大比重。本文结合试验,主要讨论采用化学还原沉淀法处理含铬废水,以获得了化学还原沉淀法处理含铬废水的最佳参数值,为实际应用提供实验数据。 1.实验方法 1.1 药品及仪器 分光光度计:上海奥析科学仪器有限公司,752n; ph计:贵阳学通生产,phs-25c; 电子天平:广东衡之杰公司,fa/ja系列。 丙酮(ch3coch3):分析纯; 无水亚硫酸钠(na2so3):分析纯; 氢氧化钠(naoh):分析纯; 重铬酸钾(k2cr2o7):分析纯; 焦亚硫酸钠(na2s2o5):分析纯; 高锰酸钾(kmno4):分析纯。 1.2 实验方法 (1)铬离子储备溶液的配制 配制2000mg/l的铬离子储备液。储备液需放在避光的地方,封闭严实,每次提取应当注意不能污染原液且储备液应尽快使用,不得放置过久的时间。 (2)铬浓度的测定 在酸性溶液中,铬离子与二苯碳酰二肼反应,生成紫红色化合物,其最大吸收波长为540nm,吸光度与浓度的关系符合比尔定律。cr6+与显色剂的显色反应一般控制酸度在0.05~0.3mol/l(1/2h2so4)范围,以0.2mol/l时显色最好。显色前,水样应调至中性。显色温度和放置时间对显色有影响,在15℃时,5~15min颜色即可稳定。 (3)铬标准曲线的制作 使用储备液配制10mg/l的铬铬离子标准溶液1000ml,分别取0.5ml,1ml,2ml,3ml,4ml,5ml放入50ml比色管中,然后加入蒸馏水稀释至50ml,在每个比色管中加入0.5ml硫酸(1:1)和0.5ml磷酸(1:1),摇匀后加入2ml显色剂ii,经过10min显色反应后,放入紫外线分光光度计中测量其吸光度(干扰离子忽略不计)。 从中反映了在使用相同储备液的情况下,水中铬离子的浓度与其在540nm紫外线照射下吸光度之间的线性关系。可以根据标准曲线图中得到的公式计算出已测得溶液吸光度所对应的铬离子的浓度。从相关系数r2=0.9996可以看出,此标准曲线线性关系良好。 2.结果与讨论 2.1 原液ph值对还原效果的影响 (1)亚硫酸钠
氧化反应和还原反应 1、(1)氧化反应:物质与氧发生的反应叫氧化反应。 还原反应:含氧化合物中的氧被夺去的反应叫还原反应。 (2)反应中夺取氧的物质具有还原性,是还原剂,发生氧化反应。 反应中失氧的物质具有氧化性,是氧化剂,发生还原反应。 (3)常见还原剂:木炭、一氧化碳、氢气 (4)具有还原性的物质有:H 2、CO 、 C 。 2 、关系:化合反应不一定是氧化反应,氧化反应不一定是化合反应 3、 氧化反应分类 (1)剧烈氧化:如燃烧、自燃、爆炸。 (2)缓慢氧化:如食物的腐烂、酿酒、铁生锈、呼吸作用等。 注意: ①、物质与氧气发生的反应叫氧化反应。(错)物质与氧气发生的反应是氧化反应。(对) ②、氧气中含有氧,但含有氧的物质不一定是氧气。 ③、判断氧化反应的一般标准就是看反应物中是否有氧气。 1.列反应既属于氧化反应又属于化合反应的是( )。 A.氧化汞――→加热汞+氧气 B.红磷+氧气――→点燃五氧化二磷 C.氢氧化钙+二氧化碳―→碳酸钙+水 D.蜡烛+氧气――→点燃二氧化碳+水 2.氧气是化学性质比较活泼的气体,它跟其他物质发生的化学反应( ) A .都是氧化反应 B .都是化合反应 C .都有、发光、放热、火焰 3.下列说法正确的是 ( ) A.化合反应一定是氧化反应 B .物质与氧气的反应都是化合反应 C.物质跟氧气的反应才叫做氧化反应 D .物质跟氧气只生成一种物质的反应既是化合反应又是氧化反应 4.下列物质在氧气中燃烧的主要现象及所属反应类型正确的是 ( ) A .硫—黄色火焰—氧化反应 B .红磷—蓝色火焰—化合反应 C .镁—耀眼白光—氧化反应 D .蜡烛—黄色火焰—化合反应 5.氢气还原氧化铜过程中,谁做氧化剂?( ) A.氢气 B.氧化铜 C.铜 D.水 6.用氢气还原氧化铜过程中,得到铜8.0g ,那么需要氢气多少?( ) A.小于0.2g B.等于0.2g C.大于0.2g D.不确定
化学氧化还原反应知识点 1、反应类型: 氧化反应:物质所含元素化合价升高的反应。 还原反应:物质所含元素化合价降低的反应。 氧化还原反应:有元素化合价升高和降低的反应。 2、反应物: 氧化剂:在反应中得到电子的物质 还原剂:在反应中失去电子的物质 3、产物: 氧化产物:失电子被氧化后得到的产物 还原产物:得电子被还原后得到的产物 4、物质性质: 氧化性:氧化剂所表现出得电子的性质 还原性:还原剂所表现出失电子的性质 1、物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。 1元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如+7价的Mn和+6价的S 2元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如0价的S和+4价的S 3元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如-2价的S 2、重要的氧化剂 1活泼非金属单质,如F2、Cl2、Br2、O2等。 2元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐等,如MnO2,NO2;浓 H2SO4,HNO3;KMnO4,KClO3,FeCl3等。 3过氧化物,如Na2O2,H2O2等。
3、重要的还原剂 1金属单质,如Na,K,Zn,Fe等。 2某些非金属单质,如H2,C,Si等。 3元素处于低化合价时的氧化物,如CO,SO2等。 4元素处于低化合价时的酸,如HCl浓,HBr,HI,H2S等。 5元素处于低化合价时的盐,如Na2SO3,FeSO4等。 电子转移的表示方法有双线桥法和单线桥法: 1、双线桥法 要点: 1箭头由反应物中化合价变化元素指向生成物中化合价已经变化了的同一元素。升高、降低各一根箭头,越过方程式中间的等号 2电子转移数目:化合价升高、失电子;化合价降低、得电子。化合价改变元素的原子个数m×每个原子得到或失去电子的个数ne-,即m×ne-。 2、单线桥法 要点: 1线桥从反应物中化合价升高的元素出发,指向反应物中化合价降低的元素,箭头对 准氧化剂中化合价降低的元素,箭头不过“=” 2在线桥上标明转移电子总数,不写得到或失去。 1、价态规律 同种元素,处于最高价态时只具有氧化性。处于最低价态时只具有还原性。处于中间 价态时既有氧化性又有还原性。 2、歧化和归中规律 价态归中规律:同种元素不同价态之间发生氧化还原反应时,价态的变化“只靠拢, 可相交,不相叉”。 3、反应先后规律 在浓度相差不大的溶液中:
E E 2-E E E F
三、基本原理 通过药剂与污染物的氧化还原反应,把废水中有毒害的污染物转化为无毒或微毒物质的处理方法称为氧化还原法。 废水中的有机污染物(如色、嗅、味、COD)及还原性无机离子(如CN-、S2-、Fe2+、Mn2+等)都可通过氧化法消除其危害,而废水中的许多重金属离子(如汞、镉、铜、银、金、六价铬、镍等)都可通过还原法去除。 废水处理中最常采用的氧化剂是空气、臭氧、氯气、次氯酸钠及漂白粉;常用的还原剂有硫酸亚铁、亚硫酸氢钠、硼氢化钠、水合脏及铁屑等。在电解氧化还原法中,电解槽的阳极可作为氧化剂,阴极可作为还原剂。 投药氧化还原法的工艺过程及设备比较简单,通常只需一个反应池,若有沉淀物生成,尚需进行因液分离及泥渣处理。电解氧化还原法的工艺过程及设备均有其特殊性,将辟专节讨论。 (一)反应程度的控制 对于水溶液中的氧化还原反应,可以方便地用各电对的电极电势来衡量其氧化性(或还原性)的强弱,估计反应进行的程度。氧化剂和还原剂的电极电势差越大,反应进行得越完全。 电极电势置主要取决于物质("电对")的本性(反映为E0值),同时也和参与反应的物质浓度(或气体分压)、温度有关,其间的关系可用奈斯特公式表示: (13-1) 利用上式可估算处理程度,即求出氧化还原反应达平衡时各有关物质的残余浓度。例如,铜屑置换法处理含汞废水有如下反应:Cu+Hg2+=Cu2++Hg 当反应在室温(25℃)达平衡时,相应原电池两电极的电极电势相等: 由标准电极电势表查得:=0.34V,=0.86V,于是可求得[Cu2+]/[Hg2+]=1017.5。可见,此反应可进行得十分完全,平衡时溶液中残Hg2+极微。 (二)影响处理能力的动力学因素 由于多数氧化还原反应速度很慢,因此,在用氧化还原法处理废水时,影响水溶液中氧化还原反应速度的动力因素对实际处理能力有更为重要的意义,这些因素包括: (1)反应剂和还原剂的本性。影响很大,其影响程度通常要由实验观察或经验来决定; (2)反应物的浓度。一般讲,浓度升高,速度加快,其间定量关系与反应机理有关,可根据实验观察来确定; (3)温度。一般讲,温度升高,速度加快,其间定量关系可由阿仑尼乌斯公式表示; (4)催化剂及某些不纯物的存在。近年来异相催化剂(如活性炭、粘土、金属氧化物等)在水处理中的应用受到重视; (5)溶液的pH值。影响很大,其影响途径有三:H+或OH-直接参与氧化还原反应;OH-或H+为催化剂;溶液的pH值决定溶液中许多物质的存在状态及相对数量。 第二节化学氧化法 一、空气(及纯氢)氧化法 氧的化学氧化性是很强的,且pH值降低,氧化性增强。但是,用O2进行氧化反应的活化能很高,因而反应速度很慢,这就使得在常温、常压、无催化剂时,空气氧化法(曝气法)所需反应时间很长,使其应用受到限制。如果设法断开氧分子中的氧一氧键(如高温、高压、催化剂、γ射线辐照等),
什么叫做超临界水? 超临界流体 任何物质,随着温度、压力的变化,都会相应地呈现为固态、液态和气态这三种物相状态,即所谓的物质三态。三态之间互相转化的温度和压力值叫做三相点。除了三相点外,每种分子量不太大的稳定的物质都具有一个固定的临界点(Critical point)。严密意义上,临界点由临界温度、临界压力、临界密度构成。当把处于汽液平衡的物质升温升压时,热膨胀引起液体密度减少,而压力的升高又使汽相两相的相界面消失,成为一均相体系,这一点即为临界点。当物质的温度、压力分别高于临界温度和临界压力时就处于超临界状态。在超临界状态下,流体的物理性质处于气体和液体之间,既具有与气体相当的扩散系数和较低的粘度,又具有与液体相近的密度和对物质良好的溶解能力。因此可以说,超临界流体是存在于气、液这两种流体状态以外的第三流体。 近几年,超临界流体技术引起了人们的广泛关注,主要是因为它具有许多诱人的特性。例如,超临界流体分子的扩散系数比一般液体高10~100倍,有利于传质和热交换。超临界流体的另一重要特点是可压缩性,温度或压力较小的变化可引起超临界流体的密度发生较大的变化。大量的研究表明,超临界流体的密度是决定其溶解能力的关键因素,改变超临界流体的密度可以改变超临界流体的溶解能力。 在超临界流体技术应用研究方面,首先要求选择适当的化学物质作为超临界流体。它必须具备以下几个条件:①化学性质稳定,对装置没有腐蚀性;②临界温度接近于室温或者接近于反应操作温度,太低和太高都不合适;③操作温度要低于被萃取物质的分解、变性温度;④临界压力要低,以便减少动力费,使成本尽可能降低;⑤要有较高的选择性,以便能够制得高纯度产品;⑥要有较高的溶解度,以便减少溶解循环量;⑦价格便宜,来源方便。 在环境保护中,常用的超临界流体有水、二氧化碳、氨、乙烯、丙烷、丙烯等,由于水的化学性质稳定,且无毒、无臭、无色、无腐蚀性,因此得到了最为广泛的应用。 (2)超临界水及其特征 在通常条件下,水始终以蒸汽、液态水和冰这三种常见的状态之一存在,且是极性溶剂,可以溶解包括盐类在内的大多数电解质,对气体和大多数有机物则微溶或不溶,水的密度几乎不随压力而改变。但是如果将水的温度和压力升高到临界点(Tc=374.3℃,pc=22.05Mpa)以上,则就会处于一种既不同于气态也不同于液态和固态的新的流体态--超临界态,该状态的水即称之为超临界水。水的存在状态如图11-4所示。在超临界条件下,水的性质发生了极大的变化,其
水热合成反应釜是在一定温度、压力条件下采用水溶液作为反应体系,利用高温高压的水溶液使那些在大气条件下不溶或难溶的物质溶解,或反应生成该物质的溶解产物,通过控制溶液的温度差使产生对流以形成过饱和状态而析出生长晶体。可用于纳米材料的制备、化合物合成、晶体生长等方面,也可以用于小剂量的合成反应,是高校极常用的小型反应釜。 水热合成法生长晶体,是19世纪中叶地质学家模拟自然界成矿作用而开始研究的,地质学家Murchison 首次使用“水热”一词,1905年水热合成法开始转向功能材料的研究。自l9世纪7O年代兴起水热合成法制备超细粉体后很快受到世界许多国家的重视讶。水热合成法(Hydrotherma1),属液相化学的范畴,是指在特制的密闭反应器(水热合成反应釜)中,采用水溶液作为反应体系,通过对反应体系加热,加压(或自生蒸气压),创造一个相对高温、高压的反应环境,使得通常难溶或不溶的物质溶解并且重结晶而进行无机合成与材料处理的一种有效方法。在常温常压下一些从热力学分析看可以进行的反应,往往因反应速度极慢,以至于在实际上没有价值,但在水热条件下却可能使反应得以实现。这主要因为在水热条件下,水的物理化学性质(与常温常压下的水相比)将发生下列变化:①蒸汽压变高;②粘度和表面张力变低;③介电常数变低;④离子积变高;⑤密度变低;⑥热扩散系数变高等。在水热反应中,水既可作为一种化学组分起作用并参与反应,又可是溶剂和膨化促进剂,同时又是压力传递介质,通过加速渗透反应和控制其过程的物理化学因素,实现无机化合物的形成和改进。水热合成法既可制备单组分微小单晶体,又可制备双组分或多组分的特殊化合物粉末,克服某些高温制备不可克服的晶形转变、分解、挥发等。并且用水热合成法制备出的纳米晶,晶粒发育完整、粒度分布均匀、颗粒之间少团聚,原料较便宜,可以得到理想的化学计量组成材料,颗粒度可以控制,生成成本低。水热合成法在合成配合物方面具有如下优势:①明显降低反应温度(100℃一250℃);②能够以单一步骤完成产物的合成与晶化(不需要高温热处理)、流程简单;③能够很好地控制产物的理想配比;④制备单一相材料;⑤可以使用便宜的原材料,成本相对较低;⑥容易得到好取向,更完整的晶体;⑦在成长的晶体中,比其他方法能更均匀地进行掺杂;⑧能调节晶体生长的环境。水热合成法也存在着一些缺点。由于水热反应在高温高压下进行,因此对水热合成反应釜进行良好的密封成为水热反应的先决条件,这也造成水热反应的一个缺点:水热反应的非可视性。只有通过对反应产物的检测才能决定是否调整各种反应参数。前苏联科学院Shubnikov结晶化学研究所的Popolitov等人在1990年报道了用大块水晶晶体制造了透明水热合成反应釜,使得人们第一次直接看到了水热反应过程,实现根据反应随时调节条件的理想。另外,水热合成法往往只适用于氧化物功能材料或少数一些对水不敏感的硫属化物的制备与处理。这些缺陷已被溶剂热法所弥补。 1 水热合成法分类 水热合成法可分为以下几种类型: (1)水热氧化:高温高压水、水溶液等溶剂与金属或合金可直接反应生长性的化合物。 例如:M+[0]——MxOy其中M为铬、铁及合金等 (2)水热沉淀:某些化合物在通常条件下无法或很难生成沉淀,而在水热条件下却生成新的化合物沉淀。例如:KF+MnCI2——KMnF2 (3)水热合成:可允许在很宽的范围内改变参数,使两种或两种以上的化合物起反应,合成新的化合物。例如:FeTiO3+K0H——K20?nTiO2 (4)水热还原:一些金属类氧化物、氢氧化物、碳酸盐或复盐用水调浆,无需或只需极少量试剂,控制适当温度合氧分压等条件,即可制得超细金属粉体。 例如:MexOy+Hz——xMe+yHzO 其中Me为银、铜等 (5)水热分解:某些化合物在水热条件下分解成新的化合物,进行分离而得单一化合物超细粉体。 例如:ZrSiO4+NaOH——ZrO2+NaSiO3 (6)水热结晶:可使一些非晶化合物脱水结晶。 例如:AI(OH)3——Al203?H20 2 水热合成法反应装备 东台市吉泰不锈钢制品厂专业生产水热合成反应釜、高压水热釜、高压釜、闷罐等。外罐采用优质304
有机化学氧化还原反应总结 一、氧化反应:有机物分子中加入O 原子或脱去H 原子的反应。 常见的氧化反应: ①醇的氧化 醇→醛 ②醛的氧化 醛→酸 ③有机物的燃烧氧化、与酸性高锰酸钾溶液的强氧化剂氧化。 ④醛类及其含醛基的有机物与新制Cu (OH )2悬浊液、银氨溶液的反应 常见的氧化剂有氧气、酸性高锰酸钾、二氧化锰、臭氧、银氨溶液和新制Cu (OH )2悬浊液 a. 能被酸性KMnO 4氧化的:烯、炔、二烯、油脂(含C==C 的)苯的同系物、酚、醛、葡萄糖等。 b. 能被银氨溶液或新制备的Cu(OH)2悬浊液氧化的:醛类、甲酸及甲酸酯、葡萄糖、麦芽糖。 1.高锰酸钾氧化 a.在稀、冷KMnO4(中性或碱性)溶液中生成邻二醇 b.在酸性高锰酸钾溶液中,继续氧化,双键位置发生断裂, 得到酮和羧酸的混合物,如: 炔烃与氧化剂(KMnO4或O3)反应,产物均为羧酸或CO2 2.臭氧化反应: CHR=CR 'R "+O3→RCH=O+R’C=OR” 3.醛的氧化:由于醛的羰基碳上有一个氢原子,所以醛比酮容易氧化,使用弱的氧化剂都能使醛氧化。利用两者氧化性能的区别,可以很迅速的鉴别醛或酮: a 费林试剂(Fehling):以酒石酸盐为络合剂的碱性氢氧化铜溶液(绿色),能与醛作用,铜被还原成红色的氧化亚铜沉淀。 坎尼扎罗(Cannizzaro )反应 不含 氢原子的醛在浓碱存在下可以发生歧化反应,即两个分子醛相互作用,其中一分子醛还原成醇,一个氧化成酸: CH 3 CH 2C=CHCH 3 CH 3 CH 3CH 2CCH 3O CH 3 COOH RCHO Ag(NH 3)2RCOONH 4O H 2NH 3HCHO HCOONa HCH 2OH
氧化还原反应方程式的配平方法 1、配平的基本方法(化合价升降法) 化合价升降法的基本步骤为:“一标、二等、三定、四平、五查”。 “一标”指的是标出反应中发生氧化和还原反应的元素的化合价,注明每种物质中升高或降低的总价数。 “二等”指的是化合价升降总数相等,即为两个互质(非互质的应约分) 的数交叉相乘。 “三定”指的是用跟踪法确定氧化产物、还原产物化学式前的系数。 “四平”指的是通过观察法配平其它各物质化学式前的系数。 “五查”指的是在有氧元素参加的反应中可通过查对反应式左右两边氧 原子总数是否相等进行复核(离子反应还应检查电荷数是否相等),如相等则方程式已配平,最后将方程式中“——”改为“=”。 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 2、配平的基本技巧(特殊方法) ①奇数配偶法:此法适用于简单的氧化还原反应方程式的配平,其步骤为“一看、二找、三配、四平、五查”(内容略)。如: 2P+3Cl2=2PCl3 ②逆向配平法:对于歧化反应方程式的配平可用化合价升降法在反应式右边进行配平。 ③合一配平法:当三种物质参与氧化还原反应或分解反应的氧化和还原产物有三种时,应将其中两种合并作为一种来看,这样配平就显得简单了。如: KNO3+S+C——K2S+N2+CO2 因为右边的K2S中,K与S分别来自左边的KNO3和S,故左边KNO3与S的系数比必须满足2∶1,所以先在KNO3前添上系数2,然后将2KNO3和S看作一个整体来配平: ④平均化合价法:此法适用于有机氧化还原方程式的配平,步骤为:先根据氢+1价,氧-2价来确定碳原子平均化合价,再用化合价升降法配平。如: ⑤离子方程式配平法:此法适用于较复杂的氧化还原反应方程式的配平。如:
氧化还原反应 氧化还原反应与四大基本反应类型的关系①置换反应都是氧化还原反应; ③有单质生成的分解反应是氧化还原反 应; ④有单质参加的化合反应也是氧化还原反 应。 从数学集合角度考虑: 氧化还原反应的概念 1.基本概念 . 2.基本概念之间的关系:
氧化剂 有氧化性 化合价降低 得电子 被还原 发生还原反应生成还原产物 还原剂 有还原性 化合价升高 失电子 被氧化 发生氧化反应生成氧化产物 [例1]金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。工业上以金红石为原料制取Ti的反应为: aTiO2+ bCl2+ cC aTiCl4+ c CO ……反应① TiCl4+2Mg Ti + 2MgCl2 ……反应② 关于反应①、②的分析不正确的是() ①TiCl4在反应①中是还原产物,在反应②中是氧化剂; ②C、Mg在反应中均为还原剂,被还原; ③在反应①、②中Mg的还原性大于C,C的还原性大于TiCl4; ④a=1,b=c=2; ⑤每生成19.2 g Ti,反应①、②中共转移4.8 mol e-。 A.①②④B.②③④C.③④D.②⑤ 标电子转移的方向和数目(双线桥法、单线桥法) ①单线桥法。从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。例: MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O ②双线桥法。得失电子分开注明,从反应物指向生成物(同种元素)注明得失及电子数。例: MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 两类特殊的化学反应 ①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。例: 3Cl2+6KOH KClO3+5KCl+3H2O ②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例: 得2e-—— 2e- 失2e-— — 失5e 得5×e 得5e-