
Phosphine-Free Synthesis of p-Type Copper(I)Selenide Nanocrystals in Hot
Coordinating Solvents
Sasanka Deka,?Alessandro Genovese,?Yang Zhang,?Karol Miszta,?Giovanni Bertoni,?
Roman Krahne,?Cinzia Giannini,?and Liberato Manna*,?
Istituto Italiano di Tecnologia,Via Morego 30,16163Geno V a,Italy,and CNR-Istituto di Crystallogra?a (IC),
Via Amendola 122/O,I-70126Bari,Italy
Received April 16,2010;E-mail:liberato.manna@iit.it
The fabrication of low-cost,ef?cient solar cells made of green materials is a main goal of energy-related research.1Several copper-based materials,such as Cu 2S,CuInS 2,CuInSe 2,CuIn x Ga 1-x Se 2,and Cu 2ZnSnS 4,have been explored to date in photovoltaics,mainly as thin ?lms,2but recently,colloidal nanocrystals of these materials have also been developed and used to make solar cells.3Today “all-nanocrystal”or organic -inorganic nanocomposite ?lms can be prepared over large areas using various deposition techniques.Also,copper selenide,a superionic conductor,has been studied in thin-?lm applications in photovoltaics,optical ?lters,and dry galvanic cells (as a solid electrolyte).1e,2c It can form in many stoichiometries (Cu 2Se,Cu 2-x Se,CuSe,Cu 2Se 3)and phases.Cop-per(I)selenide (Cu 2Se,Cu 2-x Se)crystallizes generally in the face-centered cubic berzelianite phase.4Cu 2-x Se has both a direct band gap of 2.2eV and an indirect band gap of 1.4eV (at the limit for solar cell applications)and shows p-type conductivity.Nanocrystals of Cu 2-x Se have been prepared via various routes,including colloidal synthesis methods in hot surfactants.4In contrast,CuSe has a hexagonal phase at room temperature,and it is often found as impurity in copper(I)selenide.5
We report the synthesis of colloidal Cu 2-x Se nanocrystals using noncoordinating 1-octadecene (ODE)as solvent and oleylamine as both the reductant for Se (converting it to Se 2-)and the ligand for the nanocrystals,thus avoiding the use of toxic,pyrophoric,and expensive alkylphosphines.Anhydrous CuCl (0.099g,1mmol),which is known to be stable source of Cu(I),6was added to a mixture of 5mL of oleylamine and 5mL of ODE in a ?ask.After the system was pumped to vacuum for 1h at 80°C using a Schlenk line,the mixture was put under nitrogen ?ow.Next,the temperature was increased to 300-310°C,and a suspension of Se (0.039g,0.5mmol)in 1mL of ODE was quickly injected using a syringe.The temperature was allowed to rise to the preinjection value.The total reaction time after injection was 15min,after which the ?ask was cooled rapidly to room temperature and 5mL of toluene was added to it.The mixture was transferred to a glovebox and cleaned 2-3times by precipitation with ethanol.The nanocrystals were then redispersed in toluene or trichloroethylene.The sample also contained a small amount of hexagonal platelets,often larger than 100nm,made of hexagonal CuSe,7which could be precipitated by centrifugation (see Figure 3a,b).The much smaller particles left in solution (Figure 1)had mainly cuboctahedral shapes,and most of them had a cubic structure.Distinctive sets of lattice fringes were identi?ed using high-resolution transmission electron micros-copy (HRTEM),including ones corresponding to the (111)and
(220)reticular planes of Cu 2-x Se (d 111Cu 2-x Se )3.36?and d 220Cu 2-x Se
)2.06?),but some particles had hexagonal structure (hcp CuSe).7
The average composition,determined by energy-dispersive X-ray spectroscopy (EDS),ranged from Cu 1.70Se to Cu 1.90Se,depending on the synthesis.7Since ~5%of the nanocrystals were hexagonal CuSe,the composition of the cubic Cu 2-x Se nanocrystals ranged from Cu 1.68Se to Cu 1.80Se.
Elemental mapping via energy-?ltered TEM (using the three-windows method)8con?rmed that both Cu and Se were uniformly distributed among the nanocrystals,which means that there was no appreciable compositional variation among them (Figure 1d -f)except for the occasional presence of the CuSe nanocrystals.Control syntheses with no oleylamine yielded CuCl and elemental Se,while the absence of ODE led to the formation of polydisperse nano-crystals with mixed phases.The powder X-ray diffraction (XRD)patterns of the as-synthesized Cu 2-x Se nanocrystals could be ?tted according to one form of the berzelianite Cu 2Se phase (Figure 2).Indeed,the (111)/(220)peak intensity ratio was higher than expected
?Istituto Italiano di Tecnologia.?
CNR-Istituto di
Crystallogra?a.
Figure 1.(a)TEM image of size-selected Cu 2-x Se nanocrystals grown
for 15min at 300°C,having an average size of 16nm (the size estimated by XRD was 18nm).The inset shows a sketch of the hexagonal projection of a cuboctahedron shape.(b)HRTEM image of Cu 2-x Se nanocrystals.Most of the displayed nanocrystals are seen under their [111]zone axis.The inset shows their two-dimensional fast Fourier transform.(c)Scanning electron microscopy image of Cu 2-x Se nanocrystals drop-casted from solution onto a glass substrate.(d)Elastic-?ltered (ZL)image of several nanocrystals.(e,f)Cu and Se elemental maps from the same group obtained by ?ltering the Cu L edge (at 931eV)and the Se L edge (at 1436eV).(g)Elemental quanti?cation of a group of nanocrystals by
EDS.
Published on Web 06/11/2010
10.1021/ja103223x 2010American Chemical Society
89129
J.AM.CHEM.SOC.2010,132,8912–8914
for the bulk structure.This effect could be explained by considering a deviation in the occupancies of the Cu ions from those of the bulk,as proved by Rietveld analysis of the XRD patterns,which ?tted well to the R -Cu 1.8Se phase.7Often two additional peaks (with much lower intensity)appeared at 2θ)25.35and 28.07°and were assigned to hexagonal CuSe.On the basis of the XRD data,the approximate weight percentage of CuSe nanoparticles in the sample was ~5%.9Figure 2b -d presents X-ray photoelectron spectroscopy (XPS)data for the as-synthesized nanocrystals.The binding energies were 932.30eV for Cu 2p 3/2and 54.84eV for Se 3d in Cu 2-x Se.4a The Cu 2p peak had a satellite line at 940-945eV due to Cu(II)(likely CuSe).A small peak at 58-60eV pointed to a high oxidation state of Se (possibly SeO 2).
In the present system,in addition to the speci?c choice of surfactants,the reaction temperature was also critical in phase control:syntheses performed at temperatures g 315°C yielded a mixture of tetragonal (mainly Cu 2Se)nanocrystals and metallic Cu nanoparticles (Figure 3)with various shapes,7,10and their overall size distribution was broader than that of the nanoparticles synthesized at lower temperature.Furthermore,these nanocrystals were often aggregated.The formation of metallic Cu in these cases can be explained by the competitive reduction of Cu(I)by
oleylamine at higher temperatures,as con?rmed by test syntheses.7The formation of other phases of Cu 2-x Se (mainly tetragonal here;also see the XRD pattern in the Supporting Information)deserves further discussion.Cu 2-x Se can crystallize in a large number of phases,often with small differences in energy of formation among them,and in each of these phases,copper can be found in a range of stoichiometries.In the bulk,the tetragonal phase of Cu 2-x Se is stable up to 413K,above which the cubic phase is more stable.11This is different from what we found for the nanocrystals.Many studies have reported syntheses of Cu 2-x Se nanoparticles with mixed phases,and this is not surprising in nanocrystals,for which the contribution of the surface energy to the total energy of formation is not negligible and the growth rates of various facets can be in?uenced strongly by the reaction environment.Therefore,slightly different growth conditions (even just a different choice in the surfactants or a different reaction temperature)can favor the growth of one phase over others.In the present case,for example,there appears to be a window of experimental conditions that promotes the formation of the “metastable”tetragonal phase of copper selenide.
Typical optical absorption spectra of Cu 2-x Se nanocrystals dissolved in trichloroethylene and deposited as dense ?lms on glass substrates are shown in Figure 4a.In solution,a ?rst absorption shoulder was seen at 480nm (2.58eV),which is blue-shifted with respect to the direct band gap of bulk copper selenide (2.4
eV).
Figure 2.(a)XRD patterns of two different Cu 2-x Se samples along with
the bulk XRD pattern of cubic Cu 2Se.Peaks marked as *refer to hexagonal CuSe.(b)XPS survey spectrum of one sample:C,O,Cl,and N (from oleylamine)along with Cu and Se are present.XPS core-level spectra of Cu 2-x Se from (c)Cu 2p3and (d)Se 3d.The binding energies found using XPS were corrected for specimen charging by referencing the C 1s line to 284.81
eV.
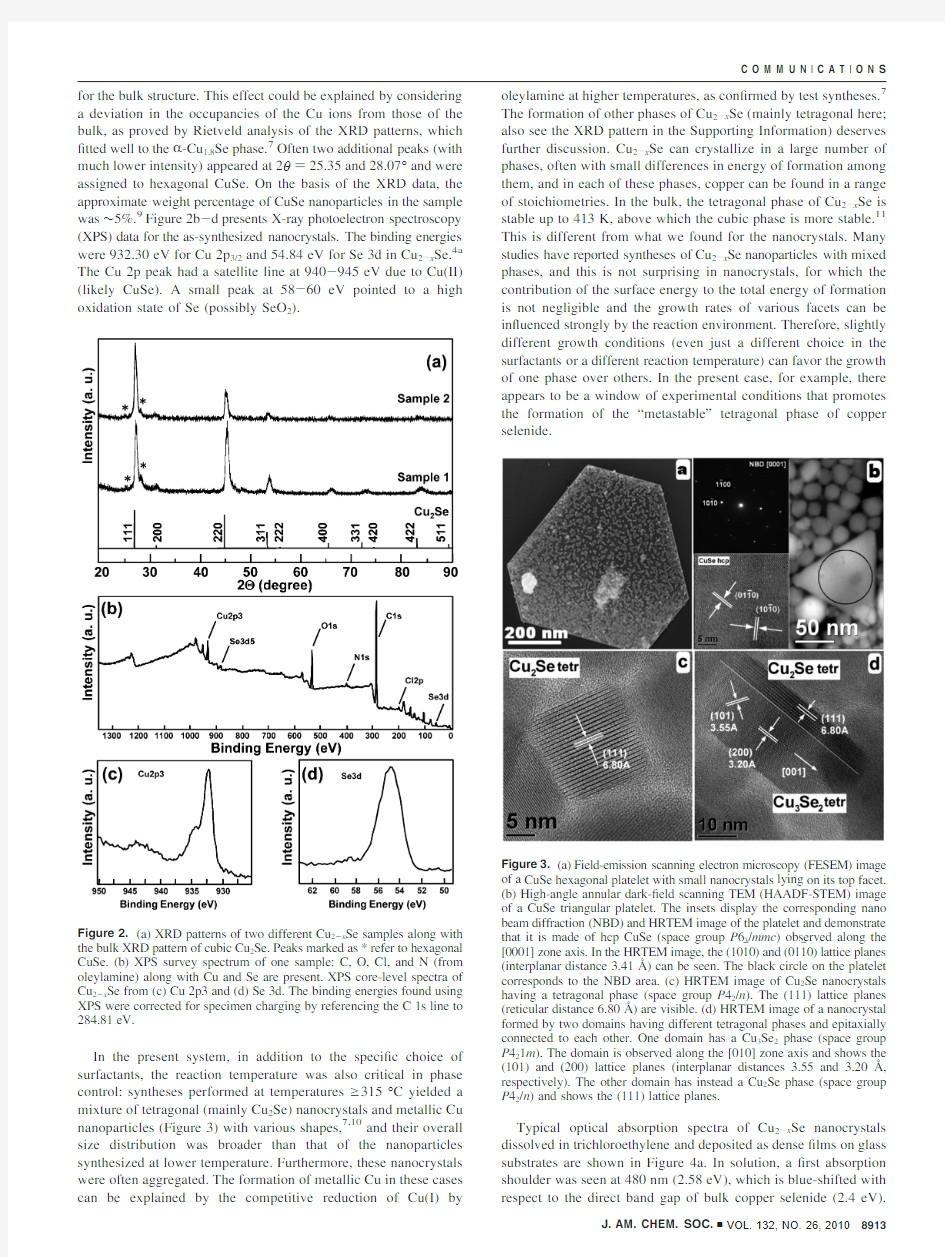
Figure 3.(a)Field-emission scanning electron microscopy (FESEM)image
of a CuSe hexagonal platelet with small nanocrystals lying on its top facet.(b)High-angle annular dark-?eld scanning TEM (HAADF-STEM)image of a CuSe triangular platelet.The insets display the corresponding nano beam diffraction (NBD)and HRTEM image of the platelet and demonstrate that it is made of hcp CuSe (space group P 63/mmc )observed along the
[0001]zone axis.In the HRTEM image,the (101
j 0)and (011j 0)lattice planes (interplanar distance 3.41?)can be seen.The black circle on the platelet corresponds to the NBD area.(c)HRTEM image of Cu 2Se nanocrystals having a tetragonal phase (space group P 42/n ).The (111)lattice planes (reticular distance 6.80?)are visible.(d)HRTEM image of a nanocrystal formed by two domains having different tetragonal phases and epitaxially connected to each other.One domain has a Cu 3Se 2phase (space group P 421m ).The domain is observed along the [010]zone axis and shows the (101)and (200)lattice planes (interplanar distances 3.55and 3.20?,respectively).The other domain has instead a Cu 2Se phase (space group P 42/n )and shows the (111)lattice planes.
J.AM.CHEM.SOC.
9
VOL.132,NO.26,20108913
C O M M U N I C A T I O N S
The direct-band-gap transition is more pronounced in the spectra recorded from Cu 2-x Se ?lms and is red-shifted by 0.30eV with respect to the solution case as a result of superlattice effects arising from the dense nanocrystal packing in the ?lm.7A broad and intense absorption peak was observed at 1150nm (in solution),which is attributed to transitions involving the indirect band gap.We investigated the conductive properties of ?lms of Cu 2-x Se nano-crystals of various thicknesses that were prepared by drop-casting nanocrystal solutions onto glass substrates inside the glovebox.Thermoelectric measurements were performed to determine the majority carrier type in the ?lms (Figure 4b).The polarity of the thermoelectromotive force was positive,implying p-type semicon-ducting behavior,13which can be attributed to the acceptor levels created by copper ions during the formation of copper-de?cient nanocrystals.In the current-voltage measurements we found ?lm resistivities of ~6×10-3?cm (see Figure 4c),in good agreement with the data reported in ref 12.Such low resistivities may suggest the use of Cu 2-x Se nanocrystals as hole-injection layers in opto-electronic devices.14We did not observe any signi?cant difference between the conductance of ?lms that were covered by poly(methyl methacrylate)(PMMA)to prevent oxidation of the nanocrystals and that of bare,unprotected ?lms.Also,the nanocrystal ?lms were slightly contaminated by the CuSe platelets in these experiments
(no size-selective precipitation had been carried out on these samples).We measured the current -voltage characteristics of individual CuSe platelets,as shown in Figure 4d,and derived for these platelets a ?lm resistivity that is 3orders of magnitude smaller than those of the nanocrystal ?lms.This result is reasonable,since within a platelet the charge transport is not hindered by the potential barrier of the surfactants,as it is the case of the nanocrystal ?lm.However,we do not expect isolated CuSe platelets to have a signi?cant impact on the ?lm resistance.
In conclusion,we have synthesized Cu 2-x Se nanocrystals using a colloidal approach that avoids the use of phosphines.The nanocrystals show a distinct optical absorption shoulder in the UV and a peak in the NIR region with a high absorption coef?cient.Thermoelectric measurements on ?lms of nanocrystals con?rmed p-type conductivity,hence making them potential candidates for use in solid-state solar cells.
Acknowledgment.We thank Mauro Povia,Eloisa Sardella,Sergio Marras,and Andrea Falqui for help with XRD,XPS,and HRTEM measurements.Financial support via the FP7Starting ERC Grant NANO-ARCH (Contract 240111)is acknowledged.
Supporting Information Available:Chemicals,experimental de-tails,control reactions,EDX and HRTEM images,XRD re?nements,additional XRD patterns,and optical absorption spectra.This material is available free of charge via the Internet at https://www.doczj.com/doc/468359986.html,.References
(1)(a)Goetzberger,A.;Hebling,C.;Schock,H.W.Mater.Sci.Eng.,R 2003,
40,1.(b)Kamat,P.V.J.Phys.Chem.C 2008,112,18737.(c)Wadia,C.;Alivisatos,A.P.;Kammen,D.M.En V iron.Sci.Technol.2009,43,2072.(d)Holder,E.;Tessler,N.;Rogach,A.L.J.Mater.Chem.2008,18,1064.(e)Hillhouse,H.W.;Beard,M.C.Curr.Opin.Colloid Interface Sci.2009,14,245.(f)Talapin,D.V.;Lee,J.S.;Kovalenko,M.V.;Shevchenko,E.V.Chem.Re V .2010,110,389.
(2)(a)Rockett,A.;Birkmire,R.W.J.Appl.Phys.1991,70,R81.(b)Hu,
Y.X.;Afzaal,M.;Malik,M.A.;O’Brien,P.J.Cryst.Growth 2006,297,61.(c)Lin,F.;Bian,G.Q.;Lei,Z.X.;Lu,Z.J.;Dai,J.Solid State Sci.2009,11,972.
(3)(a)Siebentritt,S.Thin Solid Films 2002,403,1.(b)Guo,Q.J.;Hillhouse,
H.W.;Agrawal,R.J.Am.Chem.Soc.2009,131,11672.(c)Steinhagen,C.;Panthani,M.G.;Akhavan,V.;Goodfellow,B.;Koo,B.;Korgel,B.A.J.Am.Chem.Soc.2009,131,12554.(d)Arici,E.;Sariciftci,N.S.;Meissner,D.Ad V .Funct.Mater.2003,13,165.
(4)(a)Wang,W.Z.;Yan,P.;Liu,F.Y.;Xie,Y.;Geng,Y.;Qian,Y.T.J.
Mater.Chem.1998,8,2321.(b)Xie,Y.;Zheng,X.W.;Jiang,X.C.;Lu,J.;Zhu,L.Y.Inorg.Chem.2002,41,387.(c)Zhang,A.Y.;Ma,Q.;Lu,M.K.;Zhou,G.J.;Li,C.Z.;Wang,Z.G.J.Phys.Chem.C 2009,113,15492.(d)Zhu,J.J.;Palchik,O.;Chen,S.G.;Gedanken,A.J.Phys.Chem.B 2000,104,7344.(e)Ingole,P.P.;Joshi,P.M.;Haram,S.K.Colloids Surf.,A 2009,337,136.
(5)Wei,W.;Zhang,S.Y.;Fang,C.X.;Zhao,S.Q.;Jin,B.K.;Wu,J.Y.;
Tian,Y.P.Solid State Sci.2008,10,622.
(6)Malik,M.A.;O’Brien,P.;Revaprasadu,N.Ad V .Mater.1999,11,1441.(7)See the Supporting Information for additional details.
(8)Egerton,R. F.Electron Energy Loss Spectroscopy in the Electron
Microscope ,2nd ed.;Plenum Press:New York,1996.(9)We used PowderCell (https://www.doczj.com/doc/468359986.html,).
(10)Haram,S.K.;Santhanam,K.S.V.;Neumannspallart,M.;Levyclement,
C.Mater.Res.Bull.1992,27,1185.
(11)Kashidaa,S.;Shimosakab,W.;Moric,M.;Yoshimura,D.J.Phys.Chem.
Solids 2003,64,2357.
(12)Bhuse,V.M.;Hankare,P.P.;Garadkar,K.M.;Khomane,A.S.Mater.
Chem.Phys.2003,80,82.
(13)Mane,R.S.;Kajve,S.P.;Lokhande,C.D.;Han,S.H.Vacuum 2006,80,
631.
(14)Hiramatsu,H.;Koizumi,I.;Kim,K.B.;Yanagi,H.;Kamiya,T.;Hirano,
M.;Matsunami,N.;Hosono,H.J.Appl.Phys.2008,104,11.(15)Taylor,P.L.Phys.Re V .B 1973,7,1197.
JA103223X
Figure 4.(a)Optical absorption spectra of Cu 2-x Se nanocrystals dispersed
in trichloroethylene (solid line)and of a ?lm of Cu 2-x Se nanocrystals on glass protected from oxidation by PMMA coverage (squares).(b)Plot of thermoelectromotive force (thermo-emf)voltage vs cold probe temperature.The top and bottom inset formulas indicate the ?tting equation of the data andthecalculationofthethermalpower(S ),15respectively.(c)Current -voltage (I -V )curves of two ?lms of different thicknesses prepared by drop-casting from the same sample of Cu 2-x Se nanocrystals.The curves were recorded under ambient conditions using silver paste to form the contact pads between the probes and the ?lm.We obtained resistivities of 5.76×10-3and 6.56×10-3?cm for the ?lms with thicknesses of 1.8and 0.24μm,respectively.(d)I -V data recorded from a single CuSe platelet that was contacted by electrodes fabricated by electron-beam lithography and metal evaporation of chromium (5nm)and gold (100nm).The derived sheet resistance of a platelet was ~1×10-5?cm.The inset shows a scanning electron microscopy image of a hexagonal-shaped CuSe platelet contacted by two metal electrodes.All of the reported current transport experiments were performed under ambient conditions.
8914J.AM.CHEM.SOC.
9
VOL.132,NO.26,2010
C O M M U N I C A T I O N S
铜 第一部分:铜的基本知识介绍 一、铜的发展史 铜是一种传统而又现代的重要金属材料。在人类使用的所有材料中,铜对人类文明的影响最显著。从人类文明的初期直到当今进入公元第三个千年,铜对于社会的不断进步业已做出并将继续做出重大贡献。 铜是人类最早认识和使用的金属,也是人类用以制造工具的第一种金属。考古资料证实,远在一万年以前,在西亚就用铜来制作装饰件等物品。古埃及人在象形文字中,用带圈的十字架表示铜,含义是“永恒的生命”,赞誉了它经久耐用和可以重复再生使用的特性。人类从居无所定到定居,以及到从事农业生产和饲养牲畜,一直在使用铜。随着铜在生产和生活中的日益广泛应用,人类文明从石器时代步入了铜器时代。据记载,在阿纳托尼亚发现了公元前5000多年前人类社会最早的铜器,公元前3000-4000年,西班牙韦尔瓦地区的工匠们就在提炼铜。在中东地区的西奈荒漠中出土了公元前3500年前的最早的铜炉。在埃及,公元前2750年的基厄普斯金字塔内发现了铜水管,说明当时铜在工程上已得到重要应用。约在公元前2500年,发现了铜与锡形成的合金,生产出比纯铜更坚硬耐用的青铜器和青铜工具,进入了青铜器时代。公元前一世纪罗马人开始使用铜与锌的合金——黄铜,扩大了铜合金的品种和应用范围。 在中国,4000多年前的夏禹时代就有了青铜器。距今3000-3500年的商、周年代达到了鼎盛时期。青铜器的种类、数量和制造水平远远超过了世界其它地区的任何文明。它们充分展现了中国古代社会的发达程度和中华民族先辈的高度智慧。例如,铸钟技术起源于当时的中国,从设计到制作工艺都很精细,反映了当时社会发展的水平。此后,该技术逐步传入西方,最后到达英国。英国的考古发现,铸钟出现在公元1000年左右。同时,中国也是使用金属货币最早的国家,而金属货币中,历代又以铜币为主。所以,中国古代的货币史,实际上就是铜币史。 18世纪末和19世纪初发现了电和磁,利用了铜的优异导电性能,使电的应用得以实现,促进了工业革命,并推动铜进入了一个新纪元。随着人类社会向电气化、自动化、信息化和网络化的方向迈进,铜在生产建设、人民生活以及高新技术上的重要作用日益明显。当前微电子工业中“铜芯片”革命的兴起,以及采用xDSL (数字用户专线)技术使标准铜电话线同时运载高速数据得以实现,就是很好的例证。确实,铜不仅是一种传统的非常有用的金属,而且还是重要的现代高新技术材料。 二、铜的自然属性及特性 1、铜的自然属性 金属铜,元素符号Cu,原子量63.54,比重8.92,熔点1083℃。纯铜呈浅玫瑰色或淡红色,表面形成氧化铜膜后,外观呈紫铜色。铜具有许多可贵的物理化学特性,例如其热导率和电导率都很高,化学稳定性强,抗张强度大,易熔接,具抗蚀性、可塑性、延展性。纯铜可拉成很细的铜丝,制成很薄的铜箔。能与锌、锡、铅、锰、钴、镍、铝、铁等金属形成合金。 铜冶炼技术的发展经历了漫长的过程,但至今铜的冶炼仍以火法冶炼为主,其产量约占世界铜总产量的85%。 1)火法冶炼一般是先将含铜百分之几或千分之几的原矿石,通过选矿提高到20一30%,作为铜精矿,在密闭鼓风炉、反射炉、电炉或闪速炉进行造梳熔炼,产出的熔梳(冰铜)接着送入转炉进行吹炼成粗铜,再在另一种反射炉内经过氧化精炼脱杂,或铸成阳极板进行电解,获得品位高达99.9%的电解铜。该流程简短、适应性强,铜的回收率可达95%,但因矿石中的硫在造铣和吹炼两阶段作为二氧化硫废气排出,不易回收,易造成污染。近年来出现如白银法、诺兰达法等熔池熔炼以及日本的三菱法等、火法冶炼逐渐向连续化、自动化发展。 2)现代湿法冶炼有硫酸化焙烧--->浸出--->电积,浸出--->萃取--->电积,细菌浸出等法,适于低品位复矿、氧化铜矿、含铜废矿石的堆浸、槽浸选用或就地浸出。湿法冶炼技术正在逐步推广,预计本世纪末可达总产量的20%,湿法冶炼的推出使铜的冶炼成本大大降低。 2、铜的特性
铜及铜合金牌号对照表 CONVERSION TABLE OF GRADES FOR COPPER & ITS ALLOYS
Werkstoffe: Automatenstahl: 11SMn30 11SMnPb30 * 11SMnPb37 * *) auc h 麻省理工学院Zus5atzen 冯Bi und Te (1.0715) (1.0718) (1.0737) Nirosta (INOX): X14CrMoS17 X8CrNiS18-9 (1.4104) (1.4305) 弄乱: CuZn38Pb1,5 CuZn39Pb3 CuZn35Ni2 CuZn40Al2 (2.0371) (2.0401) (2.0540) (2.0550) Neusilber: CuNi7Zn39Pb3Mn2 CuNi12Zn30Pb1 (2.0771) (2.0780) Kupfer: OsnaCu58S OsnaCu58Te (2.1498) (2.1546) 铝: AlMgSiPb AlCu4PbMgMn AlCu6BiPb (3.0615) (3.1645) (3.1655) Titan: 6.Al4V (3.7165) Maschinen: ? 索引Automaten □2 - □60mm ? Tornos-Langdrehautom aten □2 - □26mm ? Esco-Ringdrehautomaten □1 - □9mm ? 索引, Tornos und Esco CNC-Drehautomaten bis □100mm ? Kummer Feinstdrehautomaten ? 6-Spindel-Drehautomaten: 索引bis □32mm (CNC), 可利用的合金从瑞士METALWORKS
第1章配位化学导论 配位化学(coordination chemistry)是无机化学的一个重要分支学科。配位化合物(coordination compounds)(有时称络合物complex)是无机化学研究的主要对象之一。配位化学的研究虽有近二百年的历史,但仅在近几十年来,由于现代分离技术、配位催化及化学模拟生物固氮等方面的应用,极大地推动了配位化学的发展。它已广泛渗透到有机化学、分析化学、物理化学、高分子化学、催化化学、生物化学等领域,而且与材料科学、生命科学以及医学等其他科学的关系越来越密切。目前,配位化合物广泛应用于工业、农业、医药、国防和航天等领域。 配位化学发展简史 历史上记载的第一个配合物是普鲁士蓝。它是1704年由柏林的普鲁士人迪斯巴赫(Diesbach)制得,它是一种无机颜料,其化学组成为Fe4[Fe(CN)6]3·nH2O。但是对配位化学的了解和研究的开始一般认为是1798年法国化学家塔萨厄尔()报道的化合物CoCl3·6NH3,他随后又发现了CoCl3·5NH3、CoCl3·5NH3·H2O、CoCl3·4NH3以及其他铬、铁、钴、镍、铂等元素的其他许多配合物,这些化合物的形成,在当时难于理解。因为根据经典的化合价理论,两个独立存在而且都稳定的分子化合物CoCl3和NH3为什么可以按一定的比例相互结合生成更为稳定的“复杂化合物”无法解释,于是科学家们先后提出多种理论,例如,布隆斯特兰德()在1869年、约尔更生()在1885年分别对“复杂化合物”的结构提出了不同的假设(如“链式理论”等),但由于这些假设均不能圆满地说明实验事实而失败。 1893年,年仅27岁的瑞士科学家维尔纳()发表了一篇研究分子加合物的论文“关于无机化合物的结构问题”,改变了此前人们一直从平面角度认识配合物结构的思路,首次从立体角度系统地分析了配合物的结构,提出了配位学说,常称Werner配位理论,其基本要点如下: (1) 大多数元素表现有两种形式的价,即主价和副价; (2) 每一元素倾向于既要满足它的主价又要满足它的副价;
铜在作物体内的作用 铜在植物体内的功能是多方面的。它是多种酶的组成成分。铜与植物的碳素同化、氮素代谢、吸收作用以及氧化还原过程均有密切联系。(1)铜有利于作物生长发育。铜素的存在能促进蔗糖等碳水化合物向茎秆和生殖器官的流动,从而促进植株的生长发育。铜肥有利于花粉发芽和花粉管的伸长。在缺铜情况下,常因生殖器官的发育受到阻碍,而使植株发生某些生理病害,引起各类作物的穗和芒的发育不全,甚至不能结穗,空秕粒很多,产量显著降低。 (2)影响光合作用。植物叶片中的铜几乎全部含于叶绿体内,对叶绿素起着稳定作用,以防止叶绿素遭受破坏。可见,铜素供给充足能提高植物的光合作用强度,能减轻晴天中午期间光合作用所受到的抑制。铜素能增加叶绿素的稳定,对蛋白质的合成能起良好作用。铜素不足,叶片叶绿素减少,出现失绿现象。 铜与铁一样能提高亚硝酸还原酶和次亚硝酸还原酶的活性,加速这些还原过程,为蛋白质的合成提供较好的物质(氨)条件。
(3)铜能提高作物的抗寒、抗旱能力。铜能提高冬小麦的耐寒性,而且还能增强茎秆的机械强度,起到抗倒伏的作用。用硫酸铜来处理种子,在低温条件下,对提高棉花种子的发芽率有极好的反应,对玉米发芽率也有明显影响,并能增强其抗御冻害能力。同时,铜对柑橘类的耐寒性也有一定的作用。 铜能提高植株的总水量和束缚水含量,降低植物的萎蔫系数,因此,铜素营养充足有利于抗旱性的提高。一旦缺乏铜肥,就会破坏作物的水分平衡,促进植株吐水量增多,严重者会显著增加萝卜等作物萎蔫病的发病率。
(4)铜能增强植株抗病能力。铜能提高植物抗病能力作用最为突出。铜对许多植物的多种真菌性和细菌性疾病均有明显的防治效果。在果树上,使用含硫酸铜的波尔多液来防治作物的多种病害,已成为普遍采用的植保措施之一,从这一侧面可以看到铜素对提高植物抗病力的重要作用。据实验表明,土豆施用铜肥,不仅可提高整个生长发育期包括块茎形成期、以及贮存期对晚疫病的抗性,而且能减轻细菌病、疮痂病、粉痂病和丝核菌病的感染,甚至在施铜后第二年,仍有作用。如果连续施用2年铜肥,其块茎经贮藏后,细菌性软腐病可得到彻底根除。施用铜肥可使菜豆炭疽病、番茄的褐斑病以及亚麻的立枯病、炭疽病和细菌病的感染率显著降低。
微量元素Cu对植物毒害研究进展 摘要:随着含Cu杀菌剂的大量使用及工业“三废”排放量的增多,植物遭受Cu毒害的现象也越来越普遍。本文综述了当前国内外微量元素Cu在植物中的研 究:(1)Cu对植物生长的影响:(2)Cu在植物中的分配及忍耐值;(3)植物对Cu毒害的生理生化反应;(4)植物对Cu毒害的抗性及Cu毒害的治理污染对高等植物生理毒害的研究近况,探讨了Cu过量对植物光合作用、细胞结构、细胞分裂、酶学系统和其他营养元素的吸收等的影响,并探讨了该方面研究存在的不足及其展望。 关键词;铜:铜毒害:酶:植物: Cu既是植物生长发育必需的微量营养元素,又是环境污染的重金属元素〔1〕。适量的Cu对植物正常的生理代谢及产量的提高、品质的改善都有重要意义。它还是多酚氧化酶、细胞色素氧化酶及抗坏血酸氧化酶等多种酶类的组成成分之一。另外,Cu还与光合作用有关。因而,它对植物正常的生理代谢及生长发育、作物产量的提高、品质的改善都有重要意义。但由于植物正常生长需要少,且土壤中含有一定量的Cu,污水灌溉、施用污泥和农药、开矿等也增加了土壤中的Cu 含量,给植物生长带来危害。含Cu杀菌剂(蓝矾、波尔多液)是国内外果园使用历史较久的常用农药,使用量大、频度高。已有报道表明,喷落于土壤中的Cu只有极少一部分可被水淋溶,因此土壤中的Cu逐年积累,高于背景值几到几十倍。Hirst et al[2]早在1961年就提出Wisbech附近苹果园土壤Cu严重积累的问题。巴西可可种植园使用波尔多液0、5、16天后表层土壤的Cu含量分别为18.6、464.7和993.3 mg·kg-1[3]。法国部分葡萄园长期使用波尔多液,土壤Cu含量高达1280 mg·kg-1;英国部分苹果园土壤Cu含量高达1500 mg·kg-1;新西兰Cu污染严重的土壤中Cu含量竟高达8000 mg·kg-1[4]。Cu严重影响了果树生长,破坏了生态环境,危害了人类的身体健康。但随着近年来,电镀、铝铜材、地砖、印染、化工等重金属污染型工矿企业遍布城乡,工业“三废”、城市垃圾等排放及其农用化学品应用的日趋广泛,高Cu杀菌剂、杀虫剂、化肥等不合理的使用,采用高Cu饲料也
铜对人类文明历史的重大影响是任何其他材料所无法比拟 铜是一种传统而又现代的重要金属材料,在人类使用的所有材料中,铜对人类文明历史的重大影响是任何其他材料所无法比拟的,以至于人类文明发展史上有两个阶段以它的合金命名,青铜时代和亚青铜时代.18世纪末,铜的优异导电性能又催生了工业革命,为现代文明奠定了基础. 铜是人类最早认识和使用的金属,也我人类用以制造工具的第一种金属.考古资料证实,远在一万年以前.在西亚就使用铜来制作装饰件等物品.古埃及人在象形文字中,用带卷的十字架表示铜,含义是“水恒是生命”,赞誉了它经久耐用和可以重复再生使用的特性.人类从居无定所到定居,在从事农业生产和饲养牲畜的过程步入青铜时代,据记载,在阿纳托尼亚发现公元前5000多年前人类社会最早的铜器.公元前3000-4000年,西班牙韦尔瓦地区的工匠们就在提炼铜.在中东地区的西奈荒漠中出土了公元前3500年前的最早的铜炉.在埃及,公元前2750年的基厄斯金字塔内发现了铜水管,说明当时铜在工程上已得到重要应用.约在公元前2500年,发现了铜与锡形成的合金,生产出比纯铜更加坚硬耐用的青铜合金器和青铜工具,进入了青铜器时代.公元前1世纪罗马人开始使用铜和锌的合金—黄铜,扩大了铜合金的品种和应用范围. 在中国,4000多年前的夏禹时代就有了青铜器,距今3000-3500年的商.周年代,青铜器的使用达到了鼎盛时期.青铜的种类,数量和制造
水平远远超过了时间其他地区的任何文明,它们充分发现了中国古代社会的发达程度和中华民族的高度智慧.例如,铜钟铸造技术起源与当时的中国,从设计到制作工艺上都很精细.反映了当时社会发展的水平.此后,该技术逐步传入西方,最后到达英国.英国的考古发现,铸造出现在公元1000年左右.中国也是使用金属货币最早的国家,而金属货币中,历代又一铜币为主.可以说鼓捣的货币史,实际上就是铜币史. 18世纪末和19世纪初人类发现电和磁,并利用了铜的优异导电性能,使导电的应用得以实现,促进了工业革命的发展,并推动了铜进入一个新纪元.随着人类社会向电动化,自动化,信息化和网络化的方向迈进,铜的生产建设,人民生活以及高新技术上的重要作用日益明显.以铜合金为基础材料的微电子行业的兴起,使铜的应用更加是得到快速的发展,所以铜不仅是一种传统的非常有用的金属而且还是重要的现代高技术材料.
1 配位化学导论总结 1. 配位化学 1) 定义:金属或金属离子同其他分子或离子相互结合的化学。 2) 基础:无机化学 3) 重要性:与其他学科互相渗透的交叉性学科 4) 发展: ● 近代配位化学: “键理论”等理论无法全面说明形成机理与成键方式. ● 现代配位化学理论:建立:1893年,瑞士化学家维尔纳提出了现代的配位键、配位数和配位化合物结构的基本概念,并用立体化学观点成功地阐明了配合物的空间构型和异构现象。 2. 配合物的基本概念 1) 定义:由具有接受孤对电子或多个不定域电子的空位原子或离子(中心体)与可以给出孤对电子或多个不定域电子的一定数目的离子或分子(配体)按一定的组成和空间构型所形成的物种称为配位个体,含有配位个体的化合物成为配合物。 2) 组成: 内界、外界、中心体、配体、配位原子 3) 配体分类: 4) 中心原子的配位数: ● 定义:单齿配体:配位数等于内界配体的总数。多齿配体:各配体的配位原子数与配体个数乘积之和。 ● 影响中心原子的配位数因素: A 、按配 体所含配 位原子的 数目分两 种: B 、根据 键合电子 的特征分 为三种:
3. 配合物的分类 4. 配合物的命名 原则是先阴离子后阳离子,先简单后复杂。 一、简单配合物的命名: (1)先无机配体,后有机配体 cis - [PtCl2(Ph3P)2] 顺-二氯 二?(三苯基磷)合铂(II) (2) 先列出阴离子,后列出阳离子,中性分子(的名称) K[PtCl3NH3] 三氯?氨合铂(II)酸钾 (3) 同类配体(无机或有机类)按配位原子元素符号的英文字母顺序排列。 [Co(NH3)5H2O]Cl3 三氯化五氨?一水合钴(III) 中心离子 对配位数 的影响 配体对配 位数的影 响1、按中心原 子数目分为: 2、按配合物 所含配体种 类分为: 3、按配体的 齿数分类: 4、按配合物 地价键特点 分类:
配位化学的现状及发展 专业班级:化学(师范类)一班姓名:刘楠楠课程名称:配位化学 摘要:配位化学已成为当代化学的前沿领域之一。它的发展打破了传统的有机化学和无机化学之间的界线。其新奇的特殊性能在生产实际中得到了重大的应用,花样繁多的价健理论及空间结构引起了结构化学和理论化学家的深切关注。它和物理化学、有机化学、生物化学、固体化学、环境化学相互渗透,使其成为贯通众多学科的交叉点。本文将介绍配位化学在近几年的现状和发展。 关键词:配位化学;现状;发展 配位化学是在无机化学基础上发展起来的一门交叉学科,50年代以来配位化学以其与有机合成化学和结构化学相结合为特点,开始了无机化学的复兴时期,从而在实际上打破了传统的无机、有机和物理化学间的界限,进而成为各化学分支的结合点。配合物以其花样繁多的价键和空间结构促进了基础化学的发展,又以其特殊的性质在生产实践和科学实验中取得了重大的应用。配位化学是化学学科中最活跃的,具有很多生长点的前沿学科之一,它的近期发展趋势如下。 1.具有特殊性质和特殊结构配合物的合成、结构及性能的研究 各种大环、夹心、多核、簇状、非常氧化态、非常配位数、混合价态及各种罕见构型配合物的合成、结构、热力学、动力学和反应性的研究正在深入。其中巨型原子簇的研究已成为阐明金属原子化学和固体金属化学异同的桥梁;新型球型大环,聚邻苯酚脂大环配体对某些金属离子具有特殊高的选择性;在CO,CO2,H2和CH4等小分子配合物及活化方面,已发现用Co+,Li+双核配合物不仅可与CO2配位,并使其活化,而形成C—C键;此外H2的配合物研究及H2的活化亦在深入。 配合物合成、结构和性能研究方面,近年来的一个引人注目的动向是配位化学和固体化学的交叉[1]。一系列具有链状、层片状和层柱状特殊结构的配合物已经合成。对它们的性质和结构,正在进行系统研究。 2.溶液配位化学研究 溶液配位化学研究正在继续深入,但已具有新的内容。在取代反应动力学及机理方面,近年工作集中在金属碳基配合物的研究上。已知配体的空间效应,电
高铜对环境的污染及合理利用 铜是机体必需的微量元素之一,参与造血过程,促进Fe在小肠的吸收,促进 血红蛋白的台成和红细胞的生成;可使无机铁变为有机铁、由三价变为两价。此外 铜还是酰氨酸酶、红细胞色素氧化酶和超氧化物歧化酶等多种酶的组成成分,铜有 促进磷脂合成的功能,保证大脑和脊髓的神经鞘发育正常。机体缺铜时多种酶括性 降低,引起共济失调,骨质疏松,被毛褪色,繁殖机能障碍以及心力衰竭等。 微量元素铜对单胃动物(猪、禽)的独特性在于添加高水平铜产生的促生长作用,高剂量的铜还具有一定的杀菌作用,此外在饲料中添加铜,使用简便,成本低, 生产效益高,因此饲料工业中添加高铜制剂的现象相当普遍,利用添加高铜促进猪(禽)生长一直是现代畜牧生产中的常用措施之一。高铜长期应用的同时,其导致 的问题也日趋严重。 1高铜应用的危害 1.1高铜对环境的污染 1.1.1高铜对土壤生态的影响 土壤中的台铜量般在1?20 mg /kg之间(Kloke.1980 ),当土壤中的含铜量高于此数值时就会对土壤造成影响土壤微生物是土壤的重要组成部分,当铜含量 达lOOppm 时可破坏蛋白质结构。使微生物蛋白变性而死亡。造成土壤板结。土壤肥力下降。 1.1.2 高铜对植物,水生生态的影响
铜的过量应用引起植物中铜含量的增高、植物生长减慢、产量降低,以及影响 植物中其他营养元素的含量。植物在整个食物链中处于第?一级营养水平(生产水平).植物性有机物由食草动物来消费,食草动物又为寄生动物、食肉动物、食腐动物以及土壤无脊椎动物和微生物食用,因此,植物的变化无疑将影响到整个食物 链,当长期大量施用含高铜的粪于牧地,牧草(于重)含铜 1 5?20 mg /kg时 就可使对铜敏感的绵羊发生中毒一。且食物链具有生物放大作用,如金枪鱼对铜的浓缩系数为100。过量的铜还可导致地区内植物的选择,能适应高铜的植物生存,不能适应的将被淘汰,从而引起某些物种的灭亡,当水中的铜过量时,某些藻类将受到严重影响,大部分死亡,引起某些低级生物的灭亡,从而导致鱼类的大量死亡,甚至某些敏感鱼类的死亡。 1.2 高铜对畜禽机体及人体的危害 1.2.1 高铜可引起动物慢性中毒和某些营养素缺乏 日粮中影响动物生长铜的耐受量分别为:羊25 mg /kg,牛100 mg /kg ,猪 250 mg /kg ,马800 mg /kg ,鸡300 mg /kg ,家兔200 mg /kg ,鼠1 000 mg /kg 。随着年龄的增长,动物对铜的耐受提高,但如果铜使用超过安全剂量必然会引起畜禽中毒。慢性铜中毒会引起动物肝铜含量成倍增加至肝坏死、高铁血红蛋白症、高铜症、胆红素症和红细胞溶血等,临床症状表现为黄疸、食欲降低、干渴、神情呆滞、呼吸频率加快及心跳加快。长期使用高铜,由于钙、镉、铁、铅、银、锌、汞、钼、硫和锰等都有阻碍铜的吸收作用,且二价铜离子(Cu2 )可使
铜合金牌号以及对照列表 ALLOY TYPE BS STANDARD EN STANDARD SYMBOL ASTM/UNS (NEAREST EQUIVALENT) OTHER COMPATABLE ALLOYS Aluminium Bronze CA104 CW307G CuAl10Ni C63200 / C63000 NES833, BSB23(DTD197A) Aluminium Bronze CA105 - CuAl10Fe3Ni7Mn2 C63000 - Aluminium Bronze AB1-C CC331G CuAl10Fe2-C C95400 SAE68 Aluminium Bronze AB2-C CC333G CuAl10Fe5Ni5-C C95500 SAE68B Leaded Bronze LB1-C CC496K CuSn7Pb15-C C93800 SAE67 Leaded Bronze LB2-C CC495K CuSn10Pb10-C C93700 SAE64 / SAE797 / SAE792 Leaded Bronze LB4-C CC494K CuSn5Pb9-C C93500 SAE66 Leaded Bronze LB5-C CC497K CuSn5Pb20-C C94100 SAE94, SAE794 & SAE799. Leaded Bronze - - CuSn7ZnPb C93200 SAE660 Leaded Gunmetal LG2-C CC491K CuSn5Zn5Pb5-C C83600 SAE40 Leaded Gunmetal LG4-C CC492K CuSn7Zn2Pb3-C C93400 - Leaded phosphor bronze LPB1 - CuSn8Pb4Zn1 C93100 - Leaded Phosphor Bronze PB4-C CC480K CuSn10-C C92700 - Nickel Gunmetal G3 - CuSn7Ni5Zn3 B292-56 - Phosphor Bronze PB101 CW450K CuSn4 C50900 C51100 - Phosphor Bronze PB102 CW451K CuSn5 C51000 NES838 Phosphor Bronze PB103 CW452K CuSn6 C51900 - Phosphor Bronze PB104 CW459K CuSn8 C52100 BSB24 DTD265A Phosphor Bronze DTD265A - - - BSB24, PB104 Tin Phosphor Bronze PB1-C CC481K CuSn11P-C B143 SAE65 Tin Phosphor Bronze PB2-C CC483K CuSn12-C CC483K SAE65 材料化学成分
锆—吡咯基配合物的合成与结构:对吡咯基配 体配位方式影响因素的计算分析 □ 文/Joseph M.Tanski ,Gerard Parkin*(约瑟.坦斯基,杰拉德.帕金) 纽约哥伦比亚大学化学学院,纽约10027 2001.11.20 收稿 摘要:具有η1和η5吡咯基配 位方式的锆配合物的一系列结构特点已有初步研究报道。确切的说,2,5 - 二芳基-吡咯[pyr Ar2]配体(Ar= 苯基 ,2,4 – 二甲苯基)已经被用来制备[pyr Ar2]Zr(NMe 2)3(NMe 2H), [pyr Ar2]Zr(NMe 2)3,, [pyr Ar2]Zr(NMe 2)I 2和 [η 5-pyr Ar2]2ZrCl 2.。密度泛函计算结果表明,各种配位方式相对的稳定性可以被立体因素及金属中心的路易斯酸性所影响。 毫无疑问,环戊二烯配 体,在有机过渡金属化学的发展中起到了关键作用。通过和环戊邻二苯基比较,相关等电 子杂环吡咯配体,[pyr Rn ],1已不大适用于过渡金属化学。2关于锆化学,通过X 射线衍射实验,一些吡咯配合物的结构已经得到认证,观察到吡咯配体和戊二烯配体相似,只能通过氮原子结合η1-模式,3而不是η5-模式。在本文中,我们报道了一系列单一和二度(吡咯)锆配合物的合成和结构特征在吡咯配体的η5-配位中起重要的作用,而且计算分析研究致力于找到影响吡咯配体于这些衍生物中η5和η1对抗配位方式的因素。 吡咯配体芳基的2 - 5位取代以前未应用于早期的过渡金属化学。然而,我们认为这样的取代基会提供有助于像[η5-pyr Ar2]2二卤化锆类型的二茂锆化合物的类似物的稳定的合成和隔离。确实,[pyr Ar2]2ZrCl 2(Ar= 苯基,2,4 – 二甲苯基)可能是由四氯化锆和[pyr Ar2] Li 4(方案1)反应得到的。因此提供吡咯相对物到已知的弯曲插入的环戊二烯基复合物,(CP R )2-ZrCl 2。同样,易得到的半插入锆吡咯配合物是由 Zr(NMe 2)4和[pyr Ar2]H 反应得到[pyr Ar2]Zr(NMe 2)3的,通过二甲胺加成[pyr Ar2]Zr(NMe 2)3(NMe 2H)。[pyr Ar2]Zr(NMe 2)3是其他锆吡咯配合物的前体。因此,[pyr Ar2]Zr(NMe 2)3和2当量的Me 3SiI 合成二碘化物[pyr Ar2]Zr(NMe 2)I 2,然而和3当量的会导致配体重新分配,形成[pyr Ar2]2ZrI 2(Ar= 苯基)。因此,二氯化合物[pyr Ar2]2ZrCl 2可以由[pyr Ar2]Zr(NMe 2)3和过量的Me 3SiCl 反应得到。(Me=甲基,pyh=吡咯基,注释中有,下文不再赘
铜对人体及动物的生物学效应 张录强(河北师范大学生物系石家庄050016) 铜是生物正常生长发育所必需的微量元素之一。1928年威斯康星大学哈特(Hart)的研究证明,由于喂饲乳汁而患贫血症的大白鼠饲料中添加铜和铁,对血红素的形成是必要的。 铜在生物体中的作用主要是参与构成体内具有特殊生理机能的物质,是多种酶系统的活化剂、辅因子或组织成分,参与和调节生物的多种生命活动过程。 1.动物对铜的吸收代谢 铜在动物饲料中多以难溶或不溶状态存在,饲料铜是以复合物的形式被小肠粘膜吸收,仅有极少部分以离子状态进入体内。研究资料表明,大部分铜是与肠粘膜内的含巯基金属蛋白和过氧化物歧化酶结合携带进入体内的,小部分铜与小分子的蛋白质和氨基酸结合转运入小肠粘膜细胞而被吸收到体内。 进入血液的铜存在于血清和血红细胞中,铜先与血清蛋白形成松散结合,在肝脏内铜再与a2-球蛋白形成牢固结合而合成铜蓝蛋白(约占成人血浆铜的95%)。血浆铜蓝蛋白与铜含量可以调节小肠粘膜对铜的吸收,二者含量的高低与存在于肠道食物中的铜维持着某种平衡关系。当血浆铜蓝蛋白和铜含量超过正常值时,肠道中的铜不吸入体内。如果这种平衡被打破,就会导致大量铜被吸收到体内,在机体蓄积产生危害。 动物体对铜的吸收还受饲料中的钼含量高低的影响。在落基山脉区域土壤中钼含量很高,水中钼含量也很高,在当地发生的一种病叫“羊缺铜症”,可通过皮下注射铜螯合物,如铜甘氨酸或日粮中含有8~11×10-7水平铜即可预防。钼干扰铜的吸收机理被认为是:钼干扰硫化物氧化酶,使动物体内硫化物增多,而导致硫化铜沉积,使铜不能为代谢所利用,造成铜缺乏。 铜在动物体内主要以结合态的形式存在,小部分呈游离态存在,机体中铜总量的50%~70%存在于肌肉与骨骼中,20%的铜贮存在肝脏中,5%~10%的铜分布于血液中,微量铜存在于酶分子中。在机体的各组织器官中,在肝、肾及脑铜浓度较高、肝组织中铜浓度最高,是铜最大的贮存器官,而且肝中铜的含量反映出对饲料铜的摄取情况,给予高铜饲料,肝中铜含量能增加数倍。 对于动物而言,食物中铜的吸收率是较低的,大约只有摄取量的5%~10%被吸收和存留,不被吸收的部分随粪排出,体内的铜又以胆汁的形式随粪排出,其他途径仅排出少量。 2.铜在动物体内的生理功能 2.1铜与铁代谢铜与铁代谢密切相关,它影响动物对铁的吸收、运输以及利用。在体内铜通过参与细胞色素氧化酶系统和血红蛋白的合成以及解除抑制铁吸收的因子,从而促进机体对铁的吸收。由肠粘膜进入血浆中的Fe2+不能直接与血浆中的运铁蛋白结合,需在铜蓝蛋白的氧化作用下由Fe2+→Fe3+后,再与运铁蛋白结合,并随运铁蛋白运送到骨髓、肝脏及全身组织。用于合成血红蛋白、肌红蛋白和含铁酶类,或在骨髓和肝脏内形成铁贮备。铜蓝蛋白还参与机体内贮存铁动员,使其迅速释放出来,并与血浆中的β1-球蛋白结合形成运铁蛋白,参与铁的运输和代谢。 铜还是血红蛋白的合成、红细胞的成熟与释放(即造血过程)的原料和调节因子,缺铜时,降低了铜对血红蛋白的催化作用,就可能导致贫血。 2.2铜参与超氧化物歧化酶和单胺氧化酶的系统的构成。主要催化弹性蛋白肽键中赖氨酸酰残基、氨基氧化脱氨为醛基,并与分子内或分子间的另一肽键的类似醇基或氨基进行醛醇缩合或醛氨缩合、而形成胶原纤维及弹性蛋白共价交联结构,使弹性纤维形成不溶性状态,从而使机体组织维持正常弹性和韧性。 2.3铜影响一些动物的生殖机能与生长发育将适量的铜盐注入孵化的鸡蛋内,雏鸡可
配位聚合物在光电磁材料中的应用 摘要:配位聚合物由于其特殊的结构及其在光电磁等方面优异的性能引起了科学家的广泛关注。本文综述了金属有机化合物在光电磁材料中的应用,并对新型多功能材料在设计、合 成与应用方面的广阔前景作了展望。 关键词:配位聚合物;多功能材料;非线性光学;材料化学 引言: 配位聚合物(coordination polymers)或金属-有机框架(metal-organic frameworks,简称 MOFs)是指利用金属离子与有机桥联配体通过配位键合作用而形成的一类具有一维,二维或三维无限网络结构的配位化合物[1]。近年来,配位聚合物作为一种新型的功能化分子材料以其良好的结构可裁性和易功能化的特性引起了研究者浓厚的兴趣。配合物有无机的金属离子和有机配体,因此它兼有无机和有机化合物的特性,而且还有可能出现无机化合物和有机化合物均没有的新性质。配位聚合物分子材料的设计合成、结构及性能研究是近年来十分活跃的研究领域之一,它跨越了无机化学、配位化学、有机化学、物理化学、超分子化学、材料化学、生物化学、晶体工程学和拓扑学等多个学科领域,它的研究对于发展合成化学、结构化学和材料化学的基本概念及基础理论具有重要的学术意义,同时对开发新型高性能的功能分子材料具有重要的应用价值[2-7]。并对分子器件和分子机器的发展起着至关重要的作用。配位聚合物在新的分子材料中将发挥重要的作用。配位化学理论在材料的分子设计中也将起着重要的指导作用。 材料按其性能特征和用途大致可划分为结构材料和功能材料两大类。功能材料种类繁多,功能各异,其共同的特点和发展趋势是:(1) 性能优异;(2) 分子化;(3) 巨大的应用前景。金属有机光电磁材料综合了这几方面特点,将发展成为新一代材料,其结构和性能决定了它的应用越来越广泛。以下是金属有机化合物分别在光电磁材料中的应用。 1配位聚合物在光学材料中的应用 配位聚合物的光学性质研究主要集中在光致发光、电致发光以及非线性光学等方面
配位化学论文 分子轨道理论的发展及其应用 160113004 2013级化教一班马慧敏 一、前言 价建理论、分子轨道理论和配位场理论是三种重要的化学键理论。三、四十年代,价键理论占主要的地位。五十年代以来由于分子轨道理论容易计算且得到实验(光电能谱)的支持,取得了巨大的发展,逐渐占优势。价建理论不但在理论化学上有重要的意义(下文中将详细介绍)。在应用领域也有重要的发展,如分子轨道理论计算有机化合物的吸收光谱用于染料化学;前线分子轨道理论在选矿中的研究等等。 二、简介 1、分子轨道理论产生和发展 在分子轨道理论出现以前,价键理论着眼于成键原子间最外层轨道中未成对的电子在形成化学键时的贡献,能成功地解释了共价分子的空间构型,因而得到了广泛的应用。但如能考虑成键原子的层电子在成键时贡献,显然更符合成键的实际情况。1932年,美国化学家 Mulliken RS和德国化学家HundF 提出了一种新的共价键理论——分子轨道理论(molecular orbital theory),即MO法。该理论注意了分子的整体性,因此较好地说明了多原子分子的结构。目前,该理论在现代共价键理论中占有很重要的地位。 以下是各个年代提出的关于分子轨道理论的一些重要理论和方法,是分子轨道理论发展过程中的几个里程碑! 1926-1932年,在讨论分子光谱时,Mulliken和Hund提出了分子轨道理论。 认为:电子是在整个分子轨道中运动,不是定域化的。他们还提出能级图、成键、反键轨道等重要的概念。 1931-1933年,Hukel提出了一种简单的分子轨道理论,用于讨论共轭分子的性质,相当成功。 1950年,Boys用Guass函数研究原子轨道,解决了多中心积分问题,是今天广为利用的自洽场分子轨道理论的基础,在量子化学的研究中占有重要地位。 1951年,Roothaan在Hartree-Fock方程的基础上,把分子轨道写成原子轨道的线性组合,得到Roothaan方程。 1952年,福井谦一提出前线分子轨道理论,用以讨论分子的化学活性和分子间相互作用等,可以解释许多实验结果。 1965年,Woodward和Hoffman提出分子轨道对称守恒原理,发展成讨论基元反应发生可能性的重要规则。用于指导某些复杂化合物分子的合成。 2、分子轨道理论的含义和一些重要分子轨道的构成方法 1)分子轨道理论的含义
浅谈配位化学在各领域的应用 摘要配位化学已经深入到了工业、农业、生命科学、自然科学等诸多领域如可以应用在磁性,荧光,非线性等,配位化学对经济的发展、人们的生活等有着重要的影响。 关键词配合物应用药物工业化妆品 1、配合物在生物化学中的作用。 1.1配合物在有机体中存在着相当重要的作用。 人类每天除了需要摄入大量的空气、水、糖类、蛋白质及脂肪等物质以外,还需要一定的“生命金属”,它们是构成酶和蛋白的活性中心的重要组成部分。当“生命金属”过量或缺少,或污染金属元素在人体大量积累,均会引起生理功能的紊乱而致病,甚至导致死亡。因此显然配位化学在,越来越越显示出其重要作用。 某些分子或负离子,如CO或CN-,可以与血红蛋白形成比血红蛋白?O2更稳定的配合物,可以使血红蛋白中断输O2,造成组织缺O2而中毒,这就是煤气(含CO)及氰化物(含CN-)中毒的基本原理。另外,人体生长和代谢必须的维生素B12是Co的配合物,起免疫等作用的血清蛋白是Cu和Zn的配合物;植物固氮菌中的的固氮酶含Fe、Mo的配合物等。 1.2配合物在药学上的应用 1.2.1抗癌金属配合物的研究 癌症是危害人类健康的一大顽症,专家预计癌症将成为人类的第
一杀手。化疗是治疗癌症的重要手段,但是其毒副作用较大, 于是寻求高效、低毒的抗癌药物一直是人们孜孜以求、不懈努力的奋斗目标。自1965年Rosenberg等人偶然发现顺铂具有抗癌活性以来, 金属配合物的药用性引起了人们的广泛关注, 开辟了金属配合物抗癌药物研究的新领域。随着人们对金属配合物的药理作用认识的进一步深入, 新的高效、低毒、具有抗癌活性的金属配合物不断被合成出来,其中包括某些新型铂配合物、有机锡配合物、有机锗配合物、茂钛衍生物、稀土配合物、多酸化合物等。 顺铂为顺式-二氯二氨合铂(II)的俗称,其抗癌作用是美国生理学家Rosenberg B于1965年偶然发现的。顺铂为平面四边形结构的 配合物,虽然顺铂已经应用于临床, 有较好的疗效, 但由于它水溶小,使肿瘤细胞产生获得性耐药性, 有很强的毒副作用,为了减少它的活性, 人们尝试对它作结构上的修饰,卡铂便是其中之一。卡铂化学为1, 1-环丁二羧酸二氨合铂(II)。结构式中引入了亲水性的1, 1-环丁二羧酸作为配体,因此肾毒性和引发的恶心呕吐均低于顺铂, 其作用机理与顺铂相同,虽然其化学稳定
氨对铜导线腐蚀的影响(摘自--发电机组水冷却系统中铜的腐蚀情况) 氨对铜导线腐蚀速度与氨含量有关,氨含量高时,氨蚀发展很快。通过试验,发现在氨含量大于10~100 mg/L时,有明显氨蚀现象出现;凝结水氨含量不高(一般约在1 mg/L左右,由给水pH调节上限决定),并且内冷水水质受电导率控制,也不发生氨的浓缩,故往内冷水中补凝结水,一般不会发生氨蚀。当往内冷水补加氨的除盐水,就可能使氨的含量达10~100 mg/L,所以此时,要对电导率进行严格控制,方能避免氨蚀的发生。 由于氨能与铜离子形成稳定的铜氨络合物,加速铜的腐蚀,其实,氨对铜的腐蚀是有条件的,只有当溶解氧存在,同时氨的浓度较大时,才能导致铜的腐蚀;有关资料表明:只有当氨的浓度超过10mg/L时,黄铜的腐蚀速度才有明显上升。 表面膜破裂学说应力腐蚀机理。在含氨的介质中,铜和铜合金表面生成“晦暗膜”(tarnish,以Cu2O为主体的氧化物薄膜),而铜合金晶界优先生成此膜。晦暗膜质脆,在拉应力作用下发生破裂。据铃木等研究,纯铜上晦暗膜在晶粒上破裂,黄铜上晦暗膜在晶界上破裂。膜破裂处,溶液腐蚀晶界;随后又缓慢地重新生成膜,并沿晶界生长,当新生成的膜成长到一定厚度以后,形变量达到能使晦暗膜破裂的程度,新膜又发生破裂。如此循环往复,造成应力腐蚀破裂。纯铜产生穿晶破裂,黄铜产生晶间破裂。破裂是不连续进行的,破裂面应呈阶梯状,断口呈锯齿状条纹(有图但我不会贴)。 铜应力腐蚀破裂的影响因素。受拉应力的黄铜在淡水、高温高压水和蒸汽以及一切含氨(或NH4+)的介质中,都可能发生应力腐蚀破裂。最容易引起铜合金应力腐蚀破裂的是氨和能派生氨(或NH4+)的物质,以及硫化物。即使是微量的氨(几个ppm)也能使受拉应力的黄铜产生应力腐蚀破裂。水分或湿气、氧、SO2、CO2和氰等物质都会加速破裂。含锌量少于20%的黄铜,在自然环境中一般不产生应力腐蚀破裂。含锌量大于20%的黄铜,含锌量愈高,应力腐蚀破裂敏感性愈大。黄铜中加入铝、镍、锡能减轻应力腐蚀破裂。一般,黄铜件的应力腐蚀破裂都是在只有残余应力(甚至无负荷)的情况下发生的。冷加工变形的黄铜件,加工后未进行退火的,其残余应力较大,在上述介质中容易引起应力腐蚀破裂。所以,退火消除应力是防止黄钢应力腐蚀破裂的最常用的有效措施。
各国最常用铜及铜合金牌号对照表 品种分类 中国 (GB) 国际标准 (ISO) 美国 (ASTM) 日本 (JIS) 英国 (BS) 德国 (DIN) 欧洲 (EN) TU2 Cu-OF C10100 C1011 C101 OF-Cu CW008A T2 Cu-FRHC C11000 C1100 C101 E-Cu58 TP2 Cu-DHP C12200 C1220 C106 SF-Cu CW024A 紫铜 (红铜) TP1 Cu-DLP C12000 C1201 SW-Cu CW023A 银铜 TAg0.1 CuAg0.1 C10400 C1040 CuAg0.1 H90 CuZn10 C22000 C2200 CZ101 CuZn10 CW501L H70 CuZn30 C26000 C2600 CZ106 CuZn30 CW505L H68 C26200 C2620 CuZn33 CW506L H65 CuZn35 C27000 C2700 CZ107 CuZn36 CW507L H63 CuZn37 C27200 C2720 CZ108 CuZn37 CW508L 黄铜 H62 CuZn40 C28000 C2800 CZ109 CW509L CuSn4 C51100 C5111 PB101 CuSn4 CW450K QSn4-0.3 CuSn5 C51000 C5101 CuSn5 CW451K QSn6.5-0.1 CuSn6 C51900 C5191 PB103 CuSn6 CW452K QSn8-0.3 CuSn8 C52100 C5210 CuSn8 CW453K 锡青铜 QSn6.5-0.4 BZn18-18 CuNi18Zn20 C75200 C7521 NS106 CuNi18Zn20 CW409J BZn18-26 CuNi18Zn27 C77000 C7701 NS107 CuNi18Zn27 CW410J BZn15-20 C7541 锌白铜 BZn18-10 C7350 QFe0.1 (XYK-1) C19210 KFC 引线框架 QFe2.5 (XYK-4) C19400 C1940 注: 1、铜管的材质必须是TP2 或TU2挤压轧制拉伸铜管。TP2 或TU2均为纯铜,呈紫红色,又称紫铜。TU2为无氧铜,纯度高,主要用作真空器件,TP2为磷脱氧铜,多以管材供应,主要用于冷凝器、蒸发器、换热器、热交换器的零件等。 2、中国紫铜加工材按成分可分为:普通紫铜(T1、T2、T 3、T4)、无氧铜(TU1、TU2和高纯、真空无氧铜)、脱氧铜(TUP 、TUMn )、添加少量合金元素的特种铜(砷铜、碲铜、银铜)四类。
一、价键理论:本质为共价键 这个理论统治了配合物结构这一领域达二十多年,但这个价键理论只能说明配合物在基态时的性质,而不能说明与激发态有关的性质(如配合物的各种颜色和光谱),也不能说明同一过渡金属系列中不同配合物的相对稳定性等等。要点:配合物是通过给予体和接受体的反应而生成的, 给予体原子具有孤对电子, 它给出孤对电子进入作为配合物中心原子或离子的空轨道, 为了接受这些电子对, 中心原子的原子轨道首先要进行杂化形成一组新的具有一定方向性和对称性的等价杂化轨道, 再与配体的给予体轨道重叠形成 配键。如果中心原子还有合适的孤对电子, 而配体又有合适的空轨道, 这时中心原子上的孤对电子将进入配体空轨道从而形成反馈的π配键。 条件:1.中心原子内外轨杂化2.配体有孤对电子3.形成配位键 特点:1解释某些过度金属配合物的磁矩 2. 解释配合物的稳定性 3. 解释某些新型配合物 4. 不足Cu(II)配合物的稳定性过度金属配离子的特征颜色 二、晶体场理论 晶体场理论是一种静电理论, 它把配合物中中心原子与配体之间的相互作用, 看作类似于离子晶体中正负离子间的相互作用。但配体的加入, 使得中心原子五重简并的 d 轨道(见图)失去了简并性。在一定对称性的配体静电场作用下, 五重简并的d轨道将解除简并, 分裂为两组或更多的能级组, 这种分裂将对配合物的性质产生重要影响。晶体场理论没有考虑中心原子和配体的电子轨道的重叠。因此,用它来说明中心原子和配体的轨道重叠得很少的配合物是比较成功的,但对于重叠得较多的配合物,晶体场理论只能看作是粗糙的近似。另外,晶体场理论仍不能用于特殊低价和特殊高价的配合物,也不能用于羰基配合物、夹心配合物及烯烃配合物。晶体场理论的核心是配位体的静电场与中心离子的做所引起的d轨道的分裂和d电子进入低能轨道带来的稳定化能是体系能量下降,从而产生一种附加成键作用效应。晶体场理论的三要点: 点电荷、静电作用、轨道分裂晶体场稳定化能的大小与下列因素有关:配合物的几何构型;中心原子的d电子的数目;配体场的强弱;电子成对能。 三、静电理论 1916年,Kossel提出:假定中心原子和配体都是点电荷或偶极子,利用静电的静电公式对配合物进行定量计算。它的优点:能够说明一些配合物、几何构型和稳定性;缺点:将中心原子和配体都看作是没有内部结构的点电荷,不能说明配合物的磁学性质和光学性质。 四、配体场理论(分子轨道理论) 分子轨道理论最初由R.S.Mulliken和F.Fund等提出,用于说明双原子分子和芳香烃的结构。1935年Van Vleck首先用分子轨道理论方法来处理配合物的化学键问题,遵循成键三原则:能量近似、最大重叠和对称性匹配原则。在理论上比晶体场理论等方法更为严谨,所得的结果常用来补充晶体场理论的不足。既适当考虑中心原子与配体化学键的共价性, 又仍然采用晶体场理论的计算方法, 发展成为一种改进了的晶体场理论, 特称为配体场理论。能够有效地组成分子轨