
第一章 催化剂与催化作用基本知识
1、简述催化剂地三个基本特征.
答:①催化剂存在与否不影响△G θ地数值,只能加速一个热力学上允许地化学反
应达到化学平衡状态而不能改变化学平衡;②催化剂加速化学反应是通过改变化学反应历程,降低反应活化能得以实现地;③催化剂对加速反应具有选择性. 2、1-丁烯氧化脱氢制丁二烯所用催化剂为MoO 3/BiO 3混合氧化物,反应由下列各步组成
(1)CH 3-CH 2-CH=CH 2+2Mo 6++O 2-→CH 2=CH-CH=CH 2+2Mo 5++H 20
(2)2Bi 3++2Mo 5+→2Bi 2++2Mo 6+
(3)2Bi 2++1/202→2Bi 3++02-
总反应为CH 3-CH 2-CH=CH 2+1/202→CH 2=CH-CH=CH 2+H 20
试画出催化循环图.
CH 3-CH 2 CH 2=CH-CH=CH 2
Mo 5+
Bi 2+
H 20
3、合成氨催化剂中含有Fe 3O
4、Al 2O 3和K 20,解释催化剂各组成部分地作用. 答:Fe 3O 4:主催化剂,催化剂地主要组成,起催化作用地根本性物质
Al 2O 3:构型助催化剂,减缓微晶增长速度,使催化剂寿命长达数年
K 20:调变型助催化剂,使铁催化剂逸出功降低,使其活性提高
第二章 催化剂地表面吸附和孔内扩散
1、若混合气体A 和B 2在表面上发生竞争吸附,其中A 为单活性吸附,B 2为解离吸附:A+B 2+3*→A*+2B*,A 和B 2地气相分压分别为p A 和p B .吸附平衡常数为k A 和k B .
求吸附达到平衡后A 地覆盖率θA 和B 地覆盖率θB .
解:对于气体A :吸附速率v aA =k aA P A (1—θA —θB ) ;脱附速率v dA =k dA θA 平衡时:v aA =v dA ,即θA =(k aA /k dA )P A (1—θA —θB )=k A ·k B (1—θA —θB )
对于气体B :吸附速率v aB =k aB P B (1—θA —θB )2 ;脱附速率v dB =k dB θ
B 2 平衡时:v aB =v dB ,即θ
B 2= k B P B (1—θA —θB )2 故:B B A A A
A A k k P k 1P k +=θθ
B B A A B B B k k P k 1P k +=θθ
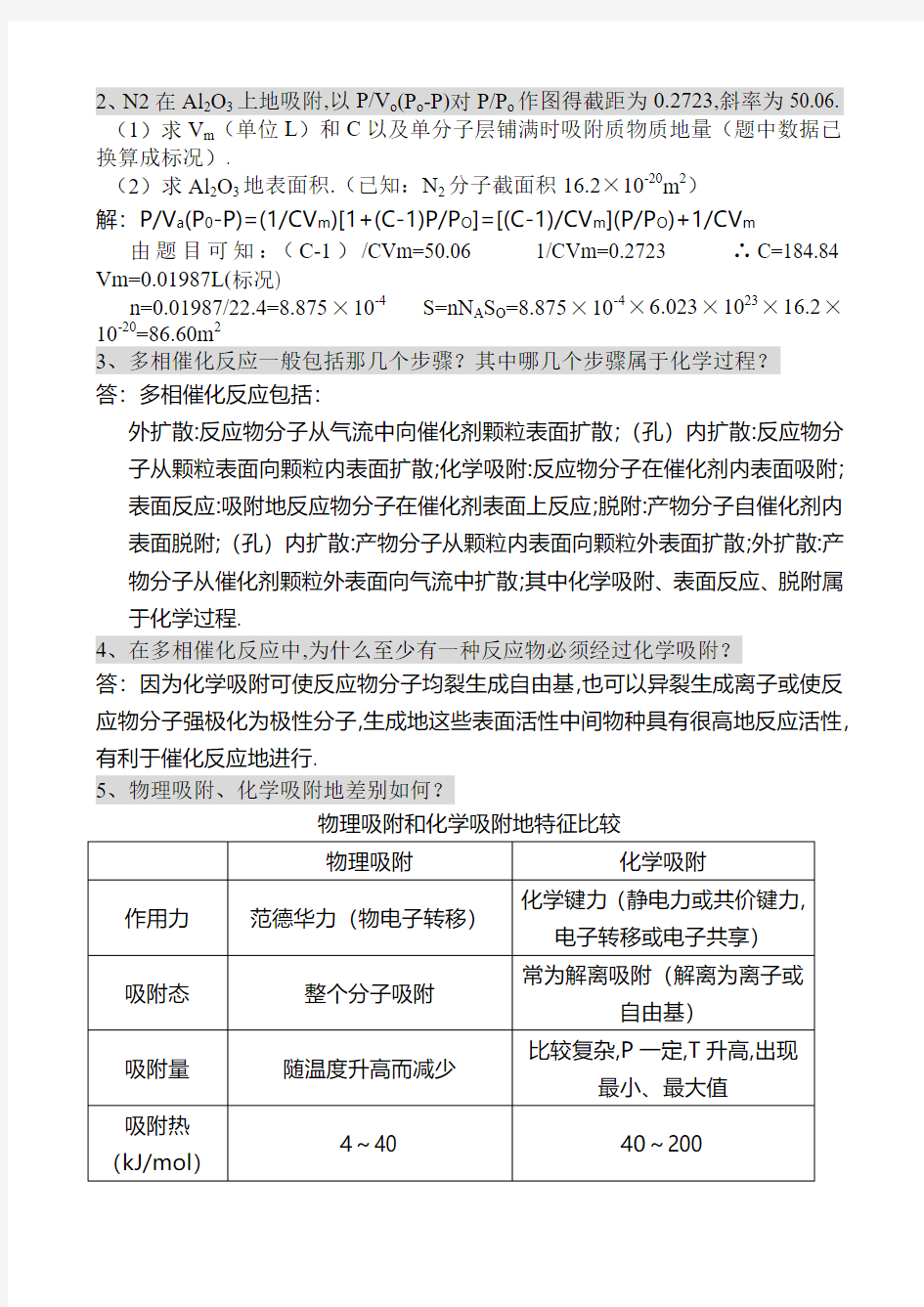
2、N2在Al2O3上地吸附,以P/V o(P o-P)对P/P o作图得截距为0.2723,斜率为50.06. (1)求V m(单位L)和C以及单分子层铺满时吸附质物质地量(题中数据已换算成标况).
(2)求Al2O3地表面积.(已知:N2分子截面积16.2×10-20m2)
解:P/V a(P0-P)=(1/CV m)[1+(C-1)P/P O]=[(C-1)/CV m](P/P O)+1/CV m 由题目可知:(C-1)/CVm=50.06 1/CVm=0.2723 ∴C=184.84 Vm=0.01987L(标况)
n=0.01987/22.4=8.875×10-4S=nN A S O=8.875×10-4×6.023×1023×16.2×10-20=86.60m2
3、多相催化反应一般包括那几个步骤?其中哪几个步骤属于化学过程?
答:多相催化反应包括:
外扩散:反应物分子从气流中向催化剂颗粒表面扩散;(孔)内扩散:反应物分子从颗粒表面向颗粒内表面扩散;化学吸附:反应物分子在催化剂内表面吸附;
表面反应:吸附地反应物分子在催化剂表面上反应;脱附:产物分子自催化剂内表面脱附;(孔)内扩散:产物分子从颗粒内表面向颗粒外表面扩散;外扩散:产物分子从催化剂颗粒外表面向气流中扩散;其中化学吸附、表面反应、脱附属于化学过程.
4、在多相催化反应中,为什么至少有一种反应物必须经过化学吸附?
答:因为化学吸附可使反应物分子均裂生成自由基,也可以异裂生成离子或使反应物分子强极化为极性分子,生成地这些表面活性中间物种具有很高地反应活性,有利于催化反应地进行.
5、物理吸附、化学吸附地差别如何?
物理吸附和化学吸附地特征比较
化学吸附态一般是指分子或原子在固体催化剂表面进行化学吸附地化学状态、电子结构及几何构型.
7、氢地吸附态有:在金属表面上地吸附态(均裂吸附)和在金属氧化物表面上地吸附态(均裂吸附)
8、室温下,氢在ZnO上地化学吸附有两类,它们是:
第一类是快速可逆地吸附:这类吸附地氢参与了乙烯加氢-氘交换反应,表明它是处于活化状态;
第二类化学吸附是慢地、不可逆地:示踪实验表明这类吸附地氢不能进行乙烯加氢和氢-氘交换反应,因而是没有得到活化地.即所谓地高配位M-吸附态和低配位L-吸附态.
9、CO在过渡金属上两种吸附态是:分子态吸附、解离型吸附
10、在一些催化剂上,已经确定了哪几种氧吸附形式?哪种氧吸附态易使烃类发生深度氧化作用?
多种吸附态:电中性地氧分子O2和带负电荷地阳离子(O2-,O-,O2-)
带吸附阳离子与深度氧化有关.
11、关于烯烃在金属上地缔合化学吸附,已经提出哪两种吸附态?答:σ型和π
型
12、有关乙炔在金属表面上地吸附态,已经提出地吸附态有哪几种?
答:π型一位吸附、σ型二位吸附、解离吸附
13、关于苯在金属上地吸附已经提出地看法有:
答:6位σ型吸附、2位σ型吸附、η6π缔合型吸附态、解离吸附
14、在一种催化剂表面产生各种吸附态地成因是多方面地,主要原因有哪两种?答:固有不均一性、诱导不均一性.
15、固有不均一性地定义:指表面原子(离子)微环境地不均一性,一般是指由催化剂本身地结构所决定地和在制备过程中所产生地价不饱和性或配位不配合性地差异.
16、Langmuir吸附地基本假设如何?
答:(1)吸附剂表面是均匀地,各吸附中心能量相同;(2)吸附分子间无相互作用;(3)吸附是单分子层吸附,其吸附分子与吸附中心碰撞才能吸附,一个分子共占据一个吸附中心;(4)一定条件下,吸附与脱附可建立动态平衡.
17、乔姆金等温式成立地条件:
只适用于化学吸附,且在较小地覆盖度范围内才有效,从化学吸附只能在一部分表面中心上进行(即吸附分子只能吸附在可以成键地吸附中心上)地观点来看,上述二者显然是一致地.
18、物理吸附地多分子层理论地基本假设:(1)固体表面是均匀地,自由表面对所有分子地吸附机会相等,分子地吸附、脱附不受其他分子存在地影响;(2)固体表面与气体分子地作用力为范德华力,因此在第一吸附层之上还可以进行第二层、第三层等多层吸附.
19、溢流定义:一定条件下形成或存在于一种固相表面地活性物种,不经脱附过程进入气相而向同样条件下不能直接形成或本来不存在该活性物种地另一种固相表面上地迁移.
第三章酸碱催化剂及其催化使用
1、酸、碱地质子论地定义:
凡是能提供质子(H+)地物质称为酸(B酸);凡是能够接受质子地物质称为碱(B碱)
2、酸、碱地电子论地定义:
凡是能接受电子对地物质称为酸(L酸);凡是能提供电子对地物质称为碱(L碱).
3、软硬酸、碱原则:
(SHAB 原则)软酸与软碱易形成稳定地络合物,硬酸与硬碱易形成稳定地络合物.而交界酸碱不论结合对象是软或硬酸碱,都能相互配位,但形成络合物地稳定性差.
4、酸、碱性质地完整描述包括哪三个方面? 答:酸中心地类型、酸中心地浓度、酸中心地强度
5、均相酸、碱催化反应地特征?
答:均相酸碱催化一般以离子型机理进行,即酸碱催化剂与反应物作用形成正碳
离子或负碱离子中间物种,这些中间物种与另一反应物作用(或本身分解),生成产物并释放出催化剂,构成酸碱催化循环.在这些催化过程中均以质子转移步骤为特征,所以,一些有质子转移地反应,如水合、脱水、酯化、水解、烷基化和脱烷基等反应,均可使用酸碱催化剂进行催化反应. 6、Bronsted 规则公式是什么,怎么使用该规则对液体酸催化反应建立催化剂筛选模型?
答:Bronsted 规则公式:α=a
a a K G k 取对数,得:logk a =logG a +αlogK a 或 logk a =logG a -αpK a
用logk a 对pK a 作图,可得到一直线,斜率为-α
α值在0~1之间.α值很小,表明反应对催化剂地酸强度不敏感,此时任何一种酸都是优良地质子给予者,反应与催化剂酸强度无关;相反,α值接近1,表明反应对催化剂酸强度很敏感,只有强酸中心才能催化该反应. 有些酸催化剂在反应过程中可同时离解出两个或多个质子,在这种情况下就须对方程作些修正.
对酸催化反应为:α=)K p q (G p k a a a
对碱催化反应为:β
=b b b K G k 或 β=)K q p
(G p k b b b 7、对酸中心地检测包括哪几个方面?
答:酸中心地类型、酸量(酸度、酸密度、酸浓度)、酸强度及其分布.
8、以TiO 2-SiO 2 为例,请阐述田部浩三关于二元混合氧化物酸性中心模型.
答:在TiO2-SiO2二元混合氧化物中,
一级结构为杂多负离子;二级结构为杂多负离子和抗衡正离子所组成杂多酸或杂多酸盐地晶体结构;三级结构指地是由杂多负离子抗衡正离子和结晶水所组成地晶体结构.
10、杂多酸地性质:
答:热稳定性:分解温度620~870K,PW>SiW>PMo>SiMo;酸性:杂多酸为强B酸;氧化还原性:杂多酸为强氧化剂;“假液相”性:吸收大量极性分子地杂多酸类似于一种浓溶液
11、用指示剂测定固体酸地酸性
(1)如,某固体酸能使蒽醌变黄色,则样品酸强度:H o≤-8.2
(2)如,某固体酸不能使蒽醌变色而能使亚苄基乙酰苯变黄色,则样品酸强度:-8.2<H o<-5.6
12、正碳离子稳定性顺序是:叔正碳离子>仲正碳离子>伯正碳离子>乙基正碳离子>甲基正碳离子
13、固体碱催化反应机理:负碳离子机理,L碱中心能够供给电子对,把C-H中地H+脱去,形成负碳离子
14、请简述分子筛沸石地结构特点.
答:分子筛地晶格骨架主要由硅铝酸部分所组成,固体内部地原子排列,是按照一定地规律作周期性地三维排列.对于不同地硅铝比例,不同地制备条件与方法,骨架结构也不同.分子筛只有中空地有高度规则性地笼状结构,通向这笼状多面体,有各种大小均一地孔道,从而组成了四通八达地微晶体.入口孔径(窗口)地大小限制了能够吸附在分子筛内部表面地分子地几何大小,从而具有筛分分子地性能.其孔径大小也与阳离子地类型有关.
15、沸石分子筛地离子交换度(简称交换度):
可用Na+交换度衡量:Na+交换度% =(交换下来地Na20量/原来沸石中含地
Na20量)×100%
16、分子筛地择形选择性:
(A)反应物择形催化:当反应混合物中有些反应物分子地临界直径小于孔径时,可以进到晶孔内,与催化剂内表面相接触进行催化反应,而大于孔径地分子不能进入晶孔内,这样便产生反应物择形催化.
(B)产物择形催化:反应产物中分子临界直径小于孔口地可以从孔中扩散出来,最终成为产物,而分子临界直径大于孔径地则无法从孔内溢出,此时便产生了产物选择性.
(C)限制过渡态择形催化:反应物分子相互作用时可生成相应地过渡态,它需要一定空间,当催化剂空腔中地有效空间小于过渡态所需要地空间时,反应将受到阻止,此时便产生限制过渡态选择性催化.
(D)分子交通控制地择形催化:具有两种不同形状和大小和孔道分子筛中,反应物分子可以很容易地通过一种孔道进入到催化剂地活性部位,进行催化反应,而产物分子则从另一孔道扩散出去,尽可能地减少逆扩散,从而增加反应速率.这种分子交通控制地催化反应,是一种特殊形式地择形选择性,称分子交通控制择形催化.
17、请简述催化裂化原料油中固体酸催化剂地发展过程.
催化剂地选择比较明显地经历以下三个阶段:
一、1936 年开始采用天然粘土催化剂(例如酸处理过地白土-微晶膨润土、蒙脱土、高岭土).这些粘土是水合硅铝酸盐,合有可交换地Ca2+、Mg2+、Fe3+等离子.经过H2SO4处理后,这些离子绝大部分为H+所交换;
二、40 年代以后,催化裂化使用了合成非晶态硅酸铝类催化剂(又称硅铝胶SiO2-Al2O3).它地优点是抗硫性能、机械性能较好,所产生地汽油辛烷值比天然催化刑也高,但汽油与焦炭比例较差;
三、近年来,由新型分子筛催化剂,与硅铝胶催化剂对比,有四个特点:1)活性高得多;2)汽油组分中合饱和烷烃及芳烃多,汽油质量较好;3)单程转化率提高,比较不易产生“过裂化”,裂化效率较高;4)抗重金属污染性能高.
第四章金属催化剂及其催化使用
1、金属分散度:分散度(D)=表相原子数/(表相+体相)原子数.分散度是指金属晶粒大小而言,晶粒大,分散度小,反之晶粒小,分散度大.
2、能带:按照分子轨道理论,把金属以及金属氧化物看成N个原子规则排列成地
近乎无限地巨大分子,相邻原子地轨道重叠,组成成属于整个材料地N个非定域分子轨道.随着N趋于无限大,能带总宽度逐渐增大,但仍保持有限值,因此能级间隔趋向于零,称为能带.
3、费米能级:电子在能带中填充地最高能级
4、d 轨道百分数:价键理论认为,过渡金属原子以杂化轨道相结合,杂化轨道通常为s、p、d等原子轨道地线性组合,称为spd 或dsp杂化,杂化轨道中d 原子轨道所占地百分数称为d特性百分数,以符号d%表示.
5、逸出功φ:费密能级与导带顶地能量差,即把一个电子从半导体内部拉到外部,变成完全自由电子时所需地最低能量.
6、金属晶体不均一性:近年来随着表面分析技术地发展,人们用低能电子衍射、俄歇能谱、紫外光电子能谱及质谱等研究金属单晶地表面结构,直接观察到晶体表面存在着晶台、晶阶和晶弯等不均一表面,
7、参照图,根据金属催化剂表面原子地几何排布对催化活性地影响,解释采用金属Ni 催化乙烯加氢反应时Ni
地[110]晶面催化活性高于
[111]晶面地催化活性地原
因.
乙烯地双位吸附络合物如图
所示:乙烯中碳原子为正四面
体,θ约为109°28',
C-C 键距离为0.154 nm,C-Ni 键地距离为
0.182 nm.
答:乙烯在金属催化剂上加氢反应机理是:氢在Ni表面解离,乙烯在Ni表面采取不解离双位(α,β)吸附,然后两者在表面上互相作用,形成半氢化地吸附态CH2CH3,最后进一步氢化为乙烷.
乙烯地双位吸附络合物如图所示:乙烯中碳原子为正四面体,θ约为109°28',C-C键距离为0.154 nm,C-Ni 键地距离为0.182 nm.为了活化最省力,原则上除所欲断裂地键外,其他地键长和键角力求不变.这样就要求双位活性中心M-M 有一定地间距a.a,b,c地关系为:θ=arccos[(c-a)/2b]
金属Ni为面心立方晶格,其不同晶面上有两种Ni-Ni 双位活性中心,分别称为窄活性位和宽活性位.窄活性位Ni-Ni 间距为a=0.248 nm,其吸附乙烯时θ
=105°41’.(比109°28’小4°28’).宽活性位Ni-Ni 间距为a=0.351 nm,其吸
附乙烯时θ=122°57’. (比109°28’小13°32’).
所以,乙烯在窄活性位上吸附时,θ角偏离较小,乙烯几何结构变化较小,因此乙烯在窄活性中心上容易吸附,是一种强吸附.但其加氢活性并不高,这是因为这种吸附产生地活性物种太稳定,不易进行进一步加氢地后续反应.而乙烯在宽活性位上吸附时,θ角偏离较大,乙烯几何结构变化较大,吸附较难,形成键造成分子内地张力较大,是一种弱吸附,但却给出高地加氢活性.
Ni 地[110]晶面含有地宽活性位较多,而[111]晶
面仅含窄活性位,因此Ni 地[110]晶面催化乙烯
加氢地活性高于[111]晶面地催化活性.
8、乙烯在各种金属膜上加氢地速度常数与金属原
子地间距有关,请从金属催化剂地结构和吸附方
面地理论,解释这种现象.
答:金属催化剂进行乙烯加氢反应时,金属地晶格
间距与活性有关.这时因为催化剂地活性和反应物分子在它上面地吸附能力相关.在反应过程中,反应物在催化剂地活性位上进行吸附,吸附地反应物进行反应生成中间态化合物,中间态化合物进一步脱附离开催化剂形成产物.多原子分子在催化剂上地吸附是多位吸附.当反应物分子地几何结构与金属地晶格距离接近时,在反应过程中,吸附地反应物分子在催化剂表面形成强吸附和稳定化合物,不能进一步反应生成中间态和脱附,导致反应物分子不能继续吸附,所以不能起到催化作用.当反应物分子几何结构与金属地晶格距离相差较大时,在反应过程中,反应物分子不能吸附在催化剂表面,也以不能起到催化作用.只有反应物分子地几何结构与金属地晶格距离相匹配,形成强度适中地吸附物种,才能起到催化作用.乙烯加氢反应中,乙烯在金属催化剂上吸附反应时地C-C 键长是0.154nm,而原子间距在0.375~0.39nm 地Pd、Pt、Rh 等与乙烯有强度适中地吸附作用,所以对该反应具有较好地催化作用.
9、巴兰金多位理论:巴兰金:提出催化作用地几何适应性与能量适应性地概念地多位理论.
其基本观点如下:反应物分子扩散到催化剂表面,首先物理吸附在催化剂活性中心上;然后反应物分子指示基团(指分子中与催化剂接触进行反应地部分)与活性中心作用,于是分子发生变形,生成表面中间络合物(化学吸附);通过进一步催化反应,最后解吸成为产物.
几何适应性;指示基团地对称性与活性中心地对称性一致才能具有催化作用. 能量适应性;根据最省力原则,要求活性中心与反应分子间有一定地结构对应性,并且吸附不能太弱,也不能太强.因为太弱吸附速度太慢,太强则解吸速度太慢,只有适中才能满足能量适应地要求.
10、晶格缺陷地类型:原子(离子)缺陷(点缺陷)[空位、间隙原子(离子)、杂质、取代原子(离子)、缔合中心],电子缺陷[电子],扩展缺陷(复合)[缺陷簇、切变面],线缺陷[错位],面缺陷[晶体表面]
11、合金地分类:
机械混合:各金属原子仍保持其原来地晶体结构,只是粉碎后机械地混在一起.这种机械混合常用于晶格结构不同地金属,它不符合化学计量.
化合物合金:两种金属符合化合物计量地比例,金属原子间靠
化学力结合组成地金属化合物.这种合金常用于晶格相同或
相近,原子半径差不多地金属.
固溶体:介于上述两者之间,这是一种固态溶液,其中一种金属
元素可视为溶剂,另一种较少地金属可视为溶解在溶剂中地
溶质.固溶体通常分为填隙式和替代式两种.
12、解释在用 Cu-Ni 合金催化剂催化乙烷氢解和环己烷脱氢
反应过程中Cu 含量增加对两个反应速度影响地差异:乙烷氢
解为甲烷地反应速度降低约4个数量级,而环己烷脱氢速度
只是略有增加,然后变得与合金组成无关,直到接近纯铜时,
速率才迅速下降.
答:(1)Cu-Ni合金催化剂上铜表面富集作用;(2)环己烷脱氢C-H键断裂容易发生,所以合金化影响不明显;(3)而对于乙烷氢解C-C键地裂解,由于发生氢解反应,金属表面至少有一对相邻金属原子与2个C原子成键,才能进行氢解反应. 当镍和铜形成合金时,由于Cu地富集,镍地表面双位数减少,而且吸附强度降低,因而导致氢解反应速度大大降低.
13、计算:[Ni](3d8)(4s2).Ni 六个轨道参与成键,有两种成键杂化轨道.
在Ni-A(d2sp3杂化)中共有6 个杂化轨道,其中4 个原子占据3 个d 轨道,在6 个杂化轨道中共有2 个d 轨道, 故d 轨道百分数为2/6=0.33
Ni-B(d3sp2杂化) 中共有7 个杂化轨道,其中4 个原子占据2 个d 轨道,在7个杂化轨道中共有3 个d 轨道, 故d 轨道百分数为3/7=0.43,故Ni 地d 轨道百分数为:0.33*30%+0.43*70%=40%
答:Ni地d 轨道百分数为40%
第五章金属氧化物催化剂
1、n 型半导体与p 型半导体地掺杂生成规律:
n 型半导体地生成:(1)非化学计量比化合物中含有过量地金属原子或低价离子可生成n型半导体,(2)负离子(氧)缺位,(3)高价离子取代晶格中地正离子,(4)向氧化物引入电负性小地原子.
p 型半导体地生成:(1)氧化物中正离子缺位地非化学计量化合物,(2)用低价正离子取代晶格中正离子,(3)通过向晶格掺入电负性大地间隙原子.
2、使用金属氧化物催化剂进行乙烯完全催化氧化反应(1),
催化剂地活性和生成热焓有关系,如图所示:
下图中纵坐标T1.8代表乙烯转化率达到1.8%时地
反应温度,温度越低表示反应活性越高;横坐标-
△Hf o代表氧化物地生成热焓,表示金属-氧键地强
弱.由图可见,氧化物生成热与乙烯氧化反应活性
成火山曲线.曲线顶端附近是PdO,它地生成热焓△
Hf o=-8.54kJ·g-1(atomO);而乙烯完全氧化反应(1)
地反应热焓ΔH=-220.6 kJ·g-1(atomO);PdO 地ΔHf0与反应热焓1/2ΔH接近,表现出活性最高.试用能量适应原理和金属
氧化物催化剂地氧化还原原理对该现象进行解释.
答:根据催化地能量适应性原理,对于吸热反应,催化剂催化目地反应进行地活化能约为该反应反应热地一半时,催化剂有较好地催化性能.因为乙烯反应热焓ΔH=-220.6KJ.g-1(atomO),所以催化剂地活化能等于1/2ΔH时,具有较好地活性.
对于金属氧化物催化剂上进行地乙烯氧
化反应包括两个过程:即C2H4 地氧化
(同时PdO被还原)和还原地Pd 被气相
氧氧化地过程.
M+1/2O2—MO 1/6C2H4+MO—1/3CO2+1/3H2O+M
这是个串联反应,过程中较慢(活化能较大)地一步将决定反应地速率.在整个反应中维持金属氧化物和金属之间地氧化还原循环是催化剂在反应中起到地地主要作用.当金属氧化物被还原和相应地金属被气相氧氧化地速率相当,才能给出最好地活性.
因为金属被气相氧氧化地反应步骤能够决定整个反应地速率,这步反应地活化能即为整个反应地活化能,因此金属地生成热焓(ΔHf0)等于1/2ΔH地金属氧化物催化剂对该反应具有较好地活性.由图可见PdO 地ΔHf0约等于1/2ΔH,所以有较好地活性.
3. 氧化物催化剂地半导体机理:(半导体催化地电子机理)在半导体催化剂上发生地催化剂反应通常伴有反应物与催化剂之间地电子转移,即反应物在半导体催化剂表面化学吸附形成单电子键、双电子键或离子键,使反应物分子被活化,然后进行一系列化学反应.
4. 氧化——还原机理(dual-redox):过渡金属氧化物催化剂在催化烃类氧化反应中,反应产物中地氧常常不是直接来自气相中氧,而是来自金属氧化物中地晶格氧,气相中地氧只是用来补充催化剂在反应中消耗地晶格氧.
5. 半导体有哪三种类型,它们导电特征是什么?
答:一种是本征半导体,这种半导体要导电,是依靠温度激发,把少量价电子由满带激发到导带(空带)中,导带中得到自由电子,这自由电子导电就叫做电子导电.同时满带放走了部分价电子后,由本来地中和状态(不带电)变为带正电,这在半导体术语中叫做正空穴(或简称正穴)地形成.正穴地移动也能产生电流,这叫做正穴电.它地导电办法是:邻近地电子迁到正空穴地位置,产生新地正空穴,新地正空六又再被其邻近地电子所占住,如此继续下去,使电子向一定地方向流动,产生了电流.电子导电又叫n 型导电.空穴导电又叫P 型导电.所以本征半导体地导电,同时存在n 型导电与P 型导电.
6. 在丁烷氧化脱氢催化剂Cr2O3-Al2O3中添加Li2O 时,其催化脱氢速率下降;加Na2O 量低时(少于1%),脱氢速率也是下降地,但加Na2O 量较大时(大于2%),脱氢速度又增加;加K2O 时,脱氢速率大增.请解释其原因.
Li+离子半径比Cr3+、Al3+离子半径略小,它们容易占据Cr3+、Al3+地位置.价数诱导地结果,引起P 型电导地增加,n 型电导地减少.所以,加进Li2O,使丁烷脱氢
反应速度减小.
加进Na 2O,在少于1%地添加量时,和Li 2O 一样,促使n -减少,亦即使反应速度降低.但加进Na 2O 达到2%时,Na +只能在品格间隙,相当于表面带正电荷,促使表面能放下降,结果使n -增加,从而促进反应.
K +比Na +、Li +地离子半径均大,它不能取代Cr 3+、Al 3+ ,只能在晶格间隙,因而纯粹起着增加n -地作用.使丁烷脱氢反应速度大增.
Langmuir 等温方程
依据模型:①吸附剂表面是均匀地,各吸附中心能量相同;②吸附分子间无相互作用;③吸附是单分子层吸附,其吸附分子与吸附中心碰撞才能吸附,一个分子只占据一个吸附中心;④一点条件下,吸附与脱附可建立动态平衡. 满足上述条件地吸附,就是Langmuir 吸附,其吸附热q 与覆盖度θ无关.
吸附速度va 与压力p 、自由表面(1-θ)成正比,即va=ap(1-θ),式中a 为吸附速度常数;脱附速度vd 只与已覆盖地表面成正比,即vd=b θ,式中b 为脱附速度常数.吸附达到平衡时,va=ad.
所以ap(1-θ)= b θ 于是可得ap b ap +=
θ ,若令b a /=λ,则p
b p λλθ+= 上式即为Langmuir 等温方程,因为m V V /=θ,故可得p
b p V V m λλ+=/式中,m V 为一定压力下单吸附层地饱和吸附量.上式还可表示为p V V V m m λ1111?+=
工业催化答案完整版标准化管理处编码[BBX968T-XBB8968-NNJ668-MM9N]
第一章催化剂基本知识1、名词解释 (1)活性:催化剂使原料转化的速率,工业生产上常以每单位容积(或质量)催化剂在单位时间内转化原料反应物的数量来表示,如每立方米催化剂在每小时内能使原料转化的千克数。 (2)选择性:目的产物在总产物中的比例,实质上是反应系统中目的反应与副反应间反应速度竞争的表现。 (3)寿命:指催化剂的有效使用期限。 (4)均相催化反应:催化剂与反应物同处于一均匀物相中的催化作用。 (5)氧化还原型机理的催化反应:催化剂与反应物分子间发生单个电子的转移,从而形成活性物种。 (6)络合催化机理的反应:反应物分子与催化剂间配位作用而使反应物分子活化。(7)(额外补充)什么是络合催化剂答:一般是过渡金属络合物、过渡金属有机化合物。 (8)反应途径:反应物发生化学反应生成产物的路径。 (9)催化循环:催化剂参与了反应过程,但经历了几个反应组成的循环过程后,催化剂又恢复到初始态,反应物变成产物,此循环过程为催化循环。
(10)线速度:反应气体在反应条件下,通过催化床层自由体积的的速率。 (11)空白试验:在反应条件下,不填充催化床,通入原料气,检查有无壁效应,是否存在非催化反应。 (12)催化剂颗粒的等价直径:催化剂颗粒是不规则的,如果把催化剂颗粒等效成球体,那么该球体的直径就是等价直径。 (13)接触时间:在反应条件下的反应气体,通过催化剂层中的自由空间所需要的时间。(14)初级离子:内部具有紧密结构的原始粒子。 (15)次级粒子:初级粒子以较弱的附着力聚集而成-----造成固体催化剂的细孔。 2.叙述催化作用的基本特征,并说明催化剂参加反应后为什么会改变反应速度 ①催化剂只能加速热力学上可以进行的反应,而不能加速热力学上无法进行的反应。 ②催化剂只能加速反应趋于平衡,而不能改变平衡的位置(平衡常数)。 ③催化剂对反应具有选择性。 ④催化剂的寿命。 催化剂之所以能够加速化学反应趋于热力学平衡点,是由于它为反应物分子提供了一条轻易进行的反应途径。 3.从反应途径说明什么是催化循环
《催化原理》习题(三) 第五章 一.概念题 螯合效应:配合物因形成螯合环而稳定性明显增加的现象。 π酸配合物:这类配合物的特点是配体除了具有孤对电子外,还有空的低能 σ-配合物。这种由配体级的d轨道或π*轨道统称空π-轨道,与中心原子形成π 中处于低能级的空π轨道接受中心原子提供的电子的配合物称为π酸配合物。 硬酸:正电荷高,体积小,可极化性低,即对外层电子约束力大,且具有lewis酸性的金属一般称为硬酸。 反式影响:指配合物中的配体对处于反式位置上的配体成键能力的影响。 配体的空间效应:由于配体的体积不同,而使反应物按一定的方向配位,从而达到有选择地生成产物的目的效应。 二.填空题: 1. 配体对催化反应作用的影响主要有反式影响,反式效应,螯合效应,大环效应,配体的空间效应。 3.根据有机金属反应中价电子数NVE,形式氧化态(OS),以及配位数(N)等的变化,把配位反应可分成配体置放基元反应,Lewis酸离解基元反应,Lewis 碱离解基元反应,还原消除基元反应,插入基元反应,氧化偶联基元反应。三.简答题 1.写出插入反应的两种过渡态机理。 答:一个配体嵌入另一个配体和中心离子之间叫插入反应。 2.根据硬软酸碱规则,判断下列配合物稳定性大小的顺序? [TiF6]2-,[TiCl6]2-,[TiBr6]2 答:Ti为第一类金属,属于硬酸类。F-、Cl-、Br-逐渐由硬变软。考虑酸碱的硬度,根据硬软酸碱规划:软亲软,硬亲硬,边界酸碱不分亲疏。可以得出上述配合物稳定性排序为: [TiF6]2->[TiCl6]2->[TiBr6]2
3.计算[Ni(NH3)6]2+的价电子数是多少,是否符合18电子规则,为什么它可稳定存在? 答:Ni是第28号元素,核外电子排布是3d84s2,每个配体NH3提供2个电子,价电子数为20。不符合18电子规则。配体NH3与金属Ni形成分子轨道,即成6个成键轨道,然后再充满3个非键轨道,最后为Eg*轨道,T2g=6,Eg*=2,稳定化能最大,因此它可稳定存在。 四.回答题 1. 指出每步正、逆均相基元反应的类型以及价电子数(NVE)、形式氧化态(OS)、配位数(N)的变化数。 Rh Cl PR3 PR3 R3P +H2 (1) -PR3 PR3 CH2=CH2 (2) (3) (4) (5) Rh Cl PR3 PR3 R3P H H Rh Cl PR3 R3P H H Rh Cl PR3 R3P H H CH2=CH2 Rh Cl PR3 R3P C2H5 H Rh Cl PR3 R3P C2H5 H (6)-CH3CH3 答:第(1)步:正反应为氧化加成反应,价电子数为16,形式氧化态为2,配位数由4变为6。 逆反应为还原消除反应,价电子数为18,形式氧化态为-2,配位数由6变为4。 第(2)步:正反应为Lewis碱离解反应,价电子数为18,形式氧化态为0,配位数由6变为5。 逆反应为Lewis碱缔合反应,价电子数为16,形式氧化态为0,配位数由5变为6。 第(3)步:正反应为配体置放反应,价电子数为16,形式氧化态为0,配位数由5变为6。 逆反应为配体置放反应,价电子数为18,形式氧化态为0,配位数由6变为
工业催化试卷及答案 Document number【SA80SAB-SAA9SYT-SAATC-SA6UT-SA18】
一、单项选择题(每小题 1 分,共 10 分) 1.为催化剂提供有效的表面和适宜孔结构的是() A.活性组分B.载体 C.助剂 D.助催化剂 2.BET等温式属于五种吸附等温线中的类型() A.I B.II C.III D.IV 3.能给出质子的称为() A.B酸 B.B碱 C.L酸 D.L碱 4.工业上氧化乙烯制环氧乙烷的催化剂是() A.Cu/γ-Al 2O 3 B.Ag/α-Al 2 O 3 C.Ag/γ-Al 2O 3 D.Ni/γ-Al 2 O 3 5.所有金属催化剂几乎都是过渡金属,主要是因为它们______()A.易失去电子 B.易得到电子 C.易强烈吸附反应物D.有着d电子结构 6.X型分子筛最大孔径约为() A. B. C.D. 7.金属在载体上的细微程度用() A.分散度表示 B.单层分布表示 C.粒度表示 D.比表面表示 8.Ziegler-Natta催化属于() A.酸催化 B.金属催化 C.金属氧化物催化 D.络合催化 9.下面属于n型半导体的是() A.ZnO B.NiO C.Cu 2 O D.CuO 10.将燃料的化学能转化为电能的电化学装置称为() A.燃料电池 B.蓄电池 C.发电机 D.燃烧反应器 二、填空题(每空 1 分,共 10 分) 11.一种良好的工业实用催化剂,应该具有三方面的要求,即活性、选择性和稳定性。 12.能给出电子对的固体称为L碱。13.对固体表面酸的描述包括酸的类型、酸强度和酸量。 14.吸附的逆过程称为脱附。 15.在分子筛结构中,相邻的四面体由氧桥联结成环。 16.研究金属化学键的理论有能带理论、价键理论和配位场理论。 17.Cu的加入使Ni的d带空穴变少。 18.金属氧化物催化剂中直接承担氧化功能的是晶格氧。 19.三效催化剂中Pt能有效的促进一氧化碳和HC的催化氧化。 20.催化剂的活性随时间的变化分为成熟期、稳定期和衰老期。 三、判断改错,在题后的括号内,正确的打“√”,错误的打“×”并 改正。(每小题 2 分,共 10 分) 21.对于工业催化剂来说,活性越高越好。 (f) 22.有机物的乙酰化要用L酸位催化。( t ) 23.X型和Y型分子筛的结构是一样的。( f ) 24.择形催化是分子筛的主要特征。( t ) 25.金属的禁带宽度很大。( f ) () 四、名词解释(每小题 4 分,共 20 分) 26.催化剂 凡能加速化学反应趋向平衡,而在反应前后其化学组成和数量不发生变化的物质。 27.超强酸 是一种酸性比100%硫酸还强的酸。H。<- 28.结构敏感反应
、单项选择题(每小题 1分,共10 分) 1.为催化剂提供有效的表面和适宜孔结构的是( ) A .活性组分 B .载体 C .助剂 D .助催化剂 2 . BET 等温式属于五种吸附等温线中的类型( ) A . I B . II C . III 3.能给出质子的称为( ) A . B 酸 B . B 碱 C . L 酸 D . L 碱 4.工业上氧化乙烯制环氧乙烷的催化剂是( ) A . Cu/ Y AI 2O 3 B . Ag/ a Al 2O 3 C . Ag/ Y AI 2O 3 D . Ni/ 丫Al 2O 3 5.所有金属催化剂几乎都是过渡金属,主要是因为它们 ___________ () A .易失去电子 B .易得到电子 12 .能给出电子对的固体称为 L 碱。 13 .对固体表面酸的描述包括酸的类型、酸强度和酸量。 14 .吸附的逆过程称为 脱附。 15 .在分子筛结构中,相邻的四面体由氧 _____ 联结成环。 16 .研究金属化学键的理论有 能带理论 、价键理论和配位场理论。 17. Cu 的加入使 Ni 的d 带空穴 变少 。 18 .金属氧化物催化剂中直接承担氧化功能的是 晶格氧 。 19 .三效催化剂中Pt 能有效的促进 一氧化碳 和HC 的催化氧化。 20 .催化剂的活性随时间的变化分为成熟期、稳定期和 衰老期 二、填空题(每空1分,共10分) 11. 一种良好的工业实用催化剂,应该具有三方面的要求,即活性、选择性和稳定性。 26 .催化剂 凡能加速化学反应趋向平衡,而在反应前后其化学组成和数量不发生变化的物质。 C .易强烈吸附反应物 D .有着d 电子结构 6 . X 型分子筛最大孔径约为( ) A . 0.4 nm B . 0.6 nm C . 0.7 nm D . 0.8 nm 7.金属在载体上的细微程度用( ) A .分散度表示 B . 单层分布表示 C .粒度表示 D . 比表面表示 & Ziegler-Natta 催化属于( ) A .酸催化 B . 金属催化 C .金属氧化物催化 D . 络合催化 9.下面属于n 型半导体的是( ) A . ZnO B . NiO 纸 订 装 C . Cu 2O D . CuO 三、判断改错,在题后的括号内,正确的打“V” ,错误的打“x”并 改正。 (每小题2分,共10分) 21 .对于工业催化剂来说,活性越高越好。(f ) 22 .有机物的乙酰化要用 L 酸位催化。(t ) 23 . X 型和Y 型分子筛的结构是一样的。 (f ) 10.将燃料的化学能转化为电能的电化学装置称为( ) A .燃料电池 B .蓄电池 C .发电机 D .燃烧反应器 24 .择形催化是分子筛的主要特征。 (t ) 25 .金属的禁带宽度很大。 (f ) () 四、名词解释(每小题 4分,共20分)
1.d 2.c 3.a (题目改成单位质量力的国际单位) 4.b 5.b 6.a 7.c 8.a 9.c (不能承受拉力) 10.a 11.d 12.b(d 为表现形式) 13. 解:由体积压缩系数的定义,可得: ()()69 669951000101d 15101/Pa d 1000102110 p V V p β----?=-=-?=??-? 14. 解:由牛顿内摩擦定律可知, d d x v F A y μ= 式中 A dl π= 由此得 d 8.57d x v v F A dl N y μμπδ ==≈
1.a 2.c 3.b 4.c 5. 解: 112a a p p gh gh gh p ρρρ=++=+汞油水 12 2 2 0.4F gh gh d h m g ρρπρ++?? ??? ==油水 (测压计中汞柱上方为标准大气压,若为真空结果为1.16m ) 6.解:(测压管中上方都为标准大气压) (1) ()()13121a a p p g h h g h h p ρρ=+-=-+油水 ρ=833kg/m 3 (2) ()()13121a a p p g h h g h h p ρρ=+-=-+油水 h 3=1.8m. 220.1256m 2 D S π== 31=Sh 0.12560.50.0628V m =?=水 ()331=S 0.1256 1.30.16328V h h m -=?=油 7.解:设水的液面下降速度为为v ,dz v dt =- 单位时间内由液面下降引起的质量减少量为:2 4 d v πρ 则有等式:2 24 d v v πρ =,代入各式得: 20.50.2744 dz d z dt πρ-=整理得: 12 0.5 2 0.2740.2744 t d z dz dt t πρ --==??
工业催化剂综述 引言 化学工业的发展经历了农副产品时代、煤化学时代、石油化学时代。纵观化学工业的发展历史,可以清楚地看出:能源的转换是每次化学工业大变革的核心,而催化剂的进展又在化学工业的大变革中起着决定性的作用。要完成一次重大变革,成批化学工艺需要改革,大量化工技术需要突破,改革和突破的关键是催化剂的创新和换代,创立一种新工艺需要一种新催化剂,出现一类新催化剂就会使化学工业产生一次飞跃。工业催化剂在化学工业中占有举足轻重的地位,约80%的化工生产过程使用催化剂。因此,了解研究工业催化剂成为了一种必要。 一、工业催化剂的定义 1.1催化剂是一类能够改变化学反应速度而本身不进入最终产物分子组成中的物质。能加速反应速度的催化剂成为正催化剂,而减慢反应速度的催化剂则称为负催化剂。 催化剂不改变化学平衡,意味着对正方向有效的催化剂,对反方向的反应同样也是有效的。 1.2工业催化剂是指具有工业生产实际意义的催化剂。一种性能优良的工业催化剂必须能适用于工业生产规模的过程,可在工厂生产所控制的压力、温度、反应物浓度、流速及接触时间等条件下能够长期在工业规模的设备中正常运转,并能持续地、稳定地保持良好的催化活性和选择性。以满足工艺设计指标的要求。此外,一种性能优良的工业催化剂还必须具有良好的耐热、耐毒稳定性,在整个使用期内必须保持良好的抗压碎强度,能耐磨蚀、抗气流冲刷而不易粉化,不至于引起压力降的强烈波动。催化剂的外形与颗粒度的大小能满足工业用催化反应器的要求。如果由于种种原因导致催化剂上积炭、积硫等,或由于某些毒物的影响而使催化活性衰退,可用较为简单的方法在反应器内或反应器外使之再生,恢复活性,至少回复部分活性以维持一定的催化剂使用寿命。此外,还应有工厂能够接受的相对便宜的价格。
工业催化参考试卷――1 一、填空 1. 催化剂只能改变化学反应到达平衡的速率_____________而不改变反应的_ _反应的平衡位置 __________。 2. 多相催化剂通常由_______、_______、_______三部分组成。 3. 评价工业催化剂性能好坏的指标有_______、_______、_______、_______、_______等。 4. 在多相催化反应中有_______、_______、_______三类控制步骤。在连串反应中,控制步骤_______总过程速度。当过程处于_______时,催化剂内表面利用率最高。 5. 固体酸表面存在_______和______两类酸性中心;两者的转化条件是_________________。 6. 催化剂表面能量分布的类型有_______、_______、_______三种形式。 7. Langmuir 吸附等温式用于_______,吸附量与压力的关系是_______。 8. 吸附热表征_______。催化活性与吸附热之间的关系_______。 9. 半导体的附加能级有_______和_______两种,N 型半导体的附加能级是_______能级,它使半导体的E f _______,电导率_______。 10. 络合物催化剂由_______和_______两部分组成。 11. 常用的工业催化剂制备方法有_______、_______、_______等。 12. 造成催化剂失活的原因有_______、_______、_______等。 13. 催化剂上的吸附有_______ 和____________两种类型; H2 的吸附常采用_______ ,烯烃的吸附常采用_________。反应物在催化剂上的吸附态决定了催化反应的 _______。 14. 按照助剂的功能,它可以分为_______、_______两类。 15. d 轨道在四面体配位场中能级分裂为_______、_______两组;当电子成对能P<分裂能Δ 时,电子采取_______排布。 16. 影响过渡金属的催化剂活性的因素有_______、______两方面,组成合金可以调节过渡金属催化剂的_______因素。 17. 分子筛催化剂的特点是_______。常用的分子筛催化剂有_______、_______等。 18. 均相催化的优点是_______、_______;但其缺点是_______、_______等。 19. 选择性的定义是________________________,其计算公式是_______________________。 二、画出[PtCl3(CH2=CH2)]―的空间构型及电子结构图,并指出CH2=CH2 活化的原因。 三、(二选一)1.写出CO+O2→CO2 在P 型半导体催化剂上的反应机理。2.试解释N 型半导体催化剂利于 加氢反应。 n—型半导体: 阳离子过剩,阴离子缺位。 例,ZnO中Zn2+ 离子过剩。 为保持电中性,过剩的离子,拉住一个电子形成eZn2+,在靠近导带附近形成一附加能级。温度升高时,此电子释放出来,成为自由电子,这是ZnO导电的来源。
1、什么是连续介质,在流体力学中为什么要建立连续介质这一理论模型? 答:(1)连续介质是指质点毫无空隙的聚集在一起,完全充满所占空间的介质。 (2)引入连续介质模型的必要性:把流体视为连续介质后,流体运动中的物理量均可以看为空间和时间的连续函数,就可以利用数学中的连续函数分析方法来研究流体运动,实践表明采用流体的连续介质模型,解决一般工程中的流体力学问题是可以满足要求的。 1-9 一只某液体的密度为800kg/,求它的重度及比重。 解: 重度:γ=ρg=800*9.8=7840kg/(˙) 比重:ρ/=800/1000=0.8 注:比重即相对密度。液体的相对密度指该液体的密度与一个大气压下4℃水的密度(1000kg/)之比---------------------------------------------课本p4。 1-11 设烟气在标准状态下的密度为1.3kg/m3,试计算当压力不变温度分别为1000℃和1200℃时的密度和重度 解:已知:t=0℃时,0=1.3kg/m3,且= 则根据公式 当t=1000℃时,烟气的密度为 kg/m3=0.28kg/m3烟气的重度为 kg/m3=2.274kg/m3 当t=1200℃时,烟气的密度为 kg/m3=0.24kg/m3烟气的重度为 kg/m3=2.36kg/m3
1—6 答:绝对压强:以绝对真空为起点计算的压力,是流体的实际,真实压力,不随大气压的变化而变化。 表压力:当被测流体的绝对压力大于外界大气压力时,用压力表进行测量。压力表上的读数(指示值)反映被测流体的绝对压力比大气压力高出的数值,称为表压力。既:表压力=绝对压力-大气压力真空度:当被测流体的绝对压力小于外界大气压力时,采用真空表测量。真空表上的读数反映被测流体的绝对压力低于大气压力的差值,称为真空度。既:真空度=︱绝对压力-大气压力︱=大气压力-绝对压力 1-8 1 物理大气压(atm)= 760 mmHg = 1033 2 mm H2O 1 物理大气压(atm) = 1.033 kgf/cm 2 = 101325 Pa 1mmH20 = 9.81 Pa 1-21 已知某气体管道内的绝对压力为117kPa,若表压为70kPa,那么该处的绝对压力是多少(已经当地大气压为98kPa),若绝对压力为68.5kPa 时其真空度又为多少? 解:P 绝=P 表+P 大气 =70kPa+98kPa =168kPa P 真=-(P 绝-P 大气) =-(68.5kPa-98kPa) =29.5kPa 1、气体在什么条件下可作为不可压缩流体? 答:对于气体,在压力变化不太大(压力变化小于10千帕)或流速
奥赛习题(结构部分) 分子结构 一、氮元素与氢元素能形成多种化合物,现有一种X,在密闭容器中加热使其完全分解,得到N2和H2,它们的分压均为反应前X压强的a倍。 1.X的的化学式(用a表示); 2.如果a=2.5,且X为离子晶体,则满足条件的X的名称和阴离子的空间构型; 3.如果a=2,且X为分子晶体,核磁共振表明结构中所有H原子都完全等价,请画出它们的全部立体结构(用A、B、C……表示),并确定哪些是非极性分子。 二、元素A原子核外s电子是p电子数的4倍,B是与A同族的相邻元素,元素C原子核外s电子数是p电子数的2倍,元素D的5s轨道和5f轨道能量相等。 1.讨论A2D6的成键与构型。 2.写出B4C3水解反应方程式。 3.讨论BD4-离子中B的杂化态。 4.化合物C8D8中所有C原子所处化学环境相同,推测C8D8的结构(C的杂化态,成键, 分子构型) 5.画出C8D8中4个D原子被氯原子取代后产物的几何异构体结构图。 6.讨论B2C6D18中B的杂化态,成键,空间构型。 7.A9C2D112-具有缺顶二十面体结构,每个顶点被AD或CD基团占有,试指出A9C2D112- 的几何异构体数目。 三、比较下列分子键角,并说明原因。 1. NH3和NF3 2. NH3和PH3 3. OF2和OCl2 4. PH3和H2S 四、比较题 1.比较Cl2O与ClO2的键角大小,并解释。 2.比较Cl2O与ClO2中O-Cl键的长短,并解释。 五、在金星大气中存在可观数量的化合物A,A在地球上是一种只有微生物生命活动才能形成的物质。化合物A的分子呈直线型,有弱极性。A在空气中极易着火生成等物质的量的B气体和C气体;A不溶于水,但加热条件下与水蒸气作用,生成B气体和D气体;气体C和D在有水存在的条件下迅速反应,生成固体E;如果在催化剂作用下A水解可以得到固体E和F的溶液。在交流放电的情况下,A分解生成E固体、G气体两种物质。 1.写出A~G各物质的化学式; 2.用X射线衍射法测得由A电解得到的E的晶体为正交晶系,晶胞参数a=1048pm,b=1292pm,c=2455pm。已知该物质的密度为2.07g·cm-3,每个晶胞中有16个E分子。确定E分子中原子的组成。 六、 1.已知最简式为IO2的物质是逆磁性的。且在一定条件下能形成I(ClO4)3·2H2O、(IO)2SO4化合物。 (1)该化合物的可能组成式为; (2)它和热水反应的方程式为; (3)它和NaOH溶液反应的方程式为; 2.已知最简式为ICl3的物质是非极性分子,分子中所有原子共平面。
1、论述催化剂是如何加速反应速率的? 催化剂可以改变反应路线,降低反应的活化能,使反应物分子中活化能的百分数增大,反应数率加快 2、催化作用有哪些基本特征? 1) 催化剂只能加速热力学上可以进行的反应,而不能 加速热力学上无法进行的反应。 2) 催化剂只能加速反应趋于平衡,而不能改变平衡的 位置(平衡常数)。 3) 催化剂对反应具有选择性。 4) 催化剂的寿命 3、说明催化剂为什么不能改变平衡反应的平衡位置? 化学平衡是由热力学决定的,DG0=RTlnKP,其中KP为反应的平衡常数,DG0是产物与反应物的标准自由焓之差,是状态函数,只决定于过程的始终态,而与过程无关,催化剂的 存在不影响DG0值,它只能加快达到平衡所需的时间,而不 能移动平衡点 4、具有加氢功能的催化剂往往对脱氢反应也有活性。试给予解释。 根据Kf=K1/K2,催化剂可以以相同的比例加速正、逆反应速率常数。因此,对于可逆反应,能够催化正方向反应的 催化剂,就应该能催化逆方向反应。 5、通常固体催化剂有哪几个部分组成的? 活性组分、助催化剂、载体 6、试说明催化剂稳定性与寿命的区别与联系。 稳定性:是指催化剂的活性和选择性随时间变化的情况。寿命:是指在工业生产条件下,催化剂的活性能够达到装置生产能力和原料消耗定额的允许使用时间。区别:前者指的是变化情况,后者指的是时间长短。联系:催化剂的稳定性直接影响了其寿命,稳定性好的催化剂的寿命长,稳定 性不好的则短。 7、多相催化反应通常包括哪个连续的步骤? (1)反应物分子从气流中向催化剂表面和孔内扩散;(2)反应物分子在催化剂内表面上吸附;(3)吸附的反应物分子在催化剂表面上相互作用或与气相分子作用进行化 学反应;(4)反应产物自催化剂内表面脱附;(5)反 应产物在孔内扩散并扩散到反应气流中去。 8、试比较物理吸附与化学吸附。 物理吸附是借助分子间力,吸附力弱,吸附热小 (8-20kJ/mol),且是可逆的,无选择性,分子量越大物 理吸附越容易发生。化学吸附化学吸附是借助于化学键力,遵从化学热力学和化学动力学的传统定律,具有选择性特征,化学吸附吸附热大(40-800kJ/mol),一般是不可逆的, 尤其是饱和烃分子的解离吸附。 9、固体表面发生化学吸附的原因是什么? 发生化学吸附的原因,是由于位于固体表面的原子具有 自由价,这些原子的配位数小于固体内原子的配位数,使得每个表面原子受到一种内向的净作用力,将扩散到其附近的 气体分子吸附形成化学键 10、金属表面上甲烷和氢分子的吸附,只能形成解离型 化学吸附,为什么? 因为分子氢、烃分子在吸附之前先必须解离,因为很多 这类分子不能直接与金属的“表面自由价”成键,必须先自身解离,成为有自由价的基团,所以只能形成解离理化学吸附。 11、如何判断一个催化反应是存在内、外扩散的控制? 如果反应物流量的改变对反应物的转化率影响较大,则 存在外扩散控制;如果催化剂的粒径大小的改变对转化率的影响较大,则存在内扩散控制。 12、试叙述固体表面酸中心类型测定方法、以吡啶作 吸附质的IR谱法(1)L酸的红外光谱特征峰:1450cm-1 、1490cm-1 和1610cm -1 (2)B酸的红外光谱特征峰:1540cm-1 13、试叙述固体酸强度测定方法。 (1)胺滴定法:选用一种适合的pKa指示剂(碱),吸附于固体酸表面上,它的颜色将给出该酸的强度(2)气态碱吸附法:当气态碱分子吸附在固体酸位中心时,强酸位 吸附的碱比弱酸位吸附的更牢固,使其脱附也更苦难。当升温排气脱附时,弱吸附的碱将首先排出,故依据不同温度下 排出(脱附)的碱量,可以给出酸强度和酸量。 14、请简要叙述沸石结构的三个层次 第一个结构层次:硅氧四面体和铝氧四面体第二个结构层次:由硅氧四面体或铝氧四面体通过氧桥联结成的环第三个结构层次:氧环通过氧桥相互联结,形成具有三维空间的多面体 15、3A、4A和5A分子筛都是型分子筛吗?它们的孔径大小分别为多少?其结构中的阳离子分别是什么? 是。3A:0.3nm 钾离子;4A:0.4nm 钠离子;5A:0.5nm 钙离子。 16、X型和Y 型分子筛的结构一样吗?它们的区别在哪里?其硅铝比分别是多少? 不一样。区别在于硅铝比不同。X型Si/Al为1-1.5;Y型Si/Al为1.5-3.0。 17、简述分子筛的主要四种催化作用、(1)酸催化;(2)择形催化;(3)双功能催化;(4)催化氧化 18、分子筛择形催化有哪四种不同形式、(1)反应物的择形催化;(2)产物的择形催化;(3)过渡状态限制的择形催化;(4)分子交通控制的择形催化 19、什么类型的分子筛具有催化氧化性能 TS-1 分子筛;ZSM-5 分子筛 20、依形态结构划分,金属催化剂分别有哪五种类型? 1)块状金属催化剂;2)分散或负载型金属催化剂;3)合金催化剂; 4)金属互化物催化剂;5)金属簇状物催化剂 21、简述金属催化剂可以发生的四种反应类型。 1)加氢反应;2)氧化反应;3)重整反应;4)氢醛化反应 22、什么是 d 带空穴?它与金属催化剂的化学吸附和催化性能之间的关系式什么? 金属的 d 带中某些能级未被充满,可看作 d 带中的空穴,称为“d 带空穴”。有 d 带空穴,就能与被吸附的气体分子形成化学吸附键,生成表面中间物种,具有催化性能。 d 带空穴愈多,末配对的 d 电子愈多,对反应分子的化学吸附也愈强。催化剂的作用在于加速反应物之间的电子转移,这就要求催化剂既具有接受电子的能力,又有给出电子的能力。过渡金属的 d 空穴正是具有这种特性,然而对一定的反应,要求催化剂具有一定的 d 空穴,而不是愈多愈好 23、什么是 d 特性百分数?它与金属催化剂的化学吸 附和催化活性有什么关系。 d 特性百分数(d%):杂化轨道中 d 原子轨道所占的百分数。 d%越大化学吸附能力越强。但从活化分子的能量因素考虑,要求化学吸附既不太强,也不要太弱。吸附太强导致不可逆吸附,吸附太弱则不足以活化反应分子,所以要求d%有一定范围 24、为什么金属催剂都是过渡金属? 金属催化剂主要是过渡金属,特别是 VIII 族金属。这与金属的结构、表面化学键有关;过渡金属是很好的加氢、脱氢催化剂,H2 很容易在金属表面吸附,吸附反应不会进行到催化剂的体相;一般金属在反应条件下很容易被氧化到体相,不能作为氧化反应催化剂,但贵金属(Pd,Pt, Ag, Au 等)能抗拒氧化,可作为氧化反应催化剂 25、什么是几何对应理论? 要求催化剂原子和反应物分子结构在几何尺寸上接近的理论称之为几何对应理论, 26、金属催化剂为什么大多数制备成负载型催化剂? 因为金属催化剂尤其是贵金属,价格昂贵,将其分散成微小的颗粒附着在高表面积和大孔隙的的载体上,可以节省用量,增加金属原子暴露于表面的机会。 27、请说明双金属催化剂的主要类型和用途。 第一类,第 VIII 族和 IB 族元素组成的双金属系,如Ni-Cu,Pd-Au 等合金;主要用于烃的氢解,加氢和脱氢等反应;第二类,两种 IB 族元素组成的,如 Ag-Au, Cu-Au 等合金,用于改善部分氧化反应的选择性;第三类,两种 VIII 族元素组成的,如 Pt-Ir, Pt-Fe 等合金,用于增加催化剂活性的稳定性。重整催化剂 Pt-Ir 较之 Pt 的稳定性大大提高,原因: Pt-Ir 形成合金减少表面烧结; Ir 有强的氢解活性,抑制了表面积炭的生成。 28、金属硫化物催化剂的基本用途是什么? 金属硫化物催化剂,如 Mo、W、Ni、Co、Fe 等的金属硫化物具有加氢、异构、氢解等催化活性,用于油品的加氢精制;加氢脱硫(HDS)、加氢脱氮(HDN)、加氢脱金属(HDM)等过
第一章 1-9解 3/78408.9800m N g =?==ργ 8.01000 800 =比重 1-10解 3 3 /kg 1358010 5006790m V m =?== -ρ 3/1330848.913580m N g =?==ργ 1-11解 273 10 t t += ρρ 31000/279.027******* .1m kg =+ = ρ 31200/241.0273 120013 .1m kg =+ = ρ 或 RT P =ρ C R p T == ρ 221100T T T ρρρ== 31 01/279.01000 273273 3.1m kg T T =+?= = ρρ 32 02/241.01200 273273 3.1m kg T T =+?= = ρρ 1-12解 T V V V P T V V t V ?-=? ? ? ????= 1111α 423.1200 273400 2731212=++==T T V V
增大了0.423倍。 1-13解 ?? ? ?? +=27310t v v t s m t v v t /818.5273 90027325 27310=+= ? ? ? ??+= 1-14解 RT P =ρ K m K mol J K mol L atm K s m T P R /27.29/31.8/082.0/05.287273 293.110132522=?=??=?=?== ρ 1-15解 RT P = ρ ()33 111/774.020*********.65m kg RT P =+??==ρ () 33 222/115.137273287102.99m kg RT P =+??==ρ 1-20解 dP dV V P 1- =α 7 9 0210210 5.0%1?=?= -=-P P dP 1-18解 2 2 2111T V P T V P = 2.020 27379273100792.610032.15 5122112=++???=?=T T P P V V 111128.02.0V V V V V V -=-=-=? 体积缩小了0.8倍。 1-19解 C PV k = nRT PV =
合肥市2019-2020学年九年级第一次练兵考试化学试题(I)卷 姓名:________ 班级:________ 成绩:________ 一、单选题 1 . 我们生活在不断变化的物质世界里,认识物质及其变化,与我们的日常生活紧密相关。下列生活中常见的变化,属于化学变化的是() A.气球爆炸 B.酒精挥发 C.馒头发霉 D.灯泡发光 2 . 下列实验现象描述正确的是 A.铁在氧气中剧烈燃烧,火星四射,生成白色固体 B.红磷在空气中燃烧产生大量的白雾,生成五氧化二磷 C.往紫色石蕊试液中通入二氧化碳气体,溶液由紫色变为红色 D.块状石灰石中加入一定量的稀硫酸,持续产生大量气泡 3 . 下列固体物质溶于水的过程中,溶液温度显著升高的是() A.氢氧化钠B.氯化钠C.硝酸铵D.蔗糖 4 . 化学与人类生活息息相关,下列说法正确的是 A.红肉含有血红素铁,很容易被人体吸收并恢复体内的铁,人体缺铁会引起佝偻病。 B.烹调食物所用燃料天然气的主要成分是甲烷,观察到火焰呈黄色或橙色时,需将灶具的空气进风口调大。C.聚乙烯具有热固性,能制成薄膜,废弃塑料不回收会造成白色污染。 D.将煤块粉碎后再燃烧,其目的是减少有害气体的排放。 5 . 我国用长征二号改进火箭发射神舟十号载人飞船,火箭所用的液态燃料偏二甲肼(C2H8N2)与N2O4发生的反应可写作:C2H8N2+2N2O4═3N2↑+2CO2↑+nH2O↑.下列说法正确的是() A.该化学方程中n=3B.该反应是分解反应 C.该反应要吸收大量的热D.N2O4是氧化物
6 . 目前,许多烧烤店都改用机制炭作燃料,引燃机制炭可以使用固体酒精,盖灭机制炭可以使用炭灰,下列有关说法错误的是() A.酒精的燃烧是为了升高温度 B.炭灰可以隔绝空气而使机制炭熄灭 C.酒精的燃烧会升高机制炭的着火点 D.机制炭做成空心可以增大与空气的接触面积 7 . 对生活中下列现象的解释不正确的是() 现象解释 A自行车轮胎在阳光下暴晒而炸裂分子受热,体积变大 B6000L氧气在加压情况下可装入容积为40L的钢瓶中气体分子间间隔大,易于压缩 C在无外力条件下,花粉会在平静的水面上移动分子在不断运动 D湿衣服在夏天比在冬天干得快温度升高,分子运动速率加快 A.A B.B C.C D.D 8 . 化学中常用“箭头”表示一种物质可以向“→”所指方向一步转化为另一种物质,“连线”表示两端物质可以反应。如图为碳和碳的化合物的相互转化关系图,下列说法错误的是 A.反应①箭头可以改为连线
专科《工业催化》 一、(共50题,共100分) 1. 关于催化剂描述不正确的是 ( ) (2分) A.催化剂量与化学计量方程式无关 B.反应速度通常与催化剂量成正比 C.加速反应但不参加反应者也是催化剂 D.参加反应后催化剂会有变化但很微小 .标准答案:C 2. 工业上用于空气氧化乙烯制环氧乙烷的催化剂中和分别作为( ) (2分) A.主催化剂和助催化剂 B.主催化剂和载体 C.载体和主催化剂 D.助催化剂和主催化剂 .标准答案:B 3. MgO载体是( ) (2分) A.酸性载体 B.两性载体 C.中性载体 D.碱性载体 .标准答案:D 4. 在过渡金属中,下列哪种物质的化学吸附最弱( ) (2分) A.乙烷 B.乙烯 C.乙炔 D.苯 .标准答案:A 5. 孔半径范围在1.5~15nm的孔称为()(2分) A.微孔 B.中间孔 C.中大孔 D.大孔 .标准答案:B 6. 下列催化剂制备方法中,只能制备低含量金属负载型催化剂的是( ) (2分) A.沉淀法 B.机械混合法 C.离子交换法 D.浸渍法 .标准答案:C 7. B.E.T.方程式的导出是基于( ) (2分) A.化学吸附的多分子层理论,用Langmuir的理想表面吸附模型推导出来 B.物理吸附的多分子层理论,用Langmuir的理想表面吸附模型推导出来的 C.物理吸附的单分子层理论,用Langmuir的理想表面吸附模型推导出来的 D.物理吸附的多分子层理论,用Freundlich的非理想表面吸附模型推导出来的 .标准答案:B 8. 两种反应物参加的多相催化反应中( ) (2分) A.两种反应物都必须发生化学吸咐 B.至少一种反应物发生化学吸附 C.至少一种反应物发生物理吸附 D.以上都可以 .标准答案:B 9. 在催化剂的煅烧过程中,下列哪种说法不正确( ) (2分) A.失去化学键合的水或二氧化碳 B.不改变孔径分布 C.形成活性相 D.稳定机械性质 .标准答案:B 10. 助催化剂()(2分) A.本身对某一反应有很好的活性 B.加入的量一般小于催化剂总量的10% C.对载体没有帮助 D.对催化活性组分无影响 .标准答案:B 11. 下列哪种制备方法是控制均匀沉淀的有效方法( ) (2分) A.在金属盐溶液中加NaOH作沉淀剂 B.在金属盐溶液中加尿素作沉淀剂并加热 C.在金属盐溶液中加Na2CO3作沉淀剂 D.在金属盐溶液中加醋酸作沉淀剂 .标准答案:B 12. 在用压汞法测孔结构时( ) (2分) A.样品孔半径越大,所需汞压越大 B.样品孔半径越小,所需汞压越小 C.样品孔半径越大,所需汞压越小 D.样品孔半径与所需汞压无关 .标准答案:C 13. 下列金属催化剂中,加氢反应活性最高的是( ) (2分) A.Pt B.Pd C.Ni D.Cu .标准答案:A 14. 在过渡金属催化加氢催化剂中,一般其“d带空穴”和“d特征百分数”范围在 ( ) (2分) A.0~2,40~50% B.2~4,40~50% C.0~2,80~90% D.2~4,80~90% .标准答案:A
第一章 流体的主要物理性质 1-1何谓流体,流体具有哪些物理性质? 答:流体是指没有固定的形状、易于流动的物质。它包括液体和气体。 流体的主要物理性质有:密度、重度、比体积压缩性和膨胀性。 2、在图3.20所示的虹吸管中,已知H1=2m ,H2=6m ,管径D=15mm ,如果不计损失,问S 处的压强应为多大时此管才能吸水?此时管内流速υ2及流量Q 各为若干?(注意:管B 端并未接触水面或探入水中) 解:选取过水断面1-1、2-2及水平基准面O-O 1-1面(水面)到2-2面的贝努利方程 再选取水平基准面O ’-O ’, 列过水断面2-2及3-3的贝努利方程 (B) 因V2=V3 由式(B)得 图3.20 虹吸管 g p H g p a 22022 2121υ γ υ γ + + =+ + g p p a 22222υ γ γ + + =g p g p H H a 202)(2322 221υγυ γ+ +=+++g g p 2102823222υ υ γ + =+ + ) (28102水柱m p =-=γ ) (19620981022a p p =?=) /(85.10)410(8.92)2( 222s m p p g a =-?=-- =γ γ υ
) /(9.1)/(0019.085.104 )015.0(32 22s L s m A Q ==??= =πυ
5、有一文特利管(如下图),已知d 1 =15cm ,d 2=10cm ,水银差压计液面高差?h =20cm 。若不计阻力损失,求常温(20℃)下,通过文氏管的水的流量。 解:在喉部入口前的直管截面1和喉部截面2处测量静压力差p 1和p 2,则由式 const v p =+22ρ可建立有关此截面的伯努利方程: ρ ρ22 212122p v p v +=+ 根据连续性方程,截面1和2上的截面积A 1和A 2与流体流速v 1和v 2的关 系式为 2211v A v A = 所以 ])(1[)(2212212A A p p v --= ρ 通过管子的流体流量为 ] )(1[) (22 1 2212A A p p A Q --=ρ )(21p p -用U 形管中液柱表示,所以 074.0) )15.01.0(1(10)1011055.13(2.081.92)1.0(4])(1[)(22 2 2 3332212'2 =-??-????=--?=πρρρA A h g A Q (m 3 /s) 式中 ρ、'ρ——被测流体和U 形管中流体的密度。
第二阶段在线作业 单选题(共20道题) 收起 1.( 2.5分)催化裂化装置一般由三个部分组成,即:反应-再生系统、分馏系统、吸收-稳定系统,其 中__是催化裂化装置的核心。 ?A、反应-再生系统 ?B、分馏系统 ?C、吸收-稳定系统 我的答案:A 此题得分:2.5分 2.(2.5分)工业催化裂化过程中,__产品不能得到。 ?A、液化气 ?B、汽油 ?C、柴油 ?D、焦炭 我的答案:D 此题得分:2.5分 3.(2.5分)催化裂化过程中__属于强吸热反应。 ?A、异构化 ?B、氢转移 ?C、分解 ?D、缩合 我的答案:C 此题得分:2.5分 4.(2.5分)下列__最容易在催化裂化催化剂上吸附。 ?A、烯烃 ?B、稠环芳香烃 ?C、稠环环烷烃 ?D、烷烃 我的答案:B 此题得分:2.5分 5.(2.5分)下列__最不易在催化裂化催化剂上吸附。 ?A、烯烃 ?B、稠环芳香烃 ?C、稠环环烷烃 ?D、烷烃 我的答案:D 此题得分:2.5分
6.(2.5分)在催化裂化过程中反应速率最快的是__。 ?A、烯烃 ?B、稠环芳香烃 ?C、稠环环烷烃 ?D、烷烃 我的答案:A 此题得分:2.5分 7.(2.5分)下面__的生焦速率最大。 ?A、烯烃 ?B、稠环芳香烃 ?C、稠环环烷烃 ?D、单环芳香烃 我的答案:B 此题得分:2.5分 8.(2.5分)下面__不属于烷烃催化裂化的特点。 ?A、产物中异构物多 ?B、产物中α-烯烃多 ?C、气体产物以C3、C4为主 ?D、异构烷烃反应速度比正构烷快很多 我的答案:B 此题得分:2.5分 9.(2.5分)下面__不属于重油催化裂化的特点。 ?A、轻质油收率低 ?B、生焦多 ?C、产品质量差 ?D、催化剂寿命长 我的答案:D 此题得分:2.5分 10.(2.5分)导致裂化催化剂中毒的金属主要是__和__。 ?A、镍、铁 ?B、镍、钒 ?C、铁、钒 ?D、铁、铜 我的答案:B 此题得分:2.5分 11.(2.5分)以下炼油厂的蒸馏操作中,以__的分离效果最好。?A、闪蒸 ?B、简单蒸馏 ?C、精馏