
河南农业大学牧医工程学院
1
Gateway 基因克隆
Gateway 基因克隆是由Invitrogen 公司在二十世纪九十年代末发明并应用于分子生物学基因克隆的一项专利技术。该技术利用专有的重组序列使得DNA 片段能够更有效地被转入质粒当中,可应用于大片段的基因克隆,并且在保持正确阅读框的前提下让不同表达载体间的DNA 转移成为可能。
这一技术在插入的目的DNA 片段两端整合att L1和att L2两个侧端重组序列,来构建一个类似通道的结构并称之为“入门克隆”(Gateway Entry Clone )。据Invitrogen 宣称Gateway 技术使用99%有效且可逆的一小组重组反应,如此使得基因克隆不同于传统的限制性内切酶方法,避免了目的片段内存在切点的问题而使得大片段DNA 保持其完整性,大大提高了克隆效率,常应用于大规模的DNA 片段整合进同一种表达载体,因此又称之为高通量基因克隆技术(Gateway Cloning Technology )。
一、Gateway 基因克隆的原理及机制
Gateway 被视为一种克隆操作平台:把目的基因克隆到入门载体(Entry Vector )后,就不用依赖限制性内切酶,而靠载体上存在的特定重组位点和重组酶,高效、快速地将目的基因克隆到其它的受体载体(Destination Vector ,目的载体)上。
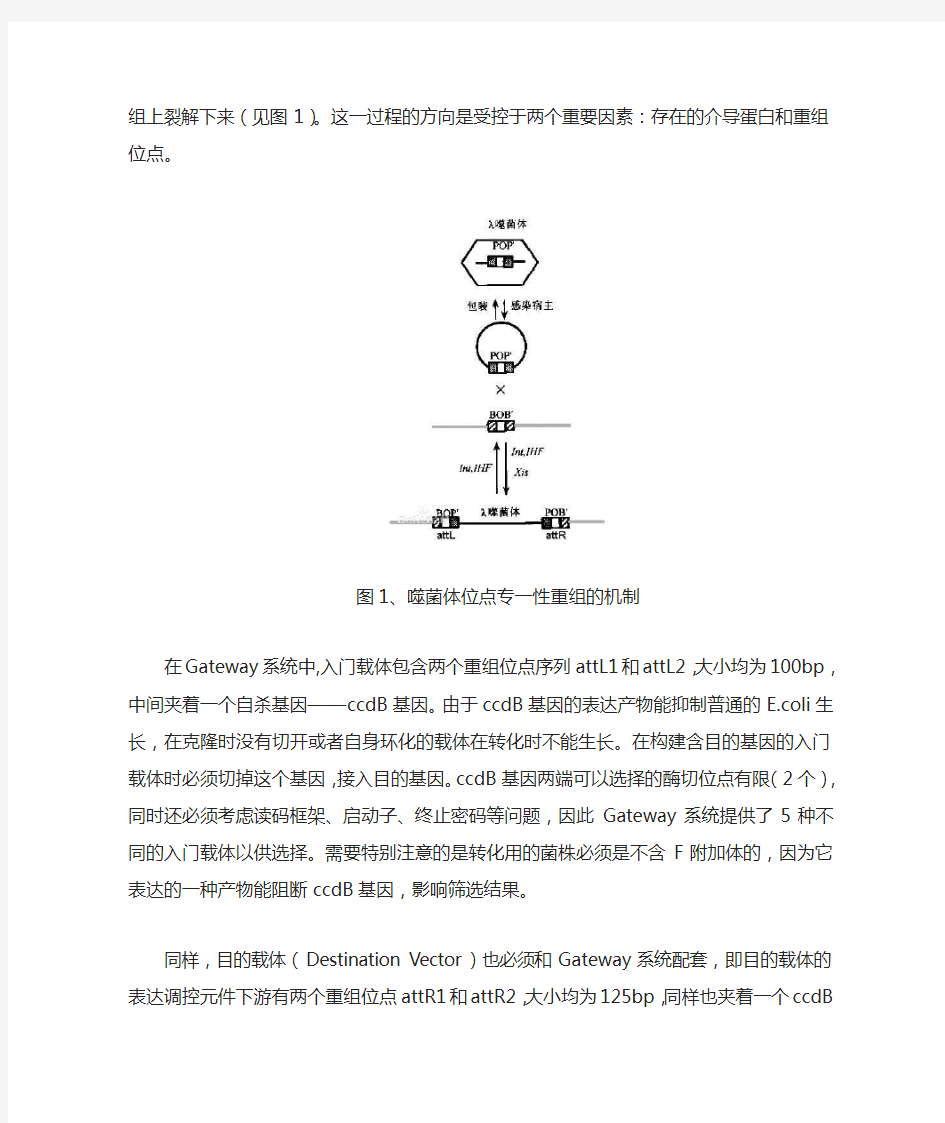
Gateway 的原理是建立在噬菌体DNA 定点整合到细菌宿主基因组上。在噬菌体和细菌的整合因子(INF 、Int )的作用下,lambda 的attP 位点和大肠杆菌基因组的
attB 位点可以发生定点重组,lambda 噬菌体DNA 整合到大肠杆菌的基因组DNA 中,两侧产生两个新位点:attL 和attR 。这是一个可逆的过程,如果在一个噬菌体编码蛋白Xis 和IHF 、Int 的共同介导下这两个新位点可以再次重组回复为attB 和attP 位点,噬菌体从细菌基因组上裂解下来(见图1)。这一过程的方向是受控于两个重要因素:存在的介导蛋白和重组位点。
图1、噬菌体位点专一性重组的机制
在Gateway系统中,入门载体包含两个重组位点序列attL1和attL2,大小均为100bp,中间夹着一个自杀基因——ccdB基因。由于ccdB基因的表达产物能抑制普通的E.coli生长,在克隆时没有切开或者自身环化的载体在转化时不能生长。在构建含目的基因的入门载体时必须切掉这个基因,接入目的基因。ccdB基因两端可以选择的酶切位点有限(2个),同时还必须考虑读码框架、启动子、终止密码等问题,因此Gateway系统提供了5种不同的入门载体以供选择。需要特别注意的是转化用的菌株必须是不含F附加体的,因为它表达的一种产物能阻断ccdB基因,影响筛选结果。
同样,目的载体(Destination Vector)也必须和Gateway系统配套,即目的载体的表达调控元件下游有两个重组位点attR1和attR2,大小均为125bp,同样也夹着一个ccdB 自杀基因。
当需要将目的基因从入门载体(Entry Vector)转移到目的载体(Destination Vector)时,只要将两种质粒混合(线性化能有效提高重组率),加入含有Int、IHF、Xis等重组因子的LR重组酶混合物,attR2序列和attL2序列发生重组,生成一个融合质粒。attL1序列再和attR1序列重组,融合质粒分解为两个新的质粒,目的基因与原来位于目的载体上的自杀基因发生重组置换,得到一个带目的基因的目的载体(生成新的重组位点attB1、B2)和带自杀基因的入门载体(生成新的重组位点attP1、P2,见图2)。由于带自杀基因的载体不能生长,加上抗生素筛选,转化产物重组率高达90%以上。
图2、gateway机制
由于在这个反应中attL1序列只和attR1序列重组,attL2序列只能与attR2序列重组,这个方向的反应称为LR反应。LR反应生成新的位点称为attP1/2(200bp)和attB1/2(25bp)序列。在一定的条件下,attP和attB序列也能发生重组,生成attL和attR序列,这个反向反应称为BP反应(见图3)[1]。
图3、BP反应及LR反应
当用户得到一个含目的基因的Gateway表达载体,希望将目的基因转移到另外几个Gateway表达载体中时,只要先将目的基因从Gateway表达载体中转移到入门载体上,在由入门载体转移到其它的表达载体就行。将含目的基因的Gateway表达载体(attB1—目的基因—attB2序列)与带有attP1-ccdB(自杀基因)-attP2序列的供体载体(pDONR,注意这个载体不同于入门载体Entry Vector)混合,加入含有Int、IHF的BP重组酶混合物,attP 和attB序列也能发生重组,生成带有目的基因的入门载体(Entry Vector)和带自杀基因的表达载体。同样,由于抗性不同以及自杀基因的作用,只有含目的基因的入门载体能被筛选出来。这即是BP反应。需要特别注意的是表达载体如果也是卡那霉素抗性,就必须选择另外一个供体质粒以便筛选。
二、Gateway 基因克隆优点
Gateway技术能够克隆一个或多个基因进入到任何蛋白表达系统(图4)。这项强大的体外技术大大地简化了基因克隆和亚克隆的步骤,而同时典型的克隆效率高达95%或更高。当基因在目的表达载体之间快速简便的穿梭时,还可以保证正确的方向和阅读框。Gateway 也有助于进行带不同数目纯化和检测标签蛋白的表达。
图4 Gateway技术的灵活性
Gateway利用了位点特异重组,所以在构建入门载体后,不再需要使用限制性内切酶和连接酶。一旦您拥有了一个入门克隆,就可以多次使用它,转移的目的基因到Gateway 改造过的各种表达载体(目的载体)。
此外,由于在重组时DNA片段的阅读框和方向保持不变,因而,不必再为新的表达克隆测序担心。在使用每一种新的表达系统时,将会节省更多的时间。
三、Gateway在构建cDNA入门文库和表达文库方面的应用
2006年,中国科学院张宁,以激活蛋白产生菌一交链孢菌为材料,用基于入噬菌体特异位点重组反应构建定向cDNA文库的Gateway技术,首次成功构建了交链孢菌cDNA入门文库和表达文库。构建的cDNA入门文库经检测,入门文库的滴度达到6X108 文库总容量为5.6X107,其阳性克性率为100%,平均插入片段大小大约为1.53Kb。通过LR重组把入门文库转换为表达文库。表达文库的滴度为1.53X 106,文库总容量为6.2 X 106,其阳性克性率为100%,平均插入片段大小大约为1.62Kb。快速、高效的构建了高质量的cDNA 入门文库和表达文库,为从分子水平进一步研究蛋白激发子提供了基础。通过大规模的免疫筛选文库获得激活蛋白全长编码基因,并进行表达与纯化,为进一步研究激活蛋白与植物受体的相互作用机理及信号途径奠定了基础[2]。
四、Gateway在植物双分子荧光互补(BiFc)系统上的应用
2013年,周洁等充分利用Gateway技术高效快捷的优势,构建了一套基于Gateway 的BiFC分析载体系统。该系统和常规的系统一致,采用融合黄色荧光蛋白(yellow fluorecent protein , YFP)片段的方法进行互作分析。其中的YFP片段被分为N端YFP ( N-terminal YFP nYFP)片段和C端YFP ( C-terminal YFP, cYFP)片段。该系统包括用于目的基因N端融合的nYFP载体和cYFP载体,及目的基因C端融合的nYFP和cYFP共4个载体。同时,还构建了带氨节青霉素(Ampicillin , Amp)抗性的入门载体,用于入门克隆。该入门载体可由实验室自行酶切制备,并且采用TA克隆的方法进行入门载体的构建,从而大大降低了创制入门克隆的成本。此外,该入门载体带有ccdB自杀基因,常规分子生物学实验室的制备手段就能保证非常低的背景克隆。总体而言,其构建的BiFC载体系统,操作简单且成本低,能够快速构建互作分析用的BiFC载体,高效的进行基因互作研究[3]。
参考文献:
[1] 李明,丁博,牛有雄,等. 小麦TaWRKY46-1基因克隆及建立在Gateway技术上的可诱导表达载体的构建[J],华北农学报, 2011,26(2)
[2] 张宁. 交链孢菌cDNA文库构建及激活蛋白基因克隆与融合表达[D].中国农业科学院. 2006
[3] 周洁,王栩鸣,陈斌,等. 基于Gateway技术的低成本植物双分子荧光互补分析系统[J].浙江农业学报,2013,25(5); 1024-1030.
Gateway克隆技术,简单易操作 在过去数十年,用限制性内切酶产生黏性末端,在DNA连接酶的作用下,连接两个甚至更多片段的克隆方法,是载体构建的经典方案。但是现如今我们再提到克隆的时候,远远不再只有传统的限制酶克隆一种选择。其中Gateway克隆技术作为一种可以快速、高效将DNA 序列转移到载体上的克隆方法已经流行开来。不要觉得Gateway克隆技术高深莫测,其实了解一下你就能懂。 Gateway克隆方法是λ噬菌体感染细菌时发生的整合和切割重组反应的体外形式。在体内,噬菌体(attP)和细菌(attB)的附着位点发生重组反应,噬菌体整合到细菌基因组中,两侧为两个新的重组位点(attL-left-和attR-right-)。在某些条件下,attL和attR位点可以重组,导致噬菌体从细菌染色体上切除并重新生成attP和attB位点。 即Gateway技术依赖于下面描述的两个反应:BP反应和LR反应,通过BP反应获得入门克隆(有时候我们也说中间克隆),再通过LR反应将目的DNA以正确的方向连接到各种目的载体上,形成不同的表达载体。GeneCopoeia的EZShuttle?重组克隆体系应用E.coli 和λ噬菌体特异位点的重组酶促体系使DNA片段在载体间相互转换,其原理与Gateway 克隆技术相同。 BP反应-构建入门载体: 通过PCR将attB位点添加到目的DAN序列两侧,形成attB-PCR产物。用attB-PCR产物或者含attB位点的供体质粒和含attP位点的质粒发生重组生成入门克隆。EZRecombinase BP混合物,货号:RCBM-1002-020
LR反应-构建表达载体: 制作表达载体时,选择适合的目标载体非常重要。这种选择取决于许多因素,如宿主类型,所需的表达水平和实验目的。选定的attR表达载体与attL-入门载体重组以产生表达载体。EZRecombinase LR混合液,货号:RCBM-1001-020
基于Gateway技术的表达载体构建 1. Gateway-T载体(pGWC)的酶切反应 pGWC除具有传统T载体的克隆功能外,还可以作为入门克隆(Entry Clone)与Gateway 重组克隆技术兼容。该载体中的ccdB基因编码一个能够使大多数E. coli致死的毒蛋白,可作为重组子的负选标记取代了蓝白斑筛选。 该载体在使用前,需经过AhdI(实验中采用其同裂酶Eam1105 I)酶切,使载体两端产生5’T,用与PCR产物的两端的3’A互补。PCR产物回收后与pGWC载体连接,挑取正向克隆送测序。 pGWC载体的酶切反应体系如下: pGWC 10 μl(约2μg) 10×Eam1105 I Buffer 5 μl Eam1105 I 2 μl ddH2O 34 μl 共计 50 μl 将反应混和液于37℃温育6h。取1μl酶切反应液走1%琼脂糖凝胶电泳检测酶切效果,估测载体片段的浓度,该酶切反应液可直接用作连接无需纯化。 2. PCR产物的回收与连接反应 PCR产物用琼脂糖凝胶回收试剂盒(北京天根生化科技有限公司)进行回收,与pGWC载体进行连接。 DNA片段与pGWC-T的连接: pGWC-T 1μl(约50ng) DNA回收片段 4μl(600bp片段约需40ng) Solution I (TaKaRa) 5μl 共计 10μl 反应混合液于4℃下连接过夜(约12~16h)。 3. 连接产物的转化 取大肠杆菌DH5α感受态细胞(50μl/管)于冰上融化,加入5μl连接产物,用移液器轻轻吸打混匀,在冰上放置30min,42℃水浴热激90s,冰上放置5min,加入无抗生素的LB培养基300μl,37℃,160rpm振荡培养45min,将菌液铺在氯霉素抗性(25mg/L)LB平板上,在超净台吹干后37℃倒置培养过夜。 4. LR反应与表达载体构建 表达载体均采用Gateway重组克隆技术构建,目标基因连入pGWC后即为入门克隆(Entry
Gateway 基因克隆 Gateway 基因克隆就是由Invitrogen公司在二十世纪九十年代末发明并应用于分子生物学基因克隆的一项专利技术。该技术利用专有的重组序列使得DNA片段能够更有效地被转入质粒当中,可应用于大片段的基因克隆,并且在保持正确阅读框的前提下让不同表达载体间的DNA转移成为可能。 这一技术在插入的目的DNA片段两端整合att L1与att L2两个侧端重组序列,来构建一个类似通道的结构并称之为“入门克隆”(Gateway Entry Clone)。据Invitrogen宣称Gateway 技术使用99%有效且可逆的一小组重组反应,如此使得基因克隆不同于传统的限制性内切酶方法,避免了目的片段内存在切点的问题而使得大片段DNA保持其完整性,大大提高了克隆效率,常应用于大规模的DNA片段整合进同一种表达载体,因此又称之为高通量基因克隆技术(Gateway Cloning Technology)。 一、Gateway 基因克隆的原理及机制 Gateway被视为一种克隆操作平台:把目的基因克隆到入门载体(Entry Vector)后,就不用依赖限制性内切酶,而靠载体上存在的特定重组位点与重组酶,高效、快速地将目的基因克隆到其它的受体载体(Destination Vector,目的载体)上。 Gateway的原理就是建立在噬菌体DNA定点整合到细菌宿主基因组上。在噬菌体与细菌的整合因子(INF、Int)的作用下,lambda的attP位点与大肠杆菌基因组的attB位点可以发生定点重组,lambda噬菌体DNA整合到大肠杆菌的基因组DNA中,两侧产生两个新位点:attL与attR。这就是一个可逆的过程,如果在一个噬菌体编码蛋白Xis与IHF、Int的共同介导下这两个新位点可以再次重组回复为attB与attP位点,噬菌体从细菌基因组上裂解下来(见图1)。这一过程的方向就是受控于两个重要因素:存在的介导蛋白与重组位点。
Gateway技术提供以下可能:通过去除冗长的亚克隆步骤节省您的时间 同时将您的基因转移到多个表达系统 在任何您选择的系统――体外,细菌,酵母,昆虫,或哺乳动物――分析表达 一、一种更好的克隆方法 Gateway技术能够克隆一个或多个基因进入到任何蛋白表达系统(图1)。这项强大的体外技术大大地简化了基因克隆和亚克隆的步骤,而同时典型的克隆效率高达95%或更高。当基因在目的表达载体之间快速简便的穿梭时,还可以保证正确的方向和阅读框。Gateway也有助于进行带不同数目纯化和检测标签蛋白的表达。 图1 Gateway技术的灵活性 Gateway技术:克隆、表达新方法 - zhchyuan2008 - zhchyuan2008的博客 目的基因克隆进入门载体后,可以同时转移目的基因到多个目的载体。 Gateway利用了位点特异重组,所以在构建入门载体后,不再需要使用限制性内
切酶和连接酶。一旦您拥有了一个入门克隆,就可以多次使用它,转移您的目的基因到Gateway改造过的各种表达载体(目的载体)。 此外,由于在重组时DNA片段的阅读框和方向保持不变,因而您不必再为新的表达克隆测序担心。在使用每一种新的表达系统时,将会节省您更多的时间。 二、一项强大而可靠的技术 Gateway技术是克隆和亚克隆DNA序列的一项新颖的通用系统,便于功能基因的分析和蛋白质的表达。一旦进入这个多功能的操作系统,DNA片段可以通过位点特异的重组在载体之间转移。 Gateway技术是基于已研究的非常清楚的λ噬菌体位点特异重组系统(attB x attP →attL x attR)。BP和LR两个反应就构成了Gateway技术(表1和图2)。BP反应是利用一个attB DNA片段或表达克隆和一个attP供体载体之间的重组反应,创建一个入门克隆。LR反应是一个attL入门克隆和一个attR目的载体之间的重组反应。 LR反应用来在平行的反应中转移目的序列到一个或更多个目的载体。 图2 Gateway技术总结 下载 (22.19 KB) 6 天前 19:23 Gateway技术:克隆、表达新方法 - zhchyuan2008 - zhchyuan2008的博客 在BP反应中基因转移形成入门克隆,在LR反应中入门克隆可以作为反应物产生最终的表达克隆。
Gateway? Cloning Protocols The Basics of Gateway? Reaction ?BP reaction—to create a Gateway? entry clone ?LR reaction—to create a Gateway? expression clone ?One tube format—to create a Gateway? expression clone from a PCR product ?Gateway? Vector Conversion—converting your favorite cloning vectors to Gateway? Technology TOPO? TA Cloning - To Create a Gateway? Entry Clone Step One - Produce PCR product Produce PCR products using Taq polymerase and your own protocol. End the PCR reaction with a final 7 to 30 minute extension step. Step Two - Perform the TOPO? Cloning Reaction 1. Set up one of the following TOPO? Cloning reactions using the reagents in the order shown. For electroporation, dilute Salt Solution 4-fold to prepare Dilute Salt Solution. Reagent Chemical Txn Electroporation Fresh PCR product0.5 to 4 μl0.5 to 4 μl Salt Solution 1 μl-- Dilute Salt Solution -- 1 μl Sterile Water to a final volume of 5 μl to a final volume of 5 μl TOPO? Vector 1 μl 1 μl Total volume6μl6μl 2. Mix gently and incubate for 5 minutes at room temperature. 3. Place on ice and proceed to transform One Shot? chemically competent E. coli, below
Gateway?技术提供以下可能: ?通过去除冗长的亚克隆步骤节省您的时间 ?将您的基因转入到多个表达系统 ?在任何您选择的系统――体外,细菌,酵母,昆虫,或哺乳动物――分析表达 Gateway?技术能够克隆一个或多个基因进入到任何蛋白表达系统(图1)。 这项强大的体外技术大大地简化了基因克隆和亚克隆的步骤,而同时典型的 克隆效率高达95%或更高。当基因在目的表达载体之间快速简便的穿梭时, 还可以保证正确的方向和阅读框。Gateway?也有助于进行带不同数目纯化和 检测标签的表达。 Gateway?利用了位点特异重组,所以在构建入门载体后,不再需要使用限制性内切酶和连接酶。一旦您拥有了一个入门克隆,就可以多次使用它,转移您感兴趣的基因到Gateway?改造过的的各种表达载体(目的载体)。 此外,由于在重组时DNA片段的阅读框和方向保持不变,因而您不必再为新的表达克隆的测序担心。在使用每一种新的表达系统时,将会节省您更多的时间。
图1-Gateway?技术的灵活性 *目的基因克隆进入门载体后, 可以同时转移目的基因到多个目的载体。 一种强大而可靠的技术 Gateway?技术是克隆和亚克隆DNA序列的一项新颖的通用系统,便于功能基因的分析和蛋白质的表达。一旦进入这个多功能的操作系统,DNA片段可以通过位点特异的重组在载体之间转移。 Gateway?技术是基于已研究的非常清楚的λ嗜菌体位点特异重组系统(attB x attP →attL x attR)。BP和LR两个反应就构成了Gateway?技术(表1和图2)。BP反应利用一个attB DNA片段或表达克隆和一个attP供体载体之间的重组反应,创建一个入门克隆。LR反应是一个attL入门克隆和一个attR目的载体之间的重组反应。LR反应用来在在平行的反应中转移目的序列到一个或更多个目的载体。 Gateway?技术也利用了ccdB选择方法,确保高效率的分离重组克隆。典型的效率是>95%。需要了解更多的有关ccdB的信息,请
河南农业大学牧医工程学院 1 Gateway 基因克隆 Gateway 基因克隆是由Invitrogen 公司在二十世纪九十年代末发明并应用于分子生物学基因克隆的一项专利技术。该技术利用专有的重组序列使得DNA 片段能够更有效地被转入质粒当中,可应用于大片段的基因克隆,并且在保持正确阅读框的前提下让不同表达载体间的DNA 转移成为可能。 这一技术在插入的目的DNA 片段两端整合att L1和att L2两个侧端重组序列,来构建一个类似通道的结构并称之为“入门克隆”(Gateway Entry Clone )。据Invitrogen 宣称Gateway 技术使用99%有效且可逆的一小组重组反应,如此使得基因克隆不同于传统的限制性内切酶方法,避免了目的片段内存在切点的问题而使得大片段DNA 保持其完整性,大大提高了克隆效率,常应用于大规模的DNA 片段整合进同一种表达载体,因此又称之为高通量基因克隆技术(Gateway Cloning Technology )。 一、Gateway 基因克隆的原理及机制 Gateway 被视为一种克隆操作平台:把目的基因克隆到入门载体(Entry Vector )后,就不用依赖限制性内切酶,而靠载体上存在的特定重组位点和重组酶,高效、快速地将目的基因克隆到其它的受体载体(Destination Vector ,目的载体)上。 Gateway 的原理是建立在噬菌体DNA 定点整合到细菌宿主基因组上。在噬菌体和细菌的整合因子(INF 、Int )的作用下,lambda 的attP 位点和大肠杆菌基因组的 attB 位点可以发生定点重组,lambda 噬菌体DNA 整合到大肠杆菌的基因组DNA 中,两侧产生两个新位点:attL 和attR 。这是一个可逆的过程,如果在一个噬菌体编码蛋白Xis 和IHF 、Int 的共同介导下这两个新位点可以再次重组回复为attB 和attP 位点,噬菌体从细菌基因组上裂解下来(见图1)。这一过程的方向是受控于两个重要因素:存在的介导蛋白和重组位点。
Gateway? 重组克隆技术 经典的克隆工作流程包括许多步骤,尤其是传统的限制性内切酶克隆方法。这种传统的方法限制了克隆的成功率。 例如,当其可能会在目的基因内部进行切割, 从而截短插入片段,并使得基因无法用于下游表达时,某些限制性内切酶是不能使用的。采用传统的克隆方法, 需要额外的片段回收步骤,而且在克隆大片段DNA 时,将会遇到重组效率降低, 从而需要浪费费很多时间以筛选到所需的克隆的问题- 所有这些步骤都会耗费大量的时间和精力,而且成功还无法得到保障。 而Gateway? 重组克隆技术则不存在这些问题。 极好的通用性 相反,Gateway? 重组克隆技术则规避了这些克隆限制,使您几乎能够使用任何表达系统。Gateway? 重组克隆采用了99% 有效且可逆的一小时重组反应, 并且不使用限制性内切酶、连接酶、亚克隆步骤,也不需要对不计其数的菌落进行筛选,从而节省您的时间、金钱和精力。Gateway? 技术自推出后便为研究界广泛采用, 仅参考文献便超过1500 篇。此技术使跨学科研究的合作变得简单方便,而且能从这些研究团体中获得众多载体用于真正的多学科科学研究。 最后,MultiSite Gateway? 技术等最新进展使得Invitrogen 的 Gateway? 克隆成为蛋白质表达和功能分析的理想克隆方法。 Gateway? 技术的优点 只需一小时,室温克隆反应便能快速产生您所需的克隆,效率高达99% 以上 无需使用限制性内切酶或连接酶便能保持片段正确的插入方向和阅读框,从而,获得可直接进行表达的克隆 从靶标鉴定到验证始终使用同一个克隆,无需重新测序,从而确保结果在整个实验过程中一致 使DNA 插入片段从一个表达载体穿梭到另一个表达载体,既提高了灵活性,同时还简化了克隆工作流程
实验方案 Gateway? 反应的基本原理 ?BP反应—构建Gatew ay? 入门克隆 ?LR 反应—构建Gatew ay? 表达克隆 ?一管模式—从PCR 产物构建Gatew ay? 表达克隆 ?Gatew ay? 载体转化—将您喜爱的克隆载体转化成Gatew ay? 载体 TOPO? TA 克隆- 创建Gateway? 入门克隆 ? ?步骤一–制备PCR 产物 使用Taq 聚合酶和自己的方案生成PCR 产物。通过 最后7 到30 分钟的延伸步骤,结束PCR 反应。 步骤二- 进行TOPO? 克隆反应 1. 按所示顺序使用试剂,以建立以下一种TOPO? 克隆 反应。对于电穿孔,将盐溶液稀释 4 倍以制备稀释 盐溶液。 试剂化学转染电穿孔法 新鲜的PCR 产物0.5 至 4 μl 0.5 至 4 μl 盐溶液 1 μl -- 稀释盐溶液-- 1 μl 无菌水至终体积为 5 μl 至终体积为 5 μl TOPO? 载体 1 μl 1 μl 总体积 6 μl 6 μl ? 2. 轻轻混合并在室温下孵育 5 分钟。 3. 置于冰上,然后开始转化One Shot? 化学感受态 E. coli,步骤如下 步骤三- 转化One Shot? 化学感受态E. coli 1. 每次转化时,解冻置于冰上的一小瓶One Shot? E. coli 细胞。 2. 在一小瓶One Shot? 化学感受态E. coli 中加入 2 μl TOPO? 克隆反应液, 轻轻混匀。
3. 在冰上孵育 5 至30 分钟。 4. 将细胞置于42°C 下热休克30 秒,不振荡。立即 将试管转移至冰上。 5. 加入250 μl 室温S.O.C. 培养基。 6. 在37°C 下振荡孵育 1 小时。 7. 在预热的LB 琼脂平板上涂布10-50 μl 细菌培养物(琼脂平板含有 100 μg/ml 大观霉素),并于37°C 下过夜孵育。 Gateway? 反应的基础知识 ? ? ? ?BP 反应 从含有att B 侧翼序列的PCR 产物到生成Gatew ay? 入门克隆只需 1 小时的简单反应。参见下文的实验设置概述。更多详细信息,请参阅说明书。 1. 在室温下向 1.5 ml 管中加入下述组分并混匀: attB-PCR 产物(=10 ng/μl;最终量~15-150 ng)1-7 μl 供体载体(150 ng/μl) 1 μl TE缓冲液,pH 8.0 补充至8 μl 2. 将BP Clonase? II 酶混合物置于冰上约 2 分钟解冻。对BP Clonase? II 酶混合物稍 微震荡两次(每次 2 秒)。 3. 对于每份样品(上述步骤1),向反应液中加入 2 μl BP Clonase? II 酶混合物,稍微震 荡两次以充分混匀。进行短暂的低速离心。 4. 将BP Clonase? II 酶混合物放回-20°C 或-80°C 储存。 5. 反应体系25°C 孵育 1 小时。 6. 向每份样品中加入 1 μl 蛋白酶K 溶液来终止反应。稍微震荡。在37°C 下孵育样品10 分钟。 转化 7. 取 1 μl 的各LR 反应液转化50 μl One Shot? OmniMA X ? 2 T1 噬菌体抗性细胞(目 录号C8540-03).冰上孵育30 分钟。通过30 秒的42°C 孵育对细胞进行热休克。加入250 μl S.O.C. 培养基并在37°C 震荡孵育 1 小时。将20 μl 和100 μl 每种转化液分别涂布于选择 性平板上。注意:任何转化率达>1.0 × 10 8 转化子/μg 的感受态细胞均可以使用。
Gateway也可以被视为一种克隆操作平台:把目的基因克隆到入门载体 (Entry Vector)后,就不用依赖限制性内切酶,而靠载体上存在的特定重组 位点和重组酶,高效、快速地将目的基因克隆到其它的受体载体 (Destination Vector,目的载体)上。 Gateway的原理也是建立在噬菌体DNA定点整合到细菌宿主基因组上。在 噬菌体和细菌的整合因子(INF、Int)的作用下,lambda的attP位点和大肠 杆菌基因组的attB位点可以发生定点重组,lambda噬菌体DNA整合到大肠杆 菌的基因组DNA中,两侧产生两个新位点:attL和attR。这是一个可逆的过程,如果在一个噬菌体编码蛋白Xis和IHF、Int的共同介导下这两个新位点 可以再次重组回复为attB和attP位点,噬菌体从细菌基因组上裂解下来。这 一过程的方向是受控于两个重要因素:存在的介导蛋白和重组位点。 在Gateway系统中,入门载体包含两个重组位点序列attL1和attL2,大小 均为100bp,中间夹着一个自杀基因——ccdB基因。由于ccdB基因的表达产 物能抑制普通的E.coli生长,在克隆时没有切开或者自身环化的载体在转化 时不能生长。在构建含目的基因的入门载体时必须切掉这个基因,接入目的基因。ccdB基因两端可以选择的酶切位点有限(2个),同时还必须考虑读码框架、启动子、终止密码等问题,因此Gateway系统提供了5种不同的入门载体 以供选择。需要特别注意的是转化用的菌株必须是不含F附加体的,因为它表 达的一种产物能阻断ccdB基因,影响筛选结果。 同样,目的载体(Destination Vector)也必须和Gateway系统配套,即 目的载体的表达调控元件下游有两个重组位点attR1和attR2,大小均为 125bp,同样也夹着一个ccdB自杀基因。 当需要将目的基因从入门载体(Entry Vector)转移到目的载体(Destination Vector)时,只要将两种质粒混合(线性化能有效提高重组率),加入含有Int、IHF、Xis等重组因子的LR重组酶混合物,attR2序列和attL2序列发生重组,生成一个融合质粒。attL1序列再和attR1序列重组, 融合质粒分解为两个新的质粒,目的基因与原来位于目的载体上的自杀基因发 生重组置换,得到一个带目的基因的目的载体(生成新的重组位点attB1、B2)和带自杀基因的入门载体(生成新的重组位点attP1、P2)。反应过程需要25 度保温1小时(时间越长,重组率越高,特别是较大的质粒,反应过夜能提高 5倍重组效率),蛋白酶K37度处理10分钟,转化。由于带自杀基因的载体不 能生长,加上抗生素筛选,转化产物重组率高达90%以上。同样,转化用的菌 株必须是不含F附加体的。
进了新实验室后一直用Gateway做克隆,发现论坛上很少有讨论gateway的帖子,特开此贴,也欢迎对gateway有经验,有兴趣和有疑问的同行们一起交流经验 Gateway官方简介: Gateway®克隆技术的基础是lambda噬菌体的位点特异性重组反应,一种准确保存遗传信息的有效的自然的生化途径。与传统的需要DNA限制性内切酶、DNA连接酶、凝胶电泳和DN***段纯化等多个步骤的单调乏味的亚克隆方法相比,该方法只需一步生化反应而且操作方便、快捷(室温60分钟),节省了大量的时间和劳力。另外,根据目的蛋白的生产和纯化的不同要求,Invi t rogen公司提供一系列含有不同启动子和融合标签、以及在几种宿主表达的目标载体。 以下是个人总结 优点: 1. 效率高,空载体含有毒性基因所以避免了大部分的假阳性。 2. 在不同载体之间转换方便,省去了大量的酶切/胶回收/去磷酸/连接的步骤,尤其适合筛选大量基因和突变体的应用。 3. 速度快,大部分反应1小时完成而且转化效率很高,自制的感受态DH10B(1ug=10^8cfu)加1ul反应产物就可以。 4. 反应缓冲液是TE,可以直接电转化 5. 兼容TOPO,可以用CmR/ccdB片断构建载体 6. 个人感觉容错率较高,对时间和温度的控制要求也不严。一开始没经验,用水浴加温,拿出来发现一个EP管里的液量神奇的增加了,应该是进了水。硬着头皮继续做居然成功了。 缺点: 1. 酶很贵,真的很贵 2. 很贵的酶还很娇贵,冰上几分钟就有可能失活。虽然现行版本的酶经过改进只需要零下20度但是为了以防万一还是推荐零下80度保存。 3. 10kb以上的片断需要隔夜培育,和传统的酶切-T4连接相比没有优势
Gateway 载体 Gateway技术提供以下可能:通过去除冗长的亚克隆步骤节省您的时间,同时将您的基因转移到多个表达系统,在任何您选择的系统-体外,细菌,酵母,昆虫,或哺乳动物-分析表达 一、一种更好的克隆方法 Gateway技术能够克隆一个或多个基因进入到任何蛋白表达系统(图1)。这项强大的体外技术大大地简化了基因克隆和亚克隆的步骤,而同时典型的克隆效率高达95%或更高。当基因在目的表达载体之间快速简便的穿梭时,还可以保证正确的方向和阅读框。Gateway也有助于进行带不同数目纯化和检测标签蛋白的表达。 图1 Gateway技术的灵活性 目的基因克隆进入门载体后,可以同时转移目的基因到多个目的载体。
Gateway利用了位点特异重组,所以在构建入门载体后,不再需要使用限制性内切酶和连接酶。一旦您拥有了一个入门克隆,就可以多次使用它,转移您的目的基因到Gateway改造过的各种表达载体(目的载体)。 此外,由于在重组时DNA片段的阅读框和方向保持不变,因而您不必再为新的表达克隆测序担心。在使用每一种新的表达系统时,将会节省您更多的时间。 二、一项强大而可靠的技术 Gateway技术是克隆和亚克隆DNA序列的一项新颖的通用系统,便于功能基因的分析和蛋白质的表达。一旦进入这个多功能的操作系统,DNA片段可以通过位点特异的重组在载体之间转移。 Gateway技术是基于已研究的非常清楚的λ噬菌体位点特异重组系统(attB x attP →attL x attR)。BP和LR两个反应就构成了Gateway技术(表1和图2)。BP反应是利用一个attB DNA片段或表达克隆和一个attP供体载体之间的重组反应,创建一个入门克隆。LR反应是一个attL入门克隆和一个attR目的载体之间的重组反应。LR反应用来在平行的反应中转移目的序列到一个或更多个目的载体。 表1 反应和术语总结 图2 Gateway技术总结 在BP反应中基因转移形成入门克隆,在LR反应中入门克隆可以作为反应物产生最终的表达克隆。
文中如未特别指出,PCR程序均为:95℃预变性5',95℃变性30",60℃退火30", 72℃延伸1'30" (短片段30"), 30个循环后延伸10min。1%琼脂糖凝胶电泳检测PCR 产物。 1.1.1载体构建及鉴定 1.PCR产物的纯化 参见安比奥生物科技公司的Puprep PCR Purification Kit 说明书。 2. 载体构建(Gateway技术) pDONR201是一种attP供体载体,用于BP反应构建入门载体,包含抗kan和抗cm筛选标记,并且含有ccdB基因,ccdB基因编码干扰大肠杆菌DNA促旋酶的一种蛋白,从而抑制标准大肠杆菌宿主的生长。当目的载体和入门克隆发生重组时,ccdB基因被目的基因取代。携带有ccdB基因的未反应载体或保留有ccdB基因副产品的细胞将不会生长。 GatewayN-GFP一种attR目的载体通过LR反应构建目的基因的表达载体(图3.3),含有35S组成型强启动子、抗氨苄青霉素基因和抗除草剂筛选标记基因Bar,还含有绿色荧光蛋白报告基因GFP。 表达载体Gatewaypleela(图2.2)含有35S组成型强启动子、抗氨苄青霉素基因和抗除草剂筛选标记基因Bar,通过LR反应构建目的基因的表达载体。
图2.2 pDONR201的结构 BP反应体系(att B x att P → att L x att R ) att B-PCR产物40-100 fmol,25-50ng pDONR?75ng 5x BP Clonase?- buffer 1 μl TE Buffer (pH 8.0) or H2O to 4.5μl BP Clonase?0 .5μl Total 5μl 反应体系放于25°C下温育2h。反应后,加2 μl 2 μg/μl的Proteinase K在37°C下处理10 min,再将BP产物(入门载体)加2μl转入大肠杆菌DH5α,在含kan的LB 板上筛选,克隆并保存入门载体。 LR反应体系(att L x att R → att B x att P ) 入门载体25-50ng 目的载体75ng 5x LR Clonase? -buffer 1μl TE Buffer(pH 8.0) or H2O to 4.5 μl LR Clonase?0.5μl Total 5 μl
API Gateway实现API管理
编者按 数字化生态,以创新客户体验为核心,所有我们身边能感知到的变化都来自于渐近的创新。这些创新需要试错,需要不断的升级,并且创新往往与我们熟知的功能分离开来分别呈现。微服务对于传统单体架构的优势之一就在于,服务的拆分带来了更新、部署、管理的隔离性,让一些单独的服务可以进行创新和实验。从而支撑了用户体验的不断升级,为实现企业数字化转型的过程,提供了技术架构层面的支撑。 我们现在已经可以很方便的通过一些电子商城购买运营的合约机,而无需到营业厅亲自办理相关的业务,这就是API Gateway的一种底层支撑。由于运营商通过API Gateway向第三方的商务平台开放了与套餐、机型销售等服务,并通过流控、鉴权等机制保障相关的安全性,才使得这样方便流畅的购物体验得以实现。 对于MOBA手游类玩家来说,“王者荣耀”是一款颇受欢迎的游戏。在一些场景下,我们会感知到“不停机更新”“体验服更新”这两种不同方式的更新形态,在底层,就是API Gateway 或者类似技术的实现,支撑灰度发布,让一些新特性发布给体验服(比如传说中露娜的二技能变化,仅在体验服更新,实际上并未如传说中一样在S11赛季更新到正式服),或者特定的游戏用户,待功能完善或者稳定运行,再向正式服或者全部用户发布,让游戏玩家的体验可以更加流畅,甚至是无感知的升级。
这些只是微服务架构或者API Gateway所支撑的万千业务场景中的沧海一粟。 但微服务本身也会带来诸多问题,粒度小难以管理就是其中之一,本文即从这个角度,阐述了API Gateway所起到的作用和一些关键的技术要素。 以微服务为核心的分布式框架贯穿了普元数字化企业技术平台的APaaS层面,本文所介绍的API Gateway是其中的关键组成部分(图中标黄的部分)。
网络安全的几项关键技术 商用网络在互联网上得以运行, 首先应建立或使原有的网络升级为内部网, 而专用的内部网与公用的互联网的隔离则有赖于防火墙技术。有了防火墙, 商家们便可以比较安全地在互联网上进行相应的商业活动。 1. 防火墙技术 “防火墙”是一种形象的说法, 其实它是一种由计算机硬件和软件的组合, 使互联网与内部网之间建立起一个安全网关( scurity gateway),从而保护内部网免受非法用户的侵入。所谓防火墙就是一个把互联网与内部网隔开的屏障。 防火墙有二类, 标准防火墙和双家网关。标准防火墙系统包括一个UNIX工作站, 该工作站的两端各接一个路由器进行缓冲。其中一个路由器的接口是外部世界, 即公用网; 另一个则联接内部网。标准防火墙使用专门的软件,并要求较高的管理水平,而且在信息传输上有一定的延迟。双家网关(dual home gateway) 则是标准防火墙的扩充,又称堡垒主机(bation host) 或应用层网关(applications layer gateway), 它是一个单个的系统, 但却能同时完成标准防火墙的所有功能。其优点是能运行更复杂的应用, 同时防止在互联网和内部系统之间建立的任何直接的边疆, 可以确保数据包不能直接从外部网络到达内部网络,反之亦然。 随着防火墙技术的进步, 双家网关的基础上又演化出两种防火墙配置, 一种是隐蔽主机网关, 另一种是隐蔽智能网关( 隐蔽子网)。隐蔽主机网关是当前一种常见的防火墙配置。顾名思义,这种配置一方面将路由器进行隐蔽, 另一方面在互联网和内部网之间安装堡垒主机。堡垒主机装在内部网上, 通过路由器的配置, 使该堡垒主机成为内部网与互联网进行通信的唯一系统。目前技术最为复杂而且安全级别最商的防火墙是隐蔽智能网关, 它将网关隐藏在公共系统之后使其免遭直接攻击。隐蔽智能网关提供了对互联网服务进行几乎透明的访问, 同时阻止了外部未授权访问者对专用网络的非法访问。一般来说, 这种防火墙是最不容易被破坏的。 2. 数据加密技术 与防火墙配合使用的安全技术还有数据加密技术是为提高信息系统及数据的安全性和保密性, 防止秘密数据被外部破析所采用的主要技术手段之一。随着信息技术的发展, 网络安全与信息保密日益引起人们的关注。目前各国除了从法律上、管理上加强数据的安全保护外, 从技术上分别在软件和硬件两方面采取措施, 推动着数据加密技术和物理防范技术的不断发展。按作用不同, 数据加密技术主要分为数据传输、数据存储、数据完整性的鉴别以及密钥管理技术四种。 (1)数据传输加密技术。 目的是对传输中的数据流加密, 常用的方针有线路加密和端——端加密两种。前者侧重在线路上而不考虑信源与信宿, 是对保密信息通过各线路采用不同