
1、现代价键理论要点:
(1)自旋相反的成单电子相互接近时,核间电子密度较大,可形成稳定的共价键
(2)共价键有饱与性。一个原子有几个未成对电子,便可与几个自旋相反的电子配对成键。
例如:H-H N≡N
(3)共价键有方向性。这就是因为,共价键尽可能沿着原子轨道最大重叠的方向形成,叫做最大重叠原理。
2、按原子轨道的重叠方式分:键与键
键:原子轨道“头碰头”重叠
键:原子轨道“肩并肩”重叠
杂化轨道理论的基本要点
原子轨道在成键的过程中并不就是一
成不变的。同一原子中能量相近的某些轨道,
在成键过程中重新组合成一系列能量相等
的新轨道而改变了原有的状态。这一过程称
为“杂化”。所形成的新轨道叫做“杂化轨道”。
杂化轨道的要点:
原子形成分子时,就是先杂化后成键
同一原子中不同类型、能量相近的原子轨道参与杂化
杂化前后原子轨道数不变
杂化后形成的杂化轨道的能量相同
杂化后轨道的形状、伸展方向发生改变
杂化轨道参与形成σ键,未参与杂化的轨道形成π键
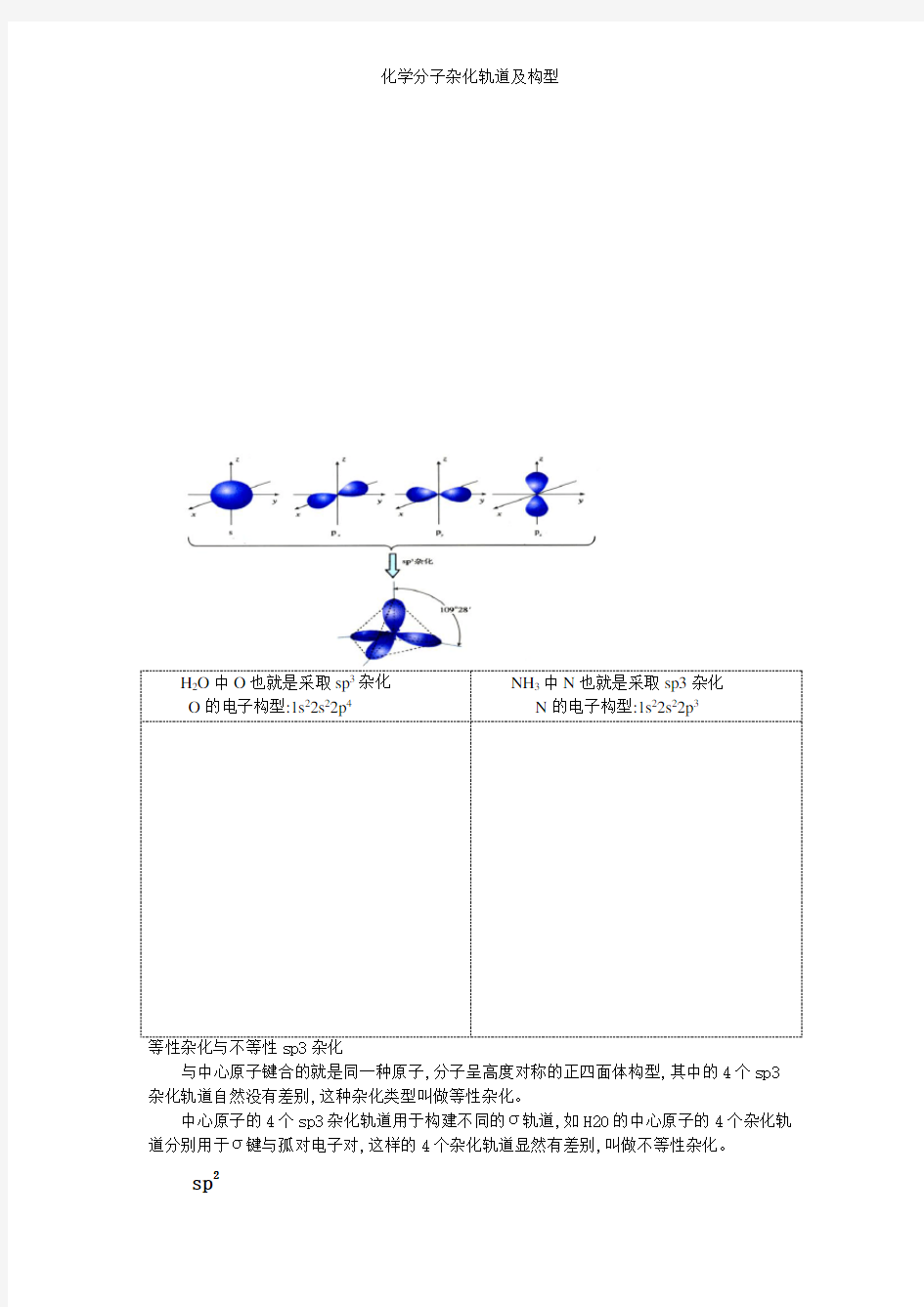
sp3
一个s轨道与三个p轨道杂化后,得四个sp3杂化轨道,每个杂化轨道的s成分为1/4,p 成分为3/4,它们的空间取向就是四面体结构,相互的键角θ=109o28′CH4,CCl4 C原子与H原子结合形成的分子为什么就是CH4,而不就是CH2或CH3?CH4分子为什么具有正四面体的空间构型(键长、键能相同,键角相同为109°28′)?
它的要点就是:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道与3个2p轨道会发生混杂,混杂时保持轨道总数不变,得到4个能量相等、成分相同的sp3杂化轨道,夹角109°28 ′,表示这4个轨道就是由1个s轨道与3个p轨道杂化形成的如下图所示:
H2O中O也就是采取sp3杂化O的电子构型:1s22s22p4NH3中N也就是采取sp3杂化N的电子构型:1s22s22p3
等性杂化与不等性sp3杂化
与中心原子键合的就是同一种原子,分子呈高度对称的正四面体构型,其中的4个sp3杂化轨道自然没有差别,这种杂化类型叫做等性杂化。
中心原子的4个sp3杂化轨道用于构建不同的σ轨道,如H2O的中心原子的4个杂化轨道分别用于σ键与孤对电子对,这样的4个杂化轨道显然有差别,叫做不等性杂化。
sp2
一个s轨道与两个p轨道杂化,得三个sp2杂化轨道,每个杂化轨道的s成分为1/3,p成分为2/3,三个杂化轨道在空间分布就是在同一平面上,互成120o
BF3分子形成
石墨、苯中碳原子也就是以sp2杂化的:
sp
一个s轨道与一个p轨道杂化后,得两个sp杂化轨道,每个杂化轨道的s成分为1/2,p成分为1/2,杂化轨道之间的夹角为180度。CO2 HC≡CH
BeCl2分子形成
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化 大纲要求(1)了解分子、原子、离子等概念的含义。了解原子团的定义。 (2)理解物理变化与化学变化的区别与联系。 (3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。 (4)理解酸、碱、盐、氧化物的概念及其相互联系。
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)大纲要求 物质结构和元素周期律 (1)了解元素、核素和同位素的含义。 (2)了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。 (3)了解原子核外电子排布。 (4)掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。 (5)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。 (6)以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。 (7)了解金属、非金属在元素周期表中的位置及其性质递变的规律。 (8)了解化学键的定义。了解离子键、共价键的形成。 化学反应与能量 (1)了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。掌握常见氧化还原反应的配平和相关计算。 (2)了解化学反应中能量转化的原因,能说出常见的能量转化形式。 (3)了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。 (4)了解热化学方程式的含义。 (5)了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。 (6)了解焓变与反应热的含义。了解△H=H(反应产物)—H(反应物)表达式的含义。 (7)理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。 (8)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。了解常见化学电源的种类及其工作原理。 (9)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。 化学反应速率和化学平衡 (1)了解化学反应速率的概念、反应速率的定量表示方法。 (2)了解催化剂在生产、生活和科学研究领域中的重大作用。 (3)了解化学反应的可逆性。 (4)了解化学平衡建立的过程。了解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。 (5)理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。 (6)了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。 电解质溶液 (1)了解电解质的概念。了解强电解质和弱电解质的概念。 (2)了解电解质在水溶液中的电离,以及电解质溶液的导电性。
1、现代价键理论要点: (1)自旋相反的成单电子相互接近时,核间电子密度较大,可形成稳定的共价键 (2)共价键有饱和性。一个原子有几个未成对 电子,便可和几个自旋相反的电子配对成 键。 例如:H-H N≡N (3)共价键有方向性。这是因为,共价键尽可 能沿着原子轨道最大重叠的方向形成,叫做最大重叠原理。 2.按原子轨道的重叠方式分:键和键 键:原子轨道“头碰头”重叠 键:原子轨道“肩并肩”重叠 杂化轨道理论的基本要点 原子轨道在成键的过程中并不是一成不变的。同一原子中能量相近的某些轨道,在成键过程中重新组合成一系列能量相等的新轨道而改变了原有的状态。这一过程称为“杂化”。所形成的新轨道叫做“杂化轨道”。 杂化轨道的要点:
原子形成分子时,是先杂化后成键 同一原子中不同类型、能量相近的原子轨道参与杂化 杂化前后原子轨道数不变 杂化后形成的杂化轨道的能量相同 杂化后轨道的形状、伸展方向发生改变 杂化轨道参与形成σ键,未参与杂化的轨道形成π键 sp3 一个s轨道与三个p轨道杂化后,得四个sp3杂化轨道,每个杂化轨道的s成分为1/4,p成分为3/4,它们的空间取向是四面体结构,相互的键角θ=109o28′CH4,CCl4 C原子与H原子结合形成的分子为什么是CH4,而不是CH2或CH3?CH4分子为什么具有正四面体的空间构型(键长、键能相同,键角相同为109°28′)? 它的要点是:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,得到4个能量相等、成分相同的sp3杂化轨道,夹角109°28 ′,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的如下图所示:
分子的结构与性质 【知识动脉】 知识框架 产生原因:共价键的方向性 Sp3 决定因素:杂化轨道方式sp2 分子的空间构型sp 空间构型的判断:VSEPR理论 空间构型决定性质等电子原理 手性分子 配合物 一、杂化轨道理论 1. 杂化的概念:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。 思考:甲烷分子的轨道是如何形成的呢? 形成甲烷分子时,中心原子的2s和2p x,2p y,2p z等四条原子轨道发生杂化,形成一组新的轨道,即四条sp3杂化轨道,这些sp3杂化轨道不同于s轨道,也不同于p轨道。 根据参与杂化的s轨道与p轨道的数目,除了有sp3杂化外,还有sp2杂化和sp杂化,sp2杂化轨道表示由一个s轨道与两个p轨道杂化形成的,sp杂化轨道表示由一个s轨道与一个p轨道杂化形成的。 思考: 应用轨道杂化理论,探究分子的立体结构。
C2H4 BF3 CH2O C2H2 思考:怎样判断有几个轨道参与了杂化? [讨论总结]:三种杂化轨道的轨道形状,SP杂化夹角为°的直线型杂化轨道,SP2杂化轨道为°的平面三角形,SP3杂化轨道为°′的正四面体构型。 小结:HCN中C原子以sp杂化,CH2O中C原子以sp2杂化;HCN中含有2个σ键和2π键;CH2O中含有3σ键和1个π键 【例1】(09江苏卷21 A部分)(12分)生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。甲醛分子中碳原子轨道的杂化类型为。甲醛分子的空间构型是;1mol甲醛分子中σ键的数目为。 解析与评价:甲醛分子中含有碳氧双键,故碳原子轨道的杂化类型为sp2杂化;分子的空间构型为平面型;1mol甲醛分子中含有2mol碳氢δ键,1mol碳氧δ键,故含有δ键的数目为3N A 答案:sp2平面型3N A 【变式训练1】(09宁夏卷38)[化学—选修物质结构与性质](15分) 已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题: (1)X与Z可形成化合物XZ3,该化合物的空间构型为____________; 2、价层电子对互斥模型 把分子分成两大类:一类是中心原子上的价电子都用于形成共价键。如CO2、CH2O、CH4等分子中的C 原子。它们的立体结构可用中心原子周围的原子数来预测,概括如下: ABn 立体结构范例 n=2 直线型CO2 n=3 平面三角形CH2O n=4 正四面体型CH4 另一类是中心原子上有孤对电子 ............)的分子。如 ....(未用于形成共价键的电子对 H2O和NH3中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。因而H2O分子呈V型,NH3分子呈三角锥型。 练习2、应用VSEPR理论判断下表中分子或离子的构型。进一步认识多原子分子的立体结构。 化学式中心原子含有孤对电子对数中心原子结合的原子数空间构型 H2S
第二节《分子的立体结构》 (3) 杂化轨道理论 班级学号姓名等第 1.最早提出轨道杂化理论的是() A.美国的路易斯 B.英国的海特勒 C.美国的鲍林 D.法国的洪特 2.下列分子中心原子是sp2杂化的是() A.PBr 3 B.CH4 C.BF3 D.H2O 3.关于原子轨道的说法正确的是() A. 凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 3杂化轨道是由 4 个 H原子的 1s轨道和 C 原子的2p 轨道混合起来而形成 B.CH 分子中的 sp 4 的 C.sp 3杂化轨道是由同一个原子中能量相近的s 轨道和 p 轨道混合起来形成的一组能量相近 的新轨道 D.凡 AB3型的共价化合物,其中中心原子 A 均采用 sp3杂化轨道成键 4.用 Pauling的杂化轨道理论解释甲烷分子的四面体结构,下列说法不正确的是() A.C 原子的四个杂化轨道的能量一样 B.C 原子的 sp3杂化轨道之间夹角一样 C.C 原子的 4 个价电子分别占据 4 个 sp3杂化轨道 D.C 原子有 1 个 sp 3杂化轨道由孤对电子占据 5.下列对 sp3、 sp2、 sp 杂化轨道的夹角的比较,得出结论正确的是() A.sp 杂化轨道的夹角最大 B.sp 2杂化轨道的夹角最大 C.sp 3杂化轨道的夹角最大 D.sp 3、 sp2、sp 杂化轨道的夹角相等 6.乙烯分子中含有 4 个 C— H 和 1 个 C=C双键, 6 个原子在同一平面上。下列关于乙烯分子 的成键情况分析正确的是() A. 每个 C 原子的 2s 轨道与2p 轨道杂化,形成两个sp 杂化轨道 B. 每个 C 原子的 1 个 2s轨道与 2 个 2p 轨道杂化,形成 3 个 sp 2杂化轨道 C.每个 C 原子的 2s 轨道与 3 个 2p轨道杂化,形成 4 个 sp3杂化轨道 D.每个 C 原子的 3 个价电子占据 3 个杂化轨道, 1 个价电子占据 1 个 2p 轨道 7. 下列含碳化合物中,碳原子发生了sp3杂化的是() A.CH4 B.CH2=CH2 C.CH≡CH D. 8. 已知次氯酸分子的结构式为H— O— Cl ,下列有关说法正确的是() A.O 原子发生 sp 杂化 B.O 原子与 H、 Cl 都形成σ键 C.该分子为直线型分子 D.该分子的电子式是H︰ O︰ Cl 9. 下列关于杂化轨道理论的说法不正确的是() A.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新轨道 B.轨道数目杂化前后可以相等,也可以不等 C.杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理 D.杂化轨道可分等性杂化轨道和不等性杂化轨道
一、共价键 1.本质:原子间形成共用电子对 分类 思考:用电子式表示H 2 、HCl的形成 共价键特征: ①饱和性:每个原子形成共价键的数目是确定的 ②方向性:原子轨道沿一定方向重叠使成键的原子轨道最大程度地重叠 2.σ键和π键 ①σ键--原子轨道沿着连线方向以“头碰头”方式重叠形成的共价键 特点:以形成化学键的两个原子核的连线为轴旋转,σ键电子云的图形不变电子云描述氢原子形成氢分子的过程(s-s σ键) ②π键--原子轨道沿着连线方向以“肩并肩”方式重叠形成的共价键 特点:(1)电子云为镜像,即是每个π键的电子云由两块组成,分别位于由两个原子核构成的平面的两侧 (2)不稳定,容易断裂 p-p π键的形成 键型 特点 σ键π键 成键方向沿轴方向“头碰头”平行方向“肩并肩” 电子云形状轴对称镜像对称 牢固程度强度大,不易断裂强度较小,易断裂 成键判断规律共价单键全是σ键 共价双键中一个是σ键,另一个是π键共价叁键中一个σ键,另两个为π键 N 2 分子中的N≡N 思考:分析CH 3CH 3 、CH 2 =CH 2 、CH≡CH、CO 2 分子中键的类别和个数 3.键参数--键能、键长与键角 ①键能:气态基态原子形成1 mol化学键释放的最低能量 键能越大,即形成化学键时放出的能量越多,化学键越稳定 应用--计算化学反应的反应热ΔH=反应物键能总和-生成物键能总和 ②键长:形成共价键的两个原子之间的核间距 键长是衡量共价稳定性的另一个参数
规律:键长越短,一般键能越大,共价键越稳定 一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定 ③键角:两个共价键之间的夹角 键角是描述分子立体结构的重要参数,分子的许多性质与键角有关 思考:N 2、O 2 、F 2 跟H 2 的反应能力依次增强,从键能的角度如何理解 4.等电子原理 等电子体:原子总数相同、价电子(最外层电子)总数相同的分子如N 2 和CO 是等电子体,但N 2和C 2 H 4 不是等电子体 等电子体原理:原子总数、价电子总数相同的分子具有相似的化学键特征,它们的物理性质是相近的。例如N 2 和CO的熔沸点、溶解性、分子解离能等都非常接近 5.用质谱测定分子的结构 原理:不同质核比的粒子在磁场中运动轨迹不同 eg:1.下列物质中能证明某化合物中一定有离子键的是() A.可溶于水 B.熔点较高 C.水溶液能导电 D.熔融状态能导电 2.下列关于化学键的叙述中,正确的是() A.离子化合物可以含共价键 B.共价化合物可能含离子键 C.离子化合物中只含离子键 D.只有活泼金属与活泼非金属间才能形成离子键 3.能够用键能解释的是() A.氮气的化学性质比氧气稳定 B.常温常压下,溴呈液体,碘为固体 C.稀有气体一般很难发生化学反应 D.硝酸易挥发,硫酸难挥发 二、分子的立体结构 1.价层电子对互斥理论 对于AB n 型分子,价电子对数 =σ键电子对数+中心原子的孤电子对数 σ键电子对数=n,孤电子对数= (a-nb) a:中心原子价的价电子数 n:与中心原子结合的原子数 b:与中心原子结合的原子最多能接受的电子数(H为1,其他原子等于“8-该原子的价电子数”) 注意:①对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减
第二节杂化轨道与空间构型 【学习目标】 1、复习巩固电子式、共价键、σ键、π键、键参数。 2、理解掌握杂化轨道、价层电子对、会计算价层电子对数,理解中心原子轨道与分子构型 的关系。 重难点:杂化轨道理解计算,杂化轨道与分子构型的关系 【回顾旧知识】 1、共价键的实质: 2、σ键、π键的形成过程 3、单键双键三键的组成 4、写出下列物质的电子式 N2HCl CO2H2O NH3BF3CH4 【开启新知识】 一、活动探究 发挥自己的想象,各小组用橡皮泥把下列物质可能的形状捏出来 CO2H2O NH3BF3CH4 提示:原子用球,键用牙签 成果展示
疑问:CO 2 H 2O 的组成都就是一个中心 原子,两个被结 合原子,分子组 成一样,构型为 什么不一样? 问题分析: 分子构 型就是由共价 键 的 与 决定的 共价 键的实质就是 也就就是说,分子长什么样与共用电子对所处的轨道夹角有关系 二、 杂化轨道理论 1.用杂化轨道理论解释甲烷分子的形成 在形成CH 4分子时, 碳原子的一个 轨道与三个 轨道发生混杂,形成四个能量相等的 杂化轨道。四个 杂化轨道分别与四个H 原子的1s 轨道重叠成键形成CH 4分子,所以四个C —H 键就是等同的。可表示为 2.杂化轨道的类型 杂化类型 sp sp 2 sp 3 参与杂化的旧的n s 化学式 立体构型 结构式 键角 比例模型 球棍模型 CO 2 O =C =O 180° H 2O 105° BF 3 120° NH 3 107° CH 4 109°28′
(1)观察上述杂化过程,分析原子轨道杂化后,数量与能量有什么变化? (2)2s轨道与3p轨道能否形成sp2杂化轨道? 三、确定杂化轨道数目及类型 对AB m形分子来说 杂化轨道数目=σ键+ 孤电子对数 练练手
杂化轨道理论(图解)一、原子轨道角度分布图 S Px Py Pz dz2 dx2-y2dxy dxz dyz 二、共价键理论和分子结构 ㈠、共价键理论简介 1、经典的化学键电子理论: 1916年德国化学家柯塞尔(Kossel)和1919年美国化学家路易斯(Lewis)等提出了化学键的电子理论。他们根据稀有气体原子的电子层结构特别稳定这一事实,提出各元素原子总是力图(通过得失电子或共用电子对)使其最外层具有8电子的稳定结构。柯塞尔用电子的得失解释正负离子的结合。路易斯提出,原子通过共用电子对而形成的化学键称为共价键(covalent [k?u`veilent]bond[b?nd])。用黑点代表价电子(即最外层s,p轨道上的电子),可以表示原子形成分子时共用一对或若干对电子以满足稀有气体原子的电子结构。为了方便,常用短线代替黑点,用“-”表示共用1对电子形成的共价单键,用“=”表示2对电子形成的共价双键,“≡”表示3对电子形成的共价叁键。原子单独拥有的未成键的电子对叫做孤对电子(lone[l?un]pair[pε?]electron[i`lektr?n])。Lewis结构式的书写规则又称八隅规则(即8电子结构)。 评价贡献:Lewis共价概念初步解释了一些简单非金属原子间形成共价分子的过程及其与离子键的区别。局限性:①、未能阐明共价键的本质和特性;②、八隅规则的例外 PCl5SF6BeCl2BF3NO,NO2… 中心原子周围价电子数101246含奇数价电子的分子… ③、不能解释某些分子的性质。含有未成对电子的分子通常是顺磁性的(即它们在磁场中表现出磁性)例如O2。 2、1927年德国的海特勒Heitler和美籍德国人的伦敦London两位化学家建立了现代价键理论,简称VB理论(电子配对法)。1931年,鲍林在电子配对的基础上提出了杂化轨道理论的概念,获1954年诺贝尔化学奖。 3、1928年-1932年,德国的洪特和美国的马利肯两位化学家提出分子轨道理论,简称MO理论。马利肯由于建立和发展分子轨道理论荣获得1966年诺贝尔化学奖。 MO法和VB法是两种根本不同的物理方法;都是电子运动状态的近似描述;在一定条件
分子杂化轨道理论 2010-5-8 化材学院 化学(1)李向阳 价键理论简明地阐明了共价键的形成过程和本质,成功解释了共价键的方向性和饱和性,但在解释一些分子的空间结构方面却遇到了困难。例如CH 4分子的形成,按照价键理论,C 原子只有两个未成对的电子,只能与两个H 原子形成两个共价键,而且键角应该大约为90°。但这与实验事实不符,因为C 与H 可形成CH 4分子,其空间构型为正四面体,∠HCH = 109.5°。为了更好地解释多原子分子的实际空间构型和性质,1931年鲍林提出了杂化轨道理论(hybrid orbital theory ),丰富和发展了现代价键理论。1953年,我国化学家唐敖庆等统一处理了s-p-d-f 轨道杂化,提出了杂化轨道的一般方法,进一步丰富了杂化理论的内容 1.杂化轨道理论的基本要点 杂化轨道理论从电子具有波动性、波可以叠加的观点出发,认为一个原子和其他原子形成分子时,中心原子所用的原子轨道(即波函数)不是原来纯粹的s 轨道或p 轨道,而是若干不同类型、能量相近的原子轨道经叠加混杂、重新分配轨道的能量和调整空间伸展方向,组成了同等数目的能量完全相同的新的原子轨道——杂化轨道(hybrid orbital),以满足化学结合的需要。这一过程称为原子轨道的杂化(hybridization )。 下面以CH 4分子的形成为例加以说明。 基态C 原子的外层电子构型为2s 2 2p x 1 2p y 1 。在与H 原子结合时,2s 上的一个电子被激发到2p z 轨道上,C 原子以激发态2s 12p x 12p y 12p z 1参与化学结合。当然,电子从2s 激发到2p 上需要能量,但由于可多生成二个共价键,放出更多的能量而得到补偿。 在成键之前,激发态C 原子的四个单电子分占的轨道2s 、2p x 、2p y 、2p z 会互相“混杂”,线性组合成四个新的完全等价的杂化轨道。此杂化轨道由一个s 轨道和三个p 轨道杂化而成,故称为sp 3杂化轨道。经杂化后的轨道一头大,一头小,其方向指向正四面体的四个顶角,能量不同于原来的原子轨道(图1.6)。 形成的四个sp 3 杂化轨道与四个H 原子的1s 原子轨道重叠,形成(sp 3-s )σ键,生成CH 4分子。 杂化轨道成键时,同样要满足原子轨道最大重叠原理。由于杂化轨道的电子云分布更为集中,杂化轨道的成键能力比未杂化的各原子轨道的成键能力强,故形成CH 4分子后体系能量降低,分子的稳定性增强。 CH 4分子形成的整个杂化过程可示意如下 图1. sp 3杂化轨道示意图 激发 杂化 sp 3杂化轨道 4 个电子能量相等 2 s 2p 基态C 原子 2 s 2p 1个2s 电子激发到2p 轨道 与4 个H 原子的1 s 电子结合 sp 3-s 重叠成键
杂化轨道理论(图解) 一、原子轨道角度分布图 S Px Py Pz dz 2 dx 2-y 2 dxy dxz dyz 二、共价键理论和分子结构 ㈠、共价键理论简介 1、经典的化学键电子理论: 1916年德国化学家柯塞尔(Kossel)和1919年美国化学家路易斯(Lewis)等提出了化学键的电子理论。他们根据稀有气体原子的电子层结构特别稳定这一事实,提出各元素原子总是力图(通过得失电子或共用电子对)使其最外层具有8电子的稳定结构。柯塞尔用电子的得失解释正负离子的结合。路易斯提出,原子通过共用电子对而形成的化学键称为共价键(covalent [k ?u`veilent]bond[b ?nd])。用黑点代表价电子(即最外层s ,p 轨道上的电子),可以表示原子形成分子时共用一对或若干对电子以满足稀有气体原子的电子结构。为了方便,常用短线代替黑点,用“-”表示共用1对电子形成的共价单键,用“=”表示2对电子形成的共价双键,“≡”表示3对电子形成的共价叁键。原子单独拥有的未成键的电子对叫做孤对电子(lone[l ?un]pair[p ε?]electron[i`lektr ?n])。Lewis 结构式的书写规则又称八隅规则(即8电子结构)。 评价 贡献:Lewis 共价概念初步解释了一些简单非金属原子间形成共价分子的过程及其 与离子键的区别。局限性:①、未能阐明共价键的本质和特性;②、八隅规则的例外很多。 PCl 5 SF 6 BeCl 2 BF 3 NO ,NO 2 …
中心原子周围价电子数10 12 4 6 含奇数价电子的分子… ③、不能解释某些分子的性质。含有未成对电子的分子通常是顺磁性的(即它们在磁场中表现出磁性)例如O2。 2、1927年德国的海特勒Heitler和美籍德国人的伦敦London两位化学家建立了现代价键理论,简称VB理论(电子配对法)。1931年,鲍林在电子配对的基础上提出了杂化轨道理论的概念,获1954年诺贝尔化学奖。 3、1928年-1932年,德国的洪特(F.Hund)和美国的马利肯(R.S.Mulliken)两位化学家提出分子轨道理论,简称MO理论。马利肯(R.S.Mulliken)由于建立和发展分子轨道理论荣获得1966年诺贝尔化学奖。 MO法和VB法是两种根本不同的物理方法;都是电子运动状态的近似描述;在一定条件下它们具有等价性。 O2 :2 O原子电子组态1s22s22p4 →O2,8×2=16个电子,外层电子:12个电子, KK(σ2s)2(σ*2s)2(σ2pz)2 (π2px)2(π2py)2(π*2px)1 (π*2py)1 MO理论认为价电子为12,其中 成键电子,(σ2s)2(σ2pz)2(π2px)2(π2py)2共8个电子 反键电子,(σ*2s)2(π*2px)1 (π*2py)1共4个电子 ------------ ----------- ----------- σ单键,3电π键,3电子π键 σ+π3+π3,由于每个π3只相当于半个键,故键级=2。尽管该键级与传统价键理论的结论一致,但分子轨道理论圆满解释了顺磁性(由于分子中存在未成对电子引起的),价键理论则不能解释。
1.BF3分子的结构: 硼原子的电子层结构为1s22s22p x1,当硼与氟反应时,硼原子的一个2s电子激发到一个空的2P轨道中,使硼原子的电子层结构变为1s22s22p x12p y1。硼原子的2s轨道和两个2p轨道杂化组合成sp2杂化轨道,硼原子的三个sp2杂化轨道分别与三个F原子的各一个2P轨道重叠形成三个sp2-p的σ键,由于三个sp2杂化轨道在同一平面上,而且夹角为120°,所以BF3分子具有平面三角形结构。 2.气态的BeCl2分子的结构: Be原子的电子结构1s22s2,从表面上看Be原子似乎不能形成共价键,但是在激发状态下,Be的一个2s 电子可以进入2p轨道,经过杂化形成2个sp杂化轨道,与氯原子中的3p轨道重叠形成两个sp-pσ键。由于杂化轨道间的夹角为180°,所以形成的BeCl2分子的空间结构是直线型。 BeCl2分子杂化态 3.乙烯、乙炔分子的结构: 乙烯分子中碳原子的原子轨道采用SP2杂化。形成乙烯分子时,两个碳原子各用一个sp2杂化轨道上的电子相互配对,形成一个σ键;每个碳原子的另外两个sp2杂化轨道上的电子分别与两个氢原子的1s轨道的电子配对形成共价键;每个碳原子的一个未参与杂化的2P轨道(均含有一个未成对电子)能够以“肩并肩”的方式重叠,该轨道上的电子配对形成一个π键。三个sp2杂化轨道的对称轴在同一平面上,对称轴夹角为1200,这样,在乙烯分子中的碳原子间,存在一个σ键和一个π键。类似地,乙炔分子中的碳原子采取sp1杂化,两个sp杂化轨道的对称轴在同一直线上,夹角为180o,两个碳原子间存在一个σ键和两个π键。 注意:杂化轨道只能形成σ键,不能形成π键。 例1.有关甲醛分子的说法正确的是() A.C原子采取sp杂化 B.甲醛分子为三角锥形结构 C.C原子采取sp2杂化 D.甲醛分子为平面三角形结构 4.氨分子的结构: 在形成氨分子时,氮原子中的原子轨道也发生了sp3杂化,生成四个SP3杂化轨道,但所生成的四个sp3杂化轨道中,只有三个轨道各含有一个未成对电子,可分别与一个氢原子的1s电子形成一个σ键,另一个sp3杂
1、现代价键理论要点: (1)自旋相反的成单电子相互接近时,核间电子密度较大,可形成稳定的共价键 (2)共价键有饱和性。一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键。 例如:H-H N≡N (3)共价键有方向性。这是因为,共价键尽可能沿着原子轨道最大重叠的方向形成,叫做最大重叠原理。 2.按原子轨道的重叠方式分:键和键 键:原子轨道“头碰头”重叠 键:原子轨道“肩并肩”重叠 杂化轨道理论的基本要点 原子轨道在成键的过程中并不是一成 不变的。同一原子中能量相近的某些轨道, 在成键过程中重新组合成一系列能量相等 的新轨道而改变了原有的状态。这一过程称 为“杂化”。所形成的新轨道叫做“杂化轨道”。 杂化轨道的要点: 原子形成分子时,是先杂化后成键 同一原子中不同类型、能量相近的原子轨道参与杂化 杂化前后原子轨道数不变 杂化后形成的杂化轨道的能量相同 杂化后轨道的形状、伸展方向发生改变 杂化轨道参与形成σ键,未参与杂化的轨道形成π键 sp3 一个s轨道与三个p轨道杂化后,得四个sp3杂化轨道,每个杂化轨道的s成分为1/4,p成分为3/4,它们的空间取向是四面体结构,相互的键角θ=109o28′CH4,CCl4C原子与H原子结合形成的分子为什么是CH4,而不是CH2或CH3?CH4分子为什么具有正四面体的空间构型(键长、键能相同,键角相同为109°28′)? 它的要点是:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,得到4个能量相等、成分相同的sp3杂化轨道,夹角109°28 ′,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的如下图所示:
分子结构与性质 一、共价键 1.本质:原子间形成共用电子对 分类{非极性共价键:两个相同的非金属元素的原子间形成的共价键 极性共价键:两个不相同的非金属元素的原子间形成的共价键 、HCl的形成 思考:用电子式表示H 2 共价键特征: ①饱和性:每个原子形成共价键的数目是确定的 ②方向性:原子轨道沿一定方向重叠使成键的原子轨道最大程度地重叠 2.σ键和π键 ①σ键--原子轨道沿着连线方向以“头碰头”方式重叠形成的共价键 特点:以形成化学键的两个原子核的连线为轴旋转,σ键电子云的图形不变 电子云描述氢原子形成氢分子的过程(s-s σ键) ②π键--原子轨道沿着连线方向以“肩并肩”方式重叠形成的共价键 特点:(1)电子云为镜像,即是每个π键的电子云由两块组成,分别位于由两个原子核构成的平面的两侧 (2)不稳定,容易断裂 p-p π键的形成
N 2 分子中的N≡N 思考:分析CH 3CH 3 、CH 2 =CH 2 、CH≡CH、CO 2 分子中键的类别和个数 3.键参数--键能、键长与键角 ①键能:气态基态原子形成1 mol化学键释放的最低能量 键能越大,即形成化学键时放出的能量越多,化学键越稳定 应用--计算化学反应的反应热ΔH=反应物键能总和-生成物键能总和 ②键长:形成共价键的两个原子之间的核间距 键长是衡量共价稳定性的另一个参数 规律:键长越短,一般键能越大,共价键越稳定 一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定 ③键角:两个共价键之间的夹角 键角是描述分子立体结构的重要参数,分子的许多性质与键角有关 思考:N 2、O 2 、F 2 跟H 2 的反应能力依次增强,从键能的角度如何理解 4.等电子原理 等电子体:原子总数相同、价电子(最外层电子)总数相同的分子如N 2 和CO 是等电子体,但N 2和C 2 H 4 不是等电子体 等电子体原理:原子总数、价电子总数相同的分子具有相似的化学键特征,它们的物理性质是相近的。例如N 2 和CO的熔沸点、溶解性、分子解离能等都非常接近 5.用质谱测定分子的结构 原理:不同质核比的粒子在磁场中运动轨迹不同 eg:1.下列物质中能证明某化合物中一定有离子键的是() A.可溶于水 B.熔点较高 C.水溶液能导电 D.熔融状态能导电 2.下列关于化学键的叙述中,正确的是() A.离子化合物可以含共价键 B.共价化合物可能含离子键 C.离子化合物中只含离子键 D.只有活泼金属与活泼非金属间才能形成离子键
分子结构与性质测试题 A卷(基础知识卷) 一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个正确答案) 1.关于氢键,下列说法正确的是()。 A.氢键比分子间作用力强,所以它属于化学键 B.冰中存在氢键,水中不存在氢键 C.分子间形成的氢键使物质的熔点和沸点升高 D.H2O是一种非常稳定的化合物,这是由于氢键所致 2在以下的分子或离子中,空间结构的几何形状不是三角锥形的是()。 A.NF3 B. C.BF3 D. 3.能说明CH4分子的5个原子不在同一平面而为正四面体构型的是 ( )。 A.两个键之间夹角为109°28′ B.C—H键为极性共价键 C.4个C—H键的键能、键长相同 D.碳的价层电子都形成共价键 4.用价层电子对互斥理论判断SO3的分子构型 ( )。 A.正四面体形 B.V形 C.三角锥形 D.平面三角形 5.乙炔分子中的碳原子采取的杂化轨道是()。 A.sp杂化 B.sp2杂化 C.sp3杂化 D.dsp杂化 6..下列分子中,所有原子不可能共处在同一平面上的是 ( )。 A.C2H2 B.CS2 C.NH3 D.C6H6 7.下列说法中正确的是 ( )。 A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 B.P4和CH4都是正四面体分子且键角都为109°28′ C.NH4+的电子式为[H··N··H ··H]+,离子呈平面正方形结构 D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 8.用价层电子对互斥理论预测H2S和BF3的立体构型,两个结构都正确的是( )。 A.直线形;三角锥形 B.V形;三角锥形 C.直线形;平面三角形 D.V形;平面三角形 9.若的中心原子A上没有孤对电子,运用价层电子对互斥模型,下列说法正确的是() A.若=2,则分子的立体结构为V形 B.若=3,则分子的立体结构为三角锥形 C.若=4,则分子的立体结构为正四面体形 D.以上说法都不正确
1、现代价键理论要点: (1)自旋相反的成单电子相互接近时,核间电子密度较大,可形成稳定的共价键 (2)共价键有饱与性。一个原子有几个未成对电子,便可与几个自旋相反的电子配对成键。 例如:H-H N≡N (3)共价键有方向性。这就是因为,共价键尽可能沿着原子轨道最大重叠的方向形成,叫做最大重叠原理。 2、按原子轨道的重叠方式分:键与键 键:原子轨道“头碰头”重叠 键:原子轨道“肩并肩”重叠 杂化轨道理论的基本要点 原子轨道在成键的过程中并不就是一 成不变的。同一原子中能量相近的某些轨道, 在成键过程中重新组合成一系列能量相等 的新轨道而改变了原有的状态。这一过程称 为“杂化”。所形成的新轨道叫做“杂化轨道”。 杂化轨道的要点: 原子形成分子时,就是先杂化后成键 同一原子中不同类型、能量相近的原子轨道参与杂化 杂化前后原子轨道数不变 杂化后形成的杂化轨道的能量相同 杂化后轨道的形状、伸展方向发生改变 杂化轨道参与形成σ键,未参与杂化的轨道形成π键 sp3 一个s轨道与三个p轨道杂化后,得四个sp3杂化轨道,每个杂化轨道的s成分为1/4,p 成分为3/4,它们的空间取向就是四面体结构,相互的键角θ=109o28′CH4,CCl4 C原子与H原子结合形成的分子为什么就是CH4,而不就是CH2或CH3?CH4分子为什么具有正四面体的空间构型(键长、键能相同,键角相同为109°28′)? 它的要点就是:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道与3个2p轨道会发生混杂,混杂时保持轨道总数不变,得到4个能量相等、成分相同的sp3杂化轨道,夹角109°28 ′,表示这4个轨道就是由1个s轨道与3个p轨道杂化形成的如下图所示:
第二章分子结构与性质 课标要求 1.了解共价键的主要类型键和键,能用键长、键能和键角等说明简单分子的某些性质 2.了解杂化轨道理论及常见的杂化轨道类型(sp、sp2、sp3),能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或离子的空间结构。 3.了解简单配合物的成键情况。 4.了解化学键合分子间作用力的区别。 5.了解氢键的存在对物质性质的影响,能列举含氢键的物质。 要点精讲 一.共价键 1.共价键的本质及特征 共价键的本质是在原子之间形成共用电子对,其特征是具有饱和性和方向性。 2.共价键的类型 ①按成键原子间共用电子对的数目分为单键、双键、三键。 ②按共用电子对是否偏移分为极性键、非极性键。 ③按原子轨道的重叠方式分为σ键和π键,前者的电子云具有轴对称性,后者的电子云具有镜像对称性。 3.键参数 ①键能:气态基态原子形成1 mol化学键释放的最低能量,键能越大,化学键越稳定。 ②键长:形成共价键的两个原子之间的核间距,键长越短,共价键越稳定。 ③键角:在原子数超过2的分子中,两个共价键之间的夹角。 ④键参数对分子性质的影响 键长越短,键能越大,分子越稳定. 4.等电子原理[来源:学§科§网] 原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质相近。 二.分子的立体构型 1.分子构型与杂化轨道理论 杂化轨道的要点 当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间形状不同。 2分子构型与价层电子对互斥模型 价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。 (1)当中心原子无孤对电子时,两者的构型一致; (2)当中心原子有孤对电子时,两者的构型不一致。 3.配位化合物 (1)配位键与极性键、非极性键的比较 (2)配位化合物 ①定义:金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物。 ②组成:如[Ag(NH3)2]OH,中心离子为Ag+,配体为NH3,配位数为2。 三.分子的性质 1.分子间作用力的比较
杂化轨道的类型与分子空间构型 一、杂化类型有 1)sp杂化 同一原子内由一个ns轨道和一个np轨道发生的杂化,称为sp杂化。杂化后组成的轨道称为sp杂化轨道。sp杂化可以而且只能得到两个sp杂化轨道。实验测知,气态BeCl2中的铍原子就是发生sp杂化,它是一个直线型的共价分子。Be 原子位于两个Cl原子的中间,键角180°,两个Be-Cl键的键长和键能都相等2)sp2杂化 同一原子内由一个ns轨道和二个np轨道发生的杂化,称为sp2杂化。杂化后组成的轨道称为sp2杂化轨道。气态氟化硼(BF3)中的硼原子就是sp2杂化,具有平面三角形的结构。B原子位于三角形的中心,三个B-F键是等同的,键角为120° 3)sp3杂化可以而且只能得到四个sp3杂化轨道。CH4分子中的碳原子就是发生sp3杂化,它的结构经实验测知为正四面体结构,四个C-H键均等同,键角为109°28′。这样的实验结果,是电子配对法所难以解释的,但杂化轨道理论认为,激发态C原子(2s12p3)的2s轨道与三个2p轨道可以发生sp3杂化,从而形成四个能量等同的sp3杂化轨道 sp型的三种杂化
π键(pi bond)成键原子的未杂化p轨道,通过平行、侧面重叠而形成的共价键,叫做π键,可简记为“肩并肩”。 π键与σ键不同,它的成键轨道必须是未成对的p轨道。π键可以是两中心,两电子的定域键,也可以是多中心,多电子的大Π键;同时,π键既可以是一般共价键,也可以是配位共价键。两个原子间可以形成最多2条π键,例如,碳碳双键中,存在一条σ键,一条π键,而碳碳三键中,存在一条σ键,两条π键。 简单地说,π键是电子云“肩并肩”地重叠,σ键是电子云“头碰头”地重叠。 烷烃中只存在一种键,所以可以发生取代反应. 烯烃的双键就是由π键和σ键组成.后者比较稳定,前者不稳定,所以发生氧化反应或者加成反应.π键和σ键是互相垂直的.平行于碳原子之间的π键就比较容易断裂. 炔烃也是由两种键组成,一个碳碳三键有两个π键.一个和σ键.π键也是不稳定的.π键和σ键之间也是互相垂直的,π键和π键之间是平行的.所以炔烃也具有烯烃的化学性质. 在乙炔分子中,有两个π键,在乙烯分子中,只有一个π键,但相对来说,乙炔分子中π电子云不如乙烯中π电子云集中。另外,乙炔分子中碳原子是sp杂化,乙烯分子中碳原子是sp2杂化。凡碳原子杂化电子云s成分愈大,这个碳原子的电负性也愈大,所以乙炔分子中碳原子的电负性比乙烯分子中碳原子的电负性大,再加上乙炔分子中两个碳原子之间的共用电子比乙烯的多,造成乙炔的键长比乙烯的短,乙炔分子中的π键比乙烯分子中的π键结合得比较牢固。 正由于乙烯和乙炔分子具有上述结构上的差异,因此表现在对不同试剂的反应上,活泼性就不同。乙烯分子中π电子云比乙炔的集中,当遇到亲电试剂进攻时,乙烯比乙炔易加成。溴和高锰酸钾都属于亲电试剂。 单键是一根σ键;双键和三键都含一根σ键,其余1根或2根是π键。但无机化合物不用此法。原因是,无机化合物中经常出现的共轭体系(离域π键)使得某两个原子之间共用的电子对数很难确定,因此无机物中常取平均键级,作为键能的粗略标准。 经验方法: 如果两原子之间只有一个化学键就是sigma键 如果不止一个化学键,那就是一个sigma键加上n个π键
化学分子杂化轨道及构型 Prepared on 22 November 2020
1、现代价键理论要点: (1)自旋相反的成单电子相互接近时,核间电子密度较大,可形成稳定的共价键 (2)共价键有饱和性。一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键。 例如:H-H N≡ N (3)共价键有方向性。这是因为,共价键尽可能沿 着原子轨道最大重叠的方向形成,叫做最大重叠 原理。 2.按原子轨道的重叠方式分:键和键 键:原子轨道“头碰头”重叠 键:原子轨道“肩并肩”重叠 杂化轨道理论的基本要点 原子轨道在成键的过程中并不是一成不变 的。同一原子中能量相近的某些轨道,在成键过程中重新组合成一系列能量相等的新轨道而改变了原有的状态。这一过程称为“杂化”。所形成的新轨道叫做“杂化轨道”。 杂化轨道的要点: 原子形成分子时,是先杂化后成键 同一原子中不同类型、能量相近的原子轨道参与杂化 杂化前后原子轨道数不变 杂化后形成的杂化轨道的能量相同 杂化后轨道的形状、伸展方向发生改变 杂化轨道参与形成σ键,未参与杂化的轨道形成π键 sp3 一个s轨道与三个p轨道杂化后,得四个sp3杂化轨道,每个杂化轨道的s成分为1/4,p成分为3/4,它们的空间取向是四面体结构,相互的键角θ=109o28′ CH4,CCl4 C原子与H原子结合形成的分子为什么是CH4,而不是CH2或CH3CH4分子为什么具有正四面体的空间构型(键长、键能相同,键角相同为109°28′) 它的要点是:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,得到4个能量相等、成分相同的sp3杂化轨道,夹角109°28 ′,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的如下图所示: H2O中O也是采取sp3杂化 O的电子构型:1s22s22p4NH3中N也是采取sp3杂化 N的电子构型:1s22s22p3 等性杂化和不等性sp3杂化 与中心原子键合的是同一种原子,分子呈高度对称的正四面体构型,其中的4个sp3杂化轨道自然没有差别,这种杂化类型叫做等性杂化。
有机化学结构与性质 1. 【2015新课标□卷理综化学】某段酸酯的分子式为G8H26O5, 1mol该酯完全水解可得到1mol 短酸和2mol乙醇,该短酸的分子式为() A. C14H18O5 B. C14H16O4 C. C14H22O5 D. C14H10O5 【答案】A 【解析】暧酸酯的分子式为G S H M Q,Imol该酷完全水解可得到Imcl度惭2md乙醇,这说明分子中含有2个酯基,因此有2分子水参加反应,水解方程式为w以嘛0玳任0—茂酸氏O,则根据原子守恒可知该琰酸的分子式中碳原子个数是18—2X2=14,氢原子个数是215+4-2X6=18,氧原子个数是5+2-2X 1 = 5,即分子式为C N H:Q』A正确* 【考点定位】本题主要是琴查酉旨美物质的水解、利用腐童守恒定律判断物质的分子式 【名师点晴】淡题以酯类的水解反应为载体「考查了学生灵活运用水解反应方程式判断有机物分子式,该题的关窿是判断出酯类物所中含有2个酣基以及原子守恒在化学反应中的应用,题目能度不大, 2. 【2015新课标口卷理综化学】分子式为C5H10O2并能与饱和NaHCQ 溶液反应放出气体的有机物有(不含立体异构)() A. 3种 B. 4种 C. 5种 D. 6种 【答案】B 【解析】分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体,这说明该有机物是饱和的 一元短酸,即分子组成为C4H9— COOH 丁基有4种,分别是CH3CH2CH2CH2—> ( CH3)2CHCH2 一、(CMLC—、CH3CH2CH CH3)一,所以该短酸也有4种,答案选B。 【考点定位】本题主要是考查有机物同分异构体种类判断,侧重于碳链异构体的考查。 【名师点晴】该题的关键是熟悉常见官能团的结构与性质,准确判断出有机物的属类,依据 碳链异构体的书写方法逐一分析判断即可,旨在考查学生灵活运用基础知识解决实际问 题的能力。 3. 【2015浙江理综化学】下列说法不正.确..的是() A. 己烷有4种同分异构体,它们的熔点、沸点各不相同 B. 在一定条件下,苯与液漠、硝酸、硫酸作用生成漠苯、硝基苯、苯磺酸的反应都属于 取代反应 C. 油脂皂化反应得到高级脂肪酸盐与甘油