
必修一化学方程式
一.过量
1.澄清石灰水中通入少量二氧化碳:Ca(OH)2 + CO2══ CaCO3 + H2O
2.澄清石灰水中通入过量二氧化碳Ca(OH)2+ 2CO2══ Ca(HCO3)2
3.氢氧化钠溶液中通入少量二氧化碳:2NaOH + CO2 ==== Na2CO3+ H2O
4.氢氧化钠溶液中通入过量二氧化碳;CO2+NaOH ==== NaHCO3
5.碳酸钠溶液中加入少量盐酸:Na2CO3+HCl ==== NaHCO3+NaCl
6.碳酸钠溶液中加入足量盐酸:NaHCO3+HCl ==== NaCl+H2O+CO2↑
7.硫酸氢纳溶液中加入少量氢氧化钡:2NaHSO4+Ba(OH)2====BaSO4↓+ NaSO4+2H2O
8.硫酸氢纳溶液中加入过量的氢氧化钡:NaHSO4+Ba(OH)2====BaSO4↓+NaOH+H2O
9.碳酸氢钙溶液中加入少量氢氧化钠溶:Ca(HCO3)2+NaOH===NaHCO3+CaCO3↓+H2O
10.碳酸氢钙溶液中加入足量氢氧化钠溶:2NaOH+Ca(HCO3)2=CaCO3↓+2H2O+Na2CO3
11.澄清石灰水中加入少量的碳酸氢钠溶液:NaHCO3+Ca(OH)2===NaOH+H2O+CaCO3↓
12.澄清石灰水中加入少量的碳酸氢钠液:2NaHCO3+Ca(OH)2=Na2CO3+2H2O+CaCO3↓
二、钠及其化合物
1.钠在空气中燃烧:4Na+O2=2Na2O
2.钠在氧气中加热:2Na+O2点燃Na2O2 Cl2 +2Na点燃2NaCl
3.钠与水反应:2Na+2H2O=2NaOH+H2↑ 2Na + 2H2O == 2Na+ + 2OH-+ H2↑
4.钠与硫酸铜溶液反应:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4 + H2↑
5.钠和氯化铁溶液反应:6Na+6H2O+2FeCl3=2Fe(OH)3↓+6Na Cl + 3H2↑
6.氧化钠的主要化学性质:2Na2O+O2△2Na2O2Na2O+H2O=2NaOH
Na2O+SO3=Na2SO4Na2O+CO2=Na2CO3Na2O+2HCl=2NaCl+H2O
7.过氧化钠与水反应: 2Na2O2+2H2O=4NaOH+O2↑
8.过氧化钠与二氧化碳反应: 2Na2O2+2CO2=2Na2CO3+O2
9.过氧化钠和硫酸反应: Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2
10.过氧化钠和二氧化硫反应Na2O2+SO2=Na2SO4
11.土法制烧碱:Ca(OH)2+Na2CO2=CaCO3↓ +2NaOH
12.二氧化碳通入饱和碳酸钠溶液:Na2CO3+H2O+CO2 =2NaHCO3↓
13.碳酸氢钠受热分解: 2NaHCO3===Na2CO3+H2O+CO2↑
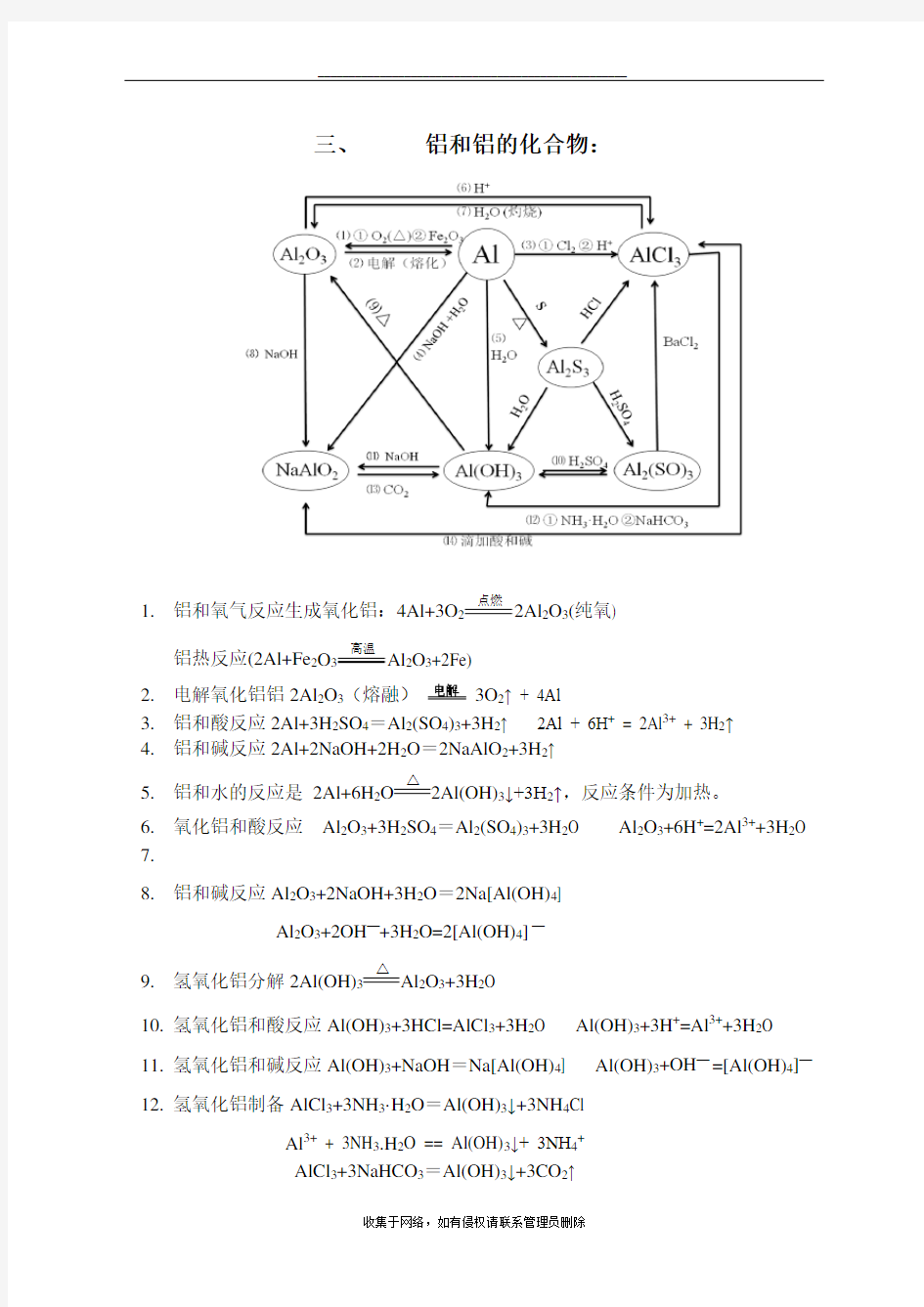
三、铝和铝的化合物:
1.铝和氧气反应生成氧化铝:4Al+3O2点燃2Al2O3(纯氧)
铝热反应(2Al+Fe2O3高温Al2O3+2Fe)
2.电解氧化铝铝2Al2O3(熔融)3O2↑ + 4Al
3.铝和酸反应2Al+3H2SO4=Al2(SO4)3+3H2↑ 2Al + 6H+ = 2Al3+ + 3H2↑
4.铝和碱反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑
5.铝和水的反应是2Al+6H2O△2Al(OH)3↓+3H2↑,反应条件为加热。
6.氧化铝和酸反应Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3+6H+=2Al3++3H2O
7.
8.铝和碱反应Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
Al2O3+2OH—+3H2O=2[Al(OH)4]—
9.氢氧化铝分解2Al(OH)3△Al2O3+3H2O
10.氢氧化铝和酸反应Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O
11.氢氧化铝和碱反应Al(OH)3+NaOH=Na[Al(OH)4] Al(OH)3+OH—=[Al(OH)4]—
12.氢氧化铝制备AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
Al3+ + 3NH3.H2O == Al(OH)3↓+ 3NH4+
AlCl3+3NaHCO3=Al(OH)3↓+3CO2↑
Al3+ + 3HCO3-== Al(OH)3↓ + 3CO2↑
13.偏铝酸钠溶液中通入二氧化碳(少量、过量)
2NaAlO2+3H2O+CO2= 2Al(OH)3↓+Na2CO3
Na2CO3+H2O+CO2=2NaHCO3
NaAlO2+2H2O+CO2= Al(OH)3↓+ NaHCO3
14.氯化铝中滴入过量的氢氧化钠:AlCl3+4NaOH=NaAlO2+3NaCl +2H2O
氢氧化钠溶液滴入过量氯化铝:AlCl3+4NaOH=NaAlO2+3NaCl +2H2O
3NaAlO2+AlCl3+6H2O=3NaCl+ 4Al(OH)3↓偏铝酸钠溶液中滴入过量盐酸:NaAlO2+4HCl=NaCl+AlCl3+2H2O
盐酸中滴入过量的偏铝酸钠溶液:NaAlO2+4HCl=NaCl+AlCl3+2H2O
3NaAlO2+AlCl3+6H2O=3NaCl+ 4Al(OH)3↓
四、铁和铁的化合物
1.铁在干燥空气中氧化3Fe + 2O2点燃
Fe3O4
2.
铁和非金属反应2Fe + 3Cl2点燃2FeCl3Fe +S△FeS
3.铁和水蒸气反应3Fe+4H2O(g)高温Fe3O4+4H2
4.铁和盐酸反应Fe+2HCl=FeCl2+H2↑Fe+2H+ = Fe2+ + H2↑
5.铁的置换Fe + CuSO4 = FeSO4 + Cu Fe + Cu2+ = Fe2+ + Cu
6.铁被氧化:
7.氢氧化亚铁被氧化4Fe(OH)2 + O2 + 2H2O == 4 Fe(OH)3
8.氢氧化铁分解2Fe(OH)3△2O3+3H2O
9.Fe2+——Fe3+的转化加氧化剂:
FeCl2 + Cl2=2FeCl3
10.Fe3+——Fe2+的转化加还原剂:
2FeCl3+Fe=3FeCl22FeCl3+Cu=2FeCl2+CuCl2
Fe + 2Fe3+ == 3Fe2+2Fe3+ + Cu == 2Fe2+ + Cu2+
11.Fe3+的检验FeCl3 + 3KSCN == Fe(SCN)3 + 3KCl
Fe3+ + 3SCN-== Fe(SCN)3(红色溶液)
五、硅及其化合物主要化学性质:
1.工业制硅2C+SiO2△Si+2CO(制得粗硅) Si(粗)+2Cl2△SiCl4
Si(粉)+O2△SiO2SiCl4+2H2△Si(纯)+4HCl
2.硅和氢氧化钠反应Si+2NaOH+H2O=Na2SiO3+2H2
Si + 2OH-+ H2O == SiO32-+ 2H2↑
3.二氧化硅和酸反应4HF+SiO2=SiF4+2H2O
4.二氧化硅和碱反应SiO2+2NaOH=Na2SiO3+H2O
SiO2 + 2OH-== SiO32-+ H2O (常温下强碱缓慢腐蚀玻璃) SiO2+CaO高温CaSiO3 SiO2+Na2CO3高温Na2SiO3+CO2
SiO2+CaCO3高温CaSiO3+CO2
5.硅酸钠变质Na2SiO3 + CO2 + H2O == H2SiO3↓+ Na2CO3
SiO32-+ CO2 + H2O == H2SiO3↓+ CO32
6.硅胶分解:H2SiO3△SiO2 + H2O
六、氯
1.氯气和非金属反应Cl2 +H22HCl (或光照)
3Cl2 +2P2PCl3Cl2 +PCl3PCl5
2.氯气和金属反应3Cl2 +2Fe2FeCl3Cl2 +2Na2NaCl
Cl2+Cu CuCl2Cl2 +2FeCl2=2FeCl3
3.氯气还原Cl2 + 2Fe2+ == 2Fe3+ + 2Cl-
Cl2+2NaBr =Br2+2NaCl Cl2+2Br-=Br2+2Cl-
Cl2 + 2KI =2KCl + I2Cl2 + 2I-== 2Cl-+ I2
4.氯气溶于水Cl2+H2O=HCl +HClO Cl2 + H2O == Cl-+ H+ + HClO
2HClO 2HCl +O2↑
5.氯气和二氧化硫Cl2+SO2 +2H2O=H2SO4 +2HCl
Cl2+ SO2 + 2H2O == 2Cl-+ SO42-+ 4H+
6.制漂白液:Cl2+2NaOH=NaCl+NaClO+H2O Cl2 + 2OH-== Cl-+ ClO-+ H2O
7.制漂粉精2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Ca(OH)2 +2Cl2=2Ca2++2ClO-+2Cl -+2H2O
8.漂白粉变质Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
七、硫及其化合物主要化学性质:
1.硫与铜的反应S+2Cu==== Cu2S
硫与铁的反应S+Fe==== FeS
硫与钠的反应S+2Na==== Na2S
硫与铝的反应3S+2Al==== Al2S3
硫与汞的反应S+Hg==== HgS
2.硫与氧气的反应S+O2==== SO2
3.硫与氢气的反应S+H2==== H2S
4.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O
5.硫与浓硫酸的反应S+2H2SO4(浓)==== 3SO2+2H2O
光照
6.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑
7.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+H2O
二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO3
8.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O
9.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca(HSO3)2
10.二氧化硫与水的反应SO2+H2O==== H2SO3
11.二氧化硫和硫化氢的反应SO2+2H2S==== 3S↓+2H2O
12.二氧化硫和氧气的反应SO2+O2====== 2SO3
13.二氧化硫和过氧化钠的反应SO2+Na2O2==== Na2SO4
14.二氧化硫和氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl
15.三氧化硫与水的反应SO3+H2O==== H2SO4
16.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO4
17.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO4
18.浓硫酸与铜的反应2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2O
19.浓硫酸与碳的反应2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O
20.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O3
21.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO2↑+H2O
22.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O
硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O
23.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S
硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS
24.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O
2H2S+O2==== 2S+2H2O
硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O
25.硫化氢与氯气的反应H2S+Cl2==== 2HCl+S↓
26.硫化氢与浓硫酸的反应H2S+H2SO4(浓)==== S↓+SO2↑+2H2O
27.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑
高中化学(人教版)必修一化学方程式汇总 1、硫酸根离子的检验: BaCl2 + Na2SO4 ==== BaSO4↓+ 2NaCl 2、碳酸根离子的检验: CaCl2 + Na2CO3 ===== CaCO3↓ + 2NaCl 3、碳酸钠与盐酸反应: Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑ 4、木炭还原氧化铜: 2CuO + C 高温 2Cu + CO2↑ 5、铁片与硫酸铜溶液反应: Fe + CuSO4 ===== FeSO4 + Cu 6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 ===== CaCO3↓+ 2NaCl 7、钠在空气中燃烧:2Na + O2 Na2O2 钠与氧气反应:4Na + O2 ==== 2Na2O 8、过氧化钠与水反应:2Na2O2 + 2H2O ==== 4NaOH + O2↑ 9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 ==== 2Na2CO3 + O2 10、钠与水反应:2Na + 2H2O ==== 2NaOH + H2↑ 11、铁与水蒸气反应:3Fe + 4H2O(g) ==== Fe3O4 + 4H2↑ 12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O ==== 2NaAlO2 + 3H2↑ 13、氧化钙与水反应:CaO + H2O ==== Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O 15、氧化铝与盐酸反应:Al2O3 + 6HCl ===== 2AlCl3 + 3H2O 16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH ===== 2NaAlO2 + H2O
人教版高一化学必修化学方程式汇总 集团档案编码:[YTTR-YTPT28-YTNTL98-UYTYNN08]
必修1 化学方程式汇总 一、钠及其重要化合物 1、钠与非金属的反应 4Na +O 2=2Na 2O (白色) 2Na + O 2 △ Na 2O 2 (淡黄色) 2Na +Cl 2 点燃 2NaCl 2、钠与水反应:2Na + 2H 2O = 2NaOH + H 2↑ (浮、熔、游、响、红) 3、 氧化钠 过氧化钠 Na 2O+H 2O=2NaOH 2Na 2O 2+2H 2O=4NaOH+O 2↑ Na 2O+CO 2=Na 2CO 3 2Na 2O 2+2CO 2=2Na 2CO 3+O 2↑ Na 2O+2HCl=2NaCl+H 2O 2Na 2O 2+4HCl=4NaCl+2H 2O+O 2↑ 6、Na 2CO 3和NaHCO 3 ①、与酸的反应 Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑ NaHCO 3+HCl=NaCl+H 2O+CO 2↑(反应速率更快) ②、与碱的反应 Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH 2NaHCO 3+Ca(OH)2=CaCO 3↓+Na 2CO 3+2H 2O NaHCO 3+NaOH = Na 2CO 3+H 2O ③、与盐的反应 Na 2CO 3+CaCl 2=2NaCl+CaCO 3↓ Na 2CO 3+BaCl 2=2NaCl+BaCO 3↓ ④、相互转化 2NaHCO 3 △ Na 2CO 3+H 2O+CO 2↑ (加热分解) Na 2CO 3+H 2O+CO 2=2NaHCO 3 (向Na 2CO 3溶液中通入足量的CO 2) 二、铝及其重要化合物 (结合Al 2O 3 和Al(OH)3的两性进行记忆!) 1、铝与非金属: 4Al + 3O 2 == 2Al 2O 3 2、铝与弱氧化性酸:2Al + 6HCl == 2AlCl 3 + 3H 2↑ 2Al+6H + == 2Al 3++3H 2 ↑ 铝与强氧化性酸:钝化(浓H 2SO 4、浓HNO 3) 3、铝与碱:2Al+2NaOH +2H 2O==2NaAlO 2 + 3H 2↑ ; 2Al+2H 2O+2OH -==2AlO 2-+3H 2↑ 4 ①、氧化铝与酸反应:Al 2O 3 + 6HCl == 2AlCl 3 + 3H 2O ②、氧化铝与碱反应:Al 2O 3 +2NaOH == 2NaAlO 2 + 2H 2O 5、氢氧化铝制备:可溶性铝盐和NH 3·H 2O AlCl 3+3NH 3·H 2O==Al(OH)3↓+3NH 4Cl Al 3++3NH 3·H 2O==Al(OH)3↓+3NH 4+ 6、氢氧化铝的不稳定性: 2Al(OH)3 △ Al 2O 3+2H 2O 7、氢氧化铝与酸反应:Al(OH)3 3 + 3H 2O 8、氢氧化铝与碱反应:Al(OH)3 +NaOH == NaAlO 2 + 2H 2O 9、“铝三角”(氢氧化铝的反应在上面已经提到,略): AlCl 3+3NaOH (少量)=Al(OH)3↓+3NaCl Al 3++3OH -=Al(OH)3↓+ AlCl 3+4NaOH (过量)=2NaAlO 2 + 2H 2O +3NaCl Al 3++4OH - = AlO 2- +2H 2O NaAlO 2+HCl (少量)+H 2O=Al(OH)3↓+NaCl AlO 2- +H + +H 2O =Al(OH)3 ↓ NaAlO 2+4HCl (过量)=AlCl 3+3NaCl+2H 2O AlO 2- +4H + =Al 3+ + 2H 2O
高一化学必修一化学方程式大全1、钠在空气中燃烧(黄色的火焰) 2Na + O2==【点燃】Na2O2 钠块在空气中变暗 4Na+O2=2Na2O Na2O在空气中加热(变黄) 2Na2O+O2=2Na2O2 2、钠与水反应(浮、熔、游、响、红) 2Na + 2H2O = 2NaOH + H2↑ 2Na + 2H2O = 2Na+ + 2OH- + H2↑ 3、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白) 2Na2O2 + 2H2O = 4NaOH + O2 ↑ 2Na2O2 + 2H2O = 4Na+ +4OH -+O2↑ 碱性氧化物Na2O与水的反应 Na2O+H2O=2NaOH 4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是: 2Na2O2 + 2CO2 = 2Na2CO3 + O2 5、苏打(纯碱)与盐酸反应 ①盐酸中滴加纯碱溶液 Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑ CO32- + 2H+= H2O + CO2↑ ②纯碱溶液中滴加盐酸,至过量 Na2CO3 + HCl =NaHCO3 + NaCl CO32- + H+ = HCO3-
NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+ = H2O +CO2↑ 6、小苏打受热分解 2NaHCO3==【加热】Na2CO3 + H2O +CO2 ↑ 7、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热 NaHCO3 + NaOH==【加热】Na2CO3 + H2O HCO3-+ OH - = H2O + CO32- (若是溶液中反应有离子方程式) 8、金属锂在空气中燃烧 4Li + O2==【加热】2Li2O 9、氯气的性质 铜丝在氯气中剧烈燃烧(棕色烟) Cu + Cl2==【点燃】CuCl2 之后加水,可由绿色溶液(浓)得到蓝色溶液(稀) Cl2 +2FeCl2 =2FeCl3 2Cl2+2NaBr=2NaCl+Br2 Cl2 +2NaI =2NaCl+I2 Cl2+SO2 +2H2O=H2SO4 +2HCl 2Na + Cl2 ==【点燃】2NaCl 10、铁在氯气中剧烈燃烧 2Fe + 3Cl2==【点燃】3FeCl3 11、氢气在氯气中燃烧(苍白色火焰) H2 + Cl2==【点燃】2HCl 氟气与氢气反应(黑暗处即可爆炸) H2+F2=2HF
高一化学必修一化学方程式总结 1、钠及其化合物的转化关系 ①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑ Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O 2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2 △ Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑ ⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑ Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2 ⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH 2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓ ⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3 OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3- ※⒂2NaHCO 3 △ Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2O HCO 3-+OH -=CO 32-+H 2O ⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑ CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑ 补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2O Ca 2++OH -+HCO 3-=CaCO 3↓+H 2O ②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2O Ca 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 2、铝及其化合物的转化关系 ①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2 △ 2Al 2O 3 2Al +6H +=2Al 3++3H 2↑ ※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O NaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂ ⒃ ⒄ ④ Al Al 2O 3 A l (O H)3 KAl(SO 4)2 NaAlO 2 AlCl 3 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿
必修一化学方程式以及离子方程式 1、硫酸根离子的检验: BaCl2+Na2SO4=BaSO4↓+2NaCl SO42-+Ba2+==BaSO4↓2、碳酸根离子的检验: CaCl2+Na2CO3=CaCO3↓+2NaCl CO32-+Ca2+==CaCO3↓3、碳酸钠与盐酸反应: Na2CO3+2HCl=2NaCl+H2O+CO2↑CO32-+2H+==CO2↑+H2O 4、铝与硝酸铜溶液反应: 2Al+3Cu(NO3)2=2Al(NO3)3+3Cu2Al+3Cu2+=2Al3++3Cu 5、钠在空气中燃烧(黄色的火焰)2Na+O2Na2O2 钠块在空气中变暗4Na+O2=2Na2O Na2O在空气中加热(变黄)2Na2O+O22Na2O2 6、钠与水反应(浮、熔、游、响、红) 2Na+2H2O=2NaOH+H2↑ 2Na+2H2O=2Na++2OH-+H2↑ 7、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白) 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2H2O=4Na++4OH-+O2↑ 碱性氧化物Na2O与水的反应Na2O+H2O=2NaOH 8、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是: 2Na2O2+2CO2=2Na2CO3+O2 9、苏打(纯碱)与盐酸反应 ①盐酸中滴加纯碱溶液 Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO32-+2H+=H2O+CO2↑ ②纯碱溶液中滴加盐酸,至过量 Na2CO3+HCl=NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O+CO2↑10、小苏打受热分解 2NaHCO3Na2CO3+H2O+CO2↑
高一化学必修一化学方 程式大全 集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)
高一化学必修一化学方程式大全 1、钠在空气中燃烧(黄色的火焰) 2Na + O2==【点燃】Na2O2 钠块在空气中变暗 4Na+O2=2Na2O Na2O在空气中加热(变黄) 2Na2O+O2=2Na2O2 2、钠与水反应(浮、熔、游、响、红) 2Na + 2H2O = 2H2O + H2 ↑ 2Na + 2H2O = 2Na+ + 2OH- + H2↑ 3、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白) 2Na2O2 + 2H2O = 4NaOH + O2 ↑ 2Na2O2 + 2H2O = 4Na+ +4OH -+O2↑ 碱性氧化物Na2O与水的反应 Na2O+H2O=2NaOH 4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是: 2Na2O2 + 2CO2 = 2Na2CO3 + O2 5、苏打(纯碱)与盐酸反应 ①盐酸中滴加纯碱溶液 Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑ CO32- + 2H+= H2O + CO2↑ ②纯碱溶液中滴加盐酸,至过量
Na2CO3 + HCl =NaHCO3 + NaCl CO32- + H+ = HCO3- NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+ = H2O +CO2↑ 6、小苏打受热分解 2NaHCO3==【加热】Na2CO3 + H2O +CO2 ↑ 7、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热 NaHCO3 + NaOH==【加热】Na2CO3 + H2O HCO3-+ OH - = H2O + CO32- (若是溶液中反应有离子方程式) 8、金属锂在空气中燃烧 4Li + O2==【加热】2Li2O 9、氯气的性质 铜丝在氯气中剧烈燃烧(棕色烟) Cu + Cl2==【点燃】CuCl2 之后加水,可由绿色溶液(浓)得到蓝色溶液(稀) Cl2 +2FeCl2 =2FeCl3 2Cl2+2NaBr=2NaCl+Br2 Cl2 +2NaI =2NaCl+I2 Cl2+SO2 +2H2O=H2SO4 +2HCl 2Na + Cl2 ==【点燃】2NaCl
高中化学必修1化学方程式总结 1、钠及其化合物的转化关系 ①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O ※⑤2Na +O 2 △ Na 2O 2 ※⑥2Na +2H 2O=2NaOH +H 2↑ ⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2 ⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH ⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3 ※⒂2NaHCO 3 △ Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2O ⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑ 补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2O Ca 2++OH -+HCO 3- =CaCO 3↓+H 2O ②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2O Ca 2++2OH -+2HCO 3-=CaCO 3↓+CO 32- +2H 2O ③钠与硫酸铜溶液的反应: 2Na + CuSO 4 + 2H 2O = Cu(OH)2↓+ Na 2SO 4 + H 2↑ ④氢氧化钠的制取: 电解食盐水法:2NaCl + 2H 2O 电解 2NaOH + H 2↑ + Cl 2↑ 石灰纯碱法:Na 2CO 3 + Ca(OH)2 = CaCO 3↓+ 2NaOH 2、铝及其化合物的转化关系 ①2Al +6HCl=2AlCl 3+3H 2 ②4Al +3O 2 △ 2Al 2O 3 2Al +6H +=2Al 3+ +3H 2↑ 或2Al + 3Fe 2O 3 高温 Al 2O 3 + 2Fe ※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O 2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3+ +3H 2O NaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂ ⒃ ⒄ ④ Al Al 2O 3 A l (O H )3 KAl(SO 4)2 NaAlO 2 AlCl 3 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿
必修一化学方程式 1、Fe(OH)3胶体的制备:FeCl3+3H2O △ Fe(OH)3(胶体)+3HCl 3、常温下钠与氧气反应:4Na + O2 = 2Na2O (白色) 4、钠在空气中燃烧:2Na + O2△ Na2O2(淡黄色) 5、钠与水反应:2Na + 2H2O = 2NaOH + H2↑ 6、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑ 7、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 === 2Na2CO3 + O2 8、铁在氧气中燃烧:3Fe+2O2点燃Fe3O4 9、铁与水蒸气反应:3Fe + 4H2O(g) 高温Fe3O4 + 4H2 10、Al与盐酸反应:2Al+6HCl===2AlCl3+3H2↑ 11、Al与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O===2NaAlO2 + 3H2↑2Al+2OH-+2H2O=2AlO2-+3H2↑ 12、Al2O3与盐酸反应:Al2O3 + 6HCl ===2AlCl3 + 3H2O Al2O3+6H+===2Al3++3H2O 13、Al2O3与氢氧化钠溶液反应:Al2O3 + 2NaOH === 2NaAlO2 + H2O Al2O3+2OH-===2AlO2-+H2O 14、Al(OH)3与盐酸反应:Al(OH)3 + 3HCl ===AlCl3 + 3H2O Al(OH)3+3H+=Al3++3H2O 15、Al(OH)3与氢氧化钠溶液反应: NaOH: Al(OH)3 + NaOH === NaAlO 2 + 2H2O Al(OH)3+OH-= AlO2-+2H2O 15、AlCl3 与NaOH:AlCl3+3NaOH = Al(OH)3+ 3NaCl Al(OH)3+ NaOH =NaAlO2+2H2O 16、实验室制取氢氧化铝(铝盐溶液加氨水): Al2(SO4)3 + 6NH3?H2O === 2Al(OH)3↓ + 3(NH4)2SO4 Al3++3NH3·H2O === Al(OH)3↓+3NH4+ 17、氢氧化铝加热分解:2Al(OH)3△ Al2O3 + 3H2O 18、氧化亚铁与盐酸反应:FeO+2HCl===FeCl2+H2O FeO+2H+===Fe2++H2O 19、氧化铁与盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O Fe2O3 +6H+===2 Fe3++3H2O 20、四氧化三铁与盐酸反应:Fe3O4 + 8HCl=== 2FeCl3 + FeCl2 + 4H2O Fe3O4+8H+=== 2 Fe3++Fe2++4H2O 22、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH === 3NaCl + Fe(OH)3↓(红褐色) 23、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH ===Na2SO4 + Fe(OH)2↓ 白色沉淀迅速变成灰绿色,最后变成红褐色氢氧化亚铁被氧化成氢氧化铁的原因: 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 24、氢氧化铁加热分解:2Fe(OH)3 △ 3H2O↑+ Fe2O3(红棕色粉末,俗称铁红) 25、FeCl3溶液与铁粉反应:2FeCl3 + Fe === 3FeCl22Fe3++Fe=3Fe2+ 26、氯化亚铁中通入氯气:2FeCl2 + Cl2=== 2FeCl3 2Fe2++Cl2=2Fe+2Clˉ
高中化学(人教版)必修一、必修二相关化学方程式汇总 必修一 1、硫酸根离子的检验:先加HCl酸化--- BaCl2 + Na2SO4==== BaSO4↓+ 2NaCl 2、碳酸根离子的检验: CaCl2 + Na2CO3 ===== CaCO3↓+ 2NaCl 碳酸钠与盐酸反应: Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑ 3、2Na + O 2Na2O2钠与氧气反应:4Na + O2 ==== 2Na2O 7、过氧化钠与水反应:2Na2O2 + 2H2O ==== 4NaOH + O2↑ 8、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 ==== 2Na2CO3 + O2 9、钠与水反应:2Na + 2H2O ==== 2NaOH + H2↑ 10、铁与水蒸气反应:3Fe + 4H2O(g) ==== F3O4 + 4H2↑ 11、Mg与HCl反应: Mg+2 HCl === MgCl2+ H2↑ 12、Al与HCl反应: 2Al+6HCl===2AlCl3+3H2↑铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O ==== 2NaAlO2 + 3H2↑ 13、氧化钙与水反应:CaO + H2O ==== Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O 15、氧化铝与盐酸反应:Al2O3 + 6HCl ===== 2AlCl3 + 3H2O 16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH ===== 2NaAlO2 + H2O 17、氯化铝与氢氧化钠溶液反应:AlCl3 + 3NaOH =====Al(OH)3↓+ 3NaCl 氢氧化铝与氢氧化钠溶液反应:Al(OH)3+ NaOH ==== NaAlO2 + 2H2O 18、偏铝酸钠与盐酸的反应:NaAlO2+HCl+H2O===== Al(OH)3↓+NaCl
高一化学必修一必考化学 方程式 Final approval draft on November 22, 2020
1、硫酸根离子的检验: 2、碳酸根离子的检验: 3、碳酸钠与盐酸反应: Na 2CO 3 + 2HCl = 2NaCl + H 2 O + CO 2 ↑及其离子方程式 4、木炭还原氧化铜: 2CuO + C 高温 2Cu + CO 2 ↑ 5、铁片与硫酸铜溶液反应: Fe + CuSO 4 = FeSO 4 + Cu及其离子方程式 6、氯化钙与碳酸钠溶液反应:CaCl 2 + Na 2 CO 3 = CaCO 3 ↓+ 2NaCl及其离子方程式 7、钠在空气中燃烧:2Na + O 2△ Na 2 O 2 钠与氧气反应:4Na + O 2 = 2Na 2 O 8、过氧化钠与水反应:2Na 2O 2 + 2H 2 O = 4NaOH + O 2 ↑ 9、过氧化钠与二氧化碳反应:2Na 2O 2 + 2CO 2 = 2Na 2 CO 3 + O 2 10、钠与水反应:2Na + 2H 2O = 2NaOH + H 2 ↑ 11、铁与水蒸气反应:3Fe + 4H 2O(g) = F 3 O 4 + 4H 2 ↑ 12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2 ↑ 13、氧化钙与水反应:CaO + H 2O = Ca(OH) 2 14、氧化铁与盐酸反应:Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2 O及其离子方程式 15、氧化铝与盐酸反应:Al 2O 3 + 6HCl = 2AlC l3 + 3H 2 O 16、氧化铝与氢氧化钠溶液反应:Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2 O 17、氯化铁与氢氧化钠溶液反应:FeCl 3 + 3NaOH = Fe(OH) 3 ↓+ 3NaCl 18、硫酸亚铁与氢氧化钠溶液反应:FeSO 4+ 2NaOH = Fe(OH)2↓+ Na 2 SO 4 19、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH) 2 + 2H 2 O + O 2 = 4Fe(OH )3 20、氢氧化铁加热分解:2Fe(OH) 3△ Fe 2 O 3 + 3H 2 O↑
高一化学必修一第三章化学方程式归纳 一、钠及其化合物 1.钠与氧气:常温: 点燃: 2.钠与水反应: 离子方程式: 3.钠与硫酸反应: 4.氧化钠与水反应: 5.过氧化钠与二氧化碳反应: 6.过氧化钠与水反应: 离子方程式: 7.NaOH溶液中通入少量CO2: 离子方程式: NaOH溶液中通入过量CO2: 离子方程式: 8.①向碳酸钠溶液中滴入少量稀盐酸: 向稀盐酸中滴入少量碳酸钠溶液: ②除去碳酸氢钠溶液中混有的碳酸钠: ③碳酸钠与氢氧化钙: ④碳酸氢钠与盐酸: ⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中: 少量氢氧化钙溶液滴入碳酸氢钠溶液中: ⑥除去碳酸钠溶液中的碳酸氢钠: ⑦除去碳酸钠固体中的碳酸氢钠:
⑧鉴别碳酸钠和碳酸氢钠溶液: 二、铝及其化合物 1.铝与氧气的反应: 2.铝与氧化铁反应(铝热反应): 3.铝和稀盐酸: 离子方程式: 4.铝和NaOH溶液: 离子方程式: 5.氧化铝和稀硫酸: 离子方程式: 6.氧化铝和NaOH溶液: 离子方程式: 7.氢氧化铝和盐酸: 离子方程式: 8.氢氧化铝和NaOH溶液: 离子方程式: 9.氢氧化铝受热分解: 10.硫酸铝与氨水反应: 离子方程式: 11.AlCl3溶液中加入少量NaOH溶液: AlCl3溶液中加入过量NaOH溶液:12.往偏铝酸钠溶液中通入少量CO2:
往偏铝酸钠溶液中通入足量CO2: 13.电解氧化铝: 三、铁及其化合物 1.铁与氧气反应: 铁与硫反应: 2.铁与盐酸反应: 离子方程式: 铁与CuSO4溶液: 离子方程式: 3.铁和水蒸气: 4.氧化亚铁与盐酸反应: 离子方程式: 5.氧化铁与盐酸反应: 离子方程式: 6.CO还原氧化铁: 7.氯化铁与氢氧化钠溶液: 离子方程式: 8.硫酸亚铁与氢氧化钠溶液: 离子方程式: 9.氢氧化铁加热分解: 10.氢氧化亚铁被氧化成氢氧化铁: 11.除去FeCl2中的FeCl3: 离子方程式: 12.FeCl2和Cl2反应: 离子方程式:
(人教版)高中化学必修一、二化学方程式汇总必修一 1、硫酸根离子的检验: BaCl2 + Na2SO4==== BaSO4↓+ 2NaCl 2、碳酸根离子的检验: CaCl2 + Na2CO3 ===== CaCO3↓ + 2NaCl 3、碳酸钠与盐酸反应: Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑ 4、木炭还原氧化铜: 2CuO + C 高温 2Cu + CO2↑ 5、铁片与硫酸铜溶液反应: Fe + CuSO4 ===== FeSO4 + Cu 6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 ===== CaCO3↓+ 2NaCl 7、钠在空气中燃烧:2Na + O2 Na2O2 钠与氧气反应:4Na + O2 ==== 2Na2O 8、过氧化钠与水反应:2Na2O2 + 2H2O ==== 4NaOH + O2↑ 9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 ==== 2Na2CO3 + O2 10、钠与水反应:2Na + 2H2O ==== 2NaOH + H2↑ 11、铁与水蒸气反应:3Fe + 4H2O(g) ==== Fe3O4 + 4H2↑ 12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O ==== 2NaAlO2 + 3H2↑ 13、氧化钙与水反应:CaO + H2O ==== Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O 15、氧化铝与盐酸反应:Al2O3 + 6HCl ===== 2AlCl3 + 3H2O
16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH ===== 2NaAlO2 + H2O 17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH ===== Fe(OH)3↓+ 3NaCl 18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH ==== Fe(OH)2↓+ Na2SO4 19、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 ==== 4Fe(OH)3 20、氢氧化铁加热分解:2Fe(OH)3 Fe2O3 + 3H2O↑ 21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O ==== 2Al(OH)3↓ + 3(NH3)2SO4 22、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl ==== AlCl3 + 3H2O 23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH ==== NaAlO2 + 2H2O 24、氢氧化铝加热分解:2Al(OH)3 Al2O3 + 3H2O 25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe ==== 3FeCl2 26、氯化亚铁中通入氯气:2FeCl2 + Cl2 ===== 2FeCl3 27、二氧化硅与氢氟酸反应:SiO2 + 4HF ==== SiF4 + 2H2O 硅单质与氢氟酸反应:Si + 4HF ==== SiF4 + 2H2↑ 28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温 CaSiO3 29、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH ==== Na2SiO3 + H2O 30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O === Na2CO3 + H2SiO3↓ 31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl === 2NaCl + H2SiO3↓ 32、氯气与金属铁反应:2Fe + 3Cl2点燃 2FeCl3
必修1 (1)4Na + O 2 ===== 2Na 2O (切口变暗) (2)2Na + O 2 Na 2O 2(黄色火焰) 白色 淡黄色 2Na + 2H 2O ===== 2NaOH + H 2↑ (2Na + 2H 2O =====2Na + + 2OH - + H 2↑) (4)钠投入CuSO 4 溶液 (浮 熔 游 响 红) CuSO 4 + 2NaOH ===== Cu(OH)2↓(蓝)+ Na 2SO 4 ( Cu 2++ 2OH - ==== Cu(OH)2↓ ) (6)2Al+2NaOH+2H 2O === 2NaAlO 2+3H 2↑ ( 2Al+2OH -+2H 2O=== 2AlO 2-+3H 2↑ ) (7) 3Fe+4H 2O(g)Fe 3O 4+4H 2 (8) 2Fe + 3Cl 2 2FeCl 3(棕色的烟) (9) Cu + Cl 2 CuCl 2(棕黄色的烟) (12) Na 2O + H 2O ===== 2NaOH (14)Na 2CO 3 + 2HCl(过量) ===== 2NaCl + H 2O + CO 2↑ (CO 32-+ 2H + ===== H 2O + CO 2↑) (15)Na 2CO 3 + HCl(少量) ===== NaHCO 3 +NaCl (CO 32-+ H + ===== HCO 3-) (16)NaHCO 3 + HCl ===== NaCl + H 2O + CO 2↑ (HCO 3-+ H + ===== H 2O + CO 2↑)(更快) (17)NaHCO 3 + NaOH ===== Na 2CO 3 + H 2O (HCO 3- + OH - ===== CO 32-+ H 2O) (18)2NaHCO 3 Na 2CO 3 + CO 2↑+ H 2O Na 2CO 3 + H 2O + CO 2 ===== 2NaHCO 3 (20)Al 2O 3 + 2NaOH ===== 2NaAlO 2 + H 2O (Al 2O 3 + 2OH -===== 2AlO 2- + H 2O) (22)Al(OH)3 + NaOH ===== NaAlO 2 + 2H 2O ( Al(OH)3 + OH - ===== AlO 2- + 2H 2O) (23)Al 2(SO 4)3+6NH 3·H 2O ===2Al(OH)3↓+3(NH 4)2SO 4 (Al 3++3NH 3·H 2O === Al(OH)3↓+3NH 4+)(制取Al(OH)3) (24)AlCl 3+3NaOH(少) === Al(OH)3↓+3NaCl (Al 3++3OH -(少) === Al(OH)3↓ ) (25)AlCl 3+4NaOH(过量) === NaAlO 2+3NaCl+2H 2O ( Al 3++4OH -(过量) === AlO 2- +2H 2O ) (26)NaAlO 2+HCl+H 2O= Al(OH)3↓+NaCl (AlO 2- + H + + H 2O = Al(OH)3↓ ) (27) NaAlO 2+4HCl = AlCl 3 +NaCl +2H 2O (AlO 2- + 4H + = Al 3++ 2H 2O) (28)Fe 2+ + 2OH - === Fe(OH)2↓ (29) Fe 3++ 3OH - === Fe(OH)3↓ (30)2Fe(OH)3Fe 2O 3 + 3H 2O (31)4Fe(OH)2+O 2+2H 2O === 4Fe(OH)3(白色沉淀迅速变成灰绿色最后变成红褐色 ) (32)2FeCl 2+Cl 2 === 2 FeCl 3 ( 2Fe 2++Cl 2 ===2 Fe 3+ +2Cl -) FeCl 2溶液中加氯水,氯水主要成分Cl 2,所以是Cl 2的反应 (33)2FeCl 3+Fe === 3 FeCl 2 (2Fe 3++Fe === 3 Fe 2+) (33) 2FeCl 3+3Mg === 3 MgCl 2 + 2Fe (34)2FeCl 3+Cu === 2FeCl 2+CuCl 2 (2Fe 3++Cu === 2Fe 2++Cu 2+) (35) Fe 3++3SCN - === Fe(SCN)3(血红色) (鉴别Fe 3+) (36) Cl 2 + H 2 2HCl (苍白色火焰) 2H 2O 2 ===== 2H 2O + O 2↑ (实验室制取氧气) (38)2HClO===== 2HCl + O 2↑ 红褐色 白色 MnO 2 光照 (Na 2CO 3与NaHCO 3 相互转化)
高一化学必修一化学方程式和离子方程式总结 1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl 2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl 3、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑ 5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu 6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl 7、钠在空气中燃烧:2Na + O2 △ Na2O2 钠与氧气反应:4Na + O2 = 2Na2O 8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑ 9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2 10、钠与水反应:2Na + 2H2O = 2NaOH + H2↑ 11、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑ 12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ 13、氧化钙与水反应:CaO + H2O = Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O 15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O 16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O 17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl 18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 19、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 20、氢氧化铁加热分解:2Fe(OH)3 △ Fe2O3 + 3H2O↑ 21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3?H2O = 2Al(OH)3↓+ 3(NH3)2SO4 22、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O 23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O 24、氢氧化铝加热分解:2Al(OH)3 △ Al2O3 + 3H2O 25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2 26、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3 27、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O 硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑ 28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO3 29、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O 30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓ 31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓ 32、氯气与金属铁反应:2Fe + 3Cl2 点燃2FeCl3 33、氯气与金属铜反应:Cu + Cl2 点燃CuCl2 34、氯气与金属钠反应:2Na + Cl2 点燃2NaCl 35、氯气与水反应:Cl2 + H2O = HCl + HClO 36、次氯酸光照分解:2HClO 光照2HCl + O2↑ 37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O 38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
人教版化学必修一化学方程式大全新编 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】
必修一化学方程式 一.过量 1. 澄清石灰水中通入少量二氧化碳:Ca(OH)2 + CO 2══ CaCO 3 + H 2O 2. 澄清石灰水中通入过量二氧化碳Ca(OH)2+ 2CO 2══ Ca(HCO 3)2 3. 氢氧化钠溶液中通入少量二氧化碳:2NaOH + CO 2 ==== Na 2CO 3+ H 2O 4. 氢氧化钠溶液中通入过量二氧化碳;CO 2+NaOH ==== NaHCO 3 5. 碳酸钠溶液中加入少量盐酸:Na 2CO 3+HCl ==== NaHCO 3+NaCl 6. 碳酸钠溶液中加入足量盐酸:NaHCO 3+HCl ==== NaCl+H 2O+CO 2↑ 7. 硫酸氢纳溶液中加入少量氢氧化钡:2NaHSO 4+Ba(OH)2====BaSO 4↓+ NaSO 4+2H 2O 8. 硫酸氢纳溶液中加入过量的氢氧化钡:NaHSO 4+Ba(OH)2====BaSO 4↓+NaOH+H 2O 9. 碳酸氢钙溶液中加入少量氢氧化钠溶:Ca(HCO 3)2+NaOH===NaHCO 3+CaCO 3↓+H 2O 10. 碳酸氢钙溶液中加入足量氢氧化钠溶:2NaOH+Ca(HCO 3)2=CaCO 3↓+2H 2O+Na 2CO 3 11. 澄清石灰水中加入少量的碳酸氢钠溶液:NaHCO 3+Ca(OH)2===NaOH+H 2O+CaCO 3↓ 12. 澄清石灰水中加入少量的碳酸氢钠液:2NaHCO 3+Ca(OH)2=Na 2CO 3+2H 2O+CaCO 3↓ 二、钠及其化合物 1. 钠在空气中燃烧:4Na+O 2=2Na 2O 2. 钠在氧气中加热:2Na+O 2 点燃 Na 2O 2 Cl 2 +2Na 点燃 2NaCl 3. 钠与水反应:2Na+2H 2O =2NaOH+H 2↑ 2Na + 2H 2O == 2Na + + 2OH -+ H 2↑ 4. 钠与硫酸铜溶液反应:2Na+2H 2O+CuSO 4=Cu(OH)2↓+Na 2SO 4 + H 2↑ 5. 钠和氯化铁溶液反应:6Na+6H 2O+2FeCl 3=2Fe(OH)3↓+6Na Cl + 3H 2↑ 6. 氧化钠的主要化学性质:2Na 2O+O 2 △ 2Na 2O 2 Na 2O+H 2O =2NaOH Na 2O+SO 3=Na 2SO 4 Na 2O+CO 2=Na 2CO 3 Na 2O+2HCl =2NaCl+H 2O 7. 过氧化钠与水反应: 2Na 2O 2+2H 2O =4NaOH+O 2↑ 8. 过氧化钠与二氧化碳反应: 2Na 2O 2+2CO 2=2Na 2CO 3+O 2 9. 过氧化钠和硫酸反应: Na 2O 2+H 2SO 4(冷、稀)=Na 2SO 4+H 2O 2 10. 过氧化钠和二氧化硫反应Na 2O 2+SO 2=Na 2SO 4 11. 土法制烧碱:Ca(OH)2+Na 2CO 2=CaCO 3↓ +2NaOH 12. 二氧化碳通入饱和碳酸钠溶液:Na 2CO 3+H 2O +CO 2 =2NaHCO 3↓ 13. 碳酸氢钠受热分解: 2NaHCO 3===Na 2CO 3+H 2O +CO 2↑