
第十九章配位化合物
1.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3亦不产生沉淀,以强碱处理并没有放出NH3,写出它的配位化学式。
答:[Pt(NH3)2Cl4]
2.下列化合物中哪些是配合物?哪些是螯和物?哪些是复盐?哪些是单盐?
(1)CuSO4·5H2O (2)K2PtCl6
(3)Co(NH3)6Cl3 (4)Ni(en)2Cl2
(5)(NH4)2SO4·FeSO46H2O (6)Cu(NH2CH2COO)2
(7)Cu(OOCH3)2 (8)KCl·MgCl2·6H2O
答:配合物:K2PtCl6;Co(NH3)6Cl3;CuSO4·5H2O
螯合物:Ni(en)2Cl2;Cu(NH2CH2COO)2
复盐:(NH4)2SO4·FeSO4·6H2O;KCl·MgCl2·6H2O
简单盐:Cu(OOCH3)2
3.命名下列各配合物和配离子:
(1)(NH4)3[SbCl6] (2)Li[AlH4]
(3)[Co(en)3]Cl3 (4)[Co(H2O)4Cl2]Cl
(5)[Cr(H2O)4Br2]Br·2H2O (6)[Cr(H2O)(en)(C2O4)(OH)]
(7)[Co(NO2)6]3- (8)[Co(NH3)4(NO2)Cl]+
(9)[Cr(Py)2(H2O)Cl3] (10)[Ni(NH3)(C2O4)]
答:(1)六氯合锑(III)酸铵
(2)四氢合铝(III)酸锂
(3)三氯化三(乙二胺)合钴(III)
(4)一氯化二氯?四水合钴(III)
(5)二水合溴化二溴?四水合钴(III)
(6)一羟基?一水?草酸根?乙二胺合铬(III)
(7)六硝基合钴(III)配阴离子
(8)一氯?一硝基?四氨合钴(III)配阳离子
(9)三氯?一水?二吡啶合铬(III)
(10)二氨?草酸根合镍(II)
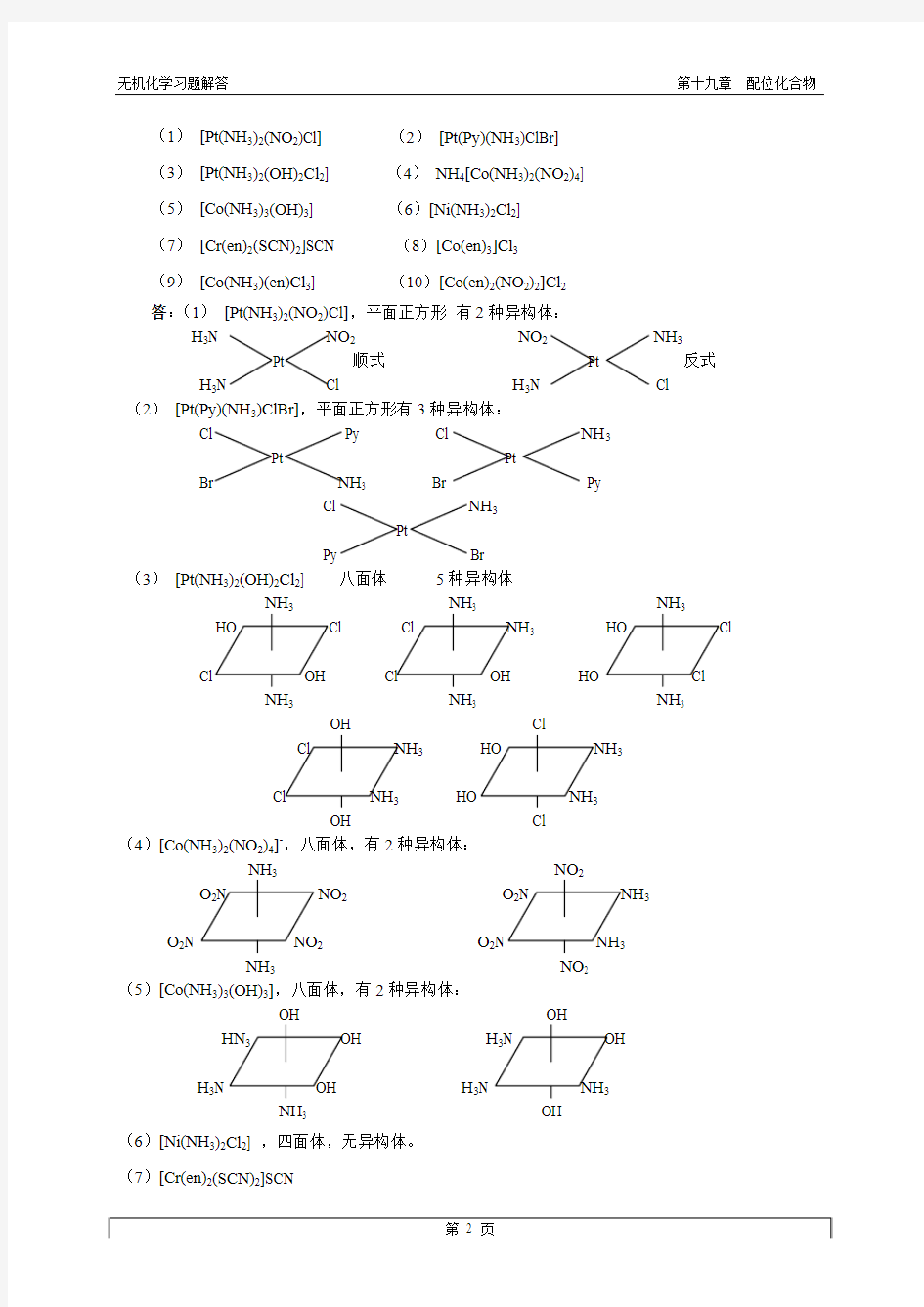
4.指出下列配合物的空间构型并画出它们可能存在的立体异构体:
(1)[Pt(NH3)2(NO2)Cl] (2)[Pt(Py)(NH3)ClBr]
(3)[Pt(NH3)2(OH)2Cl2] (4)NH4[Co(NH3)2(NO2)4]
(5)[Co(NH3)3(OH)3] (6)[Ni(NH3)2Cl2]
(7)[Cr(en)2(SCN)2]SCN (8)[Co(en)3]Cl3
(9)[Co(NH3)(en)Cl3] (10)[Co(en)2(NO2)2]Cl2
答:(1)[Pt(NH3)2(NO2)Cl],平面正方形有2种异构体:
H3N NO2NO2NH3
Pt 顺式Pt 反式H3N Cl H3N Cl (2)[Pt(Py)(NH3)ClBr],平面正方形有3种异构体:
Cl Py Cl NH3
Pt Pt
Br NH3 Br Py
Cl NH3
Pt
Py Br
(3)[Pt(NH3)2(OH)2Cl2] 八面体5种异构体
3
NH3NH3 NH3
33
OH Cl
(4)[Co(NH3)2(NO2)4]-,八面体,有2种异构体:
NO23
O22O2
NH3NO2
(5)[Co(NH3)3(OH)3],八面体,有2种异构体:
H3H3
3
(6)[Ni(NH3)2Cl2] ,四面体,无异构体。
(7)[Cr(en)2(SCN)2]SCN
[Cr(en)2(SCN)2]-,八面体有2种异构体:
(8)[Co(en)3]Cl3
[Co(en)3]3+,八面体,有1种构型
(9)[Co(NH3)(en)Cl3],八面体,有2种异构体:
(10)[Co(en)2(NO2)2]Cl2,八面体,有2种异构体
5.某金属离子在八面体弱场中的磁距为4.90B.M。而它在八面体强场中的磁距为零,该中心金属离子可能是哪个?
答:该中心金属离子可能是Fe2+
n(n = 4.90 n = 4
)2
即在八面体场中有四个成单电子,八面体强场中磁矩为零,即无成单电子,故Fe2+符合题意. 6.根据实验测得的有效磁距,判断下列各种配离子中哪几种是高自旋的?哪几种是低自旋的?哪几种是内轨型?哪几种是外轨型?
(1)Fe(en)22+ 5.5 B.M.
(2)Mn(SCN)64- 6.1 B.M.
(3)Mn(CN)64- 1.8 B.M.
(4)Co(NO2)64- 1.8 B.M.
(5)Co(SCN)42- 4.3 B.M.
(6)Pt(SN)42-0 B.M.
(7)K3[FeF6] 5.9 B.M.
(8)K3[Fe(CN)6] 2.4 B.M.
答:高自旋的有:(1),(2),(5),(7)
低自旋的有:(3),(4),(6),(8)
内轨型的有:(3),(4),(6),(8)
外轨型的有:(1),(2),(5),(7)
7.已知[Pd(Cl)2(OH)2]有两种不同的结构,成键电子所占据的杂化轨道应该是哪种杂化轨道?
答:dsp2。
8.应用软硬酸碱理论解释,在稀AgNO 3溶液中依次加入NaCl ,NH 3,KBr ,Na 2S 2O 3,KI ,KCN ,Ag 2S 产生沉淀、溶解交替的原因?
答:由软硬酸碱规则:“硬亲硬,软亲软,软硬交界就不管”。
9.预测下列各组成所形成的二组配离子之间的稳定性的大小,并简单说明原因:
(1)Al 3+ 与F - 或Cl -配合;
(2)Pd 2+与RSH 或ROH 配合;
(3)Cu 2+ 与NH 3 配合;
(4)Cu 2+与NH 2CH 2COOH 或CH 3COOH 配合。
答:(1)Al 3+与F -的配合物更加稳定,Al 3+为硬酸;而碱F -的硬度比Cl -大
(2)Pd 2+与RSH 配合后更加稳定,Pd 2+为软酸,而RSH 为软碱,ROH 为硬碱。
(3)Cu 2+与NH 3结合更加稳定。
(4)Cu 2+与NH 2CH 2COOH 结合更加稳定,因为前者的配体中有N ,后者仅有O ,N 的配位能力比O 强。
10.在0.1K[Ag(CN)2]溶液中,加入KCl 固体使Cl -的浓度为0.10 mol·dm -3,有何现象发生?
(K θsp ,AgCl = 1.8×10-10,K 稳,Ag (CN )2- = 1.25×1021)
解:设[Ag +]为x mol?dm -3
Ag + + 2CN - =Ag(CN)2-
x 2x 0.1-x
2121025.1)
2(1.0?=-x x x 得:x = 2.7×10-8(mol?dm -3)
Q i = [Ag +][Cl -] = 2.7×10-8×0.10 = 2.7×10-9 Q i > Ksp H (AgCl ),有AgCl 沉淀析出
11.在1dm -3 6 mol·dm -3的NH 3水中加入0.01mol 固体CuSO 4,溶解后,在此溶液中再加0.01mol 固体的NaOH ,铜氨配合物能否被破坏?(K 稳Cu (NH3)4 = 2.09×1013;K sp,Cu(OH)2 = 2.2×10-20) 解: 设生成 Cu(NH 3)42+ 后Cu 2+的浓度为xmol?L -1
++?+24332)NH (Cu NH 4Cu
x 6-4(0.01-x) 0.01-x
4)]
01.0(46[01.0x x x --- = 2.09 × 1013 得: x = 3.79 × 10-19 (mol?dm -3)
Q i = [Cu 2+] [OH -]2 = 3.79 × 10-19×0.012 = 3.79 × 10-23
Q i <Ksp H , 故铜氨配合物不能被破坏
12.当MH 4SCN 及少量Fe 3+同存于溶液中达到平衡时,加入NH 4F 使[F -]=[SCN -]=1 mol·dm -3,问此时溶液中[FeF 6]3-与[Fe(SCN)3]的浓度比为多少?(K 稳Fe(SCN)3=2.0×103,K 稳,[ FeF6] 3-=1×1016) 解: K 稳Fe(SCN)3 = 3
33]SCN ][Fe [])SCN (Fe [-+
633636]F ][Fe []FeF []FeF [K -+--
=稳 又 [SCN -] = [F-] = 1 mol?dm -3
333636SCN Fe K ]SCN Fe []FeF [K ]FeF [)()(稳稳=∴-- [FeF 6]3-/[Fe(SCN)] = 1×1016/2.0×
103 = 5×1012
另: Fe 3+ +6F -[FeF 6]-3
Fe 3+ + 3SCN -[Fe(SCN)3]
a 1 x a 1 y
K 稳 [FeF6]3- = a
x 61= 1×1016 K 稳Fe (SCN )3 = a y 31=2.0×103 y
x = 5×1012 所以溶液中[FeF 6]-3与[Fe(SCN)3]的浓度比为 5×1012
13.欲使1×10-5mol 的AgI 溶于1cm -3氨水,试从理论上推算,氨水的最低浓度为多少?
(K f,Ag(NH3)2+=1.12×107;K θsp,AgI =9.3×10-17)
解:Ksp H AgI = [Ag +][I -]
22332323223353253
313[][][][()]/[]()[][]110[()]110[]310()f f Ag NH K Ag NH Ag NH Ag NH Ksp AgI I K Ag NH NH I mol cm Ag NH mol cm NH mol L θ++
++-
+---+---===??=??==? ()()得:
14.已知Au + + e - = Au 的?θ=1.691V ,求Au(CN)2- + e + = Au + + 2CN -的?θ的值是多少? (K
稳, Au(CN)2-=2×
1038)
解:
]Au lg[059.0Au /Au E ]Au /CN Au [E ]
Au [1]CN ][Au []CN Au []CN Au [K dm mol 0.1]CN []CN Au [CN 2Au e )CN (Au 22223
22++θ-θ+-+--θ----
--+===?==+?+)()()()()(标准状态时:稳
=1.691 + 0.059lg1/K 稳H =1.691+0.059lg1/2×1038 =-0.57V
15.一个铜电极浸在一种含有1.00 mol·dm -3氨和1.00 mol·dm -3 Cu(NH 3)42+配离子的溶液里,若用标准氢电极为正极,经实验测得它和铜电极之间的电势差为0.0300V 。试计算 Cu(NH 3)42+配离子的稳定常数(已知?θCu 2+/Cu =0.34V )
解:E H = ?H (H +/H 2)- ?H [Cu(NH 3)42+/Cu] = 0.0300V
即 ?H [Cu(NH 3)42+/Cu] = -0.0300V
由 ?H [Cu(NH 3)42+/Cu] = ?H (Cu 2+/Cu) + 2
059.0lg[Cu 2+] 12
2432224
3321049.3K K lg 2059.034.00300.0K 1lg 2059.034.0]Cu /NH Cu [K /1]Cu []
Cu [1K NH Cu NH 4Cu ?=-
=-+=?==?+θθ+θθ++θ++稳稳稳
稳稳得:)(即得:)( 16.为什么在水溶液中,Co 3+离子能氧化水,[Co(NH 3)6]3+却不能氧化水?
K 稳, [Co(NH3)6]2+ = 1.38×105;K 稳, [Co(NH3)6]3+ = 1.58×1035; K b,NH3 = 1.8×10-5
?θCo 3+/ Co 2+ = 1.808V ; ?θOH2O = 1.229V ; ?θO2/OH- = 0.401V
解:在水溶液中,++θ?23Co /Co >O H /O 22θ?
故Co 3+能氧化水 Co 3++2H 2O=4Co 2+O 2↑+4H +
332323636
2236322365
35[][()/()](/)0.059lg [][()]
(/)0.059lg [()]1.38101.810.059lg 0.041.5810
f f Co Co NH Co NH Co Co Co K Co NH Co Co K Co NH V θθθθθφφφ++++++++++=+==?=+=?
设33[] 1.0
NH mol dm -=?,33[] 4.2410OH mol dm ---==??
22222434444()/0.0590.0591(/)(/)lg 0.401lg 0.544[]4(4.2410)O H O e OH p O p O OH O OH V OH θθφφ--
--
--++==+=+=? ])NH (Co /)NH (Co [2633
63++θ?<)
OH /O (2-? 故 Co(NH 3)63+不能氧化水
17.在1.0 mol·dm -3的HCl 溶液中加入0.010 mol·dm -3的Fe(NO 3)3后,溶液中有关配离子中哪种配离子浓度最大?(已知该体系逐级稳定常数为:k 1=4.2, k 2=1.3, k 3=0.040, k 4=0.012)
解:因各级稳定常数都比较小,Cl -过量很多故可以认为:
[Cl -] = 1.0 mol?L -1
[Cl -] + [FeCl 2+] + 2[FeCl 2+] + 3[FeCl 3] + 4[FeCl 4-] =1.0 mol?L -1
[Fe 3+] + [FeCl 2+] + [FeCl 2+] + [FeCl 3] + [FeCl 4-]=0.010 mol?L -1
2.4]
Cl ][Fe []FeCl [k 321==-++ [FeCl 2+] = 4.2[Fe 3+] 3.1]
Cl ][FeCl []FeCl [k 222==-++ [FeCl 2+] = 1.3×4.2[Fe 3+] =5.5[Fe 3+]
040.0]
Cl ][FeCl []FeCl [k 233==-+ [FeCl 3] = 0.040[FeCl 2+] = 0.04×1.3×4.2[Fe 3+]
=0.22[Fe 3+]
012.0]
Cl ][FeCl []FeCl [k 344==-- [FeCl 4-]=0.012[FeCl 3]=0.012×0.04×1.3×4.2[Fe 3+]
=0.0026[Fe 3+]
则:[Fe 3+] + 4.2[Fe 3+] + 5.5[Fe 3+] +0.22[Fe 3+] + 0.0026[Fe 3+]=0.010mol?L -1
可得:[Fe 3+]=9.2×10-4 mol?L -1
由此可以得到:FeCl 2+的浓度最大0.005 mol?L -1。
第9章配位化合物习题 1.选择题 9-1下列不能做为配位体的物质是…………………………………………( ) (A) C6H5NH2(B)CH3NH2 (C)NH4+(D)NH3 9-2关于螯合物的叙述,不正确的是……………………………………………( ) (A)螯合物的配位体是多齿配体,与中心原子形成环状结构 (B)螯合物中环愈多愈稳定 (C)螯合剂中有空间位阻时,螯合物稳定性减小 (D)螯合剂中配位原子相隔越远形成的环越大,螯合物稳定性越强 9-3 在配位化合物的内界,若有多种无机配体和有机配体,其命名顺序为……( ) (A)阴离子—阳离子—中性分子—有机配体 (B)阳离子—中性分子—阴离子—有机配体 (C)中性分子—阳离子—阴离子—有机配体 (D)阴离子—中性分子—阳离子—有机配体 9-4 在下列正方形和八面体的几何构型中,CO32-作为螯合剂的是……………( ) (A)[Co(NH3)5CO3]+(B)[Pt(en)CO3] (C)[Pt(en)(NH3)CO3] (D)[Pt(NH3)4(NO2)Cl]CO3 9-5 配位酸或配位碱比相应的普通酸或普通碱的酸性或碱性强,其原因是…( ) (A)配位酸, 碱较稳定(B)配位酸, 碱较不稳定 (C)H+或OH-为配位酸或碱的外界,易解离(D)配位后极性增强 9-6在[AlCl4]-中,Al3+的杂化轨道是……………………………………………( ) (A)sp杂化(B)sp2杂化(C)sp3杂化(D)dsp2杂化 9-7M为中心原子,a, b, d 为单齿配体。下列各配合物中有顺反异构体的是()(A)Ma2bd(平面四方)(B)Ma3b (C)Ma2bd(四面体)(D)Ma2b(平面三角形) 9-8 当1mol CoCl3?4NH3与AgNO3(aq)反应,沉淀出1mol AgCl。请问与钴成键的氯原子数为…………………………………………………………………………………()(A)0 (B)1 (C) 2 (D) 3 9-9在[Ru(NH3)4Br2]+中,Ru的氧化数和配位数分别是…………………()(A)+2和4 (B)+2和6 (C)+3和6 (D)+3和4 9-10 下列配合物的稳定性,从大到小的顺序,正确的是……………………()(A)[HgI4]2- > [HgCl4]2- > [Hg(CN)4]2-
第9章配位化合物 一判断题 1 价键理论认为,配合物具有不同的空间构型是由于中心离子(或原子)采用不同杂化轨道与配体成键的结果。() 2 价键理论能够较好地说明配合物的配位数、空间构型、磁性和稳定性,也能解释配合物的颜色。() 3 价键理论认为,在配合物形成时由配体提供孤对电子进入中心离子(或原子)的空的价电子轨道而形成配位键。() 4 同一元素带有不同电荷的离子作为中心离子,与相同配体形成配合物时,中心离子的电荷越多,其配位数一般也越大。() 5 在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。() 6 所有八面体构型的配合物比平面四方形的稳定性强。() 7 所有金属离子的氨配合物在水中都能稳定存在。() 8 价键理论认为,所有中心离子(或原子)都既能形成内轨型配合物,又能形成外轨型配合物。() 9 所有内轨型配合物都呈反磁性,所有外轨型配合物都呈顺磁性。() 10 内轨型配合物往往比外轨型配合物稳定,螯合物比简单配合物稳定,则螯合物必定是内轨型配合物。() 11 内轨型配合物的稳定常数一定大于外轨型配合物的稳定常数。() 12 不论配合物的中心离子采取d2sp3或是sp3d2杂化轨道成键,其空间构型均为八面体形。 13 [Fe(CN)6]3-和[FeF6]3-的空间构型都为八面体形,但中心离子的轨道杂化方式不同。() 14 [Fe(CN)6]3-是内轨型配合物,呈反磁性,磁矩为0。() 15 K3[FeF6]和K3[Fe(CN)6]都呈顺磁性。() 16 Fe2+的六配位配合物都是反磁性的。() 17 在配离子[AlCl4]-和[Al(OH)4]-中,Al3+的杂化轨道不同,这两种配离子的空间构型也不同。() 18 已知E(Cu2+/Cu) = 0.337V,E([Cu(NH3)4]2+/Cu) = -0.048V,则E([Cu(CN)4]2-/Cu) < -0.048V。() 19 已知E(Ag+/Ag) = 0.771V,E([Ag(NH3)2]+/Ag) = 0.373V,则E([Ag(CN)2]-/Ag) > 0.373V。() 20 按照价键理论可推知,中心离子的电荷数低时,只能形成外轨型配合物,中心离子电荷数高时,才能形成内轨型配合物。() 21 以CN-为配体的配合物,往往较稳定。() 22 Ni2+的平面四方形构型的配合物,必定是反磁性的。() 23 Ni2+的四面体构型的配合物,必定是顺磁性的。() 24 磁矩大的配合物,其稳定性强。() 25 所有Ni2+的八面体配合物都属于外轨型配合物。() 26 所有Fe3+的八面体配合物都属于外轨型配合物。() 27 已知K2[Ni(CN)4]与Ni(CO)4均呈反磁性,所以这两种配合物的空间构型均为平面正方形。() 28 按照晶体场理论,对给定的任一中心离子而言,强场配体造成d轨道的分裂能大。()。 29 按照晶体场理论可知,强场配体易形成高自旋配合物。()。 30 晶体场理论认为配合物的中心离子与配体之间的作用力是静电引力。() 31 具有d0、d10结构的配离子都没颜色,因为不能产生d-d跃迁。()
第十二章配位化合物 12.1 配合物的基本概念 12.1.1配合物的定义 历史上有记载的最早发现的第一个配合物就是我们很熟悉的亚铁氰化铁 Fe4[Fe(CN)6]3(普鲁士蓝)。它是在1704年普鲁士人狄斯巴赫在染料作坊中为寻找蓝色染料,而将兽皮、兽血同碳酸纳在铁锅中强烈地煮沸而得到的。后经研究确定其化学式为 Fe4[Fe(CN)6]3。近代的配合物化学所以能迅速地发展也正是生产实际需要的推动结果。如原子能、半导体、火箭等尖端工业生产中金属的分离技术、新材料的制取和分析;50年代开展的配位催化,以及60年代蓬勃发展的生物无机化学等都对配位化学的发展起了促进作用。目前配合物化学已成为无机化学中很活跃的一个领域。今后配合物发展的特点是更加定向综合,它将广泛地渗透到有机化学、生物化学、分析化学以及物理化学、量子化学等领域中去。如生物固氮的研究就是突出的一例。 配合物的形成: 在CuSO4溶液中加入氨水,首先得到难溶物,继续加氨水,难溶物溶解,得到透明的深蓝色的溶液。蓝色物质为复杂离子[Cu(NH3)4]2+ ,蒸发该溶液析出深蓝色晶体,其化学组成为[Cu(NH3)4]SO4·H2O。在纯的[Cu(NH3)4]SO4溶液中,除了水合硫酸根离子和深蓝色的[Cu(NH3)4]2+离子外,几乎检查不出Cu2+离子和NH3分子的存在。[Cu(NH3)4]2+这种复杂离子不仅存在于溶液中,也存在于晶体中。从上面实例可以看出,这些复杂离子至少不符合经典原子价理论,在晶体和溶液中有能以稳定的难离解的复杂离子存在的特点。 由于这类化合物的组成比较复杂,要给它下一个严密的定义是很困难的。从实质上看,配合物中存在着与简单化合物不同的键--配位键,这才是配合物的本质特点。因此把配合物的定义可归纳为: 中国化学会在1980年制订的《无机化学命名原则》中对配合物作了如下的定义:配位化合物(简称配合物)是由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(称为配体)和具有接受孤对电子或多个不定域电子的空位的原子或离子(统称中心原子)按一定的组成和空间构型所形成的化合物。 1.配位键:是一种特殊的共价键。当共价键中共用的电子对是由其中一原子独自供应时,就称配位键。配位键形成后,就与一般共价键无异。
第十二章 定量分析中的分离方法 (1~2学时) 在络合滴定一章中讨论过用掩蔽方法消除干扰问题。在实际工作中,单用掩蔽的方法有时难以消除干扰离子的影响,此时,需要选用适当的分离方法使待测组分与干扰组分分离;对于微量或痕量组分的测定,常需要富集后才能测定。对于常量组分的分离和痕量组分的富集,总的要求是分离、富集要完全,即待测组分回收率要符合一定的要求。对于含量大于1%的常量组分,回收率应接近100%;对于痕量组分,回收率可在90~110%之间,在有的情况下,例如待测组分的含量太低时,回收率在80~120%之间亦属符合要求。 §12-1 沉淀分离法 沉淀分离法是利用反应使待测组分与干扰离子分离的方法。常用的沉淀分离方法有: 1 氢氧化物沉淀分离法 使离子形成氢氧化物沉淀[如Fe(OH)3等]或含水氧化物(如SiO 2·H 2O 等)。常用的沉淀剂有NaOH 、氨水、ZnO 等。 ⑴ NaOH 溶液:通常用它可控制pH 值≥12,常用于两性金属离子和非两性金属离子的分离。 ⑵ 氨和氯化铵缓冲溶液:它可将pH 值控制在9左右,常用来沉淀不与NH 3形成络离子的许多种金属离子,亦可使许多两性金属离子沉淀成氢氧化物沉淀。 ⑶ 利用难溶化合物的悬浮液来控制pH 值:例如ZnO 悬浮液就是较常用的一种,ZnO 在水中 具有下列平衡:ZnO + H 2O Zn(OH)2 Zn 2+ + 2 OH - [Zn 2+][OH -]2 = Ksp [OH -]= ][2+Zn K sp 当加ZnO 悬浮液于酸性溶液中,ZnO 溶解而使[OH -]达一定值时,溶液pH 值就为一定的数 值。例如[Zn 2+]=0.l mol ·L -1时,[OH -]= 1 .0102.117-?=1.1×10-6 而当[Zn 2+]改变时,pH 值的改变极其缓慢。一般讲,利用ZnO 悬浮液,可把溶液的pH 值控制在5.5~6.5。其他如CaCO 3、MgO 等的悬浮液都可用以控制一定的pH 值。 氢氧化物沉淀分离法的选择性较差。形成的沉淀多为是非晶形沉淀,共沉淀现象较为严重。为了改善沉淀性能,减少共沉淀现象,沉淀作用应在较浓的热溶液中进行,使生成的氢氧化物沉淀含水分较少,结构较紧密,体积较小,吸附杂质的机会减小。沉淀完毕后加入适量热水稀释,使吸附的杂质离开沉淀表面转入溶液,从而获得较纯的沉淀。如果让沉淀作用在尽量浓的溶液中进行,并
《配位化合物》作业参考解析 1. 下列说法正确的是 A. 配合物的内界和外界之间主要以共价键相结合 B. 中心原子与配体之间形成配位键 C. 配合物的中心原子都是阳离子 D. 螯合物中不含有离子键 【B】A、D:一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C:中心原子可以是阳离子,也可以是中性原子,例如[Ni(CO)4];B:中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。 2. 下列配合物命名不正确的是 A. [Co(H2O)(NH3)3Cl2]Cl 氯化二氯·三氨·一水合钴(Ⅲ) B. [Cr(NH3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ) C. K[Co(NO2)3Cl3] 三硝基·三氯合钴(Ⅲ)酸钾 D. H2[PtCl6] 六氯合铂(Ⅳ)酸 【C】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。对于C中的配合物而言,NO2-以N原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的先后顺序,Cl-离子在前,NO2-离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。 3. 下列配离子具有正方形或者八面体形结构,其中CO32-最有可能作为双齿配体的是 A. [Co(NH3)4(CO3)]+ B. [Co(NH3)5(CO3)]+ C. [Pt(en)(NH3)(CO3)] D. [Pt(en)2(NH3)(CO3)]2+ 【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体结构时,配位数为6,形成6个配位键。B:[Co(NH3)5(CO3)]+ 配离子中,已有5个氨作为配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO32-离子只能是单齿配体,这样就形成了6个配位键;C:[Pt(en)(NH3)(CO3)] 配合物中,乙二胺(en)为双齿配体,形成2个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了4个配位键;D:[Pt(en)2(NH3)(CO3)]2+ 配离子中,乙二胺(en)为双齿配体,2个en形成4个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了6个配位键;A:[Co(NH3)4(CO3)]+ 配离子中有4个氨为配体,形成4个配位键,因此CO32-离子必须是双齿配体,这样就形成了4个配位键,如果CO32-离子是单齿配体,那么配离子的配位数为5,这与题意不符。 4. 下列分子或者离子的中心原子发生了dsp2杂化的是 A. BF3 B. [Zn(NH3)4]2+ (μ = 0 ) C. [Ni(CN)4]2-(μ = 0 ) D. 【C】A:BF3分子为正三角形,中心原子B发生sp2杂化;[Zn(NH3)4]2+ (μ = 0 )的配位数为4,中心原子提供4个杂化空轨道,由于Zn2+离子的价层电子排布为3d10,d轨道已经全部排满电子,因此只会发生sp3杂化,形成四个杂化轨道;D:NH4+离子是正面体结构,因此中心原子N原子发生了sp3杂化;C:[Ni(CN)4]2-(μ = 0 )的配位数为4,中心原子提供4个杂
1、配位化合物 (1)概念:金属离子或原子与某些分子或离子以配位键结合而形成的化合物称为配位化合物,简称配合物。 作为电子对接受体的金属离子或原子称为中心离子(原子),又称配合物的形成体,作为电子对给予体的分子或离子称为配体。 [Cu(H2O)4]2+的空间结构为平面正方形。 (2)配合物的结构 [Cu(NH3)4]SO4为例说明。 注意:离子型配合物是由内界和外界组成,内界由中心离子和配体组成。 (3)配合物的命名: 例如:[Cu(NH3)4]SO4硫酸四氨合铜 练习:对下列配合物进行命名 [Cu(NH3)4]Cl2K3[Fe(SCN)6] Na3[AlF6] 3、几种常见的配合物 实验:硫酸四氨合铜的制备。 现象:向CuSO4溶液中加入氨水,生成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液。再加入乙醇,析出深蓝色的晶体。 有关反应的离子方程式为:Cu2++2NH3·H2O=Cu(OH)2↓+2OH- Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- 蓝色沉淀深蓝色溶液 在[Cu(NH3)4]2+里,中心离子是Cu2+,配体是NH3,NH3分子的氮原子给出孤电子对,以配位键形成了[Cu(NH3)4]2+: [Cu(NH3)4]2+的空间结构为平面正方形。 实验:硫氰化铁的制备。向氯化铁溶液中滴加硫氰化钾溶液。 现象:形成血红色溶液。有关反应的化学方程式为:FeCl3+3KSCN=Fe(SCN)3+3KCl
Fe(SCN)3呈血红色,它是一种配合物。上述实验可用于鉴定溶液中存在Fe3+。 呈血红色的是一系列配合物:Fe(SCN)2+、Fe(SCN)2+、Fe(SCN)3、Fe(SCN)4-、Fe(SCN)52-、Fe(SCN)63-,配位数从1~6。 注意:配位键的强度有大有小,因而有的配合物很稳定,有的不很稳定。许多过渡金属离子对多种配体具有很强的结合力,因而,过渡金属配合物远比主族金属配合物多。 [随堂练习] 1.铵根离子中存在的化学键类型按离子键、共价键和配位键分类,应含有() A.离子键和共价键B.离子键和配位键 C.配位键和共价键D.离子键答案:C 2.下列属于配合物的是() A.NH4Cl B.Na2CO3·10H2O C.CuSO4·5H2O D.Co(NH3)6Cl3 答案:CD 3.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是() ①H2O ②NH3③F-④CN-⑤CO A.①②B.①②③ C.①②④D.①②③④⑤答案:D 4.配合物在许多方面有着广泛的应用。下列叙述不正确的是() A.以Mg2+为中心的大环配合物叶绿素能催化光合作用 B.Fe2+的卟啉配合物是输送O2的血红素 C.[Ag(NH3)2]+是化学镀银的有效成分 D.向溶液中逐滴加入氨水,可除去硫酸锌溶液中的Cu2+ 答案:D 5.下列微粒:①H3O+②NH4+③CH3COO-④NH3⑤CH4中含有配位键的是() A.①②B.①③ C.④⑤D.②④答案:A 6.下列不属于配位化合物的是() A.六氟和铝酸钠B.氢氧化二氨合银(银氨溶液)C.六氰合铁酸钾D.十二水硫酸铝钾答案:D 7.指出配合物K2[Cu(CN)4]的配离子、中心离子、配位体、配位数及配位原子。 8.亚硝酸根NO2-作为配体,有两种方式。其一是氮原子提供孤对电子与中心原子配位;另一是氧原子提供孤对电子与中心原子配位。前者称为硝基,后者称为亚硝酸根。 [Co(NH3)5NO2]Cl2就有两种存在形式,试画出这两种形式的配离子的结构式。
第八章配位化合物 思考题解析 以下配合物中心离子的配位数为6假定它们的浓度均为0.001mol.L-1,指出溶液导电能力的顺序,并把配离子写在方括号内. (1)Pt(NH3)6Cl4(2)Cr(NH3)4Cl3(3)Co(NH3)6Cl3(4)K2[PtCl6] 解:溶液导电能力顺序为Pt(NH3)6Cl4>Co(NH3)6Cl3>K2[PtCl6]>Cr(NH3)4Cl3 2. PtCl4和氨水反应, 生成化合物的化学式为)Pt(NH3)4Cl4。将1mol此化合物用AgNO3处理,得到 2molAgCl,试推断配合物内界和外界的组分, 并写出其结构式。 解:内界为[PtCl2 (NH3)4]2+、外界为2 Cl-,结构式为:[Pt Cl2 (NH3)4] Cl2。 3下列说法哪些说法不正确?说明理由。 配合物由内界和外界两部分组成。(2)只有金属离子才能作为配合物的形成体。(3)配位体的数目就是形成体的配位数。(4)配离子的电荷数等于中心离子的电荷数。(5)配离子的几何构型取决于中心离子所采用的杂化轨道类型。 解:(1)不正确。有些化合物不存在外界,如[PtCl2 (NH3)2]、[CoCl3 (NH3)3]等。 不正确。少数高氧化数的非金属元素离子也可作为形成体,如[BF4]-、[SiF6]2-中的B3+、Si4+等;另外,有些中性原子也可作形成体,如[Ni(CO)4]中的Ni原子。 不正确。在多齿配体的螯合物中,配位体数目就不等于配位数,如[Cu(en)2]2+中。 不正确。配离子电荷应是形成体和配位体电荷的代数和。如[Fe(CN)6]3-。 正确。 4.实验测得下列配合物磁矩数据(B.M.)如下: [CoF6]3- 4.5 [Ni(NH3)4]2+ 3.0 [Ni(CN)4]2-0 [Fe(CN)6]4-0 [Cr(NH3)6]3+ 3.9 {Mn(CN)6}4- 1.8 试判断它们的几何构型,并指出哪个属于内轨型,哪个属于外轨型配合物。 解:
第2课时配位键 1.了解简单配位键的概念及形成实质和配位化合物在生物、化学等领域的广泛应用。 2.知道配位键的形成条件及简单配位键的形成表示。 一、配位键的含义 氨分子中,氮原子的三个未成对电子分别与一个氢原子的电子配对形成共价键,氮原子上还存在未成键的①孤对电子,形成铵根离子时,氨分子中的②孤对电子所在的轨道将与H+的1s空轨道重叠,使③孤对电子为氮原子、氢原子所共用,从而形成一种新的化学键叫④配位键。N中,4个N—H键性质⑤相同。 二、配位键的形成条件 形成配位键的一方(如A)是能够提供⑥孤对电子的原子,另一方(如B)是具有⑦能够接受孤对电子的空轨道的原子。配位键通常用符号⑧A→B表示。配位键与共价键的差别是形成配位键的共用电子对是由⑨一方提供而不是⑩双方共同提供的。 三、配位化合物 ①向硝酸银溶液中加入氨水,首先形成白色难溶物,继续加入氨水,难溶物溶解,得到一种称为氢氧化 二氨合银的物质,其化学式为[Ag(NH3)2]OH,其中含有的配位键可表示为H3N → Ag+。 ②向硫酸铜溶液中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到一种称为硫酸四氨合 铜的物质,其化学式为[Cu(NH3)4]SO4,其中含有的配位键可表示为H3N → Cu2+。 1.配位键与共价键有什么区别? 【答案】共价键是成键原子分别提供一个电子成键,配位键是配体提供一对电子,受体提供空轨道成键。 2.配位键是电子云重叠形成的吗? 【答案】不是;配位键是孤对电子的电子云与空轨道重叠形成的。 3.为什么过渡金属容易形成配位键? 【答案】因为过渡金属有空轨道。 1.在N中存在4个N—H共价键,则下列说法正确的是( )。
配位键疑难释疑 配位键及配位化合物知识尽管在教材中所占内容不多,但它常常与化学键、轨道杂化及物质性质等内容结合在一起设计问题,因而明晰配位键的本质、存在、形成条件等相关内容具有很重要的意义。 一、配位键与共价键的本质是否相同 原子之间形成共价键时,若共用电子对只是由一方原子提供电子,而非来 自双方原子,这样的共价键就称为配位键,故配位键一定是共价键,也就具有 共价键的特征:方向性与饱和性,所以说配位键与共价键没有本质上的差异。共价键不一定是配位键,关键是看共用电子对的来源是一个成键原子还是两个 成键原子提供的,若是由成键的一个原子单方面提供的则为配位键,若是由成 键双方原子共同提供的则是普通共价键,所以说配位键与共价键只是在形成过 程上有所不同而已。如浓氨水与盐酸反应生成氯化铵,因氨气分子中的 氮原子有一对孤电子,氢离子有空轨道,故H+与氨气通过配位键结合成铵根离 子,尽管铵根离子中4个氮氢键的形成过程不同,但实验证明 这4个氮氢键的性质完全相同,没有任何差异,这也进一步证明配位键与共价 键是没有本质区别的。 二、形成配位键有何条件 配位键是一种特殊的共价键,并不是任意的两个原子相遇就能形成。它要求成键的两个原子中一个原子A有孤对电子,另一个原子B有接受孤对电子的“空轨道”,所以配位键的表示方法为A →B,A称为配体,B称为中心原子或离子。有时为了增强成键能力,中心原子或离子B利用能量相近的空轨道进行杂化后,再来接收以配体原子A的孤电子对。配位键既可以存在于分子中(如H2SO4等),又可以存在于离子之中(如铵根离子、水合氢离子等),如图所示:
、例1:气态氯化铝(Al 2Cl 6 )是具有配位键的化合物,分子中原子之间的关系 如图示,请在图中标出你认为是配位键的斜线加上箭头。 解析:配位键是指成键双方一方提供空轨道一方提供孤对电子。C1元素最外层有7个电子通过1个共用电子对就可以形成8电子稳定结构。所以氯化铝(A12Cl6)中与两个铝形成共价健的氯原子中,有一条是配位键,氯原子提供电子,铝提供空轨道。 答案: 三、含有配位键的化合物就是配位化合物吗 配位化合物一般指由过渡金属的原子或离子(价电子层的部分d轨道和s、p 轨道是空轨道)与含有孤对电子的分子(如CO、NH3、H2O)或离子(如Cl-、CN-、 2 NO等)通过配位键结合形成的化合物。显然含有配位键的化合物就不一定是配位化合物,如上述提到的硫酸及铵盐等化合物中尽管有配位键,但由于没有过渡金属的原子或离子,故它们也就不是配位化合物。当然含有过渡金属离子的化合物也不一定是配位化合物,如氯化铁、硫酸锌等化合物就不是配位化合物。现以配位化合物[Co(NH3)6]Cl3为例说明配位化合物的结构与名称
大学无机化学第十二章 试题及答案 Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】
第十三章硼族元素 总体目标: 1.掌握硼单质、氢化物、卤化物和含氧化物的性质、用途和制备方法 2. 通过硼及其化合物的结构和性质,掌握缺电子化合物的成键特征 3.掌握铝及其化合物的结构、性质和制备 4. .认识铍和铝的相似性 各节目标: 第一节硼单质及其化合物 1.掌握硼单质的结构、化学性质、用途和制备方法 2.掌握乙硼烷、硼酸(H 3BO 3 )、硼砂和三卤化硼的性质、结构和制备方法 3.通过硼及其化合物的结构和性质,掌握缺电子化合物的成键特点和桥键的形成第二节铝单质及其化合物 1.掌握铝及其化合物的主要性质和AlCl 3 的结构,了解铝的提取和冶炼 2.认识铍和铝的相似性,如金属单质、无水卤化物、水合卤化物、氢氧化物 第三节镓、铟、铊 了解镓、铟、铊单质及其重要化合物的性质 习题 一、选择题 ⒈下列有关硼、铝性质的叙述,错误的是( ) A.都是缺电子原子 (OH) 3是弱酸,Al(OH) 3 是两性偏碱性 C.其三卤化物分子都是平面三角形结构 D.都是亲氧元素 ⒉在下列a—Al 2O 3 的制备方法中,不妥的是( ) A.灼烧Al(OH) 3 B.灼烧Al(NO 3 ) 3 C.高温电解Al 2(SO 4 ) 3 D.金属铝在氧中燃烧 ⒊下列铝的化合物不能用湿法制得的是( ) A. Al 2(CO 3 ) 3 (SO 4 ) 3 C.AlCl 3 (Ac) 3 4. 以下矿物中含有铝的是( ) A.冰晶石 B.孔雀石 C.白云石 D.方铅矿
第十二章卤素 §本章摘要§ 1.卤素单质 物理性质化学性质单质的制备 2.卤化氢和氢卤酸 物理性质化学性质卤化氢制备 3.卤化物 金属卤化物拟卤素和拟卤化物互卤化物和多卤化物 4.卤素的含氧酸及其盐 次卤酸亚卤酸及其盐卤酸及其盐高卤酸及其盐 卤素位于周期表第七主族, 价层电子构型,包括F、Cl、Br、I、At五种元素,因它与稀有气体外层的8电子稳定结构只差一个e,卤素都有获得一个电子以X-负一价离子的形式存在于矿石和海水中。 F:存在于萤石CaF2、冰晶石Na3AlF6、氟磷灰石Ca5F(PO4)3在地壳中的质量百分含量约0.015%,占第十五位。 Cl:主要存在于海水、盐湖、盐井,盐床中,主要有钾石盐KCl、光卤石KCl·MgCl2.6H2O。海水中大约含氯1.9%,地壳中的质量百分含量0.031%,占第十一位。 Br:主要存在于海水中,海水中溴的含量相当于氯的1/300,盐湖和盐井中也存在少许的溴,地壳中的质量百分含量约1.6%. I:碘在海水中存在的更少,碘主要被海藻所吸收,海水中碘的含量仅为 5 %,碘也存在于某些盐井盐湖中,南美洲智利硝石含有少许的碘酸钠。 At:放射性元素, 研究的不多,对它了解的也很少。 §1. 卤素单质 一.物理性质—熔、沸点和颜色 因为:半径依次增大,分子量也增大,所以色散力也增大,所以分别以气体—液体—固体状态存在。显色原因:利用分子轨道能级图解释显色。 卤素分子中π*和σ*反键轨道能量相差较小,这个能差随着Z 的增大而变小。F2电子数少,反键π*、σ*轨道能差大△E大。 F2吸收可见光中能量高、波长短的那部分光,而显示出长波段那部分光,复合色变成黄色。
第九章 配位化合物与配位滴定法习题 1、就是非判断题 1-1中心离子的未成对电子数越多,配合物的磁矩越大。 1-2配合物由内界与外界组成。 1-3配位数就是中心离子(或原子)接受配位体的数目。 1-4配位化合物K 3[Fe(CN)5CO]的名称就是五氰根·一氧化碳与铁(Ⅱ)酸钾。 1-5一般说来,内轨型配合物比外轨型配合物稳定。 1-6配合物中由于存在配位键,所以配合物都就是弱电解质。 1-7同一种中心离子与有机配位体形成的配合物往往要比与无机配合体形成的配合物更稳定。 1-8配合物的配位体都就是带负电荷的离子,可以抵消中心离子的正电荷。 1-9电负性大的元素充当配位原子,其配位能力强。 1-10在螯合物中没有离子键。 1-11配位物中心离子所提供杂化的轨道,其主量子数必须相同。 1-12配合物的几何构型取决于中心离子所采用的杂化类型。 1-13外轨型配离子磁矩大,内轨型配合物磁矩小。 1-14配离子的配位键越稳定,其稳定常数越大。 1-15氨水溶液不能装在铜制容器中,其原因就是发生配位反应,生成[Cu(NH 3)4]2+,使铜溶解。 1-16在配离子[Cu(NH 3)4]2+解离平衡中,改变体系的酸度,不能使配离子平衡发生移动。 1-17已知[HgI 4]2-的4θβ=K 1,[HgCl 4]2-的4 θβ=K 2,,则反应[HgCl 4]2-+4I -=[HgI 4]2-+4Cl -的平衡常数为K 1/K 2。 1-18 [Cu(NH 3)3]2+ 的积累稳定常数β3就是反应[Cu(NH 3)2]2+ + NH 3?[Cu(NH 3)3]2+的平衡常数。 1-19已知θ?[Fe 3+/Fe 2+]=0、77V,电极反应[Fe(C 2O 4)3]3-+ e=[Fe(C 2O 4)2]2-+ C 2O 42-,在标准状态时,θ ?的计算式为:θθθθθ??c O C c c O C Fe c c O C Fe c Fe F /)(/])([/])([lg 0592.0)/e 24222423 34223---+?++(= 。 1-20已知Hg 2++2e=Hg,θ?=0、85V;[HgCl 4]2-+2e=Hg+4Cl -,θ ?=0、38V 电池反应 [HgCl 4]2-?Hg 2+ + 4Cl -的平衡常数计算式为()20.850.38lg 0.0592K θ?-= 。 1-21 EDTA 滴定法,目前之所以能够广泛被应用的主要原因就是由于它能与绝大多数金属离子形成1:1的配合物。 1-22能形成无机配合物的反应虽然很多,但由于大多数无机配合物的稳定性不高,而且还存在分步配位的缺点,因此能用于配位滴定的并不多。 1-23金属指示剂与金属离子生成的配合物越稳定,测定准确度越高。
第十章 配位化合物 学习要点 配合物、配合物价键理论、sp 、sp 3、dsp 2、sp3d2、d2sp3杂化轨道、外轨型、内轨型配合物、磁矩、晶体场理论、分裂能、晶体场稳定化能(CFSE )、螯合物、配位平衡 学习指南 配合物是配位化合物的简称。配离子或配位分子是由中心原子提供价层空轨道,配体中的配原子提供孤对电子,以配位键结合而成的难解离的复杂结构单元。它是由中心原子和配体组成的。中心原子往往是过渡金属离子,配体一般分为单齿配体和多齿配体,配体中直接与中心原子配位的原子称为配原子。配离子或配位分子中配原子的数目称为中心原子的配位数。配合物顺、反异构体的理化性质不同。配合物的名称有俗名、商品名和系统命名,系统命名法是配合物内外界之间服从一般无机化学命名原则,内界命名的先后顺序所遵循的一般原则是配体数—配体名称—合—中心原子名称(中心原子氧化数),不同配体按阴离子—中性分子—阳离子顺序排列。 配合物的价键理论认为:中心原子与配体之间以配位键相结合,成键过程中,中心原子提供的价层空轨道首先进行杂化,形成杂化空轨道,配合物的空间构型,取决于中心原子价层空轨道的杂化类型。常见的杂化方式有sp 、sp 2、sp 3、dsp 2、sp 3d 2、d 2sp 3等。配合物的内、外轨型,可通过配合物的磁矩测定,结合中心原子的价层电子结构来判断,进一步可推断中心原子价层空轨道的杂化类型、配合物的空间构型、磁性及定性说明部分配合物的稳定性。 配合物的晶体场理论把中心原子和配体都看成点电荷,中心原子和配体之间靠静电作用力相结合,并不形成共价键。在晶体场的作用下,中心原子d 轨道发生能级分裂,分裂能的大小与配合物的空间构型、配体场强、中心原子所带的电荷数和它所属周期等因素有关。对于d 4~d 7电子构型的中心原子,其配合物有高、低自旋之分。根据晶体场稳定化能的相对大小可以比较相同类型配合物的稳定性。晶体场理论还可以较好地解释配合物的颜色。 配位平衡属溶液的四大平衡之一。对于配位反应 M + n L ? ML n 其稳定常数 K S = βn = n n [M][L] ][ML
第九章 配位化合物与配位滴定法习题 1.是非判断题 1-1中心离子的未成对电子数越多,配合物的磁矩越大。 1-2配合物由内界和外界组成。 1-3配位数是中心离子(或原子)接受配位体的数目。 1-4配位化合物K 3[Fe(CN)5CO]的名称是五氰根·一氧化碳和铁(Ⅱ)酸钾。 1-5一般说来,内轨型配合物比外轨型配合物稳定。 1-6配合物中由于存在配位键,所以配合物都是弱电解质。 1-7同一种中心离子与有机配位体形成的配合物往往要比与无机配合体形成的配合物更稳定。 1-8配合物的配位体都是带负电荷的离子,可以抵消中心离子的正电荷。 1-9电负性大的元素充当配位原子,其配位能力强。 1-10在螯合物中没有离子键。 1-11配位物中心离子所提供杂化的轨道,其主量子数必须相同。 1-12配合物的几何构型取决于中心离子所采用的杂化类型。 1-13外轨型配离子磁矩大,内轨型配合物磁矩小。 1-14配离子的配位键越稳定,其稳定常数越大。 1-15氨水溶液不能装在铜制容器中,其原因是发生配位反应,生成[Cu(NH 3)4]2+,使铜溶解。 1-16在配离子[Cu(NH 3)4]2+解离平衡中,改变体系的酸度,不能使配离子平衡发生移动。 1-17已知[HgI 4]2-的4θβ=K 1,[HgCl 4]2-的4θβ=K 2,,则反应[HgCl 4]2-+4I -=[HgI 4]2-+4Cl - 的平衡常数为K 1/K 2。 1-18 [Cu(NH 3)3]2+ 的积累稳定常数β3是反应[Cu(NH 3)2]2+ + NH 3 [Cu(NH 3)3]2+的平衡常数。 1-19已知θ?[Fe 3+/Fe 2+]=0.77V ,电极反应[Fe(C 2O 4)3]3-+ e=[Fe(C 2O 4)2]2-+ C 2O 42-,在标准状态时, θ?的计算式为:θθθθ θ??c O C c c O C Fe c c O C Fe c Fe F /)(/])([/])([lg 0592.0)/e 2422242334223---+?++(= 。 1-20已知Hg 2++2e=Hg ,θ?=0.85V ;[HgCl 4]2-+2e=Hg+4Cl -,θ?=0.38V 电池反应 [HgCl 4]2-Hg 2+ + 4Cl - 的平衡常数计算式为()20.850.38lg 0.0592 K θ?-= 。 1-21 EDTA 滴定法,目前之所以能够广泛被应用的主要原因是由于它能与绝大多数金属离子形成1:1的配合物。 1-22能形成无机配合物的反应虽然很多,但由于大多数无机配合物的稳定性不高,而且还存在分步配位的缺点,因此能用于配位滴定的并不多。
第八章配位化合物 1.指出下列配离子的形成体、配体、配位原子及中心离子的配位数。 2. 命名下列配合物,并指出配离子的电荷数和形成体的氧化数。 (1) 三氯·一氨合铂(Ⅱ)酸钾 (2) 高氯酸六氨合钴(Ⅱ) (3) 二氯化六氨合镍(Ⅱ) (4) 四异硫氰酸根·二氨合铬(Ⅲ)酸铵 (5) 一羟基·一草酸根·一水·一乙二胺合铬(Ⅲ) (6) 五氰·一羰基合铁(Ⅱ)酸钠
根据上述结果,写出上列三种配合物的化学式。 5. 根据下列配离子中心离子未成对电子数及杂化类型,试绘制中心离子价层d 64 2-6 3-测这两种配离子价层d 电子分布情况及它们的几何构型。 7.在50.0mL0.20mol ·L -1 AgNO 3 溶液中加入等体积的1.00mol ·L -1 的NH 3 ·H 2 O ,计算达平衡时溶液中Ag + ,[Ag(NH 3 )2 ]+ 和NH 3 的浓度。 8.10mLO.10mol ·L -1 CuSO 4 溶液与lOmL6.Omol ·L -1 NH 3 ·H 2 O 混合并达平衡,计算溶液中Cu 2+ 、NH 3 及[Cu(NH 3 )4 ]2+ 的浓度各是多少? 若向此混合溶液中加入0.010molNaOH 固体,问是否有Cu(OH)2沉淀生成? 9.通过计算比较1L 6.0mol ·L -1 氨水与1L 1.0mol ·L -1KCN 溶液,哪一个可溶解较多的AgI? 10.0.10g AgBr 固体能否完全溶解于100mL 1.00mol ·L -1 氨水中? 11.在50.0 mL 0.100mol ·L -1 AgNO 3 溶液中加入密度为0.932g ·cm -3 含NH 3 18.2%的氨水30.0mL 后,再加水冲稀到100mL 。 (1)求算溶液中Ag + 、[Ag(NH 3 )2 ]+ 和NH 3 的浓度。 (2)向此溶液中加入0.0745g 固体KCl ,有无AgCl 沉淀析出? 如欲阻止AgCl 沉淀生成,在原来AgNO 3 和NH 3 水的混合溶液中,NH 3 的最低浓度应是多少? (3)如加入0.120g 固体KBr ,有无AgBr 沉淀生成? 如欲阻止AgBr 沉淀生成,在原来AgNO 3 和NH 3 水的混合溶液中,NH 3 的最低浓度应是多少? 根据(2)、(3)的计算结果,可得出什么结论? 12.计算下列反应的平衡常数,并判断反应进行的方向。 (1) [HgCl 4 ]2- +4I - [Hgl 4 ]2- + 4Cl - 已知:([HgCl 4 ]2-) = 1.17×1015 ;([HgI 4 ]2- = 6.76×1029 (2) [Cu(CN) 2 ]- + 2NH 3 [Cu(NH 3 )2 ]+ + 2CN - 已知: {[Cu(CN)2 ]-}=1.0×1024 {[Cu(NH 3 )2 ]+ } =7.24×1010 (3) [Fe(NCS) 2 ]+ + 6F - [FeF 6 ]3- + 2SCN - 巳知: {[Fe(NCS)2 ]+ }= 2.29×103 [(FeF 6 ]3-= 2.04×1014 13. 已知:E θ(Ni 2+ /Ni)= -0.257V ,E θ(Hg 2+ /Hg)= 0.8538V , 计算下列电极反应的E θ值。 (1) [Ni(CN)4]2- + 2e -Ni + 4CN - (2) [HgI 4 ]2- + 2e - Hg + 4I - *14. 已知: E θ(Cu2+/Cu)=0.340 V, 计算出电对[Cu(NH3)4]2+/Cu 的E θ值。
第十九章配位化合物 1.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3亦不产生沉淀,以强碱处理并没有放出NH3,写出它的配位化学式。 答:[Pt(NH3)2Cl4] 2.下列化合物中哪些是配合物?哪些是螯和物?哪些是复盐?哪些是单盐? (1)CuSO4·5H2O (2)K2PtCl6 (3)Co(NH3)6Cl3 (4)Ni(en)2Cl2 (5)(NH4)2SO4·FeSO46H2O (6)Cu(NH2CH2COO)2 (7)Cu(OOCH3)2 (8)KCl·MgCl2·6H2O 答:配合物:K2PtCl6;Co(NH3)6Cl3;CuSO4·5H2O 螯合物:Ni(en)2Cl2;Cu(NH2CH2COO)2 复盐:(NH4)2SO4·FeSO4·6H2O;KCl·MgCl2·6H2O 简单盐:Cu(OOCH3)2 3.命名下列各配合物和配离子: (1)(NH4)3[SbCl6] (2)Li[AlH4] (3)[Co(en)3]Cl3 (4)[Co(H2O)4Cl2]Cl (5)[Cr(H2O)4Br2]Br·2H2O (6)[Cr(H2O)(en)(C2O4)(OH)] (7)[Co(NO2)6]3- (8)[Co(NH3)4(NO2)Cl]+ (9)[Cr(Py)2(H2O)Cl3] (10)[Ni(NH3)(C2O4)] 答:(1)六氯合锑(III)酸铵 (2)四氢合铝(III)酸锂 (3)三氯化三(乙二胺)合钴(III) (4)一氯化二氯?四水合钴(III) (5)二水合溴化二溴?四水合钴(III) (6)一羟基?一水?草酸根?乙二胺合铬(III) (7)六硝基合钴(III)配阴离子 (8)一氯?一硝基?四氨合钴(III)配阳离子 (9)三氯?一水?二吡啶合铬(III) (10)二氨?草酸根合镍(II) 4.指出下列配合物的空间构型并画出它们可能存在的立体异构体:
第八章配位化合物 一、配合物的基本概念 1、配位化合物的定义及其组成 ?定义:把由一定数目的阴离子或中性分子与阳离子或原子以配位键形成的复杂分子或离子称配合单元。含有配合单元(配位键) 简单化合物反应生成的复杂化合物。 配合单元相对稳定,存在于晶体及溶液中,在溶液中不能完全离解为简单组成的部分。 ?配位键——由配体单方面提供电子对给中心原子(离子)而形成的共价键。 ? 组成中心离子的元素种类: ◆能充当中心离子的元素几乎遍及元素周期表的各个区域,但常见的是金属离子,尤其 是一些过渡金属离子,如[Co(NH3)6]3+、[Fe(CN)6]4—、[HgI4]2—。 ◆高氧化态非金属元素原子:如B、Si、P等形成[ BF4]—、[SiF6]2—、PF6—。 ◆金属元素电中性原子:如[ Ni(CO)4]、[ Fe(CO)5]、[Cr(CO)6] ?配合物的组成:配合物由内界和外界组成。内界为配合物的特征部分(即配位个体),是一个在溶液中相当稳定的整体,在配合物的化学式中以方括号表明。方括号以外的离子构成配合物的外界。内外界之间以离子键结合,故在水溶液中易解离出外界离子,而内界即配合单元很难发生离解。 如[Cu (NH3)4] SO4 ↓↓↓ 中心原子,配位体,外界 ?在配合物中同中心原子/离子配位的分子如NH3、H2O或阴离子如Cl—、CN—、SCN—称 配体属于Lewis碱,都含有孤对电子,是电子对的给予体。中 ?配位体中与中心离子(或原子)直接成键的离子称为配位原子。配位体所提供的孤对电子即是配位原子所具有的孤对电子。常见的配位原子有:F、Cl、Br、
?配位体分类——单齿配体和多齿配体 单齿配体:一个配位体只提供1个孤对电子与1个中心离子结合形成1个配位键。如NH3、—OH(羟基)、H2O:、:X—等。 多齿配体:一个配位体中含有2个或更多个配位原子,与一个中心离子形成2个或2 个以上的配位键。例如:乙二胺(en)NH2–CH2–CH2–NH2、草酸根C2O42—是 双齿配体。乙二胺四乙酸根EDTA(Y4—) 是六齿配体,其结构式如下: 螯合物:多齿配体与中心离子形成的具有闭合环状结构的配合物。螯合物具有很高的稳定性,此外,螯合物还具有特征颜色、难溶于水而易溶于有机溶剂等特点,因而被广泛用于沉淀分离、溶剂萃取、比色测定、容量分析等分离、分析工作。 ?配位数——配合物分子中直接与同一中心离子(原子)成键的配位原子数目称为中心离子(原子)的配位数(用表示)。可为1~14,常见6。本质上,配位数就是中心原子与配体形成配位键的数目。 =i? ∑ 配位数配位体的数目齿数 如[Ag(NH3)2]+ C.N.=2;[Cu(NH3)4]2+ C.N.=4;[Pt(en)2]2+ C.N.=4 单齿配体形成的配合物:中心离子的配位数=配体的数目 多齿配体形成的配合物:中心离子的配位数≠配体的数目, 配位原子数=配位数 配位数金属离子实例 2 Ag+、Cu+、Au+[Ag(NH3)2]+、[Cu(CN)2]— 4 Cu2+、Zn2+、Cd2+、Hg2+、 Al3+、Sn2+、Pb2+、Co2+、 Ni2+、Pt4+、Fe3+、Fe2+ [HgI4]2—、[Zn (CN)4] 2—、 [Pt(NH3)2Cl2] 6 Cr3+、Al3+、Pt4+、Fe3+、Fe2+、 Co2+、Ni2+、Pt4+ [PtCl] 2—、[Co(NH3) 3(H2O)]、 [Fe(CN)6] 3—、[Ni(NH3) 6] 2+、 [CrCl2(NH3) 4] + ☆☆配位数(C.N)的影响因素: ①电荷数→∞,C.N→∞。如: Ag(NH3)2+ C.N=2 PtCl42- C.N= 4 Cu(NH3)42+ C.N=4 PtCl62- C.N= 6 ②半径r→∞,C.N→∞。如: 中心离子 C.Nmax [BF4]—第二周期 4 [AlF6]3—第三、四周期 6 [La(H2O)]83+第五、六周期10 ③外层电子构型: d 0 C.N= 6 [AlF6]3- d 1 C.N= 6 [Ti(H2O)6]3+