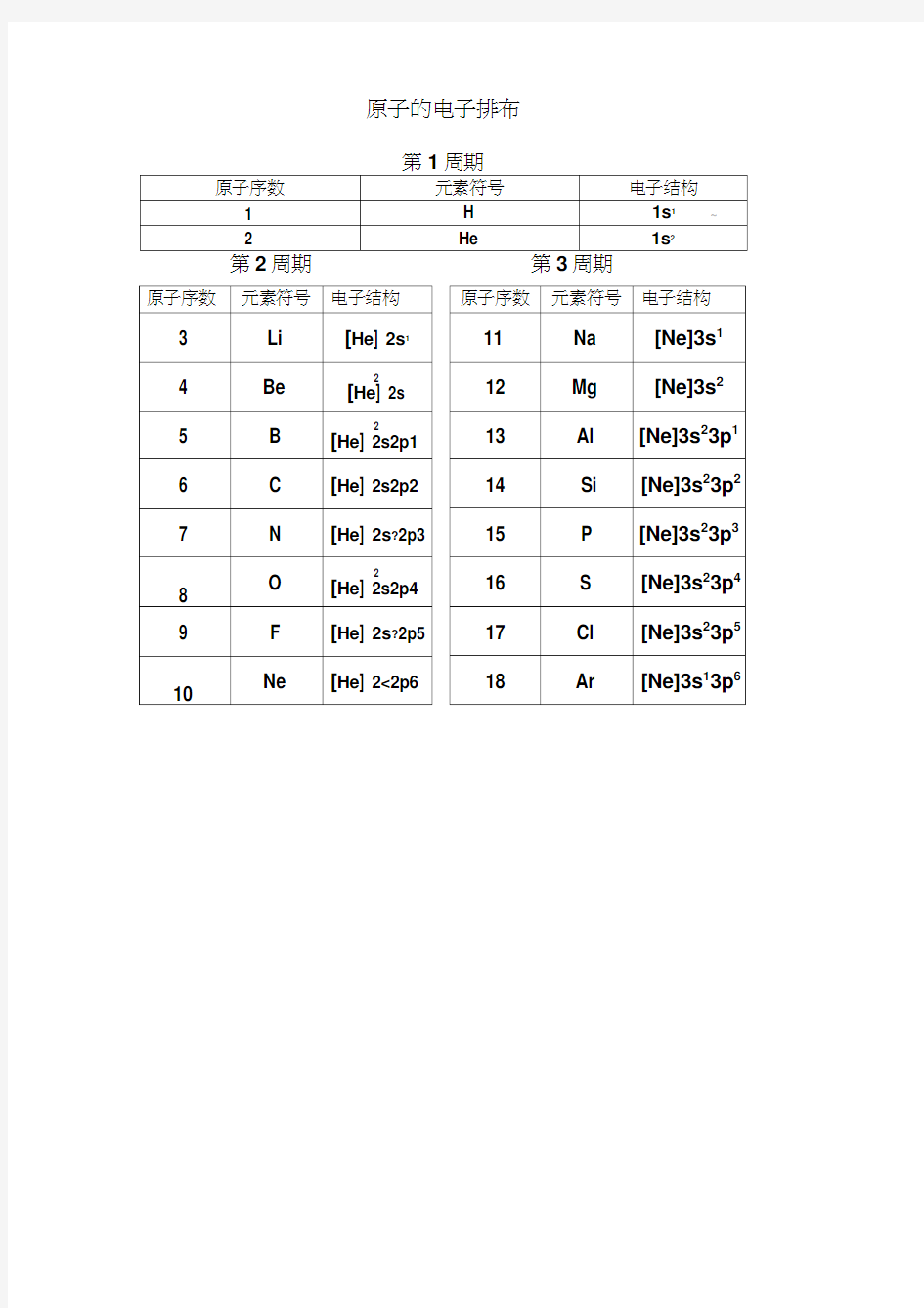
原子的电子排布
第1周期
第2周期第3周期
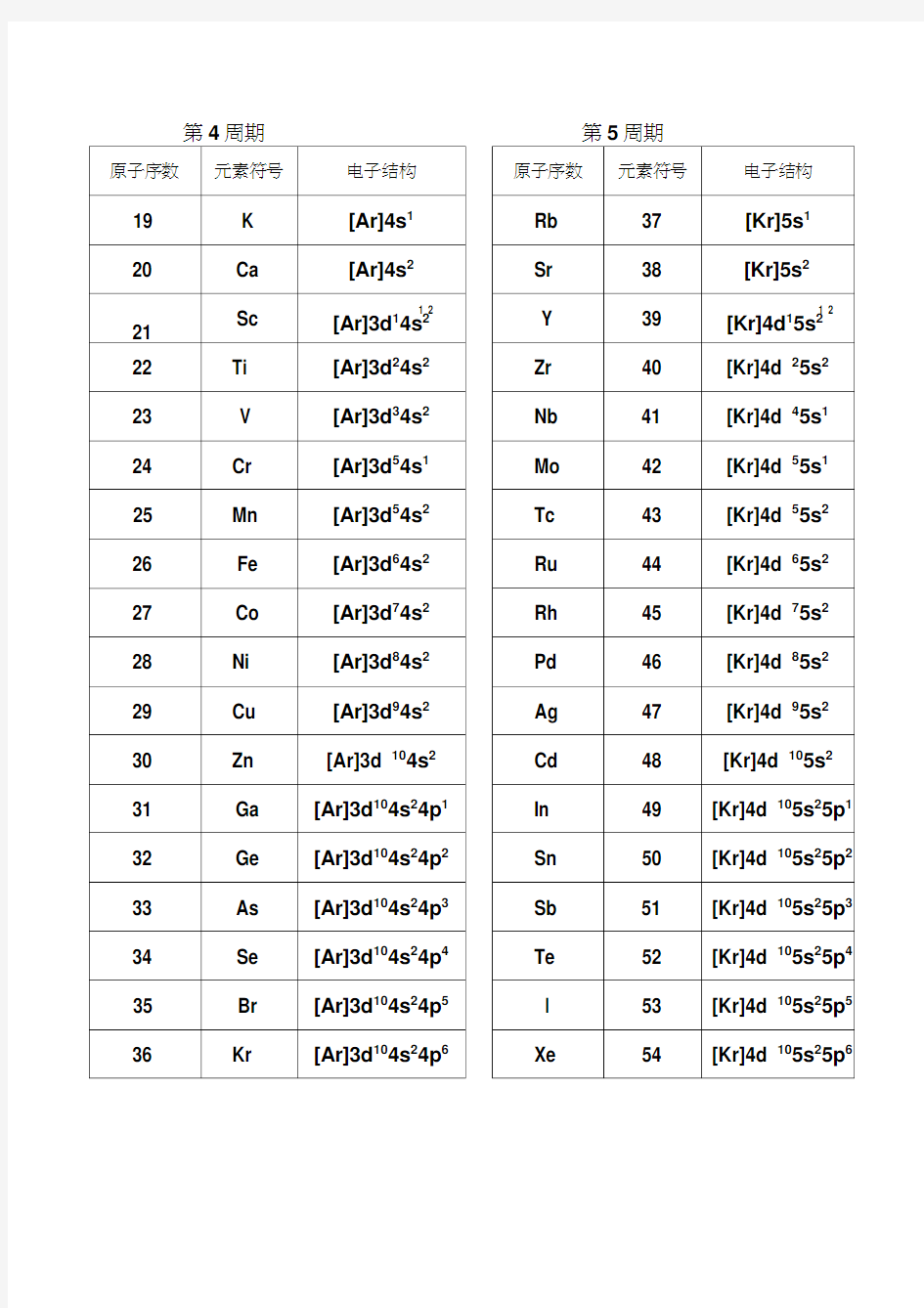
第4周期
第5周期
隸晅L ? 隸晅9?
镧系(第6周期)
锕系(第7周期)
原子的电子排布图
H
isl He is #
is_t!is_ll is2!
Li
2s丄2p __________ B e 2s H
2p B 2s 2p _________
is」is _11is丄
C
2s 2p±丄—
N 2s Jl
2P丄JL丄
O 2^ 2p_k J_ _L
is H is_ll
F
2s H2pM M 丄Ne e
2s Jl2p
乂乂乂
1s」
2s 2p H ±L N
3s f 3p _____________ 3d ——_
1sll
Mg 2s H 2p ” _!£屮
3p
3d 一一
is_i
Al 2s 2p
岀N
3s N 3p t ____________
3d —————
J
p 2s 2p
上
3S 丄L 3pj_ _L _L
3d —————is」
2s 2pl
3s 卫3p」_ t —3d —————is汕
2s 2pdl 吐IL
3s H 3pH J_ \
3d ———
is J
2s 2pJl 1£ U
3s卫3p主卫丄3d 一一一
is」
2s" 2pdlll£
3s 卫3p_tl 上L
乂
Si
3d 一一一
4d —————
1s 丄
2s 2pl 3s 3p 」
K 3d —————————— 4s 丄 4p _________ 4d _ _ _ _ _ 4f __________ ___ _ _ 1s_t
2s 2pl 3s 3pjl 1 上
Sc 3d ‘ 4s ” 4p _____________ 4d 1s
丄
2s 2pjj_j£ 乂
3s
3p
Ca 3d ————
4s
件 4p _________
4d _ _ _
_
4f __________ ____ . 1sj_ 2s 2p 丄
3s 3p
丄
Ti 3d
4s
甩 4p
4d 4f 4f
11
11电丄II
一
1S 2s
3s 3d 4s 4d 4f
V
2P 上
3P 上
± ± _ 4p _________ fl 11
1s 2s 3s 3d 4s a
4d
2P 丄 3p” H H
丄± ± 1
4p
住
n tl
丄
H s
s
s d
s
1 2 3 3 4 n M
2p 二 3P 2I Hl ± ± ± 1 4p _________ Fe
J j
L 3 p p
巾 2
3 4
ll ll tl H il 丄
K i£
丄
原子轨道能级与核外电子排布 薛万川叶其纲蒋栋成 (广西师范大学,桂林)(高等教育出版社,北京) 原子结构理论是现代化学的基础理论之 一。但仍有许多问题,诸如:原子轨道和轨道 能的概念、轨道能级高低次序、轨道的“填实孙顺序和电离顺序、原子基态时核外电子排布及其 与元素周期系的关系等,在化学教学中是经常 遇到的。 一、轨道近似与原子轨道能级 对于多电子原子轨道能级高低次序目前有 许多不同说法,这些说法的依据除去L. Paining 建议的近似能级之外,主要是Hartree-Fock SCF 轨道能、Thomas-Fermi轨道能和Slater轨道 能。这三种轨道能都是从多电子原子薛定愕方 程的轨道近似法求解后得到的。 采用玻恩一奥本海默定核近似时,含有N个电子(N>2)原子序数为Z的原子体系非相对 论性哈密顿算符为
其定态薛定厄方程为 原子结构理论的重要内容之一是掌握原子中单个电子运动状态的信息。轨道近似理论假设方程(2)的解—体系多电子波函数梦可用 单电子函数的乘积或其组合近似表示, 轨道近似假设要求(i)式中的[H〕用单电子算符【h;]的和近似表示, 经过对电子间库仑排斥势能项1/r“的简化处理使其变成只与电子i的坐标有关,则单电子算符具有下述一般形式 式中Y(r;)是在中心力场近似下核和其余 (N - 1)个电子对电子‘的平均相互作用势 能。于是原子薛定i}方程(2)分离变最后得到
单电子本征值方程 确定势能函数V(r;)的不同处理方法: Hartree-Fock SCF法、Thomas-Fermi原子统计 位能法和Slater半经验法代表不同的轨道近似 理论。不同的方法有不同的势能函数,代人单 电子方程求解得到不同类型的轨道能。Thomas- Fermi法和Slater法计算结果〔,,2,表明这两种类型的轨道能级均随原子序数增大而变化(能级 交叉情况有所不同)。Pilar}3,根据V}'achters}'} 的Hartree-Fock计算结果提出第四周期元素 ‘:总是高于,3a的说法。最近潘道皑等的Hartree-Fock计算结果指出:钾钙的e,.低于 e3d (Wachters在论文中没有报导钾钙的e3d数据),而杭钦的。;.高于e3d。原子Hariree-Fock SCF从头计算较为复杂,采用不同的基函数集 合以及计算方法上采用不同的近似处理得到的Hartree-Fock轨道能不尽相同。从目前文献报 导的各种轨道能和能级图来看,在轨道能级高 低次序以及轨道能级与原子序数的关系等问题 上尚未取得一致的意见。正如尹敬执、申淬文 在书中所指出的:中性原子中原子轨道的实际
《原子核外电子的排布》教学设计 一、教材分析 本章《物质结构元素周期律》是高中必修二第一章的内容,是在九年级化学上册第四单元《物质构成的奥秘》的理论基础上进一步的深入学习,而本节内容——原子核外电子的排布又是本章的核心内容,是后面学习元素周期律的基础。 二、学生分析 学生初中时已经学习了原子的构成和元素,对核外电子是分层排布这一知识点也做了初步了解,所以在此节内容的学习之前学生就已经具备了一些原子的相关基础知识。同时也具备一定的数学基础,能够对一些数据进行分析处理。 三、教学目标 (一)知识与技能目标 1.了解原子核外电子运动的特征。 2.了解元素原子核外电子排布的基本规律,能用原子(离子)结构示意图表示常见原子(离子)的核外电子排布。 (二)过程与方法目标 培养学生分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。 四、教学重难点 重点:原子核外电子分层排布、原子核外电子的排布及其规律。 难点:原子核外电子排布规律间相互制约关系。 五、教学过程 【引入】大家好,这节课我们进入到新课的学习:
【板书】原子核外电子的排布 【提问】在进入新课内容之前,我们先来复习一下以前学习的内容。初中的时候在《物质构成的奥秘》这一章当中我们就学习了原子的相关知识,下面我们来回顾一下,什么是原子?原子由什么微粒构成? 【学生回顾】…… 【板书】 外电子数 核电荷数=质子数=核的负电荷核外电子:带一个单位 中子:不带电 个单位的正电荷质子:带原子核原子????????1 【教师】原子由原子核和核外电子构成,而原子核又由质子和中子构成,其中质子带一个单位的正电荷,中子不带电。核外电子则带一个单位的负电荷。 【提问】那么为什么原子对外显电中性呢? 【学生】质子所带的正电荷数等于核外电子所带的负电荷数,所以原子不显电性。 【教师】很好,其中我们还学习到了一个重要的等式关系:核电荷数=质子数=核外电子数。所以质子所带的正电荷与核外电子所带的负电荷相互抵消,导致原子不显电性。 【过渡】好,我们都知道了原子的结构。现在我们来研究一下电子在原子核外究竟是怎么运动的。 【教师】大家来看ppt 上这张熟悉的原子结构图。我们可以看到原子核外有一圈圈的层状区域,由里往外分为好几个圈层,这就是我们以前初三所学习到的电子层——核外电子的运动有自己的特点,它不像行星绕太阳旋转有固定的轨道,但却有经常出现的区域,科学家把这些区域称为电子层。而核外电子就是在这样不同的电子层内运动,我们把这种现象称为核外电子的分层排布。这些都是同学们初中已经学习过的内容。 【过渡】那么,大家知道了核外电子的分层排布之后,是不是产生了这样的疑问:核外电子究竟是怎么分层排布的呢?好,接下来我们一起来共同解决同学们的疑问——我们来探究核外电子的排布规律。 【板书】核外电子的排布规律 【提问】我们来看这个原子结构,从黄色最里一层原子层到蓝色最外一层原子层,
洪特规则 德国人洪特(F.Hund)根据大量光谱实验数据总结出一个规律,即分子分布到能量简并的原子轨道时,优先以自旋相同的方式分别占据不同的轨道,因为这种排布方式原子的总能量最低。所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道。例如碳原子核外有6个电子,按能量最低原理和泡利不相容原理,首先有2个电子排布到第一层的1s轨道中,另外2个电子填入第二层的2s轨道中,剩余2个电子排布在2个p 轨道上,具有相同的自旋方向,而不是两个电子集中在一个p轨道,自旋方向相反。1适用范围 该定则只适用于LS 耦合的情况。有少数例外是由于组态相互作用或偏离LS 耦合引起的。该定则可用量子力学理论和泡利不相容原理来解释。该定则对确定自由原子或离子的基态十分有用。
2洪特规则前提 洪特规则前提:对于基态原子来说 在能量相等的轨道上,自旋平行的电子数目最多时,原子的能量最低。所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道。例如碳原子核外有6个电子,按能量最低原理和泡利不相容原理,首先有2个电子排布到第一层的1s轨道中,另外2个电子填入第二层的2s轨道中,剩余2个电子排布在2个不同的2p轨道上,具有相同的自旋方向,而不是两个电子集中在一个p 轨道,自旋方向相反。作为洪特规则的补充,能量相等的轨道全充满、半满或全空的状态比较稳定。 根据以上原则,电子在原子轨道中填充排布的顺序为1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…。3详细信息 具体内容:对于特定电子排布,不同组态的LS耦合,洪特规则确定了能量排列顺序:(1)总自旋S越大,能量越低 (2)S相等情况下,总轨道角动量L越大,能量越低
第五章原子结构元素周期律 第一节原子结构原子核外电子排布 【高考新动向】 【考纲全景透析】 一、原子的构成 1. 原子的构成 原子的组成表示式:X,其中X为原子符号,A为质量数,Z为质子数,A-Z为中子数。2.基本关系 ①质子数=核电荷数=核外电子数 ②阳离子中:质子数=核外电子数+电荷数 ③阴离子中:质子数=核外电子数-电荷数 ④质量数=质子数+中子数 3.元素、核素、同位素之间的关系如下图所示: 元素、核素和同位素的概念的比较
二、 原子核外电子排布 1.电子层的表示方法及能量变化 圆圈表示原子核,圆圈内标示出核电荷数,用弧线表示电子层,弧线上的数字表示该电子层的电子数。要注意无论是阳离子还是阴离子,圆圈内的核电荷数是不变的,变化的是最外层电子数。 离核由近及远→电子能量由低到高 2.核外电子分层排布的规律 核外电子的分层运动,又叫核外电子的分层排布,其主要规律有: (1)能量规律 原子核外电子总是先排能量最低的电子层,然后由里向外,依次排布在能量逐步升高的电子层(能量最低原理)。即排满了K 层才排L 层,排满了L 层才排M 层。 (2)分层排布规律 ①原子核外每个电子层最多容纳2n 2 个电子。 ②原子最外层电子数不超过8个电子(K 层为最外层不能超过2个电子)。 ③原子次外层电子数不超过18个电子(K 层为次外层不能超过2个电子)。 【热点难点全析】
〖考点一〗原子的构成及概念比较 1.构成原子的粒子 2.组成原子的各种粒子及相互关系 (1)原子或分子:质子数(Z)=核电荷数=核外电子数 (2)阳离子:核外电子数=质子数-所带电荷数 (3)阴离子:核外电子数=质子数+所带电荷数 3.同位素、同素异形体、同系物、同分异构体的比较 〖提醒〗(1)质子数与核外电子数之间的关系,对于原子不易出错,对于阴、阳离子容易出错。应清楚阳离子核外电子数少于质子数,阴离子核外电子数多于质子数。 (2)元素、同位素、同素异形体、同系物、同分异构体的判断关键是描述的对象。如: ①具有相同质子数的两微粒不一定是同种元素,如Ne和H2O。 ②质子数相同而中子数不同的两微粒不一定互为同位素,如14N2和13C16O。 ③2H2和3H2既不是同位素,也不是同素异形体。 【典例1】铀(U)是重要的核工业原料,其中23592U是核反应堆的燃料,下列关于23592U和23892U的说
1~36号元素基态原子的核外电子排布 广东郑春平 基态原子是处于能量最低状态下的原子,基态原子的核外电子排布,决定了元素周期表的划分和原子半径的变化规律。要认识基态原子的核外电子排布,必需要掌握排布原则和电子在原子轨道上的排布顺序。. 一、基态原子的核外电子排布三大原则 1、能量最低原则:核外电子的排布要使整个原子的能量最低,以形成稳定结构。 2、泡利不相容原理:一个原子轨道中最多只能容纳两个电子,并且这两个电子的 自旋方向必须相反。 3、洪特规则:对于基态原子,电子在能量相同的轨道上排布时,应尽可能的分占 不同的轨道并且自旋方向相同。 洪特规则实际上是为了更好的遵循能量最低原则,根据光谱实验结果,洪特进一 步指出,能量相同的原子轨道在全充满(p6和d10)、半充满(p3和d5)和全空(p0和 d0)状态时,体系能量最低,原子最稳定。 二、电子在原子轨道上的排布顺序 多电子原子中,电子填充电子轨道时,一般先填满能量低的轨道,再填能量高的轨道原子轨道能量的高低存在以下规律: 1、相同电子层上原子轨道能量的高低:ns 专题5 微观结构与物质的多样性 第一单元原子结构核外电子排布 课时训练练知能、提成绩限时测评 (时间:40分钟) 测控导航表 基础过关 1.(2013甘肃河西五市第一次联考)下列有关错误!未找到引用源。Po叙述正确的是( C ) A.Po的相对原子质量为210 B错误!未找到引用源。Po与错误!未找到引用源。Po互为同素异形体 C.Po位于第6周期ⅥA族 D错误!未找到引用源。Po原子核内的中子数为84 解析:Po元素有多种核素,210只是错误!未找到引用源。Po这种核素的近似相对原子质量,A错误错误!未找到引用源。Po与错误!未找到引用源。Po是Po的不同核素,者互为同位素,而同素异形体是指同种元素形成的不同单质,B错误;第6周期的稀有气体原子序数是86,故Po应为第6周期ⅥA族元素,C正确错误!未找到引用源。Po原子 核内的中子数为:210-84=126,D错误。 2.(2013漳州模拟)不具有放射性的同位素称之为稳定同位素,稳定同位素分析法在科学研究中获得了广泛的应用。如2H、13C、15N、18O、34S等常用作环境分析指示物。下列有关说法正确的是( B ) A.34S原子核内中子数为16 B.16O与18O互称同位素 C.13C和15N原子核内的质子数相差2 D.2H+结合OH-的能力比1H+更强 解析:34S原子核内中子数为34-16=18,A错误;16O与18O质子数相同而中子数不同,互为同位素,B正确;13C的质子数为6,15N的质子数为7,两者质子数相差1,C错误;2H+与1H+化学性质相同,D错误。 3.(2014山东实验中学一模)金属钛对体液无毒且有惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关错误!未找到引用源。Ti和错误!未找到引用源。Ti的说法中正确的是( C ) A.错误!未找到引用源。Ti和错误!未找到引用源。Ti原子中均含有22个中子 B错误!未找到引用源。Ti与错误!未找到引用源。Ti为同一核素C错误!未找到引用源。Ti与错误!未找到引用源。Ti互称同位素,在周期表中位置相同,都在第4 纵行 D.分别由错误!未找到引用源。Ti和错误!未找到引用源。Ti组成的金属钛单质互称为同分异构体 解析错误!未找到引用源。Ti和错误!未找到引用源。Ti原子中中 原子的核外电子排布 1.原子结构行星模型告诉我们,核外电子在原子核外的外周运动,那么原子的核外电子是怎样排布在原子核外的呢?下图是1~20号元素核外电子的排布图,仔细观察图像,回答下列问题:注:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出。 (1)第一层最多排_______个电子,第二层最多排________个电子,第三层最多排______个电子。规律:第n层最多容纳的电子数为______________(用含n的代数式表示)。 (2)最外层最多排_______个电子。 (3)第二层电子的能量比第一层电子的能量_________(填“大”或“小”,提示:从原子核对电子的作用思考)。 2.电子层的表示方法及能量变化: 3.核外电子的排布规律: (1)能量最低原则:核外电子总是先排布在能量______的电子层里,然后再按照由______向______的顺序依次排布在能量逐渐升高的电子层里。 (2)电子分层排布的原则: ①第n层最多容纳的电子数为______。 ②最外层不超过________个(K层为最外层时,不超过_____个)。 4.原子结构示意图:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出,如: 5.阴阳离子的形成: (1)当原子_________(填“得到”或“失去”)电子时便形成阴离子,如N3-、O2-、F-。 (2)当原子_________(填“得到”或“失去”)电子时便形成阳离子,如Na+、Mg2+、Al3+。 规律: a.当原子的最外层电子数大于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。 b.当原子的最外层电子数小于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。 6.“8e”稳定结构:___________________________________________。 由“8e”稳定结构可知,N元素常见的化合价是________,S元素常见的化合价是__________。规律:元素的最高正化合价=__________________,元素的最低负化合价=_________________。 7.原子的电子式:元素的化学性质主要由_________________决定,我们常用小黑点或×来表示 元素原子的最外层上的电子。分别写出下列粒子的电子式: Na_______、Na+__________、Cl_________、Cl-________、NH4+_________、OH-_________。 8.微粒半径大小的比较: (1)电子层数越多,微粒半径越______,如r(O)______ r(Na)。 (2)电子层数相同,核电荷数越大,微粒半径越_________,如r(Mg)______ r(Al)。 (3)电子层数相同,核电荷数也相同,电子数越多,微粒半径约___________,如r(Cl)______ r(Cl—)。规律:不同的原子结构对应不同的性质(如化合价、半径大小等),这就是“结构决定性质”。9.核外有十电子的微粒有:__________________________________________________________。 10.核外有十八电子的微粒有:________________________________________________________。 例1.(核外电子的排布规律) 1.1.下列叙述中,正确的是(A) A.在多电子的原子里,能量高的电子通常在离核较远的区域内运动 B.核外电子总是先排在能量低的电子层上,如M层只有排满18个电子后才能排N层 C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同 D.微粒的最外层只能是8个电子才稳定 1.2.A元素原子L层比B元素L层少2电子,B元素的核外电子总数比A元素的核外电子总数多5个,则A、B 可形成(D) A.AB B.A2B C.A2B3 D.B2A3 例2.(原子或离子结构示意图、电子式的书写) 2.写出下列原子或离子的结构示意图和电子式: (1)碳原子(C)_________、______________,(2)钾原子(K)_________、______________,(3)硫离子(S2-)_________、______________,(4)铝离子(Al3+)_________、______________, 基态原子的核外电子排布原子轨道 一、选择题(本题包括12小题,每小题5分,共60分) 1.2015·山东滨州高二检测 观察1s轨道电子云示意图,判断下列说法正确的是( ) A.一个小黑点表示1个自由运动的电子 B.1s轨道的电子云形状为圆形的面 C.电子在1s轨道上运动像地球围绕太阳旋转 D.1s轨道电子云的点的疏密表示电子在某一位置出现概率的多少 解析:尽管人们不能确定某一时刻原子中电子的精确位置,但能够统计出电子在什么地方出现的概率大,在什么地方出现的概率小。为了形象地表示电子在原子核外空间的分布状况,人们常用小黑点的疏密程度来表示电子在核外出现概率的大小,点密表示电子在那里出现的概率大,反之则小。由图可知,处于1s轨道上的电子在空间出现的概率分布呈球形对称,且电子在原子核附近出现的概率最大,离核越远出现的概率越小。图中的小黑点不表示电子,而表示电子曾经出现过的位置。 答案:D 2.2015·广东高二检测下列说法正确的是( ) A.s能级的能量总小于p能级的能量 B.2s的电子云半径比1s电子云半径大,说明2s的电子云比1s的多 C.当电子排布在同一能级的不同轨道时,电子总是先占满一个轨道(1个原子轨道最多只能容纳两个电子,且自旋状态相反),然后再占据其他原子轨道 D.n f能级中最多可容纳14个电子 解析:同一能层中,s能级的能量小于p能级的能量,不同能层就有可能s能级(较高能层)的能量高于p能级(较低能层)的能量,A错误;2s的电子云半径比1s电子云半径大,说明2s的电子在离原子核较远的区域出现的概率比1s的电子大,B错误;当电子排布在同一能级的不同轨道时,电子总是先占据不同的原子轨道而且自旋状态相同,C错误;n f能级有7个原子轨道,每一个原子轨道最多容纳两个电子,D正确。 答案:D 3.2015·山东日照高二检测第4层所含有的原子轨道种类数、原子轨道数目和最多容纳电子数分别为( ) A.3、9、18 B.4、12、24 C.5、16、32 D.4、16、32 解析:第四能层含s、p、d、f四种原子轨道,原子轨道数为1+3+5+7=16,每个轨道最多容纳2个电子且自旋状态相反,即最多共容纳电子数为16×2=32个。 答案:D 4.2015·河南高二检测当镁原子由1s22s22p63s2→1s22s22p63p2时,以下认识正确的是( ) A.镁原子由基态转化成激发态,这一过程中吸收能量 B.镁原子由激发态转化成基态,这一过程中释放能量 C.转化后位于p能级上的两个电子处于同一轨道,且自旋状态相同 D.转化后镁原子与硅原子电子层结构相同,化学性质相似 解析:基态Mg的电子排布式为1s22s22p63s2,由基态转化成激发态,电子能量增大,需要吸收能量,故A正确;镁原子由ls22s22p63s2→1s22s22p63p2时,由基态转化成激发态,故B错误;同一轨道不可能有自旋状态相同的两个电子,故C错误;转化后镁原子与硅原子电子层 1--36号元素电子排布式与轨道表示式电子排布式电子排布简式价电子排布式轨道表示式 氢H :1s1 1s1 1s1 氦He:1s2 [He]1s2 锂Li :1s22s1 [He]2s1 2s1 铍Be:1s22s2[He]2s2 2s2 硼B :1s22s22p1 [He]2s22p1 2s22p1 碳C :1s22s22p2[He]2s22p2 2s22p2 氮N :1s22s22p3[He]2s22p3 2s22p3 氧O :1s22s22p4 [He]2s22p4 2s22p4 氟F :1s22s22p5 [He]2s22p5 2s22p5 氖Ne:1s22s22p6 [Ne] 2s22p6 钠Na:1s22s22p63s1 [Ne]3s1 3s1 镁Mg:1s22s22p63s2 [Ne]3s2 3s2 铝Al :1s22s22p63s23p1 [Ne]3s23p1 3s23p1 硅Si :1s22s22p63s23p2[Ne]3s23p2 3s23p2 磷P :1s22s22p63s23p3[Ne]3s23p3 3s23p3 硫S :1s22s22p63s23p4[Ne]3s23p43s23p4氯Cl:1s22s22p63s23p5[Ne]3s23p5 3s23p5 氩Ar:1s22s22p63s23p6[Ar] 3s23p6 钾K :1s22s22p63s23p64s1[Ar] 4s1 4s1 钙Ca:1s22s22p63s23p64s2 [Ar] 4s2 4s2 钪Sc:1s22s22p63s23p63d14s2[Ar] 3d14s2 3d14s2 钛Ti :1s22s22p63s23p63d24s2[Ar] 3d24s2 3d24s2 矾V :1s22s22p63s23p63d34s2[Ar] 3d34s23d34s2 铬Cr:1s22s22p63s23p63d54s1[Ar] 3d54s13d54s1 锰Mn:1s22s22p63s23p63d54s2[Ar] 3d54s2 3d54s2 铁Fe:1s22s22p63s23p63d64s2 [Ar] 3d64s23d64s2 钴Co:1s22s22p63s23p63d74s2[Ar] 3d74s2 3d74s2 镍Ni:1s22s22p63s23p63d84s2[Ar] 3d84s2 3d84s2 原子核外电子排布的原理 处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生。 核外电子排布原理一——能量最低原理 电子在原子核外排布时,要尽可能使电子的能量最低。怎样才能使电子的能量最低呢?比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕。这是因为物体在越高处具有的势能越高,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用。电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态。当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),但是它总有时时刻刻想回到基态的趋势。一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的。这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、3d、4s、4p…… 原子轨道能量的高低(也称能级)主要由主量子数n和角量子数l决定。当l相同时,n越大,原子轨道能量E越高,例如E1s<E2s<E3s;E2p<E3p <E4p。当n相同时,l越大,能级也越高,如E3s<E3p<E3d。当n和l 都不同时,情况比较复杂,必须同时考虑原子核对电子的吸引及电子之间的相互排斥力。由于其他电子的存在往往减弱了原子核对外层电子的吸引力,从而使多电子原子的能级产生交错现象,如E4s<E3d,E5s<E4d。Pauling根据光谱实验数据以及理论计算结果,提出了多电子原子轨道的近似能级图。用小圆圈代表原子轨道,按能量高低顺序排列起来,将轨道能量相近的放在同一个方框中组成一个能级组,共有7个能级组。电子可按这种能级图从低至高顺序填入。 元素的电子是由元素核电荷数决定的。 现在发现的都在7层内。而每层一般有4个亚层,即s p d f四个亚层,s有1条轨道,p有3条轨道,d有5条轨道,f有7条轨道,每条轨道中最多容纳两个向相反方向旋转的电子。但是第一层没有p d f层,第二层没有d f层,第三层没有f 层,第四层后四个亚层都有。 电子层从内到外依次是s p d f层,其中s层最多2个电子,p层最多6个电子,d层最多10个电子,而f层最多14个电子。例如氢原子的电子排布是1s1,锂原子电子排布是1s22s1,氧的是1s2 2s2 2p4,而钠的是1s2 2s2 2p6 3s1,等等。 基本介绍 表示原子核外电子排布的图式之一。有七个电子层,分别用1、2、3、4、5、6、7等数字表示K、L、M、N、O、P、Q等电子层,用s、p、d、f等符号分别表示各电子亚层,并在这些符号右上角用数字表示各亚层上电子的数目。如氧原子的电子排布式为1s22s22p4。迄今为止,只发现了7个电子层! 原子核外电子排布的原理 处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前3 6号元素里,没有例外的情况发生。 核外电子排布原理一——最低能量原理 电子在原子核外排布时,要尽可能使电子的能量最低。怎样才能使电子的能量最低呢?比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕。这是因为物体在越高处具有的势能越高,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用。电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态。当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),但是它总有时时刻刻想回到基态的趋势。一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的。这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、3d、4s、4p…… 原子轨道能量的高低(也称能级)主要由主量子数n和角量子数l决定。当l相同时,n越大,原子轨道能量E越高,例如E1s<E2s<E3s;E2p<E3p<E4p。当n相同时,l越大,能级也越高,如E3s<E3p<E3d。当n和l都不同时,情况比较复杂,必须同时考虑原子核对电子的吸引及电子之间的相互排斥力。由于其他电子的存在往往减弱了原子核对外层电子的吸引力,从而使多电子原子的能级产生交错现象,如E 1.描述原子中电子运动状态的四个量子数的物理意义各是什么?它们的可能取 值是什么? 2.微观粒子的运动特征是什么并对每个特征进行简单的解释。 3.根据原子轨道近似能级图,指出下表中各电子层中的电子数有无错误,并说明 (1)s电子绕核运动,其轨道为一圆周,而p电子是走∞形的; (2)主量子数n为1时,有自旋相反的两条轨道; (3)主量子数n为4时,其轨道总数为16,电子层电子最大容量为32; (4)主量子数n为3时,有3s,3p,3d三条轨道。 5.下列各组量子数哪些是不合理的,为什么? (1)n = 2,l = 1,m = 0 (2)n = 2,l = 2,m = –1 (3)n = 3,l = 0,m = 0 (4)n = 3,l = 1,m = 1 (5)n = 2,l = 0,m = –1 (6)n = 2,l = 3,m = 2 6.已知M2+离子3d轨道中有5个电子,试推出:(1)M原子的核外电子排布;(2)M原子的最外层和最高能级组中电子数;(3)M元素在周期表中的位置。 7.写出原子序数为24的元素的名称、符号及其基态原子的电子结构式,并用四个量子数分别表示每个价电子的运动状态。 8. 说明下列各对原子中哪一种原子的第一电离能高,为什么? S与P Al与Mg Sr与Rb Cu与Zn Cs与An Rn与At 9.对某一多电子原子来说,(1)下列原子轨道3s、3p x、3p y、3p z、3d xy、3d xz、3d yz、3d z2、3d x2-y2中,哪些是等价(简并)轨道? (2)具有下列量子数的电子,按其能量由低到高排序,如能量相同则排在一起(可用“<”、“=”符号表示): (A) 3、2、1、+ 1 2;(B) 4、3、2、- 1 2 ;(C) 2、0、0、+ 1 2 ; (D) 3、2、0、+ 1 2;(E) 1、0、0、- 1 2 ;(F) 3、1、1、+ 1 2 。 10.确定一个基态原子的电子排布应遵循哪些规则?下列电子排布式各违犯了哪一规则? (1) 7N:1s2 2s2 2p x2 2p y1(2) 28Ni :1s2 2s2 2p6 3s2 3p6 3d10 (3)22Ti:1s2 2s2 2p6 3s2 3p10 课题16原子结构核外电子排布原理学习任务1原子结构核素 一、原子构成 1.构成原子的微粒及其作用 原子(A Z X)?????原子核???? ?质子(Z 个)——决定元素的种类中子[(A -Z )个]在质子数确定后 决定原子种类同位素核外电子(Z 个)——最外层电子数决定元素 的化学性质 2.微粒之间的关系 (1)原子中:质子数(Z )=核电荷数=核外电子数。 (2)质量数(A )=质子数(Z )+中子数(N )。 (3)阳离子的核外电子数=质子数-阳离子所带的电荷数。 (4)阴离子的核外电子数=质子数+阴离子所带的电荷数。 3.微粒符号周围数字的含义 4.两种相对原子质量 (1)原子(即核素)的相对原子质量:一个原子(即核素)的质量与一个12C原子质量的1 12的 比值。一种元素有几种同位素,就有几种不同核素的相对原子质量。 (2)元素的相对原子质量:按该元素各种天然同位素原子所占的原子百分比(丰度)算出的平均值。例如:A r(Cl)=A r(35Cl)×a%+A r(37Cl)×b%。 二、元素、核素、同位素 1.元素、核素、同位素的关系 2.同位素的特征 (1)同一元素的各种核素的中子数不同,质子数相同,化学性质几乎相同,物理性质差异较大。 (2)同一元素的各种稳定核素在自然界中所占的原子百分比(丰度)不变。 同位素的“六同三不同” 3.氢元素的三种核素 1 H:用字母H表示,名称为氕,不含中子; 1 2 H:用字母D表示,名称为氘或重氢,含有1个中子;1 3 H:用字母T表示,名称为氚或超重氢,含有2个中子。1 4.几种重要核素的用途 1.核外电子排布规律 2.原子结构示意图 二、原子核外电子的排布 [教学目标] 1、知识与技能目标 (1)了解元素原子核外电子排布的基本规律,能用原子(离子)结构示意图表示原子(离子)的核外电子排布 (2)了解原子核外电子的排布规律,元素的金属性和非金属性,元素的化合价、原子半径等随元素核电核数呈周期性变化的规律,认识元素周期率。 2、过程与方法目标 培养学生分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。3.情感、态度与价值观 (1)初步体会物质构成的奥秘,培养学生的抽象思维能力、想像力和分析推理能力; (2)树立“结构决定性质”、“物质的粒子性”等辩证唯物主义观点。 [教学重、难点] 构成原子的微粒间的关系和核外电子排布规律。培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。了解假说、模型等科学研究方法和科学研究的历程。 [教学过程] [复习提问] 1.构成原子的粒子有哪些,它们之间有何关系? 2.为什么原子不显电性? 3.为什么说原子的质量主要集中原子核上? [引言]我们已经知道,原子是由原子核和电子构成的,原子核的体积很小,仅占原子体积的几千亿分之一,电子在原子内有“广阔”的运动空间。在这“广阔”的空间里,核外电子是怎样运动的呢? [板书]原子核外电子的排布 [交流与讨论1]原子在核外是怎样运动的? [打开书P78页,阅读教材,核外电子是怎么排布的?用两个字概括。 【讲解】原子中的核外电子运动虽然没有固定的轨道(太阳系中的地球等有运动轨道),但却有经常出现的区域,这些区域叫做电子层。 【过渡】电子究竟是怎样分层排布的呢? 【投影】讲解:核外电子最少的有1层,最多的有7层,最靠近原子核的是第一层(K 层)……第一层的能量最低,第七层能量最高。[归纳]按能量高低分层排布。(能量由低到高) K L M N O P Q …… [1]H氢 1s1 [2]He氦 1s2 [3]Li锂 1s22s1 [4]Be铍 1s22s2 [5]B硼 1s22s22p1 [6]C碳 1s22s22p2 [7]N氮 1s22s22p3 [8]O氧 1s22s22p4 [9]F氟 1s22s22p5 [10]Ne氖 1s22s22p6 [11]Na钠 1s22s22p63s1 [12]Mg镁 1s22s22p63s2 [13]Al铝 1s22s22p63s23p1 [14]Si硅 1s22s22p63s23p2 [15]P磷 1s22s22p63s23p3 [16]S硫 1s22s22p63s23p4 [17]Cl氯 1s22s22p63s23p5 [18]Ar氩 1s22s22p63s23p6 [19]K钾 1s22s22p63s23p64s1 [20]Ca钙 1s22s22p63s23p64s2 [21]Sc钪 1s22s22p63s23p63d14s2 [22]Ti钛 1s22s22p63s23p63d24s2 [23]V钒 1s22s22p63s23p63d34s2 [24]Cr铬 1s22s22p63s23p63d54s1 [25]Mn锰 1s22s22p63s23p63d54s2 [26]Fe铁 1s22s22p63s23p63d64s2 [27]Co钴 1s22s22p63s23p63d74s2 [28]Ni镍 1s22s22p63s23p63d84s2 [29]Cu铜 1s22s22p63s23p63d104s1 [30]Zn锌 1s22s22p63s23p63d104s2 [31]Ga镓 1s22s22p63s23p63d104s24p1 [32]Ge锗 1s22s22p63s23p63d104s24p2 [33]As砷 1s22s22p63s23p63d104s24p3 [34]Se硒 1s22s22p63s23p63d104s24p4 [35]Br溴 1s22s22p63s23p63d104s24p5 [36]Kr氪 1s22s22p63s23p63d104s24p6 一、教学目标 (一)知识与技能目标 引导学生了解原子核外电子的排布规律,使他们能画出1~18号元素的原子结构示意图;了解原子的最外层电子排布与元素的原子得、失电子能力和化合价的关系。 (二)过程与方法目标 通过对原子核外电子的排布规律问题的探讨,培养学生分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。 (三)情感态度与价值观目标 培养他们的科学态度和科学精神,体验科学研究的艰辛与喜悦。 二、教学重点、难点 (一)知识上重点、难点:核外电子排布规律。 (二)方法上重点、难点:培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。 三、教学过程 【引言】 首先,请同学们观看一段视频 ——这是著名的α粒子散射实验,卢瑟福就是通过这个实验,提出了原子是由原子核和电子构成的核式结构模型的。视频中还介绍了原子核的体积很小,核外有着非常广阔的相对空间,电子就是在这非常“广阔”的空间里作高速的绕核运动。那么电子的绕核运动还有着哪些特征?这些运动的电子在核外又是怎样排布的?这就是本节课我们所要研究的内容。 【板书】二、核外电子排布 【讲述】同学们请看,屏幕上展示的是核外电子的运动特征,我们共同看一下。 (1)质量很小(9.109×10-31kg)。 (2)运动速度快(接近光速)。 (3)运动空间范围小(直径约10-10m)。 【过渡】根据核外电子的运动特征,请同学们充分发挥想象力,电子在核外的运动到底是一个什么样的情形? 【设想猜测】电子在核外的运动到底是一个什么样的情形? 【学生活动】略。 【质疑一】电子的绕核运动有没有固定的轨迹? 【质疑二】电子的绕核运动没有固定的轨迹,是不是说电子绕核运动就没有规律? 【讲述并投影】电子在原子核外的这个极小的空间内作高速运动,时而出现在离核远处,时而出现在离核近处,我们不能同时测定出电子在某一时刻的位置和速度,但是能从理论上统计出它在原子核外某一范围内出现的机会的多少——这就是我们将要在《物质结构与性质》选修教材中加以学习的电子云。 【过渡】同学们太伟大了!我们研究分析原子结构中电子的运动情况,用了不到10 分钟的时间,而科学家们却用去了一个多世纪!让我们踏着科学的足迹,重温这段曲折、坎坷、震撼世人的科学探索过程! 【投影】历史回眸 1.最早提出“原子”一词的是古希腊哲学家德谟克利特,他认为万物都是由原子组成的,原子是不可分割的最小微粒。但是很可惜,由于种种原因,这一伟大的学说没有为人们所重视,被忽视了20多个世纪——这是科学界的一大憾事! 2.直到1803年英国科学家道尔顿通过对当时化学实验的现象分析,创立了近代原子学说,第一次将原子学说从推测转变为科学概念。很长一段时间,人们都认为原子就像道尔顿说得那样,是一个小得不能再小的实心球,里面再也没有什么花样了。 原子核外电子排布 1 氢H 1 2 氦He 2 3 锂Li 2 1 4 铍Be 2 2 5 硼 B 2 3 6 碳 C 2 4 7 氮 N 2 5 8 氧 O 2 6 9 氟 F 2 7 。 10 氖 Ne 2 8 11 钠 Na 2 8 1 12 镁 Mg 2 8 2 13 铝 Al 2 8 3 14 硅 Si 2 8 4 15 磷 P 2 8 5 16 硫 S 2 8 6 17 氯 Cl 2 8 7 18 氩 Ar 2 8 8 % 19 钾 K 2 8 8 1 20 钙 Ca 2 8 8 2 21 钪 Sc 2 8 9 2 22 钛 Ti 2 8 10 2 23 钒 V 2 8 11 2 24 铬 Cr 2 8 13 1 25 锰 Mn 2 8 13 2 26 铁 Fe 2 8 14 2 27 钴 Co 2 8 15 2 28 镍 Ni 2 8 16 2 29 铜 Cu 2 8 18 1 & 30 锌 Zn 2 8 18 2 31 镓 Ga 2 8 18 3 32 锗 Ge 2 8 18 4 33 砷 As 2 8 18 5 34 硒 Se 2 8 18 6 35 溴 Br 2 8 18 7 36 氪 Kr 2 8 18 8 37 铷 Rb 2 8 18 8 1 38 锶 Sr 2 8 18 8 2 39 钇 Y 2 8 18 9 2 ) 40 锆 Zr 2 8 18 10 2 41 铌 Nb 2 8 18 12 1 42 钼 Mo 2 8 18 13 1 43 锝 Tc 2 8 18 13 2 44 钌 Ru 2 8 18 15 1 45 铑 Rh 2 8 18 16 1 46 钯 Pd 2 8 18 18 47 银 Ag 2 8 18 18 1 48 镉 Cd 2 8 18 18 2 49 铟 In 2 8 18 18 3 50 锡 Sn 2 8 18 18 4 ) 51 锑 Sb 2 8 18 18 5 52 碲 Te 2 8 18 18 6 53 碘 I 2 8 18 18 7 54 氙 Xe 2 8 18 18 8 55 铯 Cs 2 8 18 18 8 1 56 钡 Ba 2 8 18 18 8 2 57 镧 La 2 8 18 18 9 2 〖镧系〗 58 铈 Ce 2 8 18 19 9 2 〖镧系〗 59 镨 Pr 2 8 18 20 9 2 〖镧系〗 60 钕 Nd 2 8 18 21 9 2 〖镧系〗 — 61 钷 Pm 2 8 18 22 9 2 〖镧系〗 62 钐 Sm 2 8 18 23 9 2 〖镧系〗 63 铕 Eu 2 8 18 24 9 2 〖镧系〗 64 钆 Gd 2 8 18 25 9 2 〖镧系〗 65 铽 Tb 2 8 18 26 9 2 〖镧系〗 66 镝 Dy 2 8 18 27 9 2 〖镧系〗 67 钬 Ho 2 8 18 28 9 2 〖镧系〗 68 铒 Er 2 8 18 29 9 2 〖镧系〗 69 铥 Tm 2 8 18 30 9 2 〖镧系〗 70 镱 Yb 2 8 18 31 9 2 〖镧系〗 71 镥 Lu 2 8 18 32 9 2 〖镧系〗 、 72 铪 Hf 2 8 18 32 10 2 73 钽 Ta 2 8 18 32 11 2 74 钨 W 2 8 18 32 12 2原子结构 核外电子排布
核外电子排布、原子结构示意图、电子式、8电子稳定结构
高中化学 1.1.2《基态原子的核外电子排布 原子轨道》课后作业(含解析)新人教版选修3
1--36号元素电子排布式与轨道表示式(完美版)
原子核外电子排布的原理
无机化学电子排布式的写法
原子结构及电子排布-习题
2021版新高考化学(人教版)一轮复习课题16 原子结构 核外电子排布原理
教案《原子核外电子的排布》
电子排布式与轨道表示式
原子核外电子排布教学设计
原子核外电子排布