
?论著?文章编号:1007-8738(2005)03-0337-03
阳离子交换一步层析法纯化抗gp130单克隆抗体
马泓冰,庄羽美,徐 颖,郁健锋,刘 琳,李文香,张学光3(苏州大学医学生物技术研究所,江苏苏州215007)
收稿日期:2004-11-18; 修回日期:2005-01-20
基金项目:江苏省临床医学免疫重点实验室资助项目(No .200319);
苏州大学医学发展基金资助项目(No .EE120032)
作者简介:马泓冰(1967-),女,辽宁沈阳人,讲师,硕士生.
Tel:(0512)65125245;Email:ma_hongbing@yahoo https://www.doczj.com/doc/5b10003803.html,
3Corres ponding author,Email:s mbxuegz@public1.sz .js .cn
One 2step puri f i cati on of monoclonal anti 2body aga i n st gp130by cati on exchange li qui d chro matography
MA Hong 2bing,ZHUAN G Yu 2m ei,XU Ying,YU J ian 2feng,L I U L in,L I W en 2xiang,ZHAN G X ue 2guang 3
I nstitute of Medical B i otechnol ogy,Suzhou University,Suzhou 215007,China
[Abstract] A I M :To de ve l o p a o ne 2s tep p u ri fi ca ti o n
m e tho d o f a n ti 2gp130m o no c l o na l an ti bo dy (mAb )B 2S12fr om m o u se a sc ite s .M ETHOD S:Afte r filtra ted by ce n tri fu 2ga ti o n,the a sc ite s sam p l e w a s l o a de d o n a ca ti o n e xchange co l um n a nd p u ri fi ed by u si ng i o n 2streng th g ra d i en t e l u ti o n buffe r .
The e ffe c ts o f pH o f the l o a d i ng buffe r and i o n
s tre ng th g ra d i en ts o f the e l u ti o n buffe r o n the p u rity o f a n ti 2bo dy o b ta i ne d w e re i nve s ti ga ted.The a n ti bo dy ’s b i o l o g i ca l a c ti vity w a s te sted by M TT co l o ri m e try .RESU L TS:I t w a s show n tha t the mAb B 2S12w ith a p u rity o f o ve r 90%co u l d be a ch i eved by u si ng 20mm o l/L HEPES buffe r (pH 4.0)a s l o a d i ng buffe r a nd 0-1.0m o l/L N aC l a s e l u ti o n buffe r .The t o ta l re co ve ry ra te o f the mAb w a s 52%.The p u ri fi e d a n ti 2bo dy co u l d s ti m u l a te the p r o li fe ra ti o n o f XG 22ce ll li ne.CO N 2CL US I O N:The e s ta b lishe d o ne 2s tep p u ri fi ca ti o n m e tho d w a s s i m p l e and su ita b l e fo r p u ri fi ca ti o n o f mAb B 2S12.[Keywords] ca ti o n exchange li qu i d ch r om a t o g rap hy;p u ri 2
fi ca ti o n;m o no c l o na l a n ti bo dy
[摘要] 目的:建立从小鼠腹水中纯化抗gp130单克隆抗体(mAb )B 2S12的一步层析方法。方法:小鼠mAb 腹水样品经
离心后,进行阳离子交换层析柱纯化。检查了上样缓冲液的
pH 值和洗脱液的离子强度梯度对mAb 纯度的影响。纯化后mAb 的生物学活性用MTT 比色法检测。结果:在pH 4.0、20mmol/L HEPES 缓冲液条件下上样,用0~1.0mol/L 的NaCl 梯度洗脱,可获得纯度超过90%的mAb B 2S12,回收率为52%。纯化后的mAb 对XG 22细胞有明显的促增殖作用。结论:建立的一步纯化方法操作简便,所得mAb 的纯度高及生物学活性好。
[关键词] 阳离子交换层析法;纯化;单克隆抗体[中图分类号] R392.11 [文献标识码] B
gp130分子是I L 26、I L 211、制瘤素及白血病抑制因子等的信号传导链
[1]
。为了更好地了解gp130分
子与上述因子的相互作用,本研究组制备了抗gp130分子的单克隆抗体(mAb )B 2S12,并通过G 蛋白Sephar ose 亲和层析法纯化
[2]
。但该纯化方法的成本
高、配基易泄漏、不宜于规模化生产,其他纯化抗体的方法如盐析法、辛酸法[3]
等难于获得高纯度的目
的抗体,须与其他纯化方法联用
[4]
;而羟基磷灰石层
析法
[5]
及凝胶色谱法
[6]
则操作繁琐。为此,本研究
中我们采用S6强阳离子交换层析柱,建立了一种经一步盐离子梯度洗脱便可纯化抗gp 2130mAb B 2S12的方法,该法操作简单,所得mAb 的纯度高、生物学活性好。
1 材料和方法
1.1 材料 mAb B 2S12的小鼠腹水由本室制备。XG 22多发性骨髓瘤细胞株由本室建立
[7]
。B i oLogic
DuoFl ow 中高压层析仪(检测波长为280nm )、S6强
阳离子交换柱(柱床体积为1.0mL )、M ini 2Pr otean 3电泳仪、S martSpec 3000紫外可见分光光度计、Gel Doc 1000凝胶成像系统及蛋白质Lowry 法定量试剂
盒,均为B i o 2Rad 公司产品。其他试剂为分析纯试剂。1.2 方法
1.2.1 腹水mAb B 2S12的纯化 采用S6强阳离子
交换层析柱,上样缓冲溶液(A )为20mmol/L HEPES (pH 依实验条件不同而分别调整为4.0、5.0、6.0);
洗脱缓冲溶液(B )为上样缓冲溶液加1.0mol/L NaCl 。取抗gp130mAb B 2S12的腹水20.0mL,加入
适量二氧化硅粉末振荡30m in,以9000r/m in 离心20m in 。取上清过0.22mm 滤膜,置4℃待用。500μL 样品上样后,层析柱的洗脱步骤为:用100%
A液洗脱5个柱体积(5CV),用0%~100%B液洗脱5CV,再用100%B液洗脱4CV,流速为2.0mL/ m in,收集蛋白峰。
1.2.2 纯化的mAb B2S12的S DS2P AGE鉴定 取纯化的mAb B2S12样品于还原条件下进行S DS2P AGE,分离胶的浓度为120g/L,浓缩胶的浓度为50g/L,电泳后以考马斯亮蓝R250染色,再经凝胶成像仪扫描鉴定mAb B2S12的纯度。mAb B2S12的浓度采用Lo wry法试剂盒进行定量。
1.2.3 mAb B2S12促进XG22细胞增殖的作用 将XG22细胞(密度依实验要求而定)以无菌P BS洗涤2遍,然后以无I L26的培养基在37℃培养2h。以无菌P BS洗涤1遍后,按每孔含1.5×105个细胞加入到96孔板中,加入分别经阳离子交换层析及Pr otein G 亲和层析纯化的不同浓度的mAb B2S12,于37℃、50mL/L CO2条件下培养5d。每孔加入5g/L MTT 溶液20μL于37℃继续孵育5h。收集细胞,再每孔中加入150μL酸化异丙醇振荡10m in,用酶联免疫检测仪于波长490n m测定各孔的吸光度(A)值。
2 结果
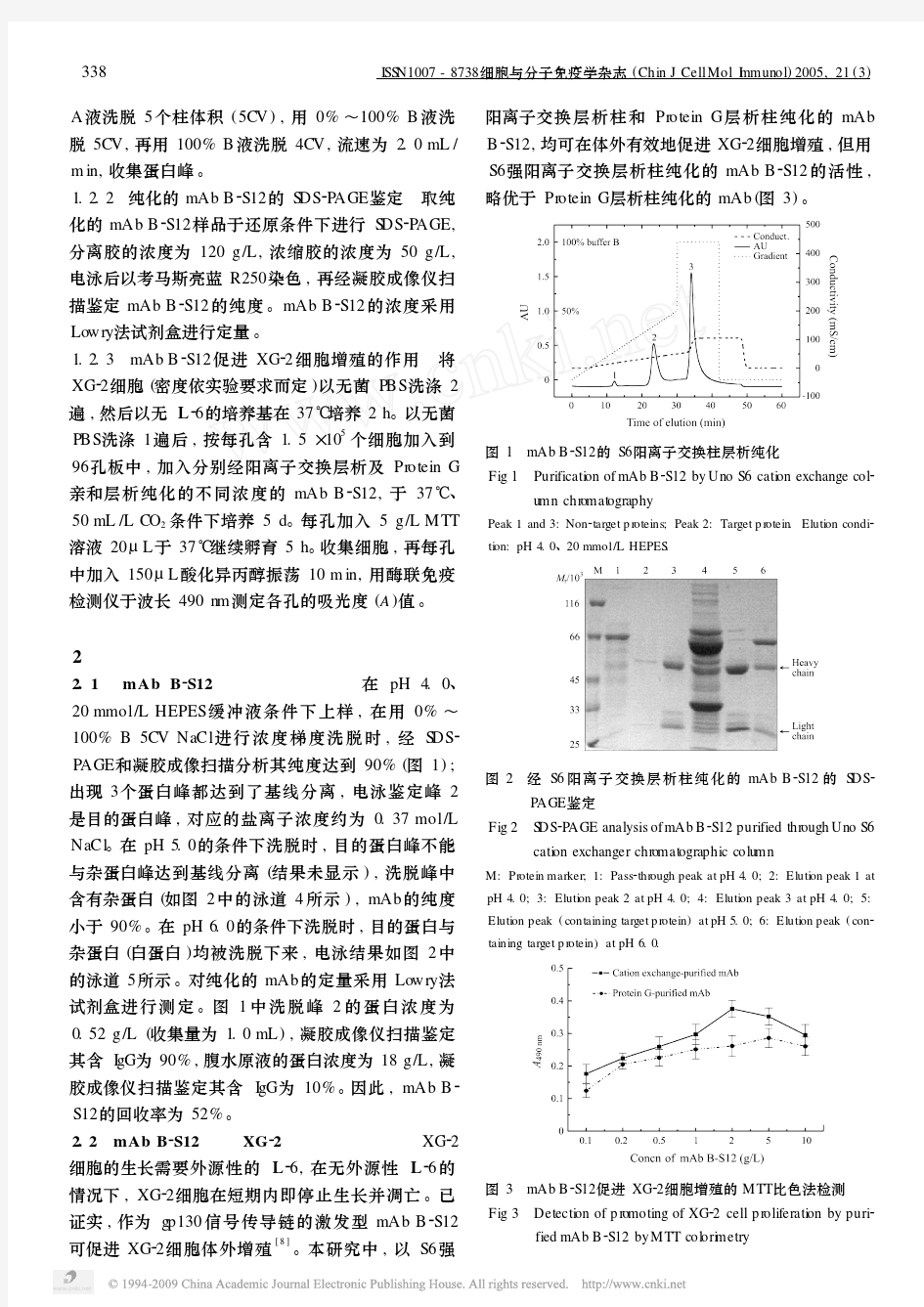
2.1 mAb B2S12的纯化及鉴定 在pH4.0、20mmol/L HEPES缓冲液条件下上样,在用0%~100%B5CV NaCl进行浓度梯度洗脱时,经S DS2 P AGE和凝胶成像扫描分析其纯度达到90%(图1);出现3个蛋白峰都达到了基线分离,电泳鉴定峰2是目的蛋白峰,对应的盐离子浓度约为0.37mol/L NaCl。在pH5.0的条件下洗脱时,目的蛋白峰不能与杂蛋白峰达到基线分离(结果未显示),洗脱峰中含有杂蛋白(如图2中的泳道4所示),mAb的纯度小于90%。在pH6.0的条件下洗脱时,目的蛋白与杂蛋白(白蛋白)均被洗脱下来,电泳结果如图2中的泳道5所示。对纯化的mAb的定量采用Lowry法试剂盒进行测定。图1中洗脱峰2的蛋白浓度为0.52g/L(收集量为1.0mL),凝胶成像仪扫描鉴定其含I gG为90%,腹水原液的蛋白浓度为18g/L,凝胶成像仪扫描鉴定其含I gG为10%。因此,mAb B2 S12的回收率为52%。
2.2 mAb B2S12促进XG22细胞增殖的作用 XG22细胞的生长需要外源性的I L26,在无外源性I L26的情况下,XG22细胞在短期内即停止生长并凋亡。已证实,作为g p130信号传导链的激发型mAb B2S12可促进XG22细胞体外增殖[8]。本研究中,以S6强阳离子交换层析柱和Pr otein G层析柱纯化的mAb B2S12,均可在体外有效地促进XG22细胞增殖,但用S6强阳离子交换层析柱纯化的mAb B2S12的活性,略优于Pr otein G层析柱纯化的mAb(图3)
。
图1 mAb B2S12的S6阳离子交换柱层析纯化
Fig1 Purificati on of mAb B2S12by Uno S6cati on exchange col2 u mn chr omat ography
Peak1and3:Non2target p r oteins;Peak2:Target p r otein.Eluti on condi2 ti on:pH4.0、20mmol/L HEPES
.
图2 经S6阳离子交换层析柱纯化的mAb B2S12的S DS2 P AGE鉴定
Fig2 S DS2P AGE analysis of mAb B2S12purified thr ough Uno S6 cati on exchanger chr omat ographic colu mn
M:Pr otein marker;1:Pass2thr ough peak at pH4.0;2:Eluti on peak1at pH4.0;3:Eluti on peak2at pH4.0;4:Eluti on peak3at pH4.0;5: Eluti on peak(containing target p r otein)at pH5.0;6:Eluti on peak(con2 taining target p r otein)at pH6.
0.
图3 mAb B2S12促进XG22细胞增殖的MTT比色法检测
Fig3 Detecti on of p r omoting of XG22cell p r oliferati on by puri2 fied mAb B2S12byMTT col ori m etry
3 讨论
使用阳离子交换层析法纯化mAb之关键是,选择合适的上样缓冲液、洗脱液的pH值和离子强度。上样时,应使mAb带有足够的正电荷而与离子交换剂结合,同时,使杂蛋白尽可能地不被离子交换剂所保留,从而便可较好地除去杂蛋白并提高柱子的载量。
本研究中所要纯化的mAb B2S12的等电点不知,故我们试用了不同的pH值条件(上样/洗脱液)进行纯化。在pH4.0条件下,目的蛋白(I gG)被离子交换柱全部保留,而杂蛋白(主要是白蛋白)被部分保留。但由于I gG和杂蛋白与离子交换树脂的交换结合能力不同,在进行梯度洗脱时,结合能力弱的杂蛋白先被洗脱下来,I gG约在0.37mol/L NaCl的条件下被洗脱下来;而结合能力强的杂蛋白则需在1.0mol/L NaCl高离子强度的条件下才能被洗脱下来,而使目的蛋白与杂蛋白完全分离。在pH5.0条件下,腹水样品中的I gG也可与离子交换柱结合,但在进行梯度洗脱时,I gG不能与杂蛋白达到基线分离,洗脱峰中含有杂蛋白。在pH6.0时,目的蛋白I gG可部分穿过阳离子交换层析柱,在进行梯度洗脱时,I gG不能与杂蛋白达到基线分离,而被共同洗脱下来。上述结果表明,随着上样缓冲液pH值的升高,目的蛋白与阳离子层析柱的结合能力逐渐下降,从而证实该mAb的等电点是偏酸性的(p I<6.5)。
mAb B2S12的最佳分离条件是,在pH4.0、20mmol/L HEPES的条件下上样,以0~1.0mol/L 的NaCl进行浓度梯度洗脱。在此酸度条件下,大部分的蛋白质可失去活性,但mAb B2S12却可保持良好的生物学活性,通过其在体外可有效地促进XG22细胞增殖而说明。
总之,本研究中建立的一步纯化mAb的阳离子交换法,具有制备条件温和、简便、快速(通常只需要1h即可完成纯化过程),且纯化的mAb活性好,为进一步规模化应用提供了实验依据。
参考文献:
[1]Kishi m ot o T,Kiru S,NarazakiM,et al.I nterleukin26fa m ily of cyt o2
kines and gp130[J].B lood,1995,86:1234-1254.
[2]邓瑞春,白云秀,张明伟,等.G蛋白亲和色谱法纯化动物血清、
抗体效果比较[J].生物技术通讯,1999,10(3):198-200. [3]McKinney MM,Parkins on A.A si m p le,non2chr omat ographic p r oce2
dure t o purify i m munogl obulins fr om serum and ascites fluid[J].J I m2 m unol M ethods,1987,96:271-278.
[4]Russ o C,Callegar o L,Lanza E,et al.Purificati on of I gG monocl onal
antibody by cap rylic acid p reci p itati on[J].J I mm unol M ethods, 1983,65:269-271.
[5]Larry HS,Vanderlaan M,Juarez2Salinas H.One2step purificati on of
mouse monocl onal antibody fr om ascites fluid by hydr oxylapatite chr o2 mat ography[J].J I mm unol M ethods,1985,76:157-169.
[6]刘 利,刘智广,刘成刚,等.高效凝胶色谱一步法制备级纯化
单克隆抗体[J].单克隆抗体通讯,1995,11(1):52-55.
[7]Zhang XG,Gaillard JP,Robillard N,et al.Rep r oducible obtaining of
human myel oma cell lines as a model f or tumor ste m cell study in hu2 man multi p le myel oma[J].B lood,1994,83:3654-3663.
[8]顾宗江,陆肇阳,邱玉华,等.gp130单克隆抗体B2S12的生物学
特性研究[J].中华微生物学和免疫学杂志,2000,20(2): 102-105.
(上接336页)
就需要这样的加工方式,以M
r
为62700的前体蛋白,
经过加工,可形成M
r
38000的具有活性蛋白酶[7]。我们推测所获丝氨酸蛋白经类似的加工后,才可能形成具有活性的蛋白酶。而关于嗜水气单胞菌分泌的此种胞外蛋白酶,在本菌的致病过程中的作用,有待于进一步研究。
我们制备的抗ESP30的抗血清可用于检测嗜水气单胞菌上清中ESP30存在的状态,以确定其在分泌出菌体后是否进行了蛋白前体的加工。因此,制备的针对该蛋白酶的多克隆抗体,对于深入研究ESP30蛋白的结构和功能提供了重要的制剂。
参考文献:
[1]Deodhar LP,Saras wathi K,Varudkar A.Aer omonas s pp.and their as2
s ociati on with human diarrheal disease[J].J C lin M icrobiol,1991,29
(5):853-856.
[2]Handfield M,Si m ard P,Couillard M,et al.A ero m onas hydrophila is o2
lated fr om food and drinking water:he magglutinati on,hemolysis,and cyt ot oxicity f or a human intestinal cell line(HT229)[J].A ppl Environ M icrobiol,1996,62(9):3459-3461.
[3]储卫华,陆承平.嗜水气单胞菌胞外蛋白酶的化学修饰[J].中国
生物化学与分子生物学报,2001,17(3):372-375.
[4]黄 勇,陈苏民,陈南春,等.YggG截短蛋白的表达及其抗体的
制备[J].细胞与分子免疫学杂志,2004,20(2):171-173.
[5]Rouille Y,Duguay S J,Lund K,et al.Pr oteolytic pr ocessing mechanis ms
in the bi osynthesis of neur oendocrine peptides:the subtilisin2like pr opr otein convertases[J].Fr ont N eur oendocrinol,1995,16(4):322-361.
[6]Kessler E,Safrin M,Gustin JK,et al.Elastase and the Las A p r otease
of Pseudomonas aeruginosa are secreted with their p r opep tides[J].J
B iol Che m,1998,273(46):30225-30231.
[7]A lbert o C,Javier Y,A lejandr o T,et al.A maj or secreted elastase is
essential for pathogenicity of aero m onas hydrophila[J].Infect and I m2 m un,2000,68(6):3233-3241.
离子交换层析介质的应用 离子交换层析分离纯化生物大分子的过程,主要是利用各种分子的可离解性、离子的净电荷、表面电荷分布的电性差异而进行选择分离的。现已成为分离纯化生化制品、蛋白质、多肽等物质中使用最频繁的纯化技术之一。 子交换层析(Ion Exchange Chromatography 简称为IEC)是以离子交换剂为固定相,依据流动相中的组分离子与交换剂上的平衡离子进行可逆交换时的结合力大小的差别而进行分离的一种层析方法。离子交换层析是目前生物化学领域中常用的一种层析方法,广泛的应用于各种生化物质如氨基酸、蛋白、糖类、核苷酸等的分离纯化。 1.离子交换层析的基本原理: 离子交换层析是通过带电的溶质分子与离子交换层析介质中可交换离子进行交换而达到分离纯化的方法,也可以认为是蛋白质分子中带电的氨基酸与带相反电荷的介质的骨架相互作用而达到分离纯化的方法。 离子交换层析法主要依赖电荷间的相互作用,利用带电分子中电荷的微小差异而进行分离,具有较高的分离容量。几乎所有的生物大分子都是极性的,都可使其带电,所以离子交换层析法已广泛用于生物大分子的分离、中等纯化及精制的各个步骤中。 由于离子交换层析法分辨率高,工作容量大,并容易操作,因此它不但在医药、化工、食品等领域成为独立的操作单元,也已成为蛋白质、多肽、核酸及大部分发酵产物分离纯化的一种重要的方法。目前,在生化分离中约有75%的工艺采用离子交换层析法。 2.离子交换层析介质: 离子交换层析的固定相是离子交换剂,它是由一类不溶于水的惰性高分子聚合物基质通过一定的化学反应共价结合上某种电荷基团形成的。离子交换剂可以分为三部分:高分子聚合物基质、电荷基团和平衡离子。电荷基团与高分子聚合物共价结合,形成一个带电的可进行离子交换的基团。平衡离子是结合于电荷基团上的相反离子,它能与溶液中其它的离子基团发生可逆的交换反应。平衡离子带正电的离子交换剂能与带正电的离子基团发生交换作用,称为阳离子交换剂;平衡离子带负电的离子交换剂与带负电的离子基团发生交换作用,称为阴离子交换剂。在一定条件下,溶液中的某种离子基团可以把平衡离子置换出来,并通过电荷基团结合到固定相上,而平衡离子则进入流动相,这就是离子交换层析的基本置换反应。通过在不同条件下的多次置换反应,就可以对溶液中不同的离子基团进行分离。下面以阴离子交换剂为例简单介绍离子交换层析的基本分离过程。 阴离子交换剂的电荷基团带正电,装柱平衡后,与缓冲溶液中的带负电的平衡离子结合。待分离溶液中可能有正电基团、负电基团和中性基团。加样后,负电基团可以与平衡离子进行可逆的置换反应,而结合到离子交换剂上。而正电基团和中性基团则不能与离子交换剂结合,随流动相流出而被去除。通过选择合适的洗脱方式和洗脱液,如增加离子强度的梯度洗脱。随着洗脱液离子强度的增加,洗脱液中的离子可
精心整理如何筛分混合的阴阳离子交换树脂? 离子交换树脂的工作原理及优缺点分析 将离子性官能基结合在树脂(有机高分子)上的材料,称之为“离子交换树脂”。树脂表面带有磺酸(sulfonic acid) 者,称为阳离子交换树脂,而带有四级氨离子的,则为阴离子交换树脂。由於离子交换树脂可以有效去除水中阴阳离子,所以经常使用於纯水、超纯水的制造程序中。(见下图) 离子交换树脂上的官能基虽可去除原水(Feed water) (Fouling)。方。 原理 软水,这是软化水设备的工作过程。 当树脂上的大量功能基团与钙镁离子结合后,树脂的软化能力下降,可以用氯化钠溶液流过树脂,此时溶液中的钠离子含量高,功能基团会释放出钙镁离子而与钠离子结合,这样树脂就恢复了交换能力,这个过程叫作“再生”。
由于实际工作的需要,软化水设备的标准工作流程主要包括:工作(有时叫做产水,下同)、反洗、吸盐(再生)、慢冲洗(置换)、快冲洗五个过程。不同软化水设备的所有工序非常接近,只是由于实际工艺的不同或控制的需要,可能会有一些附加的流程。任何以钠离子交换为基础的软化水设备都是在这五个流程的基础上发展来的(其中,全自动软化水设备会增加盐水重注过程)。 反洗:工作一段时间后的设备,会在树脂上部拦截很多由原水带来的污物,把这些污物除去后,离子交换树脂才能完全曝露出来,再生的效果才能得到保证。反洗过程就是水从树脂的底部洗入,从顶部流出,这样可以把顶部拦截下来的污物冲走。这个过程一般 需要5-15分钟左右。 吸盐(再生) (只要进水有一定的压力即可) 慢冲洗(置换) 应用 1)水处理 水处理领域离子交换树脂的需求量很大,约占离子交换树脂产量的90%,用于水中的各种阴阳离子的去除。目前,离子交换树脂的最大消耗量是用在火力发电厂的纯水处理上,其次是原子能、半导体、电子工业等。
实验二离子交换法制备纯水 一、实验目的 1.了解离子交换法制纯水的基本原理,掌握其操作方法; 2.掌握水质检验的原理和方法; 二、实验原理 离子交换法是目前广泛采用的制备纯水的方法之一。水的净化过程是在离子交换树脂上进行的。离子交换树脂是有机高分子聚合物,它是由交换剂本体和交换基团两部分组成的。例如,聚苯乙烯磺酸型强酸性阳离子交换树脂就是苯乙烯和一定量的二乙烯苯的共聚物,经过浓硫酸处理,在共聚物的苯环上引入磺酸基(–SO3H)而成。其中的H+可以在溶液中游离,并与金属离子进行交换。 R–SO3H + M+R–SO3M + H+ R:聚合物的本体;–SO3:与本体联结的固定部分,不能游离和交换;M+:代表一价金属离子。阳离子交换树脂可表示为: 如果在共聚物的本体上引入各种胺基,就成为阴离子交换树脂。例如,季胺型强碱性阴离子交换树R–N+(CH3)3OH–,其中OH–在溶液中可以游离,并与阴离子交换。 离子交换法制纯水的原理就是基于树脂和天然水中各种离子间的可交换性。例如,R–SO3H 型阳离子交换树脂,交换基团中的H+可与天然水中的各种阳离子进行交换,使天然水中的Ca2+、Mg2+、Na+、K+等离子结合到树脂上,而H+进入水中,于是就除去了水中的金属阳离子杂质。水通过阴离子交换树脂时,交换基团中的OH–具有可交换性,将HCO3–、Cl–、SO42–等离子除去,而交换出来的OH–与H+发生中和反应,这样就得到了高纯水。 交换反应可简单表示为: 2R–SO3H + Ca(HCO3)2→ (R–SO3)2Ca + 2H2CO3 R–SO3H + NaCl → R–SO3Na + HCl R–N(CH)3OH + NaHCO3→ R–N(CH)3HCO3 + NaOH R–N(CH)3OH + H2CO3→ R–N(CH)3HCO3 + H2O HCl + NaOH → H2O + NaCl 本实验用自来水通过混合阳、阴离子交换树脂来制备纯水。 [实验用品] 仪器:离子交换柱(也可用碱式滴定管代替)。 材料:玻璃纤维(棉花)、乳胶管、螺旋夹、pH试纸。 固体药品:717强碱性阴离子交换树脂、732强酸性阳离子交换树脂。 液体药品:NaOH(2mol·L-1)、HCl(2mol·L-1)、AgNO3(0.1mol·L-1)、NH3–NH4Cl缓冲溶液(pH=10)、铬黑T指示剂。 三、实验步骤 1.树脂的预处理 将717(201×7)强碱性阴离子交换树脂用NaOH(2mol·L-1)浸泡24小时,使其充分转为OH-型(由教师处理)。取OH-型阴离子交换树脂10mL,放入烧杯中,待树脂沉降后倾去碱液。加20mL 蒸馏水搅拌、洗涤、待树脂沉降后,倾去上层溶液,将水尽量倒净,重复洗涤至接近中性(用pH 试纸检验,pH=7~8)。 将732(001×7)强酸性阳离子交换树脂用HCl(2mol·L-1)浸泡24小时,使其充分转为H+型(由教师处理)。取H+型阳离子交换树脂5mL,于烧杯中,待树脂沉降后倾去上层酸液,用蒸馏水洗涤树脂,每次大约20mL,洗至接近中性(用pH试纸检验pH=5~6)。 最后,把已处理好的阳、阴离子交换树脂混合均匀。 2.装柱
离子交换层析柱的装填及处理 一、原理: 有些高分子物质含有一些可以分离的基因,例如-SO3H,-COOH等,因此可以和溶液中的离子产生交换反应。如:R-SO3H+M+ R-S3M+H+ 或R-NH3OH+CL-— R-NH3CL+OH -这类高分子物质通称离子交换剂,其中使用最普遍的是离子交换树脂。由于一定的离子交换剂对不同离子的亲和力不同,因此在洗提过程中,不同的离子在离子交换柱上的迁移速度也不同,最后得到分离。 二、目的与要求: 本实验是采用Zerolit225型阳离子交换树脂所装的柱,选以特定的PH缓冲洗脱液来分离含有两个性质不同的氨基酸溶液。通过实验要求掌握装柱、上样、洗脱、收集等离子交换柱层析技术的要点。 三、仪器与装置: 玻璃层析柱:长19cm,内径1、2cm,3# 砂芯。H L-2型恒流泵。H D-4型电脑核酸蛋白检测仪。B S-100A自动部份收集器。 250ml烧杯。 1ml吸管。 水浴锅。 72型(或721型)分光光度计。
四、试剂与药品: 树脂:Zerolit225型阳离子交换树脂。 洗脱液:0、45N,PH5、3柠檬酸缓冲液,取285g柠檬酸 (C6O7H8?H2O);186g97℅NaOH;105ml浓硫酸溶于水中稀释至10升。 样品液:0、005M ASP和LYs的0、02N HCL混合溶液。 显色剂:显色剂列出两种可任选一种。 显色剂(Ⅰ)茚三酮-TiCL3溶液。 10g茚三酮溶于500ml乙二醇甲醚,再加入0、85 ml TiCL3(15%)显色剂(Ⅱ):茚三酮-KCN溶液。 0、1M KCN:0、1628g KCN溶于水中稀释至250ml A、将1、25g茚三酮溶于25ml乙二醇甲醚,配成5%(W/V)浓度的溶液。B 、将2、5ml 0、01M KCN溶液与125ml乙醇甲醚混合。将A和B合并置棕色瓶中过夜即可使用。此溶剂用时, A、B两溶液在前一天合并,配好的溶液仅能在1-2天内使用,过时失效须重配。 五、方法与步骤: 1、树脂的处理: 关于市售新树脂的处理见 7、,本实验采用处理好的树脂。 2、装柱:将层析柱垂直装好,关闭柱底出口,在柱内注入约1cm高的柠檬酸缓冲液。
实验二离子交换层析纯化兔血清IgG 【原理】 DEAE-Sephadex A-50 (二乙氨基- 乙基- 葡萄糖凝胶A-50 )为弱碱性阴离子交换剂。用NaOH 将Cl - 型转变为OH - 型后,可吸附酸性蛋白。血清中的γ 球蛋白属于中性蛋白(等电点为pH6.85 ~7.5 ),其余均属酸性蛋白。pH7.2 ~7.4 的环境中。酸性蛋白均被DEAE-Sephadex A-50 吸附,只有γ 球蛋白便可在洗脱液中先流出,而其他蛋白则被吸附在柱上,从而便可分离获得纯化的IgG 。 【试剂与器材】 1. DEAE-Sephadex A-50 2.0.5mol/L HCl 和NaOH 3.0.1mol/L pH7.4 PBS 4.0.1mol/L Tris-HCl(pH7.4)
5.0.02 %NaN 3 6.PEG 7. 无水乙醇 8. 紫外分光光度计 9.1cm×20cm 玻璃层析柱 10. 自动部分收集器 【操作步骤】 1 .DEAE-Sephadex A-50 预处理称DEAE-Sephadex A-50 (下称A-50 )5g ,悬于500ml 蒸馏水内,1h 后倾去上层细粒。按每克A-50 加0.5mol/L NaOH 15ml 的比例,将浸泡于0.5mol/L NaOH 液中,搅匀,静置30min ,装入布氏漏斗(垫有 2 层滤纸)中抽滤,并反复用蒸馏水抽洗至pH 呈中性;再以0.5mol/L HCl 同上操作过程处理,最后以0.5mol/L NaOH 再处理一次,处理完后,将A-50 浸泡于0.1mol/L pH7.4 PBS 中过夜。
2 .装柱 ( 1 )将层析柱垂直固定于滴定架上,柱底垫一圆形尼龙纱,出水口接一乳胶或塑料管并关闭开关。 (2 )将0.1mol/L Tris-HCl(pH7.4) 沿玻璃棒倒入柱中至1/4 高度,再倒入经预处理并以同上缓冲液调成稀糊状的A-50 。待A-50 凝胶沉降2 ~3cm 高时,开启出水口螺旋夹,控制流速1ml/min ,同时连续倒入糊状A-50 凝胶至所需高度。 ( 3 )关闭出水口,待A-50 凝胶完全沉降后,柱面放一圆形滤纸片,以橡皮塞塞紧柱上口,通过插入橡皮塞之针头及所连接的乳胶或塑料管与洗脱液瓶相连接。 3 .平衡启开出水口螺旋夹,控制流速 4 滴/min ,使约2 倍床体积的洗脱液流出。并以pH 计与电导仪分别测定洗脱液及流出液之PH 值与离子强度,两者达到一致时关闭出水口,停止平衡。 4 .加样及洗脱启开上口橡皮塞及下口螺旋夹,使柱中液体缓慢滴出,当柱面液体与柱面相切时,立即关闭出水口,以毛细滴管沿柱壁加入样品(0.5ml 血清,体积应小于床体积的2% ,蛋白浓度以<100mg 为宜)。松开出水口螺旋夹使面样品缓慢进入柱内,至与柱面
离子交换层析实验原理及步骤 离子交换层析实验方法 阴离子交换剂与阳离子交换剂的装柱和层析过程基本相同。交联葡聚糖的预处理只需充分溶胀和平衡,不需要除去细粒碎片和酸碱处理。其他步骤也基本同离子交换纤维素。 1. 剂型的选择 根据蛋白质在所用缓冲液pH值下带电荷的种类选择,如pH高于蛋白质等电点,应选阴离子交换剂,反之应选阳离子交换剂。一般情况下,DEAE-纤维素用于分离酸性蛋白,而CM纤维素用于分离碱性蛋白质。 下面以DEAE-纤维素操作为例,介绍试验方法 2. 膨胀活化 此步的目的在于除去杂质,暴露DEAE-纤维素上的极性基团。DEAE-纤维素的用量则根据柱容积的大小和所需过柱样品的量来决定。一般是1.0g DEAE-纤维素相当于6ml~8ml柱床体积。 表1-4 分离的血清与所需DEAE—纤维素量及其他条件的大致关系 血清样品量(ml) DEAE需用量(g) 选层析柱规格(cm) 选脱液量(ml) 1~2 2 1×25 100~150 5 5 2×12 200~300 10 10 2×20 300~400 20 20 2×37
400~800 称取所需的量,撒于0.5Mol/L NaOH溶液中(1g DEAE—纤维素干粉约需15倍NaOH液),浸泡1h左右,不时搅拌。抽滤(以布氏漏斗加两层滤纸或尼龙纱布抽滤),以蒸馏水洗涤,再抽滤,直至滤液近中性为止,再将纤维素浸泡于0.5Mol/L HCl中1h,同样抽滤液至近中性。再将纤维素浸于0.5Mol/L NaOH液中,同样处理,洗至中性。 3. 平衡 将DEAE—纤维素放入0.0lMol/L pH 7. 4 PB液中(即起始缓冲液),静止1h,不时搅拌,待纤维素下沉后,倾去上清液或抽滤除去洗液,如此反复几次至倾出液体的pH值与加入的PB液的pH值相近时为止。 4. 装柱 层析柱的选择要大小、长度适当。一般而言,柱长和柱直径之比为10∶1~20∶1,柱的内径上下要均匀一致。用前将层析柱在清洁液内浸泡处理24h,然后依次用常水、蒸馏水、起始缓冲液充分洗涤。 装柱时,先剪一块圆形的尼龙纱布(直径与层析柱内径一致),放入层析柱底部。将柱下端连接细塑料管,夹上螺旋夹。把层析柱垂直固定在三角铁架上,倒入起始缓冲液至一半的柱高,除去死区及塑料管内的气泡。再将平衡的DEAE-纤维素糊状物沿管壁倒入柱中。注意不要产生气泡,如有气泡应排除或重装。拧开螺旋夹,使流速至1ml/5min,待缓冲液快接近纤维素面时,继续倒入纤维素糊,同时用玻璃棒搅拌表面层,以免使两次加入的纤维素形成分界层,通过进出缓冲液调节流量,也可通过塑料管的升降来控制,至柱床体积不变为止。剪一圆形滤纸(与柱内径大小一致),从柱的上端轻轻放入,使其沉接于纤维素床表面,以免在加样时打乱纤维素层。装好柱的柱面应该是平整的,无倾斜,整个柱床内无气泡、不分层。继续平衡,使流出液的pH值与流入液的pH值完全一致为止。 5. 上样 要层析的样品首先必须用起始缓冲液(4℃)平衡过夜,中间可换液数次。将柱的上端打开,用吸管将纤维素柱上面的缓冲液吸出,不要吸净,留一薄层液面,以免空气进入。沿管壁缓缓加入样品,注意不要打乱纤维素表层。拧开下端的螺旋夹,使样品进入交换剂中,快要进完时,加1ml~2ml缓冲液冲洗柱壁,随即用多量的洗脱液洗脱。 样品的加量与DEAE—纤维素有一个最适比的关系,超过这个比值,吸附就不完全,直接影响到分离的纯度。经过粗提的—球蛋白50mg~100mg,用干重约4g DEAE-纤维素装柱分离,可获得理想结果。
混床离子交换器就是阳、阴两种离子交换树脂,互相充分地混合在一个离子交换器内,同时进行阳、阴离子交换的设备。简称混床。所谓混床,就是把一定比例的阳、阴离子交换树脂混合装填于同一交换装置中,对流体中的离子进行交换、脱除。由于阳树脂的比重比阴树脂大,所以在混床内阴树脂在上阳树脂在下。一般阳、阴树脂装填的比例为1:2,也有装 填比例为1:1.5的,可按不同树脂酌情考虑选择。混床也分为体内同步再生式混床和体外再生式混床。同步再生式混床在运行及整个再生过程均在混床内进行,再生时树脂不移出设备以外,且阳、阴树脂同时再生,因此所需附属设备少,操作简便。 一、混床离子交换器的优点 (1)出水水质优良,出水pH值接近中性。 (2)出水水质稳定,短时间运行条件变化(如进水水质或组分、运行流速等)对混床出水水质影响不大。 (3)间断运行对出水水质的影响小,恢复到停运前水质所需的时间比较短。 混床设备比较好用一点的还是有机玻璃柱的那种,因为分层的时候比较容易看得清楚。 操作起来,再生效果好。以前我用的那种A3钢的,有个视孔,操作起来真的好麻烦,分层都看不到。 二、混床离子交换器的工作原理 混床床离子交换法,就是把阴、阳离子交换树脂放置在同一个交换器中,在运行前将它们均匀混合,所以可看着是由无数阴、阳交换树脂交错排列的多级式复床,水中所含盐类的阴、阳离子通过该项交换器,则被树脂交换,而得到高度纯水。在混合床中,由于阴、阳树脂是相互混匀的,所以其阴、阳离子交换反应几乎同时进行,或者说,水的阳离子交换和阴离子交换是多次交错进行的,经H型交换所产生的H+和经过OH型交换所产生的OH-都不能积累起来,基本上消除反离子的影响,交换进行得比较彻底。由于进入混合床的初级纯水质较好,交换器的负载较轻,树脂的交换能力很长时间才被子耗竭。本混合床采用体内再生法,再生时首先利用两种树脂的比重不同,用反洗使用权阴、阳离子交换树脂完全分离,阳树脂沉积在下,阴树脂浮在上面,然后阳树脂用盐酸(或硫酸)再生,阴树脂用烧碱再生。 三、混床离子交换器的结构 1、再生装置:阴离子交换树脂再生碱液在高于阴离子交换树脂面300毫米处母管进液(Φ400、500、600采用单母管进液,Φ800、2500采用双母管进液),管上小孔布液,管外采用塑料窗纱60目尼龙网布包覆。阳离子交换树脂再生酸性由底部排水装置的多孔板上排水帽进入。 2、中排装置:中排装置设置在阴、阳树脂的分界面上,用于再生排泄酸、碱还原液和冲洗型,型式分为双母管或支母管式,管子小孔外包覆塑料窗纱及60目尼龙网各一层。 3、排水装置:采用多孔板上装设PB2-500型叠片式排水帽,或宝塔式ABS型排水帽,多孔板材质按设备规格不同而异。(Φ400、500、600型采用硬聚氯乙烯多孔,Φ800、2500型采用钢衬胶多孔板)。
钠离子交换器工作原理说明 一般而言,化学除盐过程就是原水通过H+型阳离子交换器(也称阳床)和OH-型阴离子交换器(也称阴床),经过离子交换反应,将水中的阴、阳离子去除,从而制得高纯水。当原水经阳床发生交换反应之后,出水呈酸性,即水中的阳离子几乎都等当量的转变成氢离子,此时H++HC03-?C02?+H2O,所以在阳床之后端要设置除二氧化碳器。 钠离子交换器工作原理 水的硬度主要有其中的阳离子:钙(Ca2+)、镁(Mg2+)离子构成。当含有硬度的原水通过交换器的树脂层时,水中的钙、镁离子被树脂吸附,同时释放出钠离子。这样从交换器内流出的水就是去掉了硬度离子的软化水,当吸附钙、镁离子的树脂达到一定程度后,出水硬度增大,此时软水器按照预定的程序自动进行失效树脂的再生工作,利用较高浓度的氯化钠溶液通过树脂,使失效的树脂重新恢复至钠型树脂。
钠离子交换器产品结构 沈阳软化水装置主要有三部分组成: 1、自动控制装置:根据用户需要,可配置时间控制、流量控制两种控制方式的全自动控制器,并可选配润新、富莱克等控制阀,也可选用液动、气动、电动多阀控制系统。 2、罐体部分:根据用户要求,交换罐、盐罐可采用玻璃钢、碳钢衬胶、不锈钢等材质。 3、配件部分:包括布水装置、吸盐装置、管路配件等。 天然水中含有的钙(Ca2+)、镁(Mg2+)离子在加热蒸发浓缩过程中生成危害锅炉安全运行的水垢,这种天然水叫硬水。当这种硬水通过离子交换剂(NaS)时,与吸附在交换剂上的Na+离子发生交换反应,被置换于水中,转化成钠的盐类。由于钠的盐类溶解度大,且在温度升高时溶解度进一步增加,所以不会生成水垢。这个过程称为软化。但水中的钙、镁离子置换到交换剂上,使钠型交换剂(NaR)变成钙型(CaR),因而失去了与钙、镁离子再进行交换反应的能力,这一现象称之为钠离子交换失效。将失效的交换剂用食盐(NaCl)溶液使之还原成钠型交换剂,以便继续生产软水,这种现象称之为再生。钠离子交换器通过软化——失效——再生还原——软化的循环过程,使原水得到软化,供给锅炉合格的软化水。
工作原理就是离子的交换。 运行时:阳树脂(H-R)+(M+)-->:(M-R)+(H+) 阴树脂(OH-R)+(X-)-->:(X-R)+(OH-) 其中M+为金属离子,X-为阴离子。 再生过程为其逆过程。 离子交换器的失效控制 离子交换除盐水处理最简单的流程为阳床-阴床组成的一级复床除盐系统。有的一级复床除盐系统采用单元制,即每套一级复床除盐系统包括阳床、(除碳器)、阴床各一台,在离子交换除盐运行过程中,无论是阳床还是阴床先失效,都是同时再生;还有的一级复床除盐系统采用母管制,即阳床与阳床或阴床与阴床是并联运行的,哪一台交换器失效就再生哪一台。 1 检测和控制原理 强酸性阳树脂对水中各种阳离子的吸附顺序为:Fe3+>Al3+>Ca2+>Mg2+>Na+>H+. ;由此可知,水中金属离子Na+被吸附的能力最弱,所以当离子交换时树脂层的各种离子吸附层逐渐下移,H+.最后被其他阳离子置换下来,当保护层穿透时,首先泄漏的是最下层的Na+;因此监督阳离子交换器失效是以漏钠为标准的;其反应方程为(A代表金属阳离子,R 为树脂基团): An+ +nRH=RnA+n H+ HCO3- + H+ =H2O+CO2↑ 强碱性阴树脂对水中各种阴离子的吸附顺序为: SO42->NO3->Cl->OH->HCO3->HSiO3- 。由此可知,HSiO3-的吸附能力最弱,所以当离子交换时树脂层的各种离子吸附层逐渐下移,OH-.被其他阴离子置换下来,当保护层穿透时,首先泄漏的是最下层的HSiO3-;因此监督阴离子交换器失效是以漏硅为标准的;其反应方程为(B代表酸根阴离子,R为树脂基团): Bm- +mROH=RmB+mOH- 2 控制点和控制方法 由于母管制系统包含了单元制系统,而且它具有能充分使用树脂、提高交换器的出水能力、降低酸碱消耗等优点,我们在研究中主要讨论以这种结构为基础的离子交换除盐水处理系统。 以成都生物制品研究所蛋白分离车间纯水站为例,该系统为母管制水处理系统,系统的结构为:砂滤-活性炭过滤-粗滤-阳床- 一阴-二阴-混床-精滤-纯水罐,系统产水能力为5 t/h,在系统的失效控制研究中,我们提出单元失效控制概念,也就是充分利用了母管制制水系统的优点对系统进行失效控制。 (1)RO对各有机溶质的去除率大于NF膜。(2)不同有机溶质的去除率不相同,有的甚至相差很大(例如,RO和NF膜对乙酸的吸光度去除率分别为95.34%、81.45%,而对苯胺的吸光度去除率则分别为61.50%、46.82%)。 3 出水水质 原水经一级复床除盐后,电导率(25℃)低于10μS/cm,水中硅含量低于100μg/
离子交换层析法 一、原理 离子交换层析法是从复杂的混合物中,分离性质相似大分子的方法之一,依据的原理是物质的酸碱性、极性,也就是所带阴阳离子的不同。由于蛋白质也有等电点,当蛋白质处于不同的pH条件下,其带电状况也不同。阴离子交换基质结合带有负电荷的蛋白质,所以这类蛋白质被留在柱子上,然后通过提高洗脱液中的盐浓度等措施,将吸附在柱子上的蛋白质洗脱下来。结合较弱的蛋白质首先被洗脱下来。反之阳离子交换基质结合带有正电荷的蛋白质,结合的蛋白可以通过逐步增加洗脱液中的盐浓度或是提高洗脱液的pH值洗脱下来。 二、方法与步骤: 1.实验试剂与仪器:可溶性蛋白质溶液、TB缓冲液、NaCl溶液、乙醇、去离子水,层析柱、移液器、尼龙纱布、离子交换剂...... 2.实验步骤 (1)装柱: 取出层析柱,用去离子水冲洗干净,连接好管子后固定柱子;用水冲洗层析柱3-5次,每次10ml去离子水;取出填料,静止至室温后,根据需要用移液器取出3-5ml的填料进行装柱,用去离子水冲洗填料5个柱体积; (2)柱的平衡与上样: 用0.02M TB bufferA缓冲液(PH7.6)平衡Ni柱,直至流出液的pH为7.6;对处理的样品进行过滤后,缓慢上样让蛋白充分结合;
(3)洗杂蛋白: 用0.02M TB bufferA 缓冲液(PH7.6)过柱,清洗没有结合到层析柱上的杂蛋白,至流出液与缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测;用含10mMNaCL的TB bufferA 缓冲液(PH7.6)过柱,共洗约30ml,至流出液与含10mMNaCL的TB bufferA 缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测; 分别用含20mMNaCL、40mMNaCL、60mMNaCL、80mMNaCL、100mMNaCL 的TB bufferA 缓冲液(PH7.6)过柱,共洗约30ml,至流出液与含20mMNaCL、40mMNaCL、60mMNaCL、80mMNaCL、100mMNaCL的TB bufferA 缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测; (4)解离目的蛋白(洗脱): 分别用含100mMNaCL、200mMNaCL、500mMNaCL、1000mMNaCL的TB bufferA 缓冲液(PH7.6)过柱,共洗约30ml,至流出液与含100mMNaCL、200mMNaCL、500mMNaCL、1000mMNaCL的TB bufferA 缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测; (5)柱的清洗与保存: 用含1000mMNaCL的TB bufferA缓冲液(PH7.6)以冲洗层析柱,共冲洗30ml;用浓度为1.5M的NaCl溶液冲洗层析柱,共冲洗30ml;用过滤去离子水冲洗50ml;用20%乙醇冲洗30ml后于4℃20%乙醇中保存。 三、适用范围与应用 离子交换层析技术已广泛用于各学科领域。在生物化学及临床生
离子交换法的工作原理及软水器的工作过程 离子交换树脂是一种聚合物,带有相应的功能基团。一般情况下,常规的钠离子交换树脂带有大量的钠离子。 当水中的钙镁离子含量高时,离子交换树脂可以释放出钠离子,功能基团与钙镁离子结合,这样水中的钙镁离子含量降低,水的硬度下降。硬水就变为软水,这是软化水设备的工作过程。 当树脂上的大量功能基团与钙镁离子结合后,树脂的软化能力下降,可以用氯化钠溶液流过树脂,此时溶液中的钠离子含量高,功能基团会释放出钙镁离子而与钠离子结合,这样树脂就恢复了交换能力,这个过程叫作“再生”。 由于实际工作的需要,软化水设备的标准工作流程主要包括: 工作(有时叫做产水,下同)、反洗、吸盐(再生)、慢冲洗(置换)、快冲洗五个过程。不同软化水设备的所有工序非常接近,只是由于实际工艺的不同或控制的需要,可能会有一些附加的流程。任何以钠离子交换为基础的软化水设备都是在这五个流程的基础上发展来的(其中,全自动软化水设备会增加盐水重注过程)。 反洗:工作一段时间后的设备,会在树脂上部拦截很多由原水带来的污物,把这些污物除去后,离子交换树脂才能完全曝露出来,再生的效果才能得到保证。反洗过程就是水从树脂的底部洗入,从顶部流出,这样可以把顶部拦截下来的污物冲走。这个过程一般需要5-15分钟左右。 吸盐(再生):即将盐水注入树脂罐体的过程,传统设备是采用盐泵将盐水注入,全自动的设备是采用专用的内置喷射器将盐水吸入(只要进水有一定的压力即可)。在实际工作过程中,盐水以较慢的速度流过树脂的再生效果比单纯用盐水浸泡树脂的效果好,所以软化水设备都是采用盐水慢速流过树脂的方法再生,这个过程一般需要30分钟左右,实际时间受用盐量的影响。 慢冲洗(置换):在用盐水流过树脂以后,用原水以同样的流速慢慢将树脂中的盐全部冲洗干净的过程叫慢冲洗,由于这个冲洗过程中仍有大量的功能基团上的钙镁离子被钠离子交换,根据实际经验,这个过程中是再生的主要过程,所以很多人将这个过程称作置换。这个过程一般与吸盐的时间相同,即30分钟左右。 快冲洗:为了将残留的盐彻底冲洗干净,要采用与实际工作接近的流速,用原水对树脂进行冲洗,这个过程的最后出水应为达标的软水。一般情况下,快冲洗过程为5-15分钟。 离子交换法---软水器的工作原理 时间:2010-09-11 09:46来源:未知作者:阿青点击:34次 离子交换法---软水器的工作原理离子交换树脂是一种聚合物,带有相应的功能基团。一般情况下,常规的钠离子交换树脂带有大量的钠离子。当水中的钙镁离子含量高时,离子交
离子交换树脂原理 一、离子交换树脂基础介绍 离子交换树脂的全名称由分类名称、骨架(或基因)名称、基本名称组成。孔隙结构分凝胶型和大孔型两种,凡具有物理孔结构的称大孔型树脂,在全名称前加“大孔”。分类属酸性的应在名称前加“阳”,分类属碱性的,在名称前加“阴”。如:大孔强酸性苯乙烯系阳离子交换树脂。 离子交换树脂还可以根据其基体的种类分为苯乙烯系树脂和丙烯酸系树脂。树脂中化学活性基团的种类决定了树脂的主要性质和类别。首先区分为阳离子树脂和阴离子树脂两大类,它们可分别与溶液中的阳离子和阴离子进行离子交换。阳离子树脂又分为强酸性和弱酸性两类,阴离子树脂又分为强碱性和弱碱性两类 (或再分出中强酸和中强碱性类)。 离子交换树脂的命名方式: 离子交换产品的型号以三位阿拉伯数字组成,第一位数字代表产品的分类,第二位数字代表骨架的差异,第三位数字为顺序号用以区别基因、交联剂等的差异。第一、第二位数字的意义,见表8-1。 表8-1 树脂型号中的一、二位数字的意义 代号 0 1 2 3 4 5 6 分类名称强酸性弱酸性强碱性弱碱性螫合性两性氧化还原性 骨架名称苯乙烯系丙烯酸系醋酸系环氧系乙烯吡啶系脲醛系氯乙烯系大孔树脂在型号前加“D”,凝胶型树脂的交联度值可在型号后用“×”号连接阿拉伯数字表示。如D011×7,表示大孔强酸性苯乙烯系阳离子交换树脂,其交联度为7。
离子交换树脂在国内外都有很多制造厂家和很多品种。国内制造厂有数十家,主要的有上海树脂有限公司、南开化工厂、浙江争光实业股份有限公司、晨光化工研究院树脂厂、江苏色可赛思树脂有限公司等;国外较著名的如美国Rohm & Hass 公司生产的Amberlite系列、Success公司生产Ionresin系列、Dow化学公司的Dowex系列、法国Duolite系列和Asmit系列、日本的Diaion系列,还有Ionac 系列、Allassion系列等。树脂的牌号多数由各制造厂或所在国自行规定。国外一些产品用字母C代表阳离子树脂(C为cation的第一个字母),A代表阴离子树脂(A 为Anion的第一个字母),如Amberlite的IRC和IRA分别为阳树脂和阴树脂,亦分别代表阳树脂和阴树脂。我国化工部规定(HG2-884-76),离子交换树脂的型号由三位阿拉伯数字组成。第一位数字代表产品的分类:0 代表强酸性,1代表弱酸性,2代表强碱性,3代表弱碱性,4代表螯合性,5代表两性,6代表氧化还原。第二位数字代表不同的骨架结构:0代表苯乙烯系,1代表丙烯酸系,2代表酚醛系,3代表环氧系等。第三位数字为顺序号,用以区别基体、交联基等的差异。 此外大孔型树脂在数字前加字母D。因此,D001是大孔强酸性苯乙烯系树脂。 二、离子交换树脂的基本类型 (1) 强酸性阳离子树脂 这类树脂含有大量的强酸性基团,如磺酸基,SO3H,容易在溶液中离解出H+,故呈强酸性。树脂离解后,本体所含的负电基团,如SO3,,能吸附结合溶液中的其他阳离子。这两个反应使树脂中的H+与溶液中的阳离子互相交换。强酸性树脂的离解能力很强,在酸性或碱性溶液中均能离解和产生离子交换作用。 树脂在使用一段时间后,要进行再生处理,即用化学药品使离子交换反应以相反方向进行,使树脂的官能基团回复原来状态,以供再次使用。如上述的阳离子树脂是用强酸进行再生处理,此时树脂放出被吸附的阳离子,再与H+结合而恢复原来的组成。
实验报告 一、实验目的和要求 三、实验材料和主要仪器 五、实验数据记录和处理 七、实验讨论和心得 二、实验内容和原理 四、实验方法和步骤 六、实验结果和分析 一、实验目的和要求 1、学习离子交换层析的基本原理 2、学习离子交换层析分离蛋白质的基本方法和技术 3、学习蔗糖酶活性检测的基本原理和方法 二、实验内容和原理 1、离子交换层析 由于蔗糖酶的偏酸性,所以在7.3 缓冲液的环境中,粗分离纯化样品蔗糖酶带负电荷,因此我们用阴离子交换剂可以先与蔗糖酶样品可逆交换吸附,然后通过用盐离子强度逐渐提高的洗脱液,使蔗糖酶和其他杂蛋白质的电荷被中和,与离子交换剂的亲和力降低,把不同的蛋白质按所带电荷的强弱逐一被洗脱下来,从而达到分离蔗糖酶的目的。 2、酶活力检测 蔗糖酶是一种水解酶,它能蔗糖水解为等量的葡萄糖和果糖(还原糖)。(50℃水解) 3.5-二硝基水杨酸与还原糖共热被还原成棕红色的氨基化合物,在一定范围内还原糖的量和反应液的颜色深度成正比。(100℃显色) 三、实验材料和主要仪器 1、实验材料 蔗糖酶粗分离纯化(溶解即为样品Ⅲ) 2、实验试剂 ⑴ ⑵ 20 7.3 缓冲液 ⑶ 20 (1 )7.3缓冲液 ⑷ 0.2乙酸缓冲液,4.5 ⑸ 5%蔗糖溶液 ⑹ 3,5-二硝基水杨酸试剂 3、实验仪器 (1)高速冷冻离心机 (2)层析柱(φ1.0×20㎝ )(1支/组)
(3)? (1套/组) (4)部分收集器及收集试管(4管)(1台/组) (5)-20℃冰箱(保存样品用) (6)微量移液枪 200、1000 (7)1.5离心管(留样品Ⅲ和样品Ⅳ用) (8)7离心管(留样品Ⅳ用) (9)恒温水浴(50℃、100℃) (10)试管、移液管、试管架等 四、实验方法和步骤 1、仪器连接 (1)接通各仪器电源,将泵头分别放置A,B两个溶液瓶中。注意B为含溶液。 (2)点击电脑桌面上软件图标,打开软件。选择,点击,进入操作界面。点击 (3)在操作界面的工具栏,点击。出现窗口,调节为 1,确定。 2、装柱与平衡 (1)检查层析柱的两端接头,底端有膜的置于下方。 (2)程序暂停。将层析柱放入卡槽,上端接头与混合器()相连,下端接头与样品阀( )相连。 (3)平衡一个柱体积(约2020) 3、加样 停止加入20 7.3 缓冲液。待缓冲液液面与胶体表面相切时,程序暂停。旋开柱上方接头,用胶头滴管缓慢将5蔗糖酶蛋白样品溶液(样品Ⅲ)加入层析柱中,注意顺着柱壁滴加,尽可能保持胶面平整。程序继续,使样品溶液进入胶体,待样品溶液完全进入胶体后,程序暂停,用少量洗脱缓冲液将残余在层析柱壁上端的样品洗下,并完全进入胶体后,再加缓冲液至一定高度。 4、洗脱(梯度洗脱法) (1)加样后,先用进行洗脱,洗去未被凝胶吸附的杂蛋白(20左右); (2)待层析柱流出液在仪器上绘出的基线稳定,在程序主界面的工具栏→ → → ,在两个框内均填入100,点击,最后点击一次,开始梯度洗脱。每2接一管,当上升至8 时,开始测定各管的蔗糖酶活力; (3)将蔗糖酶活力高的若干管酶液(2-3管)合并,测量总体积V4(样品Ⅳ),样品用7离心管-20℃保存。 5、蔗糖酶活力检测
GE离子交换层析柱 protocol 5ml(举例 子) Preparation 1. Buffer: (pH 根据蛋白的 pI 进行调整,pH 尽量远离 pI。pH>pI,过 Q 柱;pH>pI,过 S 柱)A: 50mM Tris-HCl B: 50mM Tris-HCl 1M NaCl 过滤除杂质,4℃静置过夜除气泡。 2. Protein: 用滤器过滤除质;或者分装于 EP 管,14000rpm,4℃离心 20min,去除沉淀。 3 .Prepare enough tubes 有流速时,禁止将泵的探头暴露到空气中!!! 柱子在仪器上时,无论何时均要限压!!!
Procedure 1 打开仪器总开关,电脑。 检查:泵的探头是否放入纯水中。 洗泵:Manual--pump--pump basic wash--A on ,B on--insert--execute 洗系统:Manual--pump--flow--10ml/min--insert--execute Manual--other--End time--volume--40 ml 2 安装柱子 给流速:Manual--pump--flow--3ml/min--insert--execute(仪器显示系统压力为*Mpa)限压力:Manual--Alarms--Alarms pressure--+*)Mpa--insert--execute 是 Hitrap Q 柱子的最大限压) 装柱子:先装上面,再下面,装完后用纸巾擦干,观察是否漏液。 3 清洗柱子 限压力:Manual--Alarms--Alarms pressure--+*)Mpa--insert--execute 给流速:Manual--pump--flow--1ml/min--insert--execute(低流速下装柱子)Manual--other--End time--volume--10 ml
水的净化——离子交换法制备纯水(3学时) 一、实验目的 1.了解蒸馏法和离子交换法制备纯水的基本原理和操作方法。 2.学习离子交换树脂的使用方法。 3.学习蒸馏装置的组装方法。 二、实验原理 离子交换法制备纯水是利用离子交换树脂活性基团上具有离子交换能力的H+和OH-与水中阳、阴离子杂质进行交换,将水中阳、阴离子杂质截留在树脂上,进入水中的H+和OH-重新结合成水而达到纯化水的目的。凡能与阳离子起交换作用的树脂称为阳离子交换树脂,与阴离子起交换作用的树脂称为阴离子交换树脂。 三、实验用品 仪器:250ml锥形瓶3只、烧杯、铁架台、离子交换柱(3支,50ml)、铁架台、试管 药品:铬黑T指示剂、AgNO3(0.1mol·L-1)、HNO3(2mol·L-1)、NH3-NH4Cl缓冲液、BaCl2(0.1mol·L-1)、717#强碱性阴离子交换树脂、732#强酸性阳离子交换树脂 材料:pH试纸、脱脂棉(或玻璃纤维)、乳胶管、螺旋夹 四、实验内容 1、装柱 用两只10mL小烧杯,分别量取再生过的阳离子交换树脂7mL(湿)或阴离子交换树脂约10mL(湿),按照装柱操作要求进行装柱。第1支柱加入1/2柱容积的阳离子交换树脂,在第2支柱加入2/3柱容积的阴离子交换树脂,在第3支柱加入2/3柱容积的阴阳离子混合树脂。装置完毕,按将三个柱进行串联,在串联时同样适用纯水并注意尽量排除连接管内的气泡,以免液柱阻力过大而交换不能畅通,各柱树脂层顶上也塞入少量脱脂棉,即得离子交换净水装置。
2、离子交换与水质检验 依次使原料水流经阳离子交换柱、阴离子交换柱、混合离子交换柱。并依次接收原料水、阳离子交换柱流出水、阴离子交换柱流出水、混合离子交换柱流出水样,进行以下项目检验。(1)用电导率仪测定个样品的电导率。 (2)取各样品水2滴分别放入点滴板的圆穴内,检测钙离子、镁离子、硫酸根离子和氯离子。 结果填表格。 3、再生 按基本操作中所述的方法再生阴离子、阳离子交换树脂。 五、思考题 1.用离子交换法制备纯水的基本原理是什么?本实验操作中要注意哪些? 2、如何筛分混合的阴、阳离子交换树脂 3、电导率仪测定水纯度的根据是什么? 六、参考文献 北京师范大学无机化学教研室等编,<<无机化学实验>>,2001年,高等教育出版社 (郝桂霞)
离子交换色谱- 紫外检测法测定乳制品中三聚氰胺 何强1, 孔祥虹1, 李建华1, 乐爱山1, 赵洁2 ( 1. 陕西出入境检验检疫局, 西安710068; 2. 西安理工大学理学院, 西安710054) 摘要: 建立离子交换色谱- 紫外检测法测定乳制品中三聚氰胺。样品直接用水和乙腈提取, 分析时用LC - SCX离子交换色谱柱分离, 浓度为0.05 mol/ L磷酸二氢钾溶液( pH值为3.0) - 乙腈( 70 ∶30) 为流动相, 流速1.0 mL/min, 在紫外波长240 nm下检测。三聚氰胺在0.5 ~ 100.0 mg/ L的范围内, 质量浓度与色谱峰面积呈良好的线性关系( r=0.9999) , 最低检出限为1.0 mg/ kg, 加标回收率在93.8 % ~102.5 %范围内, 相对标准偏差(RSD) 小于3.5 %。该方法简便、快速、准确, 能够满足检测要求。 关键词:三聚氰胺; 乳制品; 离子交换色谱 Determination of melamine in dairy products with ion exchange chromatography and UV detection HE Qiang1, KONG Xiang- hong1, LI Jian- hua1, YUE Ai- shan1, ZHAO Jie2 (1. Shaanxi Entry - Exit Inspection and Quarantine Bureau, Xi' an 710068, China; 2. College of Science, Xi' an Universityof Technology, Xi' an 710054, China) Abstract: A method was developed for the determination of melamine in dairy products with ion exchange chromatography. Samples were extracted with water and acetonitrile. Chromatographic analysis was performed on a LC - SCX column eluted with 0.05 mol/ L KH2PO4(pH=3.0) - acetonitrile (70∶30) at a flow rate of 1.0 mL/min and UV detection at 240 nm. The present method showed good linear relationship(r = 0.9999) for melamin at the range of 0.5 ~ 100.0 mg/ L, the detection limit were 1.0 mg/ kg, the recoveries ranged from 93.8 % to102.5 % with relative tandard deviations (RSD) less than 3.5 %. The ethod is simple, fast, accurate for the melamine analysis. Key words: melamine; dairy products; ion exchange chromatography 正文: 最近美国FDA调查确认宠物食品受三聚氰胺污染是造成许多宠物非正常死亡的原因, 从而要求出口到美国的含蛋白产品必须检测三聚氰胺, 已经对我国的食品出口企业产生了较大的负面影响。三聚氰胺(melamine)简称三胺, 学名三氨三嗪, 别名蜜胺、氰尿酰胺、三聚酰胺, 分子式为C3N6H6, 是一种重要的氮杂环有机化工原料, 具有一定的肾毒性。因为其分子中 含有大量氮元素, 而用全氮法检测蛋白质含量时不能够区分这种“伪蛋白氮”, 所以一些不法