
溶解度练习题
一、溶液的形成
1、溶液
(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,
叫做溶液
(2)溶液的基本特征:均一性、稳定性
注意:a 、溶液不一定无色,
如CuSO 4溶液为蓝色 FeSO 4溶液为浅绿色 Fe 2(SO 4)3溶液为黄色
b 、溶质可以是固体、液体或气体;水是最常用的溶剂
c 、溶液的质量 = 溶质的质量 + 溶剂的质量
溶液的体积 < 溶质的体积 + 溶剂的体积
d 、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)
2、溶质和溶剂的判断
(1)固体、气体溶于液体时,固体、气体是溶剂;
(2)两种液体相溶时,量多的是溶剂,量少的是溶质。
(3)溶液中若有水存在,无论水的量多还是量少,水都是溶剂。
(4)在不指明溶剂时,溶剂一般是水。
3、饱和溶液、不饱和溶液
(1)概念: 饱和溶液:在一定温度下、一定量的溶剂里,不能溶解某种溶质的溶液,
叫做这种溶质的饱和溶液。
不饱和溶液:在一定温度下、一定量的溶剂里,还能继续溶解某种溶质的
溶液,叫做这种溶质的不饱和溶液。
(2)判断方法:要确定某一溶液是否饱和,只要看在一定温度下有没有不能继续溶解的剩 余溶质存在,如有,且溶质的质量不再减少,则为该溶质的饱和溶液;否则为该溶质 不饱和溶液。
(3)饱和溶液和不饱和溶液之间的转化
注:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低
②最可靠的方法是:加溶质、蒸发溶剂
(4)浓、稀溶液与饱和不饱和溶液之间的关系
①饱和溶液不一定是浓溶液
②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液
③在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓
(5)溶解时放热、吸热现象
溶解吸热:如NH 4NO 3溶解
溶解放热:如NaOH 溶解、浓H 2SO 4溶解
溶解没有明显热现象:如NaCl
二、溶解度
1、固体的溶解度
(1)溶解度的定义:在一定温度下,某固态物质在100g 溶剂里达到饱和状态时所溶解的质量
四要素:①条件:一定温度②标准:100g 溶剂③状态:达到饱和④质量:溶解度的单位:克
(2)溶解度的含义: 20℃时NaCl 的溶液度为36g 含义:
在20℃时,在100克水中最多能溶解36克NaCl
或在20℃时,NaCl 在100克水中达到饱和状态时所溶解的质量为36克
(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类) ②温度
大多数固体物的溶解度随温度升高而升高;如KNO 3
少数固体物质的溶解度受温度的影响很小;如NaCl
极少数物质溶解度随温度升高而降低。如Ca(OH)2
不饱和溶液 饱和溶液 降温、蒸发溶剂、加溶质 升温、加溶剂
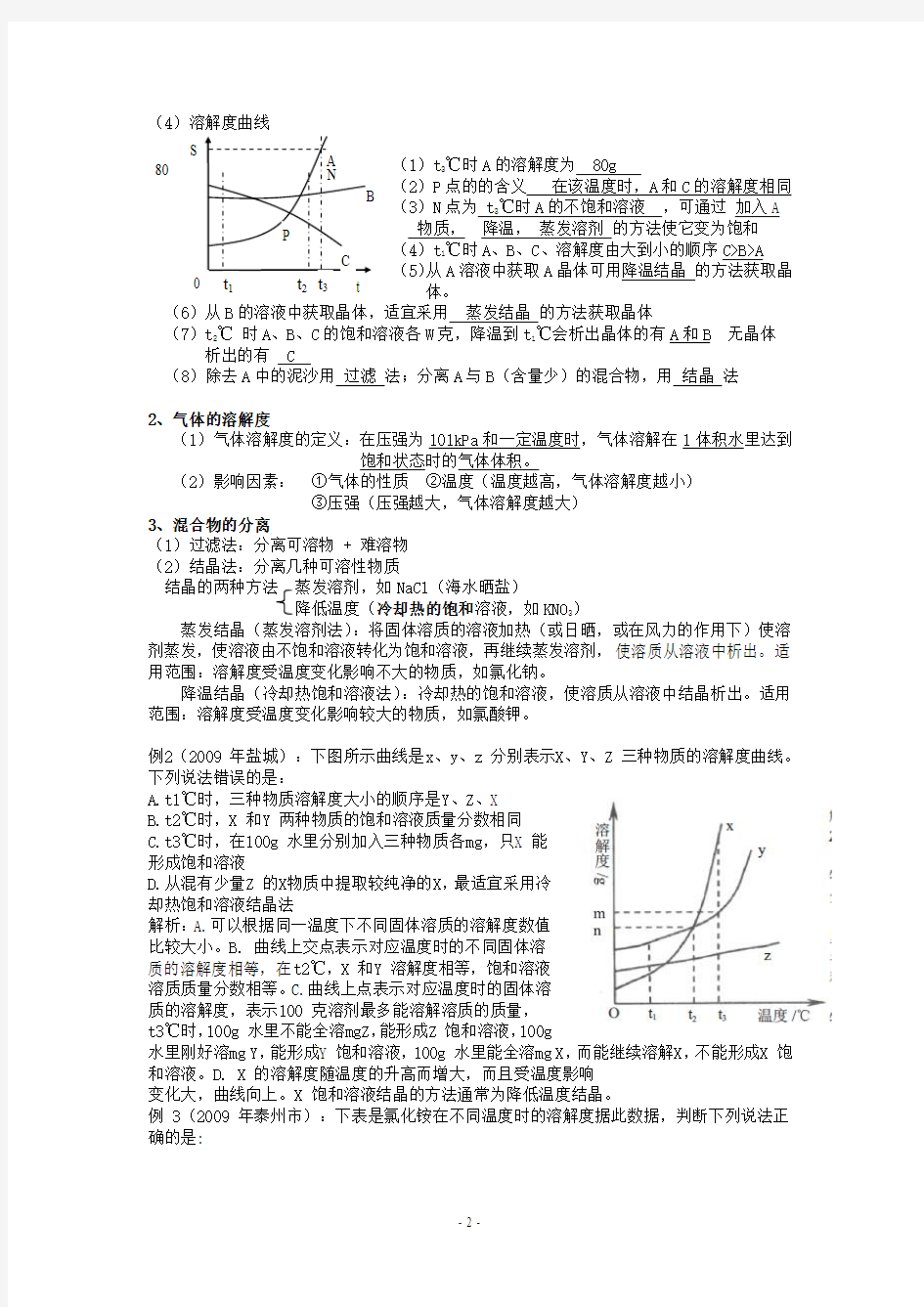
(4)溶解度曲线
(1)t 3℃时A 的溶解度为 80g (2)P 点的的含义 在该温度时,A 和C 的溶解度相同 (3)N 点为 t 3℃时A 的不饱和溶液 ,可通过 加入A 物质, 降温, 蒸发溶剂 的方法使它变为饱和 (4)t 1℃时A 、B 、C 、溶解度由大到小的顺序C>B>A (5)从A 溶液中获取A 晶体可用降温结晶 的方法获取晶体。
(6)从B 的溶液中获取晶体,适宜采用 蒸发结晶 的方法获取晶体
(7)t 2℃ 时A 、B 、C 的饱和溶液各W 克,降温到t 1℃会析出晶体的有A 和B 无晶体 析出的有 C
(8)除去A 中的泥沙用 过滤 法;分离A 与B (含量少)的混合物,用 结晶 法
2、气体的溶解度
(1)气体溶解度的定义:在压强为101kPa 和一定温度时,气体溶解在1体积水里达到
饱和状态时的气体体积。
(2)影响因素: ①气体的性质 ②温度(温度越高,气体溶解度越小)
③压强(压强越大,气体溶解度越大)
3、混合物的分离
(1)过滤法:分离可溶物 + 难溶物
(2)结晶法:分离几种可溶性物质
结晶的两种方法 蒸发溶剂,如NaCl (海水晒盐)
降低温度(冷却热的饱和溶液,如KNO 3)
蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液由不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。适用范围:溶解度受温度变化影响不大的物质,如氯化钠。
降温结晶(冷却热饱和溶液法):冷却热的饱和溶液,使溶质从溶液中结晶析出。适用范围:溶解度受温度变化影响较大的物质,如氯酸钾。
例2(2009 年盐城):下图所示曲线是x 、y 、z 分别表示X 、Y 、Z 三种物质的溶解度曲线。下列说法错误的是:
A.t1℃时,三种物质溶解度大小的顺序是Y 、Z 、X
B.t2℃时,X 和Y 两种物质的饱和溶液质量分数相同
C.t3℃时,在100g 水里分别加入三种物质各mg ,只X 能
形成饱和溶液
D.从混有少量Z 的X 物质中提取较纯净的X ,最适宜采用冷
却热饱和溶液结晶法
解析:A.可以根据同一温度下不同固体溶质的溶解度数值
比较大小。B. 曲线上交点表示对应温度时的不同固体溶
质的溶解度相等,在t2℃,X 和Y 溶解度相等,饱和溶液
溶质质量分数相等。C.曲线上点表示对应温度时的固体溶
质的溶解度,表示100 克溶剂最多能溶解溶质的质量,
t3℃时,100g 水里不能全溶mgZ ,能形成Z 饱和溶液,100g
水里刚好溶mg Y ,能形成Y 饱和溶液,100g 水里能全溶mg X ,而能继续溶解X ,不能形成X 饱和溶液。D. X 的溶解度随温度的升高而增大,而且受温度影响
变化大,曲线向上。X 饱和溶液结晶的方法通常为降低温度结晶。
例 3(2009 年泰州市):下表是氯化铵在不同温度时的溶解度据此数据,判断下列说法正确的是:
0 t 1 t 2 t 3 N t S P A B C 80
A.20℃时,氯化铵饱和溶液中氯化铵的质量分数是25%
B.20℃时,70g 氯化铵的饱和溶液升温至40℃得到不饱和溶液
C.40℃时,75g 氯化铵的饱和溶液中加入25g 水后氯化铵的质量分数为30%
D.80℃时,84g 的氯化铵饱和溶液降温至60℃时有5g氯化铵析出
解析:A.20℃时,氯化铵溶解度为40 g,100 克溶剂最多能溶解溶质的质量为40 g,形成140 g 饱和溶液,饱和溶液中氯化铵的质量分数是28.6%。B.氯化铵的溶解度随温度的升高而增大,曲线向上。氯化铵饱和溶液升高温度,溶解度变大,不会有晶体析出,溶质质量不变,溶剂质量不变,溶液质量不变,为不饱和溶液,溶质质量分数不变。C.40℃时,氯化铵溶解度为50 g,100 克溶剂最多能溶解溶质的质量为50 g,形成150 g 饱和溶液,75g 氯化铵的饱和溶液中溶质的质量为25 g,加入25g 水后溶质的质量不变,溶液的质量为100 g,氯化铵的质量分数为25%。D.80℃时,氯化铵溶解度为68g,100 克溶剂最多能溶解溶质的质量为68g,形成168g 饱和溶液,84g 氯化铵的饱和溶液中溶质的质量为34 g,溶剂的质量为50 g,60℃时,氯化铵溶解度为58 g,100 克溶剂最多能溶解溶质的质量为58g,形成158g 饱和溶液,50 g 溶剂最多能溶解溶质的质量为29g,80℃时,84g 的氯化铵饱和溶液降温至60℃时有5g 氯化铵析出。
2 典型题型及考点归纳
通过对中考化学溶解度曲线试题的分析,可以归纳出以下几种题型及对应的常见考点:
2.1 溶解度曲线含义及溶解度定义
考点归纳:曲线上点表示对应温度时的固体溶质的溶解度,表示100 克溶剂最多能溶解溶质的质量;曲线上交点表示对应温度时的不同固体溶质的溶解度相等;根据同一温度下不同固体溶质的溶解度数值比较大小。
2.2 溶解度随温度变化趋势
考点归纳:大多数固体溶质的溶解度随温度的升高而增大,而且受温度影响变化大,曲线向上,如硝酸钾,增大硝酸钾的溶解度应升高温度;少数固体溶质的溶解度随温度的升高而增大,而且受温度影响变化不大,曲线平缓向上,如氯化钠;极少数固体溶质的溶解度随温度的升高而减小,曲线向下,如氢氧化钙,增大氢氧化钙的溶解度应降低温度。
2.3 饱和溶液和不饱和溶液的转变
考点归纳:曲线上点表示饱和状态,曲线下方点表示不饱和状态;改变温度,让溶解度变小,会有晶体析出,剩余溶液为该固体溶质的饱和溶液。该题型几种常见物质知识点总结如下:硝酸钾的溶解度随温度的升高而增大,而且受温度影响变化大,曲线向上。硝酸钾不饱和溶液转变成饱和溶液时通常为加硝酸钾、降低温度、蒸发溶剂。氯化钠的溶解度随温度的升高而增大,而且受温度影响变化不大,曲线平缓向上。氯化钠不饱和溶液转变成饱和溶液时通常为加氯化钠、蒸发溶剂。氢氧化钙的溶解度随温度的升高而减小,曲线向下。氢氧化钙不饱和溶液转变成饱和溶液时通常为加氢氧化钙、升高温度、蒸发溶剂。
2.4 结晶方法的考查
该考点几种常见无机物的结晶方法可以归纳如下:
(1)硝酸钾的溶解度随温度的升高而增大,而且受温度影响变化大,曲线向上。硝酸钾饱和溶液结晶的方法通常为降低温度结晶;
(2)氯化钠的溶解度随温度的升高而增大,而且受温度影响变化不大,曲线平缓向上。氯化钠饱和溶液结晶的方法通常为蒸发溶剂结晶;
(3)氢氧化钙的溶解度随温度的升高而减小,曲线向下。氢氧化钙饱和溶液结晶的方法通常为升高温度结晶;
(4)提纯含少量杂质氯化钠的硝酸钾应降低温度结晶,提纯含少量杂质硝酸钾的氯化钠应蒸发溶剂结晶。
2.5 溶质质量分数的变化
考点归纳:饱和溶液溶质质量分数等于溶解度S/(100+溶解度S)*100%;同温下,溶解度相
等,同种溶质的饱和溶液溶质质量分数相等,比该温度下的同种溶质的不饱和溶液溶质质量分数大。该题型几种常见物质知识点总结如下:
(1)硝酸钾的溶解度随温度的升高而增大,而且受温度影响变化大,曲线向上。硝酸钾饱和溶液降低温度,溶解度变小,会有晶体析出,溶质质量减小,溶剂质量不变,溶液质量减小,为饱和溶液,溶质质量分数减小。硝酸钾饱和溶液升高温度,溶解度变大,不会有晶体析出,溶质质量不变,溶剂质量不变,溶液质量不变,为不饱和溶液,溶质质量分数不变。(2)氯化钠的溶解度随温度的升高而增大,而且受温度影响变化不大,曲线平缓向上。氯化钠饱和溶液恒温蒸发溶剂,溶解度不变,溶剂质量减小,会有晶体析出,溶质质量减小,溶液质量减小,为饱和溶液,溶质质量分数不变。
(3)氢氧化钙的溶解度随温度的升高而减小,曲线向下。氢氧化钙饱和溶液降低温度,溶解度变大,不会有晶体析出,溶质质量不变,溶剂质量不变,溶液质量不变,为不饱和溶液,溶质质量分数不变;氢氧化钙饱和溶液升高温度,溶解度变小,会有晶体析出,溶质质量减小,溶剂质量不变,溶液质量减小,为饱和溶液,溶质质量分数减小。固体溶解度曲线类试题涉及的知识点多,注重对溶解度的理解和应用,且常与数学图形结合起来,因此一般难度也比较大。在日常教学中时常关注和把握中考命题新趋势,对于改
进学习策略、转变学习方法、提高学习效率具有重要意义。
一.选择题
1.(福建南安)右图是甲、乙两种物质的溶解度曲线,下列说法正确
的是
A.甲的溶解度受温度影响比乙小
B.15℃时甲、乙的溶解度相等
C.30℃时乙的溶解度为30g
D.升高温度可使接近饱和
..
....的甲溶液变为饱和
2.(2010.绍兴)如图是A、B两种物质的溶解度曲线。在t1℃时往
两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分
搅拌后都加热到t2℃。下列说法正确的是( )
A.t1℃时,AB两物质的溶解度相等。两杯溶液均是不饱和溶液
B.t1℃时,AB两物质的溶解度相等,A溶液为饱和溶液,B溶液为不
饱和溶液
C.t2℃时,A的溶解度比B的溶解度大,两杯溶液均是不饱和溶液
D.t2℃时,A的溶解度比B的溶解度大,A溶液为不饱和溶液,B溶
液为饱和溶液
3.(10茂名)右图为A、B两种不带结晶水的固体物质溶解度曲线,下列说法不正确的是A.30℃时,A物质的溶解度为20g
B.20℃时,A和B的溶解度相同
C.10℃时,等质量的A和B饱和溶液中,B的溶剂最少
D.等质量的A、B的饱和溶液从30℃降到20℃时,B析出的晶体最多
4.(10苏州)根据下列几种物质溶解度曲线图,得到的结论正确的是
A.硝酸钾中混有少量氯化钠,采用蒸发结晶进行提纯
B.氢氧化钙饱和溶液降低温度后有晶体析出
C.80℃时,氯化钾与硫酸镁的溶解度相等
D.所有物质的溶解度均随温度的升高而增大或随温度的降低而减小
5.(10,威海)下列关于溶液的说法中,不正确的是
A B
C 0 t 1 20 t 2 温度/℃ g 40 溶解度
A .溶液中各部分性质相同,是一种高级混合物
B .氢氧化钠溶液能导电,是因为溶液中含有自由移动的离子
C .接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态
D .20℃,氯化钠的溶解度为36g ,则20℃时100g 氯化钠饱和溶液中含有氯化钠36g
6.(10江苏泰州)右图是甲、乙、丙三种物质的溶解度曲线.下列说法正确的是
A .在t 1℃时,三种物质的溶解度由大到水的顺序是甲>乙>丙
B .在t 2℃时,甲、乙两物质的溶解度相等
C .甲、乙、丙三种物质的饱和溶液升温都会转化为不饱和溶液
D .当乙的饱和溶液中混有少量丙时,可采用降温结晶的方法析出丙
7.(10海南)右图是甲、乙两种固体物质的溶解度曲线。据此判断
下列说法不正确的是:
A.t 2℃时,甲、乙的溶解度相等
B . t 3℃时,将60g 乙加入100g 水中可得l60g 溶液
C .乙的溶解度受温度影响很小
D .t l ℃时,乙的溶解度大于甲的溶解度
二.分析题
1. (10内江2)20℃时,碳酸氢钠的溶解度为9.7g ,其含
义是在20℃时___________________;工业上用氨碱法制纯
碱时,向饱和氨盐水中不断通入CO2,同时生成碳酸氢钠和
氯化铵,但却只有碳酸氢钠结晶析出,原因是________________________。
100g 水中溶解9.7g 碳酸氢钠即可达到饱和 相同温度下,氯化铵的溶解度比碳酸氢钠大
2. 右图为A
、
B
、C
三种物质的溶解度曲线,据图回答: ⑴ t 20C 时,A 、B 、C 三种物质的溶解度由大到小顺序是 A>B>C 。 ⑵ 将t 20C 时三种物质等质量的饱和溶液分别降温到00C 时,析出溶质 最多的是 A ,无溶质析出的是 C 。 ⑶ 20℃时,将30g A 物质放入50g 水中,充分搅拌,所得溶液的质量是 70 g 。 3.(10日照)右图是甲、乙两种固体物质的溶解度曲线。请回答:甲物
质在45℃时的溶解度为_______;甲、乙两物质的溶解度相等时的温
度是____℃;要使甲的不饱和溶液变为饱和溶液应_____________(填
“升高”、“降低”)温度;常压下,CO2在水中的溶解度随温度的变
化应类似于____(填“甲”、“乙”)曲线。
50 g 25 降低 乙
4.(2010辽宁鞍山)小明同学绘制了如右图所示A 、B 两种固体物质
的溶液度曲线:
(1)当温度为 ℃时,A 物质与B 物质的溶解度相等。
(2)若将B 物质从溶液中结晶析出,宜采用的方法是 。
(3)我国有许多盐碱湖,湖中溶有大量的NaCl 和Na 2CO 3,那
里的人们“冬天捞碱,夏天晒盐。”据此你认为图中 (填
“A ”或“B ”)物质的溶解度曲线与纯碱的相似。
(1)40 (2)加热蒸发 (3)A
5.(2010甘肃兰州)右图是某实验小组的同学绘制的两种固体物质的
溶解度曲线图。请你根据图示回答问题:
(1)t 1℃时,a 物质的溶解度 b 物质的溶解度 (填
“>”、“<”或“=”)。
(2)将t 2℃时a 、b 两种物质相同质量的饱和溶液,分别
冷却到t 1℃,析出晶体最多的是 物质。
(3)溶解度曲线图中的任何一点都表示溶液的一种特定状
态。图中A、B两个状态中,溶液属于不饱和状态的
是 ,状态最不稳定的是 。
(1)< (2)a (3)B A
5.(10河南)右图是某固体物质的溶解度曲线。
(1)30℃时,该物质的溶解度为 g。
(2)50℃时,将40g该物质加入到l00g水中,搅拌后得到的
是 (填“饱和"或“不饱和”)溶液;将该溶液降温到
20℃时可析出晶体 g
(1)40 (2)不饱和 10
7.(10本溪)下表列出了固体物质A在不同温度时的溶解度:
温度/℃0 10 20 30 40 50 60 70 80 90
溶解废/g 36 35 34 33 32 31 30 29 28 27
(1)70℃时,向盛有100g水的烧杯中加入30g固体A,充分溶解形成的是
(填“饱和”或“不饱和”)溶液,再将烧杯内物质温度降至20℃,此时溶液中溶质与溶剂的质量比为 (填最简整数比);
(2)通过对上表数据的分析,物质A的溶解度曲线
应是右图中的 (填“甲”或“乙”);
(1)饱和(2分) 3︰10(2分) (2)乙(2分)
8.(10无锡)右图AB两种固体物质的溶解度随温度变化的曲线。请回答
(1) ℃时,A、B两物质的溶解度相等
(2)20℃时,A物质的溶懈度 B物质的溶解度(填
“>”、“<”或“=”)。
(3)40℃时,将A、B各15 g分别加到均盛有50 g水的两只小
烧杯中,充分搅拌后,物质有剩余(填“A”或“B”)。
(4)现有50℃时A物质的不饱和溶液在不减少溶剂的情况下,欲
使其变成饱和溶液,下列措施肯定不能实现的是 (填
序号)。
①降低温度②升高温度③加人A物质
(1)30℃(2)<(3)B(4).
9.(10江西)甲、乙两种物质的溶解度曲线如右图。
(1)20℃时,甲物质的溶解度为 g;
(2) 40℃时,把40g甲物质放入100g水中,所得的溶液是
(选填“饱和”或“不饱和”);
(3)欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采用的
方法是;
(4) 40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到
20℃,所得甲物质溶液的质量(选填“>”或“=”或“<”)乙物质溶液的质量。
(1) 40 (2) 不饱和 (3) 加水或降温(4)<
10.(10武汉)有些金属的氢氧化物有相似的化学性质,但物理性质却有所不同,如Ca(OH)2,Ba(OH)2的溶解度就存在一定的差异,如下表所示:
温度/℃0 40 80
溶解度/g Ca(OH)20.187 0.141 0.094 Ba(OH)2 1.67 8.22 101.4
根据以上信息回答下列问题。
(1)下图中,表示Ca(OH)2溶解度曲线的是 ( 填“A”或“B”)。
(2)如果要将Ca(OH)2的不饱和溶液转为饱和溶液,可采取的方法是(只举一种)
(3)现有常温时含Ca(OH)2,Ba(OH)2两种溶质的某饱和溶液,若要得到较纯净的Ba(OH)2溶液,采取的物理方法为。
(1)B
(2)升高温度(或恒温蒸发溶剂、加溶液质、加氢氧化钙、加熟石灰、加消石灰、加Ca(OH)2,
加生石灰、加CaO 等)
(3)加热后趁热过滤(或升高温度后立即过滤;降温结晶、过滤,再将晶体溶于蒸馏水)
11.(10云南楚雄)如图是甲、乙两种物质的溶解度曲线,
回答下列问题:
(1)从甲物质的溶解度曲线可以得到哪些信息(请写出其中
的一条)___________________________。
(2)t 1℃时,甲、乙两种物质的溶解度较大的是___________。
(3)t 1℃时,将20g 甲物质放入50g 水中,充分搅拌能否全
部溶解____________(填“能”、“不能”或“无法判断”)。
(4)将一定量t 2℃时甲物质的饱和溶液降温到t 1℃时,该过
程中没有发生改变的是___________(填序号)
A.溶质质量
B.溶液质量
C.溶剂质量
D.溶质的质量分数
(1)甲的溶解度随着温度的升高而变大(其他合理答案也可)(2)乙(3)不能(4)C
1、如图是a 、b 、c 三种固体物质的溶解度曲线。 ①图中你能读出的信息有:(写两点) ; 。 ②要使接近饱和的C 物质的溶液变为饱和溶液,
可采取的一种措施有 。
③现有t 2℃时的a 、b 、c 三种物质的饱和溶液,
t(℃) 将其都降温至t 1℃时,析出溶质最多的是 。 ④t 2℃时,将60克a 物质放入100克水中,充分搅拌,所得溶液的质量是
克。 ⑤计算P 点(t 1℃),a 、c 两物质饱和溶液的溶质质量分数为 (精确到0.1%) 解析:(2)因为C 物质溶解度随温度升高而减小,故还可用升温法使其不饱和溶液转化为饱和溶度。
(3)a 曲线为陡升型,b 曲线为缓升型,故降温时析出a 更多。C 曲线为下降型,降温无物质析出。
(4)t 2℃时a 溶解度为50g ,所以溶液质量为100+50=150g ,剩余10ga 不能溶解。
(5)溶质质量分数=溶解度
溶解度+100×100%=12020×100%=16.7% 答案:(1)a 、b 两物质溶解度随温度升高而增大;C 物质溶解度随温度升高而减小;t 1℃时a 、c 两物质溶解度相等,为20g ;a 物质溶解度受温度变化的影响较大;0℃时a 、b 、c 三物质溶解度大小为c >b >a 等。
(2)升温,加溶质c ,蒸发溶剂
(3)a (4)150 (5)16.7%
2、下图是物质甲的溶解度曲线,请回答:
(1)t 2℃时,70g 甲的饱和溶液中含甲 g 。 (2)t 3℃时,若将40g 甲物质加入到100g 水
中,充分溶解后,所得溶液在图中可表示为 (填A 或B )点,若将其降温到t 1℃,能析出晶体
克。 答案:(1)20 (2)A 10
解析(1) 由4010040+=70甲m M 甲=20g (2)由图知t 3℃时甲溶解度大于40g ,故溶液
为不饱和溶液,可表示为曲线下方的A 点。t 1℃时100g 水中最多只能溶解甲物质30g ,则析出晶体质量为40-30=10g 。
S(g) t(℃) t 2 t 3
t 1
O 30
40 甲 A B
S(g) t 2 t 1 P b a
c 50 20 O
3、下图为A 、B 、C 三种物质的溶解度曲线,请回答
若A 中混有少量B ,可采用 方法分离;
若A 中混有少量C ,可采用 方法分离; 要从C 饱和溶液中提取出C 可采用 方法 答案:冷却热饱和溶液,升温结晶,蒸发溶剂 解析:从三种物质溶解度曲线的特点可知,A 的饱
和溶液降温时有较多的A 结晶析出,C 的饱和溶液升温
时有较多的C 结晶析出,B 曲线为缓升型,溶质质量受
温度变化影响很小。
二、掌握溶解度曲线的应用 1. 溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。
2. 可以比较在同一温度下不同物质溶解度的相对大小。
3. 根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。例如:某物质的溶解度曲线“陡”,表明该物质溶解度随温度变化明显,提纯或分离该物质时适合采用降温结晶法。某物质溶解度曲线“平缓”,提纯或分离该物质时适合采用蒸发溶剂法。
4. 从溶解度曲线上的交点,可以判断哪些物质在该点所示的温度下具有相同的溶解度。
5. 利用溶解度曲线可以确定一定质量的某物质的饱和溶液降温时析出晶体的质量。
1、 如图是x 、y 两种固体物质的溶解度曲线。下列说法正确的是( )
A. t 1℃时,x 的溶解度大于y 的溶解度
B. t 2℃时,x 的溶解度等于y 的溶解度
C. t 3℃时x 的饱和溶液降温至t 2℃时变为不饱和溶液
D. t 1℃时y 的饱和溶液升温至t 2℃时变为饱和溶液 解析:本题考查溶解度曲线的简单应用。由溶解度曲线可
知t 1℃时x 曲线在下,y 曲线在上,故t 1℃时y 的溶解度
大于x 的溶解度,故A 不正确;t 2℃时x 和y 相交,溶解
度相等,故B 正确;t 3℃时x 的饱和溶液降温至t 2℃时,
因x 物质的溶解度是随温度升高溶解度增大,随温度降低
而减小,故t 3℃时x 的饱和溶液降温至t 2℃时溶液仍为饱和溶液,C 错误;y 物质溶解度随温度升高而增大,t 1℃时y 的饱和溶液升温至t 2℃时,溶解度增大,将会成为不饱和溶液,故D 错。 答案:B
2、如图表示M 、N 两种固体物质的溶解度曲线,有关图示信息的描述正确的是( )
A. 20℃时M 的溶解度大于N 的溶解度
B. M 、N 都不是易溶物质
C. P 点表示M 、N 的溶解度相等
D. 阴影处M 、N 均为饱和溶液
解析:A 选项中要比较20℃时M 、N 的溶解度,可以在横
轴上的20℃处作与纵轴溶解度的平行线,不难看出20℃
时N 的溶解度大于M 的溶解度,即A 错误;同时我们还可
看出上述20℃时平行线与M 、N 的交点所对应的溶解度均
大于10g ,故M 、N 都属易溶物质,即B 错误;C 选项中P 点是M 曲线与N 曲线相交点,故表示P 点所对应该温度下M 、N 的溶解度相等,即C 正确;D 中由溶解度曲线面的意义可知,阴影部分M 线在下,N 线在上,故M 为饱和溶液,N 为不饱和溶液,即D 错误。 答案:C
S(g) t(℃
)
O A B C
3、根据下图溶解度曲线,回答下列问题
(1)氯化钠和纯碱晶体属于
物质(填“易溶”、“可溶”、“微溶”
或“难溶')
(2)我国某些盐湖里出产天然碱(主要成分为纯
碱)晶体,并含少量氯化钠杂质。要想从天然碱
中分离出较纯的纯碱晶体,应采用
方法。
(3)具体的实验步骤为:
①加热溶解②③④洗涤晾干
(4)完成①-②必备的实验仪器有铁架台、烧杯、玻璃棒、和
解析:本题综合考察了物质溶解度与溶解性的关系,溶解度曲线的应用,结晶分离混合物的方法及实验步骤和实验操作。本题注重了化学知识与生产生活实际的结合,突出了实验技能,这是今后中考命题的方向。从题中曲线可知,20时氯化钠与纯碱的溶解度均大于10克,氯化钠的溶解度受温度影响小,纯碱的溶解度受温度影响大,因此,分离纯碱与氯化钠混合物可采用冷却热饱和溶液的方法。
4、右图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶
液。下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不
带结晶水)( D )
A.从N→M:先向N中加入适量固体A再降温
B.从N→M:先将N降温再加入适量固体A
C.从M→N:先将M降温滤出晶体后再将其升温
D.从M→N:先将M升温再将其蒸发掉部分水
解析:M、N间的相互转化实际就是点的移动,M-N有三种路径:1、
向下再向右(加溶剂再升温);2、向右在向下(升温再加溶剂);3、
向左向下在向右(降温过滤后再升温);N-M有两种路径:1、向上在向左(加溶质或蒸发水再降温);2、向左再向上(降温在加溶质)据此故选D
5、图为甲、乙两种固体物质在水中的溶解度曲线。下列
说法错误的是( )
A.甲物质的溶解度随温度的升高而增大
B.在t1℃时,甲、乙两物质的溶解度相等
C.在t2℃时,N点表示甲物质的不饱和溶液
D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g
解析:A考线的含义正确B考查交点的含义正确C考查点
的含义(线下的点)正确D考查溶解度的概念100g溶剂
含溶质25g不是溶液故选D
6、右图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是( )
A.甲物质的溶解度为60g
B.t℃时,甲、乙两物质的溶解度相等
C.升高温度可使不饱和的甲溶液变为饱和
D.乙物质的溶解度随温度的升高而增大
解析:A考查溶解度四要素缺温度,错误B考查交点的含义正确故
选B;C考查点的移动线下方的点移到线下方更不饱和错误D考查
线的含义明显错误
7、X、Y两种固体物质的溶解度曲线如右图。下列说法中错误的是
( )
A、X的溶解度大于Y的溶解度
B、T3℃时,100g水中溶解了m2gX,降温至T2℃时溶液可恰好达到饱
和
C、T3℃时,100g水中溶解了m3gX,降温至T2℃时可析出(m3-m2)g晶体(不含结晶水)
D、T2℃时,X与Y的溶解度相同
答案:A
8、a、b、c三种物质的溶解度曲线如右图所示。
(1)t1℃时三种物质的溶解度的大小顺序是______ 。
(2)t3℃时,将a、b、c分别溶解在50g水中,均形成了饱和溶液,
冷却到t1℃时析出晶体最多的是______。 (3)n点表示______。
(4)为从混有少量c的a中提纯a,可采用_____ 法。
(5)t1℃时,取50ga的饱和溶液,将其温度升高到t2℃时溶液中a
的质量分数将______(填“变大”或“变小”或“不变”)。
答案:(1)b>c=a (2)a (3)t2时a、b的溶解度相等 (4)降温结晶(5)不变
9、T3O C时,将A、B、C三种物质分别溶于100克水中,制成饱和溶液.这三种物质的溶解度随温度而变化的曲线如右图.从T 3降至T1,下列有关说法正确的是
()
A.T3O C时,由A物质所形成的溶液的物质的量浓度最大
B.T2O C时,由A、C两物质形成的溶液质量分数相等
C.T1O C时,由B物质所形成的溶液质量分数最大,C的最小
D.T1O C时,由A物质所形成的溶液的质量分数最小
答案:C
10、溶解度曲线中的任何一点都表示溶液的一种特定状态。当溶液状
态发生变化时,表示溶液状态的点的位置(坐标)也将发生相应的改
变。某固态物质的溶解度曲线如图所示,试根据图回答下列
问题。
(1) A点的意义是______。
(2)若A、B两点的溶液在保持温度不变的情况下各加20g水,
A点的溶解度将______(填“增大”或“减小”或“不变”),
A、B的溶液中溶质的质量分数______(填“前者大”或“后者
大”或“相等”)。
(3)当处于A、B点状态的该溶液分别发生下列变化(其他
条件不变)时, 试参考表中例示描述A、B点的变动过程。
A点的变动B点的变动
①升高温度向右平移
②降低温度
③蒸发溶剂
④稀释溶液
(4)将该溶液从状态A改变为B有多种途径。试设计并简述一操作最简单、结果最准确的实验途径:
答案:(1)表示T2时该物质溶解度为S2g (2)不变、前者大
(3)
向右平移
沿曲线下移向左平移至曲线,再沿曲线下移
不动垂直上移至曲线,不再变动
垂直下移垂直下移
(4)将A状态的该溶液降温至T1,过滤除去析出的该物质晶体后,将溶液升温至T3
初三化学:溶解度知识点归纳 1.固体物质的溶解度 (1)定义:一种物质溶解在另一种物质里的能力叫溶解性.溶解性的大小与溶质和溶剂 的性质有关.根据物质在20℃时溶解度的大小不同,把物质的溶解性通常用易溶、可溶、 微溶、难溶等概念粗略地来描述. (2)固体的溶解度概念:在一定温度下,某固体物质在100g溶剂里达到饱和状态时 所溶解的质量,叫做这种物质在这种溶剂里的溶解度. 在理解固体的溶解度概念时,要抓住五个要点: ①“在一定温度下”:因为每种固体物质的溶解度在一定温度下有一个对应的定值,但这定值是随温度变化而变化的,所以给某固体物质的溶解度时,必须指出在什么温度下的溶解度才有意义. ②“在100g溶剂里”:溶剂质量有规定的值,统一为100g,但并不是100g溶液,在 未指明溶剂时,一般是指水. ③“饱和状态”:所谓饱和状态,可以理解为,在一定温度下,在一定量的溶剂里,溶质的溶解达到了最大值. ④“所溶解的质量”:表明溶解度是有单位的,这个单位既不是度数(°),也不是质量分数(%),而是质量单位“g”. ⑤“在这种溶剂里”:就是说必须指明在哪种溶剂里,不能泛泛地谈溶剂.因为同一种物质在不同的溶剂里的溶解度是不相同的. (3)影响固体溶解度大小的因素 ①溶质、溶剂本身的性质.同一温度下溶质、溶剂不同,溶解度不同.
②温度的高低也是影响溶解度大小的一个重要因素.固体物质的溶解度随温度的不同而不同.大多数固态物质的溶解度随温度的升高而升高;少数物质(如氯化钠)的溶解度受温度的影响很小;也有极少数物质(如熟石灰)的溶解度随温度的升高而降低. (4)固体物质溶解度的计算 a根据:温度一定时,饱和溶液中溶质、溶剂的质量与饱和溶液质量成正比.
初三化学:溶液、溶解度知识点梳理 要点梳理: 一、溶液 1.溶液的定义:一种或几种物质分散在另一种物质中,形成均一、稳定的混合物叫做溶液。 2,溶液的特征 (1)均一性:是制溶液各部分组成、性质完全相同。 (2)稳定性:是指外界条件不变(温度、压强等),溶剂的量不变时,溶液长期放置不会分层也不会析出固体或气体。 二、、饱和溶液与不饱和溶液 1,概念: (1)饱和溶液:在一定温度下、一定量的溶剂里,不能溶解某种绒织的溶液,叫做这种溶质的饱和溶液。 (2)不饱和溶液:在一定温度下、一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。 2.饱和溶液与不饱和溶液的意义在于指明“一定温度”和“一定量的溶剂”,且可以相互转化: 饱和溶液不饱和溶液 三、、固体物质的溶解度以及溶解度曲线 1.概念: 在一定温度下,某固体物质在100g溶剂里达到饱和状态时,所溶解溶质的质量,叫做这种物质在这种溶解里的溶解度。 2.影响固体溶解度大小的因素 (1)溶质、溶剂本身的性质 (2)温度
3.溶解度曲线 (1)溶解度曲线的意义: ①溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。 ②溶解度曲线上的每一个点表示溶质在某一温度下的溶解度。此时,溶液必定是饱和溶液。 ③两条曲线的交叉点表示两种物质在该温度下具有相同的溶解度。在该温度下,这两种物质的饱和溶液中溶质的质量分数相等。 ④在溶解度曲线的下方的点,表示该温度下的溶液是该物质的不饱和溶液。 ⑤在溶解度曲线上方的点,表示该温度下的溶液是该物质的过饱和溶液,也就是说,在溶液中存在未溶解的溶质。 (2)溶解度曲线变化的规律 大多数固体物质的溶解度随温度的升高而增大,一般表现在曲线“坡度”比较“陡”,如硝酸钾;少数固体物质的溶解度受温度的影响较小,表现在曲线的“坡度”比较“平缓”,如氯化钠;极少数固体物质的溶解度随温度的升高而减小,表现在曲线的“坡度”下降,如熟石灰。 四、结晶的方法: (1)蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液又不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。适用范围:溶解度受温度变化影响不大的物质,如氯化钠。 (2)降温结晶(冷却热饱和溶液法)冷却热的饱和溶液,使溶质从溶液中结晶析出。适用范围:溶解度受温度变化影响较大的物质,如氯酸钾。
一、溶液 1.溶液的定义:一种或几种物质分散在另一种物质中,形成均一、稳定的混合物叫做溶液。 2,溶液的特征 (1)均一性:是制溶液各部分组成、性质完全相同。 (2)稳定性:是指外界条件不变(温度、压强等),溶剂的量不变时,溶液长期放置不会分层也不会析出固体或气体。 二、、饱和溶液与不饱和溶液 1,概念: (1)饱和溶液:在一定温度下、一定量的溶剂里,不能溶解某种绒织的溶液,叫做这种溶质的饱和溶液。 (2)不饱和溶液:在一定温度下、一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。 2.饱和溶液与不饱和溶液的意义在于指明“一定温度”和“一定量的溶剂”,且可以相互转化: 饱和溶液不 饱和溶液 三、、固体物质的溶解度以及溶解度曲线 1.概念: 在一定温度下,某固体物质在100g溶剂里达到饱和状态时,所溶解溶质的质量,叫做这种物质在这种溶解里的溶解度。 2.影响固体溶解度大小的因素 (1)溶质、溶剂本身的性质 (2)温度 3.溶解度曲线 (1)溶解度曲线的意义: ①溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。 ②溶解度曲线上的每一个点表示溶质在某一温度下的溶解度。此时,溶液必定是饱和溶液。 ③两条曲线的交叉点表示两种物质在该温度下具有相同的溶解度。在该温度下,这两种物质的饱和溶液中溶质的质量分数相等。 ④在溶解度曲线的下方的点,表示该温度下的溶液是该物质的不饱和溶液。 ⑤在溶解度曲线上方的点,表示该温度下的溶液是该物质的过饱和溶液,也就是说,在溶液中存在未溶解的溶质。 (2)溶解度曲线变化的规律 大多数固体物质的溶解度随温度的升高而增大,一般表现在曲线“坡度”比较“陡”,如硝酸钾;少数固体物质的溶解度受温度的影响较小,表现在曲线的“坡度”比较“平缓”,如氯化钠;极少数固体物质的溶解度随温度的升高而减小,表现在曲线的“坡度”下降,如熟石灰。 四、结晶的方法: (1)蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液又不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。适用范围:溶解度受温度变化影响不大的物质,如氯化钠。 (2)降温结晶(冷却热饱和溶液法)冷却热的饱和溶液,使溶质从溶液中结晶析出。适用范围:溶解度受温度变化影响较大的物质,如氯酸钾。 溶解度知识点
中考化学溶液知识点总结 【考点1】溶液的概念和基本特征 一、溶液的概念 1.溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。 2.溶液的组成:溶液是混合物,由溶质和溶剂组成。溶液的质量=溶质的质量+溶剂的质量;溶液的体积≠溶质体积+溶剂体积 溶质:被溶解的物质。可以是固体、液体或气体。一种溶液中的溶质可以是一种或多种物质。 溶剂:能溶解其他物质的物质。水是最常见的溶剂。汽油、酒精也可以作为溶剂。 二、溶液的基本特征 ①均一性:指溶液形成以后,溶液各部分的组成、性质完全相同。如溶液中部分的浓度、密度和颜色完全一样。 ②稳定性:外界条件不变是溶液长期放置,溶质不会从溶液中分离出来。 ③是混合物。 【规律】溶液的判别 (1)澄清透明不代表是无色的。 (2)均一稳定的液体不一定是溶液,如水。 【举例】硬水、空气、纯净水属于溶液;泥水,油水,蒸馏水不是溶液。 【技巧】溶质、溶剂的判定 ①通常不指明溶剂的溶液,一般是水溶液。 ②当固体、气体溶于液体时,固体、气体做溶剂,液体做溶剂。 ③当两种液体互相溶解时,量多的叫做溶剂,量少的叫做溶质。 ④当物质溶解发生化学变化时,一定要正确判断溶质。 ⑤溶质和溶剂是溶液所特有的概念,悬浊液和乳浊液不存在溶质和溶剂。 ⑥溶质质量是指溶液中已溶解溶质的质量。
影响物质溶解能力的因素: 1、相似相容,溶质和溶剂的性质相似,溶解能力越强。如:氯化钠易溶于水,难溶于油,碘易溶于汽油,那溶于水。 1、大部分物质稳定越高,溶解能力越强。 对于气体,压强越大溶解能力越强。 【考点2】溶液和浊液 1、浊液:包括乳浊液和悬浊液。 2、乳浊液:小液滴分散到液体里形成不均一的、不稳定的混合物叫乳浊液。 悬浊液:固体颗粒分散到液体里形成不均一的、不稳定的混合物叫悬浊液。 3、溶液和浊液的区别
溶液溶解度知识点总结 一、溶液选择题 1.下表是NaCl、KNO3在不同温度时的溶解度: 温度/℃102030405060 NaCl35.836.036.336.637.037.3 溶解度/g KNO320.931.645.863.985.5110 据此数据,判断下列说法错误的是 A.KNO3和NaCl的溶解度曲线在20℃—30℃温度范围内会相交 B.在60℃时,KNO3的饱和溶液105g加入95g水后,溶液中溶质的质量分数为27.5%C.在20℃时,NaCl和KNO3固体各35g分别加入两只各盛有100g水的烧杯中,均不能形成饱和溶液 D.从含有少量NaCl的KNO3饱和溶液中得到较多的KNO3晶体,通常可采用冷却热饱和溶液的方法 【答案】C 【解析】 A、根据表格提供的数据可以发现,在20℃~30℃温度范围内硝酸钾和氯化钠存在溶解度相同的数值,KNO3和NaCl的溶解度曲线在20℃~30℃温度范围内会相交,错误; B、在60℃时,硝酸钾的溶解度为110g,则105g的KNO3饱和溶液,含有硝酸钾55g,加入95g 水后,溶液中溶质的质量分数=×100%=27.5%,错误;C、在20℃时,氯化钠的溶解度为36g,硝酸钾的溶解度为31.6g,NaCl 和KNO3固体各35g分别加入两只各盛有100g 水的烧杯中,氯化钠不能形成饱和溶液,硝酸钾形成饱和溶液,正确;D、硝酸钾的溶解度随温度的升高而变化很大,含有少量NaCl的KNO3饱和溶液中得到较多的KNO3晶体,通常采用冷却热的饱和溶液的方法,错误。故选C。 点睛:掌握溶解度随温度变化的特点以及饱和溶液中结晶析出晶体的方法是正确解答本题的关键。 2.实验室用KClO3制氧气并回收MnO2和KCl,下列操作不规范的是( ) A.用装置甲收集氧气 B.用装置乙溶解完全反应后的固体
《溶液》知识点 一、溶液的形成 二、溶解度 1、固体的溶解度 (1)溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量 四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克 (2)溶解度的含义: 20℃时NaCl的溶液度为36g含义: 在20℃时,在100克水中最多能溶解36克NaCl 或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克 (3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度 大多数固体物的溶解度随温度升高而升高;如KNO 3 少数固体物质的溶解度受温度的影响很小;如NaCl 极少数物质溶解度随温度升高而降低。如Ca(OH) 2 (4)溶解度曲线 ℃时A的溶解度为 80g 例:(1)t 3 (2)P点的含义在该温度时,A和C的溶解度 相同 (3)N点为 t ℃时A的不饱和溶液,可通过加 3 入A物质,降温,蒸发溶剂的方法使它变为饱和 (4)t ℃时A、B、C、溶解度由大到小的顺序C>B>A 1
(5)从A溶液中获取A晶体可用降温结晶的方法获取晶体。(6)从B的溶液中获取晶体,适宜采用蒸发结晶的方法获取晶体。 (7)t 2℃时A、B、C的饱和溶液各W克,降温到t 1 ℃ 会析出晶体的有A和B 无晶体析出 的有 C,所得溶液中溶质的质量分数由小到大依次为 A {}{}{}如:集合,,,、、A x y x B y y x C x y y x A B C ======|lg |lg (,)|lg 高考前数学知识点总结 1. 对于集合,一定要抓住集合的元素一般属性,及元素的“确定性、互异性、无序性”。 中元素各表示什么? 2.数形结合是解集合问题的常用方法:解题时要尽可能地借助数轴、直角坐标系或文氏图等工具,将抽象的代数问题具体化、形象化、直观化,然后利用数形结合的思想方法解决; 3.已知集合A 、B ,当A B ?=?时,你是否注意到“极端”情况:A =?或B =?; 4. 注意下列性质:(1) 对于含有n 个元素的有限集合M, 其子集、真子集、非空子集、非空真子集的个数依次为n 2,n 21-, n 21-, n 2 2.- ()若,;2A B A B A A B B ??== (3):空集是任何集合的子集,任何非空集合的真子集。 5. 学会用补集思想解决问题吗?(排除法、间接法) 6.可以判断真假的语句叫做命题。 若为真,当且仅当、均为真p q p q ∧若为真,当且仅当、至少有一个为真p q p q ∨ 7. 命题的四种形式及其相互关系是什么?(互为逆否关系的命题是等价命题。) 原命题与逆否命题同真、同假;逆命题与否命题同真同假。 8.注意四种条件,判断清楚谁是条件,谁是结论; 9. 函数的三要素是什么?如何比较两个函数是否相同?(定义域、对应法则、值域) 10. 求函数的定义域有哪些常见类型? 11. 如何求复合函数的定义域? 12. 求一个函数的解析式或一个函数的反函数时,需注明函数的定义域。 13. 反函数存在的条件是什么?(一一对应函数) 求反函数的步骤掌握了吗?(①反解x ,注意正负的取舍;②互换x 、y ;③反函数的定义域是原函数的值域) 14. 反函数的性质有哪些? ①互为反函数的图象关于直线y =x 对称;②保存了原来函数的单调性、奇函数性; \ 1 / 第2讲溶解度应用及溶质质量分数 溶液的溶解度 1、 固体溶解度:在一定温度下,某固体物质在100g 溶剂里达到饱和状态时所溶解的质量。(符号 为S ,单位为g )。 溶解度含义:“20℃时NaCl 的溶解度为36g”的含义:在20℃时,NaCl 在100g 水中达到饱和状态时所溶解的质量为36g 。 2、四要素: ?温度——必须指明具体的温度,溶解度才有意义。?溶剂的质量是100g 。 ?固体溶解在溶剂中,必须达到饱和状态。? 溶解度的单位通常是g 。 3、影响固体溶解度的因素:(内因)溶质性质、溶剂性质;(外因)温度。 4、溶解度与溶解性 在20℃下,溶解度小于0.01g ,被称为难溶(或不溶);溶解度介于0.01~1g 之间,被称为微溶;溶解度介于1~10g 之间,被称为可溶;溶解度大于10g ,被称为易溶。 5、溶解度曲线的常见试题(右图) ?t 3℃时A 的溶解度为 80g 。 ?P 点的的含义是: 在t 2℃时,A 和C 的溶解度相同 。? N 点为 t 3℃时A 的不饱和溶液 ,可通过加入A 物质,降温或者蒸发溶剂的方法使它变为饱和。 曲线上的点代表对应温度的饱和溶液,曲线以下的点代表该物质对应温度的不饱和溶液。 加溶质相当于把点向正上方移动(但是点不能被移动到图线上方),加溶剂相当于向下竖直移动,降温相当于向左水平移动,升温相当于向右水平移动。 ?t 1℃时A 、B 、C 溶解度由大到小的顺序 B >C > A 。?从A 溶液中获取A 晶体可用 降温结晶 的方法获取晶体。 ?从B 的溶液中获取晶体,适宜采用 蒸发结晶 (冷却热饱和溶液)的方法获取晶体。? t 2℃ 时A 、B 、C 的饱和溶液各W 克,降温到t 1℃会析出晶体的有 A 和B ,无晶体析出的有 C ,所得溶液中溶质的质量分数由小到大依次为 A <C <B 。? 除去A 中的泥沙用 过滤 法;A 中混有少量的B ,提纯A 用降温结晶(冷却热饱和溶液);B 中混有少量的A ,提纯B 用蒸发结晶。 80 · · t 2 3N t /℃ S/g P A B C 难溶 Unit 1 Wise men in history(1) Date:_______ name:_______ 【知识要点】 ★必记单词 golden adj. 金的;金色的Olympics n. [pl.]奥运会 agreement n. 同意;应允pot n. 罐 doubt v. 不能肯定;对……没把握real adj. 真的;正宗的 】 truth n. 真相;实情seem v. 好像;似乎 solve v. 解决;处理fill v. 装满;注满 bowl n. 碗;盆brave adj. 勇敢的;无畏的 metal n. 金属certain adj. 确定的;肯定的prison n. 监狱;牢狱hit v. (hit,hit)(用手或器具)击;打correct adj. 准确无误的;正确的mistake n. 错误 less det.(与不可数名词连用)较少的;更少的 ( ★常考短语 in ancient Greece 在古希腊 (be) happy with (对某人或事物)满意的= be pleased/satisfied with fill…with…用……把……装满think about = consider 考虑;思考 be filled with=be full of 充满;装满run over 溢出 ask sb for sth 向某人要某物one…the other…一个……另一个……send sb to prison 把某人关进监狱tell the truth 说实话 。 make sure 确保;设法保证something else 别的东西both…and… ……和……都…… be made of +看得见的原材料由……制成 溶解度/g t/℃ 21m m m m 溶解度曲线知识点 一、正确理解溶解度曲线的涵义 溶解度曲线就是在直角坐标系中,用来描述物质的溶解度随温度变化而变化的曲线。根据溶解度曲线可进行溶液的配制,混合物的分离与提纯,以及进行物质结晶或溶解的计算。 点 ① 曲线上的点:表示对应温度下该物质的溶解度。如:下图中a 表示 A 物质在t 1℃时溶解度为m 1g 。 曲线上方的点:表示在对应温度下该物质的饱和溶液中存在 不能继续溶解的溶质。如:图中b 表示在t 1℃时,A 的饱和溶液中有 (m 2-m 1)g 未溶解的溶质。 曲线下方的点:表示在对应温度下该物质的不饱和溶液。如: 图中C 表示在t 1℃时,A 的不饱和溶液中,还需要加入(m 1-m 3)gA 物质才达到饱和。 ②曲线交点:表示在对应温度下不同物质的溶解度相同。如图中d 表示在t 2℃,A 、B 两物质的溶解度都为m 4g 。 2、线 如图中A 物质的溶解度随温度升高而明显增大,A 曲线为“陡升型”。 如KNO 3等大多数固体物质: 图中B 物质的溶解度随温度变化不大,B 曲线为“缓升型”, 如NaCl 等少数固体物质。 图中C 物质的溶解度随温度升高而减小,C 曲线为“下降型”,如气体及Ca(OH)2等极少数固体物质。 二、掌握溶解度曲线的应用 1. 溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。 2. 可以比较在同一温度下不同物质溶解度的相对大小。 3. 根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。例如:某物质的溶解度曲线“陡”,表明该物质溶解度随温度变化明显,提纯或分离该物质时适合采用降温结晶法。某物质溶解度曲线“平缓”,提纯或分离该物质时适合采用蒸发溶剂法。 4. 从溶解度曲线上的交点,可以判断哪些物质在该点所示的温度下具有相同的溶解度。 5. 利用溶解度曲线可以确定一定质量的某物质的饱和溶液降温时析出晶体的质量。 溶解度曲线专题练习 1. 甲、乙两物质的溶解度曲线如图所示,下列说法正确的是 溶解度/g 度 五年级美术知识要点分析 一、指导思想: 以新课程理念为指导,在全面实施新课程过程中,加大力度、教改力度,深化教学方法和学习方式的研究。正确处理改革与发展创新与质量的关系,继续探索符合新课程理念的小学美术理论联系实践的教学方式和自主化多操纵学习方式。 二、教材分析: 这一册教材包括下面一些内容:《家乡美》、《逛大街》、《聪明的机器人》、《欢乐陶吧》、《同一幅画》、《星光灿烂》、《团扇》、《大地飞虹》、《编花篮》、《生命的甘露》、《飞天畅想》、《我们往旅行》等内容。 三、学生情况分析: 五年级的学生经过几年的学习认知和练习,已把握了很多简单的基本绘画知识和技能,同时也具备了一定的辨别认知能力和创造力,具备一定的辨别妍媸的能力和表现力,但在绘画,动手过程中还缺乏大胆想象创造,这些方面有待进步。 四、教学目标 : 1、通过有趣的美术表现和欣赏活动,激发学生学习爱 好。 2、运用多种材料和工具,进行绘画和简单工具制作。 3、培养学生空间知觉,形象记忆,创造等能力五、教学措施: 1、努力钻研教材,认真学习教学大纲,加强自身学习,不断进步自身素质。 2、做好课前预备,精心制作教具。 3、运用现代远程教学手段,培养学生绘画爱好。 4、充分展示图片,作品等教学手段,师加以示范。 六、从教材分析学科知识要点与难点 第 1 课《家乡美》 1、教学目标: a、了解、学习风景画的表现方法。 b、学习图案的设计的基本方法。 c、培养学生组织安排版面的能力。 d、激发学生热爱家乡、歌颂宣传家乡的情感。 2、教学重、难点: a、学习图案设计的基本方法。 b、掌握学生组织安排版面的能力第 2 课《逛大街》 1、教学目标: 溶解度 1、固体的溶解度 (1)溶解度的定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量 四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:溶解度的单位:克 (2)溶解度的含义:20℃时NaCl的溶液度为36g含义: 在20℃时,在100克水中最多能溶解36克NaCl 或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克 (3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度 大多数固体物的溶解度随温度升高而升高;如KNO3 少数固体物质的溶解度受温度的影响很小;如NaCl 极少数物质溶解度随温度升高而降低。如Ca(OH)2 例: (4)溶解度曲线 (1)t3℃时A的溶解度为80g (2)P点的的含义在该温度时,A和C的溶解度相同 (3)N点为t3℃时A的不饱和溶液,可通过加入A 物质,降温,蒸发溶剂的方法使它变为饱和 (4)t1℃时A、B、C、溶解度由大到小的顺序C>B>A (5)从A溶液中获取A晶体可用降温结晶的方法获取 晶体。 (6)从B的溶液中获取晶体,适宜采用蒸发结晶的方法获取晶体 (7)t2℃时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有A和B 无晶体析出的有 C (8)除去A中的泥沙用过滤法;分离A与B(含量少)的混合物,用结晶法 2、气体的溶解度 (1)气体溶解度的定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到 饱和状态时的气体体积。 (2)影响因素:①气体的性质②温度(温度越高,气体溶解度越小) ③压强(压强越大,气体溶解度越大) 3、混合物的分离 (1)过滤法:分离可溶物+ 难溶物 (2)结晶法:分离几种可溶性物质 结晶的两种方法蒸发溶剂,如NaCl(海水晒盐) 降低温度(冷却热的饱和溶液,如KNO3) 蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液由不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。适用范围:溶解度受温度变化影响不大的物质,如氯化钠。 降温结晶(冷却热饱和溶液法):冷却热的饱和溶液,使溶质从溶液中结晶析出。适用范围:溶解度受温度变化影响较大的物质,如氯酸钾。 新人教版九年级下册初中化学 重难点突破 知识点梳理及重点题型巩固练习 溶解度和溶质的质量分数(基础) 【学习目标】 1.掌握饱和溶液、不饱和溶液、溶解度等概念及相互关系;掌握溶解度曲线的意义及应用。 2.认识一种溶液组成的表示方法——溶质的质量分数;掌握溶质质量分数的有关计算。 3.初步学会配制一定溶质质量分数的溶液。 【要点梳理】 要点一、饱和溶液、不饱和溶液(《溶解度》一) 1.饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液。 2.不饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时的溶液,叫做不饱和溶液。 3.饱和溶液、不饱和溶液的转化方法: 大多数情况下饱和溶液和不饱和溶液存在以下转化关系(溶质为固体): 4.判断溶液是否饱和的方法: 一般说来,可以向原溶液中再加入少量原溶质,如果溶解的量不再增大则说明原溶液是饱和溶液,如果溶解的量还能增大则说明原溶液是不饱和溶液。 【要点诠释】 1.饱和溶液、不饱和溶液概念的理解 (1)首先要明确“一定条件”、“一定量的溶剂”。在某一温度和一定量的溶剂里,对某种固态溶质来说饱和了,但若改变温度或改变溶剂的量,就可能使溶液不饱和了。如室温下,100 g水中溶解31.6 g KNO3达到饱和,若升高温度或增大溶剂(水)量,原来饱和溶液就变为不饱和溶液。所以溶液饱和与否,首先必须明确“一定条件”和“一定量的溶剂”。 (2)必须明确是某种溶质的饱和溶液或不饱和溶液。如:在一定条件下不能再溶解食盐的溶液,可能还能继续溶解蔗糖,此时的溶液对于食盐来说是饱和溶液,但是对于蔗搪来说就是不饱和溶液。 2.由于Ca(OH)2的溶解度在一定范围内随温度的升高而减小,因此将Ca(OH)2的不饱和溶液转化为饱和溶液,在改变温度时应该是升高温度;将熟石灰的饱和溶液转化为不饱和溶液,在改变温度时应该是降低温度。 要点二、溶解度、溶解度曲线 1.固体的溶解度:(《溶解度》二) 在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。如果不说明溶剂,通常所说的溶解度是指物质在水里的溶解度。 2.正确理解固体的溶解度概念需要抓住四个因素: (1)一定温度。同一种固体物质在不同温度下对应的溶解度是不同的,因此必须指明温度。 最新溶液溶解度知识点题型经典 一、溶液选择题 1.某固体物质的溶解度曲线如图所示,在100g水中加入120g固体,充分搅拌,在不同温度下存在①②③④四种状态.对这四种状态的描述正确的是 A.状态①为不饱和溶液, 状态②③④均为饱和溶液 B.状态①降温至10℃,有110g晶体析出 C.各状态的溶质质量分数:①>②>③>④ D.将状态②加水200g再降温至40℃可达到状态③ 【答案】A 【解析】 A、溶解度曲线上的点对应是该温度的饱和溶液,溶解度曲线下方的点对应是该温度的不饱和溶液,①在溶解度曲线的下方为90℃该物质不饱和溶液,②③④在溶解度曲线上为一定温度下的饱和溶液,正确; B、10℃时,该物质的溶解度为20g,此时100g水能溶解20g 溶质;状态①降温至10℃,有(120g-20g)=100g晶体析出,错误; C、状态①的质量分数 = 120 100120 g g g + ×100%=54.5 %;②③④在溶解度曲线上为一定温度下的饱和溶液,一定温 度下,饱和溶液的溶质质量分数= s 100s + ×100%,状态②的质量分数 = 120 100120 g g g + ×100%=54.5 %;状态③的质量分数= 65 10065 g g g + ×100%=39.3 %;状态④ 的质量分数= 35 10035 g g g + ×100%=25.9 %;各状态的溶质质量分数:④=③>②>①;错 误;D、将状态②加水200g时,溶液中有水300g,溶质120g,再降温至40℃时,若可达 到状态③,则40℃时该物质的溶解度为40g,根据溶解度曲线可知40℃时,该物质的溶解度大于60g,错误。故选A。 点睛:一定温度下,饱和溶液的溶质质量分数= s 100s + ×100%。 2.氯化铵和硝酸钾溶解度曲线如图所示,下列叙述正确的是( ) A.50℃时,氯化铵的溶解度大于硝酸钾 B.a℃时,氯化铵与硝酸钾溶液的质量分数相等 C.将60℃的硝酸钾饱和溶液降温会变为不饱和溶液 D.40℃时,50g水中加入50g硝酸钾,充分搅拌,得到质量分数约为39%的硝酸钾溶液【答案】D 【解析】 【分析】 【详解】 A、从图中看出,50℃时,硝酸钾的溶解度大于氯化铵的,故A不正确; B、a℃时,硝酸钾和氯化铵的溶解度曲线相交,此时两物质的溶解度相等,则其饱和溶液的溶质质量分数相等,其不饱和溶液的质量分数是否相等无法确定,故B不正确; C、硝酸钾的溶解度随温度的升高明显增大,将60℃时硝酸钾饱和溶液降温后会析出晶体,剩余的溶液仍然是低温下的饱和溶液,故C不正确; D、40℃时,硝酸钾的溶解度为64g,则50g水中最多溶解硝酸钾32g,所得溶液的溶质质 量分数为 32g 100%39% 32g+50g ?≈,故D正确。 故选D。 3.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是( ) 溶解度重要知识点 溶解度曲线相关练习 1. 甲、乙两物质的溶解度曲线如图所示,下列说确的是( ) A .甲和乙的饱和溶液,从t 1℃升温到t 2℃,仍是饱和溶液 B .t 1℃时,甲和乙的溶解度相等 C .t 1℃时,甲和乙各30g 分别加入80g 水中,均能恰好完全溶解 D .t 2℃时,在100g 水中放入60g 甲,形成不饱和溶液 2. 右图是a 、b 两种固体物质的溶解度曲线。从图中可获得的信息是( ) A. 固体物质的溶解度均随温度升高而增大 B .t ℃,相同质量的a 、b 溶解时放出热量相同 C .升高温度,可使a 或b 的饱和溶液变为不饱和溶液 D .将相同质量的a 、b 分别加入100g 水中,所得溶液质量分数相同 3.右图是甲、乙两种固体物质的溶解度曲线,下列说确的是( ) A .甲的溶解度大于乙的溶解度 B .乙的不饱和溶液降温可变成饱和溶液 C .20o C 时,甲、乙两种物质的溶解度相等 D .50o C 时,甲的饱和溶液中溶质的质量分数为40% 4. 右图是a 、b 两种固体物质(不含结晶水)的溶解度曲线。下列说确的是( ) A .b 的溶解度大于a 的溶解度 B .t 1℃时,将a 、b 两种物质的饱和溶液分别恒温蒸发等质量的 水,析出晶体的质量一定相等 C .将t 2℃时的b 的不饱和溶液降温至t 1℃,一定能得到b 的饱 和溶 液 D .t 2℃时,a 溶液的溶质质量分数一定小于b 溶液的溶质质量分数 5.右图是a 、b 两种固体物质的溶解度曲线,下列说法中正确的是 A .a 的溶解度大于b 的溶解度 B .在20℃时,a 、b 的溶液中溶质的质量分数相同 C .a 、b 的溶解度都随温度升高而增大 D .a 、b 都属于易溶物质 6.t 2℃时往盛有100g 水的烧杯中先后加入a g M 和a g N (两种物质溶解时互不影响,且溶质仍是M 、N ),充分搅拌。将混合物的温度降低到t 1℃,下列说确的是( ) A.t 2℃时,得到M 的饱和溶液 B.t 2℃时,得到N 的不饱和溶液 C .温度降低到t 1℃时,M 、N 的溶质质量分数相等,得到M 、N 的不饱和溶液 D.温度降低到t 1℃时,M 、N 的溶解度相等,得到M 、N 的饱和溶液 7.右图是a 、b 、c 三种固体物质的溶解度曲线,下列叙述正确的是( ) 50- 40- 30- 20- 10- 甲 乙 温度/ t 1 t 2 溶 解度/g 项目一税收基础知识 一、税收的概念(了解) 1.税收的定义 税收:全称“国家税收”,简称“税”,是以国家为主体,为实现国家职能,凭借政治权利,按照法律标准,采用强制性手段,无偿取得财政收入的特定分配形式。 2.税收与国家、经济、财政、法律之间的关系(关联知识点) (1)税收与国家的关系 税收以国家为主体,与国家政权紧密联系的一种特定分配。国家的存在是税收产生和存在的一个前提条件(税收产生的政治条件;税收产生的经济条件是剩余产品的出现和日益增多),而税收又是国家赖以生存的重要物质基础,是国家财政收入的主要来源。 (2)税收与经济的关系 经济决定税收,税收能调节、影响经济。 (3)税收与财政的关系 税收是财政收入的主要形式,是国家财政的重要支柱,国家财政收入的90%左右来自税收。 (4)税收与法律的关系 税法是法学概念,税收是经济学概念,二者密不可分。税法是税收的法律表现形式,税收是税法所确定的具体内容。 3.税收的本质(关联知识点) (1)税收的主体是国家和政府; (2)国家征税凭借的是国家的政治权利; (3)国家征税的目的是为了实现其职能; (4)税收是国家参与社会产品分配的一种特殊形式。 二、税收的特征(了解) 税收作为一种特定的分配形式,有着自身固有的形式特征,即: (1)强制性(保证) (2)无偿性(核心) (3)固定性(两者的必然结果) 这三个特征是税收区别于其他财政收入的基本标志。税收的“三性”特征是相互联系的统一体,其中无偿性是核心,强制性是保证,固定性是上述两者的必然结果。 【关联知识点】:税收的职能 (1)组织收入职能(最基本的职能) (2)调节经济职能 (3)社会管理职能 三、税收的分类(了解) 必修中的重点知识内容以及内容解析 必修课程是整个高中数学课程的基础,包括5个模块,共10学分,是所有学生都要学习的内容。其内容的确定遵循两个原则:一是满足未来公民的基本数学需求;二是为学生进一步的学习提供必要的知识准备。从内容结构看,是螺旋式上升体系。 5个模块的内容为: 必修1:集合、函数概念与基本初等函数I(指数函数、对数函数、幂函数)。 必修2:立体几何初步、平面解析几何初步。 必修3:算法初步、统计、概率。 必修4:基本初等函数II(三角函数)、平面上的向量、三角恒等变换。 必修5:解三角形、数列、不等式。 上述内容覆盖了高中阶段传统的数学基础知识和基本技能的主要部分,其中包括集合、函数、数列、不等式、解三角形、立体几何初步、平面解析几何初步等。不同的是在保证打好基础的同时,进一步强调了这些知识形成过程和实际应用,而不在技巧与难度上做过高的要求。 此外,基础内容还增加了向量、算法、概率、统计等内容。 向量是近代数学最重要和最基本的概念之一,是沟通几何、代数、三角等内容的桥梁,它具有丰富的实际背景和广泛的应用。 现代社会是一个信息化的社会,人们常常需要根据所获取的数据提取信息,做出合理的决策,在必修课程中将学习统计与概率的基本思想和基础知识,它们是公民的必备常识。 算法是一个全新的课题,已经成为计算科学的重要基础,它在科学技术和社会发展中起着越来越重要的作用。算法的思想和初步知识,也正在成为普通公民的常识。在必修课程中将学习算法的基本思想和初步知识,算法思想将贯穿高中数学课程的相关部分。 必修课程的呈现力求展现由具体到抽象的过程,努力体现数学知识中蕴涵的基本思想方法和内在联系,体现数学知识的发生、发展过程和实际应用。教师和教材编写者应根据具体内容在适当的地方(如统计、简单线性规划等)安排一些实习作业。 必修一 ⑴重点知识内容: 必修一学生将学习集合与函数、基本初等函数、函数与方程. ①集合一章,主要是学习集合语言,从日常生活和初中数学中的实例出发引出集合概念,让学生学习用集合语言描述在义务教育阶段学过的一些集合,如数集和图形集合。为了准确使用集合语言,学习集合之间的关系与运算。集合语言在整套教材中经常使用。 ②在函数一章,除学习函数概念外,重点学习一次函数和二次函数。这两个函数是学习函数概念最好的载体,其中蕴涵着高中数学中一些重要的思想方法。在教材中设专节,在初中学过的一次、二次函数的基础上拓宽、提高。用一次函数和二次函数实现初中数学向高中数学的过渡。进一步研究了指数函数、对数函数和幂函数等基本初等函数,过渡到高中数学。③在必修1中,对通用的数学思想方法,如数形结合、配方法、待定系数法、数学建模等都给予足够的重视与练习。这些通性、通法在整个高中数学教材中反复使用。 (2)内容解析: 一、集合1、含义与表示:(1)集合中元素的特征:确定性,互异性,无序性 (2)集合的分类;有限集,无限集(3)集合的表示法:列举法,描述法,图示法 2、集合间的关系:子集:对集合A中任意一个元素,都是集合B中的元素,则称A是B 的子集。 真子集:若A是B的子集,且在B中至少存在一个元素不属于A,则A是B的真子集。 集合相等:A=B 3. 元素与集合的关系:属于不属于 九年级化学第九章-溶液知识点总结及习题 (含答案) 第九章溶液 一、悬浊液、乳浊液和溶液 1.悬浊液:固体小颗粒悬浮于液体里形成的混合物。 特点:固液混合物,且不稳定,易分层。如:黄河水,豆奶,石灰浆。 2.乳浊液:小液滴分散到液体里形成的混合物。 特点:液液不稳定混合物,易分层。如:色拉油滴入水中经振荡后而形成的水油混合物。3.①溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。 特点: 均一性----指溶液各部分的性质、组成完全相同,外观表现为透明、澄清、颜色一致。它不一定是无色,但一般透明。由溶质和溶剂组成。 稳定性----指外界条件不变时,溶液不论放置多久,溶质与溶剂都不会分层。 ②溶液的组成:由溶质和溶剂组成。 注意:(1)溶液不一定无色,如CuSO4为蓝色 FeSO4为浅绿色 Fe2(SO4)3为黄色(2)溶质可以是固体、液体或气体;水是最常用的溶剂。 (3)溶液的质量 = 溶质的质量 + 溶剂的质量;溶液的体积≠ 溶质的体积 + 溶剂的体积。 (4)溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)。 ③溶质和溶剂的判断: 溶质:被溶解的物质,可呈气、固、液三态。 溶剂:能够溶解其他物质的物质,一般为液体,也可以为气体。 (1)固体、气体溶于液体:液体为溶剂,固体、气体是溶质。 (2)液体溶于液体:有水,水为溶剂,其它为溶质;无水,量多的为溶剂,量少的为溶质。(3)根据名称:溶液的名称一般为溶质的溶剂溶液,即溶质在前,溶剂在后。 (4)如果物质在溶解时发生了化学变化,那么在形成的溶液中,溶质是反应后生成的能溶解的物质。 例1:下列各组中的物质混合后能形成溶液的是() A.碘晶体与酒精 B.硫酸钡与水 C.煤油与水 D.氢氧化铁与水 例2、下列有关溶液的说法中,正确的是 ( ) A.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大 溶液溶解度知识点总结经典 一、溶液选择题 1.请根据右图的溶解度曲线图,判断下列说法正确的是() A.a、b两物质的溶解度相等 B.t1℃时,向20g a固体加入50g 水,充分搅拌后固体能全部溶解 C.将t2℃时a、b饱和溶液降温到t1℃时,两者的溶质质量分数相等 D.b中含有少量a,可以用冷却热饱和溶液的方法提纯b 【答案】C 【解析】 试题分析:A 根据溶解度曲线可知,只有在℃时两物质溶解度相等;B t 1℃时,a物质的溶解度为36g,也就是说此温度下100g水中最多可以溶解36g a物质;C 从t2℃降温至t1℃时,两物质溶解度相等,且都为饱和溶液,因此质量分数相等;D a、b两物质溶解度变化随温度变化相差较大,因此可以用冷却热饱和溶液的方法提纯a,不可以用来提纯b。 考点:溶解度曲线的意义 点评:关于溶解度曲线的题目一直是中考的必考点,常在双选中出现,得分率不是很高,注意仔细审题,避免粗心。 2.甲、乙两种固体物质的溶解度曲线如图所示。下列有关叙述中错误的是 A.t2℃时甲的溶解度比乙的大 B.将甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大 C.升高温度可将甲的饱和溶液变成不饱和溶液 D.t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等 【答案】B 【解析】 【分析】 由甲、乙两种固体物质的溶解度曲线图可知,甲的溶解度受温度的影响较大,乙的溶解度 受温度的影响较小。 【详解】 A、由甲、乙两种固体物质的溶解度曲线图可知,t2℃时甲的溶解度比乙的大,故A正确; B、将等质量甲、乙的饱和溶液从t2降到t1,析出甲的质量大,故B不正确; C、甲的溶解度随温度升高而增大,升高温度可以将甲的饱和溶液变成不饱和溶液,故C 正确; D、t1℃时,两种物质的溶解度相等,甲和乙的饱和溶液各100g,其溶质的质量一定相等,故D正确。 故选B。 3.下表是KCl与KNO3在不同温度的溶解度。下列说法不正确 ...的是() 温 度 20304050 /℃ KCl34.0g37.0g40.0g42.6g KNO331.6g45.8g63.9g85.5g A.20℃时,KC1的溶解度大于KNO3的溶解度 B.两物质溶解度相等的温度在20~30℃之间 C.40℃时,5gKCl中加10g水可得33.3%溶液 D.50℃时,10g KNO3中加20g水,充分溶解后再降温到30℃,有KNO3固体析出 【答案】C 【解析】 试题分析:由两种物质的溶解度可知20℃时,KNO3溶解度小于KC1的溶解度,A正确;由表格数据可知温度在20~30℃时,两物质的溶解度有相同的部分,即两物质溶解度相等的温度在20~30℃之间,B正确;40℃时,KCl的溶解度为40g,即该温度下40g氯化钾溶解在100g水中恰好形成饱和溶液,那么10g水中最多溶解4g氯化钾,形成的溶液的溶质质量分数=4g/14g ×100%=28.6%,C错误;30℃时硝酸钾的溶解度为45.8g,即该温度下45.8g硝酸钾溶解在100g水中恰好形成饱和溶液,那么20g水中最多溶解硝酸钾9.16g,即50℃时,10g KNO3中加20g水,充分溶解,再降温到30℃,有KNO3固体析出,D正确。故选C。 考点:溶解度 4.a、b、c 三种物质的溶解度曲线如下图所示。取等质量℃的 a、b、c 三种物质的饱和溶液,分别蒸发等量水后恢复至℃。下列说法不正确的是上海高考数学知识点重点详解
高中化学 溶解度知识点总结
Unit-1-Wise-men-in-history知识要点解析
溶解度曲线知识点及习题
五年级美术下册知识要点分析
(完整)初中化学溶解度知识点,推荐文档
新人教版九年级下册化学[溶解度和溶质的质量分数(基础) 知识点整理及重点题型梳理]
最新溶液 溶解度知识点题型经典
初中化学溶解度教案设计
考试要点解析与练习(一 税收基础知识)
必修中的重点知识内容以及内容解析
九年级化学第九章-溶液知识点总结及习题(含答案)讲解学习
溶液 溶解度知识点总结经典