主族元素部分 卤素
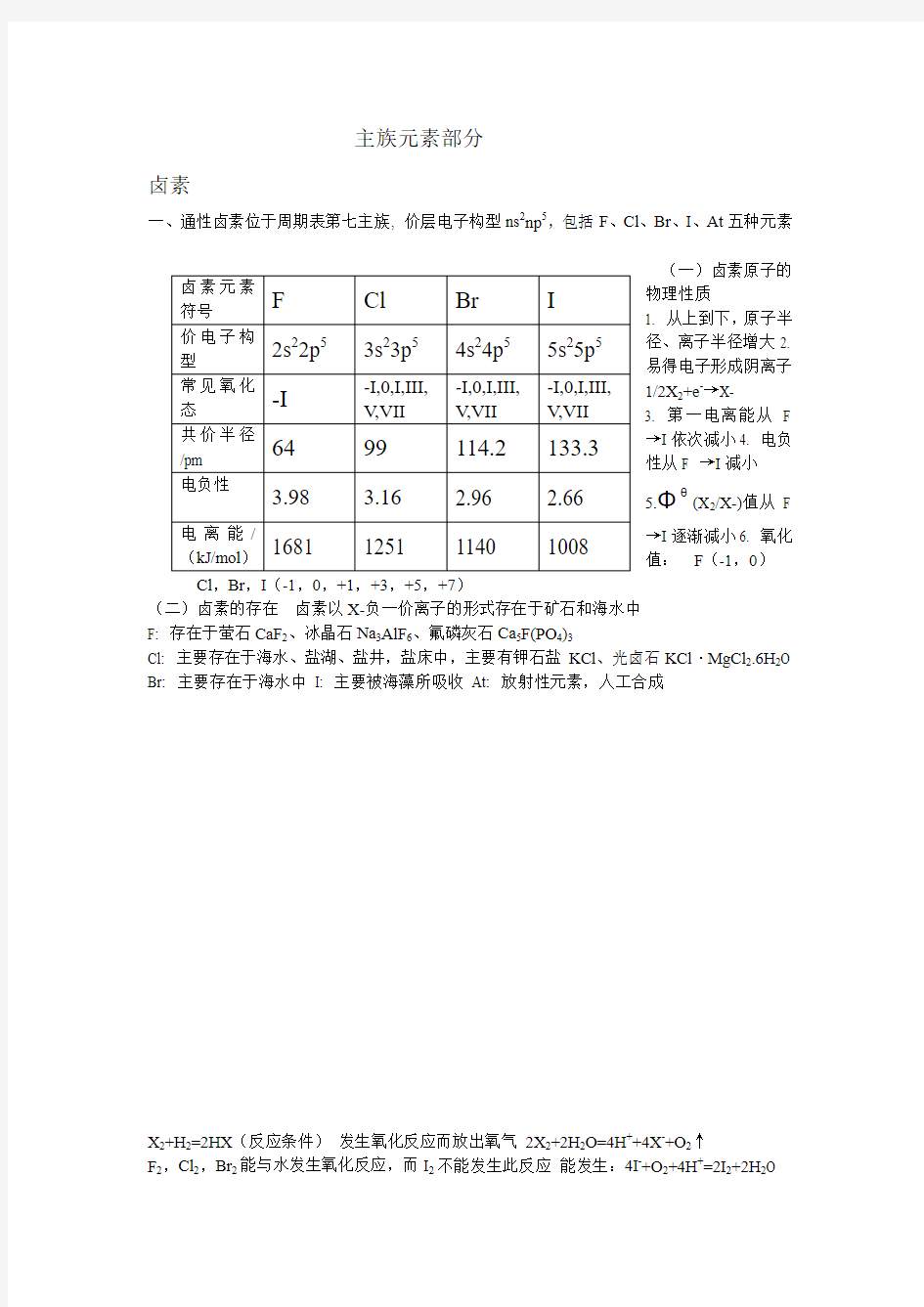
一、通性卤素位于周期表第七主族, 价层电子构型ns 2np 5,包括F 、Cl 、Br 、I 、At 五种元素
(一)卤素原子的
物理性质 1. 从上到下,原子半径、离子半径增大2. 易得电子形成阴离子1/2X 2+e -→X-
3. 第一电离能从 F →I 依次减小
4. 电负
性从F →I 减小 5.Φθ
(X 2/X-)值从F
→I 逐渐减小6. 氧化值: F (-1,0)
Cl ,Br ,I (-1,0,+1,+3,+5,+7)
(二)卤素的存在 卤素以X-负一价离子的形式存在于矿石和海水中 F: 存在于萤石CaF 2、冰晶石Na 3AlF 6、氟磷灰石Ca 5F(PO 4)3
Cl: 主要存在于海水、盐湖、盐井,盐床中,主要有钾石盐KCl 、光卤石KCl ·MgCl 2.6H 2O Br: 主要存在于海水中 I: 主要被海藻所吸收 At: 放射性元素,人工合成
X 2+H 2=2HX (反应条件) 发生氧化反应而放出氧气 2X 2+2H 2O=4H ++4X -+O 2↑
F 2,Cl 2,Br 2能与水发生氧化反应,而I 2不能发生此反应 能发生:4I -+O 2+4H +=2I 2+2H 2O
卤素元素符号 F Cl Br I 价电子构型 2s 22p 5 3s 23p 5 4s 24p 5 5s 25p 5 常见氧化态 -I
-I,0,I,III,V ,VII -I,0,I,III,V ,VII -I,0,I,III,V ,VII 共价半径/pm 64 99 114.2 133.3
电负性 3.98 3.16 2.96 2.66 电离能/
(kJ/mol )
1681 1251 1140 1008
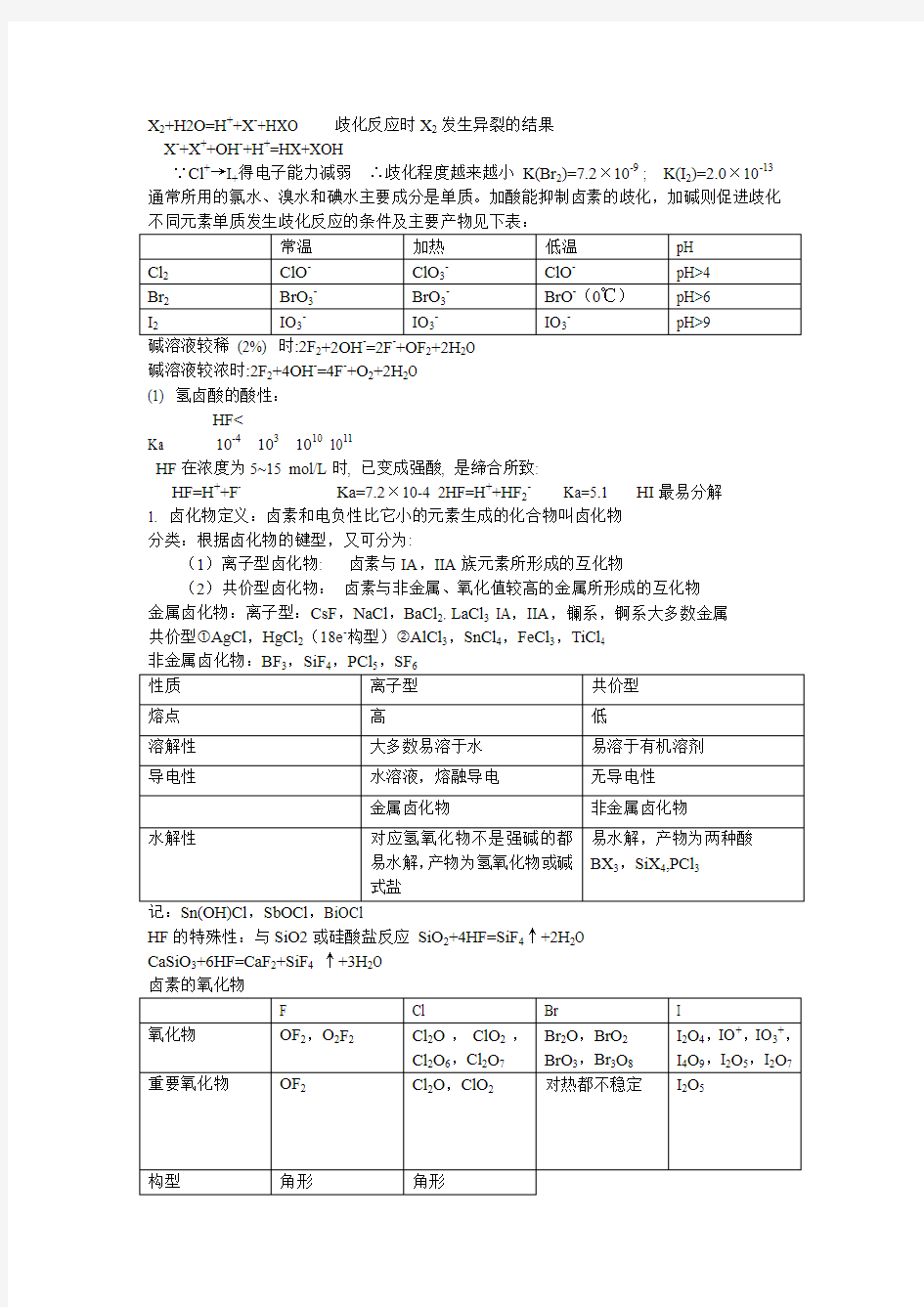
X 2+H2O=H ++X -+HXO 歧化反应时X 2发生异裂的结果 X -+X ++OH -+H +=HX+XOH
∵Cl +→I +得电子能力减弱 ∴歧化程度越来越小 K(Br 2)=7.2×10-9 ; K(I 2)=2.0×10-13 通常所用的氯水、溴水和碘水主要成分是单质。加酸能抑制卤素的歧化,加碱则促进歧化 不同元素单质发生歧化反应的条件及主要产物见下表: 常温 加热 低温 pH Cl 2 ClO - ClO 3- ClO - pH>4 Br 2 BrO 3- BrO 3- BrO -(0℃) pH>6 I 2
IO 3-
IO 3-
IO 3-
pH>9
碱溶液较稀 (2%) 时:2F 2+2OH -=2F -+OF 2+2H 2O 碱溶液较浓时:2F 2+4OH -=4F -+O 2+2H 2O (1) 氢卤酸的酸性:
HF< HF 在浓度为5~15 mol/L 时, 已变成强酸, 是缔合所致: HF=H ++F - Ka=7.2×10-4 2HF=H ++HF 2- Ka=5.1 HI 最易分解 1. 卤化物定义:卤素和电负性比它小的元素生成的化合物叫卤化物 分类:根据卤化物的键型,又可分为: (1)离子型卤化物: 卤素与IA ,IIA 族元素所形成的互化物 (2)共价型卤化物: 卤素与非金属、氧化值较高的金属所形成的互化物 金属卤化物:离子型:CsF ,NaCl ,BaCl 2,LaCl 3 IA ,IIA ,镧系,锕系大多数金属 共价型①AgCl ,HgCl 2(18e -构型)②AlCl 3,SnCl 4,FeCl 3,TiCl 4 非金属卤化物:BF 3,SiF 4,PCl 5,SF 6 性质 离子型 共价型 熔点 高 低 溶解性 大多数易溶于水 易溶于有机溶剂 导电性 水溶液,熔融导电 无导电性 金属卤化物 非金属卤化物 水解性 对应氢氧化物不是强碱的都易水解,产物为氢氧化物或碱式盐 易水解,产物为两种酸 BX 3,SiX 4,PCl 3 记:Sn(OH)Cl ,SbOCl ,BiOCl HF 的特殊性:与SiO2或硅酸盐反应 SiO 2+4HF=SiF 4↑+2H 2O CaSiO 3+6HF=CaF 2+SiF 4 ↑+3H 2O 卤素的氧化物 F Cl Br I 氧化物 OF 2,O 2F 2 Cl 2O ,ClO 2,Cl 2O 6,Cl 2O 7 Br 2O ,BrO 2 BrO 3,Br 3O 8 I 2O 4,IO +,IO 3+,I 4O 9,I 2O 5,I 2O 7 重要氧化物 OF 2 Cl 2O ,ClO 2 对热都不稳定 I 2O 5 构型 角形 角形 状态和颜色棕黄色(g)黄色 白色固体 (g) ClO2的结构:键角:116.5° Cl2O: 极易溶于水Cl2O+ H2O = 2HOCl Cl2O是HOCl的酸酐.主要用来制次氯酸盐 I2O5 制备: 2HIO3 = I2O5 + H2O性质: 2I2O5 = 2I2 + 5O2 I2O5易吸水成为HIO3, I2O5作为氧化剂, 可以氧化NO, C2H4, H2S, CO等 I2O5 +5CO= I2 + 5CO2——鉴定CO含量 卤素含氧酸 名称氧化值氯溴碘 次卤酸+1 HOF HOCl* HBrO* HOI* 亚卤酸+3 HClO2* HBrO2* - 卤酸+5 HClO3* HBrO3* HIO3 高卤酸+7 HClO4HBrO4* HIO4,H5IO6 *表示仅存在于溶液中而不能分离出纯酸 含氧酸氧化还原的周期性 同一周期主族元素和同一周期过渡元素最高氧化态含氧酸的氧化性随原子序数递增而增强。同族主族元素最高氧化态含氧酸氧化性随原子序数增加呈现锯齿形变化。 同族副族元素含氧酸的Φθ值随原子序数Z的增加而略有下降 同一元素的不同氧化态的含氧酸中,低氧化态含氧酸的氧化性较强。 次卤酸盐的通性 HOX均为酸性,HOCl > HOBr > HOI Ka 2.8×10-8 2.6×10-9 2.4×10-11 稳定性: HOCl>HOBr>HOI (HOF稳定) 次氯酸是很弱的酸Ka=2.8×10-8——比碳酸还弱 次氯酸不稳定光照:2HClO = O2+2HCl 加热:3HClO = HClO3+2HCl 问题:将氯气通入冷碱和热碱中的反应?次氯酸是很强氧化剂,本身被还原为Cl- 卤酸性质: (1)酸性: HClO3 > HBrO3 >HIO3从氯到碘依次减弱 (2)稳定性: HClO3 < HBrO3 (3)氧化性: HClO3< HBrO3 > HIO3 Φθ(XO3-/X-)/V 1.47 1.52 1.19 体现了p区第四周期元素性质的不规律性 氯酸的稳定性8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O 3HClO3=2HClO4+2ClO2↑+H2O 氯酸的氧化性2HClO3+I2=2HIO3+Cl2↑2HClO3+5HCl=3Cl2↑+3H2O 注: HClO3过量时,还原产物为Cl2 氯酸盐的性质 (1)稳定性 (2) 氧化性 在中性溶液中不能氧化KI, 但酸化后, 可氧化I -为I 2 高卤酸的氧化性 H 5IO 6是强氧化剂,被还原的产物为IO 3- 2 Mn 2++5 H 5IO 6=2 MnO 4-+5 IO 3-+11H ++7H 2O 该反应在分析化学中用来测定Mn 2+。 热稳定性增强 酸 性↓ 增 强 热 氧 稳 化 定 能↓ 性 力 增 降 高 低 HClO MClO 氧 热 化 稳↓ 能 定 力 性 降 增 低 高 HClO 2 MClO 2 HClO 3 MClO 3 HClO 4 MClO 4 氧化能力增强 氧族元素 一、通性 氧族元素位于周期表第六主族, 价层电子构型ns 2np 4,包括氧、硫、硒、碲、钋五种元素 元素符号:O 、 S 、Se 、Te 、Po O 、S 又称为成矿元素 氧、硫为非金属元素 硒、碲为准金属元素 钋为金属元素 氧族元素的基本性质 (1) 从氧到钋,原子半径、离子半径逐渐增大(2) 第一电离能和电负性从氧到钋依次减小 (3)*从氧到钋,金属性逐渐增强,非金属性逐渐减弱。 (4) 易获得两个电子达到稀有气体稳定结构 (5) 氧化值:O (0,-1,-2,+2)S (0,-2,+4,+6)Se ,Te (0,-2,+2,+4,+6) S , Se ,Te 与其它元素化合时形成共价化合物。 它们与氧化合时生成RO 2,RO 3酸性氧化物在这些化合物中有配位键形成。 二.氧及其化合物。 32. O 酸性介质中:氧化剂—O 3,O 2,H 2O 2 能发生歧化反应的物质:H 2O 2 碱性介质中:氧化剂—O 3,O 2;还原剂—H 2O 2 能发生歧化反应的物质:H 2O 2 臭氧分子中无单电子,故为反磁性物质 臭氧的性质 物理性质 是浅蓝色气体,有鱼腥臭味,161K 为深蓝色液体,比氧易溶于水 化学性质(1)臭氧易分解 2O 3→3O 2 △rHm = - 286 kJ/mol (2)是强氧化剂 它的氧化性比氧强,能氧化一些只有弱还原性的单质(如Hg ,Ag ,S )或化合物 2Ag+O 3=Ag 2O+O 2 PbS+4 O 3=PbSO 4+4 O 2 2I -+ O 3+H 2O=I 2+O 2+2OH - ——鉴定臭氧 H 2O 2(1)不稳定性 2H 2O 2→2H 2O+O 2↑ △rHm = - 198 kJ/mol 不能久放 光照、碱性介质、一些重金属能加快其分解速度 防止过氧化氢分解: 装入棕色瓶或塑料瓶中,放在阴凉处 加入一些稳定剂(如8-羟基喹啉) (2)弱酸性 过氧化氢为二元弱酸H 2O 2+Ba(OH)2 = BaO 2+2H 2O 酸 碱 盐 水 (3)氧化还原性 过氧化氢的氧化性较还原性突出 在酸性介质中氧化性强于碱性介质中的氧化性 只有遇到强氧化剂时体现还原性 过氧化氢为氧化剂的主要优点: 不会给反应体系引入杂质 三.硫的含氧化合物 名称 化学式 硫的氧化态 结构式 存在形式 次硫酸 H 2SO 2 +2 H-O-S-O-H 盐 连二亚硫酸 H 2S 2O 4 +3 - O 盐 亚硫酸 H 2SO 3 +4 - 盐 硫酸 H 2SO 4 +6 H - 酸盐 焦硫酸 H 2S 2O 7 +6 H - O 酸盐 1. 二氧化硫、亚硫酸及其盐 二氧化硫 物理性质 ☆无色有刺激气味 ☆是很好的非水溶剂 ☆极性强,易溶于水 化学性质 a. 氧化还原性(还原性较显著)b. 具有漂白性 亚硫酸性质: a. 酸性(二元酸中强酸) b. 不稳定性 c.氧化还原性 酸性介质: H 2SO 3+4H ++4e -=S+3H 2O SO 42-+4H ++2e -=H 2SO 3+H 2O H 2SO 3的还原性较突出 H 2SO 3+O 2= H 2SO 4 在较强的还原剂作用下,表现出氧化性 H 2SO 3+2H 2S=3S ↓+3H 2O 亚硫酸盐 绝大多数正盐(K +,Na +,NH 4+除外)不溶于水,酸式盐多溶于水 性质:a. 稳定性4Na 2SO 3=3Na 2SO 4+Na 2S (加热) SO 32-+2H +=SO 2↑+H 2O 用来鉴定SO 32-或HSO 3- 离子和制备SO 2 b. 氧化还原性 HSO 3-+I 2+H 2O=HSO 4-+2I -+2H + 遇强还原剂时:SO 32-+Cl 2+H 2O=SO 42-+2Cl -+2H + 为去氯剂 2. 三氧化硫、硫酸及其盐 三氧化硫 a. SO 3是强氧化剂5SO 3+2P=5SO 2+P 2O 5 SO 3+2KI=K 2SO 3+I 2 b. SO 3具有强吸水性SO 3+H 2O=H 2SO 4 硫酸性质 a.酸性(置换挥发性酸)b.吸水性c.氧化性 硫酸盐 正盐难溶于水的有:BaSO4,PbSO4,CaSO4;酸式盐大都溶于水 Na 2SO 4+H 2SO 4(过量)=2NaHSO 4 硫酸根的鉴定: 在HCl 存在时 Ba 2++SO 42-→BaSO 4↓(白色) 三.焦硫酸及其盐。 O H - O - S O 焦硫酸制备: SO 3+H 2SO 4=H 2S 2O 7 性质:比硫酸具有更强的氧化性、吸水性和腐蚀性 焦硫酸盐 制备: 性质: a. 焦硫酸盐受热分解:K 2S 2O 7→K 2SO 4+SO 3↑ b. 与金属氧化物作用生成金属硫酸盐 Al 2O 3+3 K 2S 2O 7 →K 2SO 4+Al 2(SO 4)3 分析化学中用焦硫酸盐作为熔矿剂 4.硫代硫酸及其盐。硫代硫酸钠——海波,大苏打 制备:Na 2SO 3+S →Na 2S 2O 3(煮沸) 性质:a. 遇酸分解b. 氧化还原性c.具有较强配位能力d. 重金属的硫代硫酸盐不稳定 a. 遇酸分解 S 2O 32-+2H+→S ↓+SO 2↑+H 2O 利用此反应鉴定S 2O 32-的存在 b. 氧化还原性 以还原性为主 与强氧化剂作用生成硫酸盐 S 2O 32-+4Cl 2+5H 2O →2SO 42-+8Cl -+10H + Na 2 S 2O 3为除氯剂 与较弱氧化剂 2 S 2O 32-+I 2 →S 4O 62-+2I -(连四硫酸盐) c.具有较强配位能力 AgX+2S 2O 32-→[Ag(S 2O 3)2]3-+X - (X=Cl,Br) d. 重金属的硫代硫酸盐不稳定 S 2O 32-(少量)+2Ag +→Ag 2 S 2O 3↓(白色)Ag 2 S 2O 3+H 2O →Ag 2S ↓(黑色)+H 2SO 4 白色Ag 2 S 2O 3沉淀,在溶液中迅速分解,颜色由白→黄→棕→黑色的Ag 2S 。用此反应也可鉴定S 2O 32-。 5. 过硫酸及其盐 过二硫酸盐中重要的是Na 2S 2O 8和(NH 4)2S 2O 8 性质:强氧化性: S 2O 82-+2e -=2SO 42- Cu+K 2S 2O8=CuSO 4+K 2SO 4 过硫酸及其盐不稳定2K 2S 2O 8 →2K 2SO 4+2SO 3↑+O 2↑ 氮族元素 位于周期表第五主族, 价层电子构型ns 2np 3, 包括氮、磷、砷、锑、铋五种元素 元素符号:N 、 P 、As 、Sb 、Bi 氮、磷为非金属元素 砷为准金属元素 锑、铋为金属元素 氮族元素的基本性质 (1) 从氮到铋,原子半径、离子半径逐渐增大 (2) 第一电离能和电负性从氮到铋依次减小 (3)从氮到铋,金属性逐渐增强,非金属性逐渐减弱。 (4)*成键特征 获得3个电子形成氧化态为-3的离子比VIA 和VIIA 要困难的多,只有N 3-,P 3-。 氮族主要氧化态为+3,+5,形成共价化合物是本族元素成键的特征。 (5)*惰性电子对效应 V A 自上往下氧化值为+3的物质稳定性增加,而氧化值为+5的物质稳定性降低,这种自上往下低氧化值比高氧化值物质稳定的现象,称为“惰性电子对效应。 (IIIA ,IVA 也存在这种现象) 一、氮气 1. 结构 ( KK [ 2. 制备工业上:分馏液态空气 实验室: 二、氮的氢化物 三、1. 氨 (2)化学性质 用来检验Cl 2管道是否漏气,为什么?NH 3+3Cl 2 (过量) =NCl 3+3HCl 加合反应——形成配合物Ag ++2NH 3=[Ag(NH 3)2]+ 取代反应 氨基衍生物 NH 2-;亚氨基衍生物NH ; 氮化物N 3- 2Na+2NH 3→2NaNH 2+H 2↑ 2Al+2NH 3 →AlN+3H 2↑ 2. 铵盐 铵盐的热稳定性差,加热极易分解 (1)生成氨和酸或酸式盐 NH 4HCO 3 →NH 3↑+CO 2↑+H 2O (常温)NH 4Cl →NH 3↑+HCl ↑(加热) (NH 4)2SO 4 →NH 3↑+NH 4HSO 4 (加热)(NH 4)3PO 4 →3NH 3↑+H 3PO 4 (加热) (2) 氧化性酸组成的铵盐,分解出来的氨会进一步氧化 3. 联氨 (N 2H 4)(肼) H N 以sp 3杂化轨道形成σ键 联氨的水溶液呈弱碱性 在水溶液中具有强氧化性和强还原性 N 2H 5++3H ++2e -=2NH 4+ N 2+4H 2O+4e -=N 2H 4+4OH - 例:N 2H 4+O 2=N 2+2H 2O 4. 羟氨(NH 2OH )H 水溶液呈弱碱性 具有氧化性和还原性,主要用做还原剂2NH 2OH+I 2+2OH -→N 2↑+2I -+4H 2O 易分解 3NH 2OH →NH 3↑+N 2↑+3H 2O (15℃) 5. 叠氮酸(HN 3)和叠氮化物 N HN 3中第一个N 是sp 2 杂化,其余N 为sp 杂化 HN 3水溶液呈酸性 HN 3+NaOH=NaN 3+H2O HN 3不稳定 2HN 3(g) →H 2 (g) +3N 2 (g) HN 3+H 2O=NH 2OH+N 2 HN 3具有氧化性和还原性 一、氮的含氧化合物 1. 氮的氧化物 在氧化物中N 的氧化态从I 到V 所有氧化物在热力学上都是不稳定的 除N 2O 外,其它都有毒性 工业废气组成为NO x ——破坏臭氧层,产生光化学烟雾 氮的氧化物性质和结构 化学式 熔点/K 沸点/K 性状 结构 N 2O 182 184.5 无色,助燃,无毒,做麻醉剂 NO 109.5 121 无色,顺磁性,易氧化 N 2O 3 172.4 276.5(分解) 低温固体,液体蓝色,分解为NO 和NO 2 O NO 2 181 294.5(分解) 红棕色气体,低温下聚合为N 2O 4 O N 2O 4 261.9 297.3 无色气体,易离解为NO 2 O O N 2O 5 305.6 (升华) 固体由NO 2+NO 3-组成,无色,易潮解,不稳定,强氧化剂 O O 1. 一氧化氮 制备3Cu+8HNO 3(稀)→3Cu(NO 3)2+2NO ↑+4H 2O 物理性质 无色气体,有毒, 难溶于水 化学性质 (1) 常温下很容易被氧化为NO2 (2) 与金属形成配合物 FeSO 4+NO →[Fe(NO)]SO 4 硫酸亚硝酰合铁(II) 2. 亚硝酸及其盐 亚硝酸 的 制 备 亚硝酸盐物理性质 除了浅黄色AgNO 2不溶外, 一般亚硝酸盐易溶于水, 亚硝酸盐均有毒。 亚硝酸及盐的化学性质 (1)亚硝酸有弱酸性 (2)亚硝酸的不稳定性 (3)亚硝酸及其盐具有氧化性和还原性 酸性介质 2HNO 2+4H ++4e -=N 2O+3H 2O HNO 2+H ++e -=NO+H 2O 碱性介质NO 3-+H 2O+2e -=NO 2-+2OH - 亚硝酸盐在酸性溶液中是强氧化剂;在碱性溶液中则是还原剂. 2NO 2-+2I -+4H +=2NO+I 2+2H 2O 利用此反应定量测定亚硝酸盐 2MnO 4-+5NO 2-+6H +=2Mn 2++5NO 3-+3H 2O NO2-易生成配合物 3K ++[Co(NO 2)6]3-→K 3[Co(NO 2)6] ↓(黄色) 用来鉴定钾离子 三.磷的氢化物和卤化物 1. 氢化物最重要的是膦(PH 3) 结构:与NH 3相似 化学性质:与NH 3相似 (1)碱性:PH 3比NH 3弱 PH 4I+NaOH=NaI+PH 3↑+H 2O (2)还原性: PH 3比NH 3强8CuSO 4+2PH 3+8H 2O=2H 3PO 4+8H 2SO 4+8Cu 2. 磷的卤化物 主要介绍:PCl 3和PCl 5 PCl3:结构:与NH3相似制备: 3Cl2+2P(过量)→2PCl3 性质物理性质:无色液体,易水解 化学性质(1)与金属形成配合物:Ni(PCl3)4 (2)与水反应: PCl3+3H2O →H3PO3+3HCl PCl5 结构:三角双锥制备: PCl3+Cl2(过量) →PCl5 性质:(1) 不稳定: PCl5→PCl3+Cl2 (160℃时) (2) 易水解: PCl5+H2O(不足) →POCl3+2HCl 三氯氧磷PCl5+H2O(过量) →H3PO4+3HCl 三、磷的含氧化合物 1. 磷的氧化物P4O6:制备:P4+3O2(不足)→P4O6 物理性质白色蜡状固体,易熔化,气味如蒜,有毒 化学性质(1)吸水性强P4O6+6H2O(冷)→4H3PO3(亚磷酸) P4O6+6H2O(热) →3H3PO4+PH3↑(2) 具有还原性P4O6+2O2→P4O10 P4O10制备:P4+5O2(充足)→P4O10 性质: 极易潮解, 是优良的干燥剂 P4O10+6H2SO4=6SO3+4H3PO4 P4O10+12HNO3=6N2O5+4H3PO4 2.磷的含氧酸及其盐较重要含氧酸 名称正磷酸焦磷酸三磷酸偏磷酸亚磷酸次磷酸 化学式H3PO4H4P2O7H5P3O10(HPO3)n H3PO3H3PO2 氧化态+V +V +V +V +Ⅲ+I 失水失1个水失2个水失4个水 (n=4) 物理性质: 纯磷酸为无色晶体, 为不挥发的三元中强酸, 因有氢键, 而呈粘稠状 化学性质:具有很强的配位能力2H3PO4+Fe3+→H3[Fe(PO4)2](无色)+3H+ 磷酸盐:正盐: 除K+,Na+,NH4+盐外,一般都不溶于水 磷酸一氢盐: 同上磷酸二氢盐: 均溶于水 可溶性磷酸盐的水解性正盐水解溶液呈强碱性如Na3PO4. 磷酸二氢盐以电离为主,溶液呈弱酸性. 磷酸一氢盐以水解为主, 溶液呈碱性. 最重要的是钙盐Ca3(PO4)2+2H2SO4(适量) →2CaSO4+Ca(H2PO4)2 (产物为过磷酸钙) 焦磷酸及其盐酸的性质:易溶于水在冷水中慢慢转化为磷酸其酸性比磷酸强 盐:制备: 2Na2HPO4→Na4P2O7+H2O 性质:其多数金属盐难溶于水, P2O74- 过量与金属形成配合物如[Cu(P2O7)]2- 偏磷酸及其盐 偏磷酸盐易溶于水,水溶液粘度大. 能与钙、镁等离子形成配合物,所以用做软水剂等 亚磷酸及其盐结构次磷酸结构 性质:(1)纯亚磷酸是无色晶体,易溶于水(2)亚磷酸是二元中强酸 (3)亚磷酸及盐具有还原性Ag++H2PO3+H2O→Ag+H3PO4+H+ 次磷酸及其盐性质:(1)次磷酸是一元中强酸 (2)次磷酸及盐具有强的还原性,特别是在碱性溶液中,其还原性强于亚磷酸 Cu2++H2PO2-+6OH-→2Cu+PO43-+4H2O(3)酸及盐都不稳定,发生歧化反应。 3H3PO2→2H3PO3+PH3↑ 四、砷、锑、铋 M(Ⅲ)的还原性 AsO 33-+I 2+2OH -→ AsO 43-+2I -+H 2O(pH:4~9) Sb(OH)4-+Cl 2+Na ++2OH -→ Na[Sb(OH)6] ↓ (白色)+2Cl - Bi(OH)3+Cl 2+3NaOH → NaBiO 3↓ (土黄色)+2NaCl+3H 2O H 3AsO 3 Sb(OH)3 Bi(OH)3 还 原 性 依 次 减 弱 M(Ⅴ)的氧化性 H 3AsO 4+2I -+2H +→ H 3AsO 3+I 2+H 2O Na[Sb(OH)6] +2I - +6H + →I 2+Sb 3+ +6H 2O+Na + NaBiO 3+2Mn 2++14H + →2MnO 4-+5Bi 3++ 7H 2O +5Na +利用这一反应鉴定Mn2+离子 H 3AsO 4 [Sb(OH)6]- NaBiO 3 氧 化 性 增 强 碳族元素 一.元素的基本性质 碳 硅 锗 锡 铅 元素符号 C Si Ge Sn Pb 原子序数 6 14 32 50 82 价电子层结构 2s 22p 2 3s 23p 2 4s 24p 2 5s 25p 2 6s 26p 2 主要氧化态 +IV,+II,0 (-II,-IV) +IV(+II),0, (-IV) +IV ,+II +IV ,+II +II ,(+IV) 第一电离能(kJ ·mol -1) 1086.5 786.6 760 709 716 电负性(χ) 2.5 1.8 1.8 1.8 1.9 性质 金刚石 石墨 C 60 C 原子性质 平均键角 杂化轨道形式 密度/g ·cm -3 每个原子占据体积/10-3*nm 3 C-C 键长/pm 四面体型 109.5° sp 3 3.514 5.672 154.4 平面三角形 120° sp 2 2.266 8.744 141.8 球面型 116° sp 2.28 1.678 11.87 (6/6)139.1; (6/5)145.5 二、碳的氧化物、含氧酸及其盐 1、氧化物 二氧化碳 CO 2 CO 2 的分子结构 C :sp 等性杂化,2个σ键,两个π34 一氧化碳 CO 分子结构 CO 和N 2,CN -,NO +是等电子体,结构相似: 分子中有三重键,一个σ键,两个π键 不同点:CO的一个π键是从C到O的π配键,偶极矩很小,比N2活泼 物理性质无色无臭有毒气体,在水中溶解度较小 化学性质(1)还原性: CO中C的氧化值是+II 鉴定CO: 微量的CO 通入PdCl2溶液中,会使溶液变黑CO+PdCl2+H2O→Pd+CO2+2HCl (2)配位性: CO中C的能提供孤对电子合成氨工业中用铜洗液吸收CO (3)与碱作用:显示出非常弱的酸性 (4)与其它非金属作用CO + Cl2→COCl2( 光气) 2、碳酸和碳酸盐碳酸的结构采用sp2等性杂化存在П46 三、硅的含氧化合物 1、二氧化硅结构: SiO2有晶体和无定形两种形态 二氧化硅晶体:原子晶体, 基本结构单元是硅氧四面体SiO4 最简式是SiO2 无定形二氧化硅:硅氧四面体SiO4是杂乱排列的 化学性质1, SiO2是硅酸的酸酐,是酸性氧化物和热的浓碱MOH反应和某些含氧酸盐反应2,发生氧化还原反应3,在无机酸中,只和HF作用 2、天然硅酸盐 组成:可看作是碱性氧化物和酸性氧化物组成的复杂化合物,通式aM x O y`cH2O 一些重要的硅酸盐矿物 结构:可分为链状、片状和三维网络状,但其基本结构单元都是硅氧四面体。 链状硅氧四面体共用两个顶点,可连接成长链 通式[ Si n O 3n + 1 ] ( 2n + 2 ) -这种链状硅酸根之间,通过阳离子相互结合成束,即成纤维状硅 酸盐,如石棉。 片状SiO44- 共三个顶点相联,可形成片状(层状)结构,层与层之间通过阳离子约束,得片层状硅酸盐。如云母KMg3 ( OH )2 Si3 AlO10 锗、锡、铅的主要化学性质 锡的性质比锗活泼能与稀酸缓慢作用, 生成Sn(II)的化合物 Sn+2HCl=SnCl2+H2↑4Sn+10HNO3=4Sn(NO3)2+NH4NO3+3H2O 与热的HCl, H2SO4, HNO3反应, Sn+2HCl(浓)=SnCl2+H2↑Sn+4H2SO4(浓)=Sn(SO4)2+2SO2↑+4H2O Sn+4HNO3(浓)=SnO2·H2O↓+4NO2↑+H2O 铅的性质比锡活泼 与空气中氧气反应2Pb+O2+2H2O=2Pb(OH)2 铅可被所有的酸侵蚀而形成难溶盐与热浓HCl, 浓H2SO4, 生成Pb(II)盐 Pb+4HCl(热,浓)=H2[PbCl4]+H2↑Pb+3H2SO4 (热,浓)=Pb(HSO4)2+SO2↑+2H2O 2Pb+O2=2PbO; PbO+2HAc=Pb(Ac)2+H2O 3Pb+8HNO3(稀)=3Pb(NO3)2+2NO ↑+4H2O 三、锡、铅的化合物 1. 氧化物和氢氧化物 氧化物: 锡的氧化物: 重要的是SnO2 SnO2+2NaOH=Na2SnO3+H2O 铅的氧化物: PbO, PbO2, Pb3O4 PbO与HAc和HNO3反应生成相应盐 PbO2的氧化性和酸性PbO2+2NaOH(热)=Na2PbO3+H2O PbO2+4HCl=PbCl2+Cl2↑+2H2O 2PbO2+2H2SO4=PbSO4↓+O2↑+2H2O 5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O PbO2在工业上主要用于制造蓄电池 放电—原电池负极:Pb+SO42--2e-=PbSO4↓正极:PbO2+SO42-+2H++2e-= PbSO4↓+2H2O 总反应:Pb+PbO2+H2SO4=2PbSO4↓+2H2O 充电—电解池阳极:PbSO4↓+2H2O-2e-= PbO2+SO42-+4H+阴极:PbSO4↓+2e-= Pb+SO42- 总反应:2PbSO4↓+2H2O=Pb+PbO2+H2SO4 二氯化锡SnCl2 易水解SnCl2+H2O=Sn(OH)Cl+HCl 注意: 配制SnCl2溶液时应(1)加HCl防止水解(2)加Sn粒, 防止Sn2+被氧化 Sn2+离子的鉴定:2HgCl2(过量)+SnCl2=SnCl4+Hg2Cl2↓(白) Hg2Cl2+SnCl2= SnCl2+ Hg↓(黑) 二氯化铅PbCl2 PbCl2难溶于冷水,易溶于热水.溶于盐酸中: PbCl2+2HCl=H2[PbCl4] PbI2+2KI=K2[PbI4] PbI2为黄色丝状有亮光的沉淀,难溶于冷水,易溶于沸水 Pb2+离子的鉴定:Pb2++CrO42-=PbCrO4↓(黄色)PbCrO4为黄色颜料,称为铬黄 这一反应用来鉴定Pb2+和CrO42-离子 硼一、硼原子的成键特征 价电子构型为:2s22p1能提供的成键电子:2s12p x12p y12p z 第一个成键特征:共价性(原子半径小,电离能高,电负性大) 第二个成键特征:易形成配合物和缺电子多中心键 第三个成键特征:硼单质和硼氢化合物(硼烷)的基本结构是以三面体组成的多面体 第二个成键特征a. 易形成配合物例如:HF+BF3→HBF4 b. 易形成缺电子多中心键 桥式B-H-B键 开式B-B-B硼桥键* 闭式B-B-B硼桥键 三.硼的氢化物(硼烷)和硼氢配合物 硼烷性质在物理,化学性质上更像硅烷是无色,抗磁性,多数有毒,不稳定 最简单的硼烷-乙硼烷B2H6结构 硼砂结构: 性质 强还原性 B 2H 6+3O 2 = B 2O 3+ H 2O △rHm =-2034kJ/mol 自燃 水解性 B 2H 6 +6H 2O = 2B(OH)3↓+6H 2 发生加合反应,缺电子反应 3B 2H 6 +6NH 3 = 2B 3N 3H 6(环氮硼烷:与苯是等电子体.俗称无机苯)+12H 2 五 硼的含氧化合物 构成硼的含氧化合物的基本结构单元是平面三角形的BO 3和四面体形的BO 4。 1. 三氧化二硼 制备:2H 3BO 3→B 2O 3+3H 2O 性质:(1)能被碱金属、镁和铝还原为单质硼 B 2O 3+3Mg →2B+3MgO (2)与水反应生成偏(或正)硼酸2O 3 硼酸的酸性—— 一元弱酸 在H 3BO 3中加入甘油(丙三醇),酸性可增强 B HO 2. 硼酸盐 结构特征: 基本结构单元是BO 3平面三角形和BO 4四面体. 在不同的硼酸盐中, 它们的数目不同, 连接方式不同. 硼砂—四硼酸钠 硼砂的分子式为Na 2B 4O 5(OH)4 .8H 2O 习惯上也常写作Na 2B 4O 7 .10H 2O 硼砂结构 结构单元:四个硼原子中, 有两个BO 3平面三角形和两个BO 4四面体通过共用角顶O 原子而联结起来的复杂结构。 铝 镓分族 铝及镓分族元素的一些化合物有缺电子性。常见氧化态为+I ,+III 。 Tl 的+I 化合物稳定。+III 化合物有很强的共价性 一、铝及其化合物 1. 单质铝的冶炼及性质 铝的冶炼: Al 2O 3(s )+2NaOH+2H 2O=2Na[Al(OH)4] 2Na[Al(OH)4]+CO 2=2Al(OH)3↓+Na 2CO 3+H 2O 2Al(OH)3=Al 2O 3+3H 2O Al 2O 3=4Al+3O 2 铝的性质 (1)铝的亲氧性 4Al+3O 2=2Al 2O 3 △rHm =-3339kJ/mol 铝热还原法, 利用这热量来焊接钢轨. (2)铝的两性 2Al+6HCl=2AlCl 3+3H 2↑ 2Al+2OH -+6H 2O=2[Al(OH)4]-+ 3H 2↑ 高纯铝(99.95%)不与一般的酸作用,只溶于王水. 2. 铝的氧化物及其水合物 Al 2O 3是白色难溶于水的粉末。它的主要变体有α-型Al 2O 3和 γ-型Al 2O 3。 自然界中以结晶状态存在的α-型Al 2O 3称为刚玉。刚玉的熔点高,硬度仅次于金刚石。 刚玉中由于含有不同的杂质而有不同的颜色。 含微量Cr 3+时,刚玉呈红色——红宝石 含微量Fe 3+时,刚玉呈蓝色——蓝宝石 α-型Al 2O 3和γ-型Al 2O 3性质比较 α-型Al2O3 γ-型Al2O3 与酸作用 不与酸反应 与酸反应 与碱作用 不与碱反应 与碱反应 特 性 具有耐腐蚀性 具有良好的 及绝缘性好 吸附能力及催化活性 Al 2O 3+6H +=2Al 3++3H 2O Al 2O 3+2OH -+3H 2O=2[Al(OH)4]- 3.铝盐和铝酸盐 (1)铝盐水解 : (2)几种重要的盐氯桥键为三中心四电子键Cl Cl Al 了解硫酸铝和明矾的性质Al3+的鉴定: 在氨碱性条件下,加入茜素,生成红色沉淀Al3++3NH3.H2O→Al(OH)3↓+3NH4+ Al(OH)3+3C14H5O2(OH)2(茜素) →Al(C14H7O4)3(红色)+3 H2O 稀有气体氦……太阳氖……新氩……懒惰氪……隐藏氙……奇异氡……射线稀有气体→惰性气体→稀有气体→贵气体 用途He:代替氢气充填气球和气艇 He和Ar:用于霓虹灯、灯塔工程,液氦作制冷剂,Ar作保护气体 Kr和Xe:制照特种光源,Xe灯称为“小太阳”Rn:用于恶性肿瘤的放射性治疗稀有气体的制备空气的液化稀有气体的分离原理:利用物理性质的不同 稀有气体化合物1962年巴特列发现O2+PtF6- 第一个稀有气体化合物Xe+PtF6→Xe+PtF6- 1. 氟化物Xe+F2→XeF2 Xe+2F2→XeF4Xe+3F2→XeF6 氟化物的性质——强氧化性 (1)与水反应2XeF2+2H2O=2Xe+4HF+O2↑XeF6+3H2O=2XeO3+6HF(完全水解)XeO3易爆炸的固体3XeF4+6H2O=2XeO3+2Xe+3/2O2↑+6HF (2)与还原性物质反应XeF2+2Cl-=Cl2+Xe+2F- (3)好的氟化剂2Hg+XeF4=Xe+2HgF2 2. 氧化物 XeO3:极强的氧化剂XeO3+2Cl-=Cl2+Xe 第12章氧族元素 12.1 空气中O2与N2的体积比是21:78 ,在273K和101.3kPa 下lL 水能溶解O2:49.10mL , N2:49.10mL。问在该温度下溶解于水的空气所含的氧与氮的体积比是多少? 解:己知空气中氧、氮分压比为21:78。在273K、10 1.3 kPa 下lL 水能溶解O2为49.10mL,N2为23.20 mL。溶解于水的空气中氧的体积分数为 49.10×0.21 =0.36 (49.10×0.21)+(23.20×0.78) 氮的体积分数为:1-0.36=0.64 因此溶解于水的空气所含的氧与氮的体积比是1:1. 8 。 12.2 在标准状况下,750 mL 含有O3的氧气,当其中所含O3完全分解后体积变为780mL ,若 将此含有O3的氧气lL 通入KI溶液中,能析出多少克I2 ? 解:设750mL 氧气中有x mL O3: 则有: 2 O3 → 3 O2 增加的体积 2 3 1 x30 所以2/x=1/30 x=60mL 即此氧气中O3百分比为60/750=8 % ,lL 氧气中含80mL O3 . 设能析出I2y g ,已知M (I2)=254 2I-+ 2H+ + O3 → I2 + O 2+ H2O 1mol 254g (0.08/22.4)mol y 所以 1/(0.08/22.4)=254/y y=254×0.08/22.4=0.91(g) 12.3 大气层中臭氧是怎样形成的?哪些污染物引起臭氧层的破坏?如何鉴别O3,它有什么特征 反应? 解:( 1 )O2+hv →O +O (λ<242nm ) O + O2 → O3 ( 2 )氟氯烃:CFCl3,CF2Cl2等,以及氮氧化物:NO2、NO 等可引起臭氧层的破坏。如NO2、CF2Cl2对臭氧层的破坏反应 CF2Cl2+hv→CF2C l·+C l·(λ<221nm) C l·+O3→Cl O·+O2 Cl O·+O→C l·+O2 即O3+O→O2+O2 NO2+h v→NO+O (λ<426nm) NO+ O3→ NO2+O2 NO2+O→NO+O2 即O3+O→O2+O2 所以Cl原子或NO2分子能消耗大量O3 在背诵之前先用2分钟时间看一个不伦不类的小故事: 侵害 从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,亲娘一生气,当时就休克了。 这下不得了,娘家要上告了。铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方。 这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊。 看完了吗?现在我们把这个故事浓缩一下,再用6分钟时间,把它背下来。 侵害 鲤皮捧碳蛋养福奶 那美女桂林留绿牙 嫁给康太反革命 铁姑捏痛新嫁者 生气休克 如此一告你 不得了 老爸银哥印西提 地点仙 (彩)色贝(壳)蓝(色)河 但(见)乌(鸦)(引)来鹅 一白巾供它牵 必不爱冬(天) 防雷啊! 好了,现在共用去8分钟时间,你已经把元素周期表背下来了,不信?那你再用余下的2分钟,对照一下: 第一周期:氢氦---- 侵害 第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶 第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙 第四周期:钾钙钪钛钒铬锰---- 嫁给康太反革命 铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者 砷硒溴氪---- 生气休克 第五周期:铷锶钇锆铌---- 如此一告你 钼锝钌---- 不得了 铑钯银镉铟锡锑---- 老爸银哥印西提 碲碘氙---- 地点仙 第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河 钽钨铼锇---- 但(见)乌(鸦)(引)来鹅 铱铂金汞砣铅---- 一白巾供它牵 铋钋砹氡---- 必不爱冬(天) 第七周期:钫镭锕---- 防雷啊! 唉,没办法,这么难记的东东,又必须要背,就只能这样了。以上是横着按周期背。下面是竖着按族背: 氢锂钠钾铷铯钫请李娜加入私访(李娜什么时候当皇上啦) 铍镁钙锶钡镭媲美盖茨被累(呵!想和比尔.盖茨媲美,小心累着) 硼铝镓铟铊碰女嫁音他(看来新郎新娘都改名了) 碳硅锗锡铅探归者西迁 氮磷砷锑铋蛋临身体闭 氧硫硒碲钋养牛西蹄扑 氟氯溴碘砹父女绣点爱(父女情深啊) 氦氖氩氪氙氡害耐亚克先动 化合价可以这样记忆: 一家请驴脚拿银,(一价氢氯钾钠银) 二家羊盖美背心。(二价氧钙镁钡锌) 一价氢氯钾钠银二价氧钙钡镁锌 三铝四硅五价磷二三铁、二四碳 一至五价都有氮铜汞二价最常见 正一铜氢钾钠银正二铜镁钙钡锌 三铝四硅四六硫二四五氮三五磷 一五七氯二三铁二四六七锰为正 无机化学复习总结 无机化学复习不完全攻略(原创,有不足,请指点)5 j5 K# N. x2 r) 转载自free kao yan6 n! Z+ E9 T; _) m/ U 首先说明一下,我是复习考有机专业的,因为接触无机比较早,也看过一些无机的教材,对无机的知识点略有了解,同时应版主要求,把版中无机的讨论带动起来,故介绍一下个人学的无机的心得,供大家参考,仅代表个人观点. & B$ {0 `1 t3 h7 ~ 无机的东西比较杂,并且比较松散,主要可以分为理论部分和元素化合物部分! V% q* h7 C' G+ O 理论部分主要分为四大结构和四大平衡,以及化学热力学,动力学初步和溶液 四大结构:原子结构,分子结构,配合物结构,晶体结构 四大平衡:酸碱平衡,沉淀溶解平衡,配位离解平衡,氧化还原平衡 如果你考物化的话化学热力学和动力学基础就不用看了,物化讲的比这个透彻得多,平衡的总纲以及溶液部分在物化里面也是讲的很详细; 如果你分析化学学得好的话,四大平衡也可以少看很多,因为分析化学就是建立在四大平衡的基础上的(仪器分析不算,呵呵); 5 `2 f: h; A$ f/ f+ F5 k 而结构化学里面所涉及到的结构问题又比无机的四大结构深多了,同样如果你在这方面比较强,那四大结构又省了很多事. 但是如果每门掌握的都不透彻怎么办呢?不要担心,无机的理论部分 仅仅是是一个大纲性质的东西,也就是总结性的概括.所以每种理论都有,但是每种理论要求都比较简单,按照四大结构-四大平衡-化学热力学初步-化学动力学初步-溶液的顺序自己仔细地过一遍也不是很难的事情,起码我感觉比自学有机容易多了,呵呵 如果你的化学基础比较扎实,也不要在旁边偷偷笑,正所谓"结构决定性质",无机尽管理论比较简单,但是其精髓在于用简单的理论解释大量的现象和物质性质,在你掌握相关理论的基础上要能够灵活地把它们运用到平时见到的单质和化合物的性质解释.这样才算真正掌握了无机的理论. 总的来说无机的理论部分重点在运用. s5 V [. M$ }# E) Z 而无机化学的重点则元素部分,这个也是无机主要讲的东西以及无机的特点., Y2 A. _0 I, {& Q3 Y4 ^" z- G" a 首先建议周期表最好是背过,认识并且会写除f区以外的元素,镧系最好能背过,一些重要的比如说La Ce也要知道的.* ~8 E+ ?2 e3 m$ G2 @ 个人感觉主族元素里面比较重要的是B,P,S,Sn,Pb,As,Bi,4 W' N: X5 ?8 h 副族里Hg,Co,Cr,Mn,Ti,V,Cu等比较重要,下面分主族和副族元素分开介绍:, I* Q6 y8 _- _' l' b, U7 Y w 第一主族里面要注意过氧化物,超氧化物,臭氧化物的结构和生成条件,焰色反应的火焰颜色(包括碱土金属和少量过渡金属的都要知道),以及碱金属的不溶盐; 【化学】元素周期表记忆口诀 元素周期表的结构:(记忆口诀) 七横十八纵,三短加三长,第七尚未满,有待我们装; 七主分两边,七副中间站,零族排末尾,八族括三纵; 镧锕单独列,每系占一格. 周期表中元素性质的递变规律 A.同一周期中元素性质的递变规律 以第三周期为例: *最外层电子数由1个递增到8个 *元素的金属性逐渐减弱,非金属性逐渐增强 *最高氧化物及其对应的水化物的碱性逐渐减弱,酸性逐渐增强 *元素的最高正化合价由+1逐渐增加到+7,而负化合价从第四主族开始,由-4增加到-1,最后一种元素最外层电子数为8,是稀有气体,化合价为0 *元素的原子半径逐渐缩小. B.同一主族元素性质的递变规律 同一主族元素自上而下,由于电子层数增加,原子半径增大,核对外层电子的吸引力减小,失去电子的能力增大,则元素的金属性依次增强,而非金属性依次减弱. 周期表分行列,7行18列, 行为周期,列为族。 周期有七, 三短(1,2,3)三长(4,5,6)一不全(7), 2 8 8 18 18 32 32满 6、7镧锕各15。 族分7主7副1Ⅷ零, 长短为主,长为副。 1到8重复现, 2、3分主副,先主后副。 Ⅷ特8、9、10, Ⅷ、副全金为过渡。 个别音要注意,多查查字典 青害李碧朋,探丹阳付奶。(氢氦锂铍硼,碳氮氧氟氖) 那美女桂林,流露押嫁该。(钠镁铝硅磷,硫氯氩钾钙) 抗台反革命,提供难题新。(钪钛钒铬锰,铁钴镍铜锌) 假者生喜羞,可入肆意搞。(镓锗砷硒溴,氪铷锶钇锆) 你母得了痨,八音阁隐息。(铌钼锝钌铑,钯银镉铟锡) 替弟点仙色,贝兰是普女。(锑碲碘氙铯,钡镧铈铺钕) 破杉诱扎特,弟火而丢意。(钷钐铕钆铽,镝钬铒铥镱) 虏获贪污赖,我一并进攻。(镥铪钽钨铼,锇铱铂金汞) 他钱必不安,东方雷阿土。(铊铅铋钚砹,氡钫镭锕钍) 10分钟全背化学元素周期表口诀 在背诵之前先用2分钟时间看一个不伦不类的小故事: 侵害 从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,亲娘一生气,当时就休克了。这下不得了,娘家要上告了。铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方。 这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊。 看完了吗?现在我们把这个故事浓缩一下,再用6分钟时间,把它背下来。 侵害 鲤皮捧碳蛋养福奶 那美女桂林留绿牙 嫁给康太反革命 铁姑捏痛新嫁者 生气休克 如此一告你不得了 老爸银哥印西提 地点仙 (彩)色贝(壳)蓝(色)河 但(见)乌(鸦)(引)来鹅 一白巾供它牵 必不爱冬(天)防雷啊! 好了,现在共用去8分钟时间,你已经把元素周期表背下来了,不信那你再用余下的2分钟,对照一下: 第一周期:氢氨---侵害 第二周期:锂皱硼碳氮氧氟氛----鲤皮捧碳蛋养福奶 第三周期:钠镁铝硅磷硫氯氩----那美女桂林留绿牙 第四周期:钾钙镜钛钒铬锰---嫁给康太反革命 铁钻镍铜锌惊绪----铁姑捏痛新嫁者 砷硒溴氮----生气休克 第五周期:物锶忆错锯---如此一告你 钼银钉--不得了 键钯银镉银锡锦----老爸银哥印西提 稀碘----地点仙 第六周期:绝钡铺给-——(彩)色贝(壳)蓝(色)河 锂钨铢饿----但(见)乌(鸦)(引)来鹅 依铂金汞硫铅----一白巾供它牵 铋针破氢----必不爱冬(天) 第七周期:纺镭钢--防雷啊! 第16章氧族元素 16-1 写出下列物质的化学式。 (1)方铅矿; (2)朱砂; (3)闪锌矿; (4)黄铜矿; (5)黄铁矿; (6)芒硝; (7)海波; (8)保险粉 解: (1)PbS (2)HgS (3)ZnS (4)CuFeS2 (5)FeS2 (6)Na2SO4·10H2O (7)Na2S2O3·5H2O (8)Na2S2O4·2H2O 16-2 命名下列硫的含氧酸及盐。 (1)K2S2O7; (2)H2SO5; (3)K2S2O8; (4)Na2S2O3·5H2O; (5)Na2S2O4; (6)Na2SO3; (7)Na2S4O6; (8)Na2SO4·10H2O 解: (1)焦硫酸钾(2)过一硫酸(3)过二硫酸钾 (4)五水合硫代硫酸钠(俗称海波) (5)连二亚硫酸钠 (6)亚硫酸钠(7)连四硫酸钠(8)十水合硫酸钠(俗称芒硝) 16-3 完成并配平下列反应方程式。 (1)H2S+ClO3-+H+ ------ (2)Na2S2O4+O2+NaOH------ (3)PbO2+H2O2 ------ (4)PbS+H2O2 ------- (5)S+NaOH(浓)------ (6)Cu+H2SO4(浓)------ (7)H+H2SO4(浓)------ (8)H2S+H2SO4(浓)------ (9)SO2Cl2+H2O------ (10)HSO3Cl+H2O------ 解: (1)5H2S + 8ClO3- === 5SO42- + 2H+ + 4Cl2 +4H2O (2)Na2S2O4 + O2 +2NaOH === Na2SO3 + Na2SO4 + H2O (3)PbO2+H2O2 === PbO + H2O + O2↑ (4)PbS+4H2O2 === PbSO4 + 4H2O (5)3S + 6NaOH(浓) === 2 Na2S + Na2SO3 + 3H2O (6)Cu +2H2SO4(浓) === CuSO4 + SO2↑+ 2H2O (7)S + 2H2SO4(浓) === 3SO2↑+2 H2O (8)H2S + H2SO4(浓) === S↓+ SO2+ 2H2O (9)SO2Cl2+2H2O === H2SO4+2HCl (10)HSO3Cl+H2O === H2SO4+HCl 16-4 完成下列各反应的化学方程式。 (1)Na2O2与过量冷水作用; (2)几滴热水滴在Na2O2固体上; (3)电解硫酸与硫酸铵的混合溶液; (4)将难溶于水与酸的Al2O3变成可溶于水的硫酸盐; (5)无氧条件下Zn粉还原酸式亚硫酸钠溶液; (6)将SeO2溶于水,然后通SO2Q气体; 第十三章 氧族元素 1.试用论分子轨道理描述下列各物种中的键、键级和磁性(顺磁性、逆磁性)和相对稳定性。 (1)+2O (二氧基阳离子);(2) O 2 ;(3)-2O (超氧离子) ;(4)- 22O (过氧离子)。 答:O 2分子阳、阴离子的分子轨道能级与O 2分子的相同。 (1) + 2O ] )()()()()()(K K [1*py 22pz 22py 22px 22*s 22s 2πππσσσ +2O 有一个σ键,一个π键,一个三电子键: 5.22 16)O ·B (=-=键级 有1个成单电子,显顺磁性。 (2) O 2 ] )()()()()()()(K K [1 *pz 21*py 22pz 22py 22px 22*s 22s 2ππππσσσ 22 2 6)O ·B (=-= 键级 有一个σ键,2个三电子键;有2个成单电子,显顺磁性。 (3) - 2O ] )()()()()()()(K K [1 *pz 22*py 22pz 22py 22px 22*s 22s 2ππππσσσ 5.12 36)O ·B (=-=键级 有一个σ键,一个三电子键;有1个成单电子,显顺磁性。 (4) - 22O ] )()()()()()()(K K [2 *pz 22*py 22pz 22py 22px 22*s 22s 2ππππσσσ 12 2)O ·B (==键级 - 22 O 无成单电子,为反磁性。 分子或离子的键级大,其稳定性就强,所以稳定性: +2O > O 2 >-2O >- 22O ;分子或离子的磁性与成单电子数有关,成单电子数越多,磁性越强,所以磁性 O 2>+2O =-2O >- 22O , 2.重水和重氧水有何差别?写出它们的分子式。他们有何用途?如何制备? 答:重水为D 216O 或D 2O ;重氧水为H 218O 。 重水D 2O 是核能工业中常用的中子减速剂;重氧水H 218O 是研究化学反应特别是水解反应机理的示踪物。二者的差别是:H 218O 不能维持动植物体的生命,电解水时,H 2O 优先分解,而重水D 2O 聚集在残留液中,经长时间电解后蒸馏其残留液可得到重水D 2O 。 3.解释为什么O 2分子具有顺磁性,O 3具有反磁性? 答:O 2分子中有2条三电子п键,电子未完全配对,有2个单电子,所以有顺磁性,而O 3分子中有2条σO -O 键,1条4 3π键,电子均已配对,所以有反磁性。 4.在实验室怎样制备O 3?它有什么重要性? 答:在实验室里制备臭氧主要靠紫外光(<185nm)照射氧或使氧通过静电放电装置而获得臭氧与氧的 混合物,含臭氧可达10%。臭氧发生器的示意图见图13-10。它是两根玻璃套管所组成的,中间玻璃管内壁镶有锡锚,外管外壁绕有铜线,当锡箔与铜线间接上高电压时,两管的管壁之间发生无声放电(没有火花的放电),产生电弧,02就部分转变成了03。 第一周期:氢氦---- 侵害 第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶 第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙 第四周期:钾钙钪钛钒铬锰---- 嫁给康太反革命 铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者 砷硒溴氪---- 生气休克 第五周期:铷锶钇锆铌---- 如此一告你 钼锝钌---- 不得了 铑钯银镉铟锡锑---- 老爸银哥印西提碲碘氙---- 地点仙 第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河 钽钨铼锇---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅---- 一白巾供它牵铋钋砹氡---- 必不爱冬(天)第七周期:钫镭锕---- 防雷啊! 下面是竖着按族背: 氢锂钠钾铷铯钫请李娜加入私访 铍镁钙锶钡镭媲美盖茨被累硼铝镓铟铊碰女嫁音他 碳硅锗锡铅探归者西迁 氮磷砷锑铋蛋临身体闭 氧硫硒碲钋养牛西蹄扑 氟氯溴碘砹父女绣点爱 氦氖氩氪氙氡害耐亚克先动 化合价可以这样记忆:一家请驴脚拿银,(一价氢氯钾钠银)二家羊盖美背心。(二价氧钙镁钡锌) 一价氢氯钾钠银二价氧钙钡镁锌三铝四硅五价磷二三铁、二四碳 一至五价都有氮铜汞二价最常见 正一铜氢钾钠银正二铜镁钙钡锌三铝四硅四六硫二四五氮三五磷 一五七氯二三铁二四六七锰为正碳有正四与正二再把负价牢记心 负一溴碘与氟氯负二氧硫三氮磷 元素周期表中各种元素名称的读音 第01 号元素: 氢[化学符号]H, 读“轻”, [英文名称]Hydrogen 第02 号元素: 氦[化学符号]He, 读“亥”, [英文名称]Helium 第03 号元素: 锂[化学符号]Li, 读“里”, [英文名称]Lithium 第04 号元素: 铍[化学符号]Be, 读“皮”, [英文名称]Beryllium 第05 号元素: 硼[化学符号]B, 读“朋”, [英文名称]Boron 第06 号元素: 碳[化学符号]C, 读“炭”, [英文名称]Carbon 第07 号元素: 氮[化学符号]N, 读“淡”, [英文名称]Nitrogen 第08 号元素: 氧[化学符号]O, 读“养”, [英文名称]Oxygen 第09 号元素: 氟[化学符号]F, 读“弗”, [英文名称]Fluorine 第10 号元素: 氖[化学符号]Ne, 读“乃”, [英文名称]Neon 文档来源为:从网络收集整理.word 版本可编辑.欢迎下载支持. 第12讲 副族元素及其化合物 【竞赛要求】 钛、钒、铬、锰、铁、钴、镍、铜、银、金、锌、汞、钼、钨。过渡元素氧化态。氧化物和氢氧化物的酸碱性和两性。水溶液中的常见离子的颜色、化学性质、定性检出(不使用特殊试剂)和分离。制备单质的一般方法。 【知识梳理】 一、通论 d 区元素是指IIIB~VIII 族元素,ds 区元素是指IB 、IIB 族元素。d 区元素的外围电子构型是(n -1)d 1~10ns 1~2(Pd 例外),ds 区元素的外围电子构型是(n -1)d 10ns 1~2。它们分布在第4、5、6周期之中,而我们主要讨论第4周期的d 区和ds 区元素。 同一周期的d 区或ds 区元素有许多相似性,如金属性递变不明显、原子半径、电离势等随原子序数增加虽有变化,但不显著,都反映出d 区或ds 区元素从左至右的水平相似性。 d 区或ds 区元素有许多共同的性质: (1)它们都是金属,因为它们最外层都只有1~2个电子。它们的硬度大,熔、沸点较高。第4周期d 区元素都是比较活泼的金属,题目能置换酸中的氢;而第5、6周期的d 区元素较不活泼,它们很难和酸作用。 (2)除少数例外,它们都存在多种氧化态,且相邻两个氧化态的差值为1或2,如Mn ,它有–1,0,1,2,3,4,5,6,7;而p 区元素相邻两氧化态间的差值常是2,如Cl ,它有–1,0,1,3,5,7等氧化态。最高氧化态和族号相等,但VIII 族除外。第4周期d 区元素最高氧化态的化合物一般不稳定;而第5、6周期d 区元素最高氧化态的化合物则比较稳定,且最高氧化态化合物主要以氧化物、含氧酸或氟 化物的形式存在,如WO 3、WF 6、MnO -4、FeO -24、CrO - 24等,最低氧化态的化合物主要以配合物形式存在, 如[Cr(CO)5] 2– (3)它们的水合离子和酸根离子常呈现一定的颜色。这些离子的颜色同它们的离子存在未成对的d 电子发生跃迁有关。 化学元素周期表口诀歌 1、化合价实质之歌 化合价实质要记准,金正非负单质零; 氢一氧二应记住,正负总价和为零; 许多元素有变价,条件不同价不同。 注:“金正”指金属的化合价通常显正价:“非负”指非金属的化合价通常显负价。 2、化合价之歌 氢氯钾钠一价银,二价氧钡钙镁锌,三铝四硅磷五价, 二四六硫都齐啦。谈变价,也不难,二三铁,二四碳, 三二四五氮都有,二四六七锰来占,铜汞二价最常见。 氟氯溴碘本负一,特殊情况为正七。 3、书写化学式之歌 先念后写再标价,约分之后相交叉。 4、书写化学方程式之歌 左写反应物,右写生成物;中间连等号,条件要注清; 写对化学式,式子要配平;气体和沉淀,箭号标分明。 5、金属活动性顺序表 钾钙钠镁铝锌铁,锡铅(氢),铜汞银铂金。 化学元素周期表的顺口溜 元素周期表的顺口溜如下: 1.氢锂钠钾铷铯钫,请李娜加入私访(李娜什么时候当皇上啦) 2.铍镁钙锶钡镭,媲美盖茨被累(呵!想和比尔.盖茨媲美,小心累着) 3.硼铝镓铟铊,碰女嫁音他(看来新郎新娘都改名了) 4.碳硅锗锡铅,探归者西迁 5.氮磷砷锑铋,蛋临身体闭 6.氧硫硒碲钋,养牛西蹄扑 7.氟氯溴碘砹,父女绣点爱(父女情深啊) 8.氦氖氩氪氙氡、害耐亚克先动 如何巧记元素周期表及其字母 记忆元素周期表没有什么诀窍,我这里能提供的就是五个元素五个元素的背,可以制定一个计划,一天五个,把元素名称,符号记得。之后可以用画元素周期表的方法通过填充元素来检验哪些元素还记不得。有前辈一周默写一次元素周期表,到后面可以直接倒着默,竖着默,把周期表的框格画出来,指哪个框就能说出是哪个元素。慢慢背,扎实背就可以达到很好的效果。 第十三章氧族元素 §本章摘要§1.氧 氧气和氧化物臭氧过氧化氢氧元素的成键特征 2.硫和硫化物 单质硫硫化氢和氢硫酸硫化物3.硫的含氧化合物 S(IV)的含氧化合物S(VI)的含氧化合物硫的其它价态含氧化合物4.硒和碲 氧 O:存在形式 O 2(大气圈)、H 2 O (水圈)、SiO 2 及硅酸盐,其 它含氧化合物(岩石圈)。丰度 48.6 %,居第 1 位。 硫 S:天然单质硫矿;硫化物矿。方铅矿 PbS,闪锌矿 ZnS; 硫酸盐矿:石膏 CaSO 4〃2H 2 O,芒硝 Na 2 SO 4 〃10H 2 O,重晶石 BaSO 4 , 天青石 SrSO 4 ,占0.048% 居第16位 硒 Se:硒铅矿 PbSe,硒铜矿 CuSe 碲 Te:碲铅矿 PbTe 为% 钋 Po:放射性元素,本章不做介绍。 §1. 氧 一.氧气和氧化物 1 氧气的制备 加热含氧化合物制氧气 2BaO 2→(加热)2BaO + O 2 2NaNO 3→(加热) 2NaNO 2 + O 2 最常见的是催化分解 KClO 3 ,工业 上制取 O 2 的方法是分馏液化空气。 b.p. N 2 77 K , O 2 90 K 2 氧气的性质 常温下,无色无味无臭气体,在 H 2 O 中溶解度很小,O 2为非极性分子,H 2 O 为极性溶剂。在水中有水合氧分子存在。 水中少量氧气是水生动植物赖以 二臭氧 1 臭氧的分子结构 臭氧的分子式为 O 3 ,价层电子总数: 6 + 0×2 = 6, 3对,2个配体,价层电子对构型:三角形,中心氧原子的杂化方式:sp2不等性杂化。 中心的 2Pz 轨道和两个配体的 2Pz 轨道均垂直于分子平面,互相重叠,共有 4 个电子(中心 2 个,配体 1 个× 2 )在这 3 个 Pz 轨道中运动,形成 3 中心 4 电子大Π键,表示成。 画出上述大Π键的分子轨道图,以2 臭氧的产生、性质和存在 在高温和放电的条件下,O 2 可以 变成 O 3 。如雷雨季节里闪电,产生 的高压放电,可引发反应 3 O 2 —— 2 O 3 O 3 淡蓝色,有鱼腥气味,由于分 子有极性,在水中的溶解度比 O 2 大些。 氧化性很强 大气层中,离地表 20 km ~ 40 副族元素 ————————————————————————————————作者:————————————————————————————————日期: 高中化学奥林匹克竞赛辅导讲座 第12讲副族元素及其化合物 【竞赛要求】 钛、钒、铬、锰、铁、钴、镍、铜、银、金、锌、汞、钼、钨。过渡元素氧化态。氧化物和氢氧化物的酸碱性和两性。水溶液中的常见离子的颜色、化学性质、定性检出(不使用特殊试剂)和分离。制备单质的一般方法。 【知识梳理】 一、通论 d区元素是指IIIB~VIII族元素,ds区元素是指IB、IIB族元素。d区元素的外围电子构型是(n-1)d1~10ns1~2(Pd例外),ds区元素的外围电子构型是(n-1)d10ns1~2。它们分布在第4、5、6周期之中,而我们主要讨论第4周期的d区和ds区元素。 第4周期d区、ds区元素某些性质 Sc3d14s2 Ti 3d24s2 V 3d3 4s2 Cr 3d54 s1 Mn 3d54 s2 Fe 3d64s2 Co 3d74s2 Ni 3d84s2 Cu 3d104s1 Zn 3d104 s2 熔点/℃1953 1675 4 3 1083 419 沸点/℃2727 326 77 3 2595 907 原子半径 /Pm 164 7 126 125 125128137 M2+半径 /Pm - 9 67 72 74 I1kJ·m ol-1631658 650 652.8 71 7.4 759. 4 758 7 36.7 745. 5 906.4 室温密度 /gcm-3 2.99 4.5 5.96 7.20 7.207.86 8.9 8.90 8.92 7.14 氧化态3–1,0, 2 3,4 –1,0,2 3,4, 5 –2,–1,0 2,3,4 5,6 –1,0,1 2,3,4 5,6,7 0,2,3 4,5,6 0,2 3,4 0,2 3,(4)* 1,2 3 (1) 2 *()内为不稳定氧化态。 同一周期的d区或ds区元素有许多相似性,如金属性递变不明显、原子半径、电离势等 《无机化学》研究生入学考试大纲 科目代码:836 一、考查总目标 《无机化学》主要考察学生对无机化学基础理论和元素化学基本知识掌握情况。基础理论包括物质结构基础(原子结构和元素周期律、分子结构、晶体结构和配合物结构)、化学热力学与化学动力学基础(化学热力学、化学平衡、化学动力学)和水溶液化学原理(酸碱平衡、沉淀平衡、氧化还原平衡和配位平衡)。元素化学包括主族元素、过渡元素及其化合物的存在、制备、性质和应用。要求考生系统掌握无机化学的基本知识、基础理论和基本方法,并能运用相关理论和方法分析、解决实际问题。 二、考试形式与试卷结构 (一)试卷成绩及考试时间 本试卷满分150分,考试时间为180分钟。 (二)答题方式 答题方式为闭卷、笔试。 (三)试卷内容结构 物质结构基础:约35分 化学热力学与化学动力学基础:约25分 水溶液化学原理:约35分 主族元素:约30分 过渡元素:约25分 (四)试卷题型结构 选择题:每小题2 分,共50分 填空题:每空2 分,约35分 简答题:约35分 完成并配平反应方程式:10分 计算题:20 分 三、考查范围 (一)考查目标 1、掌握元素周期律,化学热力学,近代物质结构,化学平衡以及基础电化学等基本 原理;并具有对一般无机化学问题进行理论分析和计算的能力, 2、熟悉常见元素及其化合物的性质。培养学生运用无机化学原理去掌握有关无 机化学中元素和化合物的基本知识,并能从微观和宏观相结合来阐述元素及其化合物的性质,熟悉离子的分离和鉴定。 (二)考核要求 第一章原子结构和元素周期系 1.掌握原子、分子、元素、核素、同位素、原子质量、平均原子质量、分子量、式量等基本概念。 2.了解电子等微观粒子运动的特殊性;掌握波函数、电子云、原子轨道、电子层的概念,会看波函数与电子云图形,重点掌握描述电子运动状态的四个量子数的物理意义、取值规律和合理组合。 3.根据电子排布三原则和鲍林原子轨道近似能级图,掌握原子核外电子排布规律(特殊情况除外),能书写一般元素的原子核外电子排布式和价电子构型,并根据电子排布式判断元素在周期表中的位置及有关性质。 4.理解原子的电子层结构和元素周期表的关系,元素的若干性质(原子半径、电离能、电子亲合势、电负性)与原子的电子层结构的关系。 第二章分子结构 1.了解路易斯结构式。 2.熟悉键能、键长、键角和键的极性等键参数的概念,并能用键参数解释分子的稳定性、极性等性质。 3.掌握价键理论及杂化轨道理论,理解杂化对分子性质的影响,能用杂化轨道理论解释一般分子和离子的空间构型。 4.理解离域Π键形成的条件和特点,了解等电子体原理。 5.掌握分子轨道理论的基本要点,并能用分子轨道理论解释第一、二周期简单 的双原子分子的形成及稳定性,其中以O 2分子和N 2 分子的分子轨道能级图、 分子轨道表示式为重点。 6.掌握电子对互斥理论的基本论点,能用价层电子对互斥理论预测元素分子和离子的空间构型。 7.了解分子间力产生的原因和特点,理解分子间力对化合物性质的影响。8.理解氢键形成的条件和特点,掌握氢键对化合物性质的影响。 化学元素周期表口诀化学元素周期表口诀 口诀 A、按周期分: 第一周期:氢氦 ---- 侵害 第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶 第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙) 第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命 铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者 砷硒溴氪 ---- 生气休克 第五周期:铷锶钇锆铌 ---- 如此一告你 钼锝钌 ---- 不得了 铑钯银镉铟锡锑 ---- 老把银哥印西堤 碲碘氙 ---- 地点仙 第六周期:铯钡镧铪 ----(彩)色贝(壳)蓝(色)河 钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅 铱铂金汞砣铅 ---- 一白巾供它牵 铋钋砹氡 ---- 必不爱冬(天) 第七周期:钫镭锕 ---- 很简单了~就是---- 防雷啊! B、按族分: 氢锂钠钾铷铯钫——请李娜加入私访 铍镁钙锶钡镭——媲美盖茨被雷 硼铝镓铟铊——碰女嫁音他 碳硅锗锡铅——探归者西迁 氮磷砷锑铋——蛋临身体闭 氧硫硒碲钋——养牛西蹄扑 氟氯溴碘砹——父女绣点爱 氦氖氩氪氙氡——害耐亚克先动 规律 一、元素周期表中元素及其化合物的递变性规律 1、原子半径 (1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小; (2)同一族的元素从上到下,随电子层数增多,原子半径增大。 2、元素化合价 (1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外); (2)同一主族的元素的最高正价、负价均相同。 3、单质的熔点 (1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减; (2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。 4、元素的金属性与非金属性 (1)同一周期的元素从左到右金属性递减,非金属性递增; (2)同一主族元素从上到下金属性递增,非金属性递减。 5、最高价氧化物和水化物的酸碱性 元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。 6、非金属气态氢化物 元素非金属性越强,气态氢化物越稳定。同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。 7、单质的氧化性、还原性 一般元素的金属性越强,其单质的还原性越强,其氧化物的氧离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。二、推断元素位置的规律 判断元素在周期表中位置应牢记的规律: 1、元素周期数等于核外电子层数; 2、主族元素的序数等于最外层电子数; 3、确定族数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。最后的差数就是族序数,差为8、9、10时为VIII族,差数大于10时,则再减去10,最后结果为族序数。 化合价可以这样记忆:一家请驴脚拿银,(一价氢氯钾钠银)二家羊盖美背心。(二价氧钙镁钡锌)一价氢氯钾钠银二价氧钙钡镁锌三铝四硅五价磷二三铁、二四碳一至五价都有氮铜汞二价最常见正一铜氢钾钠银正二铜镁钙钡锌 化学元素周期表背诵口诀 化学元素周期表背诵口诀一 第一周期:氢、氦--- 侵害 第二周期:锂、铍、硼、碳、氮、氧、氟、氖------- 鲤皮捧碳、蛋养福奶 第三周期:钠、镁、铝、硅、磷、硫、氯、氩 -- 那美女桂林留绿牙(那美女鬼、流露绿牙) 第四周期:钾、钙、钪、钛、钒、铬、锰嫁改康太反革命 铁、钴、镍、铜、锌、镓、锗铁姑捏痛新嫁者 砷、硒、溴、氪--- 生气、休克 第五周期:铷、锶、钇、锆、铌如此一告你 钼、锝、钌-- 不得了 铑、钯、银、镉、铟、锡、锑----- 老把银哥印西堤 碲、碘、氙、--- 、地点仙 第六周期:铯、钡、镧、铪----- (彩)色贝(壳)蓝 (色)河钽、钨、铼、锇但(见)乌(鸦)(引)来鹅铱、铂、金、汞、砣、铅一白巾、供它牵 铋、钋、砹、氡--- 必不爱冬(天) 第七周期:钫、镭、锕很简单了~就是防雷啊! 化学元素周期表背诵口诀二氢锂钠钾铷铯钫,请李娜加入私访(李娜什么时候当皇上啦) 铍镁钙锶钡镭,媲美盖茨被累(呵! 想和比尔. 盖茨媲美, 小心累着) 硼铝镓铟铊,碰女嫁音他(看来新郎新娘都改名了) 碳硅锗锡铅,探归者西迁氮磷砷锑铋,蛋临身体闭氧硫硒碲 钋,养牛西蹄扑氟氯溴碘砹,父女绣点爱(父女情深啊) 氦氖氩氪氙氡、害耐亚克先动化学元素周期表背诵口诀三一家请驴脚拿银,(一价氢氯钾钠银)二家羊盖美背心(二价氧钙镁钡锌)一价氢氯钾钠银,二价氧钙钡镁锌三铝四硅五价 磷,二三铁、二四碳一至五价都有氮,铜汞二价最常见正一铜氢钾钠银,正二铜镁钙钡锌三铝四硅四六硫,二四五氮三五磷一五七氯二三铁,二四六七锰为正 碳有正四与正二,再把负价牢记心负一溴碘与氟氯,负二氧硫 三氮磷化学元素周期表规律总结 1、原子半径 (1) 除第1 周期外,其他周期元素( 惰性气体元素除外) 的原子半径随原子序数的递增而减小; (2) 同一族的元素从上到下,随电子层数增多,原子半径增大。 2、元素化合价 (1) 除第1 周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4 递增到-1( 氟无正价,氧无+6 价,除外); (2) 同一主族的元素的最高正价、负价均相同。 3、单质的熔点 (1) 同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减; (2) 同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。 4、元素的金属性 (1) 同一周期的元素从左到右金属性递减,非金属性递 增; (2) 同一主族元素从上到下金属性递增,非金属性递减第 3 页 298#《无机化学》作业1复习资料 一、选择题 1、在室温下,把20gNaCl溶解在100ml水中所得到的分散系是() A.乳状液B.悬浊液C.胶体溶液D.离子分散系 2、配合物〔CoCl2(en)2〕+配位数是() A.2 B.4 C.6 D.8 3、下列哪个是配合物() A.[Cu(NH3)4]SO4B.KAl(SO4)2?12H2O C.(NH4)2SO4D.CuSO4 4、相同温度下,下列溶液中渗透压最大的是:() A.0.2mol/L蔗糖(C12H22O11)溶液B.50g/L葡萄糖(M B=180)溶液 C.0.01mol/L CaCl2溶液D.0.01mol/L乳酸钠(C3H5O3Na)溶液 5、能使红细胞发生皱缩现象的溶液是:() A.1g/L NaCl溶液B.12.5g/L NaHCO3液 C.9g/L NaCl溶液D.1.0mol/L NaCl溶液 6、会使红细胞发生溶血现象的是:() A.9g/L氯化钠溶液B.50g/L葡萄糖溶液 C.100g/L葡萄糖溶液D.生理盐水和等体积水混合液 7、在0.1mol/L氨水中要使电离度和pH值都减小应加入的物质是: () A.NH4Cl B.NaOH C.H2O D.NH3 8、下列各组分子、离子中不是共轭酸碱对的是:() A.HCl—Cl-B.H2CO3—CO32-C.H2CO3—HCO3-D.NH4+--NH3 9、欲配制PH=3.5缓冲液,应选择的缓冲对是:() A.HCOOH(Pka=3.76)和HCOONa B.H3PO4(Pka=2.16)和NaH2PO4 C.H2C8H4O4和(Pka=2.95) KHC8H4O4D.HAc(Pka=4.75)和NaAc 10、缓冲溶液的缓冲能力大小用()来衡量。() A.缓冲比 B.缓冲范围C.总浓度 D.缓冲容量 11、下列配离子中,最稳定的是:() A.[Cu(NH3)4]2+(K s=2.09×1013)B.[Cu(en)2]2+(K s=1.0×1020)C.[Gd(NH3)4]2+(K s=1.32×107)D.[Zn(NH3)4]2+(K s=2.88×108) 12、0.05mol/L HCN溶液中,若有0.01%的HCN电离,则HCN电离常数是: () A.5×10-8B.5×10-6 C.5×10-10 D.2.5×10-7 13、人体血液中平均每100ml中含19mgK+,则血液中K+(Mr=39)的浓度是:() A.0.49mol/L B.4.9mol/L C.4.9×10-3mol/L D.4.9×10-4mol/L 14、在H2CO3H++ HCO3-平衡体系中,若()可产生同离子效应 A.加入氢氧化钠 B.加入盐酸C.用水稀释D.升高温度 15、如果c(1/2H2SO4)= 0.48 mol?L-1,则c(H2SO4)等于。() A.0.12 mol?L-1 B.0.24mol?L-1C.0.48mol?L-1 D.0.96 mol?L-1 16、非电解质稀溶液的蒸气压下降、沸点升高、凝固点降低的数值取决于() A.溶液的体积B.溶液的质量浓度 C.溶液的温度D.溶液的质量摩尔浓度 17、对于零级反应,下列说法正确的是() A.活化能很低B.速率常数等于零 C.反应速率与反应物浓度无关D.反应物浓度不随时间变化 18、某一元弱酸的K a=1.0×10-7,0.1 mol·L-1该弱酸溶液的pH值为() 第15章 氧族元素 1. (7381) 氧呈现+2价氧化态的化合物是……( ) (A) Cl 2O 6 (B) BrO 2 (C) HClO 2 (D) F 2O 2. (7374) 硫化铵溶液放置久了变为黄棕色甚至红棕色,其原因是生成了…………( ) (A) (NH 4)2SO 4 (B) NO 2 (C) S 和NH 3·H 2O (D) (NH 4)2S 2 2 (NH 4)2S + O 2 = 2 S + 2 NH 3 + 2 H 2O (NH 4)2S + S = (NH 4)2S 2 3. (1384) 干燥H 2S 气体,通常选用的干燥剂是( ) (A) 浓H 2SO 4 (B) NaOH (C) P 4O 10 (D) NaNO 3 干燥剂:有吸水性,不与被干燥物反应。 酸碱性,氧化还原性,生成配合物的性质。 4. (1040) 下列关于-22O 和-2O 的性质的说法中,不正确的是………………………( ) (A) 两种离子都比O 2分子稳定性小 (B)- 22O 的键长比- 2O 键长短 (C)-22O 是反磁性的,而- 2O 是顺磁性的 (D)-2O 的键能比-22O 的键能大 -22O 1个σ 键,-2O 1个σ键,1个3电子π 键。 5. (4314) 下列分子式中错误的是………… ( ) (A) SF 2 (B) SF 3 (C) SF 4 (D) SOF 4 S : 3s 23p 4 常见氧化态: -Ⅱ,0,Ⅱ,Ⅳ,Ⅵ 6. (0933) 下列各组数字都是分别指原子的次外层、最外层电子数和元素的一种常见氧化态, 最符合硫的情况的一组是…………………………… ( ) (A) 2,6,-2 (B) 8,6,-2 (C) 18,6,+4 (D) 2,6,+6 S: 1s 2 2s 22p 6 3s 23p 4 8(次外层电子数),6(最外层电子数),-2(常见氧化态) 7. (0585) 在碱性溶液中,已知前两个反应的K c 值,则反应(3)的K c 值为…………( ) (1) 2S(s) + S 2-(aq)S 32-(aq) K c 1 = 13.0 (2) S(s) + S 22-(aq)S 32-(aq) K c 2 = 10.8 (3) S(s) + S 2-(aq)S 22-(aq) K c (A) 1.2 (B) 119 化学元素周期表记忆口 诀 https://www.doczj.com/doc/656214374.html,work Information Technology Company.2020YEAR 【化学】元素周期表记忆口诀 元素周期表的结构:(记忆口诀) 七横十八纵,三短加三长,第七尚未满,有待我们装; 七主分两边,七副中间站,零族排末尾,八族括三纵; 镧锕单独列,每系占一格. 周期表中元素性质的递变规律 A.同一周期中元素性质的递变规律 以第三周期为例: *最外层电子数由1个递增到8个 *元素的金属性逐渐减弱,非金属性逐渐增强 *最高氧化物及其对应的水化物的碱性逐渐减弱,酸性逐渐增强 *元素的最高正化合价由+1逐渐增加到+7,而负化合价从第四主族开始,由-4增加到-1,最后一种元素最外层电子数为8,是稀有气体,化合价为0 *元素的原子半径逐渐缩小. B.同一主族元素性质的递变规律 同一主族元素自上而下,由于电子层数增加,原子半径增大,核对外层电子的吸引力减小,失去电子的能力增大,则元素的金属性依次增强,而非金属性依次减弱. 周期表分行列,7行18列, 行为周期,列为族。 周期有七, 三短(1,2,3)三长(4,5,6)一不全(7), 2 8 8 18 18 32 32满 6、7镧锕各15。 族分7主7副1Ⅷ零, 长短为主,长为副。 1到8重复现, 2、3分主副,先主后副。 Ⅷ特8、9、10, Ⅷ、副全金为过渡。 个别音要注意,多查查字典 青害李碧朋,探丹阳付奶。(氢氦锂铍硼,碳氮氧氟氖) 那美女桂林,流露押嫁该。(钠镁铝硅磷,硫氯氩钾钙) 抗台反革命,提供难题新。(钪钛钒铬锰,铁钴镍铜锌) 假者生喜羞,可入肆意搞。(镓锗砷硒溴,氪铷锶钇锆) 你母得了痨,八音阁隐息。(铌钼锝钌铑,钯银镉铟锡) 替弟点仙色,贝兰是普女。(锑碲碘氙铯,钡镧铈铺钕) 破杉诱扎特,弟火而丢意。(钷钐铕钆铽,镝钬铒铥镱) 虏获贪污赖,我一并进攻。(镥铪钽钨铼,锇铱铂金汞) 他钱必不安,东方雷阿土。(铊铅铋钚砹,氡钫镭锕钍) 普诱那不美,惧怕可爱肥。(镤铀镎钚镅,锔锫锎锿镄) 们若老,炉肚喜波黑,卖Uun Uuu Uub! 侵害 从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,亲娘一生气,当时就休克了。 这下不得了,娘家要上告了。铁姑的老爸和她的哥哥夜入县太爷府,把大印假无机化学12章氧族元素答案
化学元素周期表口诀
无机化学考研复习总结笔记
化学元素周期表记忆口诀
10分钟全背化学元素周期表口诀
无机化学第十六章氧族元素习题
无机化学第三版下册复习资料第二十一章第十三章氧族元素1
九年级化学元素周期表口诀
高中化学竞赛第12讲副族元素及其化合物
化学元素周期表口诀歌
无机化学第十三章 氧族元素
副族元素
《无机化学》研究生入学考试大纲
化学元素周期表口诀化学元素周期表口诀
化学元素周期表背诵口诀
298#《无机化学》作业1复习资料
无机化学之 氧族元素题目+答案
化学元素周期表记忆口诀