
中级无机化学
项斯芬 姚光庆 编著 北京大学出版社
第一章
1.4.解:
1) H 2O 2
C 2
2
(2)S 2O 32
C
3v
3) N 2O (N N O 方式 ) C v
(4)Hg 2Cl 2 D h
5)
H 2C=C=CH 2 D
2d
(6)UOF 4 C 5v
7) BF 4
T d
(8)SClF 5
C 4v
9) 反 -Pt (NH 3)2Cl 2
D
2h
(10)PtCl 3(C 2H 4)
C
2v
第二章
2.1 解:
trans
P 代表 PPh 3)
2.2 解 1)MA 2B 4
Ni 2+
d 8 组态 Pt 2+ d 8 组态
第四周期 分裂能小) 第六周期(分裂能大)
Cl
Ni P
Cl
Cl
P Cl Cl Pt P
P Cl P P Pt C C l l
四面体构型 平面四方形构型(两种构型)
B
M B
A B M A B
A
M
A
A
A M
B
cis
只有一种结构 2)MA 3B 3
Co(en)2(NH 3)Cl 2+
trans cis fac(面式) mer(经式) D 4h
=0
0 C 2v
C 3v
C 2v
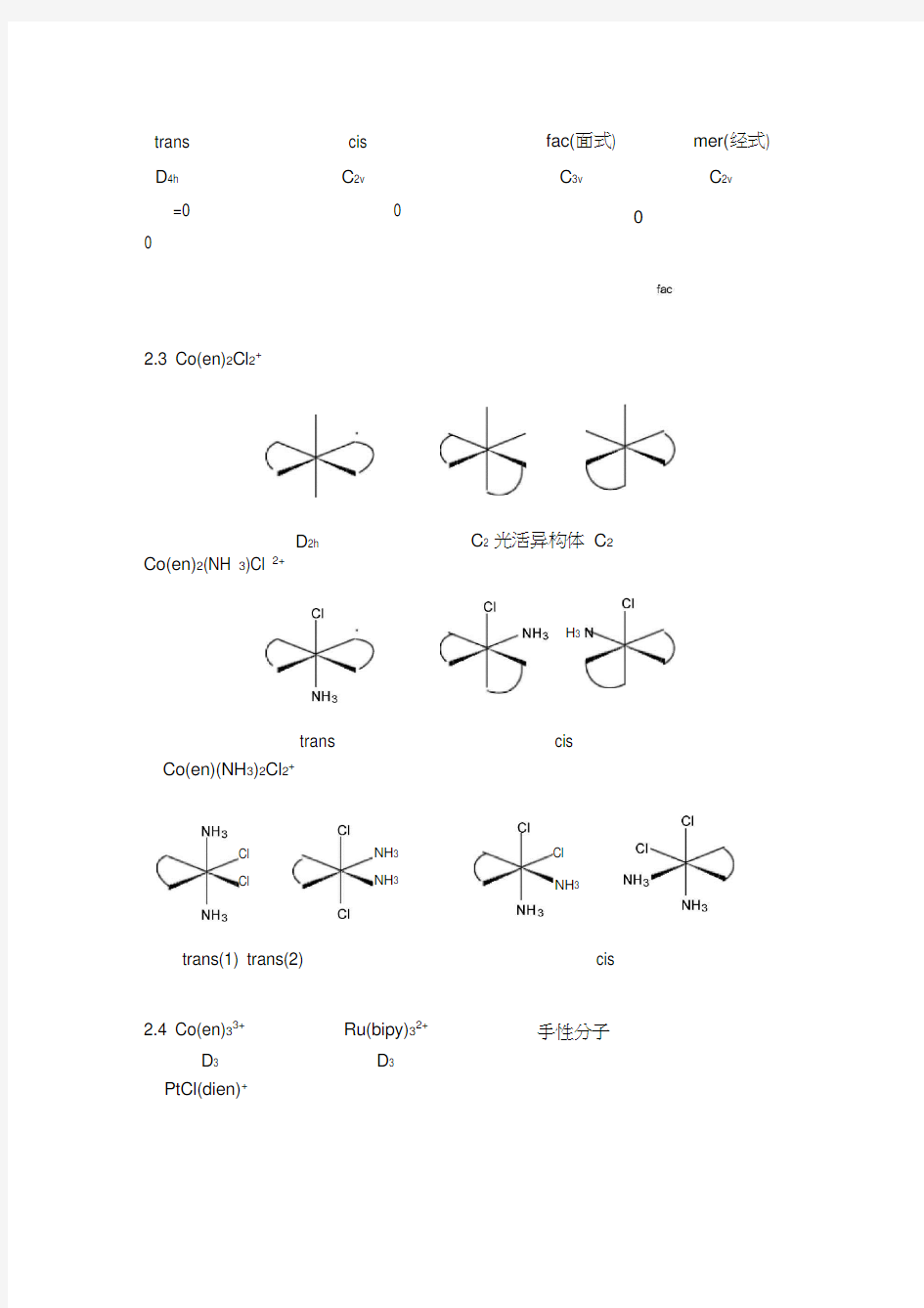
2.3 Co(en)2Cl 2+ D 2h
C 2 光活异构体 C 2
trans Co(en)(NH 3)2Cl 2+ Cl Cl NH 3 NH 3
cis
Cl NH 3
trans(1) trans(2) 2.4 Co(en)33+ D 3
PtCl(dien)+
Ru(bipy)32+
D 3
H 3
cis
手性分子
CH 2 CH 2 NH 2
HN
CH 2 CH 2 NH 2
dien
基本上为平面分子 ,无手性
2.5 (1) 分别用 BaCl 2 溶液滴入,有白色沉液出现的为 [Co(NH 3)5Br]SO 4,或分别
加入 AgNO 3溶液,产生浅黄色沉淀的为 [Co(NH 3)5SO 4]Br 。
(2) 等物质量的异构体中分别加入过量 AgNO 3,产生少量沉淀( 1molAgCl ↓) 的为前者(摩尔比为 2:1),产生大量沉淀( 2molAgCl ↓)的为后者。
或用电导方法测量,前者和后者的电导比为 2:3 (3) [Co(H 2O)4Cl 2]+
顺式 C 2v 、反式 D 4h ,对称性不同,偶极矩不同,可以用物理方法鉴别,例 如红外或 Raman 光谱不同。
2.6 8 个 CN -
基团在化合物中的化学环境是完全等同的, 可能的结构是四方反
棱柱和四方棱柱构型,不可能是 12 面体( D 2d 点群),实验证明是四方反棱柱。
2.7 根据 HSAB 的协同作用( symbiotic )原理,软配体可使中心金属变软,反 之
亦然, CN 是软配体, NH 3 是硬配体。桥连配体 NCS 中 S 比 N 软,因此分子 结构为:
(H 3N)5Co -NCS -Co(CN)5
2.8 同上题,桥连配体 NC 中 C 比 N 软,因此,分子结构为:
Co(NH 3)5-NC -Co(CN)5
2.9 AgO 晶体中的 Ag(Ⅱ)实际上是 Ag(Ⅰ)和 Ag( Ⅲ)混合而成, d 10 的 Ag(I) 为 sp 杂化,直线型
d 8的 Ag(Ⅲ)倾向 dsp 2杂化,以获得更多的晶体场稳定化能,因此为平面四方。
2.10 Mn(CO)5(NO)
(1)C 4v
Cl N
NO
2) Co(PPh2Me)2(NO)Cl 2
NO P
P
NO
Cl
Cl
C P l
Cl
NO P C2v C1 C1
3)
4)
对映体的点群不变,未给出)
[Fe(CO)4(CN)]
C2v
CN
Ni(PPhMe2)2Br3
C2v
Br
Br
Br
C s D3h
5) Ru(PPh3)3Cl2
P
P
Cl
Cl
P
Cl
Cl
Cl
Cl
C2v
D3h C s 6) VOCl 42
第三章
3-
3.1 Fe(CN)
63-
3-
∴ Fe(CN) 63-
为
LS
有一个未成对电子
3+
Fe(H 2O)63+
为 HS
有五个未成对电子
d 8 Ni(CN) 42
CN -
强场 LS 平面四
方
3.2
Ni 2+为 d 8 组态第四周期 Pt 2+ 为 d 8 组态,第六周期
按照 g f g 为金属离子的性属,周期数越高, g 因子越大
∴Pt 2+的 g 因子大于 Ni 2+的 g 因子。
( PtCl 42 ) (NiCl 42 )
分裂能 大,容易形成平面四方构型, 小,则为四面体构型
3.5
1
(1)2p 1 L=1 , S 1 , 基谱项 2
P
2
(2)2p 2 L=1 , S=1, 基谱项 3P (3)2d 1
L=2 , S 1 , 基谱项 2D
2 3
(4)2d 3
L=3 , S 3 , 基谱项 4
F 2
(5)3d 5
L=0 , S 5 , 基谱项 6S
Cl
Cl
Cl
O Cl
C 2v
Fe 3+
为 d 5,CN -
强场配体
H 2O 为弱场配体
Fe(H 2O)6
3+
NiCl 42 Cl -
弱场 HS
四面体
2
1
(6)3d9与3d1类似L=2,S 1,基谱项2D
3.6 CoF63中,Co3+的电子组态为d6,高自旋(弱场配体)∴在T-S 图中,
允许在跃迁是5T2g 5E g,只有一个吸收带。
11
3.7 0 17600cm 1B 918cm 1 Cr(H2O)63+中Cr3+为d3组态
从T-S 图上得到:
可能的两个允许跃迁为4A2 4T2 4A2 4T1
0 /B 17600 /918 19.2
在横轴上找到19.2的点,作垂线与4T2和4T1分别相交于E/B=28.5和
E/B=19.5 两点。
∴E1/B=28.5 E1=28.5× 918=26200(cm 1)
E2/B=19.5 E2=19.5× 918=17901(cm 1)
3.8(1
d6组态强场
)LS Rh(NH3)63+
1A1g
(2
)Ti(H 2O)63+d1
2T2g
(3
HS,弱场
)Fe(H2O)63+ d5
6A1g
3.9CrL6 d3LMCT 光谱
a)4A2g→4T2g(4F)(低能量峰)
4A2g→4T1g(4F)(高能量峰)
2
b)en ox F
配位场强度减弱
F 的配位场强度最弱,在T-S 图中偏左,∴有可能得4A2g→4T1g(4P)的跃迁
3.10 Mn2+为d5,H2O 为弱场配体
d5弱扬,基谱项为六重态的6A1,而高能级谱项中没有相应的六重态谱项,∴没有自旋允许的跃迁。
Cr(aq)3+为d3,弱场
cis- PtCl 2(PR 3)2
反位效应 PR 3>Cl -
允许的电子跃迁有 4A 2→4T 1,4A 2→T 1,吸收光谱在能量较低的可见光区, ∴有色。
3.11 d 2 组态的金属含氧酸根离子
+4 +5 +6 +6 CrO 44 , MnO 43 ,FeO 42 和 RuO 42 , 四周期 四周期 四周
期 五周期
氧化态和所在周期的位置对下列性质有影响 ( 1) RuO 42 的 t 最大,
CrO 44 的 t 最小。 (2)FeO 42 有最短的 M -0 键,∵ Fe(Ⅵ )离子半径最小
r Fe(Ⅵ )< r Mn( Ⅴ )< r Cr(Ⅳ )
( 3)是 LMCT 第四章
4.1 进入基团 y 不同而反应速率相同,说明反应与 y 无关,速控步为离去基团
的解离,因此反应属于 S N 1反应,即离解机理,或 D 机理。
4.2
Cl NH 3
反位效应的顺序为: NO 2
Cl
NH 3
4.3
(1)
PR 3
+
PR 3 Cl PR 3 Pt
Cl
cis
Cl Cl Pt
NO 2
2-
NH 3
PR 3 Cl
Cl Pt
PR 3
2+
Cl -
NO 2
Cl Pt
(2) . trans-PtCl 2(PR 3)2 反位效应 PR 3>Cl -
反位效应 PR 3>Cl
(3)
反位效应 Cl >NH 3≥py 4.5 速率=k 1[Au(dien)Cl 2+]+k 2[Au(dien)Cl 2+][Cl *-] 取代反应中存在两种机理①前一项表示 S N 1 反应,即单分子反应的离解机理, ② 后一项表示双分子取代的缔合机理。
注: k 1通常溶剂合作用的过程,表现为离解机理
第5章
Cl * +2
N
N Cl *
NN
+2
4.6 Mn(H 2O)26+
> Ni(H 2O)6
2+
> Ir(NH 3)36+
> Rh(NH 3)6
3+
> Co(NH 3)36+
活性逐渐减小
d 5(HS)
d 8
d 6(LS) d 6(LS) d 6(LS)
5.1 B(OCH 3)3+4NaH
250 C
NaBH 4+3NaOCH 3
2-
PR 3 Cl Pt
PR
3
Cl Cl
trans
(1)
2)
-Cl
-Cl
N N N Cl
4BF 3+3NaBH 4
(C 2H 5)2O
2B 2H 6+3NaBF 4
由 B 2H 6 再制备其它高级硼烷和衍生物 例: 2B 2H 6 120 C
B 4H 10 +H 2
5 B 4H
10
o
120C
4 B 5H 11+3 H 2
2 NaBH 4 +5 B 2H 6 Na 2[B 12H 12]+1
3 H 2
5.2 (n+x) 中的 x
骨架电子对
数
(1) B 5H 9 B 5H 5+4 2 5+2 (2) B 5H 11 B 5H 5+6
3 5+3 (3) B 3H
-81
B 3H -31
+5
3 3+3 (4) Na 2[B 10H 10] B 10H
10
1 10+1 (5) C 2B 4H 6
~B 6H 6+2
1
6+1
(1 个 C ≈1 个 B+1 个 e)
(6) C 2B 4H 8 ~B 6H 6+4
2 6+2
5.3 B 4H 10
B 4H 4+6 n+3 蛛网式
4个 3c -2e
BHB
8e 1个
B -B
2e 2个 BH 2
8e
2个
BH
4e
22e
巢式
4个 3c -2e BHB 8e 1个 3c -2e
BBB
2e 5个 B -H
10e
H H
H
B 5H 9 B 5H 5+4 n+2
2 个 B - B
4e
24e
B 10H 122-
n+2 巢式(开式) B 10H 12
2
n+3
蛛网式
参看表 5.4, B 原子个数为 10 的横排
5.6
(1)1,5-C 2B 3H 5
n+1 闭式
B 5H 11 B 5H 5+6 n+3
开式
2个 3C - 2e
BBB 4e 3个 3C
- 2e
BHB
6e 2个 BH
4e
3个 BH 2
12e
5.4
B 10H
10
n+1 闭式 2)1,2-C 2B 4H 6
n+1 闭式
26e
B
5.7
A S4
类 P 4
Te 4
6
三枝柱
5+ 6
=
9 + 2
C 8H 8
立方烷
6 + 8 = 12 + 2
第6章
6.1
H 3C CH 3 CH 3 3
Al Al CH 3
H 3C
CH 3
3
空间位阻大,形成单体
6.3
3)2,3-C 2B 4H 8
n+2 开式
4) Cp -1
Co 3+
B 4H 28-
n+3 网式
问题:
H 的位置
n+2
面 顶 棱
F + V = E + 2
四面体 4+4 = 6+2
3c - 2e 桥键 B 4H 8
(1) Si(CH3)4 P b(CH3)4
热分解较难热分解较易
因为Si-C 键较强Pb-C键较弱
(2) Li 4(CH3)4 B(CH3)3 Si(CH3)4 Si(CH3)3Cl
Lewis 酸性B(CH3)3 > Li4(CH3)4 > Si(CH3)3Cl >Si(CH3)4
单体多聚
错误较多。Li4(CH3)4 多聚体缓和了缺电子性。
(3) N(CH3)3 和As(CH3)3
Lewis 碱性:
对H+等硬酸,N(CH3)3 > As(CH3)3 ∵N 的电负性较大对有机金属化合物等软酸,As(CH3)3 > N(CH3)3 ∵As 比N 软,与软酸的结合能力强。
错误较多。对于Lewis 酸碱,可根据物质的性质分为软性和硬性,因而在比较酸碱性时也需要分类进行对比。
6.5
V(CO)617e不符合18e 规则
Cr(CO)618e
Fe(CO)518e
Ni(CO) 418e
Mn(7e),Tc(7e),
Re(7e),
Co(9e),Rh(9e),Ir(9e),价电子数均为单数,
要
满足18e 构型,不可能为单核羰基化合物
6.6 CO 和d 区金属成键时,金属次外层轨道上有参与成键 d 电子作为价电子,可以反馈到CO 的*轨道上,而BF3等p区元素则没有价电子形成反馈键,因
此不能与CO 形成稳定化合物。
-+
6.7 V(CO) -6,Mn(CO) 6+,Cr(CO) 6
反馈电子多反馈电子最少反馈电子越多,CO的*越强,C-O 越弱∴ CO 的振动频率Mn(CO) 6+>Cr(CO) 6 >V(CO) -6
6.9 由IR 吸收峰,推测其有端羰基,边桥羰基和面桥羰基
M1-CO M2-CO M3-CO
平均每个 Co 周围的价电子总数为 18。 化学式为: Co 3( 1 CO)6( 2 CO)3( 3 CO)-
*6.10 错误较多。 许多学生从化学环境上分析, 而不是根据对称性 (点群) 分析 Cis -Mo(CO) 4(P(OPh)3)2为 C 2v 点群,前一个图, 3个吸收峰 trans -Mo(CO)4[P(OPh)3]2为 D 4h 点群,对称性高, 1个吸收峰 具体推导如下:
1
A 1 (4 0 2 2) 2
4 1
A 2 (4 0 2 2) 0
4 1
B 1 (4 0 2 2) 1
4 1
B 2 (4 0 2 2) 1 2
4
(不可约) 2A 1 B 1 B 2
IR 活性
三种表示可均为 IR 活性, 3个到 4个吸收峰 同理可推出 D 4h 点群
E
2C 4 C 2
2C 2'
2C 2''
i 2S 4
h
2 v 2 d
C 2v E C 2
v
v
A 1 1 1 1 1
A 2
1 1
1
-1
B 1
1
1
1
-1
B 2
1
1
1 1 (不动 )
4 0
2
2
A 2g =0
B 1u =0
(不可约表示 ) A
1g
B
1g
E
u
A 1u =0 x,y, IR
A 2u =0
只有 E u 表示有 IR 活性
∴只有一个吸收峰
6.11 部分学生认为 1 也表示桥键。
( 1) 低温时 1H 有两种不同的化学环境(顺、反) ,被“冻结”,因此应有二
个 NMR 的信号,温度升高后,基团的转换速率加快,超过了 NMR 的时标, 因此只观察到一个峰。
( 2) 结构图:
6.12
N 2 可以有端基和侧基两种配位方式,与 CO 相同,但配位能力比 CO 弱得
多。N 2 是 CO 的等电子体,配位时提供 2 个 e ,与 CO 相同
NO ,与金属形成直线型的 M —N —O ,NO 提供 3 个电子;与金属形成弯曲
MN
型的 O ,NO 提供 1 个电子
CN 是 CO 的等电子体,配位能力很强,与 CO 不同的是 CN 主要与金属
阳离子配位,因为 CN 是带负电的阴离子。
错误较多。 CN 通常形成静电型的经典配合物
B 1g =1 B 2u =0 B 2g =0 En=1
Eg=0 cis trans
RNC ,异睛配体,类羰基配体,提供 2 个电子,可形成端基和桥基配体, RNC 比 CO 极性强,形成的 第7章
7.1 (1)CpTa(CO)4
6+4+8=18e (2)Cp 2Ru 2(CO)4
Ru -Ru
8+1+5+4=18 部分学生计算双核
的电子数为 34e ,导出单核为 17e 。
(3)PtCl 3(C 2H 4)1
16e (4)CpFe(CO)2(C 2H 4) + 18e
(5)Pt(PPh 3)2(C 2Ph 2) 16e 许多学生认为 C 2Ph 2 提供 4e 。 (6)( 4-C 7H 8)Fe(CO)3 18e
(7)(CO)5W=CMe(OMe) 18e (亚甲基化学物)
(8)Cp 2(Me)Ta=CH 2
18e (亚甲基化合物) 错误较多。 考
虑价态时出现错误。
2)( 1-C 5H 5)( 5- C 5H 5)Be 8e 和 (
1) ( 3
7.2 画结构时错误较多。 是由差别的。
CO
18e
1
-Cp 。
配键中,以 键为主 5
-C 5H 5)2Be 12e 参考 p.182
4)( 3-C 3H 5)(
5
- C 5H 5)Mo(CO) 2 18e
5)(CO)5MoCH(OH) 18e
OC OC Mo
CO H
C
OH
CO
CO
CO H
OC Mo OC
C
OH
CO
CO
类亚甲基化合
物
卡宾化合物
6) (PMe 3)(CO)3ClCrCMe
O O C
C Cr PMe 3 CMe Cl CO
类次甲基化合物或卡拜化合物 ( 1-C 5H 5)( 5
-C 5H 5)Fe(CO)2
(
3
- C 5H 5)2Fe(CO)2 (
1- C 5H 5)( 3
- C 5H 5)Fe(CO)3 (
3- C 5H 5)( 5- C 5H 5)Fe(CO) ( 3- C 5H 5)2( 1- C 5H 5)2Fe(CO) 7.5 ( 1) FeCl 2+2( 1
- C 5H 5)MgBr 7.3 Fe(C 5H 5)2(CO)n 的结构式可能为 1H 的 NMR 证明为此结构 5 ( 5-C 5H 5)2Fe+MgCl 2+MgBr 2
(2) Mo(CO) 6
E Li t (3S O iP +h B
F 34-)
(CO)5Mo= C(OEt)(SiPh 3)
(3)[Cp(CO)2Mn ≡CPh]++Cl
Cp(CO)ClMn ≡CPh + CO (p.190) 18e
(取代 ) 18e
7.6 错误较多。成键类型与配体类型混淆。如:有人将 6
-C 6H 6 和 5-C 5H 5的
成键类型写为“ 酸键”,或写成“ 配键”。
(1) Fe(CO)4(C 2H 4)
Fe -CO , σ- π配键
(2)( 6-C 6H 6)2Cr Cr 与苯环为 σ- π配键
(3)( 1-C 5H 5)( 5-C 5H 5)3Zr Zr -C( 1- C 5H 5) 键
Zr - C( 5- C 5H 5) σ- π配键 (4)Ni(CNCMe 3)2(C 2Ph 2) Ni -CNCMe 3
σ
- π配键
CPh Ni
CPh
σ -π配键 (5)(CO)5Cr=C(OMe)(Ph)
Cr -CO σ
-π配健
Cr=C 双键
具有 σ- π配健的特征
7.7 错误较多。认为 bipy ,phen 是
配体。没有认识到 N 2 既是 配体也是
酸配体。
配体
C 5H 5 ,N 2,C 6H 6, C 2H 4,C 4H 6, 给体 ( bonded )
σ-π配键 电子受体 ( bonded ) 7.9 (1)( 5- C 5H 5)Fe(CO)2 CH 3
(2)
(η5
C 5H 5)Fe(CO)
CH 15e (3)
5
(η5-C 5H 5)Co(CO)
CH 2 16e
(4
)
5 (η5
-C 5H 5)Ni CH
15e
[bipy ,phen ] 17e 酸配体 经典
配合物的
CO ,N 2,
PR 3,[bipy(弱),phen(弱)], 配体 CN 与 CH 3 等瓣相似 Fe CH 2
CH 2
5)Sn(C 2H 5)
CH 2
6e P 区第 14族元素
PR 3
Cl OC
PR 3
IrCl(CO)(PR 3)2+C 6H 5-N=C=S
IrCl(CO)(PR 3)2+CF 3CN
PR 3
Cl C CF 3
OC
N PR 3
IrCl(CO)(PR 3)2+(CF 3)2CO
7.10
(1)配位键 (2)次级键 (3)氢键
(4)
键
第8章
8.2 参考教科书 p.213-214
IrCl(CO)(PR 3)2 (16e) +H 2→
PR 3
Cl
PR 3 R 3P
CO
+ H2
Cl OC
H H
PR 3
邻位加
成
6) Co(CO) 4+
CH 2
d 16e
IrCl(CO)(PR 3)2 + CH 3I
CH 3
C 6H 5
错误较多 认为 C=N 双键打开配位
第一章 3排除下列各酸在醋酸中的酸强度次序,并指出其中那些是超酸? 4指出下列物质在液氨中的酸碱行为? 5指出在100%硫酸中的酸碱行为? 8方程式 10、什么是硬软酸原理?试从化学键角度解释这种现象。
12粗略估计下述各酸的pKa值: 第三章
28、说明无水CuSO4、Cu(H2O)62+和Cu(NH3)42+的颜色差异,并指出产生这些差异的原因 29、指出Mn(H2O)62+和Fe(H2O)63+的颜色有何特征?说明原因 30、MnO4-中Mn为d0组态,为什么他能有很深的颜色?说明颜色来源 34、CrO42-离子是d0配合物,但它能呈现颜色,1解释显色原因,2预言他的跃迁能量比 Mn4-高还是低? 第四章 6试解释二茂铁鎓离子是一种强氧化剂;二茂钴在合适的溶剂中是一中强还原剂;二茂镍易跟NO气体反应生成
O? 8举例说明什么叫做协同成键作用? 16如果钒的羰基化合物符合EAN规则,那么它的最简单化合物的分子式应该是什么?为什么它实际上又是不稳定的? 17已知Mn2(CO)10只观测到2044~1980cm-1范围内的伸缩振动带,而Co2(CO)8观察到2071~2022cm-1的振动带以及另外两个1860cm-1和1858cm-1的振动带,试画出Mn2(CO)10和Co2(CO)8的合理的结构式? 22试分析对比蔡斯盐中,乙烯与Pt2+的成键方式与金属羰基化合物中CO与金属原子的成键方式的相同与区别点。 23在乙烯中用金属锂处理Co2(CO)8时得到一个化学式为的同的红色晶体,并放出CO,该晶体的红外光谱出现3个不同的羰基伸缩振动吸收峰2080~2000,1850和1600cm-1请据此推出他的最合理的结构式。
简答題: 1. 第一过渡系元素氧化态分布有什么特点?为什么ⅦB族后的Fe元素不易达到族号氧化态? 答:氧化态分布的特征是两端少且氧化态低,中间氧化态多且高,元素呈现的氧化态与化合反应的能量及配位原子的性质有关:(1)Fe 原子虽然有8个价电子,但其要失去第七、第八个价电子时需要消耗很大的能量,虽然其形成化学键可获得一些能量,但其不能满足电离能的需要;(2)Fe的高氧化态,有很强的氧化能力,配体必须能与Fe共处。综上,Fe元素不易达到族号氧化态。 2. 钛被称作“第三金属”,请写出工业从TiO2矿抽取Ti的原理(用方程式表示)。 答:TiO2 + 2C + 2Cl2 →TiCl4 + 2CO TiCl4 + 2Mg → Ti + 2MgCl2 3. 为何氮气是反磁性物质而氧气却是顺磁性物质? 答:由分子轨道法,N2[KK(σ2s)2(σ2s*)2(π2p)4(σ2p)2], 而O2[KK(σ2s)2(σ2s*)2(σ2p)2(π2p)4(π2p*)2],N2分子中无成单电子而O2分子中两个三电子π键中各有一个成单电子,因而N2是抗磁性的,而O2是顺磁性的。 4. PF3和BF3的分子组成相似,而它们的偶极矩却明显不同,PF3(1.03D)而BF3(0.00D),为什么? 答:这是因为P与B价电子数目不同,杂化方式也不同, 因而分子结构不同所致。PF3 中P采取sp3杂化方式,分 子构型为不对称的三角锥 形,键的极性不能抵消,因 而分子有极性;而BF3中B 采取sp2杂化方式,分子为 对称的平面正三角形,键的 极性完全抵消,因而分子无 极性。 5. PF3和BF3的分子组成 相似,而它们的偶极矩却明 显不同,PF3(1.03D)而BF3 (0.00D),为什么? 答:这是因为P与B价电子 数目不同,杂化方式也不同, 因而分子结构不同所致。PF3 中P采取sp3杂化方式,分 子构型为不对称的三角锥 形,键的极性不能抵消,因 而分子有极性;而BF3中B 采取sp2杂化方式,分子为 对称的平面正三角形,键的 极性完全抵消,因而分子无 极性。 6. 热量和功是否为体系的 性质?是否为状态函数? 答:热和功都不是体系的状 态函数,而是过程函数。也 不是体系的性质,体系的性 质是描述体系的状态的物理 量,如T,V等。不能谈体系 在某种状态下具有多少功或 多少热量,它们只有在能量 变换时才会有具体的数值, 与途径有关,不同的途径, 数值不同。 7. 为何氮气是反磁性物质 而氧气却是顺磁性物质? 答:由分子轨道法,N2[KK(σ 2s)2(σ2s*)2(π2p)4(σ 2p)2],而O2[KK(σ2s)2(σ 2s*)2(σ2p)2(π2p)4(π 2p*)2],N2分子中无成单电 子而O2分子中两个三电子 π键中各有一个成单电子, 因而N2是抗磁性的,而O2 是顺磁性的。 8. 什么叫杂化?原子轨道 为什么要杂化? 答:杂化是指形成分子时, 由于原子的相互影响,若干 不同类型、能量相近的原子 轨道混合起来重新组合成一 组新轨道的过程.原子轨道 之所以杂化,是因为:(1) 通 过价电子激发和原子轨道的 杂化有可能可以形成更多的 共价键; (2)杂化轨道比未 杂化的轨道具有更强的方向 性,更利于轨道的重叠;(3) 杂化轨道的空间布局使得化 学键间排斥力更小,从而分 子构型更稳定。 9. PF3和BF3的分子组成相 似,而它们的偶极矩却明显 不同,PF3(1.03D)而BF3 (0.00D),为什么? 答:这是因为P与B价电子 数目不同,杂化方式也不同, 因而分子结构不同所致。PF3 中P采取sp3杂化方式,分 子构型为不对称的三角锥 形,键的极性不能抵消,因 而分子有极性;而BF3中B 采取sp2杂化方式,分子为 对称的平面正三角形,键的 极性完全抵消,因而分子无 极性。 选择题: 1.汞中毒的症状是 ( A )(A) 贫血 (B) 骨头畸形、压迫骨头会 引起剧痛 (C) 会诱发癌症 (D) 颤抖、呆滞、运动失调, 严重时死亡 2.在人体血液中负责输送氧 气的金属蛋白是( D ) (A) 肌红蛋白 (B) 铁贮存 蛋白 (C) 血蓝蛋白 (D) 血红蛋白 3.稀有气体中,最难被液化 的是 ( A )(A) He (B)Ne(C)Xe (D) Kr 4.下列物质中,强烈氧化性 与惰性电子对效应无关的是 ( C )(A) PbO2 (B) NaBiO3 (C) K2Cr2O7 (D) TlCl3 5. A → B + C是吸热的 可逆基元反应,正反应的活 化能为E正,逆反应的活化 能为E逆(B )(A) E正 < E逆(B) E正 > E逆 (C)E 正 = E逆 (D) 三种都可能 6.下列锕系元素是人工合成 的是 ( B )(A)Ac (B)Am (C)Th (D) U 7.维生素B12含有的金属元 素是 ( A )(A)Co (B) Fe (C) Ca (D) Mg 8.废弃的CN-溶液不能倒入 ( C )(A) 含Fe3+的 废液中 (B) 含Fe2+的废液 中 (C) 含Cu2+的酸性废液 中 (D) 含Cu2+的碱性废 液中 9. 速率常数k是一个 参数( D )(A) 无量纲 参(B) 量纲为 mol·L-1·s-1(C) 量纲为 mol2·L-1·s-1 的参数 (D) 量纲不定的参数 10.下列各元素中,电子亲 和能最高的是 ( C )(A) Cs (B) Li (C) Cl (D) F 11.最早被发现的稀有气体 元素是 ( A )(A) He (B)Ne (C)Ar (D) Kr 12.下列各元素中,第一电 离能最高的是 ( D )(A) Cs (B) Li (C) O (D) F 13. 已知某一反应 A + B →C 的E正=50kJ/mol,则该 反应的E逆为 ( D ) (A) -50KJ/mol (B) < 50KJ/mol (C) > 50KJ/mol (D) 无法确定 14.在酸性溶液中,不能稳 定存在的是 ( A ) (A) VO43- (B) CuSO4 (C) FeCl3 (D) Cr2O72- 16.Ln3+离子不易形成羰基 化合物是因为它们 ( B ) (A) 无d电子 (B) 是硬酸(C)无空d轨道 (D) 轨道对称性不匹配 17. H2O2的分解反应为: H2O2(aq) →H2O(l) + 1/2O2(g),下列表示的瞬时 速度中,正确的是 ( D ) (A) dc(H2O2)/dt (B)-dc(H2O)/dt(C)-dc(O2) /(2dt) (D) dc(O2)/(2dt) 18. 反应 X + Y → Z,其 速度方程式为:υ =k[X]2[Y]1/2,若X与Y的 浓度都增加4倍,则反应速 度将增加多少倍 ( D ) (A) 4 (B) 8 (C) 16 (D) 32 22下列元素中,电子亲和能 最高的是 ( B )(A) F (B) Cl (C) Li (D) Cs 23.在酸性溶液中,不能存 在的物种是 (A)(A)FeO42-(B)CuI
法概复习 一、法得概念与特征 概念:法就是由国家制定或认可,并由国家强制力保证实施得具有普遍效力得行为规范体系。 特征:一、法就是调整人们得行为或社会关系得规范,具有规范性。二、法就是由国家制定或认可得,体现了国家对人们行为得评价,具有国家得意志性。三、法就是由国家强制力为最后保证手段得规范体系,具有国家强制性。四、法具有普遍性。五、法就是由一定得社会物质生活条件所决定得。六、具有程序性。 二、权利与义务 概念:权利与义务就是法得最核心得内容与要素,就是贯穿于法得各个领域、各个环节、各个法律部门与法得运动过程得法律现象,就是法最基本得范畴。权利与义务代表了不同得法律精神。 权利得概念:①指公民依法应享有得权力与利益; ②就是指法律赋予人实现其利益得一种力量;③制国家通过法律规定,对法律关系主体可以自主决定作出某种行为得许可与保障手段。 权利得特征:①权利得到国家得认可与保障;②权利得行使具有自主决定性;③权利总就是与利益相联系;④权利与义务密不可分。 权利得内容:由自由权、请求权、诉权三部分构成,其中,自由权就是基础,请求权就是实体内容,诉权就是保障手段。 义务得概念:①它就是指义务人必要行为得尺度或范围;②它就是指人们必须履行一定作为或不作为得法律约束;③它就是指人们实施某种行为得必要性。 权利与义务得关系:(1)结构上得相关关系,即对立统一关系。一个表现利益,一个表现负担;一个就是主动得,一个就是受动得。(2)数量上得等值关系,一个社会得权利总量与义务总量总就是相等得。(3)功能上得互补关系,权利直接体现法律得价值目标,义务保障价值目标与权利得实现;义务有助于建立秩序,权利有助于实现自由。(4)价值意义上得主次关系,权利与义务何者为本位,在历史上就是变化着得。 三、法律关系 概念:就是法律规范在调整社会关系得过程中所形成得人们之间得权利与义务关系。 特征:(1)法律关系就是一种合法得关系;(2)法律关系就是体现意志性得特殊社会关系;既体现国家意志,也体现当事人得意志。(3)法律关系就是具体得权利与义务关系。 法律关系得构成:(1)主体,即权利得享有者与义务得承担者,包括公民、法人与非法人单位、国家。(2)内容,即法律关系主体之间得具体得权利与义务。法律上得规定只就是“应有得”、“一般性”得规定,通过特定主体体现为具体得“实有得”、“个别化”得权利与义务。(3)客体,就是指法律关系主体之间权利与义务所指向得对象,主要包括物、人身、精神产品、行为结果。 四、法律责任 概念:就是指人们对自己得违法行为所应承担得带有强制性得否定性法律后果。(否定性法律后果,即法律上不予承认,加以撤销以至制裁。) 种类:①过错责任、无过错责任、公平责任;②违宪责任、刑事责任、民事责任、行政责任。 归责原则:①因果联系原则;②责任法定原则;③公正原则; ④合理性原则。 五、宪法得概念与特征 概念:就是规定国家根本制度与根本任务、集中表现各种政治力量对比关系、保障公民权利得国家根本法。(p,25) 特征:1)宪法就是国家得根本法;2)宪法就是公民权利得保障书;3)宪法就是各种政治力量对比关系得集中表现;4)宪法就是民主事实法律化得基本形式;5)宪法规范具有根本性、原则性、纲领性、稳定性。 六、正当防卫 概念:指为了使公共利益、本人或者她人得人身与其她权利免受正在进行得不法侵害,而对实施侵害得人所采取得必要得防卫行为。 成立条件:5个(1)发生不法侵害行为;(2)不法行为正在进行;(3)为保护合法权益;(4)针对侵害者本人实施;(5)不能超过必要限度。
法概复习 一、法的概念与特征 概念:法是由国家制定或认可,并由国家强制力保证实施的具有普遍效力的行为规范体系。 特征:一、法是调整人们的行为或社会关系的规范,具有规范性。二、法是由国家制定或认可的,体现了国家对人们行为的评价,具有国家的意志性。三、法是由国家强制力为最后保证手段的规范体系,具有国家强制性。四、法具有普遍性。五、法是由一定的社会物质生活条件所决定的。六、具有程序性。 二、权利与义务 概念:权利和义务是法的最核心的内容和要素,是贯穿于法的各个领域、各个环节、各个法律部门和法的运动过程的法律现象,是法最基本的范畴。权利和义务代表了不同的法律精神。 权利的概念:①指公民依法应享有的权力和利益;②是指法律赋予人实现其利益的一种力量;③制国家通过法律规定,对法律关系主体可以自主决定作出某种行为的许可和保障手段。 权利的特征:①权利得到国家的认可和保障;②权利的行使具有自主决定性;③权利总是与利益相联系;④权利与义务密不可分。 权利的内容:由自由权、请求权、诉权三部分构成,其中,自由权是基础,请求权是实体内容,诉权是保障手段。 义务的概念:①它是指义务人必要行为的尺度或范围;②它是指人们必须履行一定作为或不作为的法律约束;③它是指人们实施某种行为的必要性。 权利和义务的关系:(1)结构上的相关关系,即对立统一关系。一个表现利益,一个表现负担;一个是主动的,一个是受动的。(2)数量上的等值关系,一个社会的权利总量和义务总量总是相等的。(3)功能上的互补关系,权利直接体现法律的价值目标,义务保障价值目标和权利的实现;义务有助于建立秩序,权利有助于实现自由。(4)价值意义上的主次关系,权利和义务何者为本位,在历史上是变化着的。 三、法律关系 概念:是法律规范在调整社会关系的过程中所形成的人们之间的权利和义务关系。 特征:(1)法律关系是一种合法的关系;(2)法律关系是体现意志性的特殊社会关系;既体现国家意志,也体现当事人的意志。(3)法律关系是具体的权利和义务关系。 法律关系的构成:(1)主体,即权利的享有者和义务的承担者,包括公民、法人和非法人单位、国家。(2)内容,即法律关系主体之间的具体的权利和义务。法律上的规定只是“应有的”、“一般性”的规定,通过特定主体体现为具体的“实有的”、“个别化”的权利和义务。(3)客体,是指法律关系主体之间权利和义务所指向的对象,主要包括物、人身、精神产品、行为结果。 四、法律责任 概念:是指人们对自己的违法行为所应承担的带有强制性的否定性法律后果。(否定性法律后果,即法律上不予承认,加以撤销以至制裁。) 种类:①过错责任、无过错责任、公平责任;②违宪责任、刑事责任、民事责任、行政责任。 归责原则:①因果联系原则;②责任法定原则;③公正原则;④合理性原则。 五、宪法的概念与特征 概念:是规定国家根本制度和根本任务、集中表现各种政治力量对比关系、保障公民权利的国家根本法。(p,25)特征:1)宪法是国家的根本法;2)宪法是公民权利的保障书;3)宪法是各种政治力量对比关系的集中表现;4)宪法是民主事实法律化的基本形式;5)宪法规范具有根本性、原则性、纲领性、稳定性。 六、正当防卫 概念:指为了使公共利益、本人或者他人的人身和其他权利免受正在进行的不法侵害,而对实施侵害的人所采取的必要的防卫行为。 成立条件:5个(1)发生不法侵害行为;(2)不法行为正在进行;(3)为保护合法权益;(4)针对侵害者本人实施;
西北大学化学系2003~2004学年度第二学期 《中级无机化学》试题及答案 一 按要求回答下列各题(6×5) 1 (1) 确定化合物B 10CPH 11的构型并予以命名; (2) 利用三中心两电子键理论判断B n H n 2-阴离子多面体结构中所包含的化学键的类型和数目。 解:(1) B 10CPH 11,写作(CH)(BH)10P ,a =1,q =0,c =0,p =10,一个P 原子, n =a +p +(P 原子数)=1+10+1=12,b =(3×1+2×10+ 3)/2=13=12+1, 属闭式结构 命名:闭式-一碳一磷癸硼烷(11)或闭式-一碳一磷代十二硼烷(11) (2) B n H n +2-22-,c=2,m =2,n =n ,写出拓扑方程并求解 n -2=s +t m -2=2-2=0=s +x n -m/2+c =n -2/2+2=n +1=x +y B -B 键的数目:3, 三中心两电子硼桥键的数目:n -2; 2 假定LiH 是一个离子化合物,使用适当的能量循环,导出H 的电子亲合焓的表达式。 解: △Lat H m θ(LiH, s) △EA H m θ(H)=(△atm H m θ+△I 1H m θ)Li +△f H m θ(H)-△f H m θ(LiH ,s)-△Lat H m θ(LiH, s) 3 应用Pauling 规则, (1) 判断H 3PO 4(pK a =2.12)、H 3PO 3(pK a =1.80)和H 3PO 2(pK a =2.0)的结构; (2) 粗略估计H 3PO 4、H 2PO 4-和HPO 42-的pK a 值。 解:(1) 根据pK a 值判断,应有相同非羟基氧原子。 H 3PO 4: H 3PO 3: H 3PO 2: (2) H 3PO 4:一个非羟基氧原子,pK a 值约为2;H 2PO 4-:pK a 值增加5,约为7;HPO 42 -pK a 约为12。 4 用VSEPR 理论预言下列分子或离子的结构,并写出它们所属的点群: f m θ P H HO HO P OH HO HO P H HO H
法学概论考试重点 1、法的基本特征14 法的基本特征是法所独具的并以此区别于其他上层建筑现象的种种重要属性。 ①法是一种行为规,具有规性。它向人们提供的行为模式具有一般性的特征,即在相同的条件下,一项法的规可以被反复适用;其还具有可预测性,法的这种属性使得人们在社会生活中就会有意识地去做或不做一定的行为。 ②法由国家制定或认可。在众多的行为规中,只有法是由国家制定或认可的。制定和认可是统治阶级意志上升为国家意志即国家创制法的两种方式。 ③法以国家强制力保证其实施并具有普遍的约束力。 ④法规定人们的权利和义务。 2、法的渊源即法的表现形式17 作为行为规的法,必须由特定的国家机关通过一定的形式表现出来,才能为人们知晓、遵守,也才具有法律上的效力。这种用以表现法的规的各种具体形式,法学上称为法的渊源或法的形式。 从历史上看,法的渊源是多种多样的,基本上可以分为两大类:一类是国家机关制定的各种规性文件,另一类是国家认可的不具备文字形式的习惯。 ①规性文件是指国家机关在其权限围按照法定程序制定和颁布的具有普遍约束力的行为规的文件,亦即通常所说的成文法或制定法。 ②国家认可的不具备文字形式的习惯,即通常所说的习惯法或不成文法。判例也是一种不成文法。 除上述基本形式外,在奴隶社会和封建社会里,某些思想家、法学家的著作或的经典,都可以成为法的渊源。 3、法系18 一般认为,凡是在容上和形式上具有某些共同特征,形成一种传统或派系的各国法律,就属于同一个法系。 西方法学家在法系的划分上也很不一致,但不少法学著作在论述法系问题时,多举英国法系、大陆法系、中国法系、印度法系、伊斯兰法系五大法系。这五大法系除大陆法系和英国法系外,其余的基本上已经成为法制史上的概念。 大陆法系是指欧洲大陆上源于罗马法、以1804年《法国民法典》为代表的各国法律,所以大陆法系也称罗马法系或民法法系。英国法系是指中世纪以来的英国法律和效仿英国法
中级无机化学习题 第二章 对称性与群论基础 1、利用Td 点群特征标表(右表)回答下列问题 (1)、群阶,对称操作类数,不可约表示数 (2)、SO 42-离子中S 原子3p x 轨道及3d xy 轨道所属的不可约表示 (3)、可约表示Г(10,-2,2,0,0)中包括了 哪些不可约表示?SO 42-离子是否表现为红外活性?SO 42-离子是否表现为拉曼活性的? 解:(1)点群的阶h=8;对称操作类=5;不可约表示数=5 (2)S 原子的P X 轨道所属不可约表示为T 2表示。 (3)()01231)2(811018 1 11=??+?-?+??=?Γ?=∑i A g h a χ;同理 02 =A a ;11=T a ;12=T a ;2=E a ;故可约表示E T T 221)0,0,2,2,10(⊕⊕=Γ- 因T 2表示中包含(x,y,z )和 (xy,xz,yz),故既表现为红外活性又表现为拉曼活性。 2 (1)、点群的阶,对称操作类数,不可约表示数 (2)、NH 3分子中偶极矩所属的不可约表示 (3)可约表示Г(6,0,2)中包括了哪些不可约表示? 解:(1)点群的阶h=6; 对称操作类=3;不可约表示数=3 (2)NH 3分子中偶极矩所属不可约表示为A 1表示 (3)()21231021616 1 11=??+??+??=?Γ?= ∑i A g h a χ;同理 02=A a , 2=E a ; 故可约表示E A 221)2,0,6(⊕=Γ 3 (1)、点群的阶,对称操作类数,不可约表示数 (2)、SF 5Cl 分子中S 原子Px 轨道所属的不可约表示 (3)、可约表示Г(4,0,0,-2,0)中包括了哪些不可约表示?
[0049]《中级无机化学》网上作业题答案 第一批次 [单选题]Fe3+与F-、Cl-、Br-、I-形成配合物,其稳定性最大的是()。 A:Fe3+与F-形成配合物 B:Fe3+与Cl-形成配合物 C: Fe3+与Br-形成配合物 D:Fe3+与I-形成配合物 参考答案:A [多选题]实验室配制SnCl2溶液时,必须在少量盐酸中配制(而后稀释至所需浓度),才能得到澄清溶液,这是由于() A:形成缓冲溶液 B:盐效应促使SnCl2溶解 C:同离子效应 D:阻止SnCl2水解 参考答案:CD [单选题]硼酸H3BO3是一种()。 A:一元中强酸 B:一元弱酸 C:三元弱酸 D:三元中强酸 参考答案:B [单选题]HF、HCl、HBr、HI的酸性最强的为()。 A:HF B:HCl C:HBr D:HI
参考答案:D [单选题]以HF为溶剂,醋酸为()。 A:酸 B:碱 C:盐 参考答案:B [单选题]在水中TlBr的溶解度比TlBr3的溶解度()。 A:大 B:小 C:相等 参考答案:B [单选题]LiF、LiCl、LiBr、LiI在水中溶解度最大的为()。A:LiF B:LiCl C:LiBr D:Lii 参考答案:D [单选题]HCO3-的共轭碱为()。 A:CO32- B:H2CO3 C:没有共轭碱 参考答案:A [单选题]H2PO4-的共轭酸为()。 A:HPO42- B:H3PO4 C:PO43-
参考答案:B [论述题]解释CF3COOH的酸性比CH3COOH的酸性强. 参考答案:是因为F是电负性最高的元素,F原子的极强的吸电子能力以及羰基的诱导作用,使CF3COOH分子中羰基O原子的正电性增强,从而对H原子的吸引减弱而使其易于解离。当H原子解离后,生成的阴离子CF3COO?中形成离域∏34,大大增加了该阴离子的稳定性。因此CF3COOH具有很强的酸性。 [填空题] 判断相对Lewis碱性(1) (H3Si)2O和(H3C)2O;其中较强的是。 参考答案:(H3C)2O 第二批次 [单选题][Co(NH3)4Cl2]+有( ) 种几何异构体。 A:2 B:3 C:4 D:5 E:6 参考答案:A [填空题]配合物[Co(NH3)5Br]SO4中中心原子Co的配位数是()。 参考答案:6 [多选题]采用下列杂化能形成外轨型配合物的有()。 A:sp3d2 B:sp3 C:d2sp3 D:d4sp3 参考答案:AB [单选题][ZnCl4]2-为()构型,[PtCl4]2-为()构型。 A:平面正方形, 平面正方形 B:正四面体, 正四面体 C:正四面体, 平面正方形 D:平面正方形,正四面体
无机化学习题参考答案(II) 第一章 1.4.解: (1)H 2O 2 2C (2)S 2O 32 3v C (3)N 2O (N N O 方式) v C ∞ (4)Hg 2Cl 2 h D ∞ (5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4 d T (8)SClF 5 4v C (9)反-Pt(NH 3)2Cl 2 2h D (10)PtCl 3(C 2H 4) 2v C 1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么? 一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。 (BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃) 2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。 P F F H 3C CH 3 N P F F H 3C CH 3 N B B H 3F 3 (该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容) 3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和(6配位),失去Lewis 酸性 4. 吸水后失效 的AlCl 3有什么方法可以脱水? 因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。(只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用还原氯化法制备,这就不是脱水方法了)。 第二章
中级无机化学复习题 1.为什么第二周期与第三周期同族元素性质存在明显差异? 2.为什么在矿物中Mg、Ca、Sr、Ba等金属离子以氧化物、氟化物、碳酸盐和硫酸盐等形式存在?Cu、Ag、Pb、Zn、Hg则以硫化物形式存在? 3.通过计算说明钾原子最后一个电子填充在4s 轨道上。 4.比较Lewis碱强度:NH3NF3NCl3NBr3 比较Lewis酸强度:BBr3BCl3BF3 5.完成下列化学反应: CO(NH2)2+H2SO4→ HNO3 +HF → H-+NH3 → 6.由于形成水合物必须放热,试分析M c X a(s)在298K时形成四水合物至少放热多少?(假定正、负离子在无水盐和含水盐中对摩尔熵的加和贡献相等。 已知每mol晶格水对水合物的摩尔熵的独立加和贡献约为39 J·K-1·mol-1,S mθ(H2O,l)=69.91 J·K-1·mol-1) 7.试通过估算Xe[PtF6]的反应焓变来说明由Xe(g)和PtF6(g)可以制备Xe[PtF6]。 (已知:PtF6-的半径为310 pm,Xe+半径为180 pm;Xe(g) 的第一电离能I1=1170 kJ mol-1,PtF6(g)的电子亲合能-771 kJ mol-1) 8.利用HSAB理论判断下列反应进行的方向,并说明理由。 HgF2 + BeI2= BeF2 + HgI2 Ag+ + HI = AgI + H+ 9.下图为自由能-温度图,回答下面问题: (1)为什么CO2线几乎与温度坐标轴平行,而CO线是一条向下的斜线? (2)已知CO2线有△Gθ=-393.5-3.3×10-3T,CO线有△
G θ=-221-0.18T ,求二线交点温度。 (3) 分别写出当温度低于和高于交点温度时,用碳还原金属氧化物MO 时的反应方程式? (4)为什么可以采用加热的方法制备Ag? 10.通过设计热力学循环计算CrCl 的生成焓,并讨论其能否稳定存在?(已知Cr +的半径估计约为100 pm, r (Cl -)=181 pm ,Cr 的升华焓和电离能 分别为397和653 kJ mol -1,Cl 2的离解能为243.4 kJ mol -1, Cl 的电子亲合能为 368.5 kJ mol -1) 。11. 已知酸性介质中下面两个元素的元素电势图: 请回答下列问题: 1) 计算:φo (IO 3-/I -)=? φo (IO 3-/HIO)=? 2) 指出电势图中哪些物质能发生歧化反应; 3) 在酸性介质中H 2O 2与HIO 3能否反应; 4) 在酸性介质中I 2与H 2O 2能否反应;5) 综合3)、4)两个反应,HIO 3与H 2O 2反应最终结果是什么?用反应式说明. 12. 利用价层电子对互斥理论完成下列问题 1)判断ClF 3、IF 5分子结构,画出分子构型图,说出构型名称。 IO 3- HIO I 2 I - 1.1951.450.535O 2 H 2O 2 H 2O 1.770.68
法学概论重点章节资料整理 第一章 一、法律产生的决定性因素: 1.商品交换和私有制的出现。 2.奴隶制的出现。 二、法律产生的一般规律性: 1.法律与国家同时产生 2.由习惯到习惯法,再由习惯法到制定法 3.不断地从个别调整上升为一般调整 4.从权利、义务的合一到权利、义务的严格分开 5.从法律与、道德的浑然一体到法律取得相对独立的地位 三、法律的本质与特征:L 1.本质:①法律的阶级性(法律的本质属性是它所体现的阶级意志性) ②法律的社会性 ③法律的本质是阶级性和社会性的统一 2.法律的特征: ①法律是调整人们行为的一种行为规。 ②法律是由国家制定或认可的规。 ③法律是以国家强制力保证实施的规。 ④法律是规定权力义务的规。 ⑤法律是对社会具有普遍约束力的规。
没找到四、法律的渊源和分类 1.法律的渊源:作为一个专门的术语,就是指用以表现法律的各种具体形式。2.法律渊源的种类:制定法 判例法 习惯法 引证法 法 国际惯例和国际条约 3.法律的分类: ①按创制方式和表现形式分为:成文法和不成文法 ②根据法的容、效力和制定程序分为:根本法和普通法 ③根据法的容分为:实体法和程序法 ④根据法的空间效力、时间效力或对人的效力分为:一般法和特别法 ⑤根据法律的主体、调整对象和渊源分为:国际法和国法 ⑥以法律运用的目的:公法和私法 ⑦法系 五、法律与其他其他社会现象的关系: 1.法律与社会经济基础 ①经济基础决定法律 ②法律反作用于经济基础 2.法律和政治
①政策是法律的指导 ②法律是政策的定型化、具体化、条文化。 3.法律和道德 ①联系:a法律积极保护统治阶级道德,在必要时把某些道德规提升为法律规加以推行。 b统治阶级道德又积极替法律辩护,影响社会舆论,要求人们遵守法律。 ②区别:a存在时间不同 b调整的围不同sdq c实施方法不同 d表现形式不同 e法律体系只有一个,即一元,而道德体系则是多元的。 第二章(我国社会主义法律的产生、本质、制定和实施) 一、我国社会主义法律的产生 二、1.没找到产生的历史必然性:①是社会主义经济的需要 ②社会主义国家政权的需要 ③社会主义意识形态的需要 2.产生的一般规律:彻底废除旧法律,批判继承 3.产生的特点:在彻底废除国民党旧法律的基础上,由新主义法律转变来的,是新主义法律的继承和发展。 二、我国社会主义法律的本质和主要特点: 1.我国社会主义法律是工人阶级和广大人民意志的表现 2.重要特点:阶级性和人民性的统一 3.另一重要特点:国家强制性和人民自觉遵守法律相统一(也是区别于剥削阶级法律的另一重要
无机化学习题参考答案 第一章 1.4.解: (1)H 2O 2 2C (2)S 2O 32- 3v C (3)N 2O (N -N -O 方式) v C ∞ (4)Hg 2Cl 2 h D ∞ (5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4- d T (8)SClF 5 4v C (9)反-Pt(NH 3)2Cl 2 2h D (10)PtCl 3(C 2H 4)- 2v C 1.B(CH 3)3和BCl 3相比,哪一个的Lewis 酸性强,为什么? 一般来说,CH 3为推电子基团,Cl 为吸电子基团,因此的Lewis 酸性强。 (BCl 3易水解;B(CH 3)3不溶于水,在空气中易燃) 2.BH 3和BF 3都可和(CH 3)2NPF 2生成加合物,在一种加合物中,B 原子和N 相连,另一种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。 P F F H 3CH 3 P F F H 3CH B B H 3F 3 (该题可参考史启桢等翻译的"无机化学",作者Shriver 等,由高教社出版, 其中关于热力学酸度参数的部分,p.190-191; 或者该书的英文原版第5章的相关内容) 3. 无水AlCl 3可作为傅-克烷基化反应的催化剂, 而吸水后则失效, 原因何在? 配位饱和(6配位),失去Lewis 酸性 4. 吸水后失效 的AlCl 3有什么方法可以脱水? 因为Al 3+是典型的硬酸,与氧的亲合力很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等气氛下加热脱水。(只能加强热生成 Al 2O 3后,用高温下用加C 和Cl 2用还原氯化法制备,这就不是脱水方法了)。
P12:法律产生的一般规律性 1、法律和国家同时产生 2、由习惯到习惯法,再由习惯法到制定 法 3、不断地从个别调整上升为一般调整 4、从权利、义务的合一到权利、义务的 严格区分 5、从法律与宗教、道德的浑然一体到法 律取得相对独立的地位 P15:奴隶制法律的本质及特点 1、严格保卫奴隶主阶级生产资料私有制 2、公开确认自由民之间不平等 3、以十分残酷的惩罚措施维护奴隶主的 政治统治 4、保留了许多原始社会规范的痕迹 最早一批奴隶制成文法: 公元前18世纪巴比伦王国《汉穆拉比法典》;公元前5世纪罗马国《十二表法》;公元前3世纪印度《摩奴法典》。中国公元前21世纪的夏朝“作禹刑”“夏刑三千”殷商“汤刑”,周朝“周礼” P17:封建制法律的本质及特点: 1、严格维护封建土地所有制和农民对封 建主的人身依附关系 2、公开规定封建等级特权 3、用野蛮残酷的手段镇压人民的反抗 P19:资产阶级法律的本质及特点: 1、宣布私有财产神圣不可侵犯 2、确认契约自由 3、规定法律面前人人平等 4、确认法制原则 P21:法律的阶级性 1、法律的本质属性是它所体现的阶级意 志性。 2、法律所体现的统治阶级意志是统治阶 级的整体意志即共同意志。 3、通过法律形式获得集中表达的统治阶 级意志就是国家意志。 4、任何意志包括国家意志都表现着人的 愿望和追求,因而都具有能动的、自 由的属性。 P26:法律的特征: 1、法律是调整人们行为的一种行为规范 2、法律是由国家制定或认可的规范 3、法律是以国家强制力保证实施的规范 4、法律是规定权利义务的规范 5、法律是对社会具有普遍约束力的规范P29:法律:由国家制定或认可,体现由特定物质 生活条件决定的统治阶级意志和社会 共同生活的需要,以权利义务为其内 容,并以国家强制力保证其实现的一种 行为规范。 法律价值的特点: 1、法律的属性和功能是法律价值形成的 基础 2、人对法律的需要的法律价值形成的主 体要素 3、法律的属性和功能与人的需要的满足 之间的桥梁是实践,惟有经过实践, 法律价值才可能体现和实现。 P32:法律的各要素及内容 三要素构成:法律规范、法律原则和法律概念 1、法律规范:法律规则,是每个单一的 法定行为模式。 法律规范的结构:适用条件、行为准 则、法律后果 法律规范分类:规范本身的性质分类 (禁止性规范、义务性规范、授权性 规范) 规范所包含的行为规则的确定程序 (确定性规范、委任性规范、准用性 规范) 2、法律原则:在一定层次的法律体系中, 对法律规范具有指导意义且比较稳定 的法律原理和准则。 分类: 以法律体系层次的级别为标准:基 本原则、具体原则 以法律原则的渊源为标准:公理性 原则、政策性原则 以涉及的内容为标准:社会原则、 专门法律原则 3、法律概念:同法律相关的各种事实加 以概括而抽象出其共同特征所形成的 具有权威性的法律用语 法律概念的功能:认知功能、构成功 能、规范功能。 P37:法律渊源的种类: 1、制定法:国家的有权机关,通过法定 程序,用成文的形式(条文)表达的 规范性文件。 2、判例法:以特定的法院所作的典型或 具有新意的判决中包含的原则作为判 案依据的法律。 3、习惯法:国家认可并赋予法律效力的 习俗和惯例。 4、引证法:(法理法或法理)国家机关(主 要的司法机关)引用某些经典或法学 家的著作和言论作为处理事件或案件 的法律根据。 5、宗教法:国家宣布或承认某些宗教典 籍和教会规章具有法律效力。 6、国际惯例和国际条约 P38:法律的分类: 1、成文法和不成文法:根据法律的创制 方式和表现形式所作的分类。 2、根本法和普通法:根据法的内容、效 力和制定程序所作的分类。 3、实体法和程序法:根据法的内容所作 的分类。 4、一般法和特别法:根据法律的空间效 力、时间效力或对人的效力所作的分 类。 5、国际法和国内法:根据法律的主体、 调整的对象主要是国家间的相互关 系。 6、公法和私法:以保护公共利益为目的 的法律为公法,以保护私人利益为目 的的法律为私法。(始于罗马法学家) 7、法系:西文法学著作中一个常见的概 念。 P44:法律和道德的关系 法律和统治阶级道德之间在根本的社 会阶级属性方面的一致性,决定了二者必然 是互相配合、互相补充和互相参透的。 一方面,法律积极保护统治阶级道德, 在必要时把某些道德规范提升法律规范加 以推行。 另一方面,统治阶级道德又各级地替法 律辩护,影响社会舆论,要求人们遵守法律。 其实,法律的每一项规定都渗透着统治 阶级的道德观念。 不同点: 1、存在的时间不同:法律只是阶级社会 中的现象;道德则与人类社会相伴始 终。 2、调整的范围不同:道德的调整范围比 法律宽。 3、实施方法不同:法律借助国家强制力; 道德依靠人们内心信念。 4、表现形式不同:法律是国家规范性文 件的形式;道德则存在于人们的观念 和风俗之中。 5、在一国之中,法律体系只有一个(一 元)而道德体系则是多元。 P45:社会主义法律产生的历史必然性 1、创立社会主义法律是社会主义经济的 需要 2、创立社会主义法律是社会主义国家政 权的需要 3、创立社会主义法律是社会主义意识形 态的需要 P49:我国社会主义法律体系产生的特点:它是在 彻底废除国民党旧法律的基础上,由新民主 主义法律转变来的,是新民主主义法律的继 承和发展。 我国社会主义法律的本质和主要特点: 我国是人民民主专政的社会主义国 家。人民民主专政实质上就是无产阶级专 政。人民民主专政的基础是工人阶级和农 民阶级的联盟。我国社会主义法律是工人 阶级和广大人民意志的表现。 特点: 1、阶级性和人民性的统一 2、国家强制性和人民自觉遵守法律相统 一 P51共产党的政策:党组织为了完成一定历史时期 的任务而制定的活动准则。 党的政策与社会主义法律的关系问题: 1、党的政策指导社会主义法律的制定和 实施 2、社会主义法律是实现党的政策的重要 手段 1)则于法律是党的政策定型化、条 文化,明确、具体地规定了人们 的权利和义务 2)由于法律是一种国家意志,具有 普遍约速力 3)由于法律具有国家强制力的属 性 3、党的政策不能代替社会主义法律(区 别) 1)党的政策工人阶级先锋队意志 体现,法律是国家意志(全体人 民的体现) 2)党的政策由党组织制定;法律由 国家制定 3)党的政策一般是号召性的原则 的指导;法律的规定比较准确和 详尽。 4)党的政策不具有国家强制性 5)党的政策内容广泛,不是所有内 容都要制定成法律。 P53:我国社会主义法律和社会主义道德的关系 社会主义法律和社会主义道德都是社 会主义经济基础的上层建筑。 社会主义法律源源不断地从社会主义 道德那里吸取内容,使之上升为法律规范; 反过来,又借助法律规范来维护和传播社会 义道德。 由于社会主义法律和社会主义道德在 调整的连范围和实施的手段等方面有很大 的区别,因此二者又不能互相代替。 P54:规律:(法则)是事物发展过程中的本质联系 和必趋势。
法学概论考试重点 1、法的基本特征 14 法的基本特征是法所独具的并以此区别于其他上层建筑现象的种种重要属性。 ①法是一种行为规范,具有规范性。它向人们提供的行为模式具有一般性的特征,即在相同的条件下,一项法的规范可以被反复适用;其还具有可预测性,法的这种属性使得人们在社会生活中就会有意识地去做或不做一定的行为。 ②法由国家制定或认可。在众多的行为规范中,只有法是由国家制定或认可的。制定和认可是统治阶级意志上升为国家意志即国家创制法的两种方式。 ③法以国家强制力保证其实施并具有普遍的约束力。 ④法规定人们的权利和义务。 2、法的渊源即法的表现形式 17 作为行为规范的法,必须由特定的国家机关通过一定的形式表现出来,才能为人们知晓、遵守,也才具有法律上的效力。这种用以表现法的规范的各种具体形式,法学上称为法的渊源或法的形式。 从历史上看,法的渊源是多种多样的,基本上可以分为两大类:一类是国家机关制定的各种规范性文件,另一类是国家认可的不具备文字形式的习惯。 ①规范性文件是指国家机关在其权限范围内按照法定程序制定和颁布的具有普遍约束力的行为规范的文件,亦即通常所说的成文法或制定法。 ②国家认可的不具备文字形式的习惯,即通常所说的习惯法或不成文法。判例也是一种不成文法。 除上述基本形式外,在奴隶社会和封建社会里,某些思想家、法学家的著作或宗教的经典,都可以成为法的渊源。 3、法系 18 一般认为,凡是在内容上和形式上具有某些共同特征,形成一种传统或派系的各国法律,就属于同一个法系。 西方法学家在法系的划分上也很不一致,但不少法学著作在论述法系问题时,多举英国法系、大陆法系、中国法系、印度法系、伊斯兰法系五大法系。这五大法系除大陆法系和英国法系外,其余的基本上已经成为法制史上的概念。 大陆法系是指欧洲大陆上源于罗马法、以1804年《法国民法典》为代表的各国法律,所以大陆法系也称罗马法系或民法法系。英国法系是指中世纪以来的英国法律和效仿英国法
?9ゴд乬 1??? ???? ? ?? FAN ? ? ??(1) V(CO)6 V ?5?6CO ?12? 17??? (2) W(CO)6 W ?6?6CO ?12? 18?? (3) Ru(CO)4H Ru ˇ?7?4CO ?8?H ˉ?2? 17??? (4) Ir(CO)(PPh 3)2Cl Ir ˇ?8?CO ?2?2PPh 3?4?Cl ˉ?2? 16?? (5) Ni(?5-C 5H 5)(NO) Ni ˇ?9?C 5H 5ˉ?6?NO ?3? 18?? (6) PtCl 3(?2-C 2H 4)ˉ Pt 2ˇ?8?3Cl ˉ?6?C 2H 4?2? 16?? 2? ? ?Ё ? M ˙M ????М? ??(1) Fe 3(CO)123h 8 (Fe)ˇ12h 2 (CO)˙48 (3h 18ˉ48)/2˙3? ? ?? ??Fe ???Fe ?? ?? ? M ˙M ??(2) H ˇ2[Os 3(CO)10]2ˉ3h 8 (Os)ˇ10h 2 (CO)ˇ2(???)˙46 (3h 18ˉ46)/2˙4? ?? ??Os ???Os ?? ?? ? ? M ˙M ?? (3) H ˇ4[Re 4(CO)12]4ˉ4h 7 (Re)ˇ12h 2 (CO) ˇ4(???)˙56 (4h 18ˉ56)/2˙8? ?? ?Re ? ?Re ?? ?? ? ? M ˙M ?? (4) [Re 4(CO)16]2ˉ4h 7 (Re)ˇ16h 2 (CO)ˇ2(???)˙62 (4h 18ˉ62)/2˙5 ? ?? ?Re ? ?Re ? ?? ? M ˙M ?? 3 [HFe 4(CO)13]ˉ H 3Os 4(CO)12I ??? ?? ? П? ?? ? ?? ? 4? ? ?Ё?CO ? ??? ?? ?М?В?? ? ?? ? ? ?Ё?CO ? ? ?????? ? ッ ??? ? ? ??? ? ??? 5??[Re 2Cl 8]2ˉ ? ????? ? ???М ? ?? ?? ? к9.7.1??? ˉ? ??Ё [Re 2Cl 8]2ˉЁ?? ?? ?? 6 ㄨ? ?乬: (1)??М? ?Ё?? ? ? ??( Fe(CO)5) ? ??( [Co(CO)4]ˉ)?(a)[HFe 4(CO)13]ˉ(H ? ) (b)H 3Os 4(CO)12I ?? C O M M (a)(b)(c)(d)(e) CO ? ? ??? (a) ッ ?? (b) ?? ?? (c) ? ??(d)?? ??(e)? ??