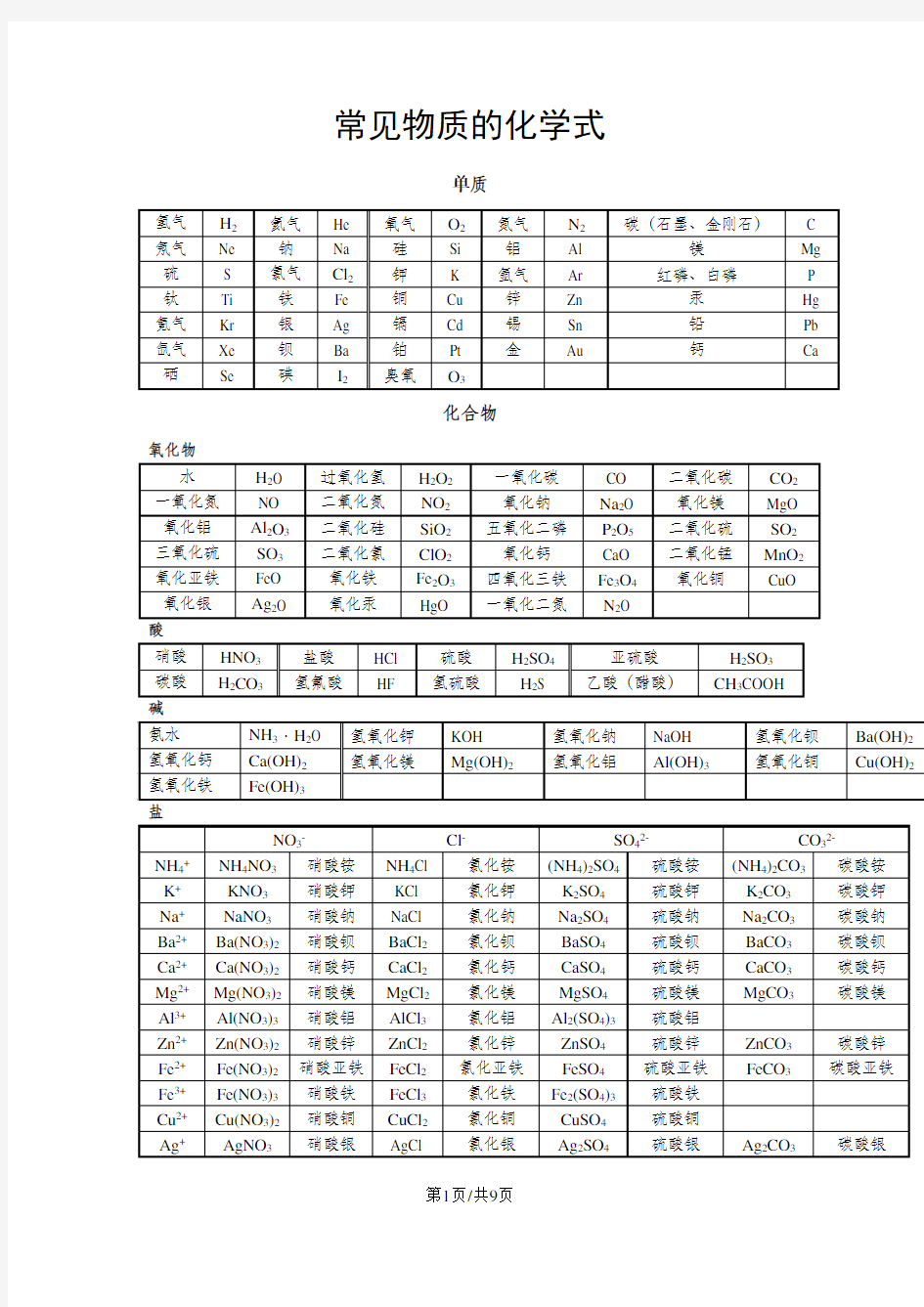

常见物质的化学式
单质
化合物
氧化物
高锰酸钾KMnO4氯酸钾KClO3锰酸钾K2MnO4
碳酸氢钙Ca(HCO3)2硫酸铜晶体CuSO4·5H2O 碳酸钠晶体Na2CO3·10H2O
碳酸氢铵NH4HCO3磷酸钙Ca3(PO4)2磷酸二氢钙Ca(H2PO4)2
碳酸氢钠NaHCO3亚硝酸钠NaNO2磷酸二氢铵NH4H2PO4
磷酸氢二铵(NH4)2HPO4羟基磷酸钙Ca10(PO4)6(OH)2
有机物
甲烷CH4乙醇(酒精)C2H5OH 乙酸(醋酸)CH3COOH 淀粉(C6H10O5)n 葡萄糖C6H12O6蔗糖C12H22O11尿素CO(NH2)2
3
常见物质的俗名
名称俗名化学式名称俗名化学式
碳酸钠苏打、纯碱Na2CO3氧化钙生石灰CaO
碳酸钠晶体天然碱、石碱、口碱Na2CO3·10H2O 固体二氧化碳干冰CO2
碳酸氢钠小苏打NaHCO 一氧化碳和氢气水煤气CO和H2
氢氧化钠烧碱、火碱、苛性钠NaOH 硫酸铜晶体胆矾、蓝矾CuSO4·5H2O 氢氧化钙熟石灰Ca(OH)2甲烷沼气CH4
常见的化学方程式
说明:用楷体标示的内容不是重点。
化合反应
红磷在空气中燃烧,产生白烟:4P+5O22P2O5
●
●白磷自燃:4P+5O2=2P2O5
●木炭充分燃烧:C+O2CO2
●木炭不充分燃烧:2C+O22CO
●硫在空气(氧气)中燃烧:S+O2SO2
●铁丝在氧气中燃烧:3Fe+2O2Fe3O4
铝在氧气中燃烧:4Al+3O22Al2O3
●
●铝不易生锈的原因:4Al+3O2=2Al2O3
●镁在空气中燃烧:2Mg+O22MgO
●铜在空气中加热:2Cu+O22CuO
●氢气在氧气中燃烧:2H2+O22H2O
●将CO2变成CO:C+CO22CO
●二氧化碳溶于水形成碳酸:CO2+H2O=H2CO3
●用生石灰制取熟石灰:CaO+H2O=Ca(OH)2
●一氧化碳燃烧:2CO+O22CO2
●向澄清的石灰水中通入过量的二氧化碳,变浑浊的石灰水又变澄清:
CaCO3+CO2+H2O=Ca(HCO3)2
●氢气在氯气中燃烧:H2+Cl22HCl
●钠在氯气中燃烧:2Na+Cl22NaCl
●镁在氮气中燃烧:3Mg+N2Mg3N2(注意氮元素的化合价)
●上面三个化学方程式给我们的启示是:燃烧不一定有氧气参与。
分解反应
●汞在空气中加热:2Hg+O22HgO
●氧化汞加强热:2HgO2Hg+O2↑
●分解过氧化氢制取氧气(实验室制取氧气的反应原理之一):2H2O22H2O+O2↑
●加热高锰酸钾制取氧气(实验室制取氧气的反应原理之一):
2KMnO4K2MnO4+MnO2+O2↑
●加热氯酸钾制取氧气(实验室制取氧气的反应原理之一):2KClO32KCl+3O2↑
●分解过氧化氢制取氧气符合绿色化学的观念,是三种方案中最安全、最节约资源的一种。
●电解水生成氢气和氧气:2H2O2H2↑+O2↑
●工业制取生石灰和CO2的反应原理:CaCO3CaO+CO2↑
●干粉灭火器的反应原理(碳酸氢钠受热分解):2NaHCO3Na2CO3+H2O+CO2↑
●碱式碳酸铜受热分解:Cu2(OH)2CO32CuO+H2O+CO2↑
●过氧化氢溶液不稳定,发生分解:2H2O2=2H2O+O2↑
●碳酸不稳定,分解成水和二氧化碳:H2CO3=H2O+CO2↑
●碳铵(碳酸氢铵)“消失”并发出刺激性气味:NH4HCO3=NH3↑+CO2↑+H2O
●石笋、钟乳石的形成过程:CaCO3+CO2+H2O=Ca(HCO3)2
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
置换反应
●氢气还原氧化铜:H2+CuO Cu+H2O
●木炭还原氧化铜:C+2CuO2Cu+CO2↑
●木炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑
●水煤气的形成:C+H2O H2+CO(注意没有气体生成符号↑)
●实验室制取氢气的反应原理:Zn+H2SO4=ZnSO4+H2↑
●金属与稀盐酸的反应
?2X+2HCl=2X Cl+H2↑(X是+1价的金属,包括K、Na)
?X+2HCl=X Cl2+H2↑(X是+2价的金属,包括Ca、Mg、Zn、Fe)
?2Al+6HCl=2AlCl3+3H2↑
●金属与稀硫酸的反应
?2X+H2SO4=X2SO4+H2↑(X是+1价的金属,包括K、Na)
?X+H2SO4=X SO4+H2↑(X是+2价的金属,包括Ca、Mg、Zn、Fe)
?2Al+3H2SO4=Al2(SO4)3+3H2↑
●金属与盐溶液的反应
?镁
◆3Mg+2AlCl3=3MgCl2+2Al
◆3Mg+Al2(SO4)3=3MgSO4+2Al
◆3Mg+2Al(NO3)3=3Mg(NO3)2+2Al
◆Mg+X Cl2=MgCl2+X(X是+2价的金属,包括Zn、Fe、Cu)
◆Mg+X SO4=MgSO4+X(X是+2价的金属,包括Zn、Fe、Cu)
◆Mg+X(NO3)2=Mg(NO3)2+X(X是+2价的金属,包括Zn、Fe、Cu)
◆Mg+2AgNO3=Mg(NO3)2+2Ag
?铝
◆2Al+3X Cl2=2AlCl3+3X(X是+2价的金属,包括Zn、Fe、Cu)
◆2Al+3X SO4=Al2(SO4)3+3X(X是+2价的金属,包括Zn、Fe、Cu)
◆2Al+3X(NO3)2=2Al(NO3)3+3X(X是+2价的金属,包括Zn、Fe、Cu)
◆Al+3AgNO3=Al(NO3)3+3Ag
?锌
◆Zn+X Cl2=ZnCl2+X(X是+2价的金属,包括Fe、Cu)
◆Zn+X SO4=ZnSO4+X(X是+2价的金属,包括Fe、Cu)
◆Zn+X(NO3)2=Zn(NO3)2+X(X是+2价的金属,包括Fe、Cu)
◆Zn+2AgNO3=Zn(NO3)2+2Ag
?铁
◆Fe+CuCl2=FeCl2+Cu
◆Fe+CuSO4=FeSO4+Cu
◆Fe+Cu(NO3)3=Fe(NO3)3+Cu
◆Fe+2AgNO3=Fe(NO3)2+2Ag
?铜:Cu+2AgNO3=Cu(NO3)2+2Ag
?K、Ca、Na不遵循这样的置换反应,它们与盐溶液反应时,会先和水反应生成对
应的碱,然后再和盐溶液反应。如:2Na+2H2O=2NaOH+H2↑NaOH+CuSO4=Na2SO4+Cu(OH)2↓
●镁在二氧化碳中燃烧:2Mg+CO22MgO+C
●水蒸气与铁在高温的条件下反应:3Fe+4H2O Fe3O4+4H2(注意没有气体生成符号
↑)
复分解反应
●NaOH溶液与稀盐酸反应:NaOH+HCl=NaCl+H2O
●NaOH溶液与稀硫酸反应:2NaOH+H2SO4=Na2SO4+2H2O
●Ba(OH)2溶液与稀硫酸反应:Ba(OH)2+H2SO4=BaSO4↓+2H2O
●用胃舒平(氢氧化铝)中和过多的胃酸:Al(OH)3+3HCl=AlCl3+3H2O
●用氢氧化镁中和过多的胃酸:Mg(OH)2+2HCl=MgCl2+2H2O
●用熟石灰中和含有硫酸的污水:Ca(OH)2+H2SO4=CaSO4+2H2O
●稀盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O
●稀硫酸除铁锈:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
●稀盐酸与氧化铜反应:CuO+2HCl=CuCl2+H2O
●稀硫酸与氧化铜反应(制取CuSO4):CuO+H2SO4=CuSO4+H2O
●提示:CaO、Na2O、K2O、BaO可以直接和酸反应。
●实验室制取CO2的反应原理:CaCO3+2HCl=CaCl2+H2O+CO2↑
●盐酸与水垢中的主要成分发生反应:CaCO3+2HCl=CaCl2+H2O+CO2↑
●实验室不用大理石和稀硫酸制取CO2的原因:CaCO3+H2SO4=CaSO4+H2O+CO2↑
●泡沫灭火器的反应原理:Na2CO3+2HCl=2NaCl+H2O+CO2↑
●误食碳酸钡后发生中毒的原因:BaCO3+2HCl=BaCl2+H2O+CO2↑
●用小苏打治疗胃酸过多:NaHCO3+HCl=NaCl+H2O+CO2↑
●硝酸银溶液与稀盐酸反应:AgNO3+HCl=HNO3+AgCl↓
●钡盐与稀硫酸反应:
●Ba(NO3)2+H2SO4=2HNO3+BaSO4↓BaCl2+H2SO4=2HCl+BaSO4↓
BaCO3+H2SO4=BaSO4↓+H2O+CO2↑
●硫酸和碱式碳酸铜反应:Cu2(OH)2CO3+2H2SO4=2CuSO4+2H2O+CO2↑
●工业制取烧碱:Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
●氯化铵与氢氧化钠溶液反应:NH4Cl+NaOH=NaCl+NH3↑+H2O
●硫酸铵与氢氧化钠溶液反应:(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O
●将熟石灰与氯化铵两种固体一起研磨,闻到刺激性气味:2NH4Cl+Ca(OH)2=CaCl2+2NH3
↑+2H2O
●将熟石灰与硫酸铵两种固体一起研磨,闻到刺激性气味:
(NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+2H2O
●生成蓝色沉淀的反应:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4(参加反应的碱只能是四大强
碱)
●生成红褐色沉淀的反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl(参加反应的碱只能是四大强
碱)
●生成白色沉淀的反应:MgCl2+2NaOH=Mg(OH)2↓+2NaCl(生成物只能是弱碱)
●生成白色沉淀的反应:MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓(硫酸盐与氢氧化钡反应)●生成蓝白沉淀的反应:CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓
●生成红白沉淀的反应:Fe2(SO4)3+3Ba(OH)2=2Fe(OH)3↓+3BaSO4↓
●配制波尔多液时发生的反应:CuSO4+Ca(OH)2=CaSO4+Cu(OH)2↓
●误食BaCO3或BaCl2发生中毒之后,要服用泻盐(MgSO4)解毒:
BaCl2+MgSO4=MgCl2+BaSO4↓
●其他常见的反应:
?NaCl+AgNO3=NaNO3+AgCl↓
?CaCl2+Na2CO3=2NaCl+CaCO3↓(CaCl2可以换成Ca(NO3)2,Na2CO3可以换成
K2CO3)
?BaCl2+Na2CO3=2NaCl+BaCO3↓(BaCl2可以换成Ba(NO3)2,Na2CO3可以换成
K2CO3)
?BaCl2+Na2SO4=2NaCl+BaSO4↓(BaCl2可以换成Ba(NO3)2,Na2SO4可以换成K2SO4)
●证明NaOH变质的三种方法:
?Na2CO3+2HCl=2NaCl+H2O+CO2↑
?Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
?Na2CO3+CaCl2=2NaCl+CaCO3↓
?Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓
●证明NaOH部分变质(先用下面的方法除去Na2CO3,然后向溶液中滴加酚酞,如果溶
液变红说明NaOH部分变质):
?Na2CO3+CaCl2=2NaCl+CaCO3↓
?Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓
●证明Ca(OH)2变质的方法:CaCO3+2HCl=CaCl2+H2O+CO2↑
●证明Ca(OH)2部分变质的方法(取两份相同的样品,分别按以下方法做)
?证明Ca(OH)2变质:CaCO3+2HCl=CaCl2+H2O+CO2↑
?证明还有Ca(OH)2存在:Ca(OH)2+2NH4Cl=CaCl2+2H2O+2NH3↑
●证明CaO部分变质的方法(取三份相同的样品,分别按以下方法做):
?证明CaO仍然存在:CaO+H2O=Ca(OH)2
?证明CaCO3的存在:CaCO3+2HCl=CaCl2+H2O+CO2↑
?证明Ca(OH)2的存在:Ca(OH)2+2NH4Cl=CaCl2+2H2O+2NH3↑
非基本类型
●一氧化碳还原氧化铜(检验一氧化碳的反应原理):CO+CuO Cu+CO2
●一氧化碳还原氧化铁(用赤铁矿炼铁、高炉炼铁的反应原理):
3CO+Fe2O 32Fe+3CO2
●一氧化碳还原氧化亚铁:CO+FeO Fe+CO2
●一氧化碳还原四氧化三铁(用磁铁矿炼铁):4CO+Fe3O 43Fe+4CO2
●黑火药点燃爆炸:S+2KNO3+3C K2S+N2↑+3CO2↑
●甲烷充分燃烧:CH4+2O 2CO2+2H2O
●甲烷不充分燃烧:2CH4+3O 22CO+4H2O
●乙醇充分燃烧:C2H5OH+3O 22CO2+3H2O
●乙醇不充分燃烧:C2H5OH+2O 22CO+3H2O
●二氧化碳使澄清的石灰水变浑浊(Ca(OH)2固体变质的原因):
Ca(OH)2+CO2=CaCO3↓+H2O
●用NaOH溶液吸收CO2(NaOH固体变质的原因):2NaOH+CO2=Na2CO3+H2O
●用NaOH溶液吸收SO2:2NaOH+SO2=Na2SO3+H2O
●NaOH溶液与SO3反应:2NaOH+SO3=Na2SO4+H2O
●葡萄糖的缓慢氧化:C6H12O6+6O 26CO2+6H2O
常见反应的现象
化学方程式反应现象备注
C+O2CO2
①木炭在空气中燃烧时持续红热,无烟
无焰;在氧气中燃烧时发出白光
②放热
③生成能使澄清石灰水变浑浊的气体
做木炭在氧气中燃烧的实验时,夹有红热木炭
的坩埚钳伸入氧气的集气瓶中时,要由瓶口向
下缓慢插入
S+O2SO2
①在空气中燃烧发出淡蓝色火焰,在氧
气中燃烧发出蓝紫色火焰
②放热
③生成有刺激性气味的气体
在做硫燃烧实验时,集气瓶底部应加入少量
NaOH溶液以吸收有毒的SO2
4P+5O22P2O5
①产生大量白烟
②放热
①由于红磷燃烧只消耗氧气,并且生成物只有
固体,所以可以用来测定空气中氧气的含量。
②应用:发令枪
2H2+O22H2O
①发出淡蓝色火焰(如果不纯,还会发
出尖锐的爆鸣声);②放热;③生成能
使无水硫酸铜变蓝的液体
①点燃氢气之前必须验纯;
②氢气是最清洁的能源,是高能燃料
③把细铁丝绕在火柴上,是为了引燃细铁丝,
使细铁丝的温度达到着火点。
④待火柴快燃尽时才缓慢插入盛有氧气的集
气瓶中,是为了防止火柴燃烧时消耗氧气,保
证有充足的氧气与细铁丝反应。
⑤由上向下缓慢伸进盛有氧气的集气瓶中是
为了防止细铁丝燃烧时放热使氧气从集气瓶
口逸出,保证有充足的氧气与细铁丝反应。
⑥集气瓶里要预先装少量水或在瓶底铺上一
薄层细沙,是为了防止灼热的生成物溅落使集
气瓶瓶底炸裂。
4Al+3O22Al2O3
①发出耀眼的白光
②放热
③生成白色固体
①铝在空气中不能燃烧(铝粉、铝箔可以)。
②铝的抗腐蚀性能好的原因:铝在空气中与氧
气反应,其表面生成一层致密的氧化铝薄膜,
从而阻止铝进一步氧化。
2Mg+O22MgO
①发出耀眼的白光
②放热
③生成白色固体
①点燃前要先用砂纸除去镁条表面的氧化膜
②应用:信号弹
2Cu+O22CuO
红色固体逐渐变成黑色可用来除去混合气体中的氧气
2Hg+O22HgO
银白色液体逐渐变成红色固体拉瓦锡实验中反应之一
2CO+O22CO2
①发出蓝色火焰
②放热
③生成能使澄清石灰水变浑浊的气体
①CO有毒!
②点燃前要验纯
③应用:煤气
2HgO2Hg+O2↑
红色固体逐渐变成银白色液体,并生成
能使带火星的木条复燃的气体
拉瓦锡实验中反应之一
石蜡+氧气二氧化
碳+水
①火焰发出白光;②放热;③生成能使
澄清石灰水变浑浊的气体;④生成能使
无水硫酸铜变蓝的液体
CH4+2O2CO2+2H2O
①发出明亮的蓝色火焰;②放热;③生
成能使澄清石灰水变浑浊的气体;④生
成能使无水硫酸铜变蓝的液体
①点燃前要验纯
②应用:天然气
Ca(OH)2+CO2=CaCO3↓
+H2O
澄清的石灰水变浑浊应用:检验二氧化碳、吸收少量二氧化碳
2H 2O 22H 2O+O 2↑
产生大量气泡,生成能使带火星木条复燃的气体
应用:实验室制取氧气 Cu 2(OH)2CO 32CuO+H 2O+CO 2↑ ①绿色固体逐渐变成黑色;②生成能使
澄清石灰水变浑浊的气体;③生成能使
无水硫酸铜变蓝的液体
H 2+CuO
Cu+H 2O
①黑色粉末逐渐变成红色
②生成能使无水硫酸铜变蓝的液体 氢气要“早来晚走”,酒精灯要“迟到早退”H 2O+CO 2=H 2CO 3 (如果加入石蕊溶液)石蕊溶液变红 证明二氧化碳与水反应生成碳酸 Fe+CuSO 4=Cu+FeSO 4
①铁钉表面附着一层红色物质 ②溶液由蓝色逐渐变成浅绿色。
可以用来验证质量守恒定律
C+2CuO
2Cu+CO 2↑ ①黑色粉末逐渐变成红色
②生成能使澄清石灰水变浑浊的气体
①加热时酒精灯上要加网罩,是为了:使火焰集中并提高温度
②反应开始的标志:澄清的石灰水变浑浊 ③配制混合物时木炭粉应稍过量的目的:防止已经还原的铜被氧气重新氧化 ④实验完毕后要先移出导气管,后熄灭酒精灯
CO+CuO Cu+CO 2
①黑色粉末逐渐变成红色
②生成能使澄清石灰水变浑浊的气体
①一氧化碳“早来”,酒精灯“迟到”的目的:排净装置内的空气,防止加热空气和一氧化碳的混合气体引起爆炸。
②一氧化碳“晚走”,酒精灯“早退”的目的:防止灼热的铜重新被空气中的氧气氧化 ③因为一氧化碳有剧毒,随意排放还会造成空气污染,所以必须进行尾气处理(方法是在装置末尾的导气口处放一只燃着的酒精灯)
物。
初三化学常见物质的化学式固态:干冰 Hg汞Fe铁Cu铜P氮气C碳磷S硫1、单质:H氢气O氧气N222苛性钠、火石灰石、大碳酸钙Ca CONaOH氢氧化钠2、化合物3理石碱、烧碱(1)氧化物:HO水CO二氧化碳CO一氧化碳SO三氧化硫二氧化硫SO3222NaCO碳酸钠纯碱、苏打CuSO·5HO硫酸铜晶体胆矾、蓝矾2324PO五氧化二磷FeO 氧化铁Fe氧化镁CaO氧化钙MgOO四氧化三铁423235碳酸氢钠、小苏打NaCl 氯化钠NaHCO食盐钠NaO氧化锰亚CuO氧化铜FeO氧化铁MnO二氧化322酸式碳酸钠KOH氢氧化钠CO(2)酸:HCl盐酸HSO硫酸HNO硝酸H碳酸(3)碱:NaOH醋酸32324乙酸 CHCOOH CHOH 乙醇酒精352氯氯化钙NaCl氢氧化钾Ca(OH)氢氧化钙(4)盐:氯化钠NaCO碳酸钠CaCl KCl2322HCl 氢氯酸盐酸 HO 过氧化氢双氧水22化钾铜绿、孔雀(OH)CO 碱式碳酸铜 HO 氧化氢Cu 水FeSO硫酸亚铁氯化亚铁FeCl硫酸铜CuSO AgCl氯化银氯化铁FeCl22234342石高KClO 硫酸锌CaCO碳酸钙BaSO硫酸钡氯酸钾KMnO硫酸铁(SO Fe)ZnSO44433342CH 甲烷沼气、坑气 FeO 氧化铁铁红324锰酸钾锰酸钾KMnO42硫酸铝钾晶.)12HO 明矾KAl(SOCO 一氧化碳煤气葡萄糖:乙酸(醋酸)COCOOHOH C)有机物:(5CH甲烷H 乙醇(酒精)CH2243452体COH6126三、物质的溶解性:一、常见物质的颜色的状态1、气体:溶的:CO、HCl、SO、NH等。322;铁、镁、无水CO、Ca(OH)NaOHCaOO、白色固体:1P、、、、KClONa、NaClCuSO4325232不溶(或不易溶):O、H、CH为银白色(汞为银白色液态)、CO、N等。2422 OMnOCuO:石墨、炭粉、铁粉、、、Fe 为紫黑色KMnO▲黑色固体2、2、金属氧化物:除CaO、NaO、KO、BaO溶外,大多数不溶443222、:3、红色固体Cu FeO CuCO(OH)为绿色、红磷▲硫:淡黄色▲、HgO323223、酸:大多数溶2+溶:凡含、4溶液的颜色Cu的溶液呈CuClCu(NO溶液、)溶液、CuSO蓝色(如:22342+溶液);凡)溶液、FeCl溶液、(如:Fe液);凡含的溶液呈浅绿色FeSOFe (NO4、碱:除氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水溶外,其他碱不溶于水22343+溶液),其余溶溶液、)(Fe黄色含Fe的溶液呈棕(如:SO溶液、Fe (NOFeCl)-的盐只有AgCl含有钾、钠、硝酸根、铵根的盐都溶于水,含Cl不溶于水,5、盐:33433222液一般为无色。(高锰酸钾溶液为紫红色) --CO3的盐的盐只有BaSO4 其他都溶于水;含SO4不溶于水,其他都溶于水;含+++溶于水,其他都不溶于水。NH4、Na K只有含、、(溶于酸)BaCO、CaCO:①盐:白色↓:即不溶于水的盐和碱沉淀5、() AgCl336、沉淀物中只有AgCl 和BaSO4不溶于稀硝酸,Fe(OH)3是红褐色沉淀,Cu(OH)2是:其Fe(OH)红褐色↓: Cu(OH)蓝色↓:等②碱:) 也不溶于稀(BaSOHNO白色↓3324蓝色沉淀,其他沉淀是白色(包括Fe(OH))有以下常见的沉淀:Mg(OH)、2 2余不溶性碱为白色。二、常见物质的学名、俗名及化学式Al(OH) CaCO BaCOAgCO推断题中,往沉淀物加稀硝酸:等都溶于酸。在3 3、3 2 3化学式化学式俗称名称名称俗称若讲沉淀不溶解,则沉淀中一定有AgCl或BaSO;若讲沉淀全部溶解,则沉淀中一4 CaO汞Hg水银氧化钙生石灰熟石灰、消气酸碳:态定没有AgCl或BaSO;若讲沉淀部分溶解,则沉淀中一定有AgCl或BaSO中的一4 4 Ca氢氧化钙二氧化碳)CO OH(22气石灰种,且还有另一种可溶于稀硝酸的沉淀。. 氢1)、由于吸水而增加的:初中化学敞口置于空气中质量改变的1、质量增加
初三化学上册化学方程式汇总 一.物质与氧气的反应: (1)单质与氧气的反应:现象 1. 镁在空气中燃烧:2Mg+O22MgO(发出耀眼白光、放热、生成白色粉末) 2. 铁在氧气中燃烧:3Fe+2O2Fe3O4(剧烈燃烧火星四射,放热、生成黑色固体) 3. 铜在空气中受热:2Cu+O22CuO(红色固体变为黑色) 4. 铝在空气中氧化:4Al+3O22Al2O3 5. 氢气中空气中燃烧:2H2+O22H2O 6. 红磷在空气中燃烧:4P+5O22P2O5(放热、生成大量白烟) 7. 硫粉在空气中燃烧:S+O2SO2(硫在空气里燃烧发出微弱的淡蓝色火焰,在氧气中燃烧得更旺发出蓝紫色火焰,放热、生成有刺激性气味的气体) 8. 碳在氧气中充分燃烧:C+O2CO2(发出白光、放热、生成一种能使石灰水变浑浊的无色气体) 9. 碳在氧气中不充分燃烧:2C+O22CO (2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧:2CO+O22CO2 11. 甲烷在空气中燃烧:CH4+2O2CO2+2H2O 12. 酒精/乙醇在空气中燃烧:C2H5OH+3O22CO2+3H2O 二.实验室制取氧气、二氧化碳、氢气原理★★★ ★13. 加热高锰酸钾:2KMnO4K2MnO4+MnO2+O2↑ ★14. 加热氯酸钾(二氧化锰做催化剂):2KClO3MnO2 2KCl+3O2↑ △ ★15.双氧水制取氧气:2H2O2MnO2 2H2O + O2↑ ★16. 实验室制取二氧化碳:CaCO3+2HCl CaCl2+ CO2↑+ H2O 17. 实验室制取氢气:Zn+H2SO4(稀)ZnSO4+H2↑ 三.利用氢气、碳、一氧化碳还原性的反应:
九年级化学常见化学式 人教版 Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】
人教版九年级化学常用化学式 氢气H 2;氮气N 2 ;氧气O 2 ;氯气Cl 2 ;碘I 2 ;红磷P;金刚石C; 硫磺S;锌Zn;铜Cu;铝Al;铁Fe;水H 2 O; 过氧化氢(双氧水)H 2O 2 二氧化碳CO 2 ;一氧化碳CO;一氧化氮NO; 二氧化氮NO 2;五氧化二磷P 2 O 5 ;二氧化硅SiO 2 ;二氧化硫SO 2 ; 三氧化硫SO 3;二氧化锰MnO 2 ;氧化铜CuO;氧化亚铁FeO; (三)氧化(二)铁Fe 2O 3 ;四氧化三铁Fe 3 O 4 ;氧化钙CaO;氧化钡BaO; (三)氧化(二)铝Al 2O 3 ;氧化镁MgO;氧化钠Na 2 O;氧化钾K 2 O; 氧化锌ZnO;氧化汞HgO;氧化钡BaO;氯化钡BaCl 2 ; 氧化铝AlCl 3;氯化亚铁FeCl 2 ;氯化铁FeCl 3 ;氯化银AgCl; 氯化氢HCl;氯化钾KCl;氯化钠(食盐)NaCl;氯化铜CuCl 2 ; 氯化镁MgCl 2;氯化钙CaCl 2 ;氯化锌ZnCl 2 ;硫化氢H 2 S; 硫化锌ZnS;硫化钠Na 2S;硫酸镁MgSO 4 ;硫酸亚铁FeSO 4 ; 硫酸铁Fe 2(SO 4 ) 3 ;硫酸钠Na 2 SO 4 ;硫酸铝Al 2 (SO 4 ) 3 ;硫酸锌ZnSO 4 ; 硫酸H 2SO 4 ;硫酸钾K 2 SO 4 ;硫酸钙CaSO 4 ;硫酸钡BaSO 4 ; 硫酸铜CuSO 4;碳酸锌ZnCO 3 ;碳酸钾K 2 CO 3 ;碳酸钡BaCO 3 ; 碳酸H 2CO 3 ;碳酸钠Na 2 CO 3 ;碳酸镁MgCO 3 ;碳酸钙CaCO 3 ; 氢氧化亚铁Fe(OH) 2;氢氧化钠NaOH;氢氧化镁Mg(OH) 2 ; 氢氧化铜Cu(OH) 2;氢氧化钡Ba(OH) 2 ;氢氧化钙Ca(OH) 2 ; 氢氧化铝Al(OH) 3;氢氧化钾KOH;氢氧化铁Fe(OH) 3 ; 氢氧化锌Zn(OH) 2;氨水NH 3 ·H 2 O;硝酸HNO 3 ; 硝酸钙Ca(NO 3) 2 ;硝酸镁Mg(NO 3 ) 2 ;硝酸钠NaNO 3 ; 硝酸银AgNO 3;硝酸钾KNO 3 ;硝酸铜Cu(NO 3 ) 2 ; 硝酸铝Al(NO 3) 3 ;硝酸锌Zn(NO 3 ) 2 ;硝酸铁Fe(NO 3 ) 3 ; 硝酸亚铁Fe(NO 3) 2 ;硝酸钡Ba(NO 3 ) 2 ;碳酸铵(NH 4 ) 2 CO 3 ; 硝酸铵NH 4NO 3 ;氯化铵NH 4 Cl;硫酸铵(NH 4 ) 2 SO 4 ;氨气NH 3 ; 碳酸氢铵NH 4HCO 3 ;碳酸氢钠NaHCO 3 ;氯酸钾KClO 3 ;锰酸钾K 2 MnO 4 高锰酸钾KMnO 4;亚硝酸钠NaNO 2 ;胆矾CuSO 4 ·5H 2 O;甲烷CH 4
△ 初三化学1-8单元化学方程式归类总结 班级:______________ 姓名:________________ 一、化合反应 1、镁燃烧:2Mg+O 22MgO 2、硫燃烧:S+O 2SO 2 3、炭燃烧:C+O 2CO 2 (O 2充足) 4、2C+O 2 2CO (O 2不足) 5、磷燃烧:4P+5O 2 2P 2O 5 6、铁燃烧:3Fe+2O 2 Fe 3O 4 7、氢气燃烧:2H 2+O 22H 2O 8、CO 2转化为CO 的反应:CO 2+C 2CO 9、生石灰变为熟石灰的反应:CaO+H 2O==Ca(OH)2 10、一氧化碳在氧气中燃烧:2CO + O 2 2CO 2 11、二氧化碳可溶于水: H 2O + CO 2==H 2CO 3 二、分解反应 1、过氧化氢制取氧气:2H 2O 2 2H 2O+O 2↑ 2、高锰酸钾制取氧气:2KMnO 4K 2MnO 4+MnO 2+O 2↑ 3、氯酸钾制取氧气:2KClO 3 2KCl+3O 2↑ 4、氧化汞受热分解:2HgO 2Hg+O ↑ 5、电解水:2H 2O 2H 2↑+ O 2↑ 6、高温煅烧石灰石:CaCO 3 CaO+CO 2↑ 三、置换反应 1、实验室制取氢气:Zn+2HCl==ZnCl 2+H 2↑或 Zn+ H 2SO 4 == ZnSO 4 + H 2↑ 2、镁与酸的反应: Mg+2HCl== MgCl 2+H 2↑ Mg + H 2SO 4 == MgSO 4 + H 2↑ 3、铁与酸的反应:Fe +2HCl== FeCl 2+H 2↑ Fe+ H 2SO 4 == FeSO 4 + H 2↑ 4、铝与酸的反应:2Al+6HCl==2AlCl 3+3H 2↑ 2Al+3H 2SO 4 = Al 2(SO 4)3+3H 2↑ 5、氢气还原氧化铜的反应:H 2 + CuO Cu + H 2 6、木炭还原氧化铜的反应:C + 2CuO 2Cu + CO 2↑ 7、氢气还原氧化铁:3H 2 + Fe 2O 32Fe + 3H 2O 8、铁与硫酸铜的反应:Fe+ CuSO 4 = Cu + FeSO 4 四、复分解反应 1、实验室制取二氧化碳的反应:CaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 2、泡沫灭火器的反应原理:Na 2CO 3 + 2HCl =2NaCl + H 2O + CO 2↑ 五、其它反应类型 1、检验二氧化碳的反应:CO 2 + Ca(OH)2 = CaCO 3 ↓+ H 2O 2、NaOH 吸收CO 2的反应:2NaOH+CO 2=Na 2CO 3+H 2O 3、一氧化碳还原四氧化三铁的反应:Fe 3O 4+4CO 3Fe+4CO 2 4、炼铁的反应原理:Fe 2O 3+3CO 2Fe+3CO 2 5、检验或除去一氧化碳的反应:CuO+CO Cu+CO 2 6、甲烷在空气中燃烧:CH 4 + 2O 2CO 2 + 2H 2O 7、酒精在空气中燃烧:C 2H 5OH + 3O 22CO 2 + 3H 2O
初三化学常见物质的化学式 1、单质:H2氢气O2氧气N2氮气C碳P磷S硫Fe铁Cu铜Hg汞 2、化合物 (1)氧化物:H2O水CO2二氧化碳CO一氧化碳SO2二氧化硫SO3三氧化硫 P2O5五氧化二磷Fe2O3氧化铁Fe3O4四氧化三铁CaO氧化钙MgO氧化镁 CuO氧化铜ZnO氧化锌FeO氧化亚铁MnO2二氧化锰 Na2O氧化钠 (2)酸:HCl盐酸H2SO4硫酸HNO3硝酸H3PO4磷酸H2CO3碳酸H2SO3亚硫酸 (3)碱:NaOH氢氧化钠KOH氢氧化钾Ca(OH)2氢氧化钙Ba(OH)2氢氧化钡Cu(OH)2 氢氧化铜Fe(OH)3氢氧化铁Fe(OH)2氢氧化亚铁Al(OH)3氢氧化铝Mg(OH)2氢氧化镁 (4)盐:NaCl氯化钠Na2CO3碳酸钠ZnCl2氯化锌CaCl2氯化钙KCl氯化钾Na2SO4硫酸 钠 CuSO4硫酸铜AgCl氯化银FeCl3氯化铁FeCl2氯化亚铁AlCl3氯化铝FeSO4硫酸亚铁 Fe2(SO4)3硫酸铁ZnSO4硫酸锌CaCO3碳酸钙BaCl2氯化钡BaSO4硫酸钡KClO3氯酸钾KMnO4高锰酸钾K2MnO4锰酸钾KNO3硝酸钾Cu(NO3)2硝酸铜Hg(NO3)2硝酸汞NH4Cl 氯化铵NH4NO3 硝酸铵(NH4)2SO4硫酸铵NH4HCO3碳酸氢铵NaHCO3碳酸氢钠Cu2(OH)2CO3碱式碳酸 铜 (5)有机物:CH4甲烷C2H5OH乙醇(酒精)CH3OH甲醇CH3COOH乙酸(醋酸)CO(NH2)2 尿素,葡萄糖:C6H12O6淀粉:(C6H10O5)n 初三化学必需的记忆性知识 一、常见物质的颜色的状态 1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH) 2、KClO 3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态) 2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色 3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色 4、溶液的颜色:凡含Cu2+的溶液呈蓝色(如:CuSO4溶液、CuCl2溶液、Cu(NO3)2溶液);凡 含Fe2+的溶液呈浅绿色(如:FeSO4溶液、FeCl2溶液、Fe (NO3)2溶液);凡含Fe3+的溶液呈棕 黄色(如:Fe2(SO4)3溶液、FeCl3溶液、Fe (NO3)3溶液),其余溶液一般为无色。(高锰酸 钾溶液为紫红色) 5、沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸) AgCl、BaSO4(也 不溶于稀HNO3) 等②碱:蓝色↓:Cu(OH)2红褐色↓:Fe(OH)3白色↓:其余不溶性碱为白色。 二、常见物质的学名、俗名及化学式 化学式名称俗称化学式名称俗称
初中常见物质的化学式(大全) 1、非金属单质氢气碳氮气氧气磷硫氯气H2CN2O2PSCl 22、金属单质钠镁铝钾钙铁锌铜NaMgAlKCaFeZnCu汞钡钨HgBaW 3、常见氧化物水一氧化碳二氧化碳五氧化二磷二氧化锰二氧化氮二氧化硅H2OCOCO2P2O5MnO2NO2SiO2二氧化硫三氧化硫一氧化氮氧化镁氧化铜氧化钡氧化亚铜SO2SO3NOMgOCuOBaOCu2O氧化亚铁三氧化二铁四氧化三铁三氧化二铝FeOFe2O3Fe3O4Al2O 34、氯化物/盐酸盐氯化钾氯化钠氯化镁氯化钙氯化铜氯化锌氯化钡氯化铝氯化银 KClNaClMgCl2CaCl2CuCl2ZnCl2BaCl2AlCl3AgCl氯化铁氯化亚铁FeCl3FeCl 25、常见的酸硫酸亚硫酸盐酸硝酸碳酸硫化氢 H2SO4H2SO3HClHNO3H2CO3H2S 6、常见的盐硫酸铜硫酸钡硫酸钙硫酸钾硫酸镁硫酸亚铁硫酸铁CuSO4BaSO4CaSO4K2SO4MgSO4FeSO4Fe2(SO4)3硫酸铝硫酸钠硫酸钾亚硫酸钠硝酸钠硝酸钾硝酸银 Al2(SO4)3Na2SO4K2SO4Na2SO3NaNO3KNO3AgNO3硝酸镁硝酸铜硝酸钙亚硝酸钠碳酸钠碳酸钙碳酸镁 MgNO3Cu(NO3)2Ca(NO3)2NaNO3Na2CO3CaCO3MgCO3碳酸钾K2CO
37、常见的碱氢氧化钠氢氧化钙氢氧化钡氢氧化镁氢氧化铜氢氧化钾氢氧化铝 NaOHCa(OH)2Ba(OH)2Mg(OH)2Cu(OH)2KOHAl(OH)3氢氧化铁氢氧化亚铁Fe(OH)3Fe(OH) 28、常见有机物甲烷乙炔甲醇乙醇 【酒精】 乙酸 【醋酸】 CH4C2H2CH3OHC2H5OHCH3COOH 9、常见结晶水合物碱式碳酸铜石膏蓝矾明矾绿矾 Cu2(OH)2CO3CaSO4?2H2OCuSO4?5H2OKAl(SO4)2?12H2OFeSO4?7 H2O 10、常见化肥尿素硝酸铵硫酸铵碳酸氢铵磷酸二氢钾 CO(NH2)2NH4NO3(NH4)2SO4NH4HCO3KH2PO4 11、沉淀微溶于水淡黄色沉淀浅绿色沉淀红褐色絮状沉淀蓝色絮状沉淀Ca(OH)2,CaSO4SFe(OH)2Fe(OH)3Cu(OH)2白色沉淀Mg(OH) 2、CaCO 3、BaCO 3、AgCl、BaSO4 (其中BaSO 4、AgCl是不溶于HNO3的白色沉淀, Mg(OH)
初中化学知识点总结 一基本概念: 1、化学变化:生成了其它物质的变 2、物理变化:没有生成其它物质的变化 3、物理性质:不需要发生化学变化就表现出来的性质 (如:颜色、状态、密度、气味、熔点、沸点、硬度、水溶性等) 4、化学性质:物质在化学变化中表现出来的性质 (如:可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等) 5、纯净物:由一种物质组成 6、混合物:由两种或两种以上纯净物组成,各物质都保持原来的性质 7、元素:具有相同核电荷数(即质子数)的一类原子的总称 8、原子:是在化学变化中的最小粒子,在化学变化中不可再分 9、分子:是保持物质化学性质的最小粒子,在化学变化中可以再分 10、单质:由同种元素组成的纯净物 11、化合物:由不同种元素组成的纯净物 12、氧化物:由两种元素组成的化合物中,其中有一种元素是氧元素 13、化学式:用元素符号来表示物质组成的式子 14、相对原子质量:以一种碳原子的质量的1/12作为标准,其它原子的质量跟它比较所得的值 某原子的相对原子质量= 相对原子质量≈ 质子数 + 中子数 (因为原子的质量主要集中在原子核) 15、相对分子质量:化学式中各原子的相对原子质量的总和 16、离子:带有电荷的原子或原子团 17、原子的结构: 原子、离子的关系: 注:在离子里,核电荷数 = 质子数≠ 核外电子数 18、四种化学反应基本类型:(见文末具体总结) ①化合反应:由两种或两种以上物质生成一种物质的反应
如:A + B = AB ②分解反应:由一种物质生成两种或两种以上其它物质的反应 如:AB = A + B ③置换反应:由一种单质和一种化合物起反应,生成另一种单质和另一种化合物的反应如: A + BC = AC + B ④复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应如:AB + CD = AD + CB 19、还原反应:在反应中,含氧化合物的氧被夺去的反应(不属于化学的基本反应类型) 氧化反应:物质跟氧发生的化学反应(不属于化学的基本反应类型) 缓慢氧化:进行得很慢的,甚至不容易察觉的氧化反应 自燃:由缓慢氧化而引起的自发燃烧 20、催化剂:在化学变化里能改变其它物质的化学反应速率,而本身的质量和化学性在化学变化前后都没有变化的物质(注:2H2O2 === 2H2O + O2 ↑ 此反应MnO2是催化剂)21、质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成物质的质量总和。 (反应的前后,原子的数目、种类、质量都不变;元素的种类也不变) 22、溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物 溶液的组成:溶剂和溶质。(溶质可以是固体、液体或气体;固、气溶于液体时,固、气是溶质,液体是溶剂;两种液体互相溶解时,量多的一种是溶剂,量少的是溶质;当溶液中有水存在时,不论水的量有多少,我们习惯上都把水当成溶剂,其它为溶质。) 23、固体溶解度:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,就叫做这种物质在这种溶剂里的溶解度 25、酸性氧化物(属于非金属氧化物):凡能跟碱起反应,生成盐和水的氧化物 碱性氧化物(属于金属氧化物):凡能跟酸起反应,生成盐和水的氧化物 26、结晶水合物:含有结晶水的物质(如:Na2CO3 .10H2O、CuSO4 . 5H2O) 27、潮解:某物质能吸收空气里的水分而变潮的现象 风化:结晶水合物在常温下放在干燥的空气里, 能逐渐失去结晶水而成为粉末的现象 28、燃烧:可燃物跟氧气发生的一种发光发热的剧烈的氧化反应 燃烧的条件:①可燃物;②氧气(或空气);③可燃物的温度要达到着火点。
初中化学常见物质化学式、名称及其俗称 一、必须掌握部分 1. C :碳,金刚石、石墨、木炭、活性炭、焦炭、煤的主要成分; 2.CO2:二氧化碳,干冰; 3.CO :一氧化碳,煤气; 4.水煤气:CO和H2混合气; 5.CH4:甲烷,天然气、瓦斯、沼气的主要成分; 6.CH3OH :甲醇; 7.> 8.C2H5OH :乙醇,酒精; 9.CH3COOH :乙酸,醋酸; 10.C6H12O6:葡糖糖; 11.Hg :汞,水银; 12.P :磷,白磷、红磷、黄磷为同素异形体; 13.S :硫,硫磺; 14.Fe :铁,生铁、钢、不锈钢的主要成分; 15.HCl :氯化氢,盐酸(氢氯酸)、胃酸的主要成分; 16.] 17.H2O2:过氧化氢,双氧水; 18.KOH :氢氧化钾,苛性钾; 19.K2CO3:碳酸钾,草木灰的主要成分; 20.CaO :氧化钙,生石灰; 21.Ca(OH)2:氢氧化钙,消石灰、熟石灰,石灰浆/乳、石灰水的主要成分; 22.CaCO3:碳酸钙,大理石、石灰石的主要成分; 23.漂白粉(有效成分为Ca(ClO)2):次氯酸钙Ca(ClO)2 和氯化钙CaCl2混合物; 24.水垢的主要成分:CaCO3 和 Mg(OH)2; 25.~ 26.NaCl :氯化钠,食盐;生理盐水是%的NaCl溶液; 27.NaNO2:亚硝酸钠(工业用盐,有毒); 28.NaOH :氢氧化钠,火碱、烧碱、苛性钠; 29.Na2CO3:碳酸钠,纯碱、苏打; 30.NaHCO3:碳酸氢钠,小苏打; 31.Al2O3:三氧化二铝,铝土矿(存在刚玉,即红宝石、蓝宝石)的主要成分; 32.Al(OH)2 :氢氧化铝,胃舒平的主要成分; 33.Fe2O3:氧化铁,铁锈和赤铁矿的主要成分; 34./ 35.Fe3O4:四氧化三铁,磁铁矿、烤蓝、考黑; 36.NH4HCO3:碳酸氢铵,碳铵; 37.(NH4)2SO4:硫酸铵,硫铵; 38.NH4NO3:硝酸铵,硝铵;
初三化学1-9单元化学方程式总结 一、物质与氧气的反应: (1)单质与氧气的反应: 1. 镁在空气中燃烧:2Mg + O 2 点燃 2MgO 2. 铁在氧气中燃烧:3Fe + 2O 2 点燃 Fe 3O 4 3. 铜在空气中受热:2Cu + O 2 加热 2CuO 4. 铝在空气中燃烧:4Al + 3O 2 点燃 2Al 2O 3 5. 氢气中空气中燃烧:2H 2 + O 2 点燃 2H 2O 6. 红(白)磷在空气中燃烧:4P + 5O 2 点燃 2P 2O 5 7. 硫粉在空气中燃烧: S + O 2 点燃 SO 2 8. 碳在氧气中充分燃烧:C + O 2 点燃 CO 2 9. 碳在氧气中不充分燃烧:2C + O 2 点燃 2CO (2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧:2CO + O 2 点燃 2CO 2 11. 甲烷在空气中燃烧:CH 4 + 2O 2 点燃 CO 2 + 2H 2O 12. 酒精在空气中燃烧:C 2H 5OH + 3O 2 点燃 2CO 2 + 3H 2O 二.几个分解反应: 13. 水在直流电的作用下分解:2H 2O 通电 2H 2↑+ O 2 ↑ 14. 加热碱式碳酸铜:Cu 2(OH)2CO 3 加热 2CuO + H 2O + CO 2↑ 15. 加热氯酸钾(有少量的二氧化锰): 2KClO 3 2KCl+3O 2 ↑ 16. 加热高锰酸钾:2KMnO 4 加热 K 2MnO 4 + MnO 2 + O 2↑ 17. 碳酸不稳定而分解:H 2CO 3 H 2O + CO 2↑ 18. 高温煅烧石灰石:CaCO 3 高温 CaO + CO 2↑ 19. 过氧化氢溶液和二氧化锰混合:2H 2O 2 2H 2O+O 2↑ 三.几个氧化还原反应: 20. 氢气还原氧化铜:H 2 + CuO 加热 Cu + H 2O 21. 木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO 2↑ 22. 焦炭还原氧化铁:3C+ 2Fe 2O 3 高温 4Fe + 3CO 2↑ 23. 焦炭还原四氧化三铁:2C+ Fe 3O 4 高温 3Fe + 2CO 2↑ 24. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO 2 2 MnO 加热 2MnO
精品文档 . 人教版九年级化学常用化学式 氢气H2;氮气N2;氧气O2;氯气Cl2;碘I2;红磷P;金刚石C;硫磺S;锌Zn;铜Cu;铝Al;铁Fe;水H2O; 过氧化氢(双氧水)H2O2 二氧化碳CO2;一氧化碳CO;一氧化氮NO;二氧化氮NO2;五氧化二磷P2O5;二氧化硅SiO2;二氧化硫SO2;三氧化硫SO3;二氧化锰MnO2;氧化铜CuO;氧化亚铁FeO; (三)氧化(二)铁Fe2O3;四氧化三铁Fe3O4;氧化钙CaO;氧化钡BaO; (三)氧化(二)铝Al2O3;氧化镁MgO;氧化钠Na2O;氧化钾K2O;氧化锌ZnO;氧化汞HgO;氧化钡BaO;氯化钡BaCl2;氧化铝AlCl3;氯化亚铁FeCl2;氯化铁FeCl3;氯化银AgCl;氯化氢HCl;氯化钾KCl;氯化钠(食盐) NaCl;氯化铜CuCl2;氯化镁MgCl2;氯化钙CaCl2;氯化锌ZnCl2;硫化氢H2S; 硫化锌ZnS;硫化钠Na2S;硫酸镁MgSO4;硫酸亚铁FeSO4;硫酸铁Fe2(SO4)3;硫酸钠Na2SO4;硫酸铝Al2(SO4)3;硫酸锌ZnSO4;硫酸H2SO4;硫酸钾K2SO4;硫酸钙CaSO4;硫酸钡BaSO4; 硫酸铜CuSO4;碳酸锌ZnCO3;碳酸钾K2CO3;碳酸钡BaCO3;碳酸H2CO3;碳酸钠Na2CO3;碳酸镁MgCO3;碳酸钙CaCO3;氢氧化亚铁Fe(OH)2;氢氧化钠NaOH;氢氧化镁Mg(OH)2; 氢氧化铜Cu(OH)2;氢氧化钡Ba(OH)2;氢氧化钙Ca(OH)2; 氢氧化铝Al(OH)3;氢氧化钾KOH;氢氧化铁Fe(OH)3; 氢氧化锌Zn(OH)2;氨水NH3·H2O;硝酸HNO3; 硝酸钙Ca(NO3)2;硝酸镁Mg(NO3)2;硝酸钠NaNO3; 硝酸银AgNO3;硝酸钾KNO3;硝酸铜Cu(NO3)2; 硝酸铝Al(NO3)3;硝酸锌Zn(NO3)2;硝酸铁Fe(NO3)3; 硝酸亚铁Fe(NO3)2;硝酸钡Ba(NO3)2;碳酸铵(NH4)2CO3; 硝酸铵NH4NO3;氯化铵NH4Cl;硫酸铵(NH4)2SO4;氨气NH3; 碳酸氢铵NH4HCO3;碳酸氢钠NaHCO3;氯酸钾KClO3;锰酸钾K2MnO4高锰酸钾KMnO4;亚硝酸钠NaNO2;胆矾CuSO4·5H2O;甲烷CH4乙醇C2H5OH;乙酸(醋酸)CH3COOH;尿素CO(NH2)2;
常用物质名称及化学式 常用物质名称及化学式 酸:氢硫酸H2S氢硒酸H2Se盐酸HCl氢溴酸HBr氢氟酸HF氢碘酸HI氢氰酸HCN硫氰酸HSCN次氯酸HClO 亚氯酸HClO2氯酸HClO3高氯酸HClO4溴酸HBrO3高溴酸HBrO4碘酸HIO3高碘酸HIO4亚硫酸H2SO3硫酸H2SO4硫代硫酸H2S2O3硝酸HNO3磷酸H3PO4 偏磷酸HPO3碳酸H2CO3 草酸H2C2O4铝酸H3AlO3硅酸H2SiO3原硅酸H4SiO4次溴酸HBrO醋酸HAc醋酸CH3COOH硼酸H3BO3 碱:氢氧化钾:KOH氢氧化钠:NaOH氢氧化银:AgOH 氢氧化锂:LiOH 氢氧化钡:Ba(OH)2氢氧化钙:Ca(OH)2氢氧化铝:Al(OH)3 氢氧化锰:Mn(OH)2氢氧化锌:Zn(OH)2 氢氧化铬:Cr(OH)3 氢氧化亚铁Fe(OH)2氢氧化铁Fe(OH)3氢氧化亚锡Sn(OH)2 氢氧化锡Sn(OH)4氢氧化铅:Pb(OH)2氢氧化铜:Cu(OH)2 氢氧化汞:Hg(OH)2氢氧化镁:Mg(OH)2 氢化物:磷化氢PH3甲烷CH4 硅烷SiH4 氨气NH3氢化钠NaH 氢化钙CaH2氢化钾KH氢化锂LiH 硝酸盐:硝酸铵NH4NO3硝酸钾KNO3硝酸锂LiNO3硝酸钠NaNO3 硝酸银AgNO3硝酸钡Ba(NO3)2硝酸铍Be(NO3)2硝酸镁Mg(NO3)2硝酸铝Al(NO3)3硝酸锰Mn(NO3)2硝酸锌Zn(NO3)2硝酸亚铁Fe(NO3)2硝酸铋Bi(NO3)3硝酸铁Fe(NO3)3 硝酸铜Cu(NO3)2硝酸钙Ca(NO3)2硝酸锡Sn(NO3)2 硝酸镉Cd(NO3)3硝酸铅Pb(NO3)2硝酸镍Ni(NO3)2硝酸钴Co(NO3)2
1 初三化学方程式及其现象 与氧有关的化学方程式: 2Mg+O2点燃====2MgO 现象:燃烧、放出大量的热、同时放出耀眼的白光 S+O2 点燃====SO2 现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。 C+O2点燃====CO2 现象:生成能够让纯净的石灰水浑浊的气体 2C+O2点燃====2CO 现象:燃烧现象外,其他现象不明显 4P+5O2点燃====2P2O5 现象::生成白烟 3Fe+2O2点燃====Fe3O4 现象:剧烈燃烧、火星四射、生成黑色的固体 2H2+O2点燃====2H2O 现象:淡蓝色的火焰 2H2O2MnO2====2H2O+O2↑ 现象:溶液里冒出大量的气泡 2HgO △====2Hg+O2↑ 现象:生成银白色的液体金属 2KClO3MnO2====2KCl+3O2↑ 现象:生成能让带火星的木条复燃的气体 2KMnO4△====K2MnO4+MnO2+O2↑ 现象:同上, 跟氢有关的化学方程式: 2H2+O2点燃====2H2O 现象:淡蓝色的火焰 Zn+H2SO4==ZnSO4+H2↑ 现象:有可燃烧的气体生成 Mg+H2SO4==MgSO4+H2↑现象:同上 Fe+H2SO4 ==FeSO4+H2↑现象:变成浅绿色的溶液,同时放出气体 2Al+3H2SO4 ==Al2(SO4)3+3H2↑ 现象:有气体生成 Zn+2HCl==ZnCl2+H2↑ 现象:同上 Mg+2HCl==MgCl2+H2↑现象:同上 Fe+2HCl==FeCl2+H2↑ 现象:溶液变成浅绿色,同时放出气体 2Al+6HCl==2AlCl3+3H2↑ 现象:有气体生成 △ H2+CuO====Cu+H2O 现象:由黑色的固体 变成红色的,同时有水珠生成 高温 2Fe2O3+3H2 =====2Fe+3H2O 现象:有水珠生成,固体颜色由红色变成银白色 跟碳有关的化学方程式: C+O2点燃====CO2(氧气充足的情况下) 现象:生成能让纯净的石灰水变浑浊的气体 2C+O2点燃====2CO(氧气不充足的情况下) 现象:不明显 高温 C+2CuO=====2Cu+CO2↑ 现象:固体由黑色变成红色并减少,同时有能使纯净石灰水变浑浊的气体生成 高温 3C+2Fe2O3=====4Fe+3CO2↑现象:固体由红色逐渐变成银白色,同时黑色的固体减少,有能使纯净的石灰水变浑浊的气体生成 CO2+C 高温====2CO 现象:黑色固体逐渐减少 3C+2H2O=CH4+2CO 现象:生成的混和气体叫水煤气,都是可以燃烧的气体 跟二氧化碳有关的化学方程式: C+O2点燃====CO2 现象:生成能使纯净的石灰水变浑浊的气体 Ca(OH)2+CO2===CaCO3↓+H2O 现象:生成白色的沉淀,用于检验二氧化碳 CaCO3+CO2+H2O===Ca(HCO3)2 现象:白色固体逐渐溶解 Ca(HCO3) △====CaCO3↓+CO2↑+H2O 现象:生成白色的沉淀,同时有能使纯净的石灰水变浑浊的气体生成 Cu2(OH)2CO3△====2CuO+H2O+CO2↑ 现象:固体由绿色逐渐变成黑色,同时有能使纯净石灰水变浑浊的气体生成 2NaOH+CO2===Na2CO3+H2O (也可为KOH ) 现象:不明显 CaCO3高温====CaO+CO2↑ 现象:有能使纯净石灰水变浑浊的气体生成 跟一氧化碳有关的,但同时也跟二氧化碳有关:
一、氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2点燃2P2O5 2. 硫粉在空气中燃烧:S + O2点燃SO2 3. 碳在氧气中充分燃烧:C + O2点燃CO2 4. 碳在氧气中不充分燃烧:2C + O2点燃2CO 5. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4 6. 镁在空气中燃烧:2Mg + O2点燃2MgO 7. 铜在空气中受热:2Cu + O2点燃2CuO 8. 铝在空气中燃烧:4Al + 3O2点燃2Al2O3 9. 氢气中空气中燃烧:2H2 + O2点燃2H2O (2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧:2CO + O2点燃2CO2 11. 甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O 12. 酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O (3)氧气的来源: 13.玻义耳研究空气的成分实验2HgO 加热Hg+ O2↑ 14.加热高锰酸钾:2KMnO4加热K2MnO4 + MnO2 + O2↑(实验室制氧气原理1) 15.过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O22 MnO 2H2O+ O2↑(实验室制氧气原理2) 16.氯酸钾在二氧化锰作催化剂加热条件下反应制氧气
2KClO 3加热 2MnO 2KCl+3O 2 ↑(实验室制氧气原理3) 二、自然界中的水: 17.水在直流电的作用下分解(研究水的组成实验): 2H 2O 通电 2H 2↑+ O 2 ↑ 18.生石灰溶于水:CaO + H 2O == Ca(OH)2 19.二氧化碳可溶于水: H 2O + CO 2==H 2CO 3 三、质量守恒定律: 20.镁在空气中燃烧:2Mg + O 2 点燃2MgO 21.铁和硫酸铜溶液反应:Fe + CuSO 4 === FeSO 4 + Cu 22.氢气还原氧化铜:H 2 + CuO 加热Cu + H 2O 四、碳和碳的氧化物: (1)碳的化学性质 23. 碳在氧气中充分燃烧:C + O 2 点燃CO 2 24.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO 2↑ 25. 焦炭还原氧化铁:3C+ 2Fe 2O 3 高温4Fe + 3CO 2↑ (2)煤炉中发生的三个反应:(几个化合反应) 26.煤炉的底层:C + O 2 点燃CO 2 27.煤炉的中层:CO 2 + C 高温2CO 28.煤炉的上部蓝色火焰的产生:2CO + O 2点燃2CO 2 (3)二氧化碳的制法与性质: 29.大理石与稀盐酸反应(实验室制二氧化碳): CaCO 3 + 2HCl == CaCl 2 + H 2O + CO 2↑
常见化学式 ?常见的化学式 一、常见单质 二、化合物
初中化学方程式全(已配平). 一、化合反应 1、镁在空气中燃烧:2Mg+ O2点燃 2MgO 2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O4 3、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O3 4、氢气在空气中燃烧:2H2 +O2点燃 2H2O 5、红磷在空气中燃烧:4P +5O2点燃 2P2O5 6、硫粉在空气中燃烧: S+ O2点燃 SO2 7、碳在氧气中充分燃烧:C +O2 点燃 CO2 8、碳在氧气中不充分燃烧:2C +O2点燃 2CO 9、二氧化碳通过灼热碳层: C +CO2高温 2CO 10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO2 11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O === H2CO3 12、生石灰溶于水:CaO+ H2O === Ca(OH)2 13、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O
14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl 二、分解反应 15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑ 16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 +O2↑ 17、水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑ 18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑ 19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑ 三、置换反应 20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu 21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑ 22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑ 23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O 24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑ 25、甲烷在空气中燃烧:CH4 +2O2 点燃 CO2+2H2O 26、水蒸气通过灼热碳层:H2O +C 高温 H2 +CO 27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑ 其他 28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO4 29、甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O 30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2 +3H2O 31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO2
一、常见物质的俗称和化学式: ①生石灰——CaO ②熟石灰——Ca(OH)2 ③石灰石、大理石——CaCO3 ④食盐——NaCl ⑤火碱、烧碱、苛性钠——NaOH ⑥纯碱、苏打——Na2CO3 ⑦小苏打——NaHCO3 ⑧铁锈、赤铁矿——Fe2O3 ⑨赤铁矿——Fe3O4 ⑩金刚石、石墨——C ⑾干冰——CO2 ⑿冰——H2O ⒀天然气(甲烷)——CH4 ⒁酒精(乙醇)——C2H5OH ⒂醋酸(乙酸)——CH3COOH 二、常见物质的颜色: 红色的固体——Cu、Fe2O3、P(红磷) 黑色的固体——C、CuO、Fe3O4、FeO、MnO2、铁粉 白色的固体——MgO、P2O5、P(白磷)、CuSO4(无水硫酸铜)、KCl、NaCl等 黄色的固体——S 蓝色的固体——CuSO4?5H2O 蓝色絮状沉淀——Cu(OH)2 红褐色絮状沉淀——Fe(OH)3 常见不溶于酸的白色沉淀——BaSO4、AgCl 溶于酸并二氧化碳气体的白色沉淀——BaCO3、CaCO3等不溶性碳酸盐的沉淀 溶于酸但不产生气体的白色沉淀——Mg(OH)2、Al(OH)3等不溶性碱的沉淀 蓝色的溶液——CuSO4、CuCl2、Cu(NO3)2等含Cu2+溶液 浅绿色的溶液——FeSO4、FeCl2、Fe(NO3)2等含Fe2+溶液 黄色的溶液——FeCl3、Fe2(SO4)3、Fe(NO3)3等含Fe3+溶液 三、常见气体 (1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色) (2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒) ◎干燥剂的选择: 1、浓硫酸可干燥:酸性气体(如:CO 2、SO2、SO 3、NO2、HCl、) 中性气体(如:H2、O2、N2、CO) ※不能干燥碱性气体(如:NH3) 2、氢氧化钠固体、生石灰、碱石灰可干燥:碱性气体(如:NH3)中性气体(如:H2、O2、N2、CO) ※不能干燥酸性气体(如:CO2、SO2、SO3、NO2、HCl、) 3、无水硫酸铜固体遇水由白色变蓝色,可检验水的存在,并吸收水蒸气。
九年级化学上册化学方 程式 集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)
九年级化学上册必备化学方程 式 (一)化合反应 1、木炭在氧气中燃烧:C+O 2点燃 CO 2 2、硫在氧气中燃烧:S+O 2 点燃 SO 2 3、镁在空气中燃烧:2Mg+O 2 点燃 2MgO 4、铁在氧气中燃烧:3Fe+2O 2点燃 Fe 3O 4 5、磷在氧气中燃烧:4P+5O 2点燃2P 2O 5 6、铜在空气中加热:2Cu+O 2加热2CuO 7、氢气在氧气中燃烧:2H 2+O 点燃2H 2O 8、一氧化碳在空气中燃烧:2CO+O 点燃2CO 2 9、碳不充分燃烧:2C+O 2(不充分)点燃2CO 10、二氧化碳通过灼热的碳层:CO 2+C 高温 2CO 11、二氧化碳与水反应:CO 2+H 2O=H 2CO 3 12、生石灰和水化合:CaO+H 2O=Ca(OH)2 (二)分解反应: 13、氯酸钾与二氧化锰共热(实验室制O 2):2KClO 3MnO 2KCl+3O 2↑ 14、电解水:2H 2O=== 2H 2↑+ O 2↑ 15、加热高锰酸钾:2KMnO 4加热K 2MnO 4 + MnO 2 + O 2↑ 16、分解过氧化氢溶液2H 2O 2 MnO 2H 2O+ O 2 ↑ 17、碳酸不稳定分解:H 2CO 3=H 2O+CO 2↑ 18、高温煅烧石灰石:CaCO 3高温CaO+CO 2↑ (三)置换反应 19、锌和稀硫酸反应(实验室制H 2):Zn+H 2SO 4=ZnSO 4+H 2↑ 20、锌和盐酸反应:Zn+2HCl=ZnCl 2+H 2↑ 21、氢气还原氧化铜:H 2+CuO 加热Cu+H 2O 22、木炭还原氧化铜:C+2CuO 高温2Cu+CO 2↑ 23、碳还原氧化铁:3C+2Fe 2O 3高温4Fe+3CO 2↑
九年级化学常见化学式人 教版 The latest revision on November 22, 2020
人教版九年级化学常用化学式 氢气H 2;氮气N 2 ;氧气O 2 ;氯气Cl 2 ;碘I 2 ;红磷 P;金刚石C; 硫磺S;锌Zn;铜Cu;铝Al;铁Fe;水H 2 O; 过氧化氢(双氧水)H 2O 2 二氧化碳CO 2 ;一氧化碳CO;一氧化氮NO; 二氧化氮NO 2;五氧化二磷P 2 O 5 ;二氧化硅SiO 2 ;二氧化硫 SO 2 ; 三氧化硫SO 3;二氧化锰MnO 2 ;氧化铜CuO;氧化亚铁FeO; (三)氧化(二)铁Fe 2O 3 ;四氧化三铁Fe 3 O 4 ;氧化钙CaO;氧化钡BaO; (三)氧化(二)铝Al 2O 3 ;氧化镁MgO;氧化钠Na 2 O;氧化钾K 2 O; 氧化锌ZnO;氧化汞HgO;氧化钡BaO;氯化钡BaCl 2 ; 氧化铝AlCl 3;氯化亚铁FeCl 2 ;氯化铁FeCl 3 ;氯化银 AgCl; 氯化氢HCl;氯化钾KCl;氯化钠(食盐) NaCl;氯化铜CuCl 2 ; 氯化镁MgCl 2;氯化钙CaCl 2 ;氯化锌ZnCl 2 ;硫化氢H 2 S; 硫化锌ZnS;硫化钠Na 2S;硫酸镁MgSO 4 ;硫酸亚铁FeSO 4 ; 硫酸铁Fe 2(SO 4 ) 3 ;硫酸钠Na 2 SO 4 ;硫酸铝Al 2 (SO 4 ) 3 ;硫酸锌ZnSO 4 ; 硫酸H 2SO 4 ;硫酸钾K 2 SO 4 ;硫酸钙CaSO 4 ;硫酸钡BaSO 4 ; 硫酸铜CuSO 4;碳酸锌ZnCO 3 ;碳酸钾K 2 CO 3 ;碳酸钡BaCO 3 ; 碳酸H 2CO 3 ;碳酸钠Na 2 CO 3 ;碳酸镁MgCO 3 ;碳酸钙CaCO 3 ; 氢氧化亚铁Fe(OH) 2;氢氧化钠NaOH;氢氧化镁Mg(OH) 2 ; 氢氧化铜Cu(OH) 2;氢氧化钡Ba(OH) 2 ;氢氧化钙Ca(OH) 2 ; 氢氧化铝Al(OH) 3;氢氧化钾KOH;氢氧化铁Fe(OH) 3 ; 氢氧化锌Zn(OH) 2;氨水NH 3 ·H 2 O;硝酸HNO 3 ; 硝酸钙Ca(NO 3) 2 ;硝酸镁Mg(NO 3 ) 2 ;硝酸钠NaNO 3 ; 硝酸银AgNO 3;硝酸钾KNO 3 ;硝酸铜Cu(NO 3 ) 2 ; 硝酸铝Al(NO 3) 3 ;硝酸锌Zn(NO 3 ) 2 ;硝酸铁Fe(NO 3 ) 3 ; 硝酸亚铁Fe(NO 3) 2 ;硝酸钡Ba(NO 3 ) 2 ;碳酸铵(NH 4 ) 2 CO 3 ; 硝酸铵NH 4NO 3 ;氯化铵NH 4 Cl;硫酸铵(NH 4 ) 2 SO 4 ;氨气NH 3 ; 碳酸氢铵NH 4HCO 3 ;碳酸氢钠NaHCO 3 ;氯酸钾KClO 3 ;锰酸钾K 2 MnO 4