
实验二十五测定叶绿素a与b的方法及其计算
一目的要求:
熟悉在未经分离的叶绿体色素溶液中测定叶绿素a与b的方法及其计算。
二实验原理:
如果混合液中的两个组分,它们的光谱吸收峰虽然有明显的差异,但吸收曲线彼此有些重叠,在这种情况下要分别测定两个组分,可根据Lambert-Beer定律,通过代数方法,计算一种组分由于另一种组分存在时对光密度的影响,最后分别得到两种组分的含量。
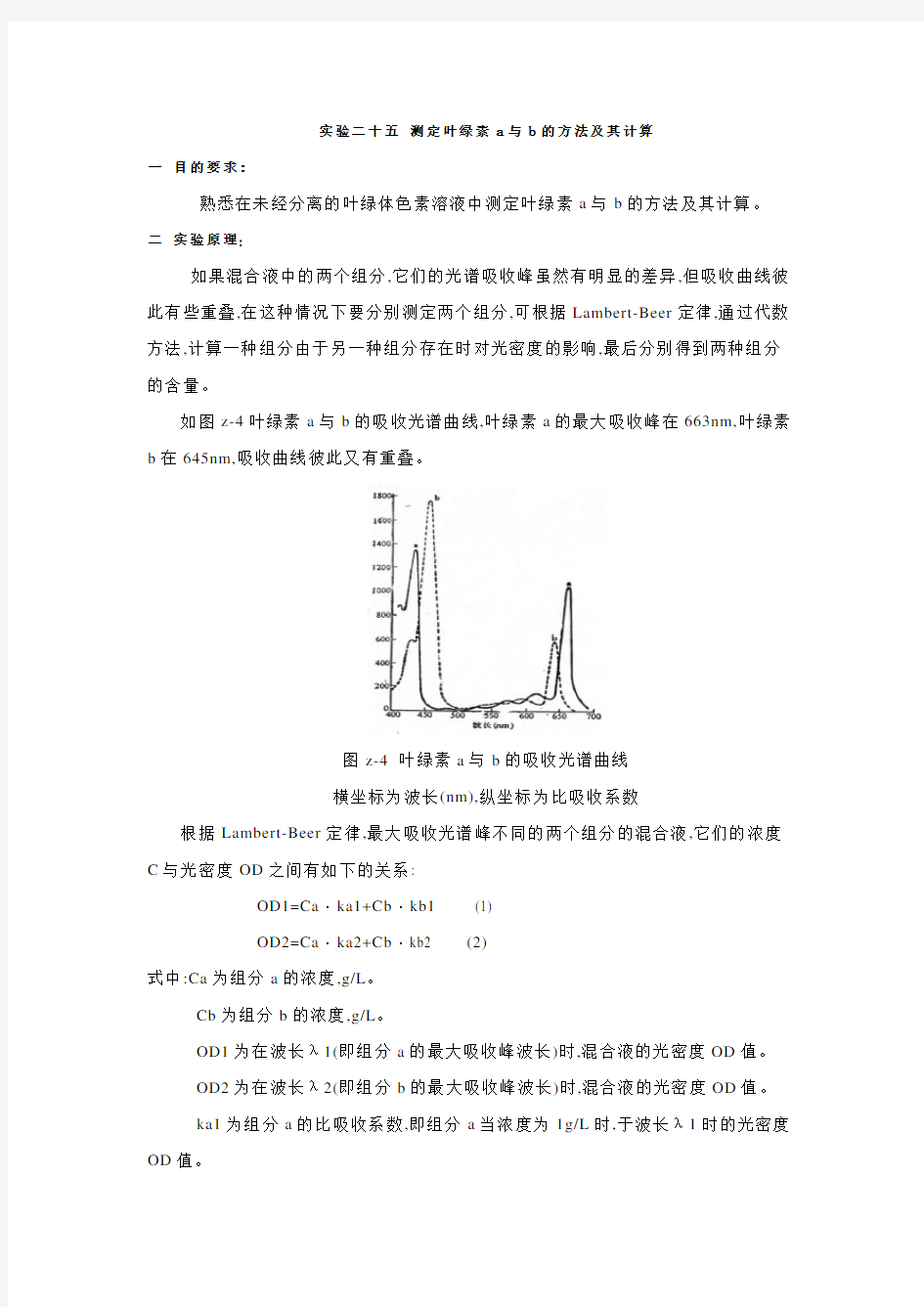
如图z-4叶绿素a与b的吸收光谱曲线,叶绿素a的最大吸收峰在663nm,叶绿素b在645nm,吸收曲线彼此又有重叠。
图z-4 叶绿素a与b的吸收光谱曲线
横坐标为波长(nm),纵坐标为比吸收系数
根据Lambert-Beer定律,最大吸收光谱峰不同的两个组分的混合液,它们的浓度C与光密度OD之间有如下的关系:
OD1=Ca·ka1+Cb·kb1 (1)
OD2=Ca·ka2+Cb·kb2 (2)
式中:Ca为组分a的浓度,g/L。
Cb为组分b的浓度,g/L。
OD1为在波长λ1(即组分a的最大吸收峰波长)时,混合液的光密度OD值。
OD2为在波长λ2(即组分b的最大吸收峰波长)时,混合液的光密度OD值。
ka1为组分a的比吸收系数,即组分a当浓度为1g/L时,于波长λ1时的光密度OD值。
kb2为组分b的比吸收系数,即组分b当浓度为1g/L时,于波长λ2时的光密度OD值。
ka2为组分a(浓度为1g/L),于波长λ2时的光密度OD值。
kb1为组分b(浓度为1g/L),于波长λ1时的光密度OD值。
从文献中可以查到叶绿素a与b的80%丙酮溶液,当浓度为1g/L时,比吸收系数k 值如下:
将表中数值代入上式(1)、(2),则得:
OD663=82、04×Ca+9、27×Cb
OD645=16、75×Ca+45、60×Cb
经过整理之后,即得到下式:
Ca=0、0127 OD663-0、00269 OD645
Cb=0、0229 OD645-0、00468 OD663
如果把Ca,Cb的浓度单位从原来的g/L改为mg/L,则上式可改写为下列形式:
Ca=12、7 OD663-2、69 OD645 (3)
Cb=22、9 OD645-4、68 OD663 (4)
CT= Ca+ Cb=8、02 OD663+20、21 OD645 (5)
(5)式中CT为总叶绿素浓度,单位为mg/L。
利用上面(3)、(4)、(5)式,即可计算出叶绿素a与b及总叶绿素的浓度(mg/L)。
[附注]一般大学教学实验室所用的分光度计多为721型,属低级类型,其单色光的半波宽要比中级类型的751型宽得多,而叶绿素a与b吸收峰的波长相差仅
18nm(663-645nm),难以达到精确测定。此外有时还由于仪器本身的标称波长与实际波长不符,测定的正确性就更差,不适用于测定。751型有时也由于波长不够准确,会带来一定误差。可用叶绿素对波长进行校正。
为校正仪器波长所需的叶绿素a与b的需要量很少,用纸层析法很快就能分离制得。取植物叶子约1g,用乙醚提取叶绿体色素,再用毛细管将色素溶液画在3mm厚滤纸上使成一直线,为使分离效果好,一般重复点样一次即可。然后于密闭容器中进行上行层析,溶剂为含有0、5%丙酮的石油醚。层析结束,用剪刀小心地剪下蓝绿色的叶绿素a与黄绿色的叶绿素b,注意剪时尽量避开分层不清晰的色区。最后分别浸于80%
丙酮中,洗下叶绿素a与b。
三实验器材与试剂:
1.实验仪器高级型分光光度计、离心机、台天平、剪刀、研钵、漏斗、移液管。
2.实验试剂丙酮、碳酸钙。
3.实验材料植物叶片。
四操作步骤:
1、色素的提取:取新鲜叶片,剪去粗大的叶脉并剪成碎块,称取0、5g放入研钵中加纯丙酮5ml,少许碳酸钙与石英砂,研磨成匀浆,将匀浆转入量筒中,并用适量80%丙酮洗涤研钵,用80%丙酮定容至10ml,吸取
2、5ml加入有10ml80%丙酮的量筒中,过滤,滤液备用。
2、测定光密度:取上述色素提取液4ml,转入比色杯中,以80%丙酮为对照,分别测定663nm、645nm处的光密度值。
3、按公式(3)、(4)、(5)分别计算色素提取液中叶绿素a、叶绿素b、及叶绿素a+b 的浓度。再根据稀释倍数分别计算每g鲜重叶片中色素的含量。
【注意事项】
1、由于植物叶子中含有水分,故先用纯丙酮进行提取,以使色素提取液中丙酮的最终浓度近似80%。
2、由于叶绿素a、b的吸收峰很陡,仪器波长稍有偏差,就会使结果产生很大的误差,因此最好能用波长较正确的高级型分光光度计。
五作业:
1、试比较阴生植物与阳生植物的叶绿素ab的比值有无不同。
2、分光光度法与比色法有何异同?
叶绿素a与b在红光区与蓝光区都有最大吸收峰,能否用蓝光区的最大吸收峰波长进行叶绿素a与b的定量分析,为什么?
叶绿素含量的测定 一、原理 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A=αCL式中:α比例常数。当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数。各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。这就是吸光度的加和性。今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿素a、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。 二、材料、仪器设备及试剂 (一)材料:新鲜(或烘干)的植物叶片。 (二)仪器设备:1)分光光度计;2)电子顶载天平(感量0.01g);3)研钵;4)棕色容量瓶; 5)小漏斗;6)定量滤纸;7)吸水纸; 8)擦境纸;9)滴管。 (三)试剂:1)95%乙醇(或80%丙酮)(v丙酮:v乙醇=2:1的95%水溶液);2)石英砂;3)碳酸钙粉。暗中2h,0.5g,25ml 三、实验步骤 1)取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,剪碎(去掉中脉),混匀。 2)称取剪碎的新鲜样品 0.2g ,共3份,分别放入研钵中,加少量石英砂和碳酸钙粉及2~3ml 95%乙醇,研成均浆,再加乙醇10ml,继续研磨至组织变白。静置3~5m 3)取滤纸1张,置漏斗中,用乙醇湿润,沿玻棒把提取液倒入漏斗中,过滤到25ml棕色容量瓶中,用少量乙醇冲洗研钵、研棒及残渣数次,最后连同残渣一起倒入漏斗中。 4)用滴管吸取乙醇,将滤纸上的叶绿体色素全部洗入容量瓶中。直至滤纸和残渣中无绿色为止。最后用乙醇定容至25ml,摇匀。 5)把叶绿体色素提取液倒入光径1cm的比色杯内,以95%乙醇为空白,在波长663nm 和645nm下测定吸光度。在波长663nm、645nm下或652nm测定吸光度。 四、实验结果计算 叶绿素a的含量 = 12.7 ? OD 663 – 2.69 ? OD 645 叶绿素a的含量 = 22.9 ? OD 645 – 4.86 ? OD 663 叶绿素a、b的总含量 = 8.02 ? OD 663 + 20.20 ? OD 645
华南师范大学实验报告 生姓名罗玉玲学号 20102501014 业生物科学年级、班级 10科四 程名称植物生理学实验实验项目植物生理学第一次实验 验类型□验证□设计□综合实验时间 2012 年 11 月 8 日 实验指导老师叶庆生、冷佳奕实验评分 绿体色素的提取、分离及理化性质的鉴定 1.实验目的 1.1学会叶绿体色素提取和分离的方法。 1.2了解叶绿体色素的荧光现象、皂化反应等理化性质。 2.实验原理 2.1叶绿体中含有绿色素(包括叶绿素a和叶绿素b)和黄色素(包括胡萝卜素和叶黄素)两大 类,这两类色素都不溶于水,而溶于有机溶剂,故可用乙醇或丙酮等有机溶剂提取。 2.2叶绿素是二羧酸酯,与强碱反应形成绿色的可溶性叶绿素盐,可与有机溶剂中的类胡萝卜素分 开;在酸性或加温条件下,叶绿素卟啉环中的Mg2+可依次被H+和Cu2+取代,形成褐色的去镁叶绿 素和绿色的铜代叶绿素;叶绿素受光激发,可发出红色荧光,反射光下可见红色荧光。 3.实验器材和试剂 3.1实验仪器与器具 研钵、漏斗、剪刀、、圆形滤纸、分光光度计、电子天平、量筒、移液管、滴管、试管、试 管架、酒精灯等 3.2实验试剂 丙酮、石英砂、碳酸钙、四氯化碳、无水氯化钠、乙醚等 3.3实验材料
勒杜鹃叶片 4.实验步骤 4.1叶绿素提取 取2g 勒杜鹃叶片 去掉主脉,剪碎 研磨 圆形滤纸过滤 收集提取液 4.2荧光现象观察 透射光下观察溶液颜色 叶绿素提取液 反色光下观察溶液颜色 4.3光对叶绿素的破坏作用 色素提取液少许等量分装于两试管 一支处于黑暗 、另一支于太阳光下 经2h 后观察两支试管的颜色 4.4铜代反应 取一支作为对照 各取色素提取液2ml 于两支试管中 取另一支 变褐色后 观察颜色的变化 4.5皂化反应 加入20mL 丙酮 少量乙酸铜粉末 滴加一滴稀盐酸 少量石英砂、碳酸钙 △
Hydrobiologia485:191–198,2002. ?2002Kluwer Academic Publishers.Printed in the Netherlands. 191 Chlorophyll-a determination with ethanol–a critical test ′Eva P′a pista1,′Eva′Acs2&B′e la B?ddi3,? 1E?tv?s Lor′a nd University of Science,Doctoral School,P′a zm′a ny P′e ter allee1/A,Budapest H-1117,Hungary 2E?tv?s Lor′a nd University of Science,Department of Microbiology,P′a zm′a ny P′e ter allee1/C Budapest H-1117, Hungary 3E?tv?s Lor′a nd University of Science,Department of Plant Anatomy,P′a zm′a ny P′e ter allee1/C,Budapest H-1117,Hungary Tel:12660240;E-mail:bbfotos@ludens.elte.hu (?Author for correspondence) Received2May2001;in revised form30August2002;accepted20August2002 Key words:algae,chlorophyll-a determination,ethanol,ISO standard10260(1992) Abstract Chlorophyll-a content is widely used as an indicator of the quality of freshwater bodies.Quanti?cation of chlorophyll-a is a routine procedure in the test laboratories of water works,and in research laboratories.Although attempts have been made to standardise the measurement procedure,there are nonetheless many procedures currently in use.This work is focused on a careful re-examination of the ISO:10260,1992standard,which prescribes90%(v/v)ethanol for chlorophyll extraction and measurement.Chlorophyll contents of cultures of the cyanobacterium Synechococcus elongatus N?geli and the chlorophyte Scenedesmus acutus Meyen were determined by means of a series of concentrations of ethanol/water mixtures which were employed as extracting agents–the water content was gradually decreased from20to0%.The extraction procedure was veri?ed by measuring the amount of retained water after using both water and oil pumps for?ltering the samples.The spectroscopic effects of the presence of water were studied and the molecular background of these spectral phenomena is discussed.The extraction yields obtained with90%ethanol were compared to those obtained with methanol and acetone.On the basis of the calculated error level,improvements to the ISO:10260,1992standard method have been suggested. Introduction The chlorophyll(Chl)content of freshwater bodies is a widely accepted indicator of water quality.Research projects on periphyton(Cattaneo,1983;Jonsson, 1987;Robinson&Rushforth,1987;Pantecost,1991) or phytoplankton(Kiss&Genkal,1993;Balogh et al., 1995;Jones,1995;Kiss,1996;Sha?k et al.,1997; Skidmore et al.,1998;Kiss et al.,1998)use these characteristics to describe the trophic state(Sumner &Fisher,1979;V?r?s&Padisák,1991;Talling, 1993)of the studied system.However,the identi?c-ation of the alga species,the knowledge of the algal cell number,or the physiological state of cells may also be important in providing a true picture of the water quality or trophic state.A combination of Chl determination and consideration of these other factors may provide an improvement in the reliability and ac-curacy of water quality estimation.Uterm?hl(1958) developed a method to determine the individual num-ber of algae with an inverted microscope and Lund et al.(1958)described a procedure to estimate the accuracy and limitations of Uterm?hl’s method. If certain taxa are in developing or degrading stages in the studied populations,consideration of the factors above is essential,since certain species produce toxins harmful to both water animals and hu-man(Slatkin et al.,1983;Codd et al.,1992).It has been established that the presence of algae and thus the Chl content indicate the concentration of certain chemicals or the appearance of toxins in the drinking water(Bernhardt&Clasen,1991).Thus,considera-
实验二、叶绿体色素的提取、分离与性质分析 一、实验目的 ?掌握叶绿体色素的提取方法;掌握板层析法分离叶绿体色素的原理和步骤;掌握叶绿体色素的部分理化性质。 二、实验原理 (一)叶绿体色素: 1.叶绿素 叶绿素a:叶绿素b=3:1 2.类胡萝卜素 胡萝卜素:叶黄素=2:1 叶绿素:类胡萝卜素=3:1 (二)叶绿素的光学性质 叶绿素a在663nm有吸收峰;叶绿素b 在645nm有吸收峰。但在蓝光区也有一个吸收峰。 胡萝卜素和叶黄素的吸收峰是在蓝光区(440nm)。 三、叶绿素含量测定: 1.取新鲜叶片,擦净组织表面污物,剪碎(去掉中脉)混匀。 2.称取剪碎的新鲜样品1.0g ,放入研钵中,加少量石英砂及2-3ml (或80%丙酮)研成匀浆,继续研磨至组织变白,静置3-5分。 3.取滤纸1张,置漏斗中,用80%丙酮湿润,沿玻棒把提取液倒人漏斗中,过滤到25ml。 4.用滴管吸取80%丙酮,将滤纸上的叶绿体色素全部洗入容量瓶中。 直至滤纸和残渣中无绿色为止。最后用80%丙酮定容至25ml,摇匀。 5.把叶绿体色素提取液倒入比色杯内。以80%丙酮为空白,在波长663nm、645nm下测定吸光度。 6 计算:按下列公式: Ca(mg/L)=12.7OD663-2.69 OD645 Cb (mg/L) =22.9OD645-4.68 OD663 C总(mg/L) = Ca+ Cb分别计算叶绿素a、b的浓度。 四、光合色素鉴定(板层析) ?支持物:硅胶层析板 ?流动相:石油醚:丙酮:(v:v=65:35) ?步骤:1、取板划线 2、点样 3、配展开剂 4、展开 5、前沿到达2/3处时停止,取出凉干并观察各色素带计算Rf值 叶绿素a:蓝绿色;叶绿素b:黄绿色;胡萝卜素:桔黄色 叶黄素:黄色 六:叶绿素前驱物的荧光观察 七、作业 1、计算你的实验中植物叶片中叶绿素的含量。 2.研磨提取叶绿素时,为何要加入CaCO3? 3.画图说明叶绿体色素板层析结果,并解释原因。
叶绿素的不同提取法的提取效果比较 中国农业仪器网更新时间:2010-9-28 15:34:23阅读23次 叶绿素的不同提取法的提取效果比较 叶片中叶绿素分子结构与人体内的血液分子相似,非常易溶入红细胞中,能抑制细菌、排出毒素,有“绿色血液”之称。同时叶绿素含量的测量能让我们了解植物缺氮的情况,叶绿素又是影响植物光合作用的重要因素,叶绿素的测量可以使用专业的测量仪器来进行快速的测量,比如使用便携式叶绿素测定仪来进行测量,同时叶绿素还可以使用常规的方法来进行,先对叶片进行提取在进行测量,不过在进行叶片提取的时候,提取方法不同还是会影响结果的。 叶绿素的提取方法有三种,分别为研磨法、浸提法、冷冻浸提法对于叶绿素a、b提取结果表现一致,以冷冻浸提法提取效果最好,其次为研磨法,再次为浸提法。 浸提法提取效果最差,一方面可能提取不完全,也可能在提取的过程中叶绿素有分解,相对冷冻浸提法,由于经过了冷冻过程破碎了细胞,提取完全而且提取过程快减少了叶绿素分解,效果最好。研磨法在研磨、过滤等操作的过程中有损失,而且提取时间过程长造成弱光下叶绿素的分解,效果不及冷冻浸提法。 叶绿素含量在提取过程中会造成一定的误差,而且测量的时间花费比较的久,同时在进行测量的时候必须将叶片采集下来之后才能进行测量,对植株造成一定的影响,也不方便在
室外进行操作,而使用手持叶绿素仪就可以避免以上的问题,操作快捷,方便在室外进行操作,同时有时无损伤的进行测量。 比较了不同有机溶剂直接浸提法和Arnon法从冷冻处理前后的玉米叶片中提取叶绿素的效率。结果表明:在室温(10℃)下浸提和冷冻处理后浸提,丙酮和乙醇(甲醇)的混合液比同类含水的提取液要好,其中丙酮∶乙醇为11∶提取液提取叶绿素快而完全,表现最好;丙酮∶乙醇∶水为4.54∶.51∶提取液最慢,丙酮∶甲醇∶水为 4.54∶.51∶提取液提取量最少;冷冻处理后叶绿素效率明显提高,其中丙酮∶乙醇为11∶提取液提取速度加快最明显。在玉米田间大量样本叶绿素测定时进行冷冻处理,既能提高叶绿素浸提的效率,又能适当储存,调节用工高峰,值得推广使用。 https://www.doczj.com/doc/7315533786.html,/view/77e3dd2f2af90242a895e5f5.htmll
叶绿素含量的测定 一、原理 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。 根据朗伯—比尔定律,某有色溶液的吸光度A 与其中溶质浓度C 和液层厚度L 成正比,即A =αCL 式中:α比例常数。当溶液浓度以百分浓度为单位,液层厚度为1cm 时,α为该物质的吸光系数。各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。 如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。这就是吸光度的加和性。今欲测定叶绿体色素混合提取液中叶绿素a 、b 和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A ,并根据叶绿素a 、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。在测定叶绿素a 、b 时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。 已知叶绿素a 、叶绿素b 的80%丙酮溶液在红外区的最大吸收峰分别位于663、645nm 处。已知在波长663nm 下叶绿素a 、叶绿素b 在该溶液中的吸光系数的分别为82.04和9.27;在波长645nm 处的吸光系数分别为16.75和45.60。根据加和性原则列出以下关系式: A663=82.04Ca+9.27Cb (1) A645=16.76Ca+45.60Cb (2) 式(1) (2)A 663nm 和A645nm 为叶绿素溶液在663nm 和645nm 处的吸光度,C a C b 分别为叶绿素a 、叶绿素b 的浓度,以mg/L 为单位。 解方程(1) (2)组得 C a =12.72 A 663—2.59 A 645 (3) C b =22.88 A 645—4.67 A 663 (4) 将C a +C b 相加即得叶绿素总量C T C T = C a 十C b =20.29A 645—8.05 A 663 (5) 从公式(3)、(4)、(5)可以看出,,就可计算出提取液中的叶绿素a 、b 浓度另外,由于叶绿素a 叶绿素b 在652nm 的吸收峰相交,两者有相同的吸光系数(均为30.5),也可以在此波长下测定一次吸光度(A 652)而求出叶绿素a 、叶绿素 b 总量 所测定材料的单位面积或单位重量的叶绿素含量可按下式进行计算: C T = 5 .341000 652 A (6) 有叶绿素存在的条件下,用分光光度法可同时测出溶液中类胡萝卜素的含量。Licht-enthaler 等对Arnon 进行了修正,提出了 80%丙酮提取液中3种色素含量的计算公式: C a =12.21A 663—2.59 A 646 (7)
实验三十三叶绿素含量的测定(分光光度法) 根据朗伯-比尔(Lambert-Beer)定律,某有色溶液的吸光度A值与其中溶质浓度C以及光径L成正比,即A=aCL(a为该物质的吸光系数)。各种有色物质溶液在不同波长下的吸光值可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下的吸光度的总和,这就是吸光度的加和性。今欲测定叶绿体色素提取液中叶绿素a、b含量,只需测定该提取液在2个特定波长下的吸光度度值,并根据叶绿素a与b在该波长下的吸光系数即可求出各自的浓度。在测定叶绿素a、b含量时,为了排除类胡萝卜素的干扰,所用单色光的波长应选择叶绿素在红光区的最大吸收峰。 已知叶绿素a、b的80%丙酮提取液在红光区的最大吸收峰分别为663nm和645nm,又知在波长663nm下,叶绿素a、b在该溶液中的比吸收系数分别为82.04和9.27,在波长645nm 下分别为16.75和45.60,可根据加和性原则列出以下关系式: A663=82.04Ca+9.27Cb (1) A645=16.75Ca+45.6Cb (2) 式中A663、A664分别为波长663nm和645nm处测定叶绿素溶液的吸光度值;Ca、Cb分别为叶绿素a、b的浓度(g/L)。 解联立方程(1)、(2)可得以下方程: Ca=0.0127A663-0.00269A645 (3) Cb=0.0229A645-0.00468A663 (4) 如把叶绿素含量单位由g/L改为mg/L,(3)、(4)式则可改写为: Ca(mg/L)=12.7A663-2.69A645 (5) Cb(mg/L)=22.9A645-4.68A663 (6) 叶绿素总量CT(mg/L)=Ca+Cb=20.2A645+8.02A663 (7) 叶绿素总量也可根据下式求导 A652=34.5×CT 由于652nm为叶绿素a与b在红光区吸收光谱曲线的交叉点(等吸收点),两者有相同的比吸收系数(均为34.5),因此也可以在此波长下测定一次吸光度(A652)求出叶绿素总量:CT(g/L)=A652/34.5 CT(mg/L)=A652×1000/34.5 (8) 因此,可利用(5)、(6)式可分别计算叶绿素a与b含量,利用(7)式或(8)式可计算叶绿
玉米叶片叶绿素的提取和测定 摘要:利用80%的丙酮提取玉米叶片中的叶绿素,再利用分光光度计测定在663nm和645nm特征波峰下的光密度值,进一步算出玉米叶绿素的含量。 关键词:叶绿素;提取;含量测定 Abstract: corn leaf chlorophyll were extracted by 80% acetone, and then the optical density were measured at the wave length of 663 and 645 nm by spectrophotometer.According to the related formulation we can circulate the Chlorophyll content. Key words: Chlorophyll,Withdraws,Determination 绿色植物吸收阳光能量,同化二氧化碳和水,制造有机物质并释放氧气的过 程,称为光合作用。光合作用所产生的有机物质主要是糖类。 光合作用能把无机物变成有机物,能蓄积太阳能,还能保护环境。这一切都 离不开叶绿素体这个细胞器,而组成叶绿体的主要成分之一是叶绿素,叶绿素的 作用就是先吸收太阳光能[5] ,然后固定CO2并与H2O同化有机物质。 除了在光合作用中起作用之外,叶绿素对人体也有相当大的作用。比如:造 血作用(叶绿素中富含微量元素铁,是天然的造血原料)、提供维生素、维持酶 的活性、解毒作用(叶绿素是最好的天然解毒剂,能预防感染,防止炎症的扩散, 还有止痛功能)、抗病强身(叶绿素在改善体质,祛病强身方面也有很多作用。 如能增强机体的耐受力;还有抗衰老、抗癌、防止基因突变等功能)。 叶绿素是植物中特有的一种成分,其他生物体内不含有叶绿素。因此,其他 生物体如动物是无法自身合成足够的能量,供给自体消耗和利用,只能从大自然 中摄取,而植物就可以自供能量。 叶绿体中主要有叶绿素:叶绿素a和叶绿素b。它们不溶于水,但能溶于酒 精、丙酮和石油醚等有机溶剂。在颜色上叶绿素a(C55H72O5N4Mg)呈蓝绿色,而叶绿素b(C55H70O6N4Mg)呈黄绿色。 叶绿素是叶绿酸的酯。叶绿酸是双羧酸,其中的两个羧基分别与甲醇(CH3OH)和叶绿醇(phytol,C20H39OH)发生酯化反应,形成叶绿素[1]。 叶绿素分子含有4个吡咯环,它们和4个甲烯基(==CH—)连接成1个大环,叫做卟啉环。镁原子居于卟啉环的中央。另外有1个含羰基和羧基的副环(同素环V),羧基以酯键和甲醇结合。叶绿醇则以酯键与在第IV吡咯环侧链上的丙酸相结合。图1是叶绿素a的结构式。叶绿素分子是一个庞大的共轭系统[7],吸
叶绿素含量的测定 绿素含量的绿定叶 一、绿绿目的 1.了解分光光度绿的工作原理~ 2.掌握不同型分光光度绿的操作方绿~号 3.通绿本绿绿的绿掌握绿素含量绿定的一绿常绿的方法学叶------分光光度法。 二、绿绿原理 叶叶体体体叶绿素是脂溶性色素~主要存在于以绿绿首的色素中。在活中~绿绿 素脂蛋白绿合受到绿原系绿的保绿~绿和光是绿定的。与并氧 叶绿素的80%丙绿提取液在波绿663nm~645nm有吸收峰~绿素叶a和绿素叶b 的绿度符合以下公式, C=0.0127A-0.00259A a663645 C=0.0229A-0.00467A绿度绿位是,g/Lb645663 C=12.7A-2.59Aa663645 C=22.9A-4.67A绿度绿位是,mg/Lb645663 叶绿素绿绿度绿, C=C+CTab 若以绿液中色素含量表示~绿来 三、绿器、绿绿和材料 1.绿器 紫外-可绿分光光度绿、、研体25ml容量、璃漏斗、璃棒、皮绿滴管瓶玻玻2. 绿绿
丙绿;分析绿,、85%丙绿、80%丙绿 2.材料 绿绿、石英砂、酸绿碳 四、操作步绿 1. 在遮光件下取出等绿绿品~剪碎~混~取绿绿条匀称0.1-0.5g~ 2. 绿品置于绿~加入少量酸绿和石英砂~加入一定绿的丙绿磨绿绿~再加研内碳体研匀 85%丙绿适量绿绿磨至绿绿白色~研 3. 绿绿有绿绿的漏斗绿液绿入将匀25ml的容量中~用瓶并80%的丙绿分次洗绿和绿绿清研~ 最后用80%的丙绿定容。 4. 以80%的丙绿绿比液~在参663和645nm波绿绿绿定吸光绿;A绿在0.2-0.8范绿~内 绿度绿大绿用80%丙绿适稀绿,。当 五、绿果绿理 按照公式绿算出绿素叶a和绿素叶b的绿度~再绿算出绿素的含量。叶六、 注意事绿 1. 在活~绿合绿绿素是绿定的~绿绿一绿破~绿素易被光解。因此~抽提和绿体内叶坏叶 定工作绿可能避光快速完成。尽 2. 绿含有大量酸性液泡的绿品~绿首先加入微性的绿液~仔绿磨后加入丙绿绿行碱冲研抽提。 3. 分光光度绿的精度绿绿定的绿果有至绿重要的影~使用前绿绿器绿行校正。响七、思考绿
实验报告 植物生理学及实验(甲)实验类型:课程 名称:实验名称:叶绿体色素的提取、分离、理化性质和叶 绿素含量的测定姓名:专业:学 号:指导老师:同组学生姓名: 实验日期:实验地点: 二、实验内容和原理一、实验目的和要求装 四、操作方法与实验步骤三、主要仪器设备订 六、实验结果与分析五、实验数据记录和处理 七、讨论、心得一、实验目的和要求、掌握植物中叶绿体色素的分离和 性质鉴定、定量分析的原理和方法。1 和b的方法及其计算。a2、熟悉在 未经分离的叶绿体色素溶液中测定叶绿素二、实验内容和原理以青菜为 材料,提取和分离叶绿体色素并进行理化性质测定和叶绿素含量分析。 原理如下:80%的乙醇或95%叶绿素和类胡萝卜素均不溶于水而溶于有机溶剂,1、常用的丙酮提取。、皂化反应。叶绿素是二羧酸酯,与强碱反应, 形成绿色的可溶性叶绿素2. 盐,就可与有机溶剂中的类胡萝卜素分开。- COOCHCOO3 Mg + 2KOH C32H30ON4Mg + 2KOH +CH3OH
HONC43230+C20H39OH 、3H+可依次被在酸性或加温条件下,叶-COOCOOCH39 20 绿素卟啉环中的Mg++取代反应。Mg2+, Cu2+ 取代Cu++取代形成褐色的去镁叶绿素和绿色的铜代叶绿素。(H+和H+ ) 取代(Zn2+) 绿色褐色 、叶绿素受光激发,可发出红色荧光,反射光下可见红色荧光。4645其中叶绿素吸收红光和兰紫光,红光区可用于定量分析,5、定量分析。 652可直接用于总量分析。663用于定量叶绿素a,b及总量,而和C最大吸收光谱不同的两个组分的混合液,它们的浓度根据朗伯-比尔定律, *k+C*kOD=Ca*k与吸光值之间有如下的关系: OD=Ca*k+C b2 1g/L和b的80查阅文献得,2b1 b1a1a2b时,比吸收系%丙酮溶液,当浓度为 叶绿素a 值如下。数k k 比吸收系数波长/nm b 叶绿素a 叶绿素 9.27 82.04 663 45.60 645 16.75
叶绿素含量测定方法---丙酮法 由于微藻的生长周期比较复杂,包括无性繁殖阶段和有性繁殖阶段,其在不同阶段的生理形态不同,有时藻细胞会聚集在一起,以片状或团状形式存在,在显微镜下难以确定其所包含的细胞数量。 藻细胞中叶绿素的含量(特别是叶绿素a的含量)通常随与细胞的生长呈较好的线性关系,因此可通过测定藻细胞中叶绿素含量变化来反映微藻的生长情况。叶绿素测定采用丙酮研磨提取法。 取适量藻液于10 mL离心管中在4000 rpm转速下离心10 min,弃去上清液,藻泥中加入适量的100 %的丙酮。采用丙酮提取法时在试管研磨器中冰浴研磨5 min,4000 rpm离心后,上清液转入10 mL容量瓶中。按上述方法对藻体沉淀进行萃取,直至藻体沉淀呈白色为止。定容后,采用722S型可见分光光度计分别测定645 nm和663 nm下萃取液的吸光值,叶绿素含量用以下公式进行计算(Amon,1949): 叶绿素a含量用以下公式进行计算: Chlorophyll a (mg/L) = (12.7×A663 nm-2.69×A645 nm)×稀释倍数 叶绿素b含量用以下公式进行计算: Chlorophyll b (mg/L) = (22.9×A645 nm-4.64×A663 nm)×稀释倍数 叶绿素总含量用以下公式进行计算: Chlorophyll a+b (mg/L) = (20.2×A645 nm+8.02×A663 nm)×稀释倍数 由于丙酮的沸点较低,较高温度下挥发很快。此外,叶绿素稳定性较差,见光易分解,因此,本实验中叶绿素的提取和测定均在低温黑暗条件下进行,以减少提取过程中的损失。 叶绿素提取方法 提取液:本试验用DMSO/80%丙酮(l/2,v/v)提取的叶绿素,谭桂英周百成底栖绿藻叶绿素的二甲基亚砜提取和测定法* 海洋与湖沼 1987 18(3)295--300. 一、直接浸提法: 1、准确量取10ml藻液,加到15ml离心管中,放在台式离心机离心,3500r/min (根据不同的藻选择不同那个的离心转速)离心5min倒上清;留藻泥。随后在盛有藻泥的离心管中加入蒸馏水,与藻泥混匀后再次离心,目的是除去藻细胞表面的盐份,此清洗过程重复三次。 2、往藻泥中加二甲基亚砜3.33ml,65℃水浴9h,20h; 3、然后离心,将上清转移到10ml棕色瓶中, 4、添加6.67ml80%丙酮到离心管中,混匀,离心,再将上清转移到10ml棕色瓶中。 5、定容,待测。
从菠菜中提取叶绿素实验报告三篇 从菠菜中提取叶绿素实验报告一 【实验目的】 1、通过绿色植物色素的提取和分离,了解天然物质的分离提纯与方法。 2、通过薄层色谱分离操作,加深了解微量有机物色谱分离鉴定的原理。 【实验原理】 叶绿色存在两种结构相似的形式即叶绿素 a{C55H77O5N4Mg}和叶绿素b{ C55H70O6N4Mg };胡萝卜素是具有长链结构的共轭多烯,有三种异构体;叶黄素C40H56O2是胡萝卜素的羟基衍生物。当提取时,从上到下颜色依次为:黄绿色,蓝绿色,黄色和橙色。 【实验仪器】 研钵,色谱柱,丙酮,乙醇,乙醚,中性氧化铝,菠菜叶,烧杯,漏斗,玻璃棒,滤纸,剪刀,脱脂棉,纱布。 【实验步骤】 1、称取30g洗净后用滤纸喜感的新鲜菠菜叶,用剪刀剪碎,放入研钵中研磨,研磨时放入少量碳酸钙,防止研磨过猛破坏叶绿素结构,研磨至烂。 2、将研磨碎的菠菜叶转入小烧杯中,加入30mL配好的乙
醇乙醚溶液,盖上表面皿,防止有机溶剂蒸发。按小组成员分别浸泡10,15,20,25,30,35,40,45,50,55分钟。 3、浸泡期间,填充色谱柱,在最下面垫入脱脂棉,再盖上一个小滤纸片,装入氧化铝至4/5处,再盖上一层滤纸片。 4、将烧杯中的菠菜叶连带着有机溶剂用纱布挤入漏斗中,转入分液漏斗,加入10mL水洗涤,除去水层(下层),再用10mL 水洗涤一次。 5、将分页漏斗中的溶液慢慢倒入色谱柱中,加几滴丙酮既可以看到颜色变化。 6、洗净仪器,收拾实验室,打扫卫生。 【实验记录】 虽然分层现象不是非常明显,但是还是可以看得见分层现象。 【结果与讨论】 1、做这个实验的时候,我觉得不应该用纱布挤干,因为个人感觉很多色素都被 纱布吸走了,导致后来的实验现象没有很明显,经过对比,没用纱布直接过滤的同学做出的现象比用纱布做的现象要明显 的多。 2、有机溶剂往往比较容易挥发,所以加入后要盖上表面皿。 3、此实验浸泡15分钟以后现象就可以很明显,因此以后
叶绿素含量的测定 一.实验原理 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。 根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A=αCL.式中:α比例常数。当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数。各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。 如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。就是吸光度的加和性。如欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三特定波长下的吸光度A,并根据叶绿素a、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。 植物叶绿素含量测定----丙酮提取法 高等植物光合作用过程中利用的光能是通过叶绿体色素(光合色素)吸收的。叶绿体色素由叶绿素a、叶绿素b、胡萝卜素和叶黄素组成。叶绿体色素的提取、分离和测定是研究它们的特性以及在光合中作用的第一步。叶片叶绿素含量与光合作用密切相关,是反眏叶片生理状态的重要指标。在植物光合生理、发育生理和抗性生理研究中经常需要测定叶绿素含量。叶绿素含量也是指导作物栽培生产和选育作物品种的重要指标。 ● 叶绿素不溶于水,溶于有机溶剂,可用多种有机溶剂,如丙酮、乙醇或二甲基亚砜等研磨提取或浸泡提取。叶绿色素在特定提取溶液中对特定波长的光有最大吸收,用分光光度计测定在该波长下叶绿素溶液的吸光度(也称为光密度),再根据叶绿素在该波长下的吸收系数即可计算叶绿素含量。 ●利用分光光计测定叶绿素含量的依据是Lambert-Beer定律,即当一束单色光通过溶液时,溶液的吸光度与溶液的浓度和液层厚度的乘积成正比。其数学表达式为: ●A=Kbc 式中:A为吸光度;K为吸光系数;b为溶液的厚度;c为溶液浓度。 ●叶绿素a、b的丙酮溶液在可见光范围内的最大吸收峰分别位于663、645nm处。叶绿素a 和b在663nm处的吸光系数(当溶液厚度为1cm,叶绿素浓度为g·L-1时的吸光度)分别为82.04和9.27;在645nm处的吸光系数分别为16.75和45.60。根据Lambert-Beer定律,叶绿素溶液在663nm和645nm处的吸光度(A663和A645)与溶液中叶绿素a、b和总浓度(a+b)(Ca、Cb 、Ca十b,单位为g·L-1),的关系可分别用下列方程式表示: ●A663=82.04C a+9.27C b (1) ●A645=16.76C a+45.60C b(2) ●C a=12.7 A663—2.59 A645(3) ●C b=22.9 A645—4.67 A663 (4) ●C a十b=20.3 A645—8.04 A663 (5) ●
叶绿体色素的提取、分离 及理化性质的测定 班级:11级生科2班 组员:XXX XX 实验名称:叶绿体色素的提取、分离及理化性质的测定
实验原理:叶绿体色素又称光合色素,在高等植物中可分为叶绿素和类胡萝卜素两大类,前者包括叶绿素a(蓝绿色)和叶绿素b(黄绿色),后者包括胡萝卜素(橙色)和叶黄素(黄色),它与们类囊体膜上的蛋白质结合形成色素蛋白复合体,不溶于水,易溶于酯,因此可用丙酮、乙醇、石油醚等有机溶剂进行提取。 层析的基本原理:在分离过程中,由一种流动相(即一种液体或气体)带动着试样经过固定相(一种支持物,如纸)向外扩散,由于试样在两相中的溶解度不同和固定相对试样中不同成分的吸附程度有别,当用适当的溶剂推动时,混合物中各成分在两相间具有不同的分配系数,所以它们的移动速度不同,经过一定时间层析后,可使试样中的各种组分得到分离,在做纸层析时,由于纸对光合色素中各种色素分子的吸附程度不同,以及这些色素分子在溶剂四氯化碳(推进剂)中溶解度也有差异,以致溶剂带动色素分子向四周移动时,各种色素分子沿纸扩散的速度也就不同,使混合色素分离,出现不同颜色的环。将提取的叶绿素溶液置于光下,在透射光呈绿色,在反射光下呈樱桃红色,种这现象称为荧光现象。在反射光下叶绿素溶液之所以呈樱桃红色,是因为叶绿色分子吸收光能后处于激状发态,激发态的叶绿素分子很不稳定,当它回到基态时,将所获得的能量以辐射能的形式发射出红光量子。叶绿素的化学性质很
不稳定,容易受强光、高温等的破坏,特别是当叶绿素与蛋白质分离以后,破坏更快,而类胡萝卜素则较稳定。叶绿素中的镁可以被H+所取代而成褐色的去镁叶绿素,后者遇铜后,其中的氢(H+)又被铜(Cu2+)取代,形成了铜代叶绿素,便由褐色转变成蓝绿色,铜代叶绿素很稳定,且比原来的绿色还要稳定些,在光下也不易被破坏。 材料与设备试剂: 1. 材料 新鲜的菠菜或小白菜等其他绿色植物叶片。 2. 设备 电子天平、研钵、烧杯、量筒、培养皿、刻度试管、试管夹、试管架、酒精灯、剪刀、圆形滤纸、小漏斗等。 3. 试剂 丙酮、四氯化碳、无水硫酸钠、6mol/L 盐酸、醋酸铜粉末、碳酸钙等。 方法与步骤: 一、1. 叶绿体色素的提取 2. 取菠菜或其他植物新鲜叶片5g,洗净,擦干,去掉主脉后剪碎,放入研钵中。
青菜叶中叶绿素含量的测定 食品学院S100111029 王婷同组人:王莹、王芳 一、实验目的 1.学习并且使用分液漏斗分离水与不溶于水的有机溶剂。 2.熟悉掌握用有机溶剂萃取青菜叶中叶绿素的方法。 二、实验原理 将青菜叶中的叶绿素萃取到丙酮中,然后将溶于丙酮的叶绿素转移到乙醚中,在指定的波长下,测定叶绿素-乙醚溶液的吸光度,然后根据公式计算青菜叶中的叶绿素a、叶绿素b 和总叶绿素的含量。 三、实验器材 1.实验仪器:天平、组织捣碎机、水、循环真空泵、抽滤瓶、滤纸、布氏漏斗、容量瓶(100ml、500ml各一个)、分液漏斗(2个)、尖嘴管、铁架台、铁圈(2个)、分光光度计。 2.实验试剂:碳酸钙、丙酮(85﹪)、乙醚、无水硫酸钠。 3.实验原料:青菜叶。 四、实验步骤 1.称取30g新鲜青菜叶置于组织捣碎机中,然后加0.05gCaCO3和85ml丙酮(85﹪),在高速组织捣碎机中,在转速20000r/min下捣碎,2min,捣碎青菜叶组织。 2.抽滤所得的匀浆,用少量85﹪丙酮多次洗涤残渣,直到残渣不带绿色为止,将溶液合并后用丙酮定容至500ml。 3.吸取25ml叶绿素-丙酮溶液,加入到含有25ml乙醚的分液漏斗中,然后加入50ml水,观察到所有的叶绿素都转入到上层乙醚相时,放出下层水相。 4.在另一只分液漏斗中加入50ml水,插入一只末端拉成小孔的玻璃管,将叶绿素-乙醚溶液注入玻璃管,溶液通过通过玻璃环末端小孔进入水相后再上升聚集在水相表面,放出下层水相,重复上述操作步骤五次,让溶于叶绿素-乙醚溶液中的丙酮转移到水相中,将乙醚层转移至容量瓶中。 5.将以上放出的下层水合并,加入25ml乙醚,同上操作,将乙醚层也转移至容量瓶中。 6.用乙醚将叶绿素-乙醚溶液定容到100ml。 7.用少量无水硫酸钠吸收叶绿素-乙醚溶液中的水分。 8.在波长660nm和642.5nm下,分别测定叶绿素-乙醚溶液的吸光度。
叶绿素测定方法 一、方法选择 1、分光光度计法>荧光光度法>SPAD速测法,浸提比色法>萃取比色法,常温浸提比色 测定>高温速浸提比色法,如果时间条件允许,建议选择常温浸提比色法。 2、药品的选择,常用有机浸提叶绿素的试剂由甲醇、乙醇、丙酮,乙醇对身体的伤害 最小,丙酮最厉害,如果通风条件不是太好,建议选择乙醇;有机试剂混合液提取具有 协同优势,乙醇与丙酮的混合液比甲醇与丙酮的混合液(甲醇乙醇混合很少)浸提的要 完全,而且稳定,乙醇、丙酮、水的浸提效果次之,差异不显著;综上,如果能买到丙 酮的话,乙醇、丙酮以1:3的比例混合液提取最好,其次是乙醇、丙酮、水以4.5:4.5:1 的比例混合液,如果不想用丙酮,可以用95%的乙醇代替,但是与混合液比,提取效率 不高。 3、称样量,0.2g样品,选用20ml浸提液浸提,0.5g样品,选用50ml浸提液浸提。二、实验原理 分光光度法测定叶绿素(包括a\b\类胡萝卜素\总量) 含量的原理是,以有机溶剂在常温暗室直接提取样品中的叶绿素,测定其吸光度,根据叶绿素(包括a\b\类胡萝卜素\总量)在特定波长的吸收,用公式计算其含量。
三、器材 棕色容量瓶、721型分光光度计(751型分光光度计更好,越精确越好) 四、步骤 1、将叶片洗净,选取中间部分,称0.200克左右,并剪成2mm左右碎条 2、将样品放入容量瓶中,加入浸提液,定容,放在暗处26h左右 3、比色,如果仅仅测定叶绿素A\B总量,测定波长在665nm、649nm、652nm 处吸光 度即可,如果还测定类胡萝卜素含量,再测定处波长在470nm处的吸光度即可。目 前,不同的浸提液提取方法都是在这些波长下测定的。 4、每个实验样品重复三次,空白两次重复即可(本实验中空白意义不大) 五、计算 Ca=13.95*A665-6.88*A649 Cb= 24.96* A649-7.32* A665 C类胡萝卜素= (1000*A470-2.05* Ca -114.8* Cb)/245 C总= A652*50/(34.5*m) Ca 为叶绿素a的浓度 M 为称样量