
泸州市高2013级一诊考试理科综合
化学试题
第Ⅰ卷
7.化学与生产、生活密切相关。下列说法不正确的是
A、利用蒸馏法可将海水淡化为饮用水
B、工业上用点燃H2、C12混合气体的方法生产盐酸
C、金属钠着火时可用干燥的沙土来灭火
D、驰名世界的中国瓷器是硅酸盐材料
8.下列说法正确的是
A.SO2和SO3均属于酸性氧化物
B.氨水和硫酸均属于电解质
C.HCl的电子式为:
D.Fe(OH)3胶体带正电
9.下列反应的离子方程式书写正确的是
A、NaHCO3溶液和盐酸;CO32—+2H+ ===== H2O+CO2↑
B、用稀硝酸洗涤试管内壁的银镜:Ag + 2H+ + NO3—=== Ag+ + NO↑+ H2O
C、向碳酸氢铵溶液中加过量的氢氧化钠溶液并加热:NH4+ + OH— NH3↑+ H2O
D、用MnS除去MnCl2溶液中的Cu2+:MnS+ Cu2+ === CuS + Mn2+
10.A、B、C、D均是短周期元素,其中A、D处于同一周期,B、C处于同一周期,A、D的最低价
离子分别为A2—和D—,B+和D—具有相同的电子层结构,元素C的简单离子是同周期元素中半径最小的。下列说法不正确的是
A、离子半径:A2—〉D—〉B+
B、元素B、C的最高价氧化物对应水化物的碱性:B〉C
C、简单氢化物的稳定性:A〉D
D、含元素C的盐溶液可能显酸性也可能显碱性
11.25℃时,下列说法不正确的是
A、0.lmo/L的H2S溶液中:c(HS—)+c(S2—)= 0.lmo/L
B、常温下,100 mL pH =2的盐酸与10 mL pH=13的NaOH溶液混合,所得溶液pH=7
C、0.lmo/L CH3COOa溶液和0.lmo/L KOH溶液等体积混合,混合溶液中浓度大小关系是:
c(K+) >c(CH3COO—) >c (OH—) >c(CH3COOH)
D、0.lmo/L的三种溶液: ①(NH4)2CO3②(NH4)2SO4③(NH4)2 Fe(SO4) 2
其c(NH4+)从大到小的顺序为:③②①
12.设N A为阿伏加德罗常数的值,下列叙述不正确的是
A、标准状况下,17gH2O2中含极性键的数目为N A
B、1L 1mo/L的Fe2(SO4)3溶液中含有的硫酸根离子数为3N A
C、标准状况下,11.2LN2和H2的混合气体中所含原子数为N A
D、5.6gFe溶于1L 0.3moL/L硝酸中,转移的电子数为0.3N A
13.利用下列装置能达到实验目的的是
A、①用于灼烧海带以提取碘
B、②用于验证非金属性:N〉C〉Si
C、③用于制取CO2
D、④用于除去CO2中少量的HC1杂质
第Ⅱ卷
(一)必考题
26.(14分)天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠有少量泄漏,可通过喷洒硫代硫酸钠
溶液来处理,以减轻污染。
(1)氰化钠(NaCN)溶液呈碱性,其原因是(用离子方程式解释)。
(2)氰化钠与硫代硫酸钠的反应为:NaCN + Na2S2O3 === NaSCN + Na2SO3;已知:NaSCN中S为-2
价,处理掉lmo lNaCN,碳原子失去电子的物质的量为。
某化学兴趣小组在实验室制备硫代硫酸钠,并探究用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
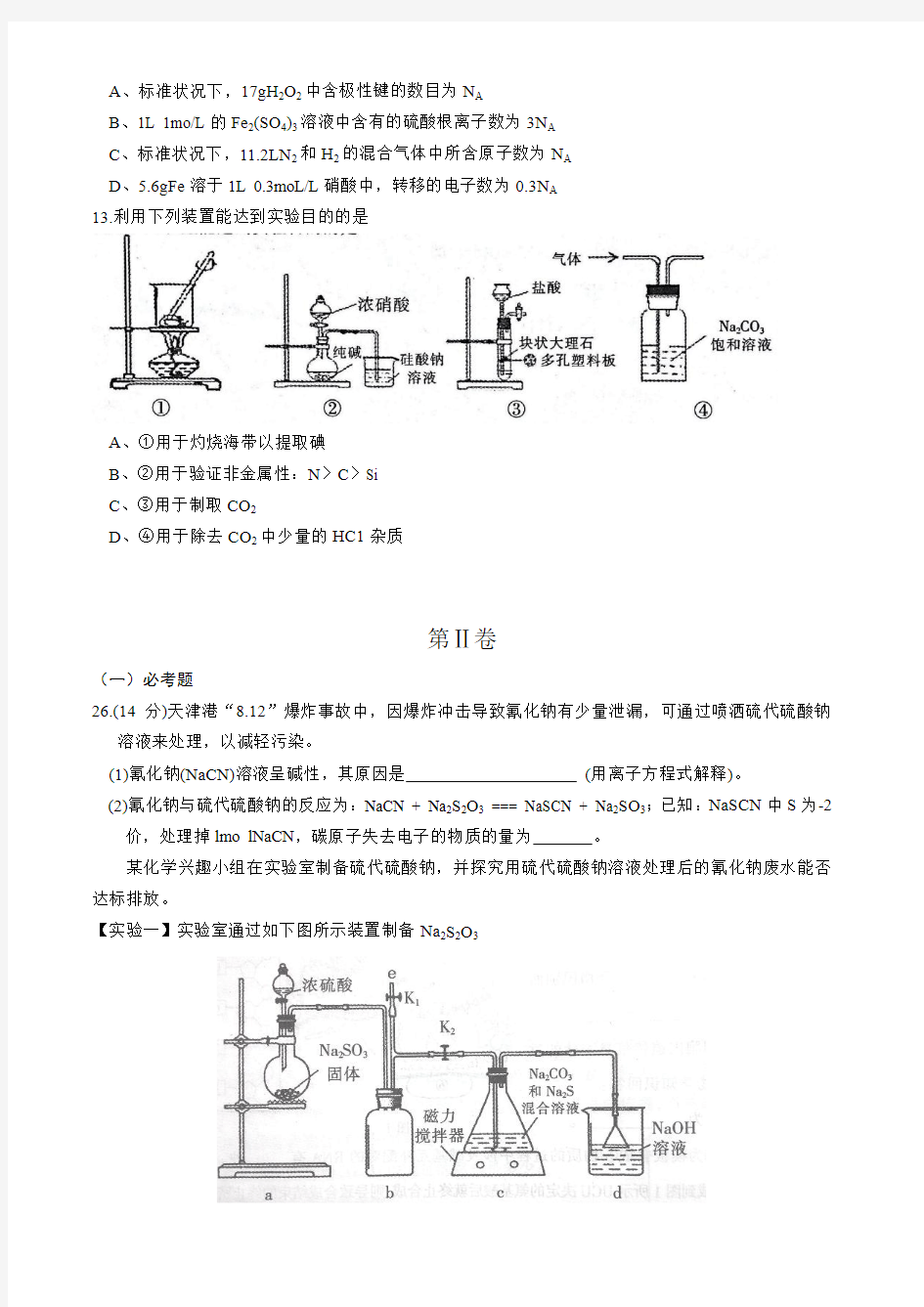
【实验一】实验室通过如下图所示装置制备Na2S2O3
(3)上图a 装置中盛装Na 2SO 3固体的仪器名称是 。
(4)b 装置的作用是 。
(5)装置c 中的产物有Na 2S 2O 3和CO 2气体等,实验后,装置d 中的溶质有NaOH 、Na 2CO 3,还可能有 、 。
(6)实验结束后,在e 处最好连接盛 (选填“NaOH 溶液”、“水”“CC14”中任一种)的注射器,再关闭K 2打开K 1,防止拆除装置时污染空气。
【实验二】已知:
①废水中氰化钠含量的最高排放标准为不超过0.5mg/L ;
②+22===[()]g +===g Ag CN Ag CN A I A I ++———,↓
;g A I 是黄色沉淀,且CN —优先与Ag +反应; 测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量,实验如下:
取25.00 mL 处理后的氰化钠废水于锥形瓶中;往锥形瓶中滴加几滴KI 溶液作指示剂;用0.0001 mol/L 的标准AgNO 3溶液滴定,平均消耗AgNO 3溶液的体积为2.50 mL 。
(7)滴定终点的判断依据是 ;
(8)处理后的废水中氰化钠的含量为 mg/L ,能否达标排放? (填“能”或“不能”)。
27.(14分)某含钴(Co)工业废料主要含有Co 2O 3,还含有少量Al 、A12O 3、Fe 等杂质,欲从该废料中制
得CoSO 4·7H 2O 晶体,其上艺流程如下:
请根据以上信息和流程图,回答下列问题:
(1)气体A 的化学式为 。
(2)写出步骤①中加碱液发生反应的离子方程式 、 。
(3)步骤②加入的稀酸是 。
(4)写出步骤②中Cu 2O 3与Na 2S 2O 3溶液发生反应的离子方程式 。
(5)若没有步骤③加入CoCO 3,这步操作,造成的后果是 。
(6)步骤④中加入CoCO 3能除去溶液中的Fe3+,其原因是 。
(7)步骤园中调节pH 为2~3的目的是 。
(8)步骤园中操作B 依次是 、 、过滤、洗涤、干燥等。
28.(15分)用甲烷和二氧化碳可以制备化工原料。
(1)一定温度下,向容积恒定为2L的密闭容器中通人3molCO2、3molCH4,发生如下反应:
CO2(g) +CH4 (g)
2CO (g) +2H2(g)
反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等。请回答下列问题:
①2min内,用H2来表示的反应速率v(H2)= ;
②此温度下该反应的平衡常数K= ;
③下列叙述可以作为该反应达到平衡状态的标志的是;(填选项字母)
A. v正(CH4) =2v 逆(H2)
B.容器内压强保持恒定不变
C.反应中断裂2mol C一H键同时消耗lmolH2
D.容器内混合气体的密度保持恒定不变
④已知:
则反应CO2(g) +CH4 (g)
2CO (g) +2H2(g) △H= 。
⑤为提高CH4的转化率,可以采取的措施是、(写两点)。
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸。
①在不同温度下乙酸的生成速率如图所示:
在250~400℃范围内,乙酸的生成速率随温度变化
的原因是
。
②250℃与400℃时乙酸的生成速率相近,请分析
判断实际生产选择的最佳温度是。
(二)选考题
36.【化学)(15分)氯化亚铜(CuCl)广泛应用于印染、电镀等化工行业,CuCl难溶于水。以火法炼铜的
尾气制备(NH4)2SO3,再以废旧印刷电路板(由铜和塑料制成)为原料生产CuCl,实验如下:
I.火法炼铜的原理为:
(1)上述反应中的氧化剂是(填化学式)。
(2)尾气用氨水吸收可以制取(NH4)2SO3,写出反应的化学方程式。
Ⅱ.用FeCl3溶液浸泡废旧印刷电路板,可回收其中的铜并制备CuCl。
步骤一;将废旧印刷电路板浸泡于100g、65%的FeCl3溶液中,充分反应后过滤,得滤液甲;
步骤二:向滤液甲中加人稀盐酸和H2O2溶液,充分反应得溶液乙;
步骤三:再向溶液乙中加入试剂a调节溶液pH,充分反应后过滤,得滤液丙和滤渣b;
步骤四:滤液丙中加入(NH4)2SO3溶液,得到CuCl产品。
请回答下列问题;
(3)步骤一用固体FeCl3配制100g、65%的FeCl3溶液,必须使用的仪器组合是(填选项字母)。
①托盘天平②烧杯③玻璃棒④50mL量筒
A.①② B. ①②③ C. ①②④ D. ①②③④
(4)欲检验步骤一之后所得溶液中的Fe2+,选择的试剂是(填选项字母)。
A.KSCN溶液
B.NaOH溶液
C.K3[Fe(CN)6]溶液
(5)步骤二实验中有较多气体产生,原因是①;该步骤选用H2O2的优点之一是不引人新的杂质离子,据此还叫以选用②代替,但改用该试剂的缺点是③。
(6)常温下,步骤三中可加入试剂a的化学式为①(任写一种),调节pH为②,Fe3+刚好沉淀完全。[已知Fe(OH)3的Ksp=4×10-38;化学上认为残留在溶液中的离子浓度小于10—5mol/L 时,沉淀已完全;lg2=0.3]
(7)步骤四反应的离子方程式为。
37.(本次未命制题))
38.(本次未命制题)
(本试卷由扫描版识别而来,如有错,请以扫描版为准!)