
3 物料衡算和热量衡算
3.1计算基准
年产4500吨的二氯甲烷氯化吸收,年工作日330天,每天工作24小时,每小时产二氯甲烷:
4500×103
330×24
=568.18kg/h
3.2物料衡算和热量衡算
3.2.1反应器的物料衡算和热量衡算
本反应为强放热反应,如不控制反应热并移走,温度会急剧升高,产生强烈的燃烧反应,是氯化物发生裂解反应。由此可以通过加入过量的甲烷得到循环气,以之作为稀释剂移走反应热。
(一)计算依据
(1)二氯甲烷产量为:568.18 kg/h,即:6.69 kmol/h;
(2)原料组成含: Cl2 96%,CH495%;
(3)进反应器的原料配比(摩尔比): Cl2:CH4:循环气=1:0.68:3.0 (4)出反应器的比例: CH2Cl2:CHCl3=1:0.5(质量比)
(CHCl3+CCl4)/CH2Cl2=0.38(摩尔比);
(5)操作压力: 0.08MPa(表压);
(6)反应器进口气体温度25o C,出口温度420o C。
CH3Cl
CH2Cl2
CHCl3
CCl4
HCl
假设循环气不参与反应,只起到带走热量的作用。则设进口甲烷为X kmol/h,出反应器的一氯甲烷Y kmol/h,氯化氢Z kmol/h。
由进反应器的原料配比(摩尔比)Cl2:CH4:循环气=1:0.68:3.0
原料组成含: Cl2 96%,CH495%。
可知:Cl2
96%
?
X
95%
?
=1
0.68
得进口Cl2为1.48X kmol/h
由CH2Cl2:CHCl3=1:0.5(质量比)
可得CHCl3每小时产量为:568.18×0.5/119.5=2.38kmol/h
由(CHCl3+CCl4)/CH2Cl2=0.38(摩尔比)
可得CCl4的量为0.38×6.69-2.38=0.162kmol/h
用元素守衡法
则:Cl元素守衡 2.96X=Y+6.69×2+2.38×3+0.162×4+Z ①
H 元素守衡4X=3Y+6.69×2+2.38+Z ②
C 元素守衡X=Y+6.69+2.38+0.162 ③解方程①①③得
X=24.87kmol/h
Y=15.64kmol/h
Z=36.81kmol/h
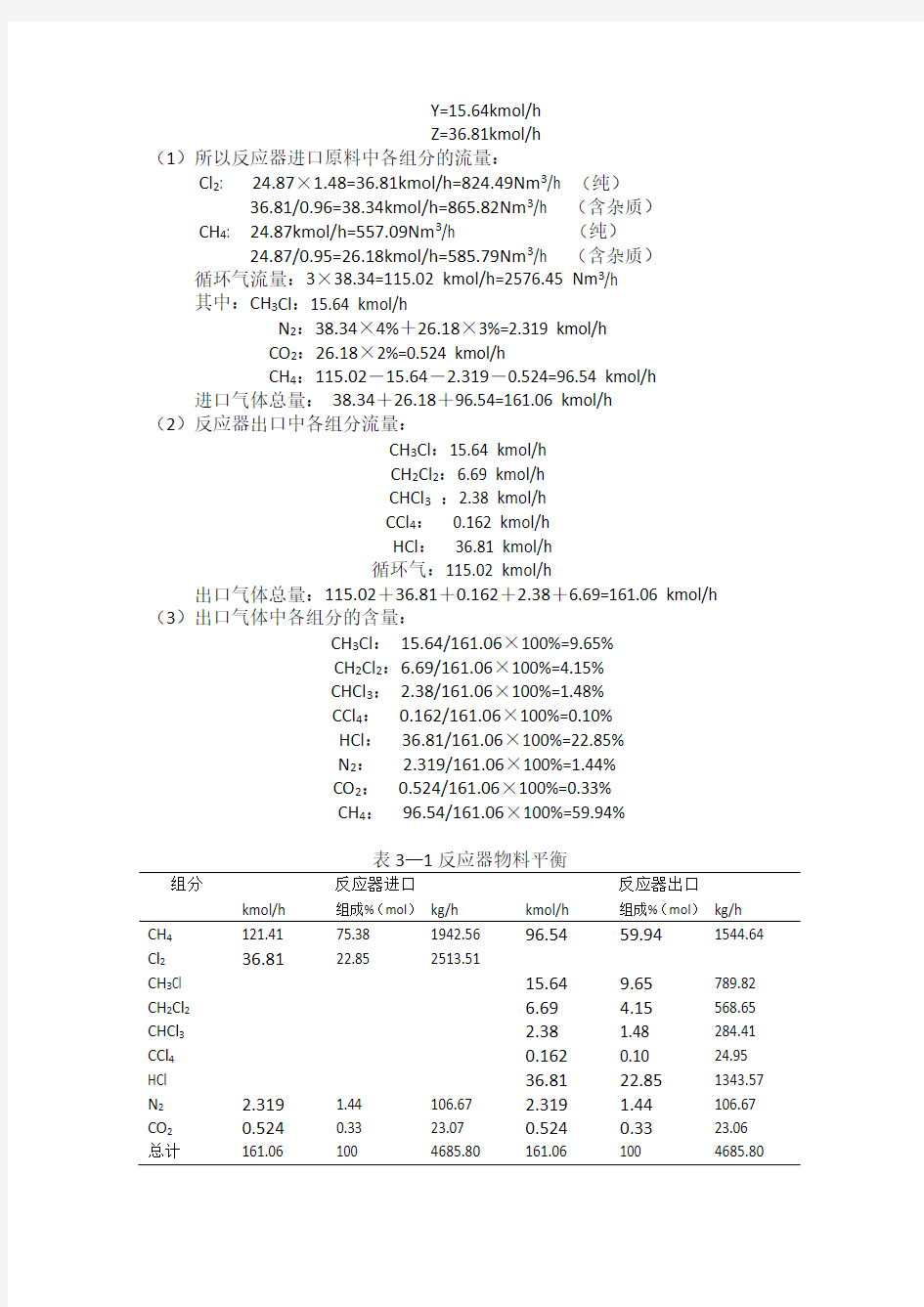
(1)所以反应器进口原料中各组分的流量:
Cl2: 24.87×1.48=36.81kmol/h=824.49Nm3/h (纯)
36.81/0.96=38.34kmol/h=865.82Nm3/h (含杂质)
CH4: 24.87kmol/h=557.09Nm3/h (纯)
24.87/0.95=26.18kmol/h=585.79Nm3/h (含杂质)
循环气流量:3×38.34=115.02 kmol/h=2576.45 Nm3/h
其中:CH3Cl:15.64 kmol/h
N2:38.34×4%+26.18×3%=2.319 kmol/h
CO2:26.18×2%=0.524 kmol/h
CH4:115.02-15.64-2.319-0.524=96.54 kmol/h 进口气体总量:38.34+26.18+96.54=161.06 kmol/h
(2)反应器出口中各组分流量:
CH3Cl:15.64 kmol/h
CH2Cl2:6.69 kmol/h
CHCl3:2.38 kmol/h
CCl4:0.162 kmol/h
HCl:36.81 kmol/h
循环气:115.02 kmol/h
出口气体总量:115.02+36.81+0.162+2.38+6.69=161.06 kmol/h (3)出口气体中各组分的含量:
CH3Cl:15.64/161.06×100%=9.65%
CH2Cl2:6.69/161.06×100%=4.15%
CHCl3:2.38/161.06×100%=1.48%
CCl4:0.162/161.06×100%=0.10%
HCl:36.81/161.06×100%=22.85%
N2: 2.319/161.06×100%=1.44%
CO2:0.524/161.06×100%=0.33%
CH4:96.54/161.06×100%=59.94%
表3—1反应器物料平衡
组分反应器进口反应器出口
kmol/h 组成%(mol)kg/h kmol/h 组成%(mol)kg/h CH4121.41 75.38 1942.56 96.5459.941544.64 Cl236.8122.85 2513.51
CH3Cl 15.649.65789.82 CH2Cl2 6.69 4.15568.65 CHCl3 2.38 1.48 284.41 CCl40.1620.10 24.95 HCl 36.8122.851343.57 N2 2.319 1.44 106.67 2.319 1.44106.67 CO20.5240.33 23.07 0.5240.3323.06 总计161.06 100 4685.80 161.06 100 4685.80
(三)热量衡算
以25℃为基准温度
由《氯碱工业理化常数手册》查得如下数据:
表3—2 反应物料标准摩尔生成焓Δf H m θ
/(kJ/mol )
Δf H m θ=∑生成物n Δf H m θ-∑反应物n Δf H m θ=-3.455×106 kJ
420℃时,由《氯碱工业理化常数手册》查得如下数据:
表3—3生成物的标准摩尔定压热容C p,m θ
/(J ﹒K -1﹒mol -1)
物质 CH 3Cl CH 2Cl 2
CHCl 3 CCl 4 HCl N 2 CO 2
n(kmol)
15.64 6.69 2.38 0.162 36.81 2.319 0.524
C p,m θ
66.07 45.975 88.287 98.887 29.96
30.65 52.27
Δt = 420-25=395℃ 输出焓:∑输出H = ∑n C p,m θ
Δt = 1.093×106 kJ 输入焓:∑输入H = 0
则放出的热量:Q 放出=Δf H m θ
+∑输出H+∑输入H=-2.362×106 kJ
222.5℃时,由《氯碱工业理化常数手册》查得如下数据:
表3—4 循环气各物质的标准摩尔定压热容C p,m θ
/(J ﹒K -1﹒mol -1) 物质 CH 4
CH 3Cl N 2 CO 2
n(kmol) 96.54 15.64 2.319 0.524 C p,m θ
49.62
54.83
30.81 53.43
循环气带出热量:Q 带出=∑n C p,m θ
Δt=2.27×106 kJ
考虑4%热损失,则2.362×106×(1-4%)=2.27 则Q 放出= Q 带出
循环气能带走的热量恰好为反应气放出的热量,是反应温度保持在420℃左右可以维持反应顺利进行。
3.2.2空冷器的物料衡算和热量衡算
由于气体温度太高,直接进入吸收器不利于氯化氢气体的吸收。因此,先用
空冷器冷却降温,以保证吸收的顺利进行。 (一)计算依据:
进口气体温度为420℃,组成和流量与反应器出口相同。 出口气体温度为80℃,操作压力为0.06MPa (表压)。 (二)热量衡算:
定性温度t=(420+80)/2=250℃
250℃时,由《氯碱工业理化常数手册》查得如下数据:
表3—5生成物的标准摩尔定压热容C p,m θ
/(J ﹒K -1﹒mol -1)
物质
CH 3Cl CH 2Cl 2 CHCl 3 CCl 4 HCl N 2 CO 2 CH 4 n(kmol) 15.64 6.69 2.38 0.162 36.81 2.319 0.524 96.54
C p,m θ
56.361 69.639 81.920 96.558 29.293 29.611 45.06 47.752
热负荷 Q=∑n C p,m θ
Δt=2.50×106 kJ
3.2.3模式吸收器的物料衡算和热量衡算
本次设计用两个石墨降膜吸收器串联吸收,气体经一膜吸收后再经二膜吸收,吸收剂水先经二膜吸收成稀酸再去一膜吸收成高浓度酸。
两膜吸收剂用量相同,惰性气体流量也相同,因此液气比L/V 也相同。 (一)第一膜式吸收器 (1) 计算依据
1、 一膜进口气体中氯化氢含量22.85%(摩尔),出口气体氯化氢含量8%,二膜出口气体氯化氢含量0.6%;
2、 一膜进口气体温度80℃,出口气体温度70℃,二膜出口气体温度60℃;
3、 吸收水温度42℃;
4、 进口气体组成同反应器出口;
5、 操作压力0.6MPa (表压);
6、 一膜出口酸浓度28%(质量),即16%(摩尔);
7、 冷却水进口温度25℃。 (2) 物料衡算
由一膜出口气体氯化氢含量8%
可知一膜出口气体总量为135.05 kmol/h ,含氯化氢10.80 kmol/h 由二膜出口气体氯化氢含量0.6%
可知二膜出口气体总量为125.00 kmol/h ,含氯化氢0.75 kmol/h
总共反应掉氯化氢量为36.06 kmol/h 由一膜出口酸浓度16%(摩尔) 则二膜出口酸浓度为5.04%
对并流高浓度气体吸收操作线方程为:
V(Y 1-Y 2)=L(X 1-X 2)
即:V(y 11?y 1
?y 21?y 2
)=L(x 11?x 1
?x
2
1?x 2
)
L V
=y 11?y 1?y 2
1?y 2
x 11?x 1?x 21?x 2
已知:V=161.06-36.81=124.25 kmol/h
x 1=0.16 x 2=0.0504 y 1=0.2285 y 2=0.08
则,需要的吸收剂用量:L=189.19kmol/h
吸收剂的单位耗用量:l=L/V=189.19/(161.06-36.81)=1.52
副产物盐酸的量:L 0=V 0(y 1-y 2)/(x 1-x 2)=161.06×(0.2285-0.006)/0.16=223.97 kmol/h 第一膜式吸收器
吸收氯化氢气体量:36.81-10.80=26.01 kmol/h 剩余气体总量:161.06-26.01=135.05kmol/h 出口气体中各组分的含量:
CH 3Cl : 15.64/135.05×100%=11.58% CH 2Cl 2:6.69/135.05×100%=4.95% CHCl 3: 2.38/135.05×100%=1.76% CCl 4: 0.162/135.05×100%=0.12% HCl : 10.80/135.05×100%=8.00% N 2: 2.319/135.05×100%=1.72% CO 2: 0.524/135.05×100%=0.39% CH 4: 96.54/135.05×100%=71.48%
表3—6第一膜式吸收器出口物料平衡
组分
第一模式吸收器出口
kmol/h
组成%(mol )
CH 4 96.54 71.48 CH 3Cl 15.64 11.58 CH 2Cl 2 6.69 4.95 CHCl 3 2.38 1.76 CCl 4 0.162 0.12 HCl 10.80 8.00 N 2 2.319 1.72 CO 2 0.524 0.39 总计
135.05
100
(3) 热量衡算
定性温度t=(70+80)/2=75℃
75℃时,由《氯碱工业理化常数手册》查得如下数据:
表3—7第一膜式吸收器出口气体的标准摩尔定压热容C p,m θ
/(J ﹒K -1﹒mol -1) 物质
CH 3Cl CH 2Cl 2
CHCl 3 CCl 4 HCl
N 2 CO 2 CH 4
n(kmol) 15.64
6.69 2.38 0.162 10.80 2.319 0.524 96.54 C p,m θ
44.55
56.11
71.25
88.93
28.86 28.77 38.32
37.21
θΔt=0.05×106 kJ
Q=∑n C p,m
42℃时,氯化氢溶解成16%的盐酸溶解热ΔH=9172.65kJ/kmol
Q溶解= L0ΔH=2.05×106kJ
Q总= Q+Q溶解=2.10×106kJ
假设冷却水温升8℃,则冷却水耗用量:
θ=75.291kJ/﹙kmol·K)
C
p,m,水
θ/8=3.49×103 kmol
W水=Q总/C
p,m,水
(二)第二膜式吸收器
(1)计算依据
1、进口气体组成同一膜出口气体组成;
2、进口气体温度70℃,出口气体温度60℃;
3、出口酸浓度5.04%;
4、吸收水温42℃,冷却水温度33℃;
5、操作压力0.036MPa(表压)。
(2)物料衡算
需要吸收剂的量与一膜相同L=189.19kmol/h
得到稀酸的量L0=V0(y1-y2)/(x1-x2)= 135.05(0.08-0.006)/0.0504=198.29 kmol/h 吸收剂单位耗用量l=L/V=1.52
被吸收的氯化氢气体量:10. 80-0.75=10.05 kmol/h
剩余气体总量:135.05-10.05=125.00 kmol/h
出口气体中各组分的含量:
CH3Cl:15.64/125.00×100%=12.51%
CH2Cl2:6.69/125.00×100%=5.35%
CHCl3:2.38/125.00×100%=1.90%
CCl4:0.162/125.00×100%=0.13%
HCl:0.75/125.00×100%=0.60%
N2: 2.319/125.00×100%=1.86%
CO2:0.524/125.00×100%=0.42%
CH4:96.54/125.00×100%=77.23%
表3—8第二膜式吸收器出口物料平衡
组分第二膜式吸收器吸收器出口
kmol/h 组成%(mol)
CH496.54 77.23
CH3Cl 15.64 12.51
CH2Cl2 6.69 5.35
CHCl3 2.38 1.90
CCl40.162 0.13
HCl 0.75 0.60
N2 2.319 1.86
CO20.524 0.42
总计125.00 100
(3) 热量衡算
定性温度t=(70+60)/2=65℃
65℃时,由《氯碱工业理化常数手册》查得如下数据:
表3—9第二膜式吸收器出口气体的标准摩尔定压热容C p,m θ
/(J ﹒K -1﹒mol -1) 物质
CH 3Cl CH 2Cl 2
CHCl 3 CCl 4 HCl
N 2 CO 2 CH 4
n(kmol) 15.64
6.69 2.38 0.162 0.75 2.319 0.524 96.54 C p,m θ
43.87
55.49
70.81
87.99 28.50 28.46 38.22
37.05
Q=∑n C p,m θ
Δt=0.05×106 kJ
42℃时,氯化氢溶解成5.04%的盐酸溶解热ΔH=3303.18kJ/kmol
Q 溶解= L 0ΔH=0.65×106kJ Q 总= Q +Q 溶解=0.7×106kJ
从一膜出来的冷却水逆流进入二膜,进口温度33℃ 其升温Δt= 0.7×106/(75.291×3.49×103)=2.66℃ 出口水温:33+2.66=35.66℃
3.2.4 中和塔(填料塔) (一)计算依据
(1)进塔气体组成同二膜出口气体组成;
(2)用20℃、15%的稀氢氧化钠溶液吸收,出塔碱浓度4%(质量); (3)出塔气体温度60℃;
(4)出口气体中无氯化氢和二氧化碳气体。 (二)物料衡算
入塔气体摩尔流量:W v =125.00 kmol/h
惰性气体摩尔流量:G 0=125.00-0.75-0.524=123.73 kmol/h
平均分子量M=50.5×12.51%+85×5.35%+119.5×1.90%+154×0.13%+
36.5×0.60%+28×1.86%+44×0.42%+16×77.23%
=26.62 则:
入塔气体质量流量:125.00×26.62=3327.5 kg/h
入塔气体密度:ρv =3327.5/(125.00×22.4)=1.19kg/m 3 15%和4%的氢氧化钠溶液转化为摩尔浓度: 15%(质量):0.1540
?
0.1540?+0.8518?×100%=7.35%(摩尔)
4%(质量):0.0440
?0.0440
?+0.9618?×100%=1.84%(摩尔)
氢氧化钠溶液消耗量:W l =(0.75+0.524×2)/(7.35%-1.84%)=32.63 kmol/h
出塔气体中无氯化氢气体和二氧化碳气体,但会带出3 kmol/h 的水蒸气
则总量为G 0=126.73 kmol/h
出口气体中各组分的含量:
CH 3Cl : 15.64/126.73×100%=12.34%
CH2Cl2:6.69/126.73×100%=5.28%
CHCl3:2.38/126.73×100%=1.88%
CCl4:0.162/126.73×100%=0.13%
N2: 2.319/126.73×100%=1.83%
CH4:96.54/126.73×100%=76.18%
H20: 3.00/126.73×100%=2.37%
表3—10中和塔(填料塔)出口物料平衡
组分吸收器出口
kmol/h 组成%(mol)CH496.54 76.18 CH3Cl 15.64 12.34 CH2Cl2 6.69 5.28 CHCl3 2.38 1.88 CCl40.162 0.13
N2 2.319 1.83
H20 3.00 2.37
总计126.73 100
物料衡算与能量衡算 5.1概述 工艺通过甲苯和甲醇采用纳米ZSM-5分子筛催化下通过烷基化反应制得对二甲苯,得到了高纯度的对二甲苯,并且在工艺流程中实现了甲苯和甲醇的循环利用,达到了经济环保的要求。 设计过程中利用Aspen Plus 对全流程进行模拟,并在此基础上完成物料衡算、能量衡算。以工段为单位进行物流衡算,全流程分为甲苯甲醇烷基化反应工段、闪蒸——倾析工段、脱甲苯工段、对二甲苯提纯工段。 5.2物料衡算 5.2.1物料衡算基本原理 系统的物料衡算以质量守恒为理论基础,研究某一系统内进出物料量及组成的变化,即: 系统累计的质量=输入系统的质量-输入系统的质量+反应生成的质量-反应消耗的质量 假设系统无泄漏: R R O U T IN C G F F dt dF -+-=/ 当系统无化学反应发生时: O U T IN F F dt dF -=/ 在稳定状态下: 0/=-=O U T IN F F dt dF ,O U T IN F F = 注:IN F —进入系统的物料流率; OUT F —流出系统的物料流率; R G —反应产生物料速率; R C —反应消耗物料速率。
5.2.2 物料衡算任务 通过对系统整体以及部分主要单元的详细物料衡算,得到主、副产品的产量、原料的消耗量、“三废”的排放量以及最后产品的质量指标等关键经济技术指标,对所选工艺路线、设计流程进行定量评述,为后阶段的设计提供依据。 5.2.3系统物料衡算 详见附录,物料衡算一览表。 5.3能量衡算 5.3.1基本原理 系统的能量衡算以能量守恒为理论基础,研究某一系统内各类型的能量的变化,即: 输入系统的能量=输出系统的能量+系统积累的能量 对于连续系统: ∑∑-=+IN O U T H H W Q 注:Q —设备的热负荷; W —输入系统的机械能; ∑OUT H —离开设备的各物料焓之和; ∑IN H —进入设备的各物料焓之和。 本项目的能量衡算以单元设备为对象,计算由机械能转换、化学反应释放能量和单纯的物理变化带来的热量变化。 5.3.2能量衡算任务 (1) 、确定流程中机械所需的功率,为设备设计和选型提供依据。 (2) 、确定精馏各单元操作中所需的热量或冷量及传递速率,确定加热剂和冷剂的用量,为后续换热和公用工程的设计做准备。 (3) 、确定反应过程中的热交换量,指导反应器的设计和选型。
第1章物料及热量衡算 本工艺采用草酸二甲酯和为原料制乙二醇,其中有未反应的、过量的氢气及中间产物乙醇酸甲酯。采用加氢反应合成并借助高效催化剂提高转化率和反应速率,在精馏分离工段中,利用复合式精馏塔进行多元物质的分离。 工艺流程的物料衡算以的流程模拟结果为基础所得到的。以工段为单位进行物料衡算,全流程分为两个工段:加氢反应工段、精馏分离工段。下面为两个工段的物流平衡表。 1.1物料衡算 1.1.1加氢反应工段 原料和经混合器混合后并在换热器中加热然后进入反应器中进行合成反应。 表 1-1 加氢反应工段的物料平衡表 项目MDO原料H2原料循环气粗乙醇温度℃165.00 70.00 40.00 40.00 压力bar 25.00 25.00 20.00 20.00 气化率0 1 1 0 质量流率kg/hr 1.19E+05 8.01E+03 1.38E+05 1.27E+05 DMO 1.19E+05 0 1.44E+00 2.37E+02 MG 0 0 2.48E+01 2.70E+03 EG 0 0 2.76E+01 6.07E+04 H2 0 8.01E+03 1.14E+05 5.98E-04
MEOH 0 2.37E+04 6.36E+04 质量分率 DMO 1 0 1.04E-05 1.86E-03 MG 0 0 1.80E-04 2.12E-02 EG 0 0 2.00E-04 4.77E-01 H2 0 1 8.27E-01 4.70E-09 MEOH 0 0 1.72E-01 5.00E-01 1.1.2精馏分离工段 反应所生成的乙二醇、甲醇以及中间产物和未完全反应的进入精馏分离工段进行精馏,此工段主要包括两个精馏塔。 表 1-2精馏工段物料平衡表 项目粗乙醇纯甲醇纯乙二醇回收原料温度℃40.00 15.00 171.62 104.61 压力bar 20.00 0.30 0.45 0.40 气化率0 0 0 0 质量流率 1.27E+05 6.36E+04 6.07E+04 2.99E+03 kg/hr DMO 2.37E+02 2.65E-10 7.34E+01 5.47E-02 MG 2.70E+03 1.69E-06 1.01E+02 8.68E-01 EG 6.07E+04 5.13E-23 6.05E+04 5.64E-02
第4章物料衡算与热量衡算 4.1 物料衡算 物料衡算即是利用物料的能量守恒定律对其进行前后操作后物料总量与产品以及物料损失状况的计算方法,也就是进入设备用于生产的物料总数恒等于产物与物料损失的总量。物料衡算与生产经济效益有着直接的关系。 物料衡算需要在知道产量和产品规格的前提下进行所需的原、辅材料量、废品量以及消耗量的计算。 物料衡算的意义: (1)知道生产过程中所需的热量或冷量; (2)实际动力消耗量; (3)能够为设备选型、台数、决定规格等提供依据; (4)在拟定原料消耗定额基础上,进一步计算日消耗量、时消耗量,能够为所需设备提供必要的基础数据。 4.1.1 年工作日的选取 (1)年工作时间365-11(法定节假日)=354×24=8496(小时) (2)设备大修 25天/年=600小时/年 (3)特殊情况停车 15天/年=360小时/年 (4)机头清理、换网过滤 6次/年 8小时/次 [354-(25+15)]×1/6次/天×8小时/次=396小时=16.5天=17天 (5)实际开车时间 365-11-25-15-17=297天 8496-600-360-396=7140小时 (6)设备利用系数 K=实际开车时间/年工作时间=7140/8496=0.84 4.1.2 物料衡算的前提及计算 (1)挤出成型阶段 物料衡算的前提是应在已知产品规格和产量的前提下进行许多原辅材料量、废品量及消耗量的计算。 1 已知:PVC片材的年生产量为28500吨,其中物料自然消耗率为0.1%,产品合格率为94%,回收率为90%。每年生产297天,二班轮流全天24小时生产。物料衡算如下: 年需要物料量 M=合格产品量/合格率=28500/0.94≈30319.15t 1年车间进料量 M= M/(1-物料自然消耗率)=30319.15t /(1-0.1%)≈30349.50t 12年自然消耗量M=M-M=30349.50-30319.15=30.35t 132年废品量 M=M-合格产品量=30319.15-28500=1819.15t 14每小时车间处理物料量 M=30319.15/297/24h≈4.25t 5年回收物料量
第 4 章物料衡算与热量衡算 4.1物料衡算物料衡算即是利用物料的能量守恒定律对其进行前后操作后物料总量与产品以及物料损失状况的计算方法,也就是进入设备用于生产的物料总数恒等于产物与物料损失的总量。物料衡算与生产经济效益有着直接的关系。 物料衡算需要在知道产量和产品规格的前提下进行所需的原、辅材料量、废品量以及消耗量的计算。 物料衡算的意义: (1)知道生产过程中所需的热量或冷量; (2)实际动力消耗量; (3)能够为设备选型、台数、决定规格等提供依据; (4)在拟定原料消耗定额基础上,进一步计算日消耗量、时消耗量,能够为所需设备提供必要的基础数据。 4.1.1 年工作日的选取 (1)年工作时间365-11 (法定节假日)=354×24=8496(小 时) (2)设备大修25 天/ 年=600 小时/ 年 (3)特殊情况停车15 天/年=360 小时/ 年 (4)机头清理、换网过滤6次/年8 小时/次 [354-(25+15)] ×1/6 次/天×8 小时/次=396小时=16.5 天=17 天(5 )实际开车时间 365-11-25-15-17=297 天8496-600-360-396=7140 小 时 (6 )设备利用系数 K= 实际开车时间/ 年工作时间=7140/8496=0.84 4.1.2 物料衡算的前提及计算 (1)挤出成型阶段物料衡算的前提是应在已知产品规格和产量的前提下进行许多原辅材 料量、废品量及消耗量的计算
已知:PVC 片材的年生产量为28500 吨,其中物料自然消耗率为 0.1% ,产品合格率为94%,回收率为90% 。每年生产297 天,二班轮流全天24 小时生产。物料衡算如下: 年需要物料量 M 1=合格产品量/合格率=28500/0.94 ≈30319.15t 年车间进料量 M2= M 1/(1-物料自然消耗率)=30319.15t / (1-0.1% ) ≈30349.50t 年自然消耗量 M3=M 2-M 1=30349.50-30319.15=30.35t 年废品量 M4=M 1-合格产品量=30319.15-28500=1819.15t 每小时车间处理物料量M 5=30319.15/297/ 24h≈4.25t 年回收物料量 M6=M 4×回收率=1819.15 ×90%≈1637.23t 新料量 M7=M 2-M 6=30349.50-1637.23=28712.27t 2)造粒阶段 ① 确定各岗位物料损失率塑化造粒工段物料损耗系数
化工中的物料衡算和能量衡算 化72 王琪2007011897 在化工原理的绪论课上,戴老师曾强调过化工原理的核心内容是“三传一反” 即传质、传动、传热和反应,而物理三大定律——质量守恒、动量守恒、能量守 恒正是三传的核心与实质,因此这三大定律在化工中统一成一种核心的方法:衡 算。正是衡算,使原本复杂的物理定律的应用变得简单,实用性强,更符合工程 学科的特点。为此化工中的物料衡算和能量衡算很重要,本文将分别从物料衡算、 能量衡算讨论化工中的衡算问题,然后将讨论二者结合的情况。 物料衡算在台湾的文献中称为“质量平衡”,它反映生产过程中各种物料 之间量的关系,是分析生产过程与每个设备的操作情况和进行过程与设备设计的 基础。一般来说物料衡算按下列步骤进行,为表示直观,做成流程图。 绘制流程图时应注意: 1.用简洁的长方形来表达一个单元,不必画蛇添足; 2.每一条物质流线代表一个真实的流质流动情况; 3.区别开放与封闭的物质流 4.区别连续操作与分批操作(间歇生产) 5.不必将太复杂的资料写在物质流线上 确定体系也比较重要,对于不同体系,衡算基准和衡算关系会有不同。 合适的基准对于衡算问题的简化很重要,根据过程特点通常有如下几种: 1.时间基准:连续生产,选取一段时间间隔如1s,1min,1h,1d;间歇生产以一釜或一批料的生产周期为基准,对于非稳态操作,通常以时间微元dt为基准。 2.质量基准,对于固相、液相体系,常采用此基准,如1kg,100kg,1t,1000lb
等。 3.体积基准(质量基准衍生):适用于气体,但要换成标准体积;适用于密度无变化的操作。 4.干湿基准:水分算在内和不算在内是有区别的,惯例如下: 烟道气:即燃烧过程产生的所有气体,包括水蒸气,往往用湿基; 奥氏分析:即利用不同的溶液来相继吸收气体试样中的不同组分从而得到气体组分,往往用干基。 化肥、农药常指湿基,而硝酸、盐酸等则指干基。 选取基准后,就要确定着眼物料了。通常既可从所有物料出发,也可根据具体情况,从某组分或某元素着眼。对于有化学反应的过程,参加反应的组分不能被选作着眼物料。 列物料衡算方程式时计算中要注意单位一致。列方程时,要注意:物料平衡是关于质量的平衡,而不是关于体积或者摩尔数的平衡。只有密度相同时才可列关于体积的方程,根据元素守恒可列相应的关于摩尔数的方程。 物料衡算方程的基本形式为:(以下均为质量,若密度不变,也可用体积或体积流速) 输入+产生=输出+积累+消耗。 对于无反应的物理过程,没有产生和消耗,所以输入=输出+积累,如果是稳态过程,积累=0,则方程变为:输入=输出。以下分别对特定的单元操作讨论物料衡算关系。 1.输送:连续性方程,进管液体=出管液体;进泵液体=出泵液体 2.过滤:总平衡:输入的料浆=输出的滤液+输入的滤饼; 液体平衡:料浆中的液体=滤液中的液体+滤饼中的液体 3.蒸发:原料液=积累+母液+晶体+水蒸气 其他过程类似。值得注意的是,如果对于每个组分列物料衡算方程,则总衡算方程不用列出,因为其不独立。一般来说,对于无反应的物理过程,如果有n 个组分,就可以列出n个方程。 对于有化学反应的过程,物料衡算要更复杂一些,因为反应中原子重新组合,消耗旧物质,产生新物质,所以每一个物质的摩尔量和质量流速不平衡。此外,在化学反应中,还涉及化学反应速率、转化率、产物的收率等因素。为了有利于反应的进行,往往一种反应物要过量。因此在进行反应过程的物料衡算时,应考虑以上因素。对于不参加反应的惰性物质列衡算方程通常比较方便。通常来讲,总质量衡算和元素衡算用得较多,组分衡算对于有化学反应的过程不可以用。 有化学反应的过程物料衡算通常有以下几种方法:直接计算法、利用反应速率进行物料衡算、元素衡算法、化学平衡常数法、结点衡算法、联系组分衡算法等。
3 物料衡算 依据原理:输入的物料量=输出的物料量+损失的物料量 3.1 衡算基准 年生产能力:2000吨/年 年开工时间:7200小时 产品含量:99% 3.2 物料衡算 反应过程涉及一个氧化反应过程,每批生产的产品相同,虽然有原料对叔丁基甲苯和溶剂甲苯的循环,第一批以后循环的物料再次进入反应,但每批加料相同。在此基础上,只要计算第一个批次的投料量,以后加料一样。 反应釜内加热时间2h、正常的反应时间18h、冷却时间1h。加上进料和出料各半个小时,这个生产周期一共2+18+1+1=22h。所以在正常的生产后,每22小时可以生产出一批产品。每年按300天生产来计算,共开工7200小时,可以生产327个批次。要求每年生产2000吨对叔丁基苯甲酸,则每批生产2000÷327=6.116吨。产品纯度99 %( wt %) 实际过程中为了达到高转化率和高反应速率,需要加入过量对叔丁基甲苯做溶剂,反应剩余的原料经分离后循环使用。 3.2.1 各段物料 (1) 原料对叔丁基甲苯的投料量 设投料中纯的对叔丁基甲苯为X kg,则由 C11H16C11H14O2 M 148.24 178.23 m x 6054.8 得x=6054.8×148.24÷178.23=5036.0 kg 折合成工业原料的对叔丁基甲苯质量为5036.0÷0.99=5086.9kg 实际在第一批生产过程加入的对叔丁基甲苯为6950.3kg (2)氧气的通入量 生产过程中连续通入氧气,维持釜内压力为表压0.01MPa,进行氧化反应。实
际生产过程中,现场采集数据结果表明,通入的氧气量为1556.8 kg,设反应消耗的氧气量为x kg 3/2O2C11H14O2 M 31.99 178.23 m x 6054.8 得x= 3/2×6054.8×31.99÷178.23=1630.1kg 此时采用的空气分离氧气纯度可达99%,因此折合成通入的氧气为1630.1÷0.99=1646.6 kg即在反应过程中,需再连续通入1646.6kg氧气。 (3)催化剂 催化剂采用乙酰丙酮钴(Ⅲ),每批加入量10.4 kg (4)水的移出量 设反应生产的水为x kg H2O C11H14O2 M 18.016 178.23 m x 6054.8 得x=6054.8×18.016÷178.23=612 kg 产生的水以蒸汽的形式从反应釜上方经过水分离器移出。 3.2.2 设备物料计算 (1)计量槽 对叔丁基甲苯计量槽: 一个反应釜每次需加入的对叔丁基甲苯质量为3475.1÷2=3475.15 kg 对叔丁基甲苯回收计量槽:每批反应结束后产生母液1834.8kg 甲苯计量槽:每批需加入甲苯做溶剂,加入量为396.1 kg (2)反应釜:反应结束后,经过冷却、离心分离后,分离出水612kg,剩余的对叔丁基甲苯1834.8kg循环进入下一批产品的生产。分离出来的固体质量为:6950.3+10.4+1646.6-612-1834.8=6160.5 kg 。 (3)进入离心机的物料:6950.3+10.4+1646.6-1834.8-612=6160.5kg (4)脱色釜:分离机分离出来的粗产品移入脱色釜,加入甲苯做溶剂,加入量为396.1 kg,搅拌升温将产品溶解,再加入76.5 kg活性碳进行脱色。进入
1 8.3干燥过程的物料衡算与热量衡算 干燥过程是热、质同时传递的过程。进行干燥计算,必须解决干燥中湿物料去除的水分量及所需的热空气量。湿物料中的水分量如何表征呢? 湿物料中的含水量有两种表示方法 1.湿基含水量w 湿物料总质量 湿物料中水分的质量= w kg 水/kg 湿料 2.干基含水量X 量 湿物料中绝干物料的质湿物料中水分的质量= X kg 水/kg 绝干物料 3.二者关系 X X w +=1w w X -=1 说明:干燥过程中,湿物料的质量是变化的,而绝干物料的质量是不变的。因此,用干基含 水量计算较为方便。 图8.7 物料衡算 符号说明: L :绝干空气流量,kg 干气/h ; G 1、G 2:进、出干燥器的湿物料量,kg 湿料/h ; G c :湿物料中绝干物料量,kg 干料/h 。 产品 G 2, w 2, (X 2), θ2 G 1, w 1, (X 1), θ1 L, t 2 , H 2
目的:通过干燥过程的物料衡算,可确定出将湿物料干燥到指定的含水量所需除去的水分量及所需的空气量。从而确定在给定干燥任务下所用的干燥器尺寸,并配备合适的风机。 1.湿物料的水分蒸发量W[kg 水/h] 通过干燥器的湿空气中绝干空气量是不变的,又因为湿物料中蒸发出的水分被空气带 走,故湿物料中水分的减少量等于湿物料中水分汽化量等于湿空气中水分增加量。即: [])]([][)(1221221121H H L W X X G w G w G G G c -==-=-=- 所以:1212221 1 2111w w w G w w w G G G W --=--=-= 2.干空气用量L[kg 干气/h] 1212) (H H W L H H L W -=∴-=Θ 令121H H W L l -== [kg 干气/kg 水] l 称为比空气用量,即每汽化1kg 的水所需干空气的量。 因为空气在预热器中为等湿加热,所以H 0=H 1,0 21211H H H H l -=-=,因此l 只与空气的初、终湿度有关,而与路径无关,是状态函数。 湿空气用量:)1(0'H L L += kg 湿气/h 或)1(0'H l l += kg 湿气/kg 水 湿空气体积:H s L V υ= m 3湿气/h 或H s l V υ=' m 3湿气/kg 水 通过干燥器的热量衡算,可以确定物料干燥所消耗的热量或干燥器排出空气的状态。作为计算空气预热器和加热器的传热面积、加热剂的用量、干燥器的尺寸或热效率的依据。 1.流程图 温度为,湿度为H 0,焓为的新鲜空气,经加热后的状态为t 1、H 1、I 1,进入干燥器与湿物料接触,增湿降温,离开干燥器时状态为t 2、H 2、I 2,固体物料进、出干燥器的流量为G 1、G 2,温度为θ1、θ2,含水量为X 1、X 2。通过流程图可知,整个干燥过程需外加热量有两处,预热器内加入热量Q p ,干燥器内加入热量Q d 。外加总热量Q =Q p +Q d 。将Q 折合
# 30000t/a12°淡色啤酒糖化车间物料衡算与热量衡算) 二次煮出糖化法是啤酒生产常用的糖化工艺,下面就以此工艺为基准进行糖化车间的热量衡算。由于没有物料数量等基础数据,因此,从物料计算开始。 已知物料定额的基础数据如表,绝对谷物的比热容为1.55Kj/kg*K, 12°麦汁在20℃时的相对密度为1.084,100℃时热麦汁的体积是20℃时的1.04倍;煮沸温度下(常压100℃)水的气化潜热为I=2257.2 Kj/kg,加热过程热损失取15%,0.3MPa的饱和水蒸气I=2725.2 Kj/kg,相应冷凝水的焓为561.47 Kj/kg,蒸汽热效率为0.95, I物料衡算 啤酒厂糖化车间的物料衡算主要项目为原料(麦芽、大米)和酒花用量,热麦汁和冷麦汁量,废渣量(糖化糟和酒花糟)等。 1.糖化车间工艺流程示意图 2.工艺技术指标及基础数据 我国啤酒生产现况决定了相应的指标,有关生产原料的配比、工艺指标及生产过程的损失等数据如上表所示。 根据基础数据,首先进行100kg原料生产12°淡色啤酒的物料计算,然后进行100L12°淡色啤酒的物料衡算,最后进行30000t/a啤酒厂糖化车间的物料平衡计算。 3. 100kg原料(75%麦芽,25%大米)生产12°淡色啤酒的物料计算 (1)热麦汁量 麦芽收率为:0.75(100-6)÷100=70.5% 大米受率为:0.92(100-13)÷100=80.04% 混合原料受得率为: (0.75×70.5%+0.25×80.04%)98.5%=71.79% 由此可得100kg混合原料可制得的12°热麦汁量为: (71.79÷12)×100=598.3kg 12°麦汁在20℃时的相对密度为1.084,而100℃热麦汁的体积是20℃时的1.04倍,故热麦汁(100℃)的体积为: (598.3÷1.084)×1.04=574 (L) (2)冷麦汁量为 574×(1-0.075)=531 (L) (3)发酵液量为: 531×(1-0.016)=522.5 (L) (4)过滤酒量为:
物料衡算和热量衡算 物料衡算 根据质量守恒定律,以生产过程或生产单元设备为研究对象,对其进出口处进行定量计算,称为物料衡算。通过物料衡算可以计算原料与产品间的定量转变关系,以及计算各种原料的消耗量,各种中间产品、副产品的产量、损耗量及组成。 物料衡算的基础 物料衡算的基础是物质的质量守恒定律,即进入一个系统的全部物料量必等于离开系统的全部物料量,再加上过程中的损失量和在系统中的积累量。 ∑G1=∑G2+∑G3+∑G4 ∑G2:——输人物料量总和; ∑G3:——输出物料量总和; ∑G4:——物料损失量总和; ∑G5:——物料积累量总和。 当系统内物料积累量为零时,上式可以写成: ∑G1=∑G2+∑G3 物料衡算是所有工艺计算的基础,通过物料衡算可确定设备容积、台数、主要尺寸,同时可进行热量衡算、管路尺寸计算等。 物料衡算的基准 (1)对于间歇式操作的过程,常采用一批原料为基准进行计算。 (2)对于连续式操作的过程,可以采用单位时间产品数量或原料量为基准进行计算。物料衡算的结果应列成原材料消耗定额及消耗量表。 消耗定额是指每吨产品或以一定量的产品(如每千克针剂、每万片药片等)所消耗的原材料量;而消耗量是指以每年或每日等时间所消耗的原材料量。 制剂车间的消耗定额及消耗量计算时应把原料、辅料及主要包装材料一起算入。 热量衡算 制药生产过程中包含有化学过程和物理过程,往往伴随着能量变化,因此必须进行能量衡算。又因生产中一般无轴功存在或轴功相对来讲影响较小,因此能量衡算实质上是热量衡算。生产过程中产生的热量或冷量会使物料温度上升或下降,为了保证生产过程在一定温度下进行,则外界须对生产系统有热量的加入或排除。通过热量衡算,对需加热或冷却设备进行热量计算,可以确定加热或冷却介质的用量,以及设备所需传递的热量。 热量衡算的基础
物料衡算和热量衡算 以下计算部分将对石灰石-石膏法的脱硫工艺进行物料衡算、热量衡算、反应器的设计和换热器的设计等具体的步骤 物料衡算简化运算条件:物料衡算主要针对脱硫装置系统(即喷淋塔)和制浆系统(石灰石浆液)来进行的,两个系统之间来联系的纽带是在脱硫塔内进行的脱硫反应,即钙硫比(Ca/S)(选择为1.02,下面将详细论述)。以下条件在计算方法中被简化 (1)不包括吸收塔的损失 (2)假设烟气带入的粉尘为零 (3)假设工艺水和石灰石不含杂质 (4)假设原烟气和净烟气没有夹带物代入和带出系统 (5)假设没有除雾器冲洗水 (6)假设没有泵的密封水 (7)假设工艺系统是封闭的,没有环境物质的进入和流出 3.1吸收系统物料衡算和相关配置 喷淋塔内主要进行脱硫反应,由锅炉引风压机引来的烟气,经过增压风机升压后,从吸收塔中下部进入吸收塔,脱硫除雾后的净烟气从吸收塔顶部侧向离开吸收塔,塔的下部为浆液池。 前面已经详细地介绍了脱硫反应的机理,由此可知反应的物料比例为 CaCO3s Ca s 1.02S s 1.02SO2 1.02 : 1.02 : 1 : 1 设原来烟气二氧化硫SO2质量浓度为 a (mg/m3),根据理想气体状态方程 PV二nRT 可得:7700mg/m3273K amg/m3(273 145)K 求得: 4 4 a=1.18X 104mg/m4 而原来烟气的流量(145C时)为20X 104(m3/h)换算成标准状态时(设为V a) 200000m3/h (145 273)K V a273K 求得 V a=1.31 X 105 m3/h=36.30 m3/s 故在标准状态下、单位时间内每立方米烟气中含有二氧化硫质量为
第三节 干燥过程的物料衡算和热量衡算 对干燥流程的设计中,物料衡算解决的问题: (1)物料气化的水分量W (或称为空气带走的水分量); (2)空气的消耗量(包括绝干气消耗量L 和新鲜空气消耗量L 0)。 而热量衡算的目的,是计算干燥流程的热能耗用量及各项热量分配(即预热器换热量 p Q ,干燥器供热量D Q 及干燥器热损失L Q )。 一、湿物料中含水率表示法 湿物料=水分+绝干物料 (一)湿基含水量w %100?= 总质量 水 m m w (8-12) 工业上常用这种方法表示湿物料的含水量。 (二)干基含水量X X =湿物料中水分质量/湿物料中绝干料质量 (8-13) 式中 X ――湿物料的干基含水量,kg 水分.(kg 绝干料)-1。 两者关系: X X w += 1 (8-14) 或 w w X -= 1 (8-15)
二、干燥器的物料衡算 图8-7 各流股进、出逆流干燥器的示意图 图8-7中,G ――绝干物料流量,kg 绝干料.s -1; L ――绝干空气消耗量,kg 绝干气.s -1; H 1 ,H 2――分别为湿空气进、出干燥器时的湿度,kg.(kg 绝干气)-1; G 1 ,G 2――分别为湿物料进、出干燥器时的流量,kg 湿物料.s -1; X 1 ,X 2――分别为湿物料进、出干燥器时的干基含水量,kg 水分.(kg 绝干料)-1。 (一)水分蒸发量W )()(122121H H L G G X X G W -=-=-= (8-16) 其中 )1()1(2211w G w G G -=-= (8-17) (二)空气消耗量L 对干燥器作水分物料衡算:2211GX LH GX LH +=+ 则: ()121221H H W H H X X G L -= --= (8-18) 若设: 121 H H W L l -= = (8-19) 式中 l ――每蒸发1kg 水分消耗的绝干空气量,称为单位空气消耗量,kg 绝干 气.(kg 水分)-1; L ――单位时间内消耗的绝干空气量,kg 绝干气.s -1。
干燥过程的物料衡算和热量衡算.
第三节 干燥过程的物料衡算和热量衡算 对流干燥过程利用不饱和热空气除去湿物料中的水分,所以常温下的空气通常先通过预热器加热至一定温度后再进入干燥器。在干燥器中热空气和湿物料接触,使湿物料表面的水分气化并将水气带走。在设计干燥器前,通常已知湿物料的处理量、湿物料在干燥前后的含水量及进入干燥器的湿空气的初始状态,要求计算水分蒸发量、空气用量以及干燥过程所需热量,为此需对干燥器作物料衡算和热量衡算,以便选择适宜型号的风机和换热器。 7-3-1 物料中含水量的表示方法 1.湿基含水量 湿物料中所含水分的质量分率称为湿物料的湿基含水量。 湿物料总质量 湿物料中水分的质量=w (7-21) 2.干基含水量 不含水分的物料通常称为绝对干料或干料。湿物料中水分的质量与绝对干料质量之比,称为湿物料的干基含水量。 量 湿物料中绝对干物料质湿物料中水分的质量=X (7-22) 上述两种含水量之间的换算关系如下: w w X -=1 kg 水/kg 干物料 X X w +=1 kg 水/kg 湿物料 (7-23) 工业生产中,通常用湿基含水量来表示物料中水分的多少。但在干燥器的物料衡算中,由于干燥过程中湿物料的质量不断变化,而绝对干物料质量不变,故采用干基含水量计算较为方便。 7-3-2 干燥器的物料衡算 通过物料衡算可求出干燥产品流量、物料的水分蒸发量和空气消耗量。对图7-8所示的连续干燥器作物料衡算。 设 G 1——进入干燥器的湿物料质量流量,kg/s ; G 2——出干燥器的产品质量流量,kg/s ; G c ——湿物料中绝对干料质量流量,kg/s ; w 1,w 2——干燥前后物料的湿基含水量,kg 水/kg 湿物料;
3 物料衡算和热量衡算 3.1计算基准 年产4500吨的二氯甲烷氯化吸收,年工作日330天,每天工作24小时,每小时产二氯甲烷: 4500×103 330×24 =568.18kg/h 3.2物料衡算和热量衡算 3.2.1反应器的物料衡算和热量衡算 本反应为强放热反应,如不控制反应热并移走,温度会急剧升高,产生强烈的燃烧反应,是氯化物发生裂解反应。由此可以通过加入过量的甲烷得到循环气,以之作为稀释剂移走反应热。 (一)计算依据 (1)二氯甲烷产量为:568.18 kg/h,即:6.69 kmol/h; (2)原料组成含: Cl2 96%,CH495%; (3)进反应器的原料配比(摩尔比): Cl2:CH4:循环气=1:0.68:3.0 (4)出反应器的比例: CH2Cl2:CHCl3=1:0.5(质量比) (CHCl3+CCl4)/CH2Cl2=0.38(摩尔比); (5)操作压力: 0.08MPa(表压); (6)反应器进口气体温度25o C,出口温度420o C。 CH3Cl CH2Cl2 CHCl3 CCl4 HCl 假设循环气不参与反应,只起到带走热量的作用。则设进口甲烷为X kmol/h,出反应器的一氯甲烷Y kmol/h,氯化氢Z kmol/h。 由进反应器的原料配比(摩尔比)Cl2:CH4:循环气=1:0.68:3.0 原料组成含: Cl2 96%,CH495%。 可知:Cl2 96% ? X 95% ? =1 0.68 得进口Cl2为1.48X kmol/h 由CH2Cl2:CHCl3=1:0.5(质量比) 可得CHCl3每小时产量为:568.18×0.5/119.5=2.38kmol/h 由(CHCl3+CCl4)/CH2Cl2=0.38(摩尔比) 可得CCl4的量为0.38×6.69-2.38=0.162kmol/h 用元素守衡法 则:Cl元素守衡 2.96X=Y+6.69×2+2.38×3+0.162×4+Z ① H 元素守衡4X=3Y+6.69×2+2.38+Z ② C 元素守衡X=Y+6.69+2.38+0.162 ③解方程①①③得 X=24.87kmol/h
3 物料衡算和热量衡算 3.1计算基准 年产4500吨的二氯甲烷氯化吸收,年工作日330天,每天工作24小时,每小时产二氯甲烷: 4500×103 330×24 =568.18kg/h 3.2物料衡算和热量衡算 3.2.1反应器的物料衡算和热量衡算 本反应为强放热反应,如不控制反应热并移走,温度会急剧升高,产生强烈的燃烧反应,是氯化物发生裂解反应。由此可以通过加入过量的甲烷得到循环气,以之作为稀释剂移走反应热。 (一) 计算依据 (1) 二氯甲烷产量为:568.18 kg/h ,即:6.69 kmol/h ; (2) 原料组成含: Cl 2 96%,CH 495%; (3) 进反应器的原料配比(摩尔比): Cl 2:CH 4:循环气=1:0.68:3.0 (4) 出反应器的比例: CH 2Cl 2:CHCl 3=1:0.5(质量比) (CHCl 3+CCl 4)/CH 2Cl 2=0.38(摩尔比); (5) 操作压力: 0.08MPa (表压); (6) 反应器进口气体温度 25o C ,出口温度420o C 。 3Cl 2Cl 2 3 4 假设循环气不参与反应,只起到带走热量的作用。则设进口甲烷为X kmol/h ,出反应器的一氯甲烷 Y kmol/h ,氯化氢 Z kmol/h 。 由进反应器的原料配比(摩尔比) Cl 2:CH 4:循环气=1:0.68:3.0 原料组成含: Cl 2 96%,CH 495%。 可知:Cl296%? X 95%?=1 0.68 得进口Cl 2为1.48X kmol/h 由 CH 2Cl 2:CHCl 3=1:0.5(质量比) 可得 CHCl 3每小时产量为:568.18×0.5/119.5=2.38kmol/h 由 (CHCl 3+CCl 4)/CH 2Cl 2=0.38(摩尔比) 可得 CCl 4的量为 0.38×6.69-2.38=0.162kmol/h 用元素守衡法 则: Cl 元素守衡 2.96X=Y+6.69×2+2.38×3+0.162×4+Z ① H 元素守衡 4X=3Y+6.69×2+2.38+Z ② C 元素守衡 X=Y+6.69+2.38+0.162 ③ 解方程①①③得 X=24.87kmol/h
第三节 干燥过程的物料衡算和热量衡算 对干燥流程的设计中,物料衡算解决的问题: (1)物料气化的水分量W (或称为空气带走的水分量); (2)空气的消耗量(包括绝干气消耗量L 和新鲜空气消耗量L 0)。 而热量衡算的目的,是计算干燥流程的热能耗用量及各项热量分配(即预热器换热量 p Q ,干燥器供热量D Q 及干燥器热损失L Q )。 一、湿物料中含水率表示法 湿物料=水分+绝干物料 (一)湿基含水量w %100?= 总质量 水 m m w (8-12) 工业上常用这种方法表示湿物料的含水量。 (二)干基含水量X X =湿物料中水分质量/湿物料中绝干料质量 (8-13) 式中 X ――湿物料的干基含水量,kg 水分.(kg 绝干料)-1。 两者关系: X X w += 1 (8-14) 或 w w X -= 1 (8-15)
二、干燥器的物料衡算 图8-7 各流股进、出逆流干燥器的示意图 图8-7中,G ――绝干物料流量,kg 绝干料.s -1; L ――绝干空气消耗量,kg 绝干气.s -1; H 1 ,H 2――分别为湿空气进、出干燥器时的湿度,kg.(kg 绝干气)-1; G 1 ,G 2――分别为湿物料进、出干燥器时的流量,kg 湿物料.s -1; X 1 ,X 2――分别为湿物料进、出干燥器时的干基含水量,kg 水分.(kg 绝干料)-1。 (一)水分蒸发量W )()(122121H H L G G X X G W -=-=-= (8-16) 其中 )1()1(2211w G w G G -=-= (8-17) (二)空气消耗量L 对干燥器作水分物料衡算:2211GX LH GX LH +=+ 则: ()121221H H W H H X X G L -= --= (8-18) 若设: 121 H H W L l -= = (8-19) 式中 l ――每蒸发1kg 水分消耗的绝干空气量,称为单位空气消耗量,kg 绝干气.(kg 水分)-1;
第二章硫酸干吸系统设计的计算2.1 干燥塔物料计算[16] 2.1.1 干燥塔入口炉气成分 表2.1 转化气进口气体成分 表2.2 电除雾器出口气体成分
2419.05 2.1.2 干燥塔入口炉气含水量 设补加空气全部在电除雾器之后加入,空气温度20摄氏度、相对湿度75%,由湿含图查得水含量为103 干空气,则补加空气带水量为: g/m 2419.05×0.01=24.19kg/h=1.34kmol/h=30.8m3/h 2.1.3 干燥塔入口气体带水 设出塔气体中含水量为3 0.1g/m,则干燥后气体带水量为: (0.1÷1000)×19372.98=1.94kg/h 2.1.4 循环酸量 决定循环酸量的方法一般有两种,一种是根据进出口酸浓度差决定,酸浓度差一般选在0.2%~0.4%范围内,第二个是根据塔的喷淋密度来决定,喷淋密度一般选在14~20m3/(m2·h)的范围内。在这里采用浓度差计算循环酸量。 H SO比重 1.7993 入塔酸:浓度93.00% 24 m/h 温度50O C 酸量x3 出塔酸:浓度92.7% 干燥塔吸收水量=(1115.81+24.19)-1.94=1138.06kg/h 由物料平衡得:X×1.7993×1000×93%=(X×1.7993×1000+1146)×92.7% X=195.44m3/h 所以采用扬量为200m3/h酸泵,型号为IHIHF125-100-250酸泵。 2.2 干燥塔热量衡算 2.2.1 炉气带入热量Q1 t=40O C时 SO2带入热量:q1=76.98×40×41.57=127997.80KJ/h O2带入热量:q2=69.28×40×29.37=81389.60KJ/h
第 4 章物料衡算与热量衡算 4.1 物料衡算物料衡算即是利用物料的能量守恒定律对其进行前后操作后物料总量与产品以及物料损失状况的计算方法,也就是进入设备用于生产的物料总数恒等于产物与物料损失的总量。物料衡算与生产经济效益有着直接的关系。物料衡算需要在知道产量和产品规格的前提下进行所需的原、辅材料量、废品量 以及消耗量的计算。 物料衡算的意义: ( 1) 知道生产过程中所需的热量或冷量; ( 2) 实际动力消耗量; ( 3) 能够为设备选型、台数、决定规格等提供依据; ( 4) 在拟定原料消耗定额基础上,进一步计算日消耗量、时消耗量,能够为所需设备提供必要的基础数据。 4.1.1 年工作日的选取 (1)年工作时间365-11 (法定节假日)=354X 24=8496 (小时) (2)设备大修25 天/年=600小时/年 (3)特殊情况停车15 天/年=360小时/ 年 ( 4)机头清理、换网过滤 6 次/ 年8 小时/ 次 [354-(25+15)] X 1/6 次/ 天X 8 小时/ 次=396小时=16.5 天=17 天 ( 5)实际开车时间 365-11-25-15-17=297天 8496-600-360-396=7140小时 ( 6)设备利用系数 K=实际开车时间/年工作时间=7140/8496=0.84 4.1.2 物料衡算的前提及计算 ( 1 )挤出成型阶段 物料衡算的前提是应在已知产品规格和产量的前提下进行许多原辅材料量、废品量及消耗量的计算。 1 已知:PVC片材的年生产量为28500吨,其中物料自然消耗率为0.1%,产品合格率为94%,回收率为90%。每年生产297天,二班轮流全天24小时生产。物料衡算如下:年需要物料量 M=合格产品量/合格率=28500/0.94"30319.15t 1年车间进料量 M= M/ (1-物料自然消耗率)=30319.15t /(1-0.1%)"30349.50t 12年自然消耗量M=M- M=30349.50-30319.15=30.35t132 年废品量 M=M -合格产品量=30319.15-28500=1819.15t14每小时车间处理物料量 M=30319.15/297/24h"4.25t 5年回收物料量 M=M X 回收率=1819.15X 90%~ 1637.23t 46 新料量 M=M -M=30349.50-1637.23=28712.27t 627 合格率94%合格产品量28500t