
磷酸化蛋白之western blot检测操作细节和注意事项
1.一定要在lysis buffer中加入蛋白酶抑制剂(配方见后页),还要加入一定量的磷酸酶抑制
剂,否则即使band压出来也会很浅,结果也不可信。
2.加一抗后最好4度过夜,保证抗体有充分的结合时间。因为磷酸化的蛋白只占总的蛋白量
的极少部分。4度也可使一抗重复使用多次(站长注:可加入防腐剂,如叠氮钠,Proclin TM 等,保存时间更长)。毕竟磷酸化的抗体都挺贵的。二抗则室温1小时即可。
3.磷酸化抗体的好坏是一个关键因素,所以要选择好的厂商。个人认为,Cell signaling公司
做的磷酸化抗体不错,尤其是MAPKs磷酸化抗体
4.最好根据厂商的protocol来操作实验,这是实验成功的保证。如Cell signaling会建议用
含5%BSA的TBST稀释phospho-p38等抗体,效果不错,而不是用常见的含5%non-fat milk的TBST。
5.抗体的稀释倍数也要适当。不同厂商也会有不同要求。
6.研究完某一蛋白的磷酸化情况后最好也要研究一下该蛋白总的表达量。如压完phospho-p
38抗体后,我会把相同的membrane做strip后再压p38,然后再strip一次,再压内标acti n。
7.做磷酸化蛋白WB时,除了目标蛋白的band以外,往往会出现非特异性的band.磷酸化抗体
不好的话,甚至会压出非特异性的band,而没有你想要的band,所以压片以后,你一定要根据markers比对一下,你压出的band分子量是否正确.我以前压WB时,压出了一条band,就以为是我想要的那条,然后还根据趋势推测可能的机制,走了不少怨枉路.还有一次,把markers 的分子量记错了,比对出来的结果当然也不对.
8.磷酸化蛋白WB时backgroud也往往较深,所以压片时间要适当,不能太长或过短,太长则b
ackgroud太深盖住想要的那条band,时间过短则可能没有band或者band太浅.
9.磷酸化蛋白WB时,用TBST洗时也要注意一下,摇床的转速不要太快,洗的时间不要太长,孵
育一抗和二抗之后分别洗5min 3次即可,宁愿background深一些,总比做不出来强得多.另外,洗的时候,最好不要把几张membrane叠在一起洗。
10.正如第5点所说的,"研究完某一蛋白的磷酸化情况后最好也要研究一下该蛋白总的表达量
“。这有两种方法,一是:相同的sample在不同的well中上样两次(可在相同的gel上,也可在不同的gel),其一压磷酸化蛋白,另一压该蛋白总的表达量(包括磷酸化和未磷酸化的该蛋白),甚至还可跑另一个gel,压内标。但是本人不建议如此做,因为这样比较时误差还是较大的。因此,比较公认的,本人也建议如此的方法,即:将原先结合上的磷酸化抗体及二抗用strip solution洗去,
11.方法如下:50度水浴30min后,用TBST洗5分钟,3次即可去除已孵育结合的抗体。许多
人会建议55度水浴30min。Strip solution是用来去除已结合的抗体,但也会去除部分的蛋白,导致蛋白信号变弱。我本人经实验发现水浴时有时温度不稳定,温度定为55度时往往其温度容易超过,导致较多的蛋白也被去除,故建议温度设为50度30min,既能有效去除已结合的抗体,又比55度更能保护蛋白.
12.Strip时一定要注意:membrane一定要完全泡在strip solution中(可用较硬的塑料膜封
好),然后要完全浸入水中,使受热均匀。这一点很重要,要不然,随后压出来的总蛋白也好,内标也好就会不均一,无法进行比较。我曾将同一张membrane用我提供的方法strip 了3次,分别压不同的抗体(因为有时候蛋白分子量很接近),效果都不错。
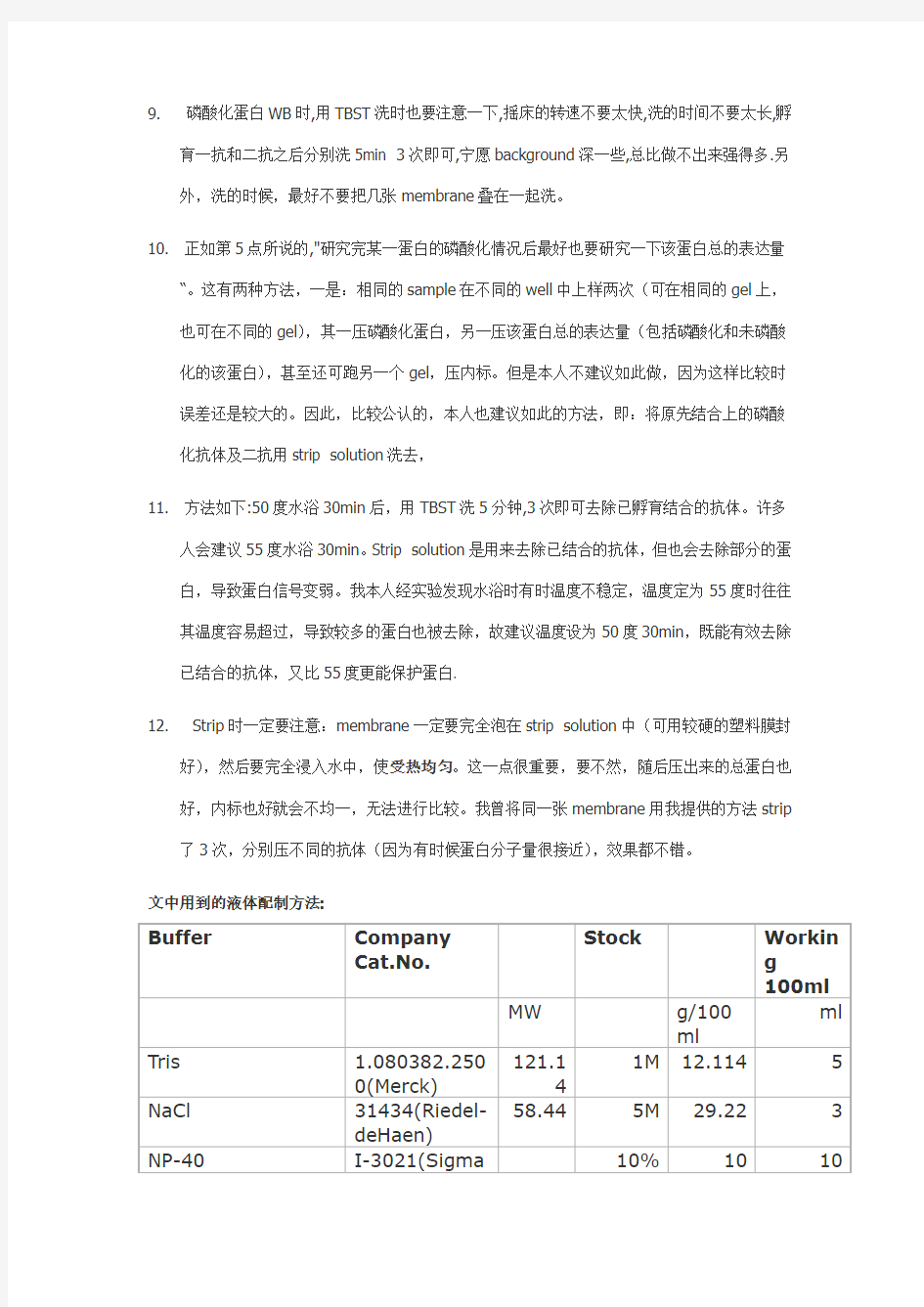
文中用到的液体配制方法:
注意事项:
Na3VO4要活化
Activation of Sodium OrthoVanadate
(1). Make Sodium orthovanadate to 200mM in ddH2O.
用ddH2O配制200mM浓度的原矾酸钠(100ml ddH2O中加入3.68克)
(2). Adjust pH to 10.0 with 1M NaOH or 1M HCl (the starting pH varies depending on t he lot of the chemical). At pH 10.0 the solution is yellow.
用1M NaOH 或1M HCl调整pH值至10.0,此时溶液呈黄色。
(3). Boil the solution until it turns colorless (about 10 mins).
煮沸直到溶液变为无色。
(4). Allow solution to cool to room temperature.
冷却至室温.
(5). Readjust pH to 10.0 and repeat steps 3 & 4 until the solution remains colorless an
d th
e pH stabilizes at 10.0. Store in aliquots at -20 o C.
重复3-4步,直到变为无色且pH值稳定至10.0,分装保存在-20 o C。
NOTE: Activation depolymerizes the vanadate, converting it to a more potent
inhibitor of protein tyrosine phosphatases. See: Gordon J. Methods Enzymol. 1991, 201:4 77-82.
●原作中关于钒酸钠贮存液浓度是1M,按照上述活化流程,在此改为200mM,因此配制1
00ml总裂解液时其体积加至0.5ml,以保证终浓度的不变
●配方配的是100ml 细胞裂解液,但各个成分的体积加起来,会发现total=102.1ml,那是因为
这些成分加在一起后总体积会缩小的.
Stripping Solution(Stripping Buffer,膜再生液)
100mM 2-mercaptoethanol (stock 14.335M, 取697.6ul)
2% SDS (stock 10%, 取20ml)
62.5mM Tris (pH6.7)(stock 1M, 取6.25ml)
加水至100ml
方法:准备一硬塑料盒,倒入strip solution,将膜完全浸泡,55度水浴30min后,用TBST洗5分钟,3次即可去除已孵育结合的抗体
另外一个Stripping buffer的配方:
10ml 2M Glycine pH 2.2
1ml 10% SDS
1ml Twen 20
室温strip 1h
洗完后用PBS wash 2 timesx10mins
附件2 白蛋白测定试剂(盒)产品技术审评规范(2017版) 本规范旨在指导注册申请人对白蛋白测定试剂(盒)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。 本规范是对白蛋白测定试剂(盒)的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。 本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本规范。 本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。 一、适用范围 白蛋白测定试剂(盒)用于体外定量测定人血清或血浆中白蛋白的浓度。 从方法学考虑,本规范主要指基于分光光度法原理,利用全自动、半自动生化分析仪或分光光度计,在医学实验室采用溴甲酚绿法、溴甲酚紫法进行白蛋白定量检验所使用的临床化学体外诊断试剂。本文不适用于干式或免疫比浊法的白蛋白测定试剂,但适用处可参照执行。 依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂
分类子目录的通知》(食药监械管[2013]242号)白蛋白测定试剂(盒)管理类别为Ⅱ类,分类代号为6840。 二、注册申报资料要求 (一)综述资料 综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性方面说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《体外诊断试剂注册管理办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局〔2014〕第44号公告)相关要求。下面着重介绍与白蛋白测定试剂(盒)预期用途有关的临床背景情况。 白蛋白为含580个氨基酸残基的单链单纯蛋白质,分子量66.3kD,分子中含17个二硫键,在Ph7.4体液中为每分子可以带有200个以上负电荷的负离子。白蛋白由肝实质细胞合成分泌,是血浆中含量最多的蛋白质,约占血浆总蛋白的57%-68%,血浆半衰期约15-19天。白蛋白为体内重要营养蛋白,并参与维持血浆胶体渗透压、酸碱平衡等内环境稳定,也是血浆中多种物质的主要转运蛋白。白蛋白增高主要见于血液浓缩而致相对性增高,如严重脱水和休克、严重烧伤、急性出血、慢性肾上腺皮质功能减低症。白蛋白降低常见于肝硬化合并腹水及其他肝功能严重损害(如急性肝坏死、中毒性肝炎等)营养不良、慢性消耗性疾病、糖尿病、严重出血肾病综合征等。 注:若注册申报产品声称临床意义超出此内容范围,应提供相关文献或临床研究依据。 (二)主要原材料研究资料(如需提供) 主要原材料的选择、制备、质量标准及实验验证研究资料;质控品、校准品的原料选择、制备、定值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。
6种方法测定蛋白质含量 一、微量凯氏(kjeldahl)定氮法 样品与浓硫酸共热。含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。若以甘氨酸为例,其反应式如下: NH2CH2COOH+3H2SO4――2CO2+3SO2+4H2O+NH3(1) 2NH3+H2SO4――(NH4)2 SO4(2) (NH4)2 SO4+2NaOH――2H2O+Na2SO4+2NH3(3) 反应(1)、(2)在凯氏瓶内完成,反应(3)在凯氏蒸馏装置中进行。 为了加速消化,可以加入CuSO4作催化剂,K2SO4以提高溶液的沸点。收集氨可用硼酸溶液,滴定则用强酸。实验和计算方法这里从略。 计算所得结果为样品总氮量,如欲求得样品中蛋白含量,应将总氮量减去非蛋白 氮即得。如欲进一步求得样品中蛋白质的含量,即用样品中蛋白氮乘以6.25即得。 二、双缩脲法(biuret法) (一)实验原理 双缩脲(NH3CONHCONH3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。在强碱性溶液中,双缩脲与CuSO4形成紫色络合物,称为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。
紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。测定范围为1-10mg蛋白质。干扰这一测定的物质主要有:硫酸铵、tris缓冲液和某些氨基酸等。 此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。主要的缺点是灵敏度差。因此双缩脲法常用于需要快速,但并不需要十分精确的蛋白质测定。 (二)试剂与器材 1.试剂: (1)标准蛋白质溶液:用标准的结晶牛血清清蛋白(bsa)或标准酪蛋白,配制成10mg/ml的标准蛋白溶液,可用bsa浓度1mg/ml的a280为0.66来校正其纯度。如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0.05NaOH配制。 (2)双缩脲试剂:称以1.50克硫酸铜(CuSO4?5H2O)和6.0克酒石酸钾钠(KNaC4H4O6?4H2O),用500毫升水溶解,在搅拌下加入300毫升10% NaOH溶液,用水稀释到1升,贮存于塑料瓶中(或内壁涂以石蜡的瓶中)。此试剂可长期保存。若贮存瓶中有黑色沉淀出现,则需要重新配制。 2.器材: 可见光分光光度计、大试管15支、旋涡混合器等。 (三)操作方法 1.标准曲线的测定:取12支试管分两组,分别加入0,0.2,0.4,0.6,0.8,1.0毫升的标准蛋白质溶液,用水补足到1毫升,然后加入4毫升双缩脲试剂。充分摇匀后,在室温(20~25℃)下放置30分
TiO2法磷酸化富集 试验:pH值对TiO2富集磷酸化蛋白的影响 共5个样品,各400ug蛋白(酶解之前),每个样品用1mg TiO2,共用5mg。流程: 1.TiO2 Beads 活化 ①向10mg TiO2 Beads中加入1000 ul Elute buffer 2,震荡20min,8200×g,2min,离心,弃上清; ②更换wash buffer 1 1000ul,第一遍摇晃两次,弃上清;第二遍,震荡20min,弃上清; ③更换Loading buffer 1000ul,2遍震荡30min,最后TiO2 Beads保存在Loading buffer中。 2.酶解后的肽段溶液中加入TFA酸化,使TFA终浓度为0.1%—0.5%,离心浓缩抽干,之后重新用Loading buffer溶解(体积控制在400ul左右)。 3.每400ug蛋白用1mg TiO2 Beads 富集,将1mg TiO2 加入到一个样品中,室温旋转30min,转速1100转/分。 4.将孵育好的肽段溶液加入脱盐柱中,8200×g,2min,收集为Flow Through。 5.再向脱盐柱中加入200ul wash buffer 1,8200×g,2min,,重复3次,收集600ul。 6.再向脱盐柱中加入200ul wash buffer 2,8200×g,2min,,重复3次,收集600ul。 4、5、6合并到一起,为Flow Through。 7.再向脱盐柱中加入200ul Elute buffer 1,8200×g,2min,,重复2次,收集400ul,为elute1;再加入200ul Elute buffer 2,8200×g,2min,收集200ul,为elute 2;合并elute 1和elute 2,总共600ul磷酸化多肽。
蛋白质磷酸化概述 蛋白质磷酸化是敏感而可逆地调节蛋白质功能的一种最常见和最重要的机制,是调节细胞增值的基础。很多多肽生长因子(血小板来源的生长因子和表皮生长因子)和细胞因子(白细胞介素-2、集落刺激因子-2和γ-干扰素)在与其受体结合后均激发磷酸化作用,而这些被诱导的磷酸化反过来激活细胞质内的蛋白激酶如raf、MEK和MAP。此外,在所以有核生物中,细胞周期中G1/S期和G2/M期的转换均受依赖细胞周期蛋白的蛋白激酶(CDK)的调节。磷酸化作用也控制着分化和发育,如果蝇视网膜的R7细胞和秀丽新小杆线虫(Caenorhabditis elegans)的阴门发育受控于受体蛋白激酶和胞内蛋白激酶。最后,新陈代谢受磷酸化作用的调节控制,尤其是葡萄糖和糖元的相互转换及葡萄糖的转运的代谢作用。因而,形形色色的生物学家为了弄清楚他们最感兴趣的基因及其编码产物的调控和功能,他们常常不约而同,有时还是不由自主地必须蛋白质地磷酸化。 研究蛋白质磷酸化最常用地方法是利用32P标记的无机磷酸盐(32Pi)进行生物合成标记。这种方法非常简单,而只将标记物中加入到培养基中。在节中描述了用32Pi进行生物成标记的一般方法。该方法能达到最大限度的提高掺入效率和降低放射性对工作人员的伤害及对设备的污染。 大多数蛋白质是在丝氨酸和苏氨酸残基上磷酸化,而许多与信号传导有关的蛋白质还在酪氨酸位置上被磷酸化。这三种羟基磷酸氨基酸在
酸性PH条件下化学性质稳定,酸水解后它们可被回收并被直接鉴定出来。在节中介绍了通过酸水解和双向薄层电泳鉴定磷酸丝氨酸、磷酸苏氨酸和磷酸酪氨酸的技术。蛋白质也可在组氨酸、半胱氨酸和天冬氨酸位置上与磷酸共价键合,它们可以是以磷酸-酶的中间体或稳定修饰物的形式存在,这些磷酸氨基酸在酸性条件下不稳定,不能用对酸稳定磷酸氨基酸的标准技术来研究,它们只能通过排除法或演绎法来鉴定。研究这些酸不稳定的氨基酸已超出本书的范围,读者可以参考《酶学方法》(Methods in Enzymolcgy)第200卷有关鉴定这些新磷酸氨基酸的技术。 磷酸酪氨酸不是含量丰富的磷酸氨基酸,因而一般很难在用32Pi标记的样品中检出,尤其是当样品中含有大量在丝氨酸残基上磷酸化的蛋白质或有RNA污染时则更难。凝胶电泳分级后的样品以碱处理,使RNA水解并使磷酸丝氨酸脱磷酸,可以大大提高磷酸酪氨酸和磷酸苏氨酸的检出率,在节中描述一种碱处理的简单方法。 如果蛋白质被磷酸化,无需借助生物合成标记方法也可鉴定磷酸氨基酸。例如,蛋白质中所含的稀有的磷酸酪氨酸可用抗磷酸酪氨酸的抗体来检测,其特异性和敏感性相当高。更普遍的是,蛋白质的磷酸化常常使蛋白质在SDS-聚丙烯酰氨凝胶电泳中的迁移率发生变化,而且几乎总是改变它的等电点。将蛋白质和磷酸酶共同温育后,从凝胶迁移率的变动可以推论出非标记蛋白质存在磷酸化残基。这种方法在内源性ATP以[γ-32P]ATP进行标记的效率很差时很实用,如目的蛋白是来源于某些难以进行生物合成标记的组织或来源于体外翻译的情
泛素化蛋白检测方法 蛋白质泛素化简介蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76 个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3 酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。泛素蛋白本身也含有7 个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48 位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63 位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。 与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB )将泛素蛋白修饰物去除掉。靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD )所 识别和结合。人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90 种DUB 酶和20 种UBD ,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。E3 酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT 结构域的E3 酶和其它含有RING 结构域或RING 样结构域(比如U-box 或PHD 结构域)的E3 酶。这两种E3 酶都在免疫调控过程中起到了关键性的作用。 蛋白质泛素化的检测方法研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。 明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是 如何发生泛素化的,影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3 酶是什么? 然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应?对下游
精心整理 泛素化蛋白检测方法 ● 蛋白质泛素化简介 蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶7个赖氨蛋白链(位赖氨酸)将泛素E2酶、600种E3E3E3E3酶都● 影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3酶是什么? 然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应?对下游的信号通路有什么影响? 研究上述内容的实验方法和实验流程: 方法一:westernblotandstrip 通过WB 检测所有发生泛素化的蛋白条带,拍照后,将膜strip 。然后与特定蛋白的抗体和特定泛素化位点的抗体反应,显色拍照。通过阳性条带的对比来初步判断某一特定蛋白的特定
位点发生了泛素化。【具体实验流程附后】 方法二:westernblotandimmunoprecipitations 通过免疫共沉淀方法将某一特定蛋白以及与其结合的蛋白分离出来。分离出来的蛋白再进行SDS电泳和westernblot分析。【具体实验流程附后】。这一方法可以明确具体哪个蛋白的哪个赖氨酸残基发生了泛素化修饰。 方法三:invitroubiquitinationassay 将要研究的目的基因转染293细胞,使其大量表达。24h后提取并分离目的蛋白。在体外反应buffer中将我们要研究的蛋白A(被泛素化的那个蛋白)与UBE1, A泛 。 SDS电
高铁血红素白蛋白检测试剂盒(Schumm 法) 简介: 出现严重血管内溶血,产生的游离血红蛋白量超过结合珠蛋白所能结合的量,血液中结合珠蛋白几乎被耗尽,游离血红蛋白分解成珠蛋白和血红素,有一部分会被氧化成高铁血红素,高铁血红素和血浆白蛋白结合生成高铁血红素白蛋白(Methemalbumin ,MHA),MHA 分子较大,不能由肾脏排出,而是经肝脏清除。 Leagene 高铁血红素白蛋白检测试剂盒(Schumm 法)(Methemalbumin Assay Kit)采用Schumm 法,其检测原理是严重血管内溶血时,结合珠蛋白与血红素结合蛋白均被耗尽,高铁血红素与白蛋白结合成MHA ,经氧化作用后用分光镜或分光光度计检测,若在处出现强的吸收峰,表示存在高铁血红素白蛋白。该试剂盒主要用于定性检测血清或血浆样本,亦可用于定性检测细胞或组织的裂解液或匀浆液等中的高铁血红素白蛋白,血清中出现高铁血红素白蛋白是溶血严重的指标。该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。 组成: 自备材料: 1、 生理盐水 2、 比色杯 3、 分光光度计或分光镜 操作步骤(仅供参考): 1、 准备样品:按照常规方法制备溶血标本血清或血浆,检测前再次高速离心,除尽红细胞,-80℃冻存。如果样品中的MHA 含量过高,可以用生理盐水适当稀释后再进行测定。 2、 加样:轻轻向待测样品加入Schumm Reagent A ,使Schumm Reagent A 完全覆盖样品表面,然后加入样品Schumm Reagent B ,轻轻混合。 4、 检测:取或恰当容量的比色杯,分别加入上述混合液,以生理盐水作为空白对照,用分光光度计或分光镜检测,若在处出现强的吸收峰,表示存在高铁血红素白蛋白,一般应数小时内检测完毕。 编号 名称 TC0211 50T Storage 试剂(A): Schumm Reagent A 15ml RT 避光 试剂(B): Schumm Reagent B 5ml ×2 RT 避光 使用说明书 1份
泛素化蛋白检测方法[精华] 泛素化蛋白检测方法 , 蛋白质泛素化简介 蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。泛素蛋白本身也含有7个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。 与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB)将泛素蛋白修饰物去除掉。靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD)所识别和结合。人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90种DUB酶和20种UBD,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。E3酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT结构域的E3酶和其它含有RING结构域或RING样结构域(比如U-box或PHD结构域)的E3酶。这两种E3酶都在免疫调控过程中起到了关键性的作用。 , 蛋白质泛素化的检测方法
研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。 明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是如何发生泛素化的,影响这一泛素化过程的关键分子是什么,或者说这一过程中的E3酶是什么, 然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应,对下游的信号通路有什么影响, 研究上述内容的实验方法和实验流程: 方法一:western blot and strip 通过WB检测所有发生泛素化的蛋白条带,拍照后,将膜strip。然后与特定蛋白的抗体和特定泛素化位点的抗体反应,显色拍照。通过阳性条带的对比来初步判断某一特定蛋白的特定位点发生了泛素化。【具体实验流程附后】方法二:western blot and immunoprecipitations 通过免疫共沉淀方法将某一特定蛋白以及与其结合的蛋白分离出来。分离出来的蛋白再进行SDS电泳和western blot分析。【具体实验流程附后】。这一方法可以明确具体哪个蛋白的哪个赖氨酸残基发生了泛素化修饰。 方法三:in vitro ubiquitination assay 将要研究的目的基因转染293细胞,使其大量表达。24h后提取并分离目的蛋白。在体外反应buffer中将我们要研究的蛋白A(被泛素化的那个蛋白)与UBE1,UbeH13-Uev 1 a heterodimer complex ,HA-ubiquitin以及我们要研究的蛋白 B(引起蛋白A泛素化的蛋白),共同进行孵育。将孵育后的产物进行IP和WB分析。【具体实验流程附后】。这一方法可以明确引起哪个蛋白是引起某蛋白发生泛素化修饰的E3连接酶。 方法四:in vitro ubiquitin-binding assay
研究蛋白质与蛋白质相互作用方法总结-实验步骤 蛋白质与蛋白质之间相互作用构成了细胞生化反应网络的一个主要组成部分,蛋白-蛋白互作网络与转录调控网络对调控细胞及其信号有重要意义。把原来spaces空间上的一篇蛋白质与蛋白质间相互作用研究方法转来,算是实验技巧分类目录的首篇。(另补充2:检测两种蛋白质之间相互作用的实验方法比较) 一、酵母双杂交系统 酵母双杂交系统是当前广泛用于蛋白质相互作用组学研究的一种重要方法。其原理是当靶蛋白和诱饵蛋白特异结合后,诱饵蛋白结合于报道基因的启动子,启动报道基因在酵母细胞内的表达,如果检测到报道基因的表达产物,则说明两者之间有相互作用,反之则两者之间没有相互作用。将这种技术微量化、阵列化后则可用于大规模蛋白质之间相互作用的研究。在实际工作中,人们根据需要发展了单杂交系统、三杂交系统和反向杂交系统等。Angermayr等设计了一个SOS蛋白介导的双杂交系统。可以研究膜蛋白的功能,丰富了酵母双杂交系统的功能。此外,酵母双杂交系统的作用也已扩展至对蛋白质的鉴定。 二、噬茵体展示技术 在编码噬菌体外壳蛋白基因上连接一单克隆抗体的DNA序列,当噬菌体生长时,表面就表达出相应的单抗,再将噬菌体过柱,柱上若含目的蛋白,就会与相应抗体特异性结合,这被称为噬菌体展示技术。此技术也主要用于研究蛋白质之间的相互作用,不仅有高通量及简便的特点,还具有直接得到基因、高选择性的筛选复杂混合物、在筛选过程中通过适当改变条件可以直接评价相互结合的特异性等优点。目前,用优化的噬菌体展示技术,已经展示了人和鼠的两种特殊细胞系的cDNA文库,并分离出了人上皮生长因子信号传导途径中的信号分子。 三、等离子共振技术 表面等离子共振技术(Surface Plasmon Resonance,SPR)已成为蛋白质相互作用研究中的新手段。它的原理是利用一种纳米级的薄膜吸附上“诱饵蛋白”,当待测蛋白与诱饵蛋白结合后,薄膜的共振性质会发生改变,通过检测便可知这两种蛋白的结合情况。SPR技术的优点是不需标记物或染料,反应过程可实时监控。测定快速且安全,还可用于检测蛋白一核酸及其它生物大分子之间的相互作用。
浅谈蛋白质磷酸化 摘要:蛋白质翻译后修饰几乎在所有的蛋白质上都会发生,被修饰后的蛋白质功能将会发生显著的变化。而蛋白质磷酸化是最常见、最重要的一种蛋白质翻译后修饰方式,在蛋白质翻译后修饰研究中有着重要地位,它参与和调控生物体内的许多生命活动。随着蛋白质组学技术的发展和应用,蛋白质磷酸化的研究越来越受到广泛的重视。本文主要介绍了蛋白质磷酸化的主要知识,主要类型与功能,以及研究蛋白质磷酸化的主要目的,最后简单了提到了预测蛋白质磷酸化位点的方法。 关键词:蛋白质修饰;蛋白质磷酸化;磷酸化位点预测 随着基因组计划基本完成,生命科学研究已进入后基因时代,主要研究对象是功能基因组学,包括结构基因组研究和蛋白质组研究等。蛋白质组研究的开展不仅是生命科学研究进入后基因组时代的里程碑,也是生命科学研究的核心内容。传统的蛋白质研究注重研究单一蛋白质,而蛋白质组学注重研究参与特定生理或病理状态的所有的蛋白质种类及其与周围环境(分子)的关系。它的研究内容包括:(1)蛋白质鉴定;(2)蛋白质翻译后修饰的研究;(3)蛋白质结构研究;(4)蛋白质细胞内定位及功能确定;(5)发现药物靶分子及制药等。 早期蛋白质组学的研究范围主要是指蛋白质的表达模式,随着学科的发展,蛋白质组学的研究范围也在不断完善和扩充。蛋白质翻译后修饰研究已成为蛋白质组研究中的重要部分和巨大挑战。所谓蛋白质翻译后修饰指的是蛋白质折叠过程中和折叠过程后再多肽链上发生的共价反应,使蛋白质质量发生改变并且赋予蛋白质各种功能。 一、蛋白质磷酸化的概述 蛋白质的磷酸化反应是指通过酶促反应把磷酸基团从一个化合物转移到另一个化合物上的过程,是生物体内存在的一种普遍的调节方式,在细胞信号的传递过程中占有极其重要的地位。已经发现在人体内有多达2000个左右的蛋白质激酶和1000个左右的蛋白质磷酸酶基因。蛋白质的磷酸化是指由蛋白质激酶催化的把ATP或GTP上γ位的磷酸基转移到底物蛋白质氨基酸残基上的过程,其逆转过程是由蛋白质磷酸酶催化的,称为蛋白质脱磷酸化。蛋白质的磷酸化修饰是生物体内重要的共价修饰方式之一。其磷酸化和去磷酸化这一可逆过程,受蛋白激酶和磷酸酶的协同作用控制.酶蛋白的磷
糖化白蛋白测定试剂盒(过氧化物酶法) 适用范围:用于体外定量测定人血清中糖化白蛋白和白蛋白测量浓度的比值(%)。 1.1 规格 GA校准品(选配):1×1mL,ALB校准品(选配):1×1mL; 质控品(选配):水平1:1×1mL,水平2:1×1mL。 1.2 组成:
签。 2.1 外观 2.1.1 GA试剂1:淡黄色液体。 2.1.2 GA试剂2:淡黄色至淡红色液体。 2.1.3 ALB试剂:黄绿色液体。 2.1.4 GA校准品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。 2.1.5 ALB校准品:无色至淡黄色液体。 2.1.6质控品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。2.1.7包装外观应整洁,标签字迹清晰,不易脱落。 2.2 净含量 液体试剂的净含量不低于标示体积。 2.3 试剂空白吸光度
2.3.1糖化白蛋白试剂空白吸光度≤0.3。 2.3.2白蛋白试剂空白吸光度≤0.5。 2.4 分析灵敏度 2.4.1糖化白蛋白样本浓度为1.4g/dL时,吸光度差值应≥0.01。 2.4.2白蛋白样本浓度为4.0g/dL时,吸光度差值应≥0.02。 2.5 线性区间 在[10.0,69.0] %的范围内,线性相关系数r≥0.990。测试浓度在[10.0,30.0] %时,绝对偏差应不超过±3%;测试浓度在[30.0,69.0]%时,相对偏差应不超过±10%。 2.6 精密度 2.6.1重复性 用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。 2.6.2批间差 用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。 2.7 准确度 与已上市产品进行对比试验,在[10.0,69.0] %的范围内,线性相关系数r≥0.975。测试浓度在[10.0,30.0] %时,绝对偏差应不超过±3%;测试浓度在[30.0,69.0]%时,相对偏差应不超过±10%。 2.8 质控品赋值有效性 测试结果在质控范围内。 2.9 校准品/质控品瓶内重复性 校准品/质控品瓶内重复性(CV)应不大于10%。 2.10 校准品/质控品批内瓶间差 校准品/质控品批内瓶间差(CV)应不大于10%。 2.11 溯源性 根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,校准品溯源至JCCRM611-1M。
6种方法测定蛋白质含量 [ 文章来源: | 文章作者: | 发布时间:2006-12-25| 字体: [大 中 小] 一、微量凯氏(kjeldahl )定氮法 样品与浓硫酸共热。含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。若以甘氨酸为例,其反应式如下: nh 2ch 2cooh+3h 2so 4——2co 2+3so 2+4h 2o+nh 3 (1) 2nh 3+h 2so 4——(nh 4)2so 4 (2) (nh 4)2so 4+2naoh ——2h 2o+na 2so 4+2nh 3 (3) 反应(1)、(2)在凯氏瓶内完成,反应(3)在凯氏蒸馏装置中进行。 为了加速消化,可以加入cuso4作催化剂,k2so4以提高溶液的沸点。收集氨可用硼酸溶液,滴定则用强酸。实验和计算方法这里从略。 计算所得结果为样品总氮量,如欲求得 样品中蛋白含量,应将总氮量减去非蛋白 氮即得。如欲进一步求得样品中蛋白质的含量,即用样品中蛋白氮乘以6.25即得。 二、双缩脲法(biuret 法) (一)实验原理 双缩脲(nh3conhconh3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。在强碱性溶液中,双缩脲与cuso4形成紫色络合物,称为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。 紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。测定范围为1-10mg 蛋白质。干扰这一测定的物质主要有:硫酸铵、tris 缓冲液和某些氨基酸等。 此法的优点是较快速 ,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。主要的缺点是灵敏度差。因此双缩脲法常用于需要快速,但并不需要十分精确的蛋白质测定。 (二)试剂与器材
磷酸化蛋白质组学常用分析和定量方法 蛋白质的磷酸化修饰是生物体内重要的共价修饰方式之一。蛋白质的磷酸化和去磷酸化这一可逆过程几乎调节着包括细胞的增殖、发育、分化、信号转导、细胞凋亡、神经活动、肌肉收缩及肿瘤发生等过程在内的所有生命活动。目前已知有许多人类疾病是由于某些异常的磷酸化修饰所引起,而有些磷酸化修饰却是某种疾病所导致的后果。在哺乳动物细胞生命周期中,大约有1/3的蛋白质发生过磷酸化修饰;在脊椎动物基因组中,有5%的基因编码的蛋白质是参与磷酸化和去磷酸化过程的蛋白激酶和磷酸(酯)酶。磷酸化修饰本身所具有的简单、灵活、可逆的特性以及磷酸基团的供体ATP的易得性,使得磷酸化修饰被真核细胞所选择接受而成为一种最普遍的调控手段。鉴于磷酸化修饰在生命活动中所具有的重要意义,探索磷酸化修饰过程的奥秘及其对细胞功能的影响已成为众多生物化学家及蛋白组学家所关心的内容。用蛋白质组学的理念和分析方法研究蛋白质磷酸化修饰,可以从整体上观察细胞或组织中磷酸化修饰的状态及其变化,这对以某一种或几种激酶及其产物为研究对象的经典分析方法是一个重要的补充,同时提供了一个全新的研究视角,并由此派生出磷酸化蛋白质组学(phosphoproteomics)这一新概念。在蛋白质组学水平进行磷酸化蛋白质的分析定量研究已引起人们广泛关注,各种技术也相应地发展起来[60, 61]。 1. 磷酸化蛋白质和磷酸肽的富集[62] 1.1 免疫亲和色谱 富集磷酸化蛋白质最简单的方法就是用识别磷酸化氨基酸残基的特异抗体进行免疫共沉淀,从复杂混合物中免疫沉淀出目标蛋白质。目前,仅有酪氨酸磷酸化蛋白质的单克隆抗体可以用来进行有效的免疫共沉淀。这是因为该抗体具有较强的亲和力和特异性,可以有效地免疫沉淀酪氨酸磷酸化的蛋白质。Imam-Sghiouar等人从B-淋巴细胞中通过免疫沉淀获得酪氨酸磷酸化的蛋白质,然后再用二维电泳分离技术并结合质谱分析方法,从而鉴定出多个与斯科特综合症相关的酪氨酸磷酸化的蛋白质。由于抗磷酸化丝氨酸和苏氨酸抗体的抗原决定簇较小,所以令抗原抗体的结合位点存在空间障碍,特异性较差。因此,目前采用磷酸化丝氨酸/ 苏氨酸的抗体来富集磷酸化蛋白质的研究相对较少。 图片来源:https://www.doczj.com/doc/8d7330714.html,/wiki/Phosphoproteomics
泛素化蛋白检测方法 ●蛋白质泛素化简介 蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。 泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。泛素蛋白本身也含有7个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。 与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB)将泛素蛋白修饰物去除掉。靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD)所识别和结合。人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90种DUB酶和20种UBD,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。E3酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT结构域的E3酶和其它含有RING结构域或RING样结构域(比如U-box或PHD结构域)的E3酶。这两种E3酶都在免疫调控过程中起到了关键性的作用。 ●蛋白质泛素化的检测方法 研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。 明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是如何发生泛素化的,影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3酶是什么?
实验七蛋白质含量测定 测定蛋白质的定量方法有很多,目前常用的有染料法,双缩脲(Biuret)法,酚试剂法(Lowry)法及紫外吸收法。 [目的要求] 1.掌握测定蛋白质的含量基本方法。 2.了解染料法、双缩脲法、Lowry法和紫外吸收法测定原理。 一、染料法 [实验原理] 在酸性溶液中染料考马斯亮蓝G-250与蛋白质结合,此时考马斯亮蓝G-250颜色从红色变为蓝色,吸收高峰从460nm移至595nm。利用这个原理可以测定蛋白质含量。 该法近年在某些方面有取代经典的Lowry法趋势,因为它操作简单,反应时间短,染料-蛋白质颜色稳定,抗干扰性强。本法的缺点是:对于那些与标准蛋白氨基酸组成有较大差异的蛋白质,有一定误差,因为不同的蛋白质与染料的结合是不同的,故该法适合测定与标准蛋白质氨基酸组成相近的蛋白质。 [器材] 吸量管;试管;721型分光光度计 [试剂] 1.标准牛血清白蛋白溶液:配成0.1mg/ml的溶液。 2.待测蛋白质溶液。 3.染料溶液:称取考马斯亮蓝G-250 0.1g溶于95%的酒精50ml,再加入85%的浓磷酸100ml,用水稀释至1000ml,混匀备用。
[操作步骤] 1.标准曲线的绘制: 按上表分别向各支试管内加入各种试剂,充分混匀,5min后在595nm波长处以0号管调零,测定各管吸光度值(A)。以吸光度值为纵坐标,蛋白质浓度为横坐标绘制标准曲线。 2.样品测定: 取1ml样品溶液(约含25~250微克蛋白质),加入染料溶液5ml混匀,5min后测定其595nm吸光度值,对照标准曲线求得蛋白质浓度。 二、双缩脲(Biuret)法测定蛋白质含量 [实验原理] 在碱性溶液中,双缩脲(H2N-CO-NH-CO-NH2)与二价铜离子作用形成紫红色的络合物,这一反应称双缩脲反应。凡分子中含二个或二个以上酰胺基(—CO-NH2),或与此相似的基团[如—CH2-NH2,—CS-NH2,—C(NH)NH2]的任何化合物,无论这类基团直接相连还是通过一个碳或氮原子间接相连,均可发生上述反应。蛋白质分子含有众多肽键(—CO-NH—),可发生双缩脲反应,且呈色强度在一定浓度范围内与肽键数量即与蛋白质含量
论述蛋白质磷酸化与去磷酸化在细胞信号系统传导中的作用及研究进展 病毒所梁晓声200628012415030 细胞信号传导过程中磷酸酶/磷酸激酶对蛋白磷酸化程度的调控控制了细胞信号传递与否,信号强度等等细胞信号传导的过程从某种程度上说就是信号传导相关分子磷酸化水平的调节过程。 磷酸酶/磷酸激酶作为胞内信号直接或间接的靶酶通过磷酸化程度控制其它酶类或蛋白质的活性,一般情况下被磷酸化的酶有活性,脱磷酸后的酶没有活性。通过这种方式可以在不改变细胞内酶或相关蛋白的浓度的情况下将部分酶活冻结或解冻。在有外界信号刺激的时候可以迅速解冻酶活而不必合成新的酶。 由于酶反应具有高度专一性,使得蛋白质磷酸化与去磷酸化这种方式在胞内介导胞外信号时具有专一应答的特点。这就使得细胞信号传导途径的上游成分只能针对一个或几个的下游成分起作用,使信号传递具有很强的专一性。同时对信号的灭活也不会由于识别的错误而影响其他信号传导途径。 磷酸化与去磷酸化在细胞对外界信号的持续反应中具有重要的作用。信号引起的细胞生理学效应中,有许多是相当持久的,如细胞的分裂、分化等。虽然胞内信号分子的寿命可以很短,但蛋白激酶一旦激活,其活性却可以通过某些方式(如自身磷酸化)维持较长时间;更重要的是被它磷酸化所调节的蛋白质和酶类,其效应可以维持更长时间,直到被蛋白磷酸酶脱磷酸化为止。 蛋白磷酸化对外界信号具有放大作用,由于是酶促反应,一个酶分子可以催化成百上千个底物分子,即使只有很弱的胞外信号也可以通过酶促反应得到充分的放大。 蛋白质激酶 蛋白质激酶是一类磷酸转移酶,其作用是将ATP的磷酸基转移到它们的底物上特定氨基酸残基上去。依据这些氨基酸残基的特异性,将这些激酶分为4类。其中主要的两类是蛋白质丝氨酸/苏氨酸激酶(STK),和蛋白质酪氨酸激酶(PTK)。这两类酶的蛋白质激酶结构域的大小约为250-300个氨基酸残基。二者的催化域在进化上是密切相关的,并认为它们有共同的祖先。因此,它们的催化域的氨基酸残基序列在很大程度上也是一致的。更重要的是,这些序列表现为一组组高度保守的,甚至是完全保守的氨基酸模体,这些模体却嵌埋在氨基酸残基序列保守性很差的区域之内。一共有11种这类高度保守的短氨基酸残基序列模体。它们都以罗马数字命名,从最N-端的I开始,到最C-端的XI。对这些酶的结晶进行X-射线结构分析,发现这些模体对这些蛋白质激酶催化结构域的磷酸转移酶活性十分重要。据以为,亚域I,II和VII在结合ATP中起重要作用;而亚域VIII则在识别肽底物中起主要作用。对酪氨酸激酶家族来说,在亚域VIII中,紧靠关键模体上游的氨基酸残基有十分有趣的差异,它们是-KWTAPE- 或-KWMAPE-,看来这些序列造成了激酶家族的这个分支的底物专一性。 蛋白磷酸酯酶 丝氨酸/苏氨酸蛋白磷酸酯酶,选择性地作用于含磷酸丝氨酸或磷酸苏氨酸残基的肽链,使之脱去磷酸基团并改变生物活性。主要成员:PPl,PP2A,PP2B,PP2C等。 酪氨酸蛋白磷酸酯酶(PTPase)分胞质型(非受体型)和受体型(PTPR)
蛋白质泛素化研究进展——探索蛋白修饰的秘密 泛素是一种含76个氨基酸的多肽,存在于除细菌外的许多不同组织和器官中,具有标记待降解蛋白质的功能。被泛素标记的蛋白质在蛋白酶体中被降解。由泛素控制的蛋白质降解具有重要的生理意义,它不仅能够清除错误的蛋白质,还对细胞周期调控、DNA修复、细胞生长、免疫功能等都有重要的调控作用。 2004年,以色列科学家Aaron Ciechanover、Avram Hershko和美国科学家Irwin Rose就因发现泛素调节的蛋白质降解而被授予2004年诺贝尔化学奖。正是因为泛素调节的蛋白质降解在生物体中如此重要,因而对它的开创性研究也就具有了特殊意义。目前,在世界各地的很多实验室中,科学家不断发现和研究与这一降解过程相关的细胞新功能。现在,研究人员已发现泛素具有多种非蛋白水解功能,包括参与囊泡转运通路、调控组蛋白修饰以及参与病毒的出芽过程等。 鉴于蛋白质降解异常与许多疾病,例如癌症、神经退行性病变以及免疫功能紊乱的发生密切相关,而基因的功能是通过蛋白质的表达实现的,因此,泛素在蛋白质降解中的作用机制如能被阐明将对解释多种疾病的发生机制和遗传信息的调控表达有重要意义。 《生命奥秘》本月专题将介绍泛素系统的来源、研究进展,并重点介绍以“泛素-蛋白酶”为靶位的抗癌疗法,希望能给相关领域的研究人员带来崭新的思路。 一、泛素样蛋白的来源及功能 1. 泛素样蛋白及其相关蛋白结构域 2. 泛素样蛋白连接后的结果 3. 泛素样蛋白修饰途径的起源 4. 前景展望 二、泛素化途径与人体免疫系统调节 1. 泛素修饰途径与NF-κB信号通路的关系 2. 泛素蛋白在天然免疫中的作用 3. 泛素化修饰途径在获得性免疫机制中的作用
蛋白质的检测(参考GB/T6432-94) 一、原理 凯氏定氮法测定试样中的含氮量,即在催化剂作用下,用浓硫酸破坏有机物,使含氮物转化为硫酸铵。加入强碱进行蒸馏使氮溢出,再用酸滴定,测出氮含量,将结果乘以换算系数 6.25,计算出粗蛋白含量。 二、试剂 (1)硫酸化学纯,含量为98%,无氮; (2)混合催化剂 0.4g硫酸铜,含5个结晶水,6g硫酸钾或硫酸钠,均为化学纯,磨碎混匀; (3)氢氧化钠化学纯,40%水溶液(m/V); (4)硼酸化学纯,2%水溶液(m/V); (5)混合指示剂甲基红0.1%乙醇溶液,溴甲酚绿0.5%乙醇溶液,两溶液等体积混合,在阴凉处保存期为3个月; (6)盐酸标准溶液基准无水碳酸钠法标定; a)0.1mol/l盐酸标准溶液:8.3mL盐酸注入1000mL蒸馏水中。 b)0.02mol/l盐酸标准溶液:1.67mL盐酸注入1000mL蒸馏水中。(7)蔗糖分析纯; (8)硫酸铵分析纯,干燥; (9)硼酸吸收液 1%硼酸水溶液1000mL,加入0.1%溴甲酚绿乙醇溶液10mL,0.1%甲基红乙醇溶液7mL,4%氢氧化钠水溶液,混合,置阴凉处保存期为1个月(全自动程序用)。
三、仪器设备 (1)实验室用样品粉碎机或研钵; (2)分样筛孔径0.45mm(40目); (3)分析天平感重0.0001g; (4)消煮炉或电炉; (5)滴定管酸式,10、25mL; (6)凯氏烧瓶 250mL; (7)凯氏蒸馏装置常量直接蒸馏式或半微量水蒸气蒸馏式; (8)锥形瓶 150、250mL; (9)容量瓶 100mL; (10)消煮管 250mL; (11)定氮仪以凯氏原理制造的各类型半自动、全自动蛋白质测定仪。 四、分析步骤 (一)仲裁法 1.试样的消煮称取试样0.5-1g(含氮量5-80mg)(精确至0.0002g), 放入凯式烧瓶中,加入6.4g混合催化剂,与试样混合均匀,再加入12mL硫酸和2粒玻璃珠,将凯式烧瓶置于电炉上加热,开始小火,待样品焦化、泡沫消失后,再加强活力(360-410℃)直至呈透明的蓝绿色,然后再继续加热,消化全过程至少2h。 2.氨的蒸馏 (1)常量蒸馏法将试样消煮液冷却,加入60-100mL蒸馏水,摇匀,
蛋白质的检测(参考 GB/T6432-94 ) 一、原理凯氏定氮法测定试样中的含氮量,即在催化剂作用下,用浓 硫酸破坏有机物,使含氮物转化为硫酸铵。加入强碱进行蒸馏使氮溢 出,再用酸滴定,测出氮含量,将结果乘以换算系数6.25 ,计算出粗 蛋白含量。 二、试剂 ( 1) 硫酸化学纯,含量为98%,无氮; (2)混合催化剂0.4g硫酸铜,含5个结晶水,6g硫酸钾或硫酸钠,均 为化学纯,磨碎混匀; ( 3) 氢氧化钠化学纯,40%水溶液( m/V); ( 4) 硼酸化学纯,2%水溶液( m/V); ( 5) 混合指示剂甲基红0.1%乙醇溶液,溴甲酚绿0.5%乙醇溶液,两溶液等体积混合,在阴凉处保存期为3 个月; ( 6) 盐酸标准溶液基准无水碳酸钠法标定; a)0.1mol/l盐酸标准溶液:8.3mL盐酸注入1000mL蒸馏水中。 b)0.02mol/l盐酸标准溶液:1.67mL盐酸注入1000mL蒸馏水中。( 7) 蔗糖分析纯; ( 8) 硫酸铵分析纯,干燥; (9)硼酸吸收液1%硼酸水溶液1000mL加入0.1%溴甲酚绿乙醇溶液 10mL 0.1%甲基红乙醇溶液7mL 4%氢氧化钠水溶液,混合, 置阴凉 处保存期为1 个月(全自动程序用) 三、仪器设备
(2)分样筛孔径0.45mm(40 目); (3)分析天平感重0.0001g ; (4)消煮炉或电炉; (5)滴定管酸式,10、25mL (6)凯氏烧瓶250mL; (7)凯氏蒸馏装置常量直接蒸馏式或半微量水蒸气蒸馏式; (8)锥形瓶150、250mL (9)容量瓶100mL; (10)消煮管250mL; (11)定氮仪以凯氏原理制造的各类型半自动、全自动蛋白质测定仪。 四、分析步骤 (一)仲裁法 1?试样的消煮称取试样0.5-1g (含氮量5-80mg)(精确至 0.0002g), 放入凯式烧瓶中,加入6.4g混合催化剂,与试样混合均匀,再加入12mL硫酸和2粒玻璃珠,将凯式烧瓶置于电炉上加热,开始小 火,待样品焦化、泡沫消失后,再加强活力(360-410 C)直至呈透明的蓝绿色,然后再继续加热,消化全过程至少2h。 2.氨的蒸馏 (1)常量蒸馏法将试样消煮液冷却,加入60-100mL蒸馏水,摇匀,