
实验五琥珀酸脱氢酶的作用及其竞争性抑制
【实验目的】
1、掌握竞争性抑制概念及作用机理。
2、了解在无氧情况下观察脱氢酶作用的简单方法。
【实验原理】
存在于心肌、骨骼肌、肝脏等组织中琥珀酸脱氨酸,能使琥珀酸脱氢而成延胡索酸,脱下氢可使甲烯蓝退色,还原为甲稀白。反应如下:
草酸、丙二酸等在结构上与琥珀酸相似,可与琥珀酸竞争与琥珀酸脱氢酸的活性中心结合。若酶已与丙二酸等结合,则不能再与琥珀酸结合而使之脱氢,产生抑制作用,且抑制程度取决于琥珀酸与抑制剂在反应体系中浓度的相对比例,所以这种抑制是竞争性抑制。本实验通过观察在由不同浓度的琥珀酸与丙二酸组成的反应体系中使等量甲稀蓝退色反应时间,从而验证丙二酸对琥珀酸的竞争性抑制作用。
【实验用品】
1、试剂
(1)0.10mol/L磷酸盐缓冲液(pH7.4):0.1mol/L NaH2PO419ml 加0.1mol/LNa2HPO481ml。
(2)0.093mol/L琥珀酸钠溶液:取琥珀酸钠1.5g溶于100ml蒸馏水中。
(3)0.10mol/L丙二酸钠溶液:取丙二酸钠1.5g溶于100ml蒸馏水中。
(4)0.02%甲稀蓝溶液。
(5)液体石蜡。
2、器具
(1)0.10mol/L磷酸盐缓冲液(pH7.4):0.1mol/L NaH2PO419ml加0.1mol/LNa2HPO481ml。
(2)0.93mol/L琥珀酸钠溶液:取琥珀酸钠1.5g溶于100ml蒸馏水中。
(3)0.10mol/L丙二酸钠溶液:取丙二酸钠1.5g溶于100ml蒸馏水中。
(4)0.02%甲烯蓝溶液。
(5)液体石蜡。
2、器具
(1)恒温水浴箱(2)研钵或组织匀浆机
【实验操作】
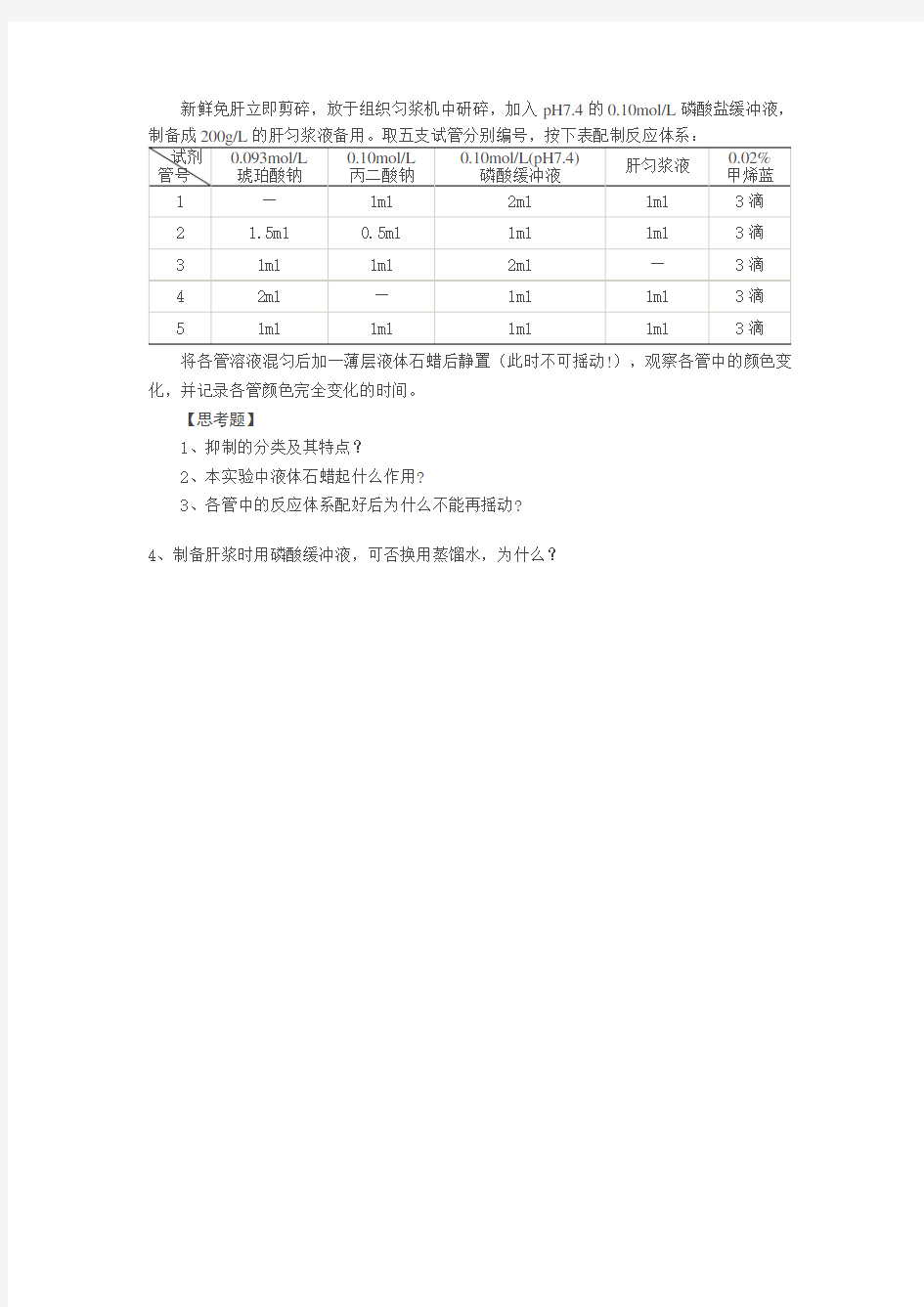
新鲜免肝立即剪碎,放于组织匀浆机中研碎,加入pH7.4的0.10mol/L磷酸盐缓冲液,
将各管溶液混匀后加一薄层液体石蜡后静置(此时不可摇动!),观察各管中的颜色变化,并记录各管颜色完全变化的时间。
【思考题】
1、抑制的分类及其特点?
2、本实验中液体石蜡起什么作用?
3、各管中的反应体系配好后为什么不能再摇动?
4、制备肝浆时用磷酸缓冲液,可否换用蒸馏水,为什么?
溶菌酶 溶菌酶 溶菌酶( Lysozyme,E.C.3.2.17),全称为1,4-p -N -溶菌酶,又称为细胞壁溶解酶,是自然界普遍存在的一种酶,因其能溶解细菌细胞壁具有溶菌作用而得名。 (一)溶菌酶的结构及物理化学性质 溶菌酶易溶于水,遇碱易破坏,不溶于丙酮、乙醚,是一种白色、无臭的结晶粉末。相对分子质量为14.7ku,由129个氨基酸残基组成,碱性氨基酸残基及芳香族氨基酸如色氨酸残基的比例很高,含有4个二硫键,如图2 -24所示,其等电点为10~11。在37℃条件下溶菌酶的生物学活性可保持6h,当温度较低时保持时间更长,利于溶菌酶在体内发挥作用。禽蛋蛋清是溶菌酶的重要来源,蛋清溶菌酶的物理化学性质如表17 -1所示。溶菌酶由两个区域组成,由一个长的α螺旋所联接,其二级结构大多是α螺旋。N末端的区域( f40~80)由一些螺旋线组成,大多数是反平行的β折叠。第二个区域由fl~39和f89~129氨基酸残基组成。分子中的这两个区域被一个螺旋体(f87天冬氨酸- 114精氨酸)所分离,分子组成了内部疏水外部亲水的基本结构,对溶菌酶发挥抗菌功能起着巨大的作用。 表17 -1 蛋清溶菌酶的物理化学特性 特性数值 相对分子质量14 400 亚基数 1 氨基酸129 等电点10.7 二硫键数 4 碳水化合物所占比例0 E1%280nm 26.4 93℃时的D热值(每分钟破坏90%的活性)110 酶活力的实验通过浑浊溶壁微球菌的细胞溶解 (二)溶菌酶的来源 溶菌酶在自然界中普遍存在,在人和许多哺乳动物的组织和分泌液中,均发现有溶菌酶存在,其物化性质基本相似,溶菌酶的来源如表17 -2所示。溶菌酶主要分布于禽蛋和鸟类蛋清中,尤其是浓厚蛋白的系带膜状层中。禽蛋中异常丰富,占整个蛋清中的 3.5%,鸡蛋蛋清是溶菌酶的主要商业来源。 表17 -2溶菌酶的来源
溶菌酶 2010级基地班马冬珂10104109 一:溶菌酶的性质: 1907年,Nicolle最早发表了枯草杆菌溶菌因子的报告,两年后,Laschtschenko指出,鸡蛋也有较强溶菌活性,并把它命名为溶菌酶(Lysozyme,EC3.2.1.17)。紧接着Fleming和Meyer等证实植物中也含有溶菌酶,以后人们对溶菌酶的特性有了更深入的认识。(1) 溶菌酶是一种广泛存在于各种动植物有机物中的糖苷水解酶,作用于N一乙酰氨基葡萄糖和N一乙酰胞壁之间的8—1,4键,能使某些细菌细胞壁中的粘多糖成分分解。是由129个氨基酸残基组成的碱性球蛋白,等电点在pH值10.8左右,分子量为14000,化学性质非常稳定。当pH值在1.2—11.3的范围剧烈变化时,其结构几乎不变。在酸性环境下,溶菌酶对热的稳定性很强;pH值低于4时,溶菌酶可以长期在室温下存放。其纯品为白色或微黄、黄色的结晶体或无定型粉末,无异味,,微甜,易溶于水,遇碱易被破坏,不溶于乙醚. 280nm的消光系数为13.0。酶活性可被该酶活性可被一些金属离子Cu2+,Fe2+,Zn2+(10-5~10-3M)以及N-乙酰葡萄糖胺所抑制,能被Mg2+,Ca2+(10-5~10-3M)、NaCl所激活。 二:提取原材料和提取方法: 溶菌酶广泛存在于家禽的蛋清、哺乳动物组织的分泌液中,一些植物(如卷心菜、木瓜等)的汁液中也有强力的溶菌酶活性。目前一般从蛋清和蛋壳中提取溶菌酶。 提取原料:鸡蛋(含量约为2%到4%)。鸡蛋清按水分和固形物所占比重,则含水分87%,固形物13%;固形物中大约90%是蛋白质, (2) 提取方法: 1.蛋清中溶茵酶的提取:蛋清中的溶菌酶可用吸附法提取,过程如下:蛋清过滤(90目100目),加入724型树脂吸附(每公斤蛋清加15g)一倾去蛋清一冲洗并控干树脂。用质量分数10%硫酸铵洗脱一洗胶液中加入晶体硫酸铵(30g/100mL)沉淀溶菌酶,沉淀晾干即得到溶菌酶粗制品。蛋清中的溶菌酶也可用直接结晶法制取,即在蛋清中加入食盐(NaCI)。使其质量分数达到5%,并调节溶液pH值至10.0左右,加入少许溶菌酶晶体为晶种,于-4摄氏度冰箱冷却静置7d一14d即可获得溶菌酶的结晶品。这种工艺方法可获得较高纯度的溶菌酶,收率也比较高。可广泛用于从蛋清提取溶菌酶的工业化生产。 2.蛋壳中溶茵酶的提取:蛋壳中(实际上是蛋壳膜)溶菌酶含量虽然较低,但从变废为宝的角度考虑,仍是提取溶菌酶的重要原料。具体工艺流程如下:蛋壳一质量分数1%NaCI抽提滤液加热去除杂蛋白,加聚丙酸凝聚(富集),溶解凝聚物,加氯化钙沉淀上清液结晶。 三:制备(重点): 1..酸性条件下热处理法提纯溶菌酶:在酸性条件下溶菌酶具有热稳定性,不易变性失活,且溶菌酶和卵蛋白的等电点分别为11.0和4.5,由于溶菌酶和卵蛋白的性质著异,因而在实验中采用热变性和调pH值使卵蛋白沉淀的方法来探讨去除卵蛋白的较好方法。研究发现溶菌酶和卵蛋白之间存在静电作用力,在加热
第14卷第1期现代农药V ol.14 No.1 专论与综述 琥珀酸脱氢酶抑制剂类杀菌剂的研发进展(Ⅱ) 仇是胜1,柏亚罗2 (1. 江苏嘉隆化工有限公司,江苏徐州 221112;2. 江苏省农药研究所股份有限公司,南京 210024) 摘要:琥珀酸脱氢酶抑制剂类 (SDHI) 杀菌剂历经3代,有18个品种上市或即将上市。尤其是第3代8个吡唑酰胺类杀菌剂的问世,有力地带动了SDHI类杀菌剂市场的迅速发展。介绍了SDHI类杀菌剂的作用机理、构效关系和专利概况,逐个陈述了它们的应用与市场,总结了该类产品的抗性情况及产生机理,并展望了SDHI类杀菌剂的发展前景。 关键词:琥珀酸脱氢酶抑制剂;酰胺类杀菌剂;研究开发;应用;市场;抗性 中图分类号:TQ 455.4+9文献标识码:A doi:10.3969/j.issn.1671-5284.2015.01.001 Progress on Research and Development of Succinate Dehydrogenase Inhibitor Fungicides (Ⅱ) QIU Shi-sheng1, BAI Ya-luo2 (1. Jiangsu Jialong Chemical Industry Co., Ltd., Jiangsu Xuzhou 221112, China; 2. Jiangsu Pesticide Research Institute Co., Ltd., Nanjing 210024, China) Abstract: Eighteen fungicides of succinate dehydrogenase inhibitors (SDHI) have launched or will launch soon through three-generation-development. Especially, the sales of eight carboxamide fungicides in the 3rd generation, promoted significantly the market development of SDHIs. The paper introduced the mechanism of action, structure- activity relationships and patent profiles of SDHIs. The uses and markets of the all active ingredients were described, their resistance and resistant mechanisms were summaried, and the futures of SDHIs were also prospected. Key words: succinate dehydrogenase inhibitor (SDHI); carboxamide fungicide; R&D; use; market; resistance (续上期) 5.4 呋喃酰胺类 (furan-carboxamides,1个) 甲呋酰胺 (fenfuram) 是由壳牌公司发现、安万特(现拜耳作物科学) 公司开发[2]。 甲呋酰胺是替代汞制剂、具内吸性的拌种剂[9],可防治谷物上的腥黑穗病和黑粉病(Tilletia和Ustilago spp.)[2]。 甲呋酰胺的主要剂型有:DS和LS[2]。其开发代号为:WL 22361;主要商品名为:Pano-ram[2]。 截至2014年10月11日,甲呋酰胺尚未在欧盟、美国和中国登记[23-25]。 5.5 氧硫杂环己二烯酰胺类 (oxathiincar- boxamides,2个) 5.5.1 萎锈灵 (carboxin) 萎锈灵由美国有利来路(现科聚亚) 公司1966年报道,1969年引入市场[2]。 萎锈灵为内吸性杀菌剂,种子处理可用于大麦、小麦和燕麦等作物,防治黑粉病、腥黑粉病[特别是散黑穗病、黑穗病(Ustilago spp.)],用药量为每100 kg种子50~200 g;还用于大麦、小麦、燕麦、水稻、棉花、花生、大豆、油菜、蔬菜、玉米、高粱和其他作物上防治种子和幼苗上的病害,如黑穗病、腐烂病和疫病等,特别是丝核菌(Rhizoctonia spp.) 引起的病害。萎锈灵不能与强碱或强酸性农药混配[2]。 萎锈灵可采用闷种、拌种和浸种等方法施用,亦可叶面喷雾防治小麦、豆类、梨等的锈病。其对作物生长具有一定的刺激作用,能使小麦增产[9]。 萎锈灵的主要剂型有:FS、SC、WP和WS等[2]。 萎锈灵的开发代号为:D 735;其单剂产品的 收稿日期:2014–10–13;修回日期:2014–10–18 作者简介:仇是胜 (1967—),男,江苏省徐州市人,高级工程师,主要从事农药及有机合成工作。Tel:0516–85038670;E–mail:qiuss001@https://www.doczj.com/doc/9d11958625.html,
实验十琥珀酸脱氢酶的作用及其竞争性抑制 一、实验目的 1、掌握竞争性抑制概念及作用机理。 2、了解在无氧情况下观察脱氢酶作用的简单方法。 二、实验原理存在于心肌、骨骼肌、肝脏等组织中琥珀酸脱氨酸,能使琥珀酸脱氢而成延胡索酸,脱下氢可使甲烯蓝退色,还原为甲稀白。反应如下:草酸、丙二酸等在结构上与琥珀酸相似,可与琥珀酸竞争与琥珀酸脱氢酸的活性中心结合。若酶已与丙二酸等结合,则不能再与琥珀酸结合而使之脱氢,产生抑制作用,且抑制程度取决于琥珀酸与抑制剂在反应体系中浓度的相对比例,所以这种抑制是竞争性抑制。本实验通过观察在由不同浓度的琥珀酸与丙二酸组成的反应体系中使等量甲稀蓝退色反应时间,从而验证丙二酸对琥珀酸的竞争性抑制作用。这样,便可以显示琥珀酸脱氢酶的作用。 三、实验仪器、材料和试剂 1、仪器:恒温水浴锅,研钵或组织匀浆机 2、材料和试剂(1)新鲜兔肝(2) 0、10mol/L磷酸盐缓冲液(pH7、4):0、1mol/L NaH2PO419 ml 加0、1mol/L Na2HPO481ml。 (3)0、093 mol/L琥珀酸钠溶液:取琥珀酸钠1、5g溶于100 ml蒸馏水中。
(4)0、10 mol/L丙二酸钠溶液:取丙二酸钠1、5g溶于100 ml蒸馏水中。 (5)0、02%甲稀蓝溶液。 (6)液体石蜡。 四、实验操作新鲜兔肝立即剪碎,放于组织匀浆机中研碎,加入pH7、4的0、10 mol/L磷酸盐缓冲液,制备成200 g/L的肝匀浆液备用。取五支试管分别编号,按下表配制反应体系:试剂管号0、093 mol/l琥珀酸钠0、10 mol/l丙二酸钠0、 10mol/l(pH7、4)磷酸缓冲液肝匀浆液0、02%甲烯蓝11ml2ml1ml3滴 21、5ml0、5ml1ml1ml3滴31ml1ml2ml3滴42ml1ml1ml3滴51ml1ml1ml1ml3滴将各管溶液混匀后加一薄层液体石蜡后静置(此时不可摇动!),观察各管中的颜色变化,并记录各管颜色完全变化的时间。思考题: 1、抑制的分类及其特点? 2、本实验中液体石蜡起什么作用? 本实验需在无氧条件下进行,可加一层液体石蜡以隔绝空气。 3、各管中的反应体系配好后为什么不能再摇动? 4、制备肝浆时用磷酸缓冲液,可否换用蒸馏水,为什么?
溶菌酶的提取和系列性质测定实验报告 学院:生物科学与工程学院 班级: 姓名: 学号: 组别:第七组 组员:
一、实验内容: 溶菌酶的提取和系列性质测定 在研究酶的性质、作用、反应动力学等问题时都需要使用高度纯化的酶制剂以避免干扰。酶的提纯工作往往要求多种方法交替应用,才能得到较为满意的效果。常用的提纯方法有盐析、有机溶剂沉淀、选择性变性、离子交换层析、凝胶过滤、亲和层析等。酶蛋白在分离提纯过程中易变性失活,为能获得尽可能高的产率和纯度,在提纯操作中要始终注意保持酶的活性如在低温下操作等,这样才能收到较好的分离提纯效果。 溶菌酶又称胞壁质酶或N-乙酰胞壁质聚糖水解酶、球蛋白G,是一种能水解致病菌中黏多糖的碱性酶。主要通过破坏细胞壁中的N-乙酰胞壁酸和N-乙酰氨基葡糖之间的β-1,4糖苷键,使细胞壁不溶性黏多糖分解成可溶性糖肽,导致细胞壁破裂内容物逸出而使细菌溶解。溶菌酶还可与带负电荷的病毒蛋白直接结合,与DNA、RNA、脱辅基蛋白形成复盐,使病毒失活。溶菌酶相对分子质量约为1.44×104,是一种强碱性蛋白质,等电点在10.0以上,并对温度和酸不敏感。在自然界中,普遍存在于鸟类和家禽的蛋清中,哺乳动物的泪、唾液、血浆、尿液、淋巴液等细胞中,植物卷心菜、萝卜、木瓜等,以蛋清含量最丰富,约为0.3%。 本实验用鸡蛋为原理,通过阳离子交换层析,硫酸铵沉淀,分子筛层析等步骤提取溶菌酶。 二、实验原理: 1蛋白质提取分离技术 以蛋白质和结构与功能为基础,从分子水平上认识生命现象,已经成为
现代生物学发展的主要方向,研究蛋白质,首先要得到高度纯化并具有生物活性的目的物质。蛋白质的制备工作涉及物理、化学和生物等各方面知识,但基本原理不外乎两方面。一是得用混合物中几个组分分配率的差别,把它们分配到可用机械方法分离的两个或几个物相中,如盐析,有机溶剂提取,层析和结晶等;二是将混合物置于单一物相中,通过物理力场的作用使各组分分配于来同区域而达到分离目的,如电泳,超速离心,超滤等。在所有这些方法的应用中必须注意保存生物大分子的完整性,防止酸、硷、高温,剧烈机械作用而导致所提物质生物活性的丧失。蛋白质的制备一般分为以下四个阶段:选择材料和预处理,细胞的破碎及细胞器的分离,提取和纯化,浓细、干燥和保存。 微生物、植物和动物都可做为制备蛋白质的原材料,所选用的材料主要依据实验目的来确定。对于微生物,应注意它的生长期,在微生物的对数生长期,酶和核酸的含量较高,可以获得高产量,以微生物为材料时有两种情况:(1)得用微生物菌体分泌到培养基中的代谢产物和胞外酶等;(2)利用菌体含有的生化物质,如蛋白质、核酸和胞内酶等。植物材料必须经过去壳,脱脂并注意植物品种和生长发育状况不同,其中所含生物大分子的量变化很大,另外与季节性关系密切。对动物组织,必须选择有效成份含量丰富的脏器组织为原材料,先进行绞碎、脱脂等处理。另外,对预处理好的材料,若不立即进行实验,应冷冻保存,对于易分解的生物大分子应选用新鲜材料制备。 2.柱层析技术 柱层析技术也称柱色谱技术。一根柱子里先填充不溶性基质形成固定相,将蛋白质混合样品加到柱子上后用特别的溶剂洗脱,溶剂组成流动相。在样品从柱子上洗脱下来的过程中,根据蛋白质混合物中各组分在固定向和流动相中的分配系数不同经过多次反复分配,将不同蛋白组分逐一分离。 根据填充基质和样品分配交换原理不同,离子交换层析,凝胶过滤层析和亲和层析是三种分离蛋白质的经典层析技术。
丙二酸对琥珀酸脱氢酶的竞争性抑制作用 竞争性抑制作用是指,当抑制剂在结构上与底物类似,能与底物竞争酶分子活性中心的结合基团,从而阻碍酶与底物结合。它是可逆的,抑制作用的强弱取决于抑制剂与底物的相对浓度。丙二酸对琥珀酸脱氢酶有竞争性抑制作用。丙二酸的结构和琥珀酸非常相似,可竞争性地与酶的活性中心结合,使其不能与琥珀酸结合。因此可通过研究不同浓度比例的丙二酸和琥珀酸,观察其对琥珀酸脱氢酶活性的影响。 1实验材料 1.1酶提取液实验室提供 1.2仪器滴管;玻璃棒;试管6支 1.3试剂0.2mol/L琥珀酸;0.02mol/L琥珀酸;0.2mol/L丙二酸;0.02mol/L丙 二酸;0.02%甲烯蓝;液体石蜡;蒸馏水 2实验方法 2.1实验原理 琥珀酸经琥珀酸脱氢酶催化,脱氢生成延胡索酸。在体外隔绝空气条件下,从琥珀酸上脱下的一对氢可由人工受氢体甲烯蓝(蓝色)接受后,被还原成甲烯白。抑制剂丙二酸竞争琥珀酸脱氢酶的活性中心,阻碍底物与该酶的结合和催化反应,使甲烯蓝褪色的速度变慢。丙二酸对该酶的抑制程度取决于其与琥珀酸的相对浓度比例。 2.2实验设计 2.2.1竞争性抑制作用鉴定 取6支试管,按下表操作: 试剂\管号 1 2 3 4 5 6 酶提取液20 20 20 20 20 - 0.2mol/L琥珀酸10 10 10 - - 10 0.02mol/L琥珀酸- - - 10 10 - 0.2mol/L丙二酸- 10 - 10 - - 0.02mol/L丙二酸- - 10 - 10 - 蒸馏水10 - - - - 25 0.02%甲烯蓝 4 4 4 4 4 4 各管混匀 液体石蜡15 15 15 15 15 15 放置室温 不断观察各管甲烯蓝褪色置甲烯白(即呈肝匀浆色)的时间,比较各管顺序。 3实验结果 记录各管褪色顺序,得下表: 管号 1 2 3 4 5 6 顺序 1 3 2 5 4 6 1号管中无抑制剂(丙二酸),所以琥珀酸在酶的催化下脱氢,使甲烯蓝褪色速度最快。3号管中底物与抑制剂比例为10:1,所以褪色速度次之。2号管和
实验四酶的竞争性抑制作用 一、目的要求: 通过实验加深对酶的竞争性抑制作用的了解 二、实验原理: 与底物化学结构类似的抑制剂,能与底物竞争和酶活性中心的结合、抑制酶的活性,这种类型的抑制为竞争性抑制。竞争性抑制的程度由抑制剂与底物相对浓度决定。如果底物浓度不变,酶活性被抑制的程度随抑制剂的浓度增加而增强。反之,如果抑制剂浓度不变,则酶活性随底物浓度的增加而逐渐恢复。 本实验观察丙二酸对琥珀酸脱氢酶的影响。琥珀酸脱氢酶的活性,在隔绝空气的条件下,可从加入的甲烯蓝褪色情况来观察。 COOH COOH ︳︳ CH2 琥珀脱氢酶CH ︳+ 甲烯蓝——————→‖+ 甲烯白 CH2 CH ︳︳ COOH COOH 三、实验材料 1、试剂: (1)0.2 mol/L 琥珀酸:称取琥珀酸23.618g,用蒸馏水配成约600ml ,用5mol/L NaOH 调pH至7.4,再加水至1000ml (2)0.02mol/L琥珀酸:用0.2 mol/L 琥珀酸稀释10倍 (3)0.2 mol/L 丙二酸:称取丙二酸22.92g ,用蒸馏水配成约600ml ,5mol/L NaOH调pH 至7.4,再加水至1 000ml (4)0.02mol/L丙二酸:用0.2 mol/L丙二酸稀释10倍 (5)0.1mol/L 磷酸盐缓冲液(pH7.4):取0.2 mol/L Na2HPO4 19ml ,加蒸馏水至200ml (6) 0.02%甲烯蓝 (7)液体石蜡 2、器材 (1)小试管及试管架(2)吸量管(10ml *1)及滴管(8支)(3)研钵 四、实验方法 1、心肌匀浆的制备:取动物(鼠、猪等)心肌1g,置研钵中,剪碎,研磨成匀浆,再加入0.1mol/L 磷酸盐缓冲液10ml ,磨匀,备用 2、取小试管5支并编号,按下表操作:
琥珀酸脱氢酶的作用及丙二酸的抑制作用 【目的】 1 .掌握琥珀酸脱氢酶作用及丙二酸抑制作用的实验技术与原理。 2 .深化理解酶的竞争性抑制作用的特点。 【原理】 肌肉组织含有的琥珀酸脱氢酶是一种结合蛋白酶,以 FAD 为辅基。它能催化琥珀酸脱氢生成延胡索酸, FAD 接受氢生成FAD·2H 。体外实验以美蓝 ( 甲烯蓝 ) 为受氢体,使美蓝还原生成美白 ( 甲烯白 ) 。其反应如下: 琥珀酸脱氢酶活性越高,美蓝脱色所需的时间越短,由于美白易被空气中的氧氧化成美蓝。故实验需在无氧条件下进行,可加一层液体石蜡以隔绝空气。 丙二酸与琥珀酸的化学结构很相似,能和琥珀酸竞争与琥珀酸脱氢酶结合,从而抑制琥珀酸的脱氢作用。其抑制程度与抑制剂和底物二者的浓度有关。本实验通过不同浓度的琥珀酸和丙二酸来观察丙二酸对琥珀酸脱氢酶的抑制作用。 【器材】 1 .研钵与剪刀 2 .漏斗 3 .纱布 4 .恒温水浴 【试剂】 1 . 0.2mol/L 琥珀酸溶液 2 . 0.02mol/L 琥珀酸溶液 3 . 0.2mol/L 丙二酸溶液
4 . 0.02mol/L 丙二酸溶液 以上四种溶液均先用 5mol/L NaOH 溶液调至 pH7.0 ,再用 0.01mol/L NaOH 溶液调至 pH7.4 。直接用琥珀酸钠或丙二酸钠配制亦可。 5 . 1/15mol/L 磷酸盐缓冲液( pH7.4 ) 1/15mol/L Na 2 HPO 4 80.8ml 与 1/15mol/L KH 2 PO 4 19.2ml 混匀即可。 6 . 0.02% 美蓝溶液 7 .液体石蜡 【操作】 1 .肌肉提取液的制备 取用蒸馏水清洗过的新鲜动物肌肉组织约 10g ,置于研钵(或匀浆器)中,研磨成糜状,然后每克肌肉组织加 4 倍体积的冰冷的 pH7.4 1/15mol/L 磷酸盐缓冲液,混匀,用双层纱布过滤,取滤液备用。 2 .酶促反应 取试管 5 支,编号,按下表操作。 将上述各试管液混匀后,沿各管壁加入液体石蜡 5 ~ 10 滴,使其在液面形成一薄层以隔绝空气。置于37 ℃ 水浴中保温,记录各管保温开始时间及美蓝开始脱色的时间。 3 .计算并解释各管美蓝颜色变化原因。
--第三章酶测试题-- 一、单项选择题(在备选答案中只有一个是正确的) 1.关于酶的叙述哪项是正确的? A.所有的酶都含有辅基或辅酶B.只能在体内起催化作用C.大多数酶的化学本质是蛋白质 D.能改变化学反应的平衡点加速反应的进行E.都具有立体异构专一性(特异性) 2.酶原所以没有活性是因为: A.酶蛋白肽链合成不完全B.活性中心未形成或未暴露C.酶原是普通的蛋白质 D.缺乏辅酶或辅基E.是已经变性的蛋白质 3.磺胺类药物的类似物是: A.四氢叶酸B.二氢叶酸C.对氨基苯甲酸D.叶酸E.嘧啶 4.关于酶活性中心的叙述,哪项不正确? A.酶与底物接触只限于酶分子上与酶活性密切有关的较小区域B.必需基团可位于活性中心之内,也可位于活性中心之外C.一般来说,总是多肽链的一级结构上相邻的几个氨基酸的残基相对集中,形成酶的活性中心D.酶原激活实际上就是完整的活性中心形成的过程E.当底物分子与酶分子相接触时,可引起酶活性中心的构象改变 5.辅酶NADP+分子中含有哪种B族维生素? A.磷酸吡哆醛B.核黄素C.叶酸D.尼克酰胺E.硫胺素
6.下列关于酶蛋白和辅助因子的叙述,哪一点不正确? A.酶蛋白或辅助因子单独存在时均无催化作用B.一种酶蛋白只与一种辅助因子结合成一种全酶C.一种辅助因子只能与一种酶蛋白结合成一种全酶D.酶蛋白决定结合酶蛋白反应的专一性E.辅助因子直接参加反应 7.如果有一酶促反应其〔8〕=1/2Km,则v值应等于多少Vmax? A.0.25 B.0.33 C.0.50 D.0.67 E.0.75 8.有机磷杀虫剂对胆碱酯酶的抑制作用属于: A.可逆性抑制作用B.竞争性抑制作用C.非竞争性抑制作用D.反竞争性抑制作用E.不可逆性抑制作用 9.关于pH对酶活性的影响,以下哪项不对? A.影响必需基团解离状态B.也能影响底物的解离状态C.酶在一定的pH范围内发挥最高活性D.破坏酶蛋白的一级结构E.pH改变能影响酶的Km值10.丙二酸对于琥珀酸脱氢酶的影响属于: A.反馈抑制B.底物抑制C.竞争性抑制D.非竞争性抑制E.变构调节二、多项选择题(在备选答案中有二个或二个以上是正确的,错选或未选全的均不给分) 1.关于酶的竞争性抑制作用的说法哪些是正确的? A.抑制剂结构一般与底物结构相似B.Vm不变C.增加底物浓度可减弱抑制剂的影响D.使Km值增大 2.关于酶的非竞争性抑制作用的说法哪些是正确的? A.增加底物浓度能减少抑制剂的影响B.Vm降低C.抑制剂结构与底物无相似之处D.Km值不变
实验一溶菌酶的溶菌作用 实验目的: 1、掌握溶菌酶对革兰氏阳性菌溶解的原理及应用。 2、证实体液中溶菌酶的存在观察溶菌酶的溶菌现象。基本原理: 正常情况下,机体的唾液、泪液、痰、鼻腔分泌物以及白细胞和血清等均含有丰富 的溶菌酶。测定分泌物和体液中的溶菌酶含量及其变动情况,可作为评价机体非特异性免疫功能的指标之一。 溶菌酶的杀菌机理是其作用于细菌细胞壁的粘肽层,粘肽是细菌的细胞壁主要成分。溶菌酶能切断粘肽结构中的N-乙酰葡萄糖胺和N-乙酰胞壁酸之间的B - 1,4 糖苷键,破坏粘肽支架,使细胞壁破坏。由于细菌细胞壁的重要功能之一是保护细菌,即抗低渗,故细菌失去细胞壁的保护作用后,在低渗环境中可发生溶解。溶菌酶的主要作用对 象是革兰氏阳性菌。革兰氏阴性细菌细胞壁粘肽层外还有脂多糖、外膜和脂蛋白结构, 故在一般情况下溶菌酶不易发挥直接作用。实验材料: 1、葡萄球菌:本菌是一种革兰氏阳性菌,普通琼脂培养基生长良好。 2、标准溶菌酶:称取溶菌酶标准纯品,用蒸馏水配制为1000ug/ml 原液, 并稀释为100、50、10 ug/ml 标准液,用前保存在冰箱中。 3、唾液:用无菌平皿收集唾液,可在同学间收集。(于饭后两小时,清水漱口3 次,10 分钟后,收集唾液于清洁烧杯中); 4、其它:无菌打孔器(孔径2mm ),无菌毛细吸管、毫米尺等。实验方法: 1、制备含葡萄球菌的琼脂平板加热融化3%琼脂,冷至60C ~70C时, 加入1ml 葡萄球菌菌液,混合均匀,倾注于无菌平皿内。 2、用无菌打孔器在葡萄球菌琼脂平板上打孔,孔径2mm 左右,孔距5- 20mm 。用针头挑出孔内琼脂, 3、用毛细吸管取新鲜收集的唾液加入琼脂孔内,每孔加满唾液,同时加标准溶菌酶作阳性对照。 4、置24-28 °C下12-18h观察结果。观察各孔周围溶菌情况,测量溶菌环直径。实验结果: 用毫米尺或三角板量取小孔周围溶菌环直径,并作记录,可与标准溶菌酶阳性对
溶菌酶的研究及应用简介 摘要溶菌酶(lysozyme)是一种专门作用于微生物细胞壁的水解酶,又称胞壁质酶(muramidase)。人们对溶菌酶的研究始于20 世纪初,英国细菌学家Fleming在发现青霉素的前6年(1922年)发现人的唾液、眼泪中存在能溶解细菌细胞壁的酶,因其具有溶菌作用,故命名为溶菌酶,其中鸡蛋溶菌酶的研究和应用已相当深入和广泛[1]。通过对它的结构、性质、来源的研究;溶菌酶已广泛的应用于医药、生物工程和食品工业等多个方面。 关键词溶菌酶;结构;应用;研究进展 溶菌酶(Lysozymc EC3.2.1.17)又名胞壁质酶(muramidase)、乙酞胞壁酸聚糖水解酶(N-acctylmuramide glyca-nohydrolase),广泛地分布于自然界[2]。在病毒(如噬菌体T4)、细菌(如枯草杆菌)、植物(如番木瓜)、动物(如鼠、狗)及人体都含有。人体多数组织器官含有一定浓度的溶菌酶。但以脾、肾含量较高。在鼻及支气管分泌液、泪液、脑脊液、唾液、乳汁及血液中均含有一定量的溶菌酶。此酶自被发现以来,经科学家们不断地研究,使得它在酶学及临床医学中均占有一定的重要位置,也将其应用于医疗、食品、畜牧及生物工程中。 1 溶菌酶的发现 1907年Nicollc[2]猜测芽胞杆菌(Bacillus)及枯草杆菌中含有溶解细菌的酶。1909年https://www.doczj.com/doc/9d11958625.html,schtchenko[3]第一个报道了鸡蛋清含有溶解细菌的酶。1922年Alexander Fleming[2]发现鼻粘液里有一种能溶解微球菌(micrococcus
lysodeikticus)及其他细菌的酶,他把这种酶命名为溶菌酶(lysozyme)。经过仔细的观察和研究,他发现此酶广泛地存在于生物组织及机体的某些分泌物中。之后Robert及Wolff 也从鸡蛋清里提取出溶菌酶。1937~1946年间Abraham[3],Robinson, Alderson及Fevold等人通过实验从而分别获得了溶菌酶的结晶。 2 溶菌酶的理化性质、空间结构 2.1溶菌酶的理化性质 溶菌酶由129个氨基酸构成的单纯碱性球蛋白,在酸性环境下,溶菌酶对热的稳定性很强。当pH值为1.2~11.3围剧烈变化时,但其结构几乎维持不变。当pH值为4~7,96℃热处理15 min仍能保持87%的酶活性;当pH值为3 时能耐100℃加热处理45min;但碱很容易破坏酶活性,当处于碱性pH 值围时,溶菌酶的热稳定性就很差[4]。在干燥条件下,溶菌酶可以长期在室温存放,其纯品为白色或微黄色。黄色的结晶体或无定形粉末,无臭,味甜。易溶于水,易遭碱破坏,不溶于丙酮和乙醚。其分子结构如下: 2.2 空间结构 溶菌酶是第一个结构弄清楚的酶,在很长一段时间中,其中有许多蛋白晶体研究及蛋白质结构与功能关系研究。这些进展都是利用溶菌酶获得的溶菌酶一直
实验八 丙二酸对琥珀酸脱氢酶的竞争性抑制作用 【目的】 验证丙二酸对琥珀酸脱氢酶的竞争性抑制作用。 【原理】 琥珀酸在琥珀酸脱氢酶催化下脱氢生成延胡索酸,脱下的氢被受氢体接受。本实验用亚甲蓝(MB )作为受氢体,亚甲蓝接受琥珀酸脱下的氢由蓝色还原成无色的甲烯白(MBH 2)。丙二酸与琥珀酸分子结构相似,能竞争性抑制琥珀酸脱氢酶。通过观察亚甲蓝颜色消退的程度,可以判断丙二酸对琥珀酸脱氢酶的抑制程度。 COOH CH CH + MB COOH CH 2CH 2+ MBH 2 琥珀酸 亚甲蓝(蓝色) 延胡索酸 还原性亚甲蓝(无色) 琥珀酸脱氢酶 【器材】 试管及试管架、滴管、剪刀、研钵或20ml 匀浆器、电热恒温水浴箱。 【试剂】 1. 0.1mol/L 磷酸缓冲液(PH7.4) 取0.1mol/L Na 2HPO 4溶液19ml 和0.1mol/L NaH 2PO 4溶液81ml 混合即可。 2. 1.5% 琥珀酸钠溶液 3. 1% 丙二酸钠溶液 4. 0.02% 亚甲蓝溶液 5.液状石蜡 【操作】 1. 取新鲜动物肌肉或肝5g 左右,放入研钵,用剪刀将组织剪碎,然后加入10ml 在冰箱中保存的PH7.4的磷酸缓冲液充分研磨均匀(或在匀浆器内进行匀浆,制备成20%匀浆液)。 2. 取4支试管,编号,按下表操作:
表3-11 丙二酸对琥珀酸脱氢酶的竞争性抑制作用 加入物(滴) 1 2 3 4 匀浆10 10 -10 1.5%琥珀酸钠溶 10 10 10 20 液 1%丙二酸钠溶液-10 10 10 蒸馏水20 10 20 - 0.02%亚甲蓝溶液10 10 10 10 3. 各管混匀后,各加少量液状石蜡覆盖在液体上,置37℃水浴中保温,随时观察各管颜色变化,并记录各管亚甲蓝褪色时间。 【结果及分析】 比较各管亚甲蓝褪色情况,并对实验结果进行分析。 【思考题】 1. 什么是竞争性抑制作用,与非竞争性抑制作用有何不同。 2. 为什么要用石蜡油隔绝空气来进行实验?
实验五琥珀酸脱氢酶的作用及其竞争性抑制 【实验目的】 1、掌握竞争性抑制概念及作用机理。 2、了解在无氧情况下观察脱氢酶作用的简单方法。 【实验原理】 存在于心肌、骨骼肌、肝脏等组织中琥珀酸脱氨酸,能使琥珀酸脱氢而成延胡索酸,脱下氢可使甲烯蓝退色,还原为甲稀白。反应如下: 草酸、丙二酸等在结构上与琥珀酸相似,可与琥珀酸竞争与琥珀酸脱氢酸的活性中心结合。若酶已与丙二酸等结合,则不能再与琥珀酸结合而使之脱氢,产生抑制作用,且抑制程度取决于琥珀酸与抑制剂在反应体系中浓度的相对比例,所以这种抑制是竞争性抑制。本实验通过观察在由不同浓度的琥珀酸与丙二酸组成的反应体系中使等量甲稀蓝退色反应时间,从而验证丙二酸对琥珀酸的竞争性抑制作用。 【实验用品】 1、试剂 (1)0.10mol/L磷酸盐缓冲液(pH7.4):0.1mol/L NaH2PO419ml 加0.1mol/LNa2HPO481ml。 (2)0.093mol/L琥珀酸钠溶液:取琥珀酸钠1.5g溶于100ml蒸馏水中。 (3)0.10mol/L丙二酸钠溶液:取丙二酸钠1.5g溶于100ml蒸馏水中。 (4)0.02%甲稀蓝溶液。 (5)液体石蜡。 2、器具 (1)0.10mol/L磷酸盐缓冲液(pH7.4):0.1mol/L NaH2PO419ml加0.1mol/LNa2HPO481ml。 (2)0.93mol/L琥珀酸钠溶液:取琥珀酸钠1.5g溶于100ml蒸馏水中。 (3)0.10mol/L丙二酸钠溶液:取丙二酸钠1.5g溶于100ml蒸馏水中。 (4)0.02%甲烯蓝溶液。 (5)液体石蜡。 2、器具 (1)恒温水浴箱(2)研钵或组织匀浆机 【实验操作】
溶菌酶溶液 简介: 华越洋溶菌酶溶液是浓度分别为10mg/ml的蛋清型溶菌酶溶液,可以用于下列分子生物学实验: 1.核酸纯化 2.包涵体蛋白纯化 3.质粒DNA纯化 4.几丁质的水解 5.细胞壁的水解 运输及保存: 低温运输,-20℃保存,有效期一年。 ============================================================= 溶菌酶存在于卵清、唾液等生物分泌液中,催化细菌细胞壁肽聚糖N-乙酰氨基葡糖与N-乙酰胞壁酸之间的1,4-β-糖苷键水解的酶。 溶菌酶(lysozyme)又称胞壁质酶(muramidase)或N-乙酰胞壁质聚糖水解酶(N-acetylmuramide glycanohydrlase),是一种能水解致病菌中黏多糖的碱性酶。主要通过破坏细胞壁中的N-乙酰胞壁酸和N-乙酰氨基葡糖之间的β-1,4糖苷键,使细胞壁不溶性黏多糖分解成可溶性糖肽,导致细胞壁破裂内容物逸出而使细菌溶解。溶菌酶还可与带负电荷的病毒蛋白直接结合,与DNA、RNA、脱辅基蛋白形成复盐,使病毒失活。因此,该酶具有抗菌、消炎、抗病毒等作用。
用途用于生化研究,临床上用于急慢性咽喉炎、扁平苔癣、扁平疣等疾病的治疗。 生产 以蛋清为原料,在pH6.5条件下用弱酸性阳离子交换树脂732吸附后,再用硫酸铵洗脱,经透析后冷冻干燥得产品。 制备 溶菌酶是采用生物工程技术进行克隆、提取而制取,它是一种天然酶,安全绿色的添加剂,无抗药性。该酶广泛存在于人体多种组织中,鸟类和家禽的蛋清、哺乳动物的泪、唾液、血浆、尿、乳汁等体液以及微生物中也含此酶,其中以蛋清含量最为丰富。从鸡蛋清中提取分离的溶菌酶是由18种129个氨基酸残基构成的单一肽链。它富含碱性氨基酸,有4对二硫键维持酶构型,是一种碱性蛋白质,其N端为赖氨酸,C端为亮氨酸。可分解溶壁微球菌、巨大芽孢杆菌、黄色八叠球菌等革兰阳性菌。 优点 1.溶菌酶是很稳定的蛋白质,有较强的抗热性。蛋清溶菌酶是C型,是已知的最耐热的酶;2.溶菌酶不会因为有机溶剂的处理而失活,当转移到水溶液中时,溶菌酶的活力可全部恢复;3.溶菌酶可被冷冻或干燥处理,且活力稳定;4.溶菌酶适宜pH5.3~6.4,可用于低酸性食品防腐;5.溶菌酶生产成本较低;6.溶菌酶的抗菌谱较广,不仅局限于G+ 菌,对部分G 菌也有抑制效果;7.溶菌酶作为防腐剂安全性高。溶菌酶是一种天然蛋白质,1992年FAO/WTO 的食品添加剂协会已经认定溶菌酶在食品中应用是安全的。 应用 医学应用 可作为一种具有杀菌作用的天然抗感染物质。有抗菌、抗病毒、止血、消肿止痛及加快组织恢复功能等作用。临床用于慢性鼻炎、急慢性咽喉炎、口腔溃疡、水痘、带状疱疹和扁平疣等。也可与抗菌药物合用治疗各种细菌和病毒感染。口服和肌注均有效。口服,3~5片/次(肠溶片含10mg),3次/日。口含,1片/次(口含片含20mg),4~6次/日。外用:以1%~2%溶液滴注、涂擦或直接喷粉。肌注,50mg~100mg/次,1~2次/日。滴眼:用2%溶液。副作用偶有较轻的过敏反应。氯化溶菌酶医疗效果更广,有浓痰分散、出血抑制、组织修复、消炎镇痛、抗过滤性病毒等作用,因而用氯化溶菌酶的制药有消炎消痔、治感冒、皮肤病及眼、鼻、喉等用药. 食品应用 可作为防腐剂,它的主要功用是水解细菌细胞壁,在细胞内,则对吞噬后的病原菌起破坏作用.该酶对革兰氏阳性菌中的枯草杆菌、耐辐射微球菌有分解作用。对大肠杆菌、普通变形菌和副溶血性弧菌等革兰氏阴性菌也有一定程度溶解作用,其最有效浓度为0.05%。与植酸、聚合磷酸盐、甘氨酸等配合使用,可提高其防腐效果。
溶菌酶试验综合型实验报告 目录 第1章引言 (2) 生化技术重要理论 (2) 蛋白质提取分离技术 (2) 第2章实验准备 (20) 2.1引言 (20) 2.2仪器及材料 (20) 2.3方法 (20) 第3章酶的提取 (22) 3.1引言 (22) 3.2内容及步骤 (23) 第4章酶的纯化 (24) 4.1引言 (24) 4.2方法 (25) 第5章酶活力、蛋白浓度测定 (26) 5.1引言 (26) 5.2仪器及试剂 (27) 5.3方法: (27) 5.4实验结果 (29) 第6章酶促动力学(Km测定、酶的抑制) (30) 6.1引言 (30) 6.2仪器及试剂 (31) 6.3方法 (31) 6.4 结论 (32) 第7章SDS-聚丙烯酰胺凝胶电泳测酶相对分子量及纯度鉴定 (33) 7.1引言 (33) 7.2方法 (34) 7.3 .结果 (35) 7.4结论 (35)
第1章引言 生化技术重要理论 蛋白质提取分离技术 以蛋白质和结构与功能为基础,从分子水平上认识生命现象,已经成为现代生物学发展的主要方向,研究蛋白质,首先要得到高度纯化并具有生物活性的目的物质。蛋白质的制备工作涉及物理、化学和生物等各方面知识,但基本原理不外乎两方面。一是得用混合物中几个组分分配率的差别,把它们分配到可用机械方法分离的两个或几个物相中,如盐析,有机溶剂提取,层析和结晶等;二是将混合物臵于单一物相中,通过物理力场的作用使各组分分配于来同区域而达到分离目的,如电泳,超速离心,超滤等。在所有这些方法的应用中必须注意保存生物大分子的完整性,防止酸、硷、高温,剧烈机械作用而导致所提物质生物活性的丧失。蛋白质的制备一般分为以下四个阶段:选择材料和预处理,细胞的破碎及细胞器的分离,提取和纯化,浓细、干燥和保存。 微生物、植物和动物都可做为制备蛋白质的原材料,所选用的材料主要依据实验目的来确定。对于微生物,应注意它的生长期,在微生物的对数生长期,酶和核酸的含量较高,可以获得高产量,以微生物为材料时有两种情况:(1)得用微生物菌体分泌到培养基中的代谢产物和胞外酶等;(2)利用菌体含有的生化物质,如蛋白质、核酸和胞内酶等。植物材料必须经过去壳,脱脂并注意植物品种和生长发育状况不同,其中所含生物大分子的量变化很大,另外与季节性关系密切。对动物组织,必须选择有效成份含量丰富的脏器组织为原材料,先进行绞碎、脱脂等处理。另外,对预处理好的材料,若不立即进行实验,应冷冻保存,对于易分解的生物大分子应选用新鲜材料制备。 1.蛋白质的分离纯化 1.1蛋白质(包括酶)的提取 大部分蛋白质都可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质则溶于乙醇、丙酮、丁醇等有机溶剂中,因些,可采用不同溶剂提取分离和纯化蛋白质及酶。 1.1.1水溶液提取法
溶菌酶的提纯结晶和活力测定 姓名:学号: 班级:指导老师: 一、实验前言 1.实验背景 溶菌酶(lysozyme)是一种能够水解细胞壁成分中N- 乙酰胞壁酸与N- 乙酰葡萄糖胺之间的β- 1,4 糖苷键的酶,被广泛应用于医药、食品工业、生物工程等方面,现从鸡蛋蛋清中提取溶菌酶已达到工业化生产水平。蛋清中的溶菌酶含量越高,酶活力越强,越有利于鸡蛋的保存,因此测定鸡蛋蛋清中的溶菌酶对我国溶菌酶生产、禽蛋产品加工有重要的指导作用,也为蛋品质评定提供了一个重要参数。 活力测定的基本原理是用一种细菌悬液作为基质,加入待测标本后保持一定时间,如样 品中含有溶菌酶则细菌被溶解,即其细胞壁不溶性多糖变成可溶性粘肤。测定方法很多:如平皿测定法、光电比浊法、粘度测定法、分解产物测定法(因为底物往往过量,通常不用底物)、化学滴定法、分光光度法及同位素技术,其中以平皿测定法和比浊法最为常用。 溶菌酶分布很广,而且不是单独存在的,往往是和许多因子共同作用、相互协调。同时,可以直接或间接地通过酶的分解产物而起作用。在这里许多问题正处于摸索阶段,有些方面通过特定的实验,预测其应用。而这些特定的实验往往对某种或某一个动物而言,还有其局限性。未定论的问题很多,许多应用尚未大面积使于临床,但是溶菌酶必将越来越引起人们的重视,特别是其广布于人体,在医药、科研方面的作用尤为重要. (l)抗菌 溶菌酶不但作用于革兰氏阳性细菌,而且它作为一种非特异性免疫,即对所有的病原微 生物都有一定程度的抵抗力,没有特殊的选择性,对身体的自然防御起很大作用.如鼻粘膜,口
腔中含有一些溶菌酶,临床用于治疗副鼻窦炎和龋齿;眼泪和白血球中溶菌酶含量最高,因此在干燥综合症诊断上,认为泪液溶菌酶值的下降可以提供敏感可靠的指标,并能反映泪腺受损程度;在白血病患者的尿中,含有大量溶菌酶,临床上可有效地诊断白血病。白血球中的溶菌酶在脱颗粒过程中被排列到噬菌体内,噬菌体感染宿主(抗原)后,诱导产生溶菌酶(抗体),这种溶菌酶是噬菌体染色体组,通过细胞壁分解酶和膜多糖分解酶的作用而表现,其主要功能一是使噬菌体产生吸附作用,二是使噬菌体向宿主菌体内注入DNA,溶菌酶在噬菌体侵入宿主菌细胞和溶菌的整个过程中都起着重要作用,此溶菌酶(抗体)和补体共同作用,使某些微生物敏感,因此,溶菌酶可能和噬菌体内其他抗微生物系统有协同作用,主要作用是消化细菌,而不是杀死细菌。普遍认为,这种白细胞具有抗肿瘤作用和治疗由细菌、病毒引起的炎症。以上这种抗原—抗体反应也可以在体外进行溶菌反应,即血清学反应,可解析细菌表层结构和作为研究分子生物学的材料,通过它寻找新酶类,也可用做病毒性传染病的诊断。 (2)抗病毒 一方面如流行感冒和腺病毒,可能它的蛋白质外壳具有溶菌酶的作用点,现已证明,腺病毒在人体内引起呼吸道炎症,在实验动物中引起肿瘤。因此,用溶菌酶可以治疗呼吸道疾患,抗动物肿瘤。另一方面溶菌酶作用的细菌产物可诱发产生干扰素,而干扰素主要功能是抗病毒。 (3)提高抗菌素疗效 因为抗菌素是微生物合成的代谢产物,通过抑制细菌细胞壁肤聚糖及核酸和蛋白质的合成,影响细胞膜,因而具有抑制或致死其他微生物的作用。而溶菌酶也作用于细胞膜,与抗菌素合用可提高疗效。 (4)组织修复
琥珀酸脱氢酶的作用及其竞争性抑制 [原理] 肌肉组织中含有琥珀酸脱氢酶,能催化琥珀酸脱氢转变成延胡索酸。反应中生成的FADH2可使蓝色的甲烯蓝还原为无色的甲烯白(还原型甲烯蓝)。丙二酸与琥珀酸的分子结构相似,是琥珀酸脱氢酶的竞争性抑制剂,故能与琥珀酸竞争琥珀酸脱氢酶的活性中心。丙二酸与琥珀酸脱氢酶结合后,酶活性受到抑制,则不能再催化琥珀酸的脱氢反应。抑制程度的大小,随抑制剂与底物两者浓度的比例而定。 本实验以甲烯蓝为受氢体,在隔绝空气的条件下,通过甲烯蓝的褪色程度来判断琥珀酸脱氢酶的活性,并籍此观察丙二酸对琥珀酸脱氢酶活性的抑制作用。 CH2COOH CH2 COOH FAD MB?2H(甲烯白) 琥珀酸 琥珀酸脱氢酶 CHCOOH HOOCCH FADH2MB(甲烯蓝) 延胡索酸 [试剂] 1.0.2mol/L琥珀酸: 取琥珀酸钠(MW:270.14)27克加水至500ml。 2.0.02mol/L琥珀酸: 取1液稀释10倍。 3.0.2mol/L丙二酸: 取丙二酸钠(MW:166.05)16.7克加水至500ml。 4.0.02mol/L丙二酸: 取3液稀释10倍。 5.1/15mol/L pH7.4磷酸盐缓冲: 1/15mol/LNa2HPO4溶液80.8ml与1/15mol/LKH2PO419.2ml 混合即成。 (1)1/15mol/LNa2HPO4溶液: 取Na2HPO4.12H2O (MW:358.14)23.876 克, 加水至1000ml。 (2)1/15mol/LKH2PO4溶液:取KH2PO4(MW:136.09)1.814克,加水至200ml. 6.0.02%甲烯蓝溶液 7.液体石蜡 [主要器材] 1.新鲜猪心 2.玻璃研钵 3.漏斗