
专题复习:陌生情景中化学方程式的书写技巧
题型1 氧化还原反应型的化学方程式和离子方程式的书写 【真题回顾】
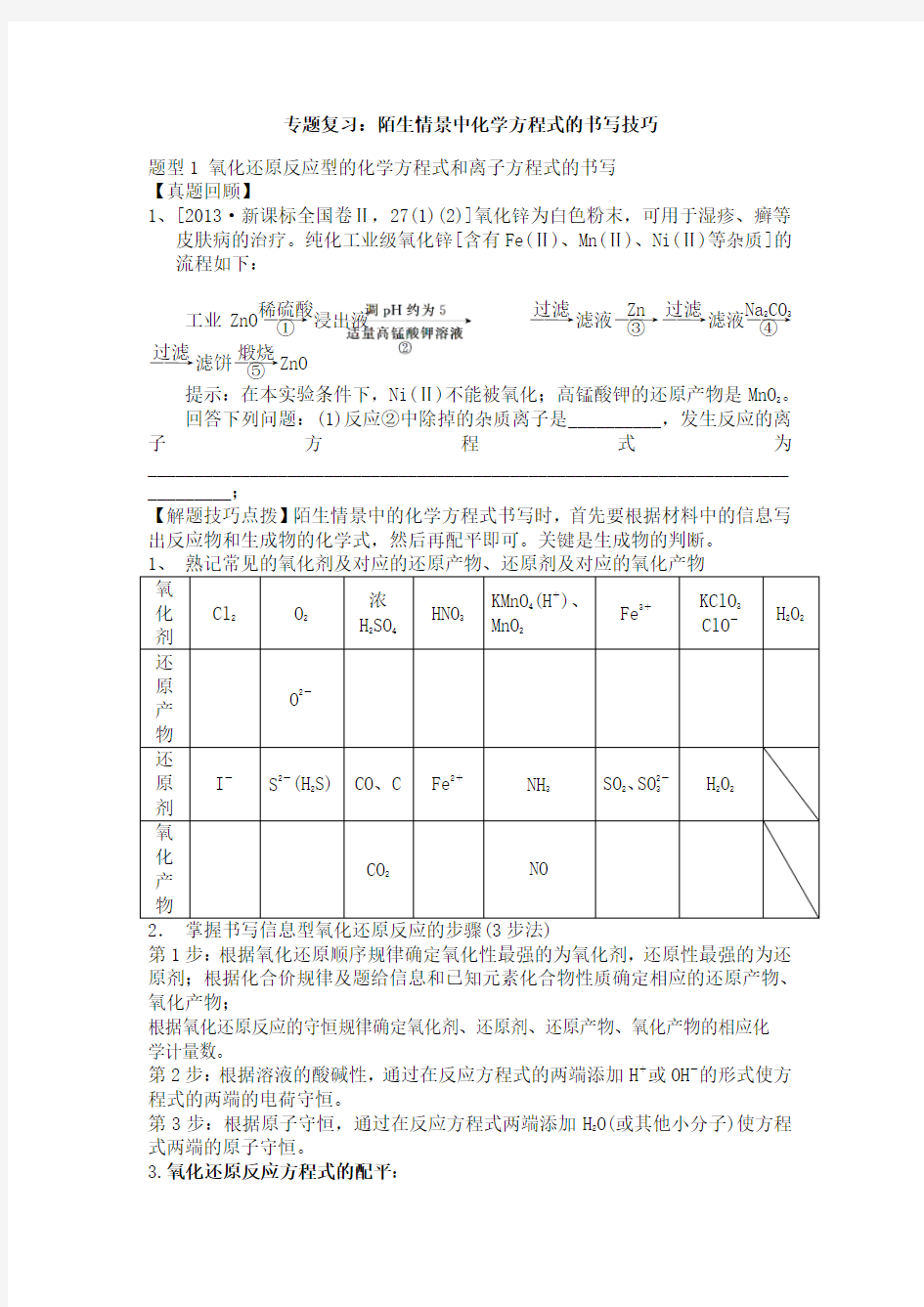
1、[2013·新课标全国卷Ⅱ,27(1)(2)]氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
工业ZnO ――→稀硫酸①浸出液 ――→过滤滤液――→Zn ③――→过滤滤液――→Na 2CO 3
④――→过滤滤饼――→煅烧⑤
ZnO 提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO 2。 回答下列问题:(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为______________________________________________________________________________;
【解题技巧点拨】陌生情景中的化学方程式书写时,首先要根据材料中的信息写出反应物和生成物的化学式,然后再配平即可。关键是生成物的判断。 氧
化剂 Cl 2 O 2 浓H 2SO 4 HNO 3 KMnO 4(H +)、MnO 2 Fe 3+ KClO 3
ClO -
H 2O 2
还原
产物 O 2-
还
原剂 I - S 2-(H 2S) CO 、C Fe 2+ NH 3 SO 2、SO 2-
3 H 2O 2 氧化
产物
CO 2 NO
第1步:根据氧化还原顺序规律确定氧化性最强的为氧化剂,还原性最强的为还原剂;根据化合价规律及题给信息和已知元素化合物性质确定相应的还原产物、氧化产物;
根据氧化还原反应的守恒规律确定氧化剂、还原剂、还原产物、氧化产物的相应化学计量数。 第2步:根据溶液的酸碱性,通过在反应方程式的两端添加H +或OH -的形式使方程式的两端的电荷守恒。
第3步:根据原子守恒,通过在反应方程式两端添加H 2O(或其他小分子)使方程式两端的原子守恒。
3.氧化还原反应方程式的配平:
步骤:①标出化合价变化了的元素的化合价。
②列变化:分别标出化合价升高数和化合价降低数
③根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。
④利用元素守恒,观察配平其他物质
对点集训
1.([2013·北京理综,27(2)]在酸性条件下,将MnO-
4
氧化Fe2+的离子方程式补充完整:
MnO-
4
+Fe2++________===Mn2++Fe3++________。
2.(08宁夏卷)(1)配平下面的化学方程式(将有关的化学计量数填入答题卡
的横线上):
□KMnO
4+□FeSO
4
+□H
2
SO
4
=□Fe
2
(SO
4
)
3
+□MnSO
4
+□K
2
SO
4
+□H
2
O
3.(08全国Ⅱ卷)(NH
4)
2
SO
4
在高温下分解,产物是SO
2
、H
2
O、N
2
和NH
3
。在该反
应的化学方程式中,化学计量数由小到大的产物分子依次是( )
A.SO
2、H
2
O、N
2
、NH
3
B.N
2
、SO
2
、H
2
O、NH
3
C.N
2、SO
2
、NH
3
、H
2
O D.H
2
O、NH
3
、SO
2
、N
2
4.(2012全国课标卷26)高铁酸钾(K
2FeO
4
)是一种强氧化剂,可作为水处理剂和
高容量电池材料。FeCl
3和KClO在强碱性条件下反应可制取K
2
FeO
4
,其反应
的离子方程式为;
5.(2013·江苏,16)氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制
备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO
3,含少量FeCO
3
)
为原料制备高纯氧化镁的实验流程如下:
(1)MgCO
3
与稀硫酸反应的离子方程式为_____________________________________。
(2)加入H
2O
2
氧化时,发生反应的化学方程式为
_______________________________。
6.在NaClO溶液中通入足量SO
2
,写出发生反应的离子方程式:__________________。
7.氧化还原反应是氧化和还原两个过程的对立统一。现有一个还原过程的反应式如下:
NO-
3+4H++3e-===NO↑+2H
2
O
(1)下列五种物质中能使上述还原过程发生的是________(填字母)。
A.KMnO
4B.Na
2
CO
3
C.Cu
2
O D.Fe
2
(SO
4
)
3
E.Si
(2)写出上述反应的化学方程式并配平:______________________________________。
题型2 电化学反应中的电极反应式的书写
【真题回顾】
1、【2013全国理综28】二甲醚直接燃料电池具有启动快、效率高等优点,其能
量密度高于甲醇直接燃料电池kW ·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为__________________________________
【对点集训】
1、(2010重庆卷29)(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示.
①当左槽溶液逐渐由黄变蓝,其电极反应式为.
2、(2012全国26)(4)高铁酸钾(K
2FeO
4
)是一种强氧化剂,可作为水处理剂和高
容量电池材料。与MnO
2—Zn电池类似,K
2
FeO
4
—Zn也可以组成碱性电池,K
2
FeO
4
在电池中作为正极材料,其电极反应式为,该电池总反应的离子方程式为。
3、(2012北京25)
写出HSO
3
-在阳极放电的电极反应式:
题型3.热化学方程式的书写
【真题回顾】
1、(2013全国28)二甲醚(CH
3OCH
3
)是无色气体,可作为一种新能源。有合成
气(组成为H
2、CO和少量的CO
2
)直接制备二甲醚,其中的主要过程包括以下四
个反应:
甲醇合成反应:
(i)CO(g)+2H
2(g)=CH
3
OH (g) △H1=·mol-1
(ii)CO
2(g)+3H
2
(g)=CH
3
OH(g)+H
2
O(g) △H2=·mol-1
水煤气变换反应:(iii) CO(g)+H
2O(g)=CO
2
(g)+H
2
(g) △H
3
=·mol-1
二甲醚合成反应:(iv)2CH
3OH(g)=CH
3
OCH
3
(g)+ H
2O(g) △H
4
=·mol-1
回答下列问题:
由H
2
和C0直接制备二甲醚(另一产物为水蒸
气)的热化学方程式为
_____________________。
【对点集训】
1、(2010安徽25)(4)处理含CO、SO
2
烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:CO(g)+1
2
O
2
(g)=CO
2
(g) ?H=-kJ·mol-2
S(g)+ O
2(g)=SO
2
(g) ?H=-kJ·mol-1
此反应的热化学方程式是。
2、(2010福建)已知液态化合物CS 2 0.2mol 在O 2中完全燃烧,生成两种气态氧化物,298K 时放出热量215kJ 。 该反应的热化学方程式为________。
3、(2010江苏)已知下列反应:
222()()()2()CO g SO g S g CO g +=+ 18.0J H k mol -?=
2222()()()2()H g SO g S g H O g +=+ 190.4J H k mol -?=
222()()2()CO g O g CO g += 1566.0J H k mol -?=-
2222()()2()H g O g H O g += 1483.6J H k mol -?=-
()S g 与2()O g 反应生成2()SO g 的热化学方程式为 。
4、(2012北京)用Cl 2生产某些含氯有机物时会产生副产物HC1。利用反应A ,可实现氯的循环利用。反应A: (1) 已知:Ⅰ反应A 中, 4mol HCI 被氧化,放出的热量。 反应A 的热化学方程式是_______________。
5、(2012天津)(14分)X 、Y 、Z 、M 、G 五种元素分属三个短周期,且原子序数依次增大。X 、Z 同主族,可形成离子化合物ZX ;Y 、M 同主族,可形成MY 2、MY 3两种分子。
请回答下列问题:
⑷ X 2M 的燃烧热ΔH = -a kJ·m o l -1 ,写出X 2M 燃烧反应的热化学方程式:
________________________________________________________
⑸ ZX 的电子式为___________;ZX 与水反应放出气体的化学方程式为___________________________。
⑹ 熔融状态下,Z 的单质和FeG 2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2
Fe + 2ZG
放电时,电池的正极反应式为__________________________: 充电时,______________(写物质名称)电极接电源的负极; 该电池的电解质为___________________。
【知识专题练习】 1、(2012全国27)光气(COCl 2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO 与Cl 2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为 。
(2)工业上利用天然气(主要成分为CH 4)与CO 2进行高温重整制备CO ,已知CH 4、H 2和CO 的燃烧热(△H)分别为 — KJ·mol -1、— KJ·mol -1、— KJ·mol -1,则生成1 m 3(标准状况)CO 所需热量为 ;
(3)实验室中可用氯仿(CHCl 3)与双氧水直接反应制备光气,其反应的化学方程式为 。
2、硫粉、炭粉与硝酸钾混合,可以得到黑火药。黑火药爆炸的产物与其组成有
关。一般黑火药组成为一硫二硝三碳,爆炸产物为K
2S、N
2
、CO
2
。
(1)写出黑火药爆炸反应的化学方程式
3.某校曾发生在实验室中学生误将高锰酸钾与红磷相混,发生爆炸,造成一死一
残的严重事故。试写出这一变化的化学方程式(KMnO
4的还原产物是MnO
2
)
________________________________________ (并用双线桥标明化合价升降)
4.某一反应体系中共有Pb
3O
4
、NO、MnO
2
、Cr
2
O
3
、Cr(MnO
4
)
2
和Pb(N
3
)
2
(名称叠氧
化铅,其中Pb为+2价)六种物质,已知Pb(N
3)
2
是反应物之一。根据你学过的
有关化学定律和知识,试写出这个反应的化学方程
式。
5.(1)有人烹调时,分别含有碘化钾和碘酸钾的加碘食盐混合,当滴食醋时,产生紫色蒸气,反应的离子方程式为
6.铁酸钠(Na
2FeO
4
)是处理过程中使用的一种新型净水剂,它的氧化性比高锰酸
钾更强,本身在反应中被还原成Fe3+离子。
(1)配平制取铁酸钠的化学方程式:
□Fe(NO
3)
3
+□NaOH+□Cl
2
---□Na
2
FeO
4
+□NaNO
3
+□NaCl+□H
2
O
7.(2008全国卷26)实验室可由软锰矿(主要成分为MnO
2)制备KMnO
4
,方法如
下:软锰矿和过量的固体KOH和KClO
3在高温下反应,生成锰酸钾(K
2
MnO
4
)和
KCl;用水溶解,滤去残渣,滤液酸化后,K
2MnO
4
转变为MnO
2
和KMnO
4
;滤去MnO
2
沉淀,浓缩溶液,结晶得到深紫色的针状KMnO
4
。试回答:
(1)软锰矿制备K
2MnO
4
的化学方程式是
;
(2)K
2MnO
4
制备KMnO
4
的离子方程式是
;
(3)KMnO
4能与热的经硫酸酸化的Na
2
C
2
O
4
反应,生成Mn2+和CO
2
,该反应的化学
方程式是;
8、实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO
2
等)制备聚
铁(碱式硫酸铁的聚合物)和绿矾(FeSO
4·7H
2
O),
过程如下:过程①中,FeS和O
2
、、
H 2SO
4
反应的化学方程式为:
___________________________________
9、冶金工业产生的废水中含有有毒的
CN-,工业上处理这种废水是在碱性条件下,
用NaClO来理。产物中有一种是气体,
请写出反应的离子方程式_____________
9、.将实验室FeSO
4
溶液与过氧化氢溶液混合,写出其离子方程式___________________________________
。
11、500℃时,L(标准状况)SO
2
在催化剂作用下与NO发生化学反应。若有2××1023个电子转移时,写出该反应的化学方程式_______________________ 。
12、将20mL ·L-1 Na
2SO
3
溶液逐滴加入到20 mL ·L-1KMnO
4
溶液(硫酸酸化)
中,溶液恰好褪为无色。写出反应的离子方程式_____________ 。
13、将SO
2通入酸性KMnO
4
溶液,溶液逐渐褪色,生成Mn2+,同时pH降低,则
该反应的离子方程式是___________________________
。
14、工业上为了处理含有Cr
2O
7
2-的酸性工业废水,采用下面的处理方法:往工业
废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)
3
和
Fe(OH)
3
沉淀生成,工业废水中铬的含量已低于排入标准。请回答下列问题:(1)两极发生反应的电极反应式阳极:___________________________
阴极:
(2)写出Cr
2O
7
2—变为Cr3+的离子方程式:
____________________________________
7.肼(N
2H
4
)又称联氨,是一种可燃性的液体,可用作火箭燃料。肼—空气燃料电
池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:
正极的电极反应式__________________________
负极的电极反应式__________________________