
盘点“糖类的知识”
068350 河北省丰宁县实验中学 马娟
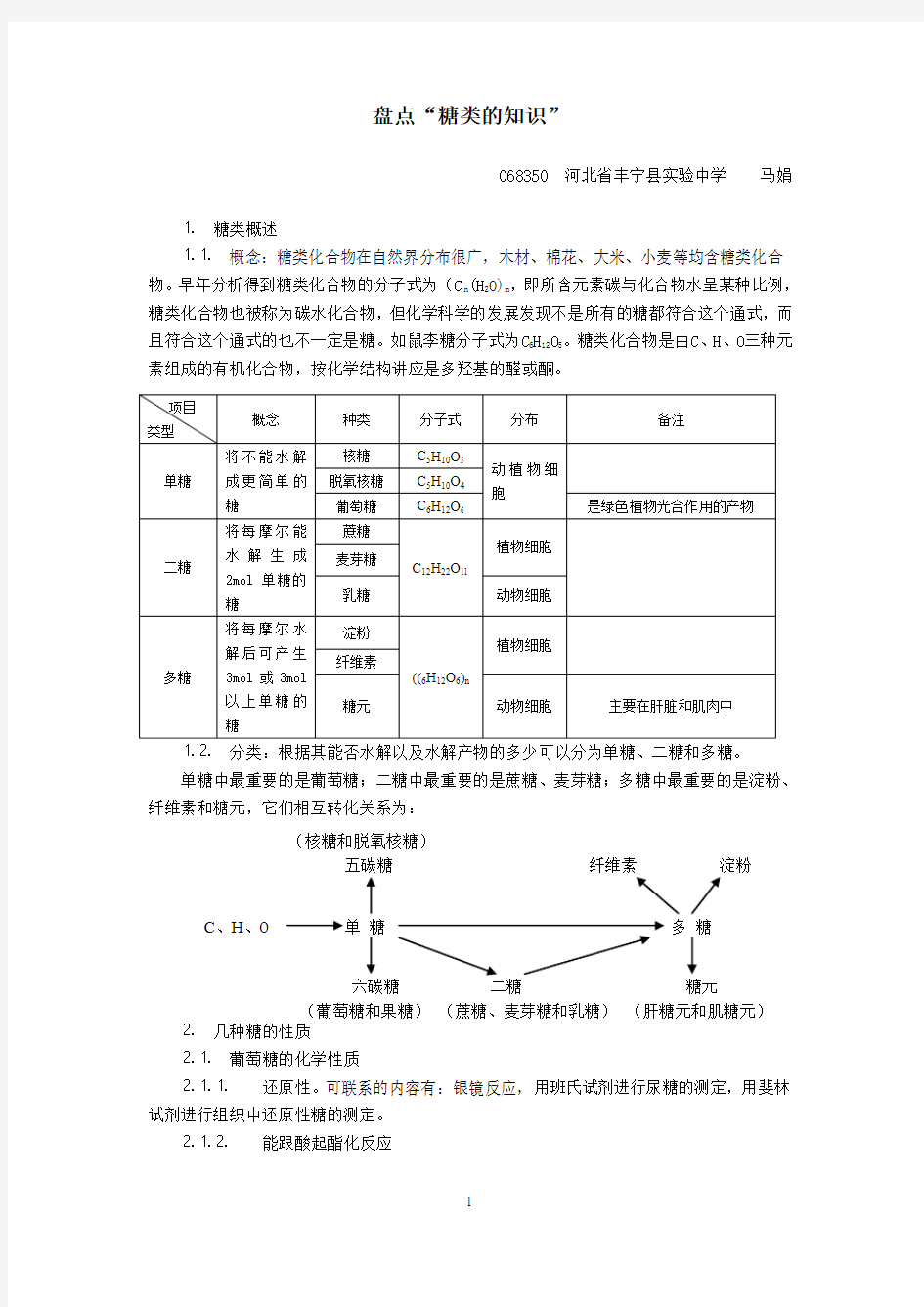
⒈ 糖类概述
⒈⒈ 概念:糖类化合物在自然界分布很广,木材、棉花、大米、小麦等均含糖类化合物。早年分析得到糖类化合物的分子式为(C n (H 2O)m ,即所含元素碳与化合物水呈某种比例,糖类化合物也被称为碳水化合物,但化学科学的发展发现不是所有的糖都符合这个通式,而且符合这个通式的也不一定是糖。如鼠李糖分子式为C 6H 12O 5。糖类化合物是由C 、H 、O 三种元素组成的有机化合物,按化学结构讲应是多羟基的醛或酮。
⒈⒉ 分类:根据其能否水解以及水解产物的多少可以分为单糖、二糖和多糖。 单糖中最重要的是葡萄糖;二糖中最重要的是蔗糖、麦芽糖;多糖中最重要的是淀粉、纤维素和糖元,它们相互转化关系为:
⒉
几种糖的性质
⒉⒈ 葡萄糖的化学性质
⒉⒈⒈ 还原性。可联系的内容有:银镜反应,用班氏试剂进行尿糖的测定,用斐林试剂进行组织中还原性糖的测定。
⒉⒈⒉ 能跟酸起酯化反应
C 、H 、O 单 糖 多 糖
五碳糖 纤维素 淀粉
六碳糖 二糖 糖元 (葡萄糖和果糖) (蔗糖、麦芽糖和乳糖) (肝糖元和肌糖元) (核糖和脱氧核糖)
⒉⒈⒊氧化反应。可联系的内容有:动植物细胞进行有氧呼吸和无氧呼吸时的比较,厌氧发酵(酒精发酵、乳酸发酵),兼性厌氧型微生物——酵母菌。
⒉⒉蔗糖和麦芽糖的化学性质。
⒉⒉⒈蔗糖不具有还原性,而麦芽糖具有还原性。可联系的内容有:还原性糖(还有果糖)与非还原性糖的鉴定。
⒉⒉⒉水解反应。蔗糖水解生成一分子葡萄糖和一分子果糖,而麦芽糖水解生成两分子葡萄糖。可联系的内容有:蔗糖不具有还原性,而它的水解产物具有还原性。
⒉⒊淀粉的化学性质
⒉⒊⒈跟碘作用呈现蓝色。可联系的内容有:用碘液检验淀粉。
⒉⒊⒉水解反应。可联系的内容有:食物中的淀粉的化学性消化的过程,工业上用硫酸等无机酸作催化剂水解制葡萄糖。
⒉⒋纤维素的化学性质
⒉⒋⒈水解反应。
⒉⒋⒉发生不完全的酯化反应。可联系的内容有:生成纤维素硝酸酯的反应、火棉与胶棉。
⒊糖类的功能
⒊⒈糖类是生物体的主要能源和碳源物质糖类物质可以通过分解而放出能量。糖类还可以为生物体合成其他化合物(如某些氨基酸、核苷酸、脂肪酸等)提供碳原子和碳链骨架,构成组织和细胞的成分。
⒊⒉糖类与生物体结构有关纤维素和壳多糖都不溶于水,有平坦伸展的带状构象,堆砌得很紧密,所以它们彼此之间的作用力很强,适于作强韧的结构材料。纤维素是细胞壁的主要成分。壳多糖是昆虫等生物体外壳的主要成分。细菌的细胞壁由刚性的肽聚糖组成,它们保护着质膜免受机械力和渗透作用的损伤,并使细菌具有特定的形状。
⒊⒊糖类是贮藏的养料糖类以颗粒状态储存于细胞中。
⒊⒋糖类是细胞通讯识别作用的基础细胞表面可以识别其他细胞或分子,并接受它们携带的信息,同时细胞表面也通过表面上的一些大分子表示其本身的活性。细胞与细胞之间的相互作用,是通过一些细胞表面复合糖类中的糖和与其互补的大分子来完成的。
⒊⒌糖类具有润滑保护作用黏膜分泌的粘液中有粘稠的粘多糖,可以保护润滑的表面。关节腔的滑液就是透明质酸经过大量水化而形成的粘液。
⒋植物体内糖的代谢:绿色植物体内糖类的代谢,可用下图表示。
⒌⒈糖的消化、吸收和代谢:见后附图一。注意事项:
⒌⒈⒈食物中的糖类来源大部分是淀粉,此外还有少量的蔗糖、乳糖、果糖等。它们都要经过消化水解变为单糖才能吸收。人和动物体内能直接利用的糖类是葡萄糖。
⒌⒈⒉C6H12O6进入红细胞的方式是协助扩散,但C6H12O6通过其他细胞的细胞膜的方式是主动运输,C6H12O6由肠腔进入组织细胞至少需要经过7次主动运输。
⒌⒈⒊肌糖元不能直接转化为C6H12O6进入血液中,必须首先转化为乳酸进入血液运至肝脏后再转变为肝糖元或葡萄糖。
⒌⒈⒋C6H12O6只有供就充足的时候才能转化为脂肪,但只要供应充足,糖类将很容易转变为脂肪。
⒌⒈⒌果糖是通过弥散作用进入上皮细胞。
⒌⒈⒍血糖的去路是层递的,非并列式的。
⒌⒈⒎肌糖元分解后不能进入血液,只能供肌细胞利用。
⒌⒈⒏尿糖的测定:利用班氏糖定性试剂或斐林试剂检测尿液中是否含有葡萄糖(还原性糖)
⒌⒉糖类代谢与人体健康
⒌⒊糖类和脂质之间的转化关系:
⒌⒊⒈糖类可大量转变为脂肪:糖类代谢的中间产物可以转变为甘油和脂肪酸,两者结合生成脂肪,这种转变在人和动物体内可大量进行,这就是吃糖能胖人的原理。
⒌⒊⒉脂肪只能少量转变为糖:在人和动物体内,甘油经一系列过程可以转变为糖,而脂肪酸却几乎不能转变为糖,因此,脂肪不能大量转变为糖。这就是肥胖后很难减肥的原因之一。
⒌⒋糖类和蛋白质之间的转化关系:
⒌⒋⒈糖类代谢的中间产物可以转变为非必需氨基酸:糖类在分解过程中产生的一些中间产物(如丙酮酸)可通过转氨基作用产生与之相对的非必需氨基酸,但由于糖类分解时不能产生与必需氨基酸相对应的中间产物,因此糖类不能转化为必需氨基酸,这也是人体
每天必须摄取一定量蛋白质的原因之一。
⒌⒋⒉蛋白质可以转化为糖类:
水解作用脱氨基作用
蛋白质氨基酸不含N部分糖类
⒍血糖平衡的调节:
⒍⒈图示血糖平衡的调节:血糖的平衡依赖于血浆中有适量的相关激素,适量的相关激素又是通过复杂的神经调节和体液调节共同作用实现的。
整合激素的直接调节血糖调节的总体过程可以归纳概括如下图解:
血糖调节的中枢在下丘脑,其神经调节的简要过程如下:
当血糖含量降低时,刺激下丘脑某一区域的有关神经(交感神经),然后作用于胰岛A 细胞,使其分泌胰高血糖素增加,从而升高血糖含量。
当血糖含量升高时,刺激下丘脑另一区域的有关神经(副交感神经),然后作用于胰岛B细胞,使其分泌胰岛素增加,从而降低血糖含量。维持血糖平衡的激素调节与神经调节之间的联系如下图:
⒍⒉与血糖平衡调节有关的三种激素:
⒍⒉⒈肾上腺素与胰高血糖素协同作用使肝糖元分解
⒍⒉⒉胰岛素和胰高血糖素的拮抗作用使血糖维持相对稳定。
⒌⒉⒊胰高血糖素可使非糖物质转化为葡萄糖。
⒍⒉⒋胰高血糖素促进胰岛素的分泌,胰岛素抑制胰高血糖素的分泌。
⒍⒊肝脏是调节血糖浓度的主要器官。当饭后血糖浓度升高时,肝脏利用血糖合成糖原(肝糖原约占肝重的5%)。过多的糖则可在肝脏转变为脂肪以及加速磷酸戊糖循环等,从而降低血糖,维持血糖浓度的恒定。相反,当血糖浓度降低时,肝糖原分解及糖异生作用加强,生成葡萄糖送入血中,调节血糖浓度,使之不致过低。因此,严重肝病时,易出现空腹血糖降低,主要由于肝糖原贮存减少以及糖异生作用障碍的缘故。临床上,可通过耐量试验(主要是半乳糖耐量试验)及测定血中乳酸含量来观察肝脏糖原生成及糖异生是否正常。
⒎糖类的应用
⒎⒈生物学意义:
⒎⒈⒈糖类是构成生物体的重要成分,也是细胞的主要能源物质。
⒎⒈⒉淀粉和糖元分别是指植物和动物细胞中储藏能量的物质,纤维素是植物细胞壁的成分。
⒎⒉葡萄糖还用于制药工业、糖果工业,制镜工业和热水瓶胆镀银用葡萄糖作还原剂。食品行业:食品级葡萄糖用于制造糕点、面包、罐头等食品的甜味剂和营养剂;用做蔬菜保鲜剂可以使蔬菜在长途运输过程中保持鲜嫩;用在食品烘烤业来生产面包及糕点。用于面包可以促进酵母生长,并产生气体,还会促进面包皮的褐变反应,使最终产品在外观及风格上受人喜欢,既提高了产品的口味,又符合营养保健的要求。
制药工业:在饮料中使用葡萄糖,可立即起到使饮用者消除饥饿和增强运动能力的作用,葡萄糖作为甜味剂的特点是能使配合的香味更为精细,即使达到20%的浓度,也不会像蔗糖那样产生令人不适的浓甜感。口服用葡萄糖可用于各种疾病治疗和营养元素强化剂。
⒎⒊淀粉可用来制葡萄糖和酒精。
⒎⒋纤维素用于制造纤维素硝酸酯、纤维素乙酸酯、粘胶纤维和造纸等。
一. 对有关“蛋白质”知识点的梳理 2、“两个标准”是指判断组成蛋白质的氨基酸必须同时具备的标准有2个:一是数量标准,即每种氨基酸分子至少都含有一个氨基和一个羧基;二是位置标准,即都是一个氨基和一个羧基连接在同一个碳原子上。 3、“三个数量关系”是指蛋白质分子合成过程中的3个数量关系(氨基酸数、肽键数或脱水分子数、肽链数),它们的关系为:当n个氨基酸缩合成一条肽链时,脱水分子数为,形成个肽键,即脱去的水分子数=肽键数=氨基酸数-1= n-1;当n个氨基酸形成m条肽链时,肽键数=脱水分子数= n-m。 环肽,n个氨基酸缩合成一个环肽,脱水数=肽键数=氨基酸数= n。 4、“四个原因”是指蛋白质分子结构多样性的原因有4个:(1)氨基酸分子的种类不同; (2)氨基酸分子的数量不同;(3)氨基酸分子的排列次序不同;(4)多肽链的空间结构不同。 5、“五大功能”是指蛋白质分子主要有5大功能(功能多样性是由分子结构的多样性决定): (1)结构蛋白:是构成细胞和生物体的重要物质,如人和动物的肌肉主要是蛋白质;(2)催化作用,如参与生物体各种生命活动的绝大多数酶;(少量为RNA)(3)运输作用,如细胞膜上的载体、红细胞中的血红蛋白; (4)调节作用,例如部分激素,胰岛素和生长激素都是蛋白质。(激素都有调节作用,但不一定都为蛋白质); (记忆)胰岛素只能注射原因:胰岛素是蛋白质,口服会被消化酶水解,失去药效。 (5)免疫(包括细胞识别)作用,如抗体、受体、(糖蛋白)。 6.蛋白质必含元素C、H、O、N(可能含有S、Fe,均存在与R基上)。 7、富含蛋白质的食物:肉、蛋、奶和大豆制品。 8、氨基酸分为必需氨基酸和非必需氨基酸。必须从外界获取在体内不能合成的称为必需氨基酸。有8种(苯丙氨酸、甲硫氨酸、赖氨酸、苏氨酸、色氨酸、亮氨酸、异亮氨酸、缬氨酸)婴儿9种(赖氨酸)。常以谷类(尤其玉米)为食的人群应补充赖氨酸。在体内由甲种氨基酸合成乙种氨基酸,可得乙为非必需氨基酸。 9、蛋白质、核酸是生物大分子,氨基酸、核苷酸为小分子。 10、脱水缩合形成二肽(),产物(二肽和水)。肽键()。双缩脲试剂(A质量浓度0.1g/ml的NaOH溶液,B质量浓度0.01g/ml 的CuSO2溶液)与肽键发生紫色显色反应(2个及以上) 11、多肽通常条件下为链状结构(做题时出现“通常或一般情况下”则不考虑环肽)。肽链盘曲折叠行程呢共有一定空间结构的蛋白质分子。许多蛋白质有几条连,通过一定的化学键(二硫键、链间肽键)互相结合在一起。这些肽链不呈直线,也不在一个平面上。 12.胰岛素由两条肽链组成(最好记住),51个氨基酸。 13、蛋白质多样性的根本原因:遗传信息的多样性。 14、盐析是可逆的。变性是不可逆的。高温、强酸、强碱和重金属盐都能够使蛋白质变性。(应用:汞中毒后喝牛奶、高温杀菌、医用酒精消毒等)。吃熟鸡蛋更容易消化原因(高温使蛋白质分子的空间结构变得伸展、松散,容易被蛋白酶水解。) 15、一切生命活动都离不开蛋白质,蛋白质是生命活动的主要承担者(体现者)。 二. 归类分析1. 有关蛋白质中肽键数及脱下水分子数的计算 m个氨基酸分子缩合成n条多肽链时,要脱下m-n个水分子,同时形成个m-n肽键,可用公式表示为:肽键数目=脱下的水分子数=水解时需要的水分子数=氨基酸数(m)-肽链条数(n) 例1. 血红蛋白分子有574个氨基酸,4条肽链,在形成此蛋白质分子时,脱下的水分子数和形成的肽键数分别是()分析:依据脱下的水分子数=肽键数目=氨基酸数-肽链条数,直接得到答案D. 570和570 2. 有关蛋白质中游离的氨基或羧基数目的计算 氨基酸之间脱水缩合时,原来的氨基和羧基已不存在,形成的多肽的一端是-NH2,另一端是—COOH,所以对于n条肽链的多肽,每1条肽链至少应有1个-NH2,1个—COOH,若还有-NH2或—COOH,则存在于R基中。 (1)至少含有的游离氨基或羧基数目=肽链条数 例2. 某蛋白质分子由3条多肽链组成,内有肽键109个,则此分子中含有-NH2或—COOH的数目至少为:()分析:每1条多肽链至少含有1个氨基和1个羧基,并且分别位于这条肽链的两端。3条多肽链应至少含有3个氨基和3个羧基。答案为3、3。 (2)游离氨基或羧基数目=肽链条数+R基中含有的氨基或羧基数 例3. 现有1000个氨基酸,其中氨基有1020个,羧基1050个,则由此合成的4条肽链中氨基、羧基的数目分别是()分析:1000个氨基酸中含有氨基1020个,羧基1050个,多出来的20个氨基或50个羧基存在于R基中,依蛋白质中含有的游离氨基或羧基数目=肽链条数+R基中含有的氨基或羧基数,得到答案为C. 24、54。 3. 有关蛋白质相对分子质量的计算 蛋白质的相对分子质量=氨基酸数目×氨基酸的平均分子质量-脱下水的数目×18 - 二硫键数×2 例4. 已知20种氨基酸的平均分子质量是128,某蛋白质分子由两条肽链组成,共有肽键98个,该蛋白质的分子质量最接近于()分析:根据蛋白质中肽键数=氨基酸数-肽链条数,可以推知氨基酸的数目为98+2=100,在此蛋白质的形成过程中失去的水分子数为98,答案为11036。
1 了解最基础简单得急救知识(心肺脑复苏) 2 处理野外常见得意外情况(创伤/出血/溺水/高空坠落/烧烫伤/冻伤/高原病等) [慨述] 1心肺脑复苏:即针对呼吸与循环骤停所采取得急救措施,以人工呼吸替代病人得自主呼吸,以心脏按压形成暂时得人工循环并诱发心脏得自主搏动。更重要得就是中枢神经系统得恢复。 2 早期复苏得重要性:心脏停搏4分钟内开始复苏效果好,有效复苏得时间虽然仅有分秒之差却显著影响复苏效果 [步骤] 1 初期复苏:主要任务就是迅速有效得恢复生命器官(特别就是心脏与脑得血液灌流与缺氧) A(airway):保持呼吸道通畅 B(breathing)有效得人工呼吸 C(circulation)建立有效得人工循环 1 迅速判断意识情况 2 呼救 3放置于仰卧位 4通畅气道(亨利斯手法) 5判断有无呼吸,行人工呼吸 6判断有无心跳,行心脏按压(体位、部位、*作方法、并发症、有效按压得指标、心前区捶击) 一人工呼吸 首先保持呼吸道通畅 a:以耳靠近病人得鼻与口,以听或感觉就是否有气流(也可观察棉花或纸条) b:观察病人得胸廓就是否有起伏 判断呼吸就是否停止 清除呼吸道内得异物或分泌物,利用托下颌或将头部后仰可消除舌后缀引起得气道梗阻 口对口人工呼吸
口对鼻或口对口鼻人工呼吸 二心脏按压 外伤后如何止血 正常男性总血量约占体重得8%,女性约占7、5%。外伤时失血量达总血量得20%,可出现头昏,乏力,颜面苍白,口干,四肢发冷,冷汗淋漓,呼吸急促,脉搏细弱,血压急剧下降以至测不到。失学量达到40%有生命危险,能迅速止血意义重大。 [分类] 外出血:血液从皮肤向体外流出 内出血:血液从破裂得血管流入组织,脏器或体腔内 静脉出血:颜色暗红,流出缓慢,呈持续性 动脉出血:颜色鲜红,血流急,呈喷泉状或一汩汩涌出 毛细血管出血:颜色较鲜红,从整个创面渗出,找不到明显得出血点,一般可自行凝固。 如受伤后无外出血,但有失血得表现或两者不成比例应警惕,应急送医院。 [方法] 1指压法:适用于中等或较大得动脉出血得急救。用手指或掌把出血得血管上端(即出血得近心端)用力压向下面得骨骼,阻断血液来源以达到暂时止血得目得。不同得出血部位,应选择不同得指压点。 A头顶及颞部出血:在耳前对准下颌关节上方,压迫颞浅动脉。如双侧出血,可同时压迫双侧颞浅动脉 B 颜面部出血:在下颌角前约半寸凹陷处,将面动脉压于下颌骨上 C 头颈部出血:气管外侧,甲状软骨旁,胸锁乳突肌前源,用拇指按压颈总动脉,余四指放于颈后部,把血管用力压于颈椎上。绝对禁止同时压迫双侧颈总动脉,可能出现心脏骤停。 D上臂下部,前臂及手出血:压迫上臂内侧肱动脉于肱骨上 E 手掌及手指出血:双拇指分别压迫腕横纹上内侧与外侧。自救时,可用健侧手握紧伤侧手腕 F在腹股沟中下1/3处,将鼓动脉压在股骨上 H 足部出血:用双拇指分别压迫足中部近脚腕处与足跟内侧与内踝之间得动脉
线粒体: 1.呼吸链(电子传递链)Respiratory chain一系列能够可逆地接受和释放H+和e-的化学物质所组成的酶体系在线粒体内膜上有序地排列成互相关联的链状。 2.化学渗透假说(氧化磷酸化偶联机制):线粒体内膜上的呼吸链起质子泵的作用,利用高能电子传递过程中释放的能量将H+泵出内膜外,造成内膜内外的一个H+梯度(严格地讲是离子的电化学梯度),A TP合酶再利用这个电化学梯度来合成A TP。 3.电子载体:在电子传递过程中与释放的电子结合并将电子传递下去的物质称为电子载体。参与传递的电子载体有四种∶黄素蛋白、细胞色素、铁硫蛋白和辅酶Q,在这四类电子载体中,除了辅酶Q以外,接受和提供电子的氧化还原中心都是与蛋白相连的辅基。 4.阈值效应:突变所产生的效应取决于该细胞中野生型和突变型线粒体DNA的比例,只有突变型DNA达到一定数量(阈值)才足以引起细胞的功能障碍,这种现象称为阈值效应。 5.导向序列:将游离核糖体上合成的蛋白质的N-端信号称为导向信号,或导向序列,由于这一段序列是氨基酸组成的肽,所以又称为转运肽。 6.信号序列:将膜结合核糖体上合成的蛋白质的N-端的序列称为信号序列,将组成该序列的肽称为信号肽。 7.共翻译转运:膜结合核糖体上合成的蛋白质通过定位信号,一边翻译,一边进入内质网,由于这种转运定位是在蛋白质翻译的同时进行的,故称为共翻译转运。 8.蛋白质分选:在膜结合核糖体上合成的蛋白质通过信号肽,经过连续的膜系统转运分选才能到达最终的目的地,这一过程又称为蛋白质分选。 核糖体: 1.原核生物mRNA中与核糖体16S rRNA结合的序列称为SD序列(SD sequence) 。 2.核酶:将具有酶功能的RNA称为核酶。 3.N-端规则(N-end rule): 每一种蛋白质都有寿命特征,称为半衰期(half-life)。研究发现多肽链N-端特异的氨基酸与半衰期相关,称为N-端规则。 4.泛素介导途径:蛋白酶体对蛋白质的降解通过泛素(ubiquitin)介导,故称为泛素降解途径。蛋白酶体对蛋白质的降解作用分为两个过程:一是对被降解的蛋白质进行标记,由泛素完成;二是蛋白酶解作用,由蛋白酶体催化。 细胞核: 1.核内膜:有特有的蛋白成份(如核纤层蛋白B受体),膜的内表面有一层网络状纤维蛋白质,即核纤层(nuclear lamina),可支持核膜。 核外膜:靠向细胞质的一层,是内质网的一部分,胞质面附有核糖体 核周隙:内、外膜之间有宽20~40nm的腔隙,与粗面内质网腔相通 核孔复合体:内、外膜融合处,物质运输的通道 核纤层:内核膜内表面的纤维网络,支持核膜,并与染色质、核骨架相连。 2.核孔复合体:是细胞核内外膜融合形成的小孔,直径约为70 nm,是细胞核与细胞质间物质交换的通道。 3.核孔蛋白:参与构成核孔的蛋白质,可能在经核孔的主动运输中发挥作用。 核运输受体:参与物质通过核孔的主动运输。 核周蛋白: 是一类与核孔选择性运输有关的蛋白家族,相当于受体蛋白。 5.输入蛋白:核定位信号的受体蛋白, 存在于胞质溶胶中, 可与核定位信号结合, 帮助核蛋白进入细胞核。 输出蛋白:存在于细胞核中识别并与输出信号结合的蛋白质, 帮助核内物质通过核孔复合
高中化学知识点规律大全 ——糖类油脂蛋白质 1.糖类 [糖类的结构和组成] (1)糖类的结构:分子中含有多个羟基、醛基的多羟基醛,以及水解后能生成多羟基醛的由C、H、O组成的有机物.糖类根据其能否水解以及水解产物的多少,可分为单糖、二糖和多糖等. (2)糖类的组成:糖类的通式为Cn(H2O)m,对此通式,要注意掌握以下两点:①该通式只能说明糖类是由C、H、O三种元素组成的,并不能反映糖类的结构;②少数属于糖类的物质不一定符合此通式,如鼠李糖的分子式为C6H12O5;反之,符合这一通式的有机物不一定属于糖类,如甲醛CH2O、乙酸C2H4O2等. [单糖——葡萄糖] (1)自然界中的存在:葡萄和其他带甜味的水果中,以及蜂蜜和人的血液里. (2)结构:分子式为C6H12O6(与甲醛、乙酸、乙酸乙酯等的最简式相同,均为CH2O),其结构简式为:CH2OH -(CHOH)4-CHO,是一种多羟基醛. (3)化学性质:兼有醇和醛的化学性质. ①能发生银镜反应. ②与新制的Cu(OH)2碱性悬浊液共热生成红色沉淀. ③能被H2还原: CH2OH-(CHOH)4-CHO + H 2CH2OH-(CHOH)4-CH2OH(己六醇) ④酯化反应: CH2OH-(CHOH)4-CHO+5CH3COOH CH2-(CH):--CHO(五乙酸葡萄糖酯) OOCCH3 (4)用途:①是一种重要的营养物质,它在人体组织中进行氧化反应,放出热量,以供维持人体生命活动所需要的能量;②用于制镜业、糖果制造业;③用于医药工业.体弱多病和血糖过低的患者可通过静脉注射葡萄糖溶液的方式来迅速补充营养.
(1)多糖:由许多个单糖分子按照一定的方式,通过分子间脱水缩聚而成的高分子化合物.淀粉和纤维素是最重要的多糖. (2)高分子化合物;即相对分子质量很大的化合物.从结构上来说,高分子化合物通过加聚或缩聚而成.判断是否为高分子化合物的方法是看其化学式中是否有n值(叫做聚合度),如聚乙烯卡CH:一CH2头、淀粉(C6H10O5)n等都是高分子化合物.通过人工合成的高分子化合物属于合成高分子化合物,而淀粉、纤维素等则属于天然高分子化合物. NaOH 24 溶液中和稀H2SO4,使溶液呈碱性,才能再加入银氨溶液并水浴加热. 2.油脂 [油脂] (1)油脂的组成和结构:油脂属于酯类,是脂肪和油的统称.油脂是由多种高级脂肪酸(如硬脂酸、软脂酸等)与甘油生成的甘油酯.它的结构式表示如下: 在结构式中,R1、R2、R3代表饱和烃基或不饱和烃基.若R l=R2=R3,叫单甘油酯;若R1、R2、R3不相同,则称为混甘油酯.天然油脂大多数是混甘油酯. (2)油脂的物理性质: ①状态:由不饱和的油酸形成的甘油酯(油酸甘油酯)熔点较低,常温下呈液态,称为油;而由饱和的软脂酸或硬脂酸生成的甘油酯(软脂酸甘油酯、硬脂酸甘油酯)熔点较高,常温下呈固态,称为脂肪.油脂是油和脂肪的混合物. ②溶解性:不溶于水,易溶于有机溶剂(工业上根据这一性质,常用有机溶剂来提取植物种子里的油). (3)油脂的化学性质:
一、蛋白质化学 蛋白质的特征性元素(N),主要元素:C、H、O、N、S,根据含氮量换算蛋白质含量:样品蛋白质含量=样品含氮量*6.25 (各种蛋白质的含氮量接近,平均值为16%), 组成蛋白质的氨基酸的数量(20种),酸性氨基酸/带负电荷的R基氨基酸:天冬氨酸(D)、谷氨酸(E); 碱性氨基酸/带正电荷的R基氨基酸:赖氨酸(K)、组氨酸(H)、精氨酸(R) 非极性脂肪族R基氨基酸:甘氨酸(G)、丙氨酸(A)、脯氨酸(P)、缬氨酸(V)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M); 极性不带电荷R基氨基酸:丝氨酸(S)、苏氨酸(T)、半胱氨酸(C)、天冬酰胺(N)、谷氨酰胺(Q); 芳香族R基氨基酸:苯丙氨酸(F)、络氨酸(Y)、色氨酸(W) 肽的基本特点 一级结构的定义:通常描述为蛋白质多肽链中氨基酸的连接顺序,简称氨基酸序列(由遗传信息决定)。维持稳定的化学键:肽键(主)、二硫键(可能存在), 二级结构的种类:α螺旋、β折叠、β转角、无规卷曲、超二级结构, 四级结构的特点:肽键数≧2,肽链之间无共价键相连,可独立形成三级结构,是否具有生物活性取决于是否达到其最高级结构 蛋白质的一级结构与功能的关系:1、蛋白质的一级结构决定其构象 2、一级结构相似则其功能也相似3、改变蛋白质的一级结构可以直接影响其功能因基因突变造成蛋白质结构或合成量异常而导致的疾病称分子病,如镰状细胞贫血(溶血性贫血),疯牛病是二级结构改变 等电点(pI)的定义:在某一pH值条件下,蛋白质的净电荷为零,则该pH值为蛋白质的等电点(pI)。 蛋白质在不同pH条件下的带电情况(取决于该蛋白质所带酸碱基团的解离状态):若溶液pH
品质基础知识-品质篇 一、品管工作 1、检验工作--进料、制程、成品检验;计量工具、质量记录保存。 2、预防工作--缺点记录之分析、数据之分析、抽样计划的设计。 3、评价工作--顾客抱怨处理、全厂品质稽核、品质报告提出、改善对策的成效评估。 二、品管部机能 1、对全厂品质管制教育之实施 2、品质活动之制定与推动 3、品质规范之建立 4、制程能力之解析 5、异常之对策改善活动 6、提示管制图或品质报告 7、供料厂商之辅导 8、客户品质抱怨之处 9、品质成本核算 10、各种检查工作之执行 三、品管中英文表示 1、IPQC(In Process Quality Control)-制程巡检 2、IQC( In Coming Quality Control)—进料检验 3、FQC(Final Quality Control)—最终品质检验 4、OQC(Outgoing Quality Control)--出货检验 5、QA(Quality Audit)--品质稽核 6、QA(Quality Assurance)---品质保证 7、QE(Quality Engineering)-----品质工程
8、QCC(Quality Control Circle)---品管圈 9、TQM(Total Quality Manaage)---全面品质经营 10、TQC(Total Quality Control)-----全面品质经营 11、SPC(Statistics Processs Control)----统计制程管制 12、COQ(Cost Of Quality)----品质成本 13、AQL(Accept Quality Control)---允收品质水准 四、品管名词解释 1、品质管制(QC)――为了经济地制造出符合消费者要求的品质之产品或服务之方法体系 2、品质保证(QA)----为了保证充分滿足消费者所要求的品质,生产和服务者在品质系统内实施并依需要证明其能提供足够的信心。使人相信某一实体将会达到品质要求而所进行之系统性活动称为品质保证。 3、品质检查(QI)――以某些方法来试验品质,并将其结果与品质判定基准比较,以确定各个物品为良品或不良品或与批定基准相比较以判定它是否合格。 4、全面品质管制(TQC)――将一个组织内各单位的品质开发、品质维持、及品质改进的各项努力整合起来籍以使行销,工程,生产与售后服务能以达到最经济的水准,使顾客完全滿意的有效制度。 5、全面品质保证――以顾客为导向从企画,执行、检查到回馈;包含了公司所有的部门及所有的成员不断地追求品质改善,依循零缺点的保证而成为习惯的一种方式。 6、质量――指某一项产品或服务整体之特徵,包括产品或服务明显和潜在之要求。 7、抽样检验―――从群体中随机抽取一定数量的样本,经过试验或测定以后以其结果与判定基准相比较,再利用统计方法,判定以群体是合格或不合格的检验过程,称为抽样检验。
高三第二轮复习生物知识结构网络 第一单元 生命的物质基础和结构基础 (细胞中的化合物、细胞的结构和功能、细胞增殖、分化、癌变和衰老、生物膜系统和细胞工程) 1.1化学元素与生物体的关系 1.2生物体中化学元素的组成特点 1.3生物界与非生物界的统一性和差异性
1.5蛋白质的相关计算 设构成蛋白质的氨基酸个数m, 构成蛋白质的肽链条数为n, 构成蛋白质的氨基酸的平均相对分子质量为a, 蛋白质中的肽键个数为x, 蛋白质的相对分子质量为y, 控制蛋白质的基因的最少碱基对数为r, 则肽键数=脱去的水分子数,为n m x- =……………………………………①蛋白质的相对分子质量x ma y18 - =…………………………………………② 或者x a r y18 3 - =…………………………………………③1.6蛋白质的组成层次
1.7核酸的基本组成单位 1.8生物大分子的组成特点及多样性的原因 1.9生物组织中还原性糖、脂肪、蛋白质和DNA的鉴定
1.10选择透过性膜的特点 1.11细胞膜的物质交换功能 1.12线粒体和叶绿体共同点 1、具有双层膜结构 2、进行能量转换 3、含遗传物质——DNA 4、能独立地控制性状 5、决定细胞质遗传 6、内含核糖体 7、有相对独立的转录翻译系统 8、能自我分裂增殖 1.13真核生物细胞器的比较 水 被选择的离子和小分子 其它离子、小分子和大分子 亲脂小分子 高浓度——→低浓度 不消耗细胞能量(A TP ) 离子、不亲脂小分子 低浓度——→高浓度 需载体蛋白运载 消耗细胞能量(ATP )
1.14细胞有丝分裂中核内DN A、染色体和染色单体变化规律 注:设间期染色体数目为2N个,未复制时DNA 含量为2a 。 1.15理化因素对细胞周期的影响 注:+ 表示有影响 1.16细胞分裂异常(或特殊形式分裂)的类型及结果 1.17细胞分裂与分化的关系 G
生物化学知识点总结 一、蛋白质 蛋白质的元素组成:C、H、O、N、S 大多数蛋白质含氮量较恒定,平均16%,即1g氮相当于6.25g蛋白质。6.25称作蛋白质系数。 样品中蛋白质含量=样品中含氮量×6.25 蛋白质紫外吸收在280nm,含3种芳香族氨基酸,可被紫外线吸收 等电点(pI):调节氨基酸溶液的pH值,使氨基酸所带净电荷为零,在电场中,不向任何一极移动,此时溶液的pH叫做氨基酸的等电点。 脯氨酸和羟脯氨酸与茚三酮反应产生黄色物质,其余的氨基酸与茚三酮反映均产生蓝紫色物质。氨基酸与茚三酮反应非常灵敏,几微克氨基酸就能显色。 肽平面:肽键由于C-N键有部分双键的性质,不能旋转,使相关的6个原子处于同一平面,称作肽平面或酰胺平面。 生物活性肽:能够调节生命活动或具有某些生理活动的寡肽和多肽的总称。 1)谷胱甘肽:存在于动植物和微生物细胞中的一种重要三肽,由谷氨酸(Glu)、半胱氨酸(Cys)和甘氨酸(Gly)组成,简称GSH。由于GSH含有一个活泼的巯基,可作为重要的还原剂保护体内蛋白质或酶分子中的巯基免遭氧化,使蛋白质或酶处在活性状态。 寡肽:10个以下氨基酸脱水缩合形成的肽 多肽:10个以上氨基酸脱水缩合形成的肽 蛋白质与多肽的区别: 蛋白质:空间构象相对稳定,氨基酸残基数较多 多肽:空间构象不稳定,氨基酸残基数较少 蛋白质的二级结构:多肽链在一级结构的基础上,某局部通过氢键使肽键平面进行盘曲,折叠,转角等形成的空间构象。 α?螺旋的结构特点: 1)以肽键平面为单位,以α?碳原子为转折盘旋形成右手螺旋;肽键平面与中心轴平行。2)每3.6个氨基酸残基绕成一个螺圈,螺距为0.54nm,每个氨基酸上升0.15nm。
质量基础知识 一、常用术语定义 质量的狭义定义:产品、体系、或过程的一组固有特性满足顾客和其他相关方要求的能力质量的广义定义:公司全面管理目标的实现。 如:供方的控制、成本、顾客满意度、新产品开发周期、生产周期、库存周转频次等 质量目标:企业在一定时期内在质量方面所要达到的预期成果。 2015年我司的质量目标是成品交付不合格率≤154PPM;外检进货检验拒收全年<28件;在工地出现AMT全年<26件;生产过程产品一次交验合格率≥99%; 检验的定义:采用某种方法(技术、手段)测量、检查、试验和计量产品的一种或多种质量特性并将测定结果与判定标准相比较,以判定每个产品或每批产品是否合格的过程。 检验的分类: 按检验数量分:全数检验、抽样检验; 按流程分:进货检验、过程检验、最终检验、出货检验; 按判别方法分:计数检验、计量检验; 按产品检验后产品是否可供使用来分:破坏性检验、非破坏性检验 全检:又称100%检验。是对一批产品进行全部检验的方法。 抽样检验:从一批产品中随机抽取一定量的样本,然后根据一定的判断标准来判断该产品是否合格。请注意:抽样对象应为怀疑品。 成批进货检验:又称进厂检验。在供应商正常交货时对该批物资进行的检验,其目的是防止不符合质量要求的原材料、外购件和外协件进入生产过程,并为稳定正常的生产秩序和保证产品质量提供必要的条件。 首件检验:在生产开始时或工序因素调整后,对制造的第一件或前几件进行的检验。 实施首件检验的前提:①采用工装、模具、程序进行加工的第一件合格品。 ②按照图纸进行组装的第一件合格品。 ③一模几件的第一模合格品 成品检验:又称最终检验或出厂检验。对完工后的成品质量进行检验,其目的在于保证不合格的成品不出厂、不入库,以确保用户利益和企业自身的信誉。 合格品:满足顾客要求的产品 合格率的计算方法(举例说明):某一批产品总数是5000,合格产品数量为4780,则其产品合格率=4780/5000*100%=95.6% 不合格品:不满足顾客要求的产品。 不合格率的计算方法(举例说明):某一批产品总数是5000,不合格品数量为220,则其产品不合格率=220/5000*100%=4.4% 按照实际需要,将不合格区分为A、B、C三类: A类不合格:根据判断和经验,易于对产品的使用者、维护者或产品有关人员造成危害或不安全状况的缺陷。单位产品的极重要质量特性不符合规定,或单位产品的质量特性极严重不符合规定。 B类不合格:易于造成故障或大大降低单位产品预定实用性的缺陷。单位产品的重要质量特性不符合规定,或单位产品的质量特性严重不符合规定。
急救常识培训 人工呼吸 1、人工呼吸是采用人工方法帮助病人呼吸,最后使病人恢复呼吸功能的一种急救技术。人工呼吸不仅在麻醉时使用,对溺水、电击、中毒、工矿事故、地震、航海意外和战地急救等往往是抢救能否成功的先决条件。 2、人工呼吸有多种方法,最常用的是口对口人工呼吸法和口对鼻人工呼吸法。口对口人工呼吸不需任何器械,操作时病人仰卧,头后仰,将病人衣领解开,腰带放松,清除口鼻内异物痰液,取出假牙,拉出舌头,保持呼吸道畅通。操作者一手托起下颌,另一手捏紧鼻孔,先深吸一口气,再对病人口部用力吹入,如此反复施行。如病人胸壁能随每次吹气而举起,吹气停止后于病人口部能感到气流呼出时,即证明人工呼吸有效。人工呼吸每分钟进行16次。如病人牙关紧闭,不能口对口呼吸则可进行口对鼻呼吸。如果同时有心跳停止,则可人工呼吸同时作胸外心脏按摩。一般人工呼吸与胸外心脏按摩比率为1:4,即作一次人工呼吸,需作4次胸外心脏按摩。 3、人工呼吸必须进行到病人出现自主呼吸,并继续间断进行才能有效。 胸外心脏按摩 1、胸外心脏按摩是借压迫胸壁使心脏受挤压而排血的方法。 2、如果人体出现意外伤害和疾病,如触电、溺水、外伤、出血、过敏反应、心脏病等,心脏停止跳动,各器官就会缺血坏死。大脑缺血超过6-8分钟,即可发生不可逆转的脑细胞死亡。此时一旦发现病人昏迷、苍白、无脉跳及心跳,即应立即进行胸外心脏按摩。 3、进行胸外心脏按摩时病人应仰卧,背部最好垫以硬板,操作者位于一侧,双臂伸直,两手掌放平重叠,用手掌跟部(并借用自身重量)按压病人胸正中下部,成人每次按压宜使胸壁下降3-4厘米,才能排血。按压后放松,如此反复进行。一般成人按压频率60次/分为宜。人工胸外心脏按摩常与人工呼吸同时进行。 4、人工胸外心脏按摩的有效指标是:能在颈部动脉、股动脉等大动脉部位摸到脉搏;听诊血压在60毫米汞柱以上;紫绀减轻;散大的瞳孔开始缩小;出现自主呼吸。 酒精中毒 1、醉酒轻者头晕、头痛、醉话连篇、行走不稳,严重者呕吐、流涕、苦笑无常、昏睡不醒,甚至于因呼吸中枢麻痹而死亡。这些都是酒精中毒的表现。有酒瘾的人容易成为慢性中毒者,经常酒醉的人容易造成肝硬化。 2、轻度中毒者眼部充血、颜面潮红或苍白、头晕头痛、欣快兴奋、言语增多。应让其喝些醋水(将食醋加入温开水)或吃些新鲜水果(如西瓜、萝卜等)。
蛋白质知识点解读 舟山中学 杨重云 1.元素:组成蛋白质的元素有C 、H 、O 、N ,有些蛋白质还含有S 。其中氮的含量较恒定,平均为16%,这是蛋白质元素组成的一个特点。因此,一般可以由测定生物样品中的氮,粗略地计算出其中蛋白质的含量(每一克氮相当于6.25克的蛋白质)。 2.氨基酸:组成蛋白质的基本单位是氨基酸。组成蛋白 质的氨基酸约有20种。氨基酸的结构通式为(右图所示): 由结构通式可知,氨基酸的分子式可表示为C 2H 4O 2—R , 氨基酸的结构特点为:一个中央C 原子上连接着一个氨基、一 个羧基、一个H 和一个R 基团。由于R 基上可能含有氨基或羧基,所以一个氨基酸至少有一个氨基和一个羧基。不同氨基酸的R 基团不同。 例1、下列各项关于氨基酸的叙述中,正确的是( ) A .氨基酸是蛋白质的组成单位,由氨基和羧基组成 B .每个氨基酸都含有一个氨基和一个羧基 C .两个氨基酸之间的羧基和氨基脱水缩合形成多肽 D .组成蛋白质的氨基酸分子中至少含有一个氨基和一个羧基并连接在同一个碳原子上 解析:氨基酸是组成蛋白质的基本单位,每个氨基酸分子中至少含有一个氨基和一个羧基并连接在同一个碳原子上。两个氨基酸分子脱水缩合形成的是二肽。 答案:D 3.脱水缩合:在酶的作用下,一个氨基酸的羧基提供的“—OH ”与另一个氨基酸的氨基提供的“—H ”生成一分子水被脱去,而羧基和氨基剩余的基团相连成为肽键,肽键的结构式为“—CO —NH —”。 在氨基酸脱水缩合过程中,有许多数量关系,是各种考试命题的热点,望同学们引起足
够重视。现把有关数量关系总结如下: 典型公式:肽键数=脱去的水分数;蛋白质的相对分子质量=氨基酸相对分子质量的总和—失去水分子的相对分子质量的总和。 例2、现有氨基酸800个,其中氨基总数为810个,羧基总数为808个,则由这些氨基酸合成的含有2条肽链的蛋白质共有肽键、氨基和羧基的数目依次分别为()A.798、2和2 B.798、12和10 C.799、1和1 D.799、11和9 解析:侧链基团上氨基总数为10个,侧链基团上羧基总数为8个,每条多肽链至少含一个氨基和一个羧基,故由这些氨基酸合成的含有2条肽链的蛋白质共有肽键、氨基和羧基的数目依次分别为798、12和10。 答案:B 4.蛋白质结构多样性:组成蛋白质的多肽链的氨基酸在种类、数量和排列顺序上的不同,构成蛋白质的多肽链在空间结构上的不同。每种蛋白质都有其独特的空间结构,正确的三维结构是蛋白质表现其特有的生物学活性所必需的。 例3、生物体内的蛋白质千差万别,其原因不可能是() A.组成肽键的化学元素不同B.组成蛋白质的氨基酸的种类和数量不同 C.氨基酸排列顺序不同D.组成蛋白质的多肽链的空间结构不同 解析:蛋白质内的肽键结构式为—CO—NH—,每个肽键中的化学元素都是相同的。 答案:A 5.蛋白质功能多样性:蛋白质的结构多样性决定了其功能多样性,二者是高度统一的。蛋白质功能主要有:①作为生物体和细胞的“建筑”材料,如肌肉中的蛋白质;②起着推动化学反应的作用,如消化食物的消化酶;③负责与疾病作斗争,如抗体参与清除病原体;④帮助物质出入细胞,如细胞膜上的载体;⑤调节作用,如胰岛素、生长激素等;⑥运输作用,如血红蛋白,等等。总之,蛋白质具有多种多样的重要功能,生物体的一切生命活动都与蛋白质有关。但要注意:蛋白质通常不是生物体的能源物质。
高中生物蛋白质知识点总结 蛋白质是组成人体一切细胞、组织的重要成分。机体所有重要的组 成部分都需要有蛋白质的参与。一般说,蛋白质约占人体全部质量的18%, 最重要的还是其与生命现象有关。下面是小编整理的高中生物蛋白质知识点 总结,供参考。 1.蛋白质基本含义蛋白质是由氨基酸以“脱水缩合”的方式组成的多肽链经 过盘曲折叠形成的具有一定空间结构的物质。蛋白质中一定含有碳、氢、氧、 氮元素。蛋白质是由α—氨基酸按一定顺序结合形成一条多肽链,再由一条 或一条以上的多肽链按照其特定方式结合而成的高分子化合物。蛋白质就是 构成人体组织器官的支架和主要物质,在人体生命活动中,起着重要作用, 可以说没有蛋白质就没有生命活动的存在。2.原子数由m个氨基酸,n条肽 链组成的蛋白质分子,至少含有n个—COOH,至少含有n个—NH2,肽键 m-n个,O原子m+n个。分子质量设氨基酸的平均相对分子质量为a,蛋白 质的相对分子质量=ma-18(m-n)基因控制基因中的核苷酸6信使RNA中的核 苷酸3蛋白质中氨基酸13.蛋白质组成及特点蛋白质是由C(碳)、H(氢)、O(氧)、N(氮)组成,一般蛋白质可能还会含有P(磷)、S(硫)、Fe(铁)、Zn(锌)、Cu(铜)、B(硼)、Mn(锰)、I(碘)、Mo(钼)等。这些元素在蛋白质中的组成百分比约为: 碳50%氢7%氧23%氮16%硫0~3%其他微量。(1)一切蛋白质都含N元素, 且各种蛋白质的含氮量很接近,平均为16%;(2)蛋白质系数:任何生物样品中 每1g元N的存在,就表示大约有100/16=6.25g蛋白质的存在,6.25常称为 蛋白质常数(3)蛋白质是以氨基酸为基本单位构成的生物高分子。蛋白质分子 上氨基酸的序列和由此形成的立体结构构成了蛋白质结构的多样性。蛋白质 具有一级、二级、三级、四级结构,蛋白质分子的结构决定了它的功能。
品质管理基础知识考试试题 部门:_____________ 姓名:_______________________ 得分:__________________ 1填空题(每空2分,共30分) a)质量是一组—固有特性满足要求—的程度。 b)质量具有_经济性、广义性、时效性、相对性—四个特点。 c)质量管理经历了—质量检验阶段、统计质量控制阶段、全面质量管理—三个阶段。 d)质量改进的基本过程是PDCA循环_。 e)影响产品质量的主要因素有—人、机、料、法、测、环_。 2、名词解释(每题2分,共计12分) a)要求:指明示的、通常隐含的或必须履行的需求和期望。 b)质量管理:是指在质量方面指挥和控制组织的协调活动。 c)质量改进:是质量管理的一部分,致力于增强质量要求的能力。 d)关键质量特性:是指若超过规定的特性值要求,会直接影响产品安全性或产品整机功能丧失的质量特性。 e)重要质量特性:是指若超过规定的特性值要求,将造成产品部分功能丧失的质量特性。 f)一般质量特性:是指若超过规定特性值要求,暂不影响产品功能,但可能会引超产品功能的逐渐丧失。 3、简述题(每题5分,共45分): a)如何理解质量? 简答:一组固有特性满足要求的程度。 固有特性:指某事物本身应具有的特性。如:定位销的外径、产品的外形等质量的内涵是由一组固有特性组成,并且这些固有特性是以满足顾客及相关方所要求的能力加以表征。质量具有经济性、广义性、时效性和相对性。 b)简述质量概念的发展? 简答:质量的概念由符合性发展到适用性,最后发展到广义质量。 符合性质量:它以符合”现行标准的程度作为衡量依据 适用性质量:它是以适合顾客需要的程度作为衡量标准。 广义质量的概念:即一组固有特性满足要求的程度。它既反应了要符合标准要求,也反应了满足顾客及相关方的需要。 c)你是如何理解质量管理的? 简答:是指在质量方面指挥和控制组织的协调活动。通常包括制定质量方针和质量目标及质量策划、质量控制、质量保证和质量改进。 质量策划:策划建立质量方针和目标,并为实现这些质量目标设计行动方案。
急诊急救基本知识培训 心肺复苏 一.心肺脑复苏新进展 (一)心肺脑复苏的历史:最早的记载是西方国家公元前800年左右,有口对口救活一个 孩子的案例,我国心肺复苏的历史也相当悠久,早在1700年的东汉时期,名医张仲景所着《金匮要略》已对缢死复苏方法经行了详尽的阐述。 (二)现代复苏学的建立:真正的世界复苏学建立,是从20世纪开始的,国内外专家经长 期研究总结出心肺复苏的操作步骤,---------现代复苏学的基础:胸外心脏按压,人工呼吸、和电复律。 二、心脏呼吸骤停与心肺复苏 (一)概念: 1.猝死:指外表健康或非预期死亡的人在外因或无外因的作用下,突然或意外的是发生非暴力性死亡。(世界卫生组织建议发病后6小时内称猝死) 2.心脏骤停:是指患者突然意外的心脏停止有效博动和(或)自主呼吸停止。 心脏骤停是指任何心脏病或非心脏病患者,在未能估计到的时期内心脏突然停止,不能有效地泵出血液,导致全身各组织器官缺血缺氧,脑血流突然中断,出现意识丧失,患者如经及时抢救可获得存活,否则将发生生物学死亡(即“真的死亡”) 3.脑死亡:包括脑干在内的全部脑组织的不可逆损害,对脑死亡的诊断涉及体征、脑电图、脑循环和脑代谢等方面,主要包括:①持续深昏迷,对外部刺激全无反应。 ②无自主呼吸 ③无自主运动,肌肉紧张。 ④挠肝功能和脑干反射大部或全部丧失,体温调节紊乱。 ⑤脑电图呈等电位 ⑥排除抑制脑功能的可能因素,如低温、严重代谢和内分泌紊乱、肌肉松剂和其它药物的作用等。 (二)心肺脑复苏术 1、心肺复苏术是针对呼吸循环骤停的病人所采取的最初抢救方法,由于从心脏停博到细胞坏死的时间以脑细胞最短,维持脑组织的灌流来那个是复苏的重点,所以将心肺复苏术扩张为“心肺脑复苏术” 2、心肺脑复苏的步骤 基础生命支持(初期复苏)A:开放气道,制定 B:呼吸支持(口对口呼吸) C:循环支持(胸外按压) D:除颤(主要用体外自动除颤器)。 3、心肺复苏流程:旧版:A-B-C 2010年新版改为C-A-B 把心脏按压放在首位(要求准确判断心脏呼吸骤停) (1)按压位置:胸骨中下交界处,术者站在或跪在病人身体一侧 方法:术者两只手掌根部重叠置于病人胸骨中下交界处,肘关节伸直,借助身体的重力 向病人脊柱方向按压。 按压深度:胸骨下陷成人至少5cm ,儿童4cm 按压频率:100次/分
2 极性不带电荷7种:甘氨酸(Gly)丝氨酸(Ser)苏氨酸(Thr)半胱氨酸(Cys)酪氨酸(Tyr)天冬酰胺(Asn)谷氨酰胺(Gln) 3 极性带正电(碱性氨基酸)3种:赖氨酸(Lys)精氨酸(Arg)组氨酸(His) 4极性带负电(酸性氨基酸)2种:天冬氨酸(Asp)谷氨酸(Glu) 5 脂肪族氨基酸:丙、缬、亮、异亮、蛋、天冬、谷、赖、精、甘、丝、苏、半胱、天冬酰胺、谷氨酰胺 6 芳香族氨基酸:苯丙氨酸、酪氨酸 7 杂环族氨基酸:组氨酸、色氨酸 8 杂环亚氨基酸:脯氨酸 9 由于一个晶体中分子的有序排列通常只有在分子单元相同的情况下才能形成,许多蛋白质都能结晶这一事实,强有力地证明,即使是非常大的蛋白质,也是有特定结构的不连续的化学实体。 10 稳定一个特定蛋白质结构的最重要的作用力是非共价相互作用。蛋白质行使功能经常伴有两种或更多结构形式的相互转变。 11 蛋白质中原子的空间排列叫做蛋白质的构象。蛋白质的可能构象包括任何无须破坏共价键而达成的结构状态。具有功能和折叠构象的任何一种蛋白质称为天然蛋白质。 12 弱相互作用力是稳定蛋白质构象的主要作用力,因为它们数目众多。自由能最低的蛋白质构象(即最稳定的构象)就是弱相互作用力数目最多的一种构象。 13 蛋白质中基团是协同形成氢键的,一个氢键的形成有利于其
他氢键的形成。 14 蛋白质结构模式规则:疏水残基主要包埋在蛋白质内部,远离水;蛋白质内氢键的数目达到最大值。肽键是刚性的平面。 15 蛋白质是以氨基酸为基本单位构成的生物高分子,蛋白质分子上氨基酸的序列和由此形成的立体结构构成了蛋白质结构的多样性。蛋白质具有一级、二级、三级、四级结构,蛋白质分子的结构决定了它的功能。 一级结构:蛋白质多肽链中氨基酸的排列顺序,以及二硫键的位置。二级结构(α-螺旋、β-折叠):蛋白质分子局区域内,多肽链沿一定方向盘绕和折叠的方式。三级结构:蛋白质的二级结构基础上借助各种次级键卷曲折叠成特定的球状分子结构的空间构象。四级结构:多亚基蛋白质分子中各个具有三级结构的多肽链,以适当的方式聚合所形成的蛋白质的三维结构。 16 蛋白质中发现的α-螺旋都是右手螺旋,α-螺旋是α角蛋白中最主要的结构,它最佳地利用了内部的氢键。氨基酸序列影响α螺旋稳定性。脯氨酸和甘氨酸残基的存在阻碍α-螺旋的形成。 17 影响α-螺旋稳定性的因素:连续性的R基团带电的氨基酸残基之间的静电排斥(或吸引);相邻的基团体积庞大;间隔三个或四个残基的氨基酸侧链之间的相互作用;脯氨酸和甘氨酸残基的存在;螺旋节段末端的氨基酸残基与α-螺旋固有的电偶极的相互作用。 18 β构象使多肽链折叠成片状结构。锯齿状的多肽链并排排列,形成一系列的片层结构,这种排列叫β-折叠片。氢键在多肽链的相
班级姓名 血红蛋白的提取和分离导学案 一、基础 1、蛋白质提取与分离的依据:1.分子的大小2.电荷性质和多少3.溶解度4.吸附性质5.对其他分子亲和力 2、血红蛋白由四条肽链组成,包括2个a-肽链和2个β一肽链;(4个亚铁红素基团);血红蛋白因含血红素而成红色;血红蛋白作用:运输氧气和二氧化碳 2、分离蛋白质的方法:凝胶色谱法也叫分配色谱法:根据被分离物质的相对分子质量的大小来分离蛋白质凝胶①性质:一些微小的多孔球体,球内含许多贯穿的通道; ②化学本质:多糖类化合物化合物,如葡聚糖、琼脂糖 原理:相对分子质量的较大的蛋白质无法进入凝胶颗粒内部,路程较短,移动速度较快,先流出,相对分子质量的较小的蛋白质由于扩散作用进入凝胶颗粒内部,路程较长,移动速度较慢,后流出。 3、透析法:透析袋又称玻璃纸;一般用硝酸纤维素制成。利用透析袋小分子自由通过,大分子留下。 4、电泳法:利用分离样品中各种分子带电性质的差异以及分子本身大小,使带电分子产生不同的迁移速率,从而实现样品中各种分子的分离。 两种常用电泳法琼脂糖凝胶电泳法和聚丙烯酰胺凝胶电泳法; 测定蛋白质分子量即鉴定方法:常用SDS—聚丙烯酰胺凝胶电泳 SDS能消除净电荷对迁移速率的影响,原因:SDS使蛋白质变成单链,SDS所带负电荷大大超过蛋白质分子原有的电荷量,因此掩盖了不同种类蛋白质的电荷的差别,使电泳迁移速率完全取决于分子大小。 二、蛋白质提取与分离四步 1、样品处理(1)红细胞的洗涤:目的:去除杂蛋白,洗涤次数过少,无法除净; 洗涤干净的标志:上清液不在呈现黄色;洗涤用生理盐水 低速短时离心,防止白细胞和淋巴细胞沉淀 加入柠檬酸钠,防止血液凝固 缓慢搅拌的目的,防止防止红细胞破裂 (2)血红蛋白的释放:加蒸馏水和40%体积甲苯。 蒸馏水的作用:使红细胞大量吸水胀裂;甲苯的作用溶解红细胞的细胞膜(3)分离血红蛋白第1层(最上层):无色透明甲苯层 离心第2层白色薄层固体,脂溶性物质的沉淀层, 第3层:红色透明,血红蛋白的水溶液层 第4层:其它杂质的暗红色,沉淀层 滤纸的作用:过滤除去脂质和细胞破碎物 分液漏斗的作用是:分离血红蛋白和有机溶剂 2、粗分离—透析血红蛋白目的除去样品中分子量较小的杂质。将透析袋放入磷酸缓冲溶液中,透析12h 缓冲溶液的作用:模拟细胞内的pH环境,保证血红蛋白的正常结构和功能。。 3、纯化—凝胶色谱法①胶色谱柱的制作②凝胶色谱柱的装填. ③.样品的加入和洗脱 观察到红色区域均匀移动,说明色谱柱制作成功 注意:凝胶装填时尽量紧密,均匀,以低凝胶颗粒之间的空隙; 加入洗脱液的湿凝胶用沸水浴加热目的:不但节约时间,还能除去凝胶中可能带有的微生物和排除凝胶内的空气。 装填凝胶柱时不能有气泡存在。(气泡和空隙会扰乱洗脱液中蛋白质的洗脱次序,降低分离效果液面不要低于凝胶表面,否则可能有气泡混入,影响液体在柱内的流动与最终生物大分子物质的分离效果不能发生洗脱液洗脱液流干,露出凝胶颗粒的现象。 4、纯度鉴定常用SDS—聚丙烯酰胺凝胶电泳 1.判断常考语句,澄清易混易错 (1)纯化主要是根据蛋白质以及蛋白质与其他物质之间的理化性质的差异进行的() (2)透析法可去除小分子化合物杂质,原理是不同分子所携带净电荷不同() (3)通过控制离心速率,可使分子大小、密度不同的蛋白质沉降分层,从而分离不同的蛋白质() (4)不同的物质在同一电场中的泳动速度不同,因此可用电泳法分离蛋白质() (5)影响泳动速度的因素包括带电颗粒的性质、电场强度、溶液的pH等() (1)√(2) ×(3) √(4) √(5) √ 2.分析命题热图,明确答题要点 下图是用凝胶色谱法分离a、b两种蛋白质的示意图,请分析: (1)先从层析柱中洗脱出来的是哪种蛋白质?a蛋白质先洗脱出来。为什么?,因为a的相对 分子质量较大,被排阻在凝胶颗粒外面,在颗粒之间迅速通过 (2)d是什么?有什么特点?d是多孔板,蛋白质可以通过,凝胶颗粒不能通过。 (3)层析柱装填时不能有气泡的原因是什么?气泡会扰乱蛋白质的洗脱次序,干扰实验结果。 4.如图表示血红蛋白提取和分离的部分实验装置,请据图回答下列问题: (1)血红蛋白是人和其他脊椎动物红细胞的主要组成成分,它在红细胞中的作用体现 了蛋白质具有______功能 (2)甲装置中,B是血红蛋白溶液,则A是_____________;乙装置中,C溶液的作用 是______________。 (3)甲装置用于___________ ,目的是_______________________________。用乙装置 分离蛋白质的方法叫__________,是根据____________分离蛋白质的有效方法。 (4)用乙装置分离血红蛋白时,待____________________________时,用试管收集流出液,每5 mL收集一管,连续收集。 答案(1)运输(2)磷酸缓冲溶液洗脱血红蛋白(3)透析(粗分离)去除样品中相对分子质量较小的杂质凝胶色谱法相对分子质量的大小(4)红色的蛋白质接近色谱柱的底端 10.血红蛋白是人和其他脊椎动物红细胞的主要组成成分,负责血液中O2和部分CO2的运输。请根据血红蛋白的提取和分离流程图回答下列问题: (1)将实验流程补充完整:A为______________,B为_________________。凝胶色谱法是根据_________________________而分离蛋白质的有效方法 (2)洗涤红细胞的目的是去除____________________;离心速度过高和时间过长会使__________一同沉淀,达不到分离的效果。洗涤干净的标志是________________________。释放血红蛋白的过程中起作用的是______________。 (3)某同学利用琼脂糖凝胶电泳技术将得到的蛋白质进行分离,在电泳过程中,影响蛋白质迁移速度的因素包括蛋白质分子的______________、分子的大小、形状等。而另一位同学则利用凝胶过滤分离蛋白质。待蛋白质接近凝胶色谱柱底端时,用试管连续收集流出液。先收集到的蛋白质与后收集到的蛋白质的区别是____________________________________ 答案(1)血红蛋白的释放样品的加入和洗脱蛋白质相对分子质量的大小(2)杂质蛋白(血浆蛋白)白细胞等离心后