
高考总复习电极反应式的书写
【考纲要求】
1.理解原电池的工作原理并正确书写各种化学电源的电极反应和总反应方程式;
2.理解电解池的工作原理并正确书写电极反应和总反应方程式。
【考点梳理】
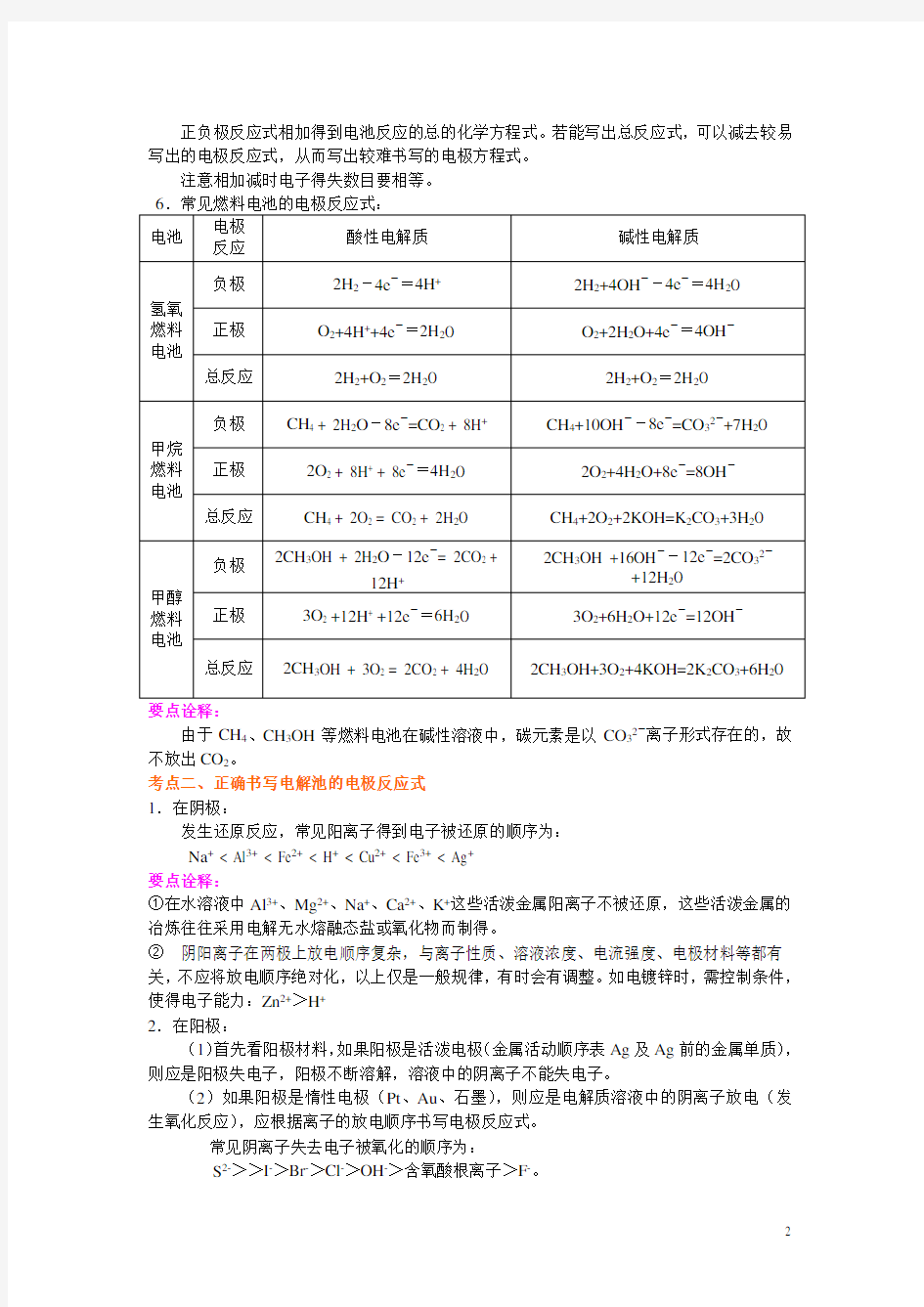
【高清课堂:399199电极反应式的书写】
考点一:正确书写原电池的电极反应式
1.先确定原电池的正负极,列出正、负电极上的反应物质,在等式的两边分别写出反应物和生成物。
要点诠释:
一般来说,较活泼的金属失去电子,为原电池的负极,但不是绝对的。如镁片和铝片插入氢氧化钠溶液中组成的原电池虽然镁比铝活泼,但由于铝和氢氧化钠溶液反应失去电子被氧化,因而铝是负极,此时的电极反应为:
负极:2Al-6e-===2Al3+
正极:6H2O +6e-==6OH-+3H2↑或2Al3++2H2O+6e-+2OH-==2AlO2-+3H2↑
再如,将铜片和铝片同时插入浓硝酸中组成原电池时,由于铝在浓硝酸中发生了钝化,铜则失去电子、作原电池的负极被氧化,此时的电极反应为:
负极:Cu-2e-=== Cu2+
正极:2NO3-+ 4H+ +2e-=== 2NO2↑+2H2O
2.要注意电解质溶液的酸碱性:
要点诠释:
在正负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系。如氢-氧燃料电池就分酸式和碱式两种,如果是在碱性溶液中,则不可能有H+出现,同样在酸性溶液中,也不能出现OH-。
在酸性溶液中:负极:2H2-4e-=== 4H +;正极:O2 + 4H+ + 4e-=== 2H2O
在碱性溶液中:负极:2H2-4e-+4OH— ===4H2O;正极:O2 +2H2O + 4e-=4OH—。3.要注意电子转移的数目
要点诠释:
在同一个原电池中,负极失去电子的总数一定等于正极得到电子的总数,所以在书写电极反应式时,要注意正负极得失电子相等。这样可避免在由电极反应式写总反应方程式或由总方程式改写电极反应式时所带来的失误。
4.电极反应式的书写必须遵循离子方程式的书写要求:
要点诠释:
①电极反应式等式的两边原子数目及电荷必须守恒。
②反应式中的难溶物、难电离的物质、气体、单质、氧化物等均应写成化学式形式。如铅蓄电池中,PbSO4为难溶物,电极反应式为:
负极:Pb(s)+SO42-(aq)-2e-=PbSO4(s),
正极:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l)。
③注意电解质溶液的成分对正负极反应产物的影响。如负极反应生成的阳离子若与电解质溶液的阴离子反应,则电解质溶液的阴离子应写入电极反应式,例如Fe与Cu在NaOH溶液中形成原电池,负极反应为Fe+2OH--2e-===Fe(OH)2。
5.抓住总的反应方程式
要点诠释:
正负极反应式相加得到电池反应的总的化学方程式。若能写出总反应式,可以减去较易写出的电极反应式,从而写出较难书写的电极方程式。
注意相加减时电子得失数目要相等。
要点诠释:
由于CH4、CH3OH等燃料电池在碱性溶液中,碳元素是以CO32-离子形式存在的,故不放出CO2。
考点二、正确书写电解池的电极反应式
1.在阴极:
发生还原反应,常见阳离子得到电子被还原的顺序为:
Na+ < Al3+ < Fe2+ < H+ < Cu2+ < Fe3+ < Ag+
要点诠释:
①在水溶液中Al3+、Mg2+、Na+、Ca2+、K+这些活泼金属阳离子不被还原,这些活泼金属的冶炼往往采用电解无水熔融态盐或氧化物而制得。
②阴阳离子在两极上放电顺序复杂,与离子性质、溶液浓度、电流强度、电极材料等都有关,不应将放电顺序绝对化,以上仅是一般规律,有时会有调整。如电镀锌时,需控制条件,使得电子能力:Zn2+>H+
2.在阳极:
(1)首先看阳极材料,如果阳极是活泼电极(金属活动顺序表Ag及Ag前的金属单质),则应是阳极失电子,阳极不断溶解,溶液中的阴离子不能失电子。
(2)如果阳极是惰性电极(Pt、Au、石墨),则应是电解质溶液中的阴离子放电(发生氧化反应),应根据离子的放电顺序书写电极反应式。
常见阴离子失去电子被氧化的顺序为:
S2->>I->Br->Cl->OH->含氧酸根离子>F-。
【典型例题】
类型一、燃料电池的电极反应式
例1、CH4和O2在KOH溶液中组成燃料电池,该电池的负极反应式为_____ 。
【答案】CH4+10OH--8e-=CO32-+7H2O
【解析】
第一步:找氧化还原反应中的对应关系:氧化剂——还原产物;还原剂——氧化产物。即:负极:CH4(还原剂)→CO32-(氧化产物)。
第二步:分析电子转移的物质的量,CH4中碳元素为-4价,CO32-中碳元素为+4价,1 mol CH4失去8 mol电子,即负极:CH4—8e-→CO32-。
第三步:依据电荷原理配平以上电极反应式,缺少的物质从反应介质中寻找。因为该电池为碱性电池,而且左右相差10 mol负电荷,所以应该在左边添加10 mol OH-。即:负极:CH4—8e-+ 10OH-=CO32-
第四步:配平质量守恒,使等号两边各原子数相等,等号左边有OH-,则右边缺H2O,所以负极反应式为:CH4+10OH--8e-=CO32-+7H2O
同理,正极反应式为:O2+2H2O+4e-=4OH-
【总结升华】也可先写出配平的总反应式:CH4+2O2+2OH—=CO32-+3H2O和正极反应式:O2+2H2O+4e-=4OH-,然后用前者减去后者即得出负极反应式。
举一反三:
【变式1】若将KOH的碱性反应环境变为酸性环境,则该电池的负极反应式为_____ 。【答案】CH4-8e-+2H2O =CO2↑+ 8H+
【解析】还原剂为CH4,氧化产物为CO2,在负极1 mol CH4生成1 mol CO2共转移8 mol 电子,在上题第三步中需要在右边添加8 mol H+,在第四步中应该有2 mol H2O参加反应,即负极电极反应式为:CH4-8e-+2H2O =CO2↑+ 8H+
【变式2】以甲烷燃料电池为例来分析在不同的环境下电极反应式的书写方法:
(1)酸性条件(2)、碱性条件(3) 固体电解质(高温下能传导O2-)
(4)熔融碳酸盐(如:熔融K2CO3)环境下
【答案】(1)酸性条件:
燃料电池总反应:CH4+2O2=CO2+2H2O ①
燃料电池正极反应:O2+4H++4e-=2H2O ②
①-②×2,得燃料电池负极反应:CH4-8e-+2H2O=CO2+8H+
(2)碱性条件:
燃料电池总反应:CH4+202+2NaOH=Na2CO3+3H2O ①
燃料电池正极反应:O2+2H2O+4e-=4OH-②
①-②×2,得燃料电池负极反应:CH4+10OH--8e-=CO-2
+7H2O
3
(3)固体电解质(高温下能传导O2-):
燃料电池总反应:CH4+2O2=CO2+2H2O ①
燃料电池正极反应:O2+4e-=202- ②
①-②×2,得燃料电池负极反应:CH4+4O2--8e-=CO2+2H2O
(4)熔融碳酸盐(如:熔融K2CO3)环境下:
电池总反应:CH4+2O2=CO2+2H2O。正极电极反应式:O2+2CO2+4e-=2CO-23。电池总反应-正极电极反应式得负极反应式:CH4+4CO-23-8e-=5CO2+2H2O
【变式3】据报道,摩托罗拉公司的一种以甲醇为原料、以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可持续使用一个月。关于该电池的叙述正确的是
A、放电时,正极反应为:O2 + 4e-+ 4H+=2H2O
B、放电时,负极反应为:CH3OH-6e-+ 8OH-=CO32-+ 6H2O
C、充电时,原电池的负极与电源的正极相连接
D、充电时,阴极反应为:4OH--4e-=2H2O + O2↑
【答案】B
【解析】放电时,正极是O2得电子,但溶液是碱性的,电极反应式是:O2 + 4e-+ 2H2O = 4OH-。充电时,原电池的负极与电源的负极相连接,使发生了氧化反应的原电池的负极被还原,阴极发生的是得电子的还原反应,即:CO32-+ 6e-+ 6H2O =CH3OH + 8OH-。
类型二、可充电电池电极反应式的书写
例2、镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2,写出放电时负极反应式和充电时阴极反
应式。
【答案】负极:Cd-2e-+2OH-=Cd(OH)2;阴极:Cd(OH)2+2e-=Cd+2OH-。
【解析】放电时负极反应式为:Cd-2e-+2OH-=Cd(OH)2;
正极反应式为:NiOOH-e-+H2O = Ni(OH)2+OH-。
充电时,阳极电极反应式为:Ni(OH)2-e-+OH-===NiOOH+H2O;
阴极反应式为:Cd(OH)2+2e-===Cd+2OH-。
【总结升华】放电是原电池反应,充电是电解过程。放电后负极变成阴极,正极变成阳极。即:负极阴极,正极阳极。
综观历年高考试题可发现,解可充电电池试题的关键在于能否正确书写放电时的电极反应式。要正确书写放电时的电极反应式,既要弄清得失电子的物质,还要特别注意电极产物是否与电解质溶液共存,要写出实际存在的电极反应式。然后根据原电池的负极反应与电解池的阴极反应、原电池的正极反应与电解池的阳极反应互为逆反应,即可快速写出充电时的电极反应式。
举一反三:
【变式1】铅蓄电池的电极反应式错误的是:
A.负极:Pb-2e-=Pb2+;
B.正极:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l)
C.阳极:PbSO4(s)+2H2O(l)-2e-=PbO2(s)+4H+(aq)+SO42-(aq);
D.阴极:PbSO4(s)+2e-=Pb(s)+SO42-(aq)
【答案】A
【解析】放电时负极电极反应式应为:Pb(s)+SO42-(aq)-2e-=PbSO4(s)。
【变式2】高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下:
Ni(OH)2 + M 充电
放电
NiOOH + MH
已知,电池使用KOH溶液做电解质溶液;原电池正极反应式为NiOOH+ H2O +e-=
Ni(OH)2 + OH-,负极反应式为。
【答案】MH + OH-- e-=M + H2O
【变式3】天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被还原,并以原子形式嵌入电池负极材料碳(C6)中,
以LiC6表示。电池反应为LiCoO2+C6充电
放电
CoO2+LiC6。则下列说法正确的是( )
A.放电时,电池的正极反应为LiC6-e-==Li++C6
B.放电时,电池的正极反应为CoO2+Li++e-==LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
【答案】B
【解析】A项,放电时,电池的正极得e-,发生还原反应,A项错误;B项,放电时发生原电池反应,电池正极反应为还原反应,B项正确;C项,含活泼氢的有机物作电解质,易得电子;D项,锂的相对原子质量小,其密度小,所以锂离子电池的比能量高。故选B。
类型三、电解池中的电极反应式
例3、写出用石墨作阳极,Fe作阴极,电解CuSO4溶液的电极反应式和电解总方程式。
【答案】阴极:Cu2++2e-==Cu,阳极:4OH--4e-==2H2O+O2↑
【解析】石墨作阳极,Fe作阴极,两电极都不反应。
阳离子放电顺序:Cu2+>H+,故Cu2++2e-==Cu
阴离子放电顺序:OH->SO42-,故4OH--4e-==2H2O+O2↑
总方程式为:
2Cu2++2H2O电解2Cu+O2↑+4H+或2CuSO4+2H2O电解Cu+O2↑+2H2SO4
举一反三:
【变式1】若铜作电极电解饱和食盐水,写出电极反应式。
【答案】阳极:Cu-2e-= Cu2+,阴极:2H++2e-= H2↑或2H2O+2e-= H2↑+2OH-。
【解析】由于电极材料为Cu,是活泼电极,铜参与阳极反应,溶液中的阴离子不能失电子,但阴极反应仍按溶液中的阳离子放电顺序书写。该电解池的电极反应为:阳极:Cu-2e-= Cu2+,
阴极:2H++2e-= H2↑或2H2O+2e-= H2↑+2OH-。
【变式2】若铂作电极电解硫酸钠溶液,写出电极反应式及电解总化学方程式。
【答案】
阳极:4OH-—4e-=O2↑+2H2O
阴极:4H++4e-=2H2↑
电解总化学方程式:2H2O电解H2↑+O2↑