
第二节原子结构与元素的性质(第1课时)
【基础演练】
1.最外电子层排布为3s23p3的原子,核外电子占有的轨道数为( )
A.4 B.7 C.8 D.9
2.在元素周期表中前五周期的五种元素的位置关系如图3-1所示,若B元素的核电荷数为Z,则五种元素的核电荷数之和不可能为( )
图3-1
A.5Z B.5Z+14 C.5Z+10 D.5Z+1
3.气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是( )
A.1s22s22p63s23p2―→1s22s22p63s23p1
B.1s22s22p63s23p3―→1s22s22p63s23p2
C.1s22s22p63s23p4―→1s22s22p63s23p3
D.1s22s22p63s23p63d104s24p2―→1s22s22p63s23p63d104s24p1
4.下列各项叙述中,正确的是( )
A.电子层序数越大,s原子轨道的形状相同、半径越大
B.在同一电子层上运动的电子,其自旋方向肯定不同
C.镁原子由1s22s22p63s2→1s22s22p63p2时,原子吸收能量,由基态转化成激发态
D.原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解
5.有A、B和C三种主族元素,若A元素阴离子与B、C元素的阳离子具有相同的电子层结构,且B的阳离子半径大于C的阳离子半径,则这三种元素的原子序数大小次序是( )
A.B<C<A B.A<B<C C.C<B<A D.B>C>A
6.超重元素的假说预言自然界中可存在原子序数为114的稳定同位素298114X,试根据原子结构理论和元素周期律预测正确的是( )
A.298114X位于第七周期,第ⅣA族 B.X是非金属元素
C.XO2是酸性氧化物 D.X元素的化合价有+2和+4
7.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( ) A.半导体材料砷化镓 B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌 D.超导材K3C60
8.有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为n s1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,C是________,D是________,E是________。
(2)由这五种元素组成的一种化合物是(写化学式)__________________。写出该物质的一种主要用途________________________。
(3)写出C元素基态原子的电子排布式______________________________。
(4)用轨道表示式表示D元素原子的价电子构型________________________。
(5)元素B与D的电负性的大小关系是________,C与E的第一电离能的大小关系是________。(填“>”、“<”或“=”)
9.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是________,B元素是________,C元素是________(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是________。
(4)F是由两种元素组成的三原子分子,其分子式是________,电子式是________。
(5)G分子中含有4个原子,其分子式是________。
(6)H分子中含有8个原子,其分子式是________。
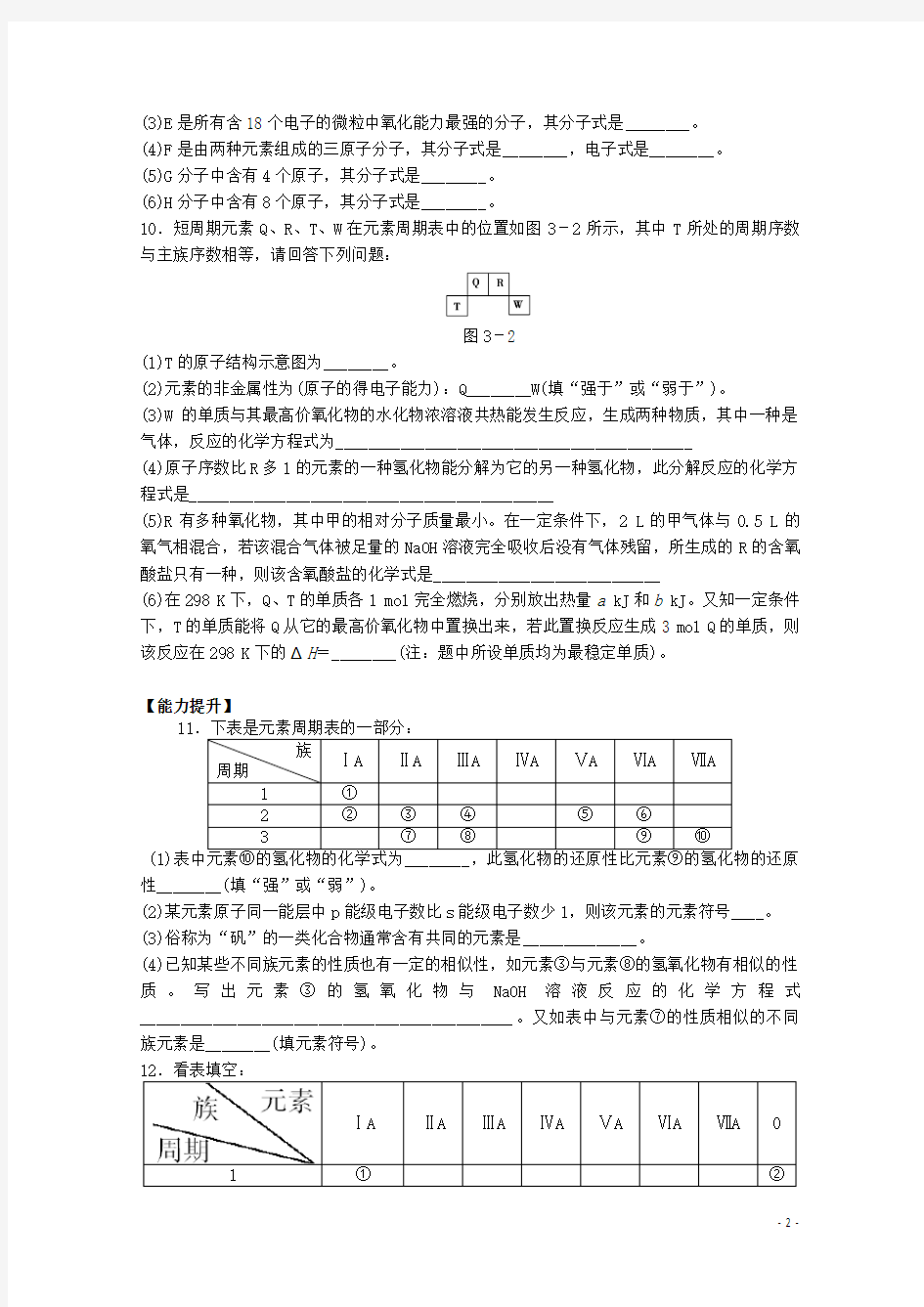
10.短周期元素Q、R、T、W在元素周期表中的位置如图3-2所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
图3-2
(1)T的原子结构示意图为________。
(2)元素的非金属性为(原子的得电子能力):Q________W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为____________________________________________
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是_____________________________________________
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________________________
(6)在298 K下,Q、T的单质各1 mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3 mol Q的单质,则该反应在298 K下的ΔH=________(注:题中所设单质均为最稳定单质)。
【能力提升】
11.下表是元素周期表的一部分:
族
ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 周期
1 ①
2 ②③④⑤⑥
3 ⑦⑧⑨⑩
(1)表中元素⑩的氢化物的化学式为________,此氢化物的还原性比元素⑨的氢化物的还原性________(填“强”或“弱”)。
(2)某元素原子同一能层中p能级电子数比s能级电子数少1,则该元素的元素符号____。
(3)俗称为“矾”的一类化合物通常含有共同的元素是______________。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式______________________________________________。又如表中与元素⑦的性质相似的不同族元素是________(填元素符号)。
12.看表填空:
ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0
1 ①②
2 ③④⑤⑥
3 ⑦⑧⑨⑩
(1)写出①~⑩号元素的元素符号:
①__________,②__________,③__________,
④__________,⑤__________,⑥__________,
⑦__________,⑧__________,⑨__________,
⑩________。能形成共价键的元素有______种。
(2)①、⑤、⑨号元素,相互化合时可形成________化合物,但溶于水后也可以电离出
__________离子和__________离子。
(3)⑧、⑩号元素化合时,可通过__________形成__________化合物。
(4)①、⑤、⑦号元素相互化合形成的物质中,既有__________键,又有__________键,它的
俗称有__________、__________、__________。
(5)可形成双原子分子的单质有(写化学式):________、__________、__________、__________、
__________,原子间以__________键结合。
(6)可形成最稳定气态氢化物的元素是__________。
(7)①、④号元素形成的气态氢化物溶于水后,溶液呈__________性,①、⑩号元素形成的气
态氢化物溶于水后溶液呈__________性。
(8)③、⑤、⑦号元素相互化合可形成________化合物。该物质俗称为________,但属于
________类物质。
(9)分子中含有18个电子的气态氢化物有________种,分别写出化学式
____________________,将分子中含10个电子的气态氢化物的化学式分别写出:
______________、______________、______________。
(10)含氧量最高的离子化合物和共价化合物分别是(填化学式)__________和__________。
(11)10种元素中化学性质最不活泼的是____________。
(12)③、⑦、⑨三种元素的最高价氧化物的水化物中,碱性由强到弱的顺序是
____________________。
13.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为______________________
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是__________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种
化合物的电子式:__________________________。
(4)由表中两种元素的原子按组成的常见液态化合物的稀溶液易被催化分解,可使用的
催化剂为(填序号)________。
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为____________________________。
N→⑥的单质的化学方程式为______________________________
常温下,为使0.1 mol·L-1 M溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定
量的Y溶液至________________________。
第二节 原子结构与元素的性质(第1课时)
【基础演练】
1. 核外电子排布为1s 22s 22p 63s 23p 3的原子,其轨道数为1+1+3+1+3=9。
D
2. 若D 、B 、E 位于ⅡA 族、B 与D ,B 与E 原子序数可相差8;若D 、B 、E 位于ⅢA 族以后,B 与D 可相差8,B 与E 可相差18,或B 与D 相差18,D 与E 相差32,因此D 项不可能。 D
3. 由于B 项的核外电子排布式中3p 3为半充满状态,比较稳定,因此失去一个电子比较困
难,需要吸收更多的能量。 B
4. s 能级原子轨道都是球形的,且能层序数越大,半径也越大,故A 正确;在一个轨道中电子的自旋方向肯定不同,但在同一能层中,电子的自旋方向是可以相同,如C 原子的核外电子排布(轨道表示式),在2p 能级上2个电子的自旋方向相同,故B 错误;Mg 原
子3s 2能级上的2个电子吸收能量跃迁到3p 2能级上,由基态转化成激发态,故C 正确;原子
最外层电子排布是5s 1的元素是Rb 元素,其氢氧化物(RbOH)是强碱,可以与氢氧化铝(与弱碱
不反应)反应,故D 错误。 A 、C
5. 电子排布相同的离子半径,原子序数大的半径小。可知三种元素的位置如图: A B C
,所以B 正确。 B
6. 原子序数为114,利用减数法(原子序数减去每个周期元素的种类)
114-2-8-8-18-18-32-32=-4(结果为正数从左向右数几列;结果为负数从右向左数几列)为-4,从右向左数4列,所以该元素位于第七周期第ⅣA 族,故A 正确;第ⅣA 族是碳族元素,C 、Si 是非金属元素,从上到下,金属性逐渐增强,Sn 、Pb 已经是金属元素,所以114号元素应为金属元素,故B 、C 错误;依据C 元素有+2、+4价可推测X 元素也有+2和+4两种化合价,D 正确。 A 、D
7. C
8. 由A 、E 同族且最外层只有一个电子,可知A 为H ,E 为Na 或K 。B 、D 最外层电子排布
为n s 2n p 4,即B 为O ,D 为S ,C 最外层电子为D 的一半,故C 为Al 。那么E 只能为K 。这五种
元素组成的化合物为明矾(KAl(SO 4)2·12H 2O),利用Al 3+水解生成胶状Al(OH)3,这一性质可用
来净水。
(1)H O Al S K (2)KAl(SO 4)2·12H 2O 可做净水剂 (3)1s 22s 22p 63s 23p 1 (4) (5)O >S Al >K
9. 熟悉含有18个电子的微粒:无机分子:Ar 、F 2、HCl 、H 2S 、PH 3、SiH 4、N 2H 4、H 2O 2等;
有机分子:C 2H 6、CH 3OH 等。离子:K +、Ca 2+、Cl -、S 2-、HS -、P 3-、O 2-2等。
(1)K Cl S (2)HCl (3)F 2 (4)H 2S H ··S ····
··H (5)H 2O 2或PH 3 (6)C 2H 6
10. 本题考查元素周期表、元素周期律及盖斯定律。意在考查学生对元素“位、构、性”的关系应用与推断的能力,以及运用盖斯定律进行相关计算的能力。通过比较Q 、R 、T 、W 的关系可知,Q 、R 位于第2周期,T 、W 位于第3周期,故T 为ⅢA 族元素,即T 为Al ,因此Q 、R 、W 分别为C 、N 、S 。
(1)Al 为13号元素,有3个电子层,每层电子数分别为2、8、3。
(2)Q 、W 的最高价氧化物对应的水化物分别为H 2CO 3、H 2SO 4,酸性后者大,故非金属性C 弱于S 。
(3)S 与浓H 2SO 4发生氧化还原反应,一定生成中间价态的硫的化合物,题目提示该物质为气体,故其为SO 2,则另外一种产物为水。
(4)原子序数比R 大1的元素是O ,其氢化物有H 2O 、H 2O 2,后者可以分解为前者,同时有氧气产生。
(5)氮的氧化物中相对分子质量最小的是NO ,根据NO 与O 2的比例关系可知,反
应的化学方程式为:4NO +O 2+4NaOH===4NaNO 2+2H 2O 。
(6)可以写出C 、Al 的燃烧的热化学方程式:
C(s)+O 2(g)===CO 2(g);ΔH 1=-a kJ·mol -1 ①
4Al(s)+3O 2(g)===2Al 2O 3(s);ΔH 2=-4b kJ·mol -1 ②
4Al(s)+3CO 2(g)===2Al 2O 3(s)+3C(s);ΔH =?
根据盖斯定律得,ΔH =ΔH 2-ΔH 1×3=(3a -4b )kJ·mol -1。
(1) (2)弱于
(3)S +2H 2SO 4(浓)=====加热3SO 2↑+2H 2O
(4)2H 2O 2=====MnO 22H 2O +O 2↑(或其他合理答案)
(5)NaNO 2
(6)(3a -4b )kJ·mol -1
【能力提升】
11. (1)HCl 弱 (2)Li 或B (3)S 、O (4)Be(OH)2+2NaOH===Na 2BeO 2+2H 2O Li
12. (1)H He C N O F Na Mg S Cl 7 (2)共价 阳 阴 (3)离子键 离子
(4)共价 离子 烧碱 苛性钠 火碱 (5)O 2 Cl 2 F 2 H 2 N 2 共价 (6)F (7)碱 酸
(8)离子 纯碱 盐 (9)三 H 2S 、HCl 、SiH 4 NH 3 CH 4 HF (10)Na 2O 2 H 2O 2 (11)He
(12)NaOH >H 2CO 3>H 2SO 4
13 (1)Na >Al >O
(2)HNO 3>H 2CO 3>H 2SiO 3
(3)Na +-或Na +-
(4)a 、b
(5)Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4
2Al 2O 3(熔融)=====电解冰晶石4Al +3O 2↑
溶液的pH 等于7(本题考查元素在周期表中的位置与原子结构、元素性质的关系。意在考查学生的分析推理能力。根据各元素在周期表中的位置,推出各元素依次为: ①H、②C、③N、④O、⑤Na、⑥Al、⑦Si、⑧Cl。
(1)Na 、Al 是第三周期元素,O 在第二周期,所以原子半径:Na >Al >O 。
(2)因为非金属性:N >C >Si ,所以酸性:HNO 3>H 2CO 3>H 2SiO 3。
(3)H 、O 、Na 、Cl 形成的符合条件的物质很多,比较容易写出电子式的有NaOH 、NaClO 。
(4)该液态物质是H 2O 2,MnO 2、FeCl 3均可以作H 2O 2分解的催化剂。
(5)⑥的单质是Al ,逆推得N 为Al 2O 3,Z 为Al(OH)3;因为M 是仅含非金属元素的盐,所以M 是铵盐,由此推出X 、Y 对应的物质是氨水和铝盐,铝盐可能是AlCl 3或Al(NO 3)3。M 可能
是NH 4Cl 或NH 4NO 3,NH +4可以水解,要使其溶液中M 电离的阴、阳离子浓度相等,则根据电荷
守恒得c (OH -)=c (H +),即溶液应为中性。)
第一章 原子结构与性质知识点归纳 山东临沂市莒南三中(276600) 张琛 山东省烟台市蓬莱四中(265602) 马彩红 2.位、构、性关系的图解、表解与例析 (1)元素在周期表中的位置、元素的性质、元素原子结构之间存在如下关系: 同位素(两个特性)
3.元素的结构和性质的递变规律 4.核外电子构成原理 (1)核外电子是分能层排布的,每个能层又分为不同的能级。 随着原子序数递增 ① 原子结构呈周期性变化 ② 原子半径呈周期性变化 ③ 元素主要化合价呈周期性变化 ④ 元素的金属性与非金属形呈周期性变化 ⑤ 元素原子的第一电离能呈周期性变化 ⑥ 元素的电负性呈周期性变化 元素周期律 排列原则 ① 按原子序数递增的顺序从左到右排列 ② 将电子层数相同的元素排成一个横行 ③ 把最外层电子数相同的元素(个别除外),排成一个 纵行 周期(7个横行) ① 短周期(第一、二、三周期) ② 长周期(第四、五、六周期) ③ 不完全周期(第七周期) 性质递变 原子半径 主要化合价 元 素 周 期 表 族(18 个纵行) ① 主族(第ⅠA 族—第ⅦA 族共七个) ② 副族(第ⅠB 族—第ⅦB 族共七个) ③ 第Ⅷ族(第8—10纵行) ④ 结 构
(2)核外电子排布遵循的三个原理: a.能量最低原理b.泡利原理c.洪特规则及洪特规则特例 (3)原子核外电子排布表示式:a.原子结构简图b.电子排布式c.轨道表示式5.原子核外电子运动状态的描述:电子云 6.确定元素性质的方法 1.先推断元素在周期表中的位置。 2.一般说,族序数—2=本族非金属元素的种数(1 A族除外)。 3.若主族元素族序数为m,周期数为n,则: (1)m/n<1时为金属,m/n值越小,金属性越强: (2)m/n>1时是非金属,m/n越大,非金属性越强;(3)m/n=1时是两性元素。
处理民族关系的原则:平等、团结、共同繁荣编号019 识记:处理民族关系的三原则。 【学习目标】 理解:处理民族关系的三原则各自的原因及三者的关系。 分析:联系当前党和国家采取一系列加快民族自治地区发展的政策和措施,分析说明处理好民族关系的重要性。。【教学重点】理解我国处理民族关系的基本原则。 【教学难点】理解我国处理民族关系的基本原则。 7.1课前预习案 一.自主预习提纲 1.新中国成立后,我国形成了一种什么样的民族关系? 我国形成了一种平等、团结、互助、和谐的社会主义民族关系: ★★2.我国处理民族关系的基本原则是什么? 民族平等、民族团结、各民族共同繁荣的基本原则。 ★3.什么是民族平等(内容)?地位如何?制定民族平等原则的依据是什么? ⑴民族平等是指:依法平等的享有政治、经济、文化和社会等方面的权利,平等的履行应尽的义务。 ⑵地位:是我国处理民族关系的首要原则,是实现民族团结的政治基础和实现各民族共同繁荣的前提条件。 ⑶依据:宪法规定,中华人民共和国各民族一律平等。我国各民族只有人口多少和发展程度上的区别,绝无高低优劣之分。各族人民都为祖国文明作出了贡献,都是国家的主人。 注意:A平等不等于相同;B仍然存在事实上的不平等 ★4.团结的重要性如何? 民族的团结、民族的凝聚力,是衡量一个国家综合国力的重要标志之一,是社会稳定的前提,是经济发展和社会进步的保证,是国家统一的基础。坚持民族团结是我国处理民族关系的重要原则。 ★5.各民族共同繁荣的必要性: 由社会主义本质决定的,是国家实现现代化和中华民族实现伟大复兴的必然要求。坚持各民族共同繁荣是我国处理民族关系的根本原则。 ★★6.民族平等、民族团结、各民族共同繁荣三原则的关系如何? 三者互相联系、不可分割的。民族平等是实现民族团结的政治基础。民族平等和民族团结是实现各民族共同繁荣的前提条件。各民族共同繁荣特别是经济发展,是各民族平等、民族团结的物质保证。 7.实施西部大开发的意义(课本75框里内容) 8.如何巩固社会主义民族关系?(珍惜、巩固和发展。从国家、公民、青年学生角度回答) (1)国家的角度:坚持和完善民族平等、民族团结和各民族共同繁荣的原则;制定和完善有关法律和制度,为我国平等团结互助和谐的社会主义民族关系提供法律和制度保障。 (2)公民的角度:自觉履行宪法规定的维护国家统一和全国各民族团结的义务,是每个中国公民的责任;作为当代青年学生,要把巩固和发展社会主义民族关系的责任付诸行动 二.本课时知识网络构建指导 三.预习检测 1.广西壮族自治区实行民族区域自治制度 50 多年来,在党的民族政策光辉照耀下,各民族人民心相连、手相牵,共同缔造了一个文明和谐的大家庭。可见在我国 A.逐步形成了平等团结互助和谐的民族关系 B.民族差异已经消除 C.伴随各民族的共同繁荣,民族问题已经消除D.各民族人民依法平等地履行应尽的义务 2.在每届全国人大代表中,每个少数民族都有本民族的代表。西藏珞巴族人口不足 3000 人,也拥有 1 名全国人大代表。这体现出我国处理民族关系的 A.民族团结原则 B.民族互助原则 C.民族平等原则 D.各民族共同繁荣原则 3.截至 2012 年 7 月底,各对口支援省市共安排援疆项目1296 个,已拨付到疆援助资金共 90.8 亿元人民币。这体现了我国A.坚持民族平等的原则 B.坚持民族团结的原则 C.实行民族区域自治制度D.坚持各民族共同繁荣的原则 4.没有民族团结,就不会有稳定的社会环境。“民族团结则兴,民族分裂则败”。材料表明 A.加强民族团结是国家兴旺、社会稳定的重要条件B.我国民族关系融洽,不可能出现民族分裂 C.只有在民族平等的基础上,才能实现民族团结 D.民族团结的原则符合我国民族关系的状况 5.实现国家的长治久安和中华民族的伟大复兴,需要在各民族干部群众的思想上筑起坚决维护祖国统一、反对民族分裂的坚固长城。这就必须做到 ①自觉履行维护民族团结的义务②坚决反对一切民族歧视、民族分裂的行为 ③消除民族间的差别④尊重各民族的风俗习惯、宗教信仰和语言文字 A.①②③ B.②③④ C.①③④ D.①②④ 6.中国是统一的多民族国家,妥善处理民族关系是事关改革发展和稳定的重大问题。要正确处理民族关系必须坚持一定的原则,对这些原则,下列说法正确的是 ①民族平等、民族团结、各民族共同繁荣是我国改革开放以来处理民族关系的基本原则②民族团结是实现民族平等的政治基础③各民族共同繁荣是民族团结和民族平等的物质保证④民族平等和民族团结是实现各民族共同繁荣的前提条件 A.①② B.③④ C.②③④ D.①②③④ 1
选修3 物质结构与性质 第一节 原子结构与性质 基础知识整合] 1.能层、能级和原子轨道 (1)轨道形状??? s 电子的原子轨道呈球形对称p 电子的原子轨道呈哑铃形 (2)s 、p 、d 、f 能级上原子轨道数目依次为1、3、5、7,其中n p x 、n p y 、n p z 三个原子轨道在三维空间相互垂直,各能级的原子轨道半径随能层数(n )的增大而增大。 (3)能量关系??????? ①相同能层上原子轨道能量的高低:n s (1)能量最低原理:原子的电子排布遵循构造原理,能使整个原子的能量处于最低状态,简称能量最低原理。 构造原理:原子的核外电子在填充原子轨道时,随着原子核电荷数的递增,原子核每增加一个质子,原子核外便增加一个电子,这个电子大多是按着能级的能量由低到高的顺序依次填充的,填满一个能级再填一个新能级,这种规律称为构造原理。 构造原理示意图: (2)泡利原理:在一个原子轨道里,最多只能容纳2个电子,且它们的自旋状态相反。 (3)洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。 注:洪特规则特例:当能量相同的原子轨道在全充满(p6、d10、f14)、半充满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低。如24Cr的基态原子电子排布式为1s22s22p63s23p63d54s1,而不是1s22s22p63s23p63d44s2。 4.电子的跃迁与原子光谱 (1)电子的跃迁 ①基态―→激发态: 当基态原子的电子吸收能量后,电子会从低能级跃迁到较高能级,变成激发态原子。 ②激发态―→基态: 激发态原子的电子从较高能级跃迁到较低能级时会释放出能量。 原子结构(必修) 近代原子结构模型的演变 ⑤ 质子数(Z )= 阴离子核外电子数 — 阴离子的电荷数 一、原子结构模型的演变 公元前5世纪,古希腊哲学家德谟克利特提出古代原子学说,认为万物都是由间断的、 不可分的原子构成的。 模型 道尔顿(英) 汤姆生(英) 卢瑟福(英) 玻尔(丹麦) 海森伯 年代 1803年 1904年 1911年 1913年 1926年 依据 元素化合时 的质量比例关系 发现电子 ɑ粒子散射 氢原子光谱 近代科学实验 主要内容 原子是不可 再分的实心小球 葡萄干布丁式 核式模型 行星轨道式原子模型 量子力学原子结构模型 模型 (微观粒子具有波粒二象性) 存在问题 不能解释电子的存在 不能解释ɑ粒 子散射时的现 象 不能解释氢 原子光谱 二、原子的构成 1. 得 电 失 子 阳离子 X n+ (核外电子数= ) 离子 阴离子 X n- (核外电子数= ) 2. 原子、离子中粒子间的数量关系: ① 质子数=核电荷数=核外电子数=原子序数 ② 质量数(A )=质子数(Z )+ 中子数(N ) ③ 离子电荷=质子数—核外电子数 ④ 质子数(Z )= 阳离子核外电子数 + 阳离子的电荷数 ⑥ 质量数≈相对原子质量 原子核 原子A Z X 中子(A-Z 个,电中性,决定原子种类→同位素) 质子(Z 个,带正电,决定元素的种类) 核外电子(Z 个,带负点,核外电子排布决定元素的化学性质) ①核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的 电子层(能量最低原理); ②每个电子层最多容纳2n2个电子(n为电子层数); ③最外层电子数目不能超过8个(K层为最外层时不能超过2个); ④次外层电子数目不能超过18个(K层为次外层时不能超过2个); ⑤倒数第三层电子数目不能超过32个(K层为倒数第三层时不能超过2个)。 (2)阳离子:核电荷数=核外电子数+电荷数(如图乙所示) (3)阴离子:核电荷数=核外电子数—电荷数(如图丙所示) M电子层 微粒符号(原子或离子) L电子层原子核 K电子层核电荷数 (1)原子核中无中子的原子1 1H 3.核外电子排布的一般规律 (1) 电子层数(n) 1 2 3 4 5 6 7 符号K L M N O P Q 电子层能量的关系从低到高 电子层离核远近的关系由近到远 (2)在含有多个电子的原子里,电子依能量的不同是分层排布的,其主要规律是: 4.原子、离子的结构示意 (1)原子中:核电荷数=核外电子数(如图甲所示) 5.常见等电子粒子 (1)2电子粒子:H—、Li+、Be2+;H2、He (2)10电子粒子:分子Ne、HF、H20、NH3、CH4 ;阳离子Na+、Mg2+、Al3+、NH4+、H30+; 阴离子N3-、O2-、F-、OH-、NH2-。 (3)18电子粒子:分子Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4; 阳离子K、Ca ;阴离子P3—、S2—、Cl—、HS—、O22—。 (4)14电子粒子:Si、N2、CO、C2H2;16电子粒子:S、O2、C2H4、HCH0 。 6.1~20号元素原子结构的特点 一、等差数列选择题 1.《周碑算经》有一题这样叙述:从冬至日起,依次小寒、大寒、立春、雨水、惊蛰、春分、清明、谷雨、立夏、小满、芒种十二个节气日影长减等寸,冬至、立春、春分日影之和为三丈一尺五寸,前九个节气日影长之和为八丈五尺五寸,则后五个节气日影长之和为( )(注:一丈=十尺,一尺=十寸) A .一丈七尺五寸 B .一丈八尺五寸 C .二丈一尺五寸 D .二丈二尺五寸 2.已知n S 为等差数列{}n a 的前n 项和,3518a S +=,633a a =+,则n a =( ) A .1n - B .n C .21n - D .2n 3.在等差数列{a n }中,a 3+a 7=4,则必有( ) A .a 5=4 B .a 6=4 C .a 5=2 D .a 6=2 4.已知等差数列{}n a 的前n 项和为n S ,且110a =,56S S ≥,下列四个命题:①公差d 的最大值为2-;②70S <;③记n S 的最大值为M ,则M 的最大值为30;④20192020a a >.其真命题的个数是( ) A .4个 B .3个 C .2个 D .1个 5.设a ,0b ≠,数列{}n a 的前n 项和(21)[(2)22]n n n S a b n =---?+,*n N ∈,则 存在数列{}n b 和{}n c 使得( ) A .n n n a b c =+,其中{}n b 和{}n c 都为等比数列 B .n n n a b c =+,其中{}n b 为等差数列,{}n c 为等比数列 C .· n n n a b c =,其中{}n b 和{}n c 都为等比数列 D .· n n n a b c =,其中{}n b 为等差数列,{}n c 为等比数列 6.已知数列{}n a 是公差不为零的等差数列,且1109a a a +=,则129 10 a a a a ++???+= ( ) A . 278 B . 52 C .3 D .4 7.已知等差数列{}n a 中,前n 项和2 15n S n n =-,则使n S 有最小值的n 是( ) A .7 B .8 C .7或8 D .9 8.已知等差数列{}n a 的前n 项和为n S ,若936S S =,则6 12S S =( ) A . 17 7 B . 83 C . 143 D . 103 9.已知数列{}n a 是等差数列,其前n 项和为n S ,若454a a +=,则8S =( ) 第一章原子结构与性质 ?原子结构 1?能级与能层 加:也瓦子的总十轨ift 呈哦讳醪 mW L1+ wpFfe 詆上 各隐级上的廉「孰直養副」枳|睡緘丄宇牛 佩址」一-牛 * + b +*-r ⑴相同题上㈱子執坦能量的高低; WS 畀卩M?i 『 ② 形状相R 的尙子報说能卡的髙低: 农2令触靭…… ③ 同橋层内用状相同而伸屛方向 不同的廉了蜿ifi 的昶章和专'如 即“ 2i 如即勘道仰能楚4A 零 3. 原子核外电子排布规律 ⑴构造原理:随着核电荷数递增,大多数元素的电中性基 轨道(能级),叫做构造原理。 J ◎⑥?金 ? ◎⑥、⑥、⑥ ⑥⑥⑥? ?i/ 能级交错:由构造原理可知,电子先进入 说明:构造原理并不是说 4s 能级比3d 能级能 量低(实际上 4s 能级比3d 能级能量高),而是指这样顺 序填充电子可以使整个原子的能量最低。 也就是说,整个原子的能量不能机械地看做是各电子所处轨道的 能量之和。 (2)能量最低原理 现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量 最低原理。 构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。 (3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。 换言之, 态原子的电子按右图顺序填入核外电子运动 4s 轨道,后进入3d 轨道,这种现象叫能级交错。 一个轨道里最多只能容纳两个电子, 且电旋方向相反 (用“TJ”表示),这个原理称为泡利(Pauli )原理 (4) 洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道, 洪特规则特例:当p 、d 、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。 即 p0、dO 、fO 、p3、d5、f7、p6、d10、f14 时,是较稳定状态。 前36号元素中,全空状态的有 4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、 15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有 10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。 4. 基态原子核外电子排布的表示方法 (1) 电子排布式 ① 用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K : 1s22s22p63s23p64s1。 ② 为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相 应稀有气体 的元素符号外加方括号表示,例如 K : [Ar]4s1。 (2) 电子排布图(轨道表示式) 每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。 如基态硫原子的轨道表示式为 帀冋戸冋河丽FW1 In 2 驶 2fi 3* 3|> 二.原子结构与元素周期表 1. 原子的电子构型与周期的关系 (1) 每周期第一种元素的最外层电子的排布式为 ns1。每周 期结尾元素的最外层电子排布式除 He 为1s2 外,其余为ns2np6。He 核外只有2个电子,只有1个s 轨道,还未出现p 轨道,所以第一周期结尾元素的 电子排布跟其他周期不同。 (2) 一个能级组最多所容纳的电子数等于一个周期所包含的元素种类。但一个能级组不一定全部是能量 相同的能级,而 是能量相近的能级。 2. 元素周期表的分区 (1)根据核外电子排布 ① 分区 这个规则叫洪特( Hund )规则。比如, f J J J fJ I f p3的轨道式为 而且自旋方向相同, 原子结构与性质 一 原子结构 1、原子的构成 中子N (核素) 原子核 近似相对原子质量 质子Z (带正电荷) → 核电荷数 元素 → 元素符号 原子结构 决定原子呈电中性 电子数(Z 个) 化学性质及最高正价和族序数 体积小,运动速率高(近光速),无固定轨道 核外电子 运动特征 电子云(比喻) 小黑点的意义、小黑点密度的意义。 排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图 2、三个基本关系 (1)数量关系:质子数 = 核电荷数 = 核外电子数(原子中) (2)电性关系: ①原子中:质子数=核电荷数=核外电子数 ②阳离子中:质子数>核外电子数 或 质子数=核外电子数+电荷数 ③阴离子中:质子数<核外电子数 或 质子数=核外电子数-电荷数 (3)质量关系:质量数 = 质子数 + 中子数 二 原子核外电子排布规律 决定 X) (A Z 三相对原子质量 定义:以12C原子质量的1/12(约1.66×10-27kg)作为标准,其它原子的质量跟它比较所得的值。其国际单位制(SI)单位为1,符号为1(单位1一般不写) 原子质量:指原子的真实质量,也称绝对质量,是通过精密的实验测得的。 如:一个氯原子的m(35Cl)=5.81×10-26kg。 核素的相对原子质量:各核素的质量与12C的质量的1/12的比值。一种元素有几种同位素,就应 有几种不同的核素的相对原子质量, 相对诸量如35Cl为34.969,37Cl为36.966。 原子比较核素的近似相对原子质量:是对核素的相对原子质量取近似整数值,数值上与该质量 核素的质量数相等。如:35Cl为35,37Cl为37。 元素的相对原子质量:是按该元素各种天然同位素原子所占的原子个数百分比算出的平均值。如: Ar(Cl)=Ar(35Cl)×a% + Ar(37Cl)×b% 元素的近似相对原子质量:用元素同位素的质量数代替同位素相对原子质量与其原子个数百分比 的乘积之和。 第一章物质结构与性质教案 教材分析: 一、本章教学目标 1.了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。 2.了解能量最低原理,知道基态与激发态,知道原子核外电子在一定条件下会发生跃迁产生原子光谱。 3.了解原子核外电子的运动状态,知道电子云和原子轨道。 4.认识原子结构与元素周期系的关系,了解元素周期系的应用价值。 5.能说出元素电离能、电负性的涵义,能应用元素的电离能说明元素的某些性质。 6.从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,在抽象思维、理论分析的过程中逐步形成科学的价值观。 本章知识分析: 本章是在学生已有原子结构知识的基础上,进一步深入地研究原子的结构,从构造原理和能量最低原理介绍了原子的核外电子排布以及原子光谱等,并图文并茂地描述了电子云和原子轨道;在原子结构知识的基础上,介绍了元素周期系、元素周期表及元素周期律。总之,本章按照课程标准要求比较系统而深入地介绍了原子结构与元素的性质,为后续章节内容的学习奠定基础。尽管本章内容比较抽象,是学习难点,但作为本书的第一章,教科书从内容和形式上都比较注意激发和保持学生的学习兴趣,重视培养学生的科学素养,有利于增强学生学习化学的兴趣。 通过本章的学习,学生能够比较系统地掌握原子结构的知识,在原子水平上认识物质构成的规律,并能运用原子结构知识解释一些化学现象。 注意本章不能挖得很深,属于略微展开。 第一节原子结构 第一课时 知识与技能: 1、进一步认识原子核外电子的分层排布 2、知道原子核外电子的能层分布及其能量关系 3、知道原子核外电子的能级分布及其能量关系 4、能用符号表示原子核外的不同能级,初步知道量子数的涵义 5、了解原子结构的构造原理,能用构造原理认识原子的核外电子排布 6、能用电子排布式表示常见元素(1~36号)原子核外电子的排布 方法和过程: 复习和沿伸、类比和归纳、能层类比楼层,能级类比楼梯。 情感和价值观:充分认识原子结构理论发展的过程是一个逐步深入完美的过程。 教学过程: 1、原子结构理论发展 从古代希腊哲学家留基伯和德谟克利特的朴素原子说到现代量子力学模型,人类思想中的原子结构模型经过多次演变,给我们多方面的启迪。 现代大爆炸宇宙学理论认为,我们所在的宇宙诞生于一次大爆炸。大爆炸后约两小时,诞生了大量的氢、少量的氦以及极少量的锂。其后,经过或长或短的发展过程,氢、氦等发生原子核的熔合反应,分期分批地合成其他元素。 〖复习〗必修中学习的原子核外电子排布规律: 第一节原子结构 第一课时 知识与技能: 1、进一步认识原子核外电子的分层排布 2、知道原子核外电子的能层分布及其能量关系 3、知道原子核外电子的能级分布及其能量关系 4、能用符号表示原子核外的不同能级,初步知道量子数的涵义 5、了解原子结构的构造原理,能用构造原理认识原子的核外电子排布 6、能用电子排布式表示常见元素(1~36号)原子核外电子的排布 教学内容: 一、原子结构理论发展 从古代希腊哲学家留基伯和德谟克利特的朴素原子说到现代量子力学模型,人类思想中的原子结构模型经过多次演变,给我们多方面的启迪。 现代大爆炸宇宙学理论认为,我们所在的宇宙诞生于一次大爆炸。大爆炸后约两小时,诞生了大量的氢、少量的氦以及极少量的锂。其后,经过或长或短的发展过程,氢、氦等发生原子核的熔合反应,分期分批地合成其他元素。 〖复习〗必修中学习的原子核外电子排布规律: 核外电子排布的一般规律 (1)核外电子总是尽量先排布在能量较低的电子层,然后由里向外,依次 排布在能量逐步升高的电子层(能量最低原理)。 (2)原子核外各电子层最多容纳个电子。 (3)原于最外层电子数目不能超过个(K层为最外层时不能超过个电 子)。 (4)次外层电子数目不能超过个(K层为次外层时不能超过个),倒 数第三层电子数目不能超过个。 说明:以上规律是互相联系的,不能孤立地理解。例如;当M层是最外层时,最多可排个电子;当M层不是最外层时,最多可排个电子 练习: 1、画出下列原子的结构示意图:Be、N、Na、Ne、Mg 在这些元素的原子中,最外层电子数大于次外层电子数的有,最外层电子数与次外层电子数相等的有,最外层电子数与电子层数相等的有; L层电子数达到最多的有,K层与M层电子数相等的有。 2、A元素原子的M电子层比次外层少2个电子。B元素原子核外L层电子数比最外层多7个电子。(1)A元素的元素符号是,B元素的原子结构示意图为________________; (2)A、B两元素形成化合物的化学式及名称分别是__ _____ _。 二、能层与能级 能层:多电子原子的核外电子的________是不同的,按电子的______差异,可将核外电子分成不同的能层由内而外可以分为: 第一、二、三、四、五、六、七……能层 《第1讲原子结构与性质》训练 1.如图是四位同学学习了元素周期表后,对这节内容的认识,你认为不正确的是() 【答案】C 【解析】氢元素中氕原子就不舍中子 2.下列叙述错误的是()A.13C和14C属于同一种元素,它们互为同位素 B.1H和2H是不同的核素,它们的质子数相等 C.14C和14N的质量数相等。它们的中子数不等 D.6Li和7Li的电子数相等,中子数也相等 【答案】D 【解析】13C和14C互为同位素;14C和14N质量数都为14,中子数分别为8、7;1H和2H 互为同位素,质子数相等;6Li和7Li互为同位素,质子教和电子数都对应相等,但中子数不相等. 3.在短周期元素中,若某元素原子的最外层电子数与其电子层数相等,则符合条件的元素种数为()A.1种B.2种C.3种D.4种 【答案】C 【解析】符合此条件的元素有H、Be、Al三种元素。 4.下列各项中的两个分子核外电子总数不同的是()A.H2O2和CH3OH B.HNO2和HClO C.H2O和CH4 D.HCl和F2 【答案】B 【解析】A项、D项分子中核外电子总数都为18,C项分子中核外电子总数均为10。5.近20年来,同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用。 如在陆地生态研究中,2H、13C、15N、18C、34S等被视作环境分析指示原子。下列说法中正确的是()A.34S原子核内的中子数为16 B.1H218O的摩尔质量为20 g·mol-1 C.13C和15N核内的质子数相差2 D.2H+核外电子数为2 【答案】B 【解析】选A项中S为16号元素,质量数为34,中子数为34-16=18,错误;B项中1H218O 的摩尔质量=(1×2+18) g·mol-1=20 g·mol-1,正确;C项中C为6号元素,N为7号元素, 当虞姬横刀,将一朵生命之情绽放成矛尖锋刃的湛蓝。我看到鲜红鲜红的血流过雪白雪白的颈。壮士掩面,乌骓悲鸣。 鲁迅说成功是把好的东西包装给人看,而失败是把好的东西毁灭给人看。于是,你便成了最伟大的毁灭的艺术。“曾是气吞残虏!”你的英勇是无人企及的神话。釜破舟沉,是你无畏的誓言。“何弊之乘”的果敢,“挡我者死”的豪迈。几千年后似乎还可以听到你圆睁环眼倒竖钢髯的一声断喝。乌骓马来往奔突,每一个轮回的拼杀都像是一条法力无边的咒语,使尸堆成山,使血流成河。那杆长予挑起了几多秦国虎狼之将的尸首,几千年后壁上清吟之时还自滴着秦兵的黑血! 然而,你胜不了刘邦。因为你,还有诚信。 “竖子不足与谋!”范增如是说。当楚强汉弱之时,诛刘邦之机会何止千万。然而你没有。“不可沽名学霸王。”毛泽东说你沽名钓誉,我没有看到,我只看到你的诚信。“此沛公左司马曹无伤言之。”你直言不讳,面对的还是刘邦。于是曹无伤被诛,试问天下谁人再敢助楚?你以为楚河汉界便是界限,殊不知刘邦有心明修栈道,暗渡(度)陈仓!韩信谓刘邦不善用兵而善用将,他的心计,他的丢诚弃信便是他的武器。而这居然比你的宝马大刀还要锋利。然而刘邦不足以与你相比;刘邦是君主,而项羽,是英雄!于是你英雄的起事,英雄的南征北战,英雄的失败。当楚歌的韵律从四面八方像魔音一般折磨你的耳鼓,面对嘶鸣的乌骓和似水的虞姬,你的眼泪磨蚀你的伟岸。“虞姬虞姬奈若何?”于是在乌江,你完成了一个没有丢弃诚信的男人的毁灭艺术。 当拔山举鼎的传奇褪色成一页泛黄的史册,与斜阳下汉家的小儿稚嫩的传唱“大风起兮云飞扬”,你终于远去,留下一个顶天立地的背影。也许你做了鬼雄,跨着随你投江而死的乌骓,旌旗十万斩阎罗,你轰轰烈烈的死去,因为有诚信,为你殉葬。 于是,你不朽,你最终还是战胜了刘邦,以你的诚信,刺刘邦于后人的口碑之下! 【简评】 仅仅用“中心明确,语言优美”来评价这篇散文,是远远不够的。这位考生不以成败论英雄,而是以“诚信”为中心,深入探究人性的善恶美丑,阐述了独到而深刻的见解。这种不拘前人旧说,用充满思辩色彩的严密推理得出的结论,表现了一种十分可贵的科学的创新精神。再加上严谨无隙而又流动自如的结构,优美畅达而又灵动轻捷的语言,便将这种深邃的哲理思考悄无声息地融进了充分诗化的语言和无处不在的情感氛围之中,显示了作者相当成熟而扎实的语文素养。 【素材运用】 1、话题"意气": 在棋盘拼杀,楚河汉界分明,我会一如既往想起楚王项羽与汉王刘邦。虞姬的自刎,乌骓的投江让更多的人倒向项羽,鸿门宴上的刘邦似乎只是小人,听听汉家小儿高唱"大风起兮云飞扬"便热血沸腾,可历史的车轮证明了刘邦比项羽更能成就一番大业。是他主张张骞扶着驼铃走向了大漠,是他让卫青挥动旌旗舞向了大漠的飞沙。他们都是英雄,皆有意气,是意气二字所有义项不同,楚王的意气用事,与汉王的意气风发。王安石《题乌江亭》:百战疲劳壮士哀,中原一败势难回。江东弟子今犹在,肯为君王卷土来?(湖南高考满分作文《谈意气》) 2、话题"自信": 项羽过于相信自己。大家都知道项羽破釜沉舟的故事,他在战场上一向是攻无不克,战无不胜。别的暂且不说,只那以少胜多的钜鹿之战就令人惊叹不已。恐怕正因如此,项羽养成了孤傲的性格。无论什么都以己为尊,好像这天下除了他就再也没有别的人可以收拾了。独断专行使历史陷入了沉思,过分的自信也就铸下了这千年的遗憾。(安徽高考满分作文《刚愎自用的典型--项羽人物形象刍议》) 3、话题"相信自己与听取别人的意见": 乌江岸边,夜色如水。如漆的夜里张扬着狰狞,一支支闪烁的火把如一支支泛着幽蓝的眼睛。啊--是谁用凄凉的声音,在唱一首首熟悉的楚歌?是三千江东子弟不散的英灵吗?骓,僵卧在它曾经踏起飞尘的黄沙中,一朵冷艳开在虞姬如雪的粉颈上。呐喊依旧。如霜的冷刃上浸染着殷红的温暖,一具勇猛硕大的躯体缓缓躺在孕育它的大地上。在这个不灭的神话中,留下了千年的遗憾。亚父范增的一句"竖子不足与谋"似乎就已奠定了悲剧的基础。鸿门宴,亚父频举的玉玦,不在你的双眼,项庄、项伯的舞剑成了千古的笑资。在你自负的笑声中,溜走了你的宿敌。我是谁?我是叱咤风云的西楚霸王。他,刘邦小儿算得什么?他有破釜沉舟、九战九捷的自信与魄力吗?什么智勇双全的韩信求见,哼,一个胯下之父来到这里谋职,让他滚!我这里不缺谋士!一辆破旧的马车,蹒跚前行,浑浊的老泪在范增满是沟壑的脸上纵横……一切都完了,为什么到临死的时候,你还怀着"时不利兮"的愤怒,冲不破自负的牢笼呢?(满分作文《千年的遗憾》) 4、话题"自己的认知和他人的期望": 第1讲原子结构与性质 【考纲点击】 原子结构与元素的性质:(1)了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~3 6号元素原子核外电子、价电子的电子排布式和电子排布图(轨道表达式);(2)了解电离能的含义,并能用以说明元素的某些性质;(3)了解电子在原子轨道之间的跃迁及其简单应用;(4)了解电负性的概念并能用以说明元素的某些性质。 考点1原子结构 1.能层与能级 (1)能层、能级与最多容纳电子数 能层 (n) 一二三四五六七符号K L M N O P Q 能级1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s …… 最多容纳电子数2 2 6 2 6 10 2 6 10 14 2 …… 2 8 18 32 …2n2 (2)常见原子轨道电子云轮廓 原子轨道电子云轮廓形状轨道个数 s 球形 1 p 哑铃形 3(p x ,p y ,p z ) 2.核外电子排布 (1)排布规律 ①能量最低原理:基态原子核外电子优先占据能量最低的原子轨道,如Ge :1s 22s 22p 63s 23p 63d 104s 24p 2。 ②泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子。 ③洪特规则:原子核外电子在能量相同的各轨道上排布时,电子总是优先单独占据一个轨道,且自旋状态相同。 ④洪特规则特例 在能量最低原理的基础上,当轨道出现半充满、全充满、全空时,能量更低。 例:Cu 1s 22s 22p 63s 23p 63d 104s 1 Cr 1s 22s 22p 63s 23p 63d 54s 1 (2)四种表示方法 表示方法 举例 电子排布式 Cr :1s 22s 22p 63s 23p 63d 54s 1 简化电子排布式 Cu :[Ar]3d 104s 1 价电子排布式 Fe :3d 64s 2 电子排布图(或轨道表示式) (3)易错防范 ①电子排布式 a.3d 、4s 书写顺序混乱 如???Fe :1s 22s 22p 63s 23p 64s 23d 6(×)Fe :1s 22s 22p 63s 23p 63d 64s 2(√) b.违背洪特规则特例。 如???Cr :1s 22s 22p 63s 23p 63d 44s 2(×)Cr :1s 22s 22p 63s 23p 63d 54s 1 (√) ???Cu :1s 22s 22p 63s 23p 63d 94s 2(×)Cu :1s 22s 22p 63s 23p 63d 104s 1(√) 课练15原子结构 基础练 1.下列有关化学用语正确的是() A.甲烷分子的球棍模型: B.NH4I的电子式: C.F原子的结构示意图: D.中子数为20的氯原子:3717Cl 2.131 53I是常规核裂变产物之一,可以通过测定大气或水中131 53I的含量变化来监测核电站是否发生放射性物质泄漏。下列有关13153I的叙述中错误的是() A. 131 53I的化学性质与127 53I相同 B. 131 53I的原子序数为53 C. 131 53I的原子核外电子数为78 D. 131 53I的原子核内中子数多于质子数 3.已知氢有3种核素(1H、2H、3H),氯有2种核素(35Cl、37Cl)。则HCl的相对分子质量可能有() A.1种B.5种 C.6种D.1 000种 4.两种微粒含有相同的质子数和电子数,这两种微粒可能是() ①两种不同的原子;②两种不同元素的原子;③一种原子和一种分子;④一种原子和一种离子;⑤两种不同分子;⑥一种分子和一种离子;⑦两种不同阳离子;⑧两种不同阴离子;⑨一种阴离子和一种阳离子 A.①③⑤⑥⑦⑧B.①③⑤⑦⑧ C.①③④⑤⑦D.全部都是 5.下列说法中正确的是() A.原子中,质量数一定大于质子数 B.电子层多的原子半径一定大于电子层少的原子半径 C.由两种元素组成的化合物,若含有离子键,就没有共价键 D.自然界中有多少种核素,就有多少种原子 6.镨(Pr)、钕(Nd)都属于稀土元素,在军事和国防工业上有广泛应用,下列有关说法中正确的是() A.镨(Pr)和钕(Nd)可能互为同位素 B.140 59Pr是镨的一种新元素 C.140 59Pr核内有59个质子,核外有81个电子 D.140 59Pr质量数为140,原子序数为59,核内有81个中子 7.据报道,在火星和金星大气层中发现了一种非常特殊的能导致温室效应的气态化合物,它的结构式为16O===C===18O。下列说法正确的是() A.16O与18O为同种核素 B.16O===C===18O与16O===C===16O互为同位素 C.16O===C===18O与16O===C===16O的化学性质几乎完全相同 D.目前提出的“低碳经济”的目标是向空气中增加CO2,促进碳的平衡 8.六种粒子的结构示意图分别为 A B C D E F 请回答下列问题: (1)依次写出6种粒子的符号:_____________________________________________________________________ ___。 (2)A、B、C、D、E、F共表示________种元素、________种原子、________种阳离子、________种阴离子。 (3)上述微粒中,阴离子与阳离子可构成两种化合物,这两种化合物的化学式为________、________。 9.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子)。请回答: (1)A元素是________,B元素是________,C元素是________。(用元素符号表示) (2)D是由两种元素组成的双原子分子,其分子式是________。 (3)E是所有含18个电子的微粒中氧化能力最强的单质分子,其分子式是________。 (4)F是由两种元素组成的三原子分子,其分子式是________,电子式是________。 (5)G分子中含有4个原子,其分子式是________。 (6)H分子中含有8个原子,其分子式是________。 10.已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如图所示的转化关系。 (1)如果A、B、C、D均是10电子的微粒,则A的结构式为________;D的电子式为________。 (2)如果A和C是18电子的微粒,B和D是10电子的微粒。 第一章原子结构与性质 课标要求 1.了解原子核外电子的能级分布,能用电子排布式表示常见元素的(1~36号)原子核外电子的排布。了解原子核外电子的运动状态。 2.了解元素电离能的含义,并能用以说明元素的某种性质 3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。 4.了解电负性的概念,知道元素的性质与电负性的关系。 要点精讲 一.原子结构 1.能级与能层 2.原子轨道 3.原子核外电子排布规律 ⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。 能级交错:由构造原理可知,电子先进入4s 轨道,后进入3d 轨道,这种现象叫能级交错。 说明:构造原理并不是说4s 能级比3d 能级能量低(实际上4s 能级比3d 能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。也就是说,整个原子的能量不能机械地看做是各电子所处轨道的能量之和。 (2)能量最低原理 现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。 构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。 (3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli )原理。 (4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund )规则。比如,p3的轨道式为 或,而不是。 洪特规则特例:当p 、d 、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。 前36号元素中,全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。 4. 基态原子核外电子排布的表示方法 (1)电子排布式 ①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K :1s22s22p63s23p64s1。 ②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以↑↓ ↑ ↓ ↓ ↓ ↑ ↑ ↑ 第一章 原子结构与性质知识点归纳 2.位、构、性关系的图解、表解与例析 同位素(两个特性) 3.元素的结构和性质的递变规律 4.核外电子构成原理 (1)核外电子是分能层排布的,每个能层又分为不同的能级。 (2)核外电子排布遵循的三个原理: a .能量最低原理 b .泡利原理 c .洪特规则及洪特规则特例 (3)原子核外电子排布表示式:a .原子结构简图 b .电子排布式 c .轨道表示式 5.原子核外电子运动状态的描述:电子云 6.确定元素性质的方法 第二章 分子结构与性质复习 随着原子序数递增 ① 原子结构呈周期性变化 ② 原子半径呈周期性变化 ③ 元素主要化合价呈周期性变化 ④ 元素的金属性与非金属形呈周期性变化 ⑤ 元素原子的第一电离能呈周期性变化 ⑥ 元素的电负性呈周期性变化 元素周期律 排列原则 ① 按原子序数递增的顺序从左到右排列 ② 将电子层数相同的元素排成一个横行 ③ 把最外层电子数相同的元素(个别除 外),排成一个纵行 周期 (7个 横行) ① 短周期(第一、二、三周期) ② 长周期(第四、五、六周期) ③ 不完全周期(第七周期) 元 素 周 期 表 族(18 个纵行) ① 主族(第ⅠA 族—第ⅦA 族共七个) ② 副族(第ⅠB 族—第ⅦB 族共七个) ③ 第Ⅷ族(第8—10纵行) ④结 构 1、微粒间的相互作用 (2)共价键的知识结构 2.分子构型与物质性质 (1)微粒间的 相互作用 σ键 π键 按成键电子云 的重叠方式 极性键 非极性键 一般共价键 配位键 离子键 共价键 金属键 按成键原子 的电子转移方式 化学键 范德华力 氢键 分子间作用力 本质:原子之间形成共用电子对(或电子云重叠) 特征:具有方向性和饱和性 σ键 特征 电子云呈轴对称 (如s —s σ键、 s —p σ键、p —p σ键) π键 特征 电子云分布的界面对通过键轴的一个平面对称(如p —p π键) 成键方式 共价单键—σ键 共价双键—1个σ键、1个π键 共价叁键—1个σ键、2个π键 规律 键能:键能越大,共价键越稳定 键长:键长越短,共价键越稳定 键角:描述分子空间结构的重要参数 用于衡量共价键的稳定性 键参数 共 价 键 新课标(人教版)高一化学选修3 全部教学案 第一章原子结构与性质 教材分析: 一、本章教学目标 1.了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。 2.了解能量最低原理,知道基态与激发态,知道原子核外电子在一定条件下会发生跃迁产生原子光谱。 3.了解原子核外电子的运动状态,知道电子云和原子轨道。 4.认识原子结构与元素周期系的关系,了解元素周期系的应用价值。 5.能说出元素电离能、电负性的涵义,能应用元素的电离能说明元素的某些性质。 6.从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,在抽象思维、理论分析的过程中逐步形成科学的价值观。 本章知识分析: 本章是在学生已有原子结构知识的基础上,进一步深入地研究原子的结构,从构造原理和能量最低原理介绍了原子的核外电子排布以及原子光谱等,并图文并茂地描述了电子云和原子轨道;在原子结构知识的基础上,介绍了元素周期系、元素周期表及元素周期律。总之,本章按照课程标准要求比较系统而深入地介绍了原子结构与元素的性质,为后续章节内容的学习奠定基础。尽管本章内容比较抽象,是学习难点,但作为本书的第一章,教科书从内容和形式上都比较注意激发和保持学生的学习兴趣,重视培养学生的科学素养,有利于增强学生学习化学的兴趣。 通过本章的学习,学生能够比较系统地掌握原子结构的知识,在原子水平上认识物质构成的规律,并能运用原子结构知识解释一些化学现象。 注意本章不能挖得很深,属于略微展开。 相关知识回顾(必修2) 1.原子序数:含义: (1)原子序数与构成原子的粒子间的关系: 原子序数====。(3)原子组成的表示方法 a. 原子符号:A z X A z高中化学原子结构必修
吉林省舒兰市第一中学等差数列基础测试题题库doc
完整版原子结构与性质知识点总结与练习
高中化学选修三 原子结构与性质知识总结
第一章《原子结构与性质》全章教案
选修3第一章《原子结构与性质》全章教案
1《第1讲 原子结构与性质》训练
吉林省舒兰市第一中学高中语文 题乌江亭项素材话题素材 新人教版必修1
第1讲 原子结构与性质.doc
高中化学练习-原子结构_word版含解析
【人教版】高中化学选修3知识点总结:第一章原子结构与性质
选修3第一章原子结构与性质知识总结
人教版-选修3-第一章 原子结构与性质全章教案