
药品不良反应监测报告制度
1.为了加强药品的安全监管,严格执行《药品不良反应报告与监测管理办法》,特制定本制度。
2.在正常用法、用量情况下,患者在给药过程中或给药后,出现的可能与所用药物有关的不良症状称之为药品不良反应。
3. 本制度适用于本院所有涉及药品使用和管理的科室、部门。
4.药物不良反应检测小组负责全院药物不良反应监测报告工作的组织、计划、实施和协作。药剂科负责药品不良反应报告与监测的日常工作。
5.药物不良反应报告的基本原则及范围:报告原则为“可疑就报”:报告范围为药品引起的所有可疑不良反应。
6、报告及反馈程序:
6.1若患者情况紧急,应及时对症处理,并把药品不良反应因素列入对原因的考虑之
列,详细询问既往史,救治过程中避免使用过敏发生率高的药品。
6.2对本事件是否为药品不良反应做出判断,若判断有困难,请示上级医生或反馈给
药品不良反应监测小组。
6.3及时与医院药品不良反应监测人员联系,并妥善保存原始资料,等待药物不良反
应监测人员的进一步处理。
6.4.一旦确定为药品不良反应,待患者情况稳定后,填写药品不良反应报表,内容尽
量详尽。药品不良反应可以在网上报告,也可以填写纸质报告。
6.5纸质填写的普通药物不良反应报告由护理站及时送交及药剂科每周定期派监测
人员收集,群体药物不良事件、严重不良反应应立即上报药品不良反应监测小组,经小组专家讨论定性后,上报省监测中心。上报工作由药品不良反应监测小组指定的专人负责。
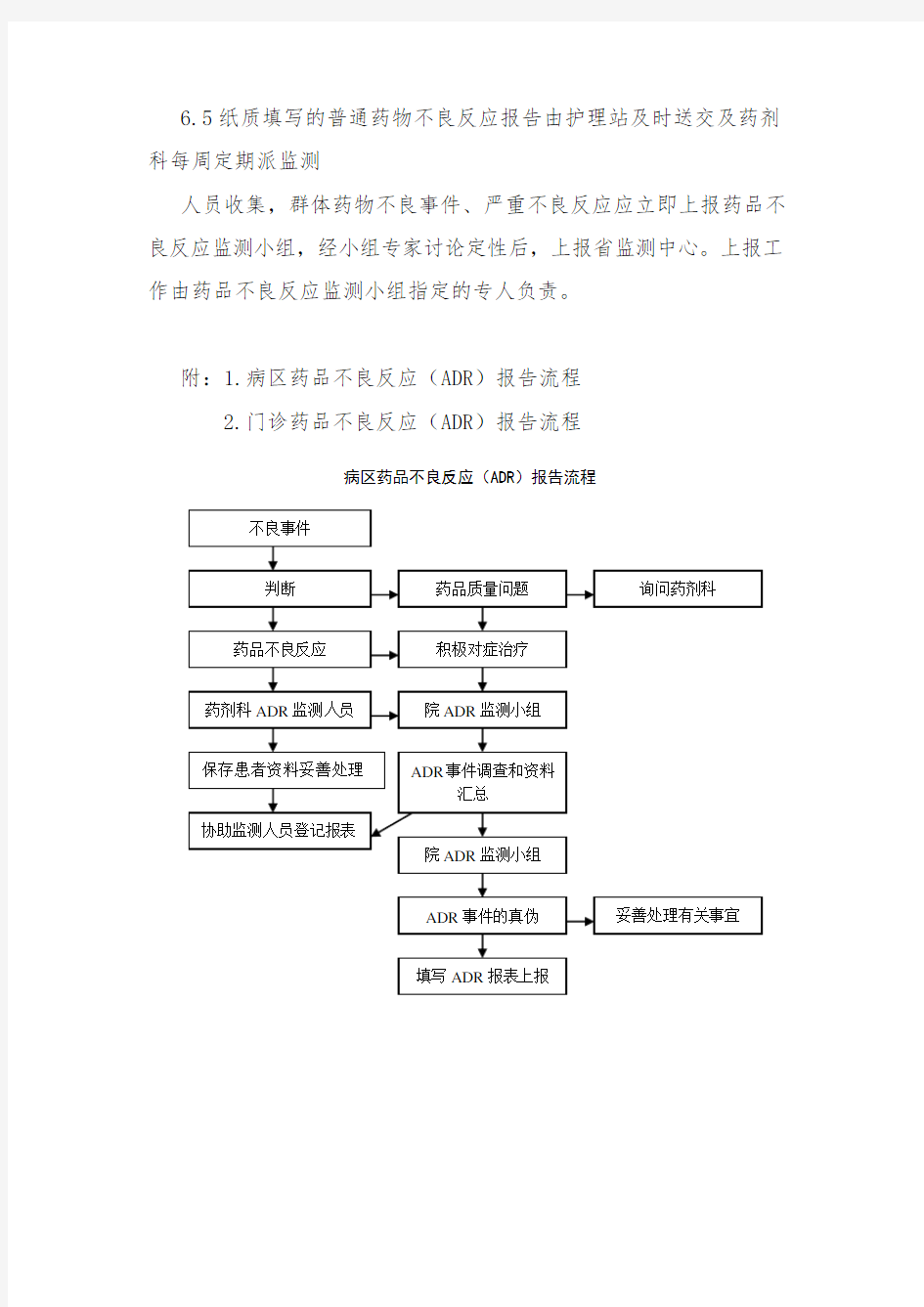
附:1.病区药品不良反应(ADR)报告流程
2.门诊药品不良反应(ADR)报告流程
病区药品不良反应(ADR)报告流程
门诊药品不良反应(ADR)报告流程