
一、酸碱滴定
原
理
酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。
基本反应H++ OH- = H
2
O
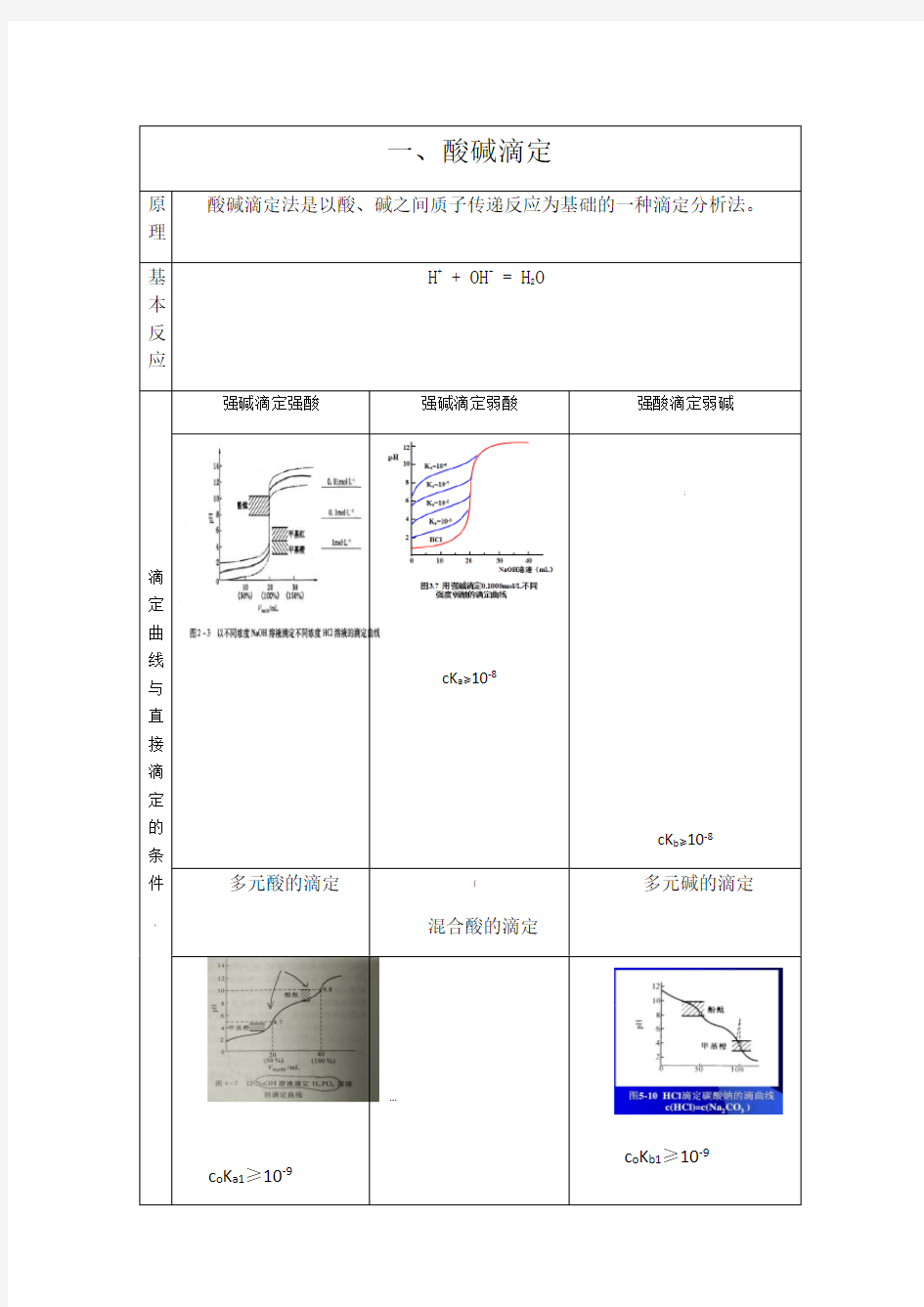
滴定曲线与直接滴定的条件
"
强碱滴定强酸强碱滴定弱酸强酸滴定弱碱
cK a≥10-8
;
cK b≥10-8多元酸的滴定[
混合酸的滴定
多元碱的滴定c o K a1≥10-9
…
c o K b1≥10-9
应
用
硼酸的测定、铵盐的测定、克氏定发、酸酐和醇类的测定等
`
酸
碱
溶
液
p
H
计
算
一元弱酸两性物质
二元弱酸缓冲物质`
;
$
原理
配位滴定是以络合反应(形成配合物)反应为基础的滴定分析方法。
基本
反应
M+Y=MY
配合物的稳定常数
酸效应αY(H)·
干扰离子效应αY(N)
溶液酸度越大,αY(H)越大,表示酸效应引
起的副反应越严重。
αY(H)=1+β1[H+] +β2[H+] 2+β3[H+] 3+β
4[H+] ?+β? [H+] ?
[Y]越小,αY(N)越大,表示干扰
离子效应引起的副反应越严重。
金属离子的配位效应αM(OH)、αM(L)及
总副反应αM
Y的总副反应αY
条件稳定常数K’MY
αM越小,αY越小,K’MY越小,配合物稳定
性越大
滴定条件准确直接滴定的条件
K’MY≥10-6
分别滴定的条件
K’MY≥10-6,△lgK≥5
配位
剂
1.无机配位剂
2.有机配位剂:EDTA、CyDTA、EGTA、EDTP等
指示
剂
铬黑T、二甲酚橙、钙指示剂、PAN等
、
指示
剂原
理
指示剂游离态与配合态颜色不同
影响
滴定
突跃
范围
因素
1.金属离子浓度的影响:K’MY一定时,CM越大,ΔpM’越大
2.条件稳定常数的影响:CM一定时,K’MY越大,ΔpM’越大
3.酸度的影响:pH越小,αY(H)越大,K’MY越小,ΔpM’越小
4.其他辅助配位剂的影响:CL越大,αM(L)越大,K’MY越小,ΔpM’越小
用掩蔽和解蔽的方法进行滴定
;
常用
掩蔽
方法
配位掩蔽
法
沉淀掩蔽法氧化还原隐蔽法解蔽法
应用测定石灰
石中CaO、
MgO的含
测定Ga2+、Mg2+Bi3+、Zr4+、Th4+的
滴定
测定Cu2+、
Zn2+、Pb2+
^ )
原理氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定
分析方法。
基本反
应
Ox+ne-=Red
】
条件电
极电位
条件对电极电位的影响
离子强度副反应酸度|
一般忽略离子强
度的影响,一般
用浓度代替活度
酸度变化直接影
响电对的电极电
位
条件平
衡常数
%
滴定反
应条件
影响反
应速率
的因素
1.反应物浓度
2.温度
3.催化剂
4.诱导作用
滴定曲线与终点的测定化学计量点前化学计量点时化学计量点后,
指示剂氧化还原指示剂、自身指示剂、专属指示剂
预处理预氧化、预还原,除去有机物:干法灰化。湿法灰化
应用高锰酸钾法重铬酸钾&
碘量法
其他氧化还原滴定法
过氧化氢测定,钙、铁、有机物的测定,水样中化学需氧量的测定铁的测定,水样中化
学需氧量的测定
硫化钠总还
原能力的测
定,硫酸铜
中铜的测
定,漂白粉
中有效氯的
测定,费休
法测定微量
水分
硫酸铈法,溴酸钾法、
亚砷酸钠-亚硝酸钠法
四、沉淀滴定
原理利用沉淀反应,可以定量测定试样中某些组分的一种滴定分析方法。
[
基本反应
M++A-==MA(s)
溶度积常数
影响沉淀溶解度的因素同离子效应、盐效应、酸效应、配位效应,温度、溶剂、沉淀颗粒大小和结构的影响。
影响沉淀纯
度的因素与
措施
共沉淀:表面吸附、混晶、吸留和包藏;后沉淀
沉淀形成的条件
晶形沉淀
无定形沉淀
1. 在适当稀的溶液中沉淀
2. 不断搅拌并缓慢滴加稀沉淀剂
3. 在热溶液中进行沉淀,冷却后过滤
4. 在保证沉淀定量完全的条件下,适当增
高沉淀时溶液的酸度 5. 沉淀完全后,陈化一定时间
1. 在较浓的溶液中沉淀,较快
加入沉淀剂 2. 在热溶液中进行
3. 沉淀前加入适当的电解质,
通常是易分解挥发的铵盐
沉淀滴定法条件
1.生成的沉淀应具有恒定的组成,而且溶解度必须很小
2.沉淀反应必须迅速、定量的进行
3.能够用适当的指示剂或其他方法确定滴定的终点
应用(银量法) 摩尔法-铬酸钾;佛尔哈德法-铁铵矾;法扬司法-吸附指示剂