2020年高考全国Ⅰ卷理综化学试题
一、单选题
1.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸CH COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是( )
(3
CH CH OH能与水互溶 B.NaClO通过氧化灭活病毒
A.32
C.过氧乙酸相对分子质量为76
D.氯仿的化学名称是四氯化碳
【答案】D
【解析】乙醇易溶于水,能与水以任意比例互溶,A项正确;次氯酸钠具有强氧化性,能通过氧化灭
CH COOOH可知其相对分子质量为76, C项正确。活病毒,B项正确;由过氧乙酸的结构简式()
3
氯仿的化学式为
CHCl,化学名称是三氯甲烷,D项错误。
3
2.紫花前胡醇可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( )
C H O B.不能使酸性重铬酸钾溶液变色
A.分子式为14144
C.能够发生水解反应
D.能够发生消去反应生成双键
【答案】B
【解析】由紫花前胡醇的结构简式可确定其分子式为
C H O,A项正确;结构中含有碳碳双键、醇
14144
羟基,能使酸性重铬酸钾溶液变色,B项错误;结构中含有酯基,能发生水解反应,C项正确;该有机物能发生消去反应,形成碳碳双键,D项正确。
3.下列气体去除杂质的方法中,不能实现目的的是( )
【答案】A
【解析】二氧化硫和硫化氢都具有还原性,都能与酸性高锰酸钾溶液发生氧化还原反应,不能用酸性高锰酸钾溶液除去二氧化硫中的硫化氢气体,A 项符合题意;HCl极易溶于水,氯气在饱和食
盐水中溶解度很小,可用饱和食盐水除去氯气中的氯化氢气体,B 项不符合题意;铜与氧气在加热条件下反应生成氧化铜,铜与氮气不反应,故可用灼热的铜丝网除去氮气中的氧气,C 项不符合题意;2NO 可与NaOH 反应,NO 不与NaOH 反应,可用NaOH 溶液除去NO 中的2NO ,D 项不符合题意。
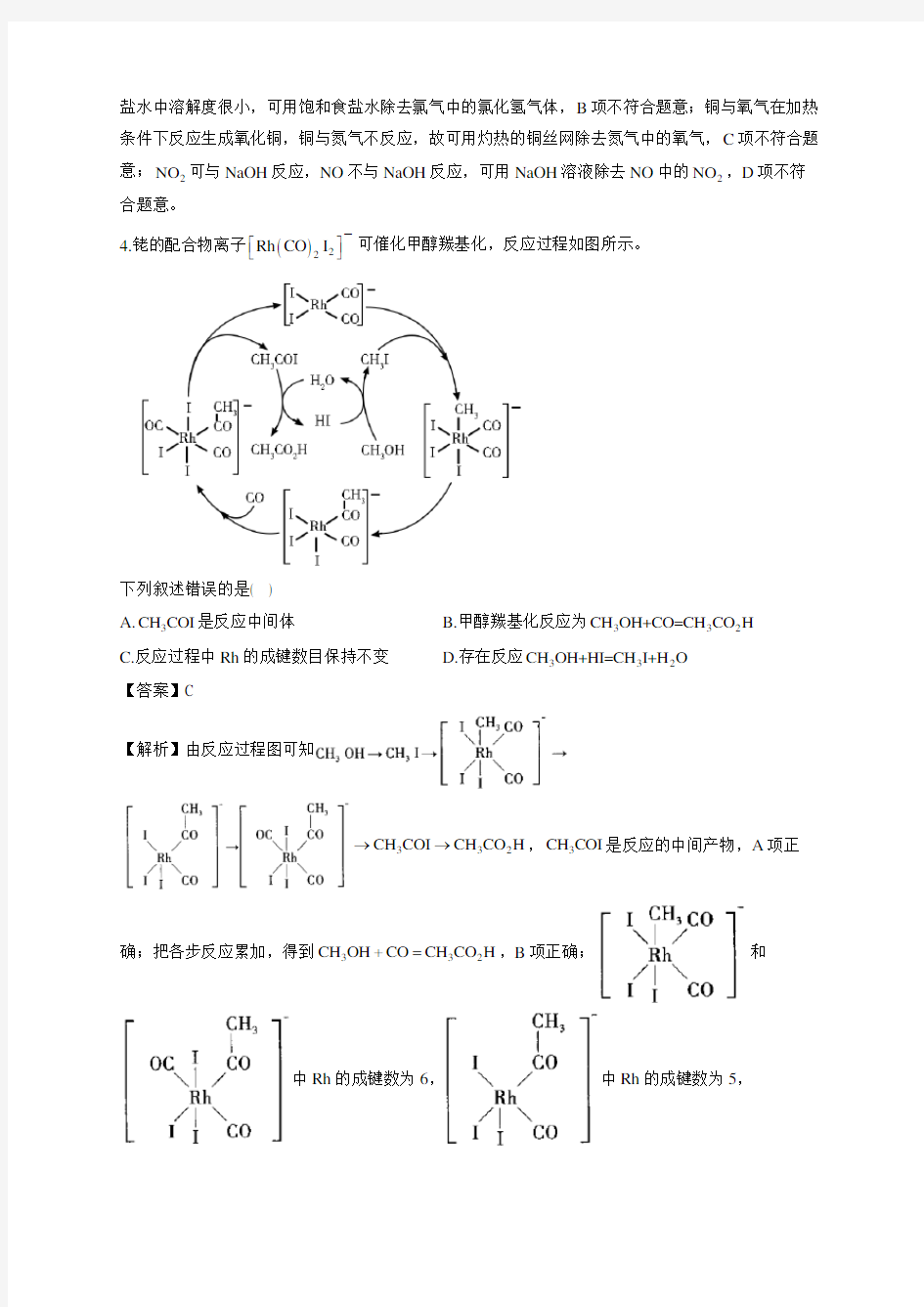
4.铑的配合物离子()22Rh CO I ????-
可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是( ) A.3CH COI 是反应中间体
B.甲醇羰基化反应为332CH OH+CO=CH CO H
C.反应过程中Rh 的成键数目保持不变
D.存在反应332CH OH+HI=CH I+H O
【答案】C
【解析】由反应过程图可知
332CH COI CH CO H →→,3CH COI 是反应的中间产物,A 项正
确;把各步反应累加,得到332CH OH CO CH CO H +=,B 项正确;和
中Rh 的成键数为6,中Rh 的成键数为5,
中Rh 的成键数为4,反应过程中Rh 的成键数不相同,C 项错误;由题图可
知,甲醇的第一步反应为332CH OH HI CH I H O +=+,D 项正确。
5.1934年约里奥–居里夫妇在核反应中用α粒子(即氦核42He )轰击金属原子W Z X ,得到核素30
Z+2Y ,
开创了人造放射性核素的先河: W Z X +42He →30Z+2Y +10n 。其中元素X 、Y 的最外层电子数之和为
8。下列叙述正确的是( ) A.W Z X 的相对原子质量为26 B.X 、Y 均可形成三氯化物 C.X 的原子半径小于Y 的 D.Y 仅有一种含氧酸
【答案】B
【解析】27
13
Al 的相对原子质量为27,A 项错误;x(A1)、Y(P)均可形成 三氯化物,分别为33AlCl PCl 、,B 项正确;根据同一周期主族元素从左到右原子半径依次减小知,X(Al)的原子半径
大于Y(P)的,C 项错误;Y(p)有多种含氧酸,如33H PO 和43H PO 等,D 项错误。
6.科学家近年发明了一种新型2Zn CO -水介质电池。电池示意图如图,电极为金属锌和选择性催化材料,放电时,温室气体2CO 被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( )
A.放电时,负极反应为24Zn 2e 4OH Zn(OH)---
-+=
B.放电时,1 mol 2CO 转化为HCOOH ,转移的电子数为2 mol
C.充电时,电池总反应为24222Zn OH) 2Zn O 4OH O (2H --=+↑++
D.充电时,正极溶液中OH -浓度升高 【答案】D
【解析】由题给装置图可知,放电时负极梓失去电子后结合-OH 生成24Zn(OH)-
,负极反应为24Zn 2e 4OH Zn(OH)----+=, A 项正确;放电时,正极上2CO 得电子生成HCOOH ,2CO 中C 的
化合价为+4,HCOOH 中C 的化合价为+2,21mol CO 转化为1molHCOOH ,转移2mol 电子,B 项
正确;充电 时阴极上24Zn(OH)-参与反应得到锌,阳极上2H O 参与反应得到氧气,电池总反应为24222Zn(OH)2Zn O 4OH 2H O --=+↑++,C 项正确;充电时,阳极上发生失电子的氧化反应:
222H O 4e O 4H -+-=↑+,氢氧根离子浓度降低,D 项错误。
7.以酚酞为指示剂,用0.1000-1mol L 的NaOH 溶液滴定20.00 mL 未知浓度的二元酸2H A 溶液。溶液中,pH 、分布系数δ随滴加NaOH 溶液体积NaOH V 的变化关系如图所示。[比如2-A 的分布系数:2-2-
-2-2c(A )δ(A )=c(H A)+c(HA )+c(A )
]
下列叙述正确的是( )
A.曲线①代表2δ(H A),曲线②代表-δ(HA )
B. 2H A 溶液的浓度为0.2000 -1mol L
C.-HA 的电离常数2a 1.010K -=?
D.滴定终点时,溶液中+2--(Na )<2(A )+(HA )c c c
【答案】C
【解析】由题图可知加入40 mL NaOH 溶液时达到滴定终点,又2H A 为二元酸,则2H A 溶液的浓度为10.1000mol L -?,由题图可知,没有加入NaOH 溶液时,2H A 溶液的pH 约为1.0,分析可知2H A 第一步完全电离,曲线 ①代表()HA δ-,曲线②代表()
2A δ-,A 项错误,B 项错误;由题图
可知()()2HA A δδ--=时溶液pH=2.0,即()()
2HA A c c --=时溶液pH=2.0
,则
(
)()()()
22
a H A HA
1.010HA
c c K c +-
-
--
?=
=?,C 项正确;滴定终点时溶液中存在的离子有
2Na H A HA OH ++---、、、、,根据电荷守恒有()()()()()
2---Na H 2A HA OH c c c c c +++=++,此时
()()H OH c c +-<,则()()()
2--Na 2A HA c c c +>+, D 项错误 。
二、非选择题题
8.钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及234SiO Fe O 、。采用以下工艺流程可由黏土钒矿制备43NH VO 。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH 如下表所示:
(1)“酸浸氧化”需要加热,其原因是___________。
(2)“酸浸氧化”中,+VO 和2+VO 被氧化成2VO +,同时还有___________离子被氧化。写出+
VO 转化
为2VO +反应的离子方程式___________。
(3)“中和沉淀”中,钒水解并沉淀为252V O xH O ?,随滤液②可除去金属离子+2++K Mg Na 、、、___________,以及部分的___________。
(4)“沉淀转溶”中,252V O xH O ?转化为钒酸盐溶解。滤渣③的主要成分是___________。 (5)“调pH”中有沉淀生成,生成沉淀反应的化学方程式是___________。
(6)“沉钒”中析出43NH VO 晶体时,需要加入过量4
NH Cl ,其原因是___________。 【答案】(1)加快酸浸和氧化反应速率(促进氧化完全)
(2)2+Fe ; +++2+222VO +MnO +2H =VO +Mn +H O
(3)2+Mn ;3+3+Fe Al 、 (4)()3Fe OH
(5)()223NaAlO +HCl+H O=NaCl+Al OH ↓或()()243Na Al OH +HCl= NaCl+Al OH +H O ↓???? (6)利用同离子效应,促进43NH VO 尽可能析出完全
【解析】 (1)“酸浸氧化”中温度较低时,酸浸和氧化反应速率较慢。为了加快酸浸和氧化反应速率,需要加热。
(2)从原料看,“酸漫氧化”中四氧化三铁溶于稀硫酸,发生反应
()342442423Fe O 4H SO FeSO Fe SO H O 4+=++,加入的二氧化锰除氧化VO +和2VO +外,还氧化
2+Fe 。VO +转化为2VO +反应的离子方程式为2222VO MnO 2H VO Mn
H O ++++
++=++。 (3)根据表格中数据知,pH 在3.0~3.1时,铁离子接近沉淀完全,少量铁离子随滤液②除去,3+A1部分沉淀,大量铝离子随滤液②除去,22+K Mg Na Mn +++、、、随滤液②除去。
(4)在pH>13的强碱性溶液中252V O H O x ?转化为钒酸盐而溶解,3Al(OH)转化为4NaAl(OH)而溶解,()3Fe OH 不溶,故滤渣③的主要成分是()3Fe OH 。
(5)pH=8.5时铝元素沉淀,故“调pH ”时生成氢氧化铝沉淀,反应的化学方程式为
432NaAl(OH)HCl=Al(OH)NaCl H O +↓++。
(6)“沉钒”时要使43NH VO 尽可能析出完全,利用同离子效应,加入过量4NH Cl 可达到此目的。
9.为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:
(1)由42FeSO 7H O 固体配制-140.10 mol L FeSO 溶液,需要的仪器有药匙、玻璃棒、_________(从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u ∞)应尽可能地相近。根据下表数据,盐桥中应选择____________作为电解质。
(4)电池反应一段时间后,测得铁电极溶液中()
2+Fe c 增加了0.02-1mol L 。石墨电极上未见Fe 析
出。可知,石墨电极溶液中()
2+
Fe c =________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______,铁电极的电极反应式为_______。因此,验证了2+Fe 氧化性小于________,还原性小于________。
(6)实验前需要对铁电极表面活化。在4FeSO 溶液中加入几滴()243Fe SO 溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是_______。 【答案】(1)烧杯、量筒、托盘天平 (2)KCl (3)石墨 (4)0.09mol/L
(5)3+-2+Fe +e =Fe ;-2+Fe-2e =Fe ;3+Fe ; Fe
(6)取活化后溶液少许于试管中,加入KSCN 溶液,若溶液不出现血红色,说明活化反应完成 【解析】(1)利用固体配制一定物质的量浓度的溶液时需要用托盘天平称量固体,用烧杯溶解固体,用量筒量取蒸馏水。
(2)根据盐桥中阴、阳离子不能参与反应,及33
32Fe 3HCO Fe(OH)3CO +-
+=↓+↑、2+2-44Ca +SO CaSO =↓,可排除23HCO Ca -+、,再根据4FeSO 溶液显酸性,而3NO -
在酸性溶液中具有氧化性,可排除3NO -
最后根据阴、阳离子的电迁移率应尽可能地接近,知选择KCl 作盐桥中电
解质较合适。
(3)电子由负极流向正极,结合电子由铁电极流向石墨电极,可知铁电极为负极,石墨电极为正极。 盐桥中的阳离子流向正极(石墨电极)溶液中。
(4)由题意知负极反应为2Fe 2e Fe -+-=,正极反应为32Fe e Fe +-++=,则铁电极溶液中()
2Fe c +增加-10.02mol L 时,石墨电极溶液中()
2Fe c +增加-10.04mol L ,故此时石墨电极溶液中
()
21Fe 0.09mol L c +-=?。
(5)石墨电极的电极反应式为32Fe e Fe +-++=,铁电极的电极反应式为2Fe 2e Fe -+-=,故验证了氧化性:32Fe Fe ++>,还原性:2Fe Fe +>。
(6)该活化反应为32Fe 2Fe 3Fe +++=, 故通过检验3+Fe 可说明活化反应是否完成,具体操作为取少量活化后溶液于试管,滴加几滴KSCN 溶液,若溶液不变血红色,则说明活化反应已完成。
10.硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是2SO 的催化氧化:12231SO (g)O (g)SO (g)98kJ mol 2
H -+????→?=-?钒催化剂
。回答下列问题:
(1)钒催化剂参与反应的能量变化如图所示,52V O (s)与()2SO g 反应生成4VOSO (s)和24V O (s)的热化学方程式为:_________。
(2)当2SO (g)、2O (g)和2N (g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa 、2.5MPa 和5.0MPa 压强下,2SO 平衡转化率α随温度的变化如图所示。反应在5.0MPa 、550℃时的α=__________,判断的依据是__________。影响α的因素有__________。
(3)将组成(物质的量分数)为22%SO (g)m 、2%O (g)m 和2%N (g)q 的气体通入反应器,在温度t 、压强p 条件下进行反应。平衡时,若2SO 转化率为α,则3SO 压强为___________,平衡常数p K =___________(以分压表示,分压=总压×物质的量分数)。
(4)研究表明,2SO 催化氧化的反应速率方程为:0.8
1(1)v k n ααα'??
'=-- ???
。式中:k 为反应速率常
数,随温度t 升高而增大;α为2SO 平衡转化率,α'为某时刻2SO 转化率,n 为常数。在
α'=0.90时,将一系列温度下的k 、α值代入上述速率方程,得到v t ~曲线,如图所示。
曲线上v 最大值所对应温度称为该α'下反应的最适宜温度m t 。m t t <时,v 逐渐提高; m t t >后,v 逐渐下降。原因是__________________________。
【答案】(1)12524242V O (s)2SO (g)2VOSO (s)V O (s)351kJ mol H -+=+?=-?
(2) 0.975;该反应气体分子数减少,增大压强,α提高。25.0MPa 2.5MPa p >=,所以1p =5.0MPa ;反应物(2N 和2O )的起始浓度(组成)、温度、压强
(3)
2m 100m p αα-;()0.5
1.51100mp m α
αα?
?- ?
-??
(4)升高温度,k 增大使v 逐渐提高,但α降低使v 逐渐下降。当t <t m ,k 增大对v 的提高大于α引起的降低;当m t t >,k 增大对v 的提高小于α引起的降低
【解析】(1)根据题图(a )知,12432522V O (s)SO (g)V O (s)SO (g)24kJ mol H -+=+?=-?①,124341V O (s)2SO (g)2VOSO (s)399kJ mol H -+=?=-?②。根据盖斯定律,由②-①×2得:112524242V O (s)2SO (g)2VOSO (s)V O (s)(39948)kJ mol 351kJ mol H --+=+?=-+?=-?。
(2)由题给反应式知,该反应为气体分子数减少的反应,其他条件一定时,增大压强,2SO 平衡转化率增大,故1 5.0MPa p =。结合题图(b )知5.0MPa 、550℃时对应的2SO 平衡转化率为0.975。影响平衡转化率的因素有:温度、压强、反应物的起始浓度等。 (3)设通入的22SO O 、和2N 共100mol ,利用三段式法进行计算:
2231SO (g)O (g)SO (g)2
+????→钒催化剂
起始量/mol 2m m 0 转化量/mol 2m α m α 2m α 平衡量/mol 22m m α-m m α- 2m α
平衡时气体的总物质的量为(3)mol m q m α+-,则()2SO (22)/(3)p p m m m q m αα=?-+-,
()2O ()/(3)p p m m m q m αα=?-+-,()3SO 2/(3)p p m m q m αα=?+-,因3 100m q +=,()()()
3p 12
22SO SO O p K p p =
?
,代入计算得p 0.5
1.5(1)100K m p m α
αα=
??
- ?
-??
。
(4)升高温度,反应速率常数k 增大,反应速率v 提高,但α降低使反应速率逐渐下降。m t t <时,k 增大对v 的提高大于α引起的降低;m t t >后,k 增大对v 的提高小于α引起
的降低。
11.Goodenough 等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态2+Fe 与3+Fe 离子中未成对的电子数之比为_________。
(2)Li 及其周期表中相邻元素的第一电离能()1I 如表所示。11(Li)(Na)I I >,原因是_________。111(Be)(B)(Li)I I I >>,原因是________。
(3)磷酸根离子的空间构型为_______,其中P 的价层电子对数为_______、杂化轨道类型为_______。
(4)4LiFePO 的晶胞结构示意图如(a)所示。其中O 围绕Fe 和P 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有4LiFePO 的单元数有____个。
电池充电时,4LiFePO 脱出部分Li +,形成14Li FePO x -,结构示意图如(b)所示,则x =_______,
()()23Fe Fe n n ++: =_______。
【答案】(1)4:5
(2)Na 与Li 同主族,Na 的电子层数更多,原子半径更大,故第一电离能更小;Li ,Be 和B 为同周期元素,同周期元素从左至右,第一电离能呈现增大的趋势;但由于基态Be 原子的s 能级轨道处于全充满状态,能量更低更稳定,故其第一电离能大于B 的 (3) 正四面体形;4;3sp (4)4;
3
16
或0.1875 ;13:3 【解析】 (1)根据构造原理可知基态2+Fe 和3+Fe 的价层电子排布式分别为63d 和53d ,其未成对电子数分别为4和5,即未成对电子数之比为
45
。 (2)Li 和Na 均为第ⅠA 族元素,由于Na 电子层数多,原子半径大,故Na 比Li 容易失去最外层电子,即11(Li)(Na)I I >。Li 、Be 、B 均为第二周期元素,随原子序数递增,第一电离能有增大的趋势,而Be 的2s 能级处于全充满状态,较难失去电子,故第一电离能Be 比B 大。
(3)34PO -的中心原子P 的价层电子对数为4,孤电子对数为0,中心原子P 为3sp 杂化,故34
PO -
的空间构型为正四面体。
(4)由题图可知,小白球表示锂原子,由图(a )知,每个晶胞中的锂原子数为
81/841/441/24?+?+?=,故一个晶胞中有4个4LiFePO 单元。由图(b )知,14Li FePO x -结构
中,一个晶胞含有13/4个锂原子,此时锂原子、铁原子的个数比为13:16,进而推出3/16x =。设()1316416Li Fe PO 中二价铁离子的个数为a ,三价铁离子的个数为b ,由231348a b ++=,
16a b +=,得到1:3: 3a b =,即()()
23Fe :Fe 13:3n n ++=。
12.有机碱,例如二甲基胺()、苯胺(),吡啶()等,在有机合成中应用很普遍,目前
“有机超强碱”的研究越来越受到关注,以下为有机超强碱F 的合成路线:
已知如下信息:
①22H C=CH 3
CCl COONa
乙二醇二甲醚/△
??????→
②
2
+RNH NaOH 2HCl
-???→
③苯胺与甲基吡啶互为芳香同分异构体 回答下列问题:
(1)A 的化学名称为________。
(2)由B 生成C 的化学方程式为________。 (3)C 中所含官能团的名称为________。 (4)由C 生成D 的反应类型为________。 (5)D 的结构简式为________。
(6)E 的六元环芳香同分异构体中,能与金属钠反应,且核磁共振氢谱有四组峰,峰面积之比为6∶2∶2∶1的有________种,其中,芳香环上为二取代的结构简式为________。 【答案】(1)三氯乙烯 (2)
+KOH Δ
→
醇+KCl+2H O
(3) 碳碳双键、氯原子 (4)取代反应
(5)
(6)6 ;
【解析】 (1)由A 的结构式可确定其化学名称为三氯乙烯。
(2)由B 、C 的结构简式可确定反应时1分子B 消去1分子HCl ,由此可写出反应的化学方程式。
(3)根据C 的结构简式可知C 中含有碳碳双键和氯原子两种官能团。
(4)C 与二环己基胺发生取代反应生成D 。
(6)E 分子中仅含1个0原子,根据题中限定条件,其同分异构体能与金属钠反应,可知其同分异构体中一定含有—OH ,再结合核磁共振氢谱有4组峰,且峰面积之比为6:2:2:1,可知其同分异
构体中一定含有2个3CH -,且两个3CH -处于对称的位置,符合条件的同分异构体有6种,分别是
。其中芳香环上为二取代的结构简式为。