
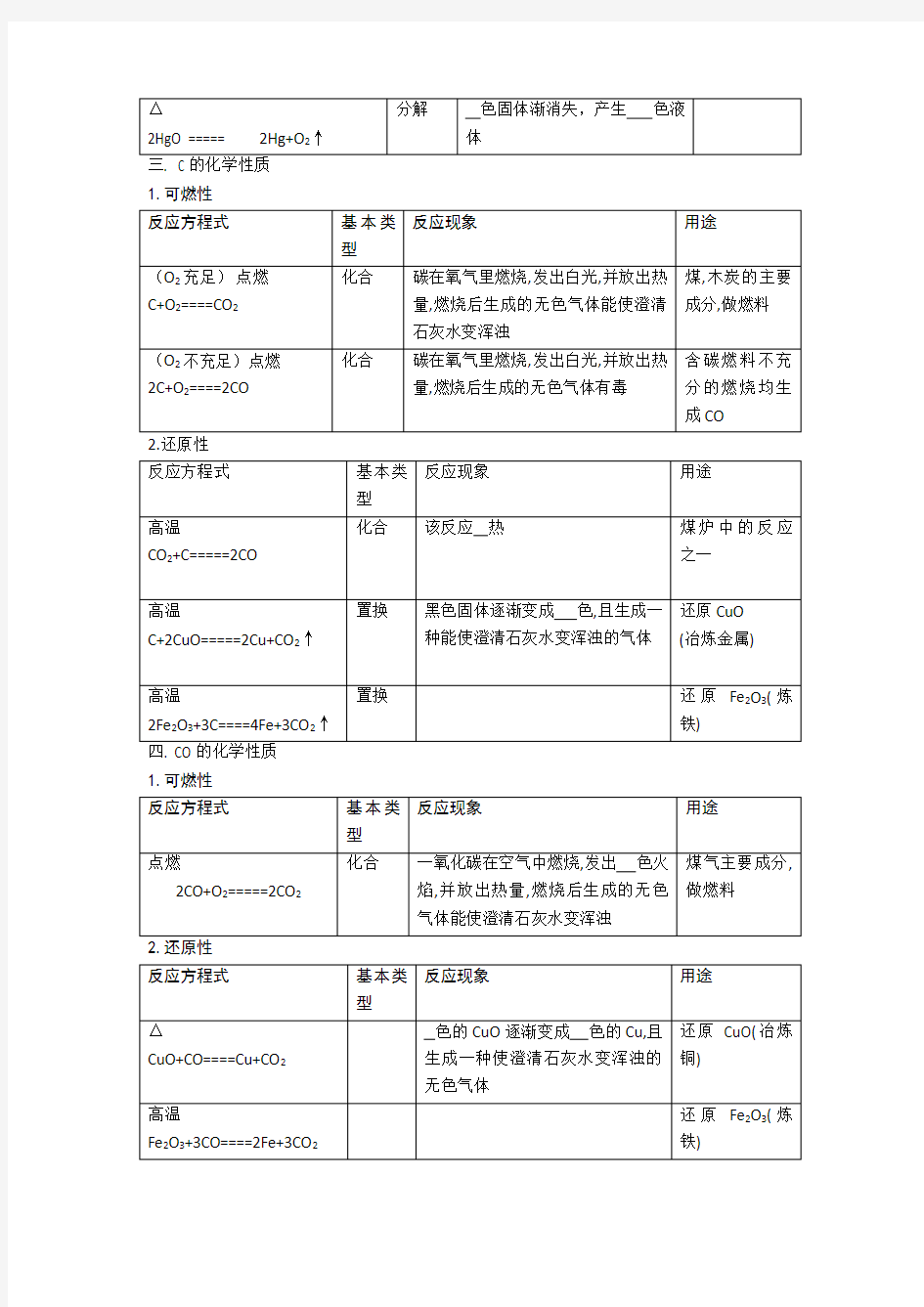
中考九年级上册化学方程式大全一、 O2的化学性质(比较活泼,具有氧化性、助燃性)
2
1.可燃性
1.可燃性
五.CO2的化学性质
1.与H2O反应
六、CO2的制取
初中化学全册方程式网络图一、氧系网络
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
⑾
⑿
⒀
⒂
二、碳系网络
⑴可燃
性
还原
性
⑵可燃
性
还原
性
⑶可燃
性
还原
性
⑷
⑹
⑺
⑻实验室制二氧化
碳
工业制二氧化
碳
⑼
⑽
⑾
⑿
写出以上反应的化学方程式
二、中考化学推断题
2.A~F是初中化学常见的物质,已知A、B、C、D、E是五种不同类别的物质,A是空气中含有的一种气体,E是地壳中含量最多的金属元素组成的单质,F中各元素质量比为2:1:2,六种物质之间的反应与转化关系均为初中化学常见的化学反应,图中“﹣”表示相连的物质能相互反应,“→”表示一种物质转化成另一种物质(部分反应物、生成物及反应条件已略去)请回答下列问题:
(1)E物质的化学式_____。
(2)A和C反应的化学方程式_____。
(3)E和F反应的化学方程式_____。
(4)如图所有的化学反应中涉及到的基本反应类型有_____种。
【答案】Al 。Ca(OH)2+CO2═CaCO3↓+H2O 。2Al+3CuSO4═Al2(SO4)3+3Cu 。
2 。
【解析】
【分析】
E是地壳中含量最多的金属元素组成的单质,故E是铝,F中各元素质量比为2:1:2,能与铝反应,故F能是硫酸铜,D能生成硫酸铜,能与铝反应,故D是硫酸,A是空气中含有的一种气体,能与B相互转化,能与C反应,故A可能是二氧化碳,B是碳酸钠,C可能是氢氧化钙,带入框图,推断合理;
【详解】
(1)E物质是铝,化学式为Al;
(2)A和C反应是氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,化学方程式为
Ca(OH)2+CO2═CaCO3↓+H2O;
(3)E和F反应是铝和硫酸铜反应生成硫酸铝和铜,化学方程式为
2Al+3CuSO4═Al2(SO4)3+3Cu;
(4)如图的化学反应中涉及到的基本反应类型有置换反应和复分解反应两种;
3.已知A、B、C、D、E是初中化学中常见的不同类别的物质。它们之间的关系如图所示(“→”表示物质间的转化关系,“-”表示两端的物质能发生化学反应)。A是使用最广泛的金属,C是常用的食品干燥剂,E是配制波尔多液的主要成份之一,其溶液为蓝色,F为三
种元素组成的化合物。请回答:
(1)写出下列物质的化学式:A______,C______。 (2)写出物质B 的一种用途:______。
(3)写出D 转化为F 的化学方程式______,图中所涉及的反应没有包含的基本反应类型是______。
【答案】Fe CaO 金属除锈 Ca (OH )2+Na 2CO 3=CaCO 3↓+2NaOH 分解反应 【解析】 【分析】
A 是使用最广泛的金属,因此A 是铁;C 是常用的食品干燥剂,因此C 是氧化钙;E 是配制波尔多液的主要成份之一,其溶液为蓝色,因此E 是硫酸铜;F 为三种元素组成的化合物;铁与硫酸反应生成硫酸亚铁和氢气,因此
B 是硫酸;硫酸和氢氧化钙反应生成硫酸钙和水,因此D 是氢氧化钙;碳酸钠和氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠,因此F 是氢氧化钠。 【详解】
(1)A 是使用最广泛的金属,因此A 是铁,化学式为Fe ;C 是常用的食品干燥剂,因此C 是氧化钙CaO 。
(2)B 是硫酸,硫酸可用于金属除锈等。
(3)碳酸钠和氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠,化学方程式为
2233Ca(OH)+Na CO =CaCO +2NaOH ;图中所涉及的反应没有包含的基本反应
类型是分解反应。 【点睛】
A 是使用最广泛的金属,因此A 是铁;C 是常用的食品干燥剂,因此C 是氧化钙;E 是配制波尔多液的主要成份之一,其溶液为蓝色,因此E 是硫酸铜。
4.A 、B 、C 、D 、E 、F 、G 分别是一氧化碳、二氧化碳、氧化铜、稀硫酸、氢氧化钡溶液、碳酸钠溶液、氯化钡溶液中的一种.B 的相对分子质量为44,它们之间有如图所示的关系,图中相连的两个方框表示相应物质间能发生反应.回答下列问题:
(1)B 、E 分别为_____、_____. (2)A 与D 反应的实验现象为_____.
(3)F与G反应的化学方程式为_____.
【答案】二氧化碳稀硫酸产生白色沉淀 CuO+COΔCu+CO2
【解析】
【分析】
A、B、C、D、E、F、G分别是一氧化碳、二氧化碳、氧化铜、稀硫酸、氢氧化钡溶液、碳酸钠溶液、氯化钡溶液中的一种,B的相对分子质量为44,所以B是二氧化碳,二氧化碳会与氢氧化钡反应,所以C是氢氧化钡,氢氧化钡会与稀硫酸、碳酸钠反应,D如果是碳酸钠,碳酸钠除了会与氢氧化钡、稀硫酸反应,不会与气体物质反应,所以A是氯化钡,E是稀硫酸,稀硫酸会与氧化铜反应,所以F是氧化铜,G是一氧化碳,经过验证,推导正确。
【详解】
(1)所以B是二氧化碳,E是稀硫酸;
(2)A与D的反应是稀硫酸和氢氧化钡反应生成硫酸钡沉淀和水,所以实验现象为:产生白色沉淀;
(3)F与G的反应是一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,化学方程式为:CuO+COΔCu+CO2.
故答案为:(1)二氧化碳,稀硫酸;(2)产生白色沉淀;(3)CuO+COΔCu+CO2.5.粗盐中含有MgCl2、CaCl2等杂质,工业提纯粗盐的工艺流程如图所示:
(1)Ca(OH) 2俗称_____,步骤①反应的化学方程式为_____。
(2)步骤③操作a的名称是_____。
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有_____。
【答案】熟石灰或消石灰 MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;过滤 CaCl2(或氯化钙)
【解析】
【分析】
粗盐水里面含有氯化镁和氯化钙,加入过量的氢氧化钙溶液,会生成氢氧化镁白色沉淀,加入过量的碳酸钠溶液,生成碳酸钙沉淀,滤液中含有氯化钙。
【详解】
(1)氢氧化钙的俗名为熟石灰或消石灰;步骤①加入过量的氢氧化钙溶液,氯化镁与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:
MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2。
(2)过滤是分离固体和液体的操作,步骤③操作a后得到沉淀和滤液,故为过滤。(3)根据Ca(OH)2可除去MgCl2,Na2CO3可除去CaCl2.如果步骤①和步骤②的顺序颠倒,步骤②先反应溶液中就有过量的碳酸钠,然后完成步骤①,这时过量的氢氧化钙把上步中多余的碳酸钠除去,同时生成氢氧化钠,另外氢氧化钙与氯化镁反应还生成氯化钙,最后步骤④中加入适量的盐酸,反应掉生成的氢氧化钠,但不与生成的氯化钙反应,所以最后所得的精盐水中还含有CaCl2,故答案为:CaCl2。
【点睛】
除杂的原则:除去杂质,不能引入新的杂质。
6.下图所示是有关物质之间的相互转化关系.已知常温下B、C为气体,D、F均为无色液体,E为黑色固体,与稀硫酸反应得到蓝色溶液(部分反应物和生成物及反应条件已略去).
根据关系图回答:
(1)F的化学式为,化学反应①的方程式为
(2)若A为一种盐,则A可能是,若A为一种氧化物,则反应②的方程式
是:。
【答案】(1)H2O22H2O2H2↑ +O2↑(2) Na2CO3或CaCO3 CO2+C2CO
【解析】
试题分析:根据题中的叙述可知,E为氧化铜,F为过氧化氢、D为水、C为氧气;故(1)F的化学式为H2O2,化学反应①的方程式为2H2O2H2↑ +O2↑;(2)若A为一种盐,则A可能是碳酸盐,故Na2CO3或CaCO3若A为一种氧化物,则反应②的方程式是:CO2+C2CO。
考点:物质的推断
7.A~E均为初中化学常见的物质,它们之间的关系如图所示。图中“-”表示相连的物质之可以在溶液中发生化学反应,?“→”表示由某种物质可通过一步反应直接转化为另一种物质(部分反应物、生成物及反应条件已略去),已知A是目前世界上年产量最高的金属;B 是胃酸的主要成分;C水溶液呈蓝色,常用来配制农药波尔多液;D属于碱:E属于盐。
(1)则C的化学式为______。
(2)A与B反应的化学方程式为______。
(3)E转化为D的化学方程式为______。
【答案】CuSO4 Fe+2HCl=FeCl2+H2↑ Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【解析】
【分析】
根据“A~E均为初中化学常见的物质“,”A是目前世界上年产量最高的金属“,则A是铁;根据“B是胃酸的主要成分”,则B为稀盐酸;根据“C水溶液呈蓝色,常用来配制农药波尔多液”,则C为硫酸铜溶液;根据“D属于碱:E属于盐”,结合图框,则推测D可能为氢氧化钠,E可能为碳酸钠溶液,代入检验,符合题意。
【详解】
(1)根据分析,则C的化学式为CuSO4。
(2)A与B反应,即铁与稀盐酸反应,故反应的化学方程式为Fe+2HCl═FeCl2+H2↑。(3)E转化为D,即碳酸钠与氢氧化钙反应生成白色的碳酸钙沉淀和氢氧化钠,故反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。
故答案为:
CuSO4;Fe+2HCl═FeCl2+H2↑;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。
【点睛】
本题为框图型物质推断题,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质的化学式,然后顺推或逆推或由两边向中间推得出其他物质的化学式。
8.已知A、B、C、D、E是初中化学中常见的不同类别的物质。它们之间的关系如图所示(“→”表示物质间的转化关系,“﹣”表示两端的物质能发生化学反应)。A是使用最广泛的金属,C是常用的食品干燥剂,E是配制波尔多液的主要成分之一,其溶液为蓝色,F是由三种元素组成的化合物,请回答下列问题:
(1)写出化学式:B_____,选择C作为食品干燥剂的原因有_____(答一条即可)。
(2)写出D 转化为F 的化学方程式_____。
(3)B 在生产上的用途有_____,上述反应没有包含的基本反应类型是_____。
【答案】H 2SO 4 价格低廉 Na 2CO 3+Ca (OH )2=2NaOH+CaCO 3↓ 金属除锈 分解反应 【解析】 【分析】
A 是使用最广泛的金属,A 是铁;C 是常用的食品干燥剂,C 是氧化钙;E 是配制波尔多液的主要成分之一,其溶液为蓝色,E 是硫酸铜;Fe 能和
B 反应,B 在一定的条件下能生成硫酸铜,则B 是硫酸;又已知A 、B 、
C 、
D 、
E 是初中化学中常见的不同类别的物质,氧化钙能和硫酸反应,在一定条件下生成D ,D 可能是氢氧化钙;氢氧化钙能在一定条件下生成
F ,F 能和硫酸铜反应,则F 可能是氢氧化钠。 【详解】
(1)Fe 能和B 反应,B 在一定的条件下能生成硫酸铜,则B 是硫酸,B 是硫酸,化学式为24H SO ,选择C 作为食品干燥剂的原因是价格低廉。
(2)碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,化学方程式为:
2323Na CO +Ca(OH)2NaOH+CaCO =。
(3)硫酸在生产上的用途有除锈;上述反应包括置换反应、化合反应、复分解反应,没有分解反应。 【点睛】
A 是使用最广泛的金属,A 是铁;C 是常用的食品干燥剂,C 是氧化钙;E 是配制波尔多液的主要成分之一,其溶液为蓝色,E 是硫酸铜;Fe 能和
B 反应,B 在一定的条件下能生成硫酸铜,则B 是硫酸。
【参考答案】***试卷处理标记,请不要删除
一、选择题
二、中考化学推断题
九年级下册化学方程式总结 (一)酸的化学性质 1.跟指示剂的反应(pH紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色。 2.氢前的金属+酸→盐+H2↑ 3H22AlCl36HCl(现象:反应剧烈,产生大量气泡)⑧铝和稀盐酸反应:2AlH2MgCl22HCl(现象:反应缓慢,产生较少气泡,溶液由无色变浅绿色)⑦镁和稀盐酸反应:MgH2FeCl22HCl(现象:反应较剧烈,产生较多气泡)⑥铁和稀盐酸反应:FeH2ZnCl22HCl ⑤锌和稀盐酸反应:Zn3H2Al2(SO4)33H2SO4(现象:反应剧烈,产生大量气泡)④铝和稀硫酸反应:2AlH2MgSO4H2SO4(现象:反应缓慢,产生较少气泡,溶液由无色变浅绿色)③镁和稀硫酸反应:MgH2FeSO4H2SO4(现象:反应较剧烈,产生较多气泡)(实验室制H2反应原理)②铁和稀硫酸反应:FeH2ZnSO4H2SO4①锌和
稀硫酸反应:Zn 3.酸+金属氧化物→盐+水 3H2O(现象:红色粉未(或铁锈)逐渐溶解,溶液由无色变黄色)2FeCl36HCl①氧化铁和盐酸反应:Fe2O3 3H2O(现象:红色粉未(或铁锈)逐渐溶解,溶液由无色变黄色)Fe2(SO4)33H2SO4②氧化铁和硫酸反应:Fe2O3 3H2O2AlCl36HClH2O(现象:黑色粉未逐渐溶解,溶液由无色变蓝色)⑤氧化铝和盐酸反应:Al2O3CuSO4H2SO4H2O(现象:黑色粉未逐渐溶解,溶液由无色变蓝色)④氧化铜和硫酸反应:CuOCuCl22HCl③氧化铜和盐酸反应:CuO 4.酸+碱→盐+水(中和反应) 2H2O(要借助酸碱指示剂来判断反应的进行)CaCl22HCl2H2O(要借助酸碱指示剂来判断反应的进行)③氢氧化钙和盐酸反应:Ca(OH)2Na2SO4H2SO4H2O(要借助酸碱指示剂来判断反应的进行)②氢氧化钠和硫酸反应:2NaOHNaClHCl①氢氧化钠和盐酸反应:NaOH
初中化学方程式总汇 一、氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧:2Mg + O2 =点燃= 2MgO 2. 铁在氧气中燃烧:3Fe + 2O2=点燃= Fe3O 4 3. 铜在空气中受热:2Cu + O2=加热= 2CuO 4. 铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O3 5. 氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O 6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 =点燃= 2P2O5 7. 硫粉在空气中燃烧: S + O2 =点燃= SO2 8. 碳在氧气中充分燃烧:C + O2=点燃= CO2 9. 碳在氧气中不充分燃烧:2C + O2 =点燃= 2CO (2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO2 11. 甲烷在空气中燃烧:CH4 + 2O2=点燃=CO2 + 2H2O 12. 酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O (3)氧气的来源: 13.玻义耳研究空气的成分实验 2HgO =加热= Hg+ O2↑ 14.加热高锰酸钾:2KMnO4 =加热= K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2 (MnO2催化剂)=2H2O+ O2↑(实验室制氧气原理2) 二、自然界中的水: 16.水在直流电的作用下分解(研究水的组成实验): 2H2O =通电= 2H2↑+ O2 ↑ 17.生石灰溶于水:CaO + H2O == Ca(OH)2
初中化学方程式 一、氧气的性质: (1)单质与氧气的反应:(化合反应) 1.镁在空气中燃烧:2Mg + O 2点燃 2MgO 2.铁在氧气中燃烧:3Fe + 2O2点燃 Fe 3O4 3.铜在空气中受热:2Cu + O2 2CuO 4.铝在空气中燃烧:4Al + 3O2点燃 2Al2O3 5.氢气中空气中燃烧:2H2 + O2点燃 2H2O 6.红磷在空气中燃烧(研究空气组成的实 验):4P + 5O2点燃 2P2O5 7.硫粉在空气中燃烧: S + O2点燃 SO2 8.碳在氧气中充分燃烧:C + O2点燃 CO2 (2)化合物与氧气的反应: 10.一氧化碳在氧气中燃烧: 2CO + O2点燃 2CO2 11.甲烷在空气中燃烧: CH4 + 2O2点燃 CO2 + 2H2O 12.酒精在空气中燃烧: C2H5OH + 3O2点燃 2CO2 + 3H2O (3)氧气的来源: 13. 拉瓦锡研究空气的成分实验 2HgO Hg+ O2 ↑ 14. 加热高锰酸钾(实验室制氧气原理1) 2KMnO4K2MnO4 + MnO2 + O2↑ 15. 过氧化氢在二氧化锰作催化剂条件下 分解反应: 2H2O2MnO22H2O+ O2 ↑(实验 室制氧气原理2) 16加热氯酸钾(二氧化锰):(实验室制氧气原理3) 2KClO3 MnO22KCl+3O2↑ 二、自然界中的水: 17. 水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑ 18. 生石灰溶于水:CaO + H2O === Ca(OH)2 19. 二氧化碳可溶于水: H2O + CO2=== H2CO3 三、质量守恒定律: 20. 镁在空气中燃烧:2Mg + O2点燃 2MgO 21. 铁和硫酸铜溶液反应: Fe + CuSO4 === FeSO4 + Cu 22. 氢气还原氧化铜: H2 + CuO Cu + H2O 四、碳和碳的氧化物: (1)碳的化学性质 23. 碳在氧气中充分燃烧:C + O2点燃 CO2 24.碳在氧气中不充分燃烧: 2C + O2点燃 2CO 25. 木炭还原氧化铜: C+ 2CuO 高温2Cu + CO2↑ 26. 焦炭还原氧化铁: 3C+ 2Fe2O3高温4Fe + 3CO2↑ (2)煤炉中发生的三个反应:(几个化合反应) 27.煤炉的底层:C + O2点燃 CO2 28.煤炉的中层:CO2 + C高温2CO 29.煤炉的上部蓝色火焰的产生: 2CO + O2点燃 2CO2 (3)二氧化碳的制法与性质: 30.大理石与稀盐酸反应(实验室制二氧化碳): CaCO3 + 2HCl === CaCl2 + H2O + CO2↑31.碳酸不稳定而分解: H2CO3 === H2O + CO2↑ 32.二氧化碳可溶于水: H2O + CO2=== H2CO3 33.高温煅烧石灰石(工业制二氧化碳):CaCO3高温CaO + CO2↑
九年级化学方程式总汇 第一单元 走进化学世界 (1) 2 NaOH + CuSO 4 ==== Na 2SO 4 + Cu(OH)2↓ (2) CaCO 3 + 2HCl ===CaCl 2 + CO 2↑ + H 2O (3) CO 2 + Ca(OH)2 ===CaCO 3↓+ H 2 (4) Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2 ↑ 第二单元 我们周围的空气 ⑴ S + O 2 SO 2 ⑵ 4 P + 5 O 2 2 P 2O 5 ⑶ C + O 2 CO 2 ⑷ 3 Fe + 2 O 2 Fe 3O 4 ⑸ 2 H 2O 2 O 2↑ + 2 H 2O ⑹ 2 KClO 3 2KCl + 3O 2↑ ⑺ 2 KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ ⑻ 2 H 2O 2 H 2 ↑+ O 2 ↑ ⑼ 2 H 2 + O 2 2H 2O ⑽ C 2H 5OH + 3 O 2 2 CO 2 + 3 H 2O ⑾ 2 HgO 2 Hg + O 2↑ ⑿ CO 2 + Ca(OH)2 CaCO 3↓+ H 2O MnO 2 △ MnO 2 △ △
第三单元 自然界的水 ⑴ 2 H 2O 2 H 2 ↑+ O 2 ↑ ⑵ 2 HgO 2 Hg + O 2↑ ⑶ 2 H 2 + O 2 2 H 2O ⑷ H 2 + Cl 2 2 HCl ⑸2 KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ 第四单元 物质构成的奥秘 ⑴2 H 2O 2 H 2 ↑+ O 2 ↑ ⑵S + O 2 SO 2 第五单元 化学方程式 ⑴ 2 Mg + O 2 2 MgO ⑵ Fe + CuSO 4 FeSO 4 + Cu ⑶ Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2 ↑ ⑷ 2 NaOH + CuSO 4 Na 2SO 4 + Cu(OH)2↓ ⑸ CaCO 3 CaO + CO 2↑ ⑹ H 2 + CuO Cu + H 2O ⑺ Fe 2O 3 + 3 H 2 2 Fe + 3 H 2 O ⑻ Fe 2O 3 + 3CO 2Fe + 3CO 2 ⑼C 2H 4 + 3 O 2 2 H 2O + 2 CO 2 △ △ 高温 高温 高温 △
初三化学方程式按元素归类总结 与氧有关的化学方程式: 单质与氧气的反应: 点燃 1.镁在氧气中燃烧:2Mg+O2====2MgO现象:燃烧、放出大量的热、同时放出耀眼的白光 点燃 2.铁在氧气中燃烧:3Fe+2O2====Fe3O4现象:剧烈燃烧、火星四射、生成黑色的固体 △ 3.铜在氧气中受热:2Cu+O2====2CuO 4.铝在空气中燃烧:4Al+3O2点燃 ====2Al2O3点燃 5.氢气中氧气中燃烧:2H2+O2====2H2O现象:淡蓝色的火焰 点燃 6.红磷在空气中燃烧:4P+5O2====2P2O5现象::生成白烟 7.硫粉在氧气中燃烧:S+O2点燃 ====SO2现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生 成有刺激性气味的气体。 点燃 8.碳在氧气中充分燃烧:C+O2====CO2现象:生成能够让澄清石灰水浑浊的气体 点燃 9.碳在氧气中不充分燃烧:2C+O2====2CO现象:燃烧 点燃 10.汞(水银)在氧气中燃烧:2Hg+O2====2HgO 化合物与氧气的反应: 点燃 11.一氧化碳在氧气中燃烧:2CO+O2====2CO2 点燃 12.甲烷在空气中燃烧:CH4+2O2====CO2+2H2O 13.酒精在空气中燃烧:C2H5OH+3O2点燃 ====2CO2+3H2O 几个分解反应: MnO2 14.双氧水催化制氧气:2H2O2====2H2O+O2↑现象:溶液里冒出大量的气泡
通电 15.水在直流电的作用下分解:2H2O====2H2↑+O2↑ △ 16.加热碱式碳酸铜:Cu2(OH)2CO3====2CuO+H2O+CO2↑
九年级化学常见化学方程式 一、化合反应(多变一 ) (1) 木炭燃烧:① C +O CO 2(充分)② 2C + O 2 2CO (不充分) (2) CO 燃烧: 2 (煤气燃烧) (3) 硫燃烧: S +O (4) 磷燃烧:4P + 2O 5(大量白烟) (5) 白磷自燃:4P + 5O 2=2P 2O 5(大量白烟) (6) 铁燃烧:3Fe +2O Fe 3O 4(剧烈燃烧,火星四射,生成黑色固体) (7) 镁条燃烧:2Mg +O 2MgO (发出耀眼的白光) (8) 铝缓慢氧化:4Al +3O 2O 3 (铝具有抗腐蚀性) (9) 氢气燃烧:2H 2+O 2H 2O (最清洁的高能燃料) (10) 2Cu +O 22CuO (生成黑色固体) (11) 2Hg +O 〔2Hg +O 2↑〕 (12) C +CO 22CO (CO 2作氧化剂的反应) (13)非金属氧化物和水反应生成相应的酸: CO 2+H 2O =H 2CO 3 (雨水呈酸性) 〔H 2CO 3=H 2O +CO 2↑〕 SO 2+H 2O =H 2SO 3(亚硫酸) SO 3+H 2O =H 2SO 4 (14) 可溶性金属氧化物和水反应,生成相应的可溶性碱: CaO +H 2O =Ca (OH )2 (生石灰作为干燥剂) 二、分解反应(一变多) (1) 实验室用纯净物制氧气(有三种不同类别物质生成的分解反应): 2KMnO K 2MnO 4+(2) +3O 2↑ (3) 过氧化氢分解制氧气:2H 2O 2 2↑ (4) 通电分解水:2H 2O 2↑ (5) 工业上制CO 2:CaO +CO 2↑ (6) 碳酸氢盐受热易分解:
九年级化学10~11单元化学方程式汇总 一、第十单元化学方程式 (一)酸的化学性质 1.跟指示剂的反应(pH<7) 紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色。 2.氢前的金属+酸→盐+H 2↑ ①锌和稀硫酸反应:2442Zn H SO ZnSO H +=+↑(现象:反应较剧烈,产生较多气泡)(实验室制H 2反应原理) ②铁和稀硫酸反应:2442Fe H SO FeSO H +=+↑(现象:反应缓慢,产生较少气泡,溶液由无色变浅绿色) ③镁和稀硫酸反应:2442Mg H SO MgSO H +=+↑(现象:反应剧烈,产生大量气泡) ④铝和稀硫酸反应:24243223()3Al H SO Al SO H +=+↑ ⑤锌和稀盐酸反应:222Zn HCl ZnCl H +=+↑(现象:反应较剧烈,产生较多气泡) ⑥铁和稀盐酸反应:222Fe HCl FeCl H +=+↑(现象:反应缓慢,产生较少气泡,溶液由无色变浅绿色) ⑦镁和稀盐酸反应:222Mg HCl MgCl H +=+↑(现象:反应剧烈,产生大量气泡) ⑧铝和稀盐酸反应:322623Al HCl AlCl H +=+↑ 3.酸+金属氧化物→盐+水 ①氧化铁和盐酸反应:O H FeCl HCl O Fe 2332326+=+(现象:红色粉未(或铁锈)逐渐溶解,溶液由无色变黄色) ②氧化铁和硫酸反应:O H SO Fe SO H O Fe 234242323)(3+=+(现象:红色粉未(或铁锈)逐渐溶解,溶液由无色变黄色) ③氧化铜和盐酸反应:O H CuCl HCl CuO 222+=+(现象:黑色粉未逐渐溶解,溶液由无色变蓝色) ④氧化铜和硫酸反应:O H CuSO SO H CuO 2442+=+(现象:黑色粉未逐渐溶解,溶液由无色变蓝色) ⑤氧化铝和盐酸反应:O H AlCl HCl O Al 2332326+=+ 4.酸+碱→盐+水(中和反应) ①氢氧化钠和盐酸反应:O H NaCl HCl NaOH 2+=+(要借助酸碱指示剂来判断反应的进行)
九年级下册化学方程式归纳总结 (一)金属的化学性质1、金属与酸的反应 (1)镁和稀硫酸或盐酸的反应Mg+H2SO4=MgSO4+H2↑ Mg+2HCl=MgCl2+H2↑ 【实验现象:迅速产生大量气泡,放出大量的热】 (2)铝和稀硫酸或盐酸的反应2Al+3H2SO4=Al2(SO4)3+3H2↑ 2Al+6HCl=2AlCl3+3H2↑(3)锌和稀硫酸或盐酸的反应Zn+H2SO4=ZnSO4+H2↑ Zn+2HCl =ZnCl2+H2↑ 【实验现象:产生大量气泡,放出热量】 (4)铁和稀硫酸或盐酸的反应Fe+H2SO4=FeSO4+H2↑ Fe+2HCl=FeCl2+H2↑ 【实验现象:有气泡产生,溶液由无色变为浅绿色】2、金属和盐溶液的反应 (1)铁和硫酸铜溶液反应Fe+CuSO4=FeSO4+Cu 【实验现象:铁丝表面有红色物质析出,溶液由蓝色变成浅绿色】(2)铜和硝酸银溶液反应Cu+2AgNO3=Cu(NO3)2+2Ag 【实验现象:铜片表面有银白色物质析出,溶液由无色变为蓝色】(3)铜和硝酸汞溶液反应Cu+Hg(NO3)2=Cu(NO3)2+Hg 【实验现象:铜片表面有白色物质析出,溶液由无色变为蓝色】 (4)铝和硫酸铜溶液的反应2Al+3CuSO4=Al2(SO4)3+3Cu 【实验现象:铝片表面有红色物质析出,溶液由蓝色变为无色】(二)酸的化学性质1、酸和金属氧化物的反应 (1)铁锈(主要成分氧化铁)和盐酸或稀硫酸的反应 Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 【实验现象:铁锈溶解,溶液由无色变为黄色】(2)氧化铜和稀硫酸的反应CuO+H2SO4= CuSO4+H2O 【实验现象:黑色固体溶解,溶液由无色变为蓝色】2、酸和盐的反应
初三中考化学方程式汇总 <重要化学方程式汇总> 石灰石(或大理石)与稀盐酸反应(实验室制CO2):CaCO3 + 2HCl === CaCl2 + H2O+ CO2↑ 二氧化碳通过澄清石灰水(检验CO2):Ca(OH)2 + CO2 =CaCO3↓+ H2O 氯酸钾与二氧化锰的混合物共热:2KClO3 MnO2 2KCl + 3O2↑ 加热高锰酸钾:2KMnO4 K2MnO4 + MnO2 + O2↑ MnO2 MnO2 过氧化氢:H2O2 ========= H2O + O2↑ 一、与氧气的反应 (1)化合反应 1、木炭在氧气中燃烧:C + O2 CO2 (在氧气中:产生使石灰水变浑浊的无色气体) 2、木炭在空气中不充分燃烧:2C + O2 2CO 3、一氧化碳在氧气中燃烧:2CO + O2 2CO2 (产生蓝色火焰) 4、硫粉在氧气中燃烧:S + O2 SO2 (在空气中:呈淡蓝色火焰;在氧气中:呈明亮的蓝紫色火焰,产生有刺激性气味的气体) 5、磷在氧气中燃烧:4P + 5O2 2P2O5 (产生浓厚的白烟) 瓶底留少量水或细沙
6、铁在氧气中燃烧:3Fe + 2O2 Fe3O4 (剧烈燃烧,火星四射,生成黑色固体) 7、镁在空气中燃烧:2Mg + O2 2MgO (发出耀眼的白光,生成白色固体) 8、铜在空气中加热;2Cu + O2 2CuO (红色固体变为黑色固体) 9、氢气在空气中燃烧:2H2 + O2 2H2O (产生淡蓝色火焰,干冷烧杯壁有小水珠。或产生爆鸣声) (2)有机物质与氧气的反应[不属于四大反应类型中的任何一种] 10、甲烷在空气中燃烧:CH4 + 2O2 CO2 + 2H2O 11、酒精在空气中燃烧:C2H5OH + 3O2 2CO2 + 3H2O 二、制取气体 1、实验室过氧化氢与二氧化锰的混合物制氧气:2H2O2 MnO2 2H2O+ O2↑ 加热高锰酸钾制氧气:2KMmO4 K2MnO4 + MnO2 + O2↑ 加热氯酸钾(白色)和二氧化锰混合制氧气:2KClO3 MnO2 2KCl + 3O2↑(黑色固体与白固体末混合) 2、石灰石(或大理石)与稀盐酸反应(实验室制CO2):CaCO3 + 2HCl === CaCl2 + H2O+ CO2↑ 3、高温煅烧石灰石(工业上制二氧化碳的方法):CaCO3 CaO + CO2↑
★九年级下册化学方程式总结(全) 第八单元金属和金属材料 1.铝在空气中缓慢氧化,生成致密氧化膜 4Al+3O2=2Al2O3 2.金属与稀盐酸、稀硫酸反应 Mg+2HCl=MgCl2+H2↑Mg+H2SO4=MgSO4+H2↑ 2Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑ Zn+2HCl=ZnCl2+H2↑Zn+H2SO4=ZnSO4+H2↑ 固体溶解,产生无色气泡(Mg,Al,Zn反应的剧烈程度依次减弱) 3.金属间的置换反应(几个典型例子) (金属性强的金属能够置换出金属性弱的金属,K,Ca,Na除外) Fe+CuSO4=Cu+FeSO4 银白色金属(铁丝)表面覆盖一层红色物质(湿法炼铜、镀铜) 2Al+3CuSO4=Al2(SO4)3+3Cu 银白色金属表面覆盖一层红色物质 Cu+2AgNO3=Cu(NO3)2+2Ag 紫红色金属表面覆盖一层银白色物质 4. 一氧化碳与赤铁矿(氧化铁)反应(工业炼铁的原理) Fe2O3+3CO高温2Fe+3CO2 高炉中的其他反应: C+CO2高温2CO C+O2高温CO2 5. 铁生锈:4Fe+3O2=2Fe2O3(红褐色固体,疏松多孔)或4Fe+3O2+xH2O=2Fe2O3·xH2O 铜生锈:2Cu+O2+CO2+H2O=Cu2(OH)2CO3(碱式碳酸铜)(铜锈,铜绿,孔雀绿) (铜锈分解:Cu2(OH)2CO3△2CuO+CO2↑+H2O)
第九单元溶液 6.生石灰溶于水 CaO+H2O=Ca(OH)2放出大量热量 第十单元酸和碱 7.把CO2通入紫色石蕊试液中 CO2+H2O=H2CO3 8.金属与稀盐酸、稀硫酸反应 Mg+2HCl=MgCl2+H2↑Mg+H2SO4=MgSO4+H2↑ 2Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑Zn+2HCl=ZnCl2+H2↑Zn+H2SO4=ZnSO4+H2↑ 9.铁锈与稀盐酸/稀硫酸反应 Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 10.生石灰溶于水 CaO+H2O=Ca(OH)2放出大量热量 11.碱与酸性氧化物(酸性气体)反应 Ca(OH)2+CO2=CaCO3↓+H2O (澄清石灰水变浑浊用途:检验CO2)2NaOH+CO2=Na2CO3+H2O (NaOH在空气中易潮解) 2NaOH+SO2=NaSO3+H2O 2NaOH+SO3=NaSO4+H2O 12.碱+某些盐→盐+另一种碱 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 13.酸与碱发生综合反应 NaOH+HCl=NaCl+H2O Ca(OH)2+2HCl=CaCl2+2H2O 2NaOH+H2SO4=Na2SO4+2H2O Ca(OH)2+H2SO4=CaSO4+2H2O (用熟石灰处理硫酸厂污水) Al(OH)3+3HCl=AlCl3+3H2O (治疗胃酸过多)
九年级所有化学方程式总汇——全
初中化学方程式总汇 一、氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧:2Mg + O2 =点燃= 2MgO 2. 铁在氧气中燃烧:3Fe + 2O2=点燃= Fe3O 4 3. 铜在空气中受热:2Cu + O2=加热= 2CuO 4. 铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O3 5. 氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O 6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 =点燃= 2P2O5 7. 硫粉在空气中燃烧: S + O2 =点燃= SO2 8. 碳在氧气中充分燃烧:C + O2=点燃= CO2 9. 碳在氧气中不充分燃烧:2C + O2 =点燃= 2CO (2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO2 11. 甲烷在空气中燃烧:CH4 + 2O2=点燃=CO2 + 2H2O 12. 酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O (3)氧气的来源: 13.玻义耳研究空气的成分实验 2HgO =加热= Hg+ O2↑ 14.加热高锰酸钾:2KMnO4 =加热= K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2 (MnO2催化剂)=2H2O+ O2↑(实验室制氧气原理2) 二、自然界中的水: 16.水在直流电的作用下分解(研究水的组成实验):
2H2O =通电= 2H2↑+ O2 ↑ 17.生石灰溶于水:CaO + H2O == Ca(OH)2 18.二氧化碳可溶于水: H2O + CO2==H2CO3 三、质量守恒定律: 19.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO 20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu 21.氢气还原氧化铜:H2 + CuO =加热= Cu + H2O 22. 镁还原氧化铜:Mg + CuO =加热= Cu + MgO 四、碳和碳的氧化物: (1)碳的化学性质 23. 碳在氧气中充分燃烧:C + O2 =点燃= CO2 24.木炭还原氧化铜:C+ 2CuO =高温=2Cu + CO2↑ 25.焦炭还原氧化铁:3C+ 2Fe2O3=高温= 4Fe + 3CO2↑ (2)煤炉中发生的三个反应:(几个化合反应) 26.煤炉的底层:C + O2 =点燃= CO2 27.煤炉的中层:CO2 + C =高温= 2CO 28.煤炉的上部蓝色火焰的产生:2CO + O2 =点燃= 2CO2 (3)二氧化碳的制法与性质: 29.大理石与稀盐酸反应(实验室制二氧化碳): CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑ 31.二氧化碳可溶于水: H2O + CO2== H2CO3 32.高温煅烧石灰石(工业制二氧化碳):CaCO3=高温= CaO + CO2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳): Ca(OH)2 + CO2 === CaCO3↓+ H2O
九年级——化学方程式及现象汇总(上册课本)一、化合反应: 1、镁在空气中燃烧:2Mg + O 2 点燃 2MgO 现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末 2、铁在氧气中燃烧:3Fe + 2O 2点燃 Fe 3 O 4 现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体 注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。 3、铜在空气中受热:2Cu + O 2 △2CuO 现象:铜丝变黑。 4、铝在氧气中燃烧:4Al + 3O 2点燃 2Al 2 O 3 现象:发出耀眼的白光,放热,有白色固体生成。 5、氢气中空气中燃烧或爆炸:2H 2 + O 2 点燃 2H 2 O
现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。 6、红(白)磷在空气中燃烧:4P + 5O 2点燃 2P 2 O 5 现象:(1)发出白光(2)放出热量(3)生成大量白烟。 7、硫粉在空气中燃烧:S + O 2点燃 SO 2 现象:(注意两种现 象有差异) A、在纯的氧气中 发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。 B、在空气中燃烧 (1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。 8、碳在氧气中充分燃烧:C + O 2点燃 CO 2 现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊
9、碳在氧气中不充分燃烧:2C + O 2 点燃 2CO 10、二氧化碳通过灼热碳层: C + CO 2 高温 2CO(吸热反应)上册111页 11、一氧化碳在氧气中燃烧:2CO + O 2点燃 2CO 2 现象:发出蓝色的火焰,放热,澄清石灰水变浑浊。 12、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO 2 + H 2O == H 2 CO 3 现象:石蕊试液由紫色变成红色。 注意:某些非金属氧化物+水→酸如: SO 2 + H 2 O == H 2 SO 3 (亚硫酸) SO 3 + H 2 O == H 2 SO 4 (硫 酸) 13、生石灰溶于水:CaO + H 2O == Ca(OH) 2 (此反应放出热量) 14、用无水硫酸铜鉴定水的存在:(化学方程式不用特别记忆, 但要记得这种方法及现象CuSO 4 + 5H 2 O = CuSO 4 ·5H 2 O(五水硫酸铜, 胆矾)
九年级化学10~11单元化学方程式汇总 一、第十单元化学方程式 (一)酸的化学性质 1.跟指示剂的反应(pH<7) 紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色。 2.氢前的金属+酸→盐+H 2↑ ①锌和稀硫酸反应:2442Zn H SO ZnSO H +=+↑(现象:反应较剧烈,产生较多气泡)(实验室制H 2反应原理) ②铁和稀硫酸反应:2442Fe H SO FeSO H +=+↑(现象:反应缓慢,产生较少气泡,溶液由无色变浅绿色) ③镁和稀硫酸反应:2442Mg H SO MgSO H +=+↑(现象:反应剧烈,产生大量气泡) ④铝和稀硫酸反应:24243223()3Al H SO Al SO H +=+↑ ⑤锌和稀盐酸反应:222Zn HCl ZnCl H +=+↑(现象:反应较剧烈,产生较多气泡) ⑥铁和稀盐酸反应:222Fe HCl FeCl H +=+↑(现象:反应缓慢,产生较少气泡,溶液由无色变浅绿色) ⑦镁和稀盐酸反应:222Mg HCl MgCl H +=+↑(现象:反应剧烈,产生大量气泡) ⑧铝和稀盐酸反应:322623Al HCl AlCl H +=+↑ 3.酸+金属氧化物→盐+水 ①氧化铁和盐酸反应:O H FeCl HCl O Fe 2332326+=+(现象:红色粉未(或铁锈)逐渐溶解,溶液由无色变黄色) ②氧化铁和硫酸反应:O H SO Fe SO H O Fe 234242323)(3+=+(现象:红色粉未(或铁锈)逐渐溶解,溶液由无色变黄色) ③氧化铜和盐酸反应:O H CuCl HCl CuO 222+=+(现象:黑色粉未逐渐溶解,溶液由无色变蓝色) ④氧化铜和硫酸反应:O H CuSO SO H CuO 2442+=+(现象:黑色粉未逐渐溶解,溶液由无色变蓝色) ⑤氧化铝和盐酸反应:O H AlCl HCl O Al 2332326+=+ 4.酸+碱→盐+水(中和反应) ①氢氧化钠和盐酸反应:O H NaCl HCl NaOH 2+=+(要借助酸碱指示剂来判断反应的进行) ②氢氧化钠和硫酸反应:O H SO Na SO H NaOH 2424222+=+(要借助酸碱指示剂来判断反应的进行) ③氢氧化钙和盐酸反应:O H CaCl HCl OH Ca 22222)(+=+(要借助酸碱指示剂来判断反应的进行)
与氧有关的化学方程式: 2Mg+O2点燃 ====2MgO 现象:燃烧、放出大量的热、同时放出耀眼的白光 S+O2点燃 ====SO2 现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。 C+O2点燃 ====CO2 现象:生成能够让澄清石灰水浑浊的气体 2C+O2点燃 ====2CO 现象:燃烧 4P+5O2点燃 ====2P2O5 现象::生成白烟 3Fe+2O2点燃 ====Fe3O4 现象:剧烈燃烧、火星四射、生成黑色的固体 2H2+O2点燃 ====2H2O 现象:淡蓝色的火焰 2H2O2MnO2 ====2H2O+O2↑现象:溶液里冒出大量的气泡 2HgO △ ====2Hg+O2↑现象:生成银白色的液体金属 2KClO3MnO2 ====2KCl+3O2↑现象:生成能让带火星的木条复燃的气体 2KMnO4 △ ====K2MnO4+MnO2+O2↑现象:同上, 跟氢有关的化学方程式: 2H2+O2点燃 ====2H2O 现象:淡蓝色的火焰 Zn+H2SO4==ZnSO4+H2↑现象:有可燃烧的气体生成 Mg+H2SO4==MgSO4+H2↑现象:同上 Fe+H2SO4 ==FeSO4+H2↑现象:变成浅绿色的溶液,同时放出气体2Al+3H2SO4 ==Al2(SO4)3+3H2↑现象:有气体生成 Zn+2HCl==ZnCl2+H2↑现象:同上
Mg+2HCl==MgCl2+H2↑现象:同上 Fe+2HCl==FeCl2+H2↑现象:溶液变成浅绿色,同时放出气体 2Al+6HCl==2AlCl3+3H2↑现象:有气体生成 △ H2+CuO====Cu+H2O 现象:由黑色的固体变成红色的,同时有水珠生成 高温 2Fe2O3+3H2 =====2Fe+3H2O 现象:有水珠生成,固体颜色由红色变成银白色————————————————又是分割线——————————————————跟碳有关的化学方程式: C+O2点燃 ====CO2(氧气充足的情况下) 现象:生成能让纯净的石灰水变浑浊的气体 2C+O2点燃 ====2CO(氧气不充足的情况下) 现象:不明显高温 C+2CuO=====2Cu+CO2↑现象:固体由黑色变成红色并减少,同时有能使纯净石灰水变浑浊的 气体生成 高温 3C+2Fe2O3=====4Fe+3CO2↑现象:固体由红色逐渐变成银白色,同时黑色的固体减少,有能使 纯净的石灰水变浑浊的气体生成 CO2+C 高温 ====2CO 现象:黑色固体逐渐减少 3C+2H2O=CH4+2CO 现象:生成的混和气体叫水煤气,都是可以燃烧的气体跟二氧化碳有关的化学方程式: C+O2点燃 ====CO2 现象:生成能使纯净的石灰水变浑浊的气体 Ca(OH)2+CO2===CaCO3↓+H2O 现象:生成白色的沉淀,用于检验二氧化碳CaCO3+CO2+H2O===Ca(HCO3)2 现象:白色固体逐渐溶解 Ca(HCO3) △ ====CaCO3↓+CO2↑+H2O 现象:生成白色的沉淀,同时有能使纯净的石灰水变浑浊
九年级化学方程式大全 一、化合反应:由二种或二种以上的物质生成一种物质的反应(多变一) 1、二氧化碳和水反应: 2 、二氧化硫和水反应 3、三氧化硫和水反应 4、氧化钙和水反应 5、氧化钠和水反应 6、碳在高温下和二氧化碳反应 6、碳在空气中燃烧 7、一氧化碳燃烧 8、硫燃烧 9、磷燃烧 10、铁在氧气中燃烧 11、铝在氧气中燃烧 12、镁在空气中燃烧 13、铜在空气中加热 二、分解反应:由一种物质生成二种或二种以上的物质的反应。(一变多)(一)实验室制氧气 1、高锰酸钾加热分解 2、双氧水和二氧化锰混合 3、氯酸钾和二氧化锰加热分解 4、碳酸分解 5、氢氧化铜受热分解: 6、石灰石高温分解 7、水通电分解 三、置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应。 1、锌和稀硫酸反应 2、锌和稀盐酸反应 3、铁和稀硫酸反应 4、铁和稀盐酸反应 5、铝和稀硫酸反应 6、铝和稀盐酸反应 7、镁和稀硫酸反应 8、镁和稀盐酸反应 (二)金属氧化物和氢气或碳反应,可治炼金属 1、氢气还原氧化铜 2、氢气还原氧化铁: 3、氢气还原氧化亚铁 4、氢气还原四氧化三铁: 5、镁还原氧化铜 6、碳和氧化铜高温 7、碳还原氧化铁8、碳还原氧化亚铁
(三)金属与某些盐溶液反应,可治炼金属 (1)铁和硫酸铜反应(2)铝和硫酸铜反应 (3)铜和硝酸汞反应(4)铜和硝酸银反应 四、复分解反应:两种化合物相互交换成分生成两种新的化合物的反应。 (一)酸+某些金属氧化物盐+水 (1)盐酸与氧化铁反应 (2)硫酸与氧化铁反应 (3)硫酸与氧化铜反应 (4)盐酸与氧化铜反应 (二)酸+碱盐+水(中和反应) 1、氢氧化钠和稀盐酸反应 2、氢氧化铜和盐酸反应 3、氢氧化铜和硫酸反应 4、氢氧化钠和硫酸反应 5、氢氧化钡和硫酸反应(三)盐+酸新盐+新酸(生成物中有气体、沉淀或水) 1、大理石(石灰石)和稀盐酸反应 2、碳酸钠和稀盐酸反应 3、硝酸银和盐酸反应 4、氯化钡和稀硫酸反应(四)盐+碱新盐+新碱(反应物均溶于水,生成物中有沉淀) 1、硫酸铜和氢氧化钠反应 2、氯化铁和氢氧化钠反应 3、碳酸钠和氢氧化钙反应 4、硫酸铜和氢氧化钡反应 5、硫酸镁和氢氧化钡反应 6、氯化铵和氢氧化钙反应 (五)盐+盐两种新盐(反应物均溶于水,生成物中有沉淀) 1、氯化钾和硝酸银反应 2、氯化钠和硝酸银反应
九年级化学上册常见化学方程式 反应类型化学反 应化学方程式特征 及现象 化合反应1.木炭 充分燃 烧 C+O2CO2发出白 光,放热 2.木炭 不充分 燃烧 2C+O2 2CO生成有 毒气体 3.硫磺 燃烧 S+O2 SO2有蓝(紫) 色火焰.生 成刺激性 气体 4.铁丝 燃烧 3Fe+2O2 Fe3O4火星四 射.生成 黑色固体5.镁带 燃烧 2Mg+O2 2MgO有耀眼白 光,生成 白色固体6.红磷 燃烧 4P+5O22P2O5有大量白 烟生成 7.铜丝2Cu+O 22CuO 亮红色固
8.铝丝燃烧4Al+3O22Al2O3火星四 射,生成 白色固体 9.氢气燃烧2H2+O22H2O有淡蓝色 火焰 10.有毒气体CO 燃烧2CO+O22CO2有蓝色火 焰 11.CO2和H2O反应CO2+H2O = H2CO3生成物能 使石蕊变 红 12.CO2与C反应CO2+C 2CO所有物质 中都含碳 元素 13.生石灰和水反应CaO+H2O = Ca(OH)2实验室制 氢氧化 钙,反应 放热 14.氢气与氯气H2+Cl2 2HCl剧烈燃 烧,产生
15.汞与氧气的反应2Hg+O22HgO 银白色液 体变成粉 红色固体 分解反应16.氯酸 钾制取 氧气 2KClO3 2KCl+3O2 ↑ 加热固体 混合物制 取氧气 17.过氧 化氢制 氧气 2H2O2 2H2O + O2 ↑常温下固 液混合物 制取氧气18.高锰 酸钾制 氧气 2KMnO4K2MnO4+MnO2+O2↑加热纯净 物制取氧 气 19.水电 解 2H2O 2H2↑+O2↑分解产生 两种气体 单质20.碳酸 分解 H2CO3= H2O+CO2↑碳酸不 稳定21.碳酸 钙煅烧 CaCO3CaO+CO2↑工业制取 二氧化碳 22.氧化2HgO 2Hg+O 2 产生银白
初中化学常见化学方程式总汇(练习卷) 班级_______________ 姓名_______________________ 一、氧气和水 (1).物质与氧气的反应 磷在空气(或氧气)中燃烧:___________________________________________ 硫在空气(或氧气)中燃烧:___________________________________________ 碳在空气(或氧气)中燃烧:___________________________________________ 氢气在空气(或氧气)中燃烧:___________________________________________ 铁在氧气中燃烧:___________________________________________ (2)实验室制取氧气 加热高锰酸钾:___________________________________________ 加热氯酸钾和二氧化锰:___________________________________________ 过氧化氢与二氧化锰混合:___________________________________________ (3)水通电分解:___________________________________________ 二、碳和碳的化合物 (1)单质碳 木炭的完全燃烧:___________________________________________ 木炭的不完全燃烧:___________________________________________ 高温下木炭还原氧化铜:___________________________________________ 高温下木炭还原氧化铁:___________________________________________ (2)二氧化碳 二氧化碳与水反应:_______________________ 碳酸分解:________________________ 二氧化碳与石灰水:___________________________________________ 碳酸钙与稀盐酸:___________________________________________ 碳酸钠与稀盐酸:___________________________________________ (3)一氧化碳 一氧化碳燃烧:___________________________________________ 一氧化碳还原氧化铜:___________________________________________ 一氧化碳高温下还原氧化铁:___________________________________________ (4)甲烷和酒精(乙醇) 甲烷在空气(或氧气)中燃烧:___________________________________________ 酒精在空气(或氧气)中燃烧:___________________________________________ 三、金属及酸碱盐
初三化学方程式按元素归类总结与氧有关的化学方程式: 2Mg+O2点燃 ====2MgO 现象:燃烧、放出大量的热、同时放出耀眼的白光 S+O2点燃 ====SO2 现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。 C+O2点燃 ====CO2 现象:生成能够让澄清石灰水浑浊的气体 2C+O2点燃 ====2CO 现象:燃烧 4P+5O2点燃 ====2P2O5 现象::生成白烟 3Fe+2O2点燃 ====Fe3O4 现象:剧烈燃烧、火星四射、生成黑色的固体 2H2+O2点燃 ====2H2O 现象:淡蓝色的火焰 2H2O2MnO2 ====2H2O+O2↑现象:溶液里冒出大量的气泡 2HgO △ ====2Hg+O2↑现象:生成银白色的液体金属 2KClO3MnO2 ====2KCl+3O2↑现象:生成能让带火星的木条复燃的气体 2KMnO4 △ ====K2MnO4+MnO2+O2↑现象:同上, 跟氢有关的化学方程式: 2H2+O2点燃 ====2H2O 现象:淡蓝色的火焰 Zn+H2SO4==ZnSO4+H2↑现象:有可燃烧的气体生成 Mg+H2SO4==MgSO4+H2↑现象:同上 Fe+H2SO4 ==FeSO4+H2↑现象:变成浅绿色的溶液,同时放出气体2Al+3H2SO4 ==A l2(SO4)3+3H2↑现象:有气体生成
Zn+2HCl==ZnCl2+H2↑现象:同上 Mg+2HCl==MgCl2+H2↑现象:同上 Fe+2HCl==FeCl2+H2↑现象:溶液变成浅绿色,同时放出气体 2Al+6HCl==2A lCl3+3H2↑现象:有气体生成 △ H2+CuO====Cu+H2O 现象:由黑色的固体变成红色的,同时有水珠生成 高温 2Fe2O3+3H2 =====2Fe+3H2O 现象:有水珠生成,固体颜色由红色变成银白色————————————————又是分割线——————————————————跟碳有关的化学方程式: C+O2点燃 ====CO2(氧气充足的情况下) 现象:生成能让纯净的石灰水变浑浊的气体 2C+O2点燃 ====2CO(氧气不充足的情况下) 现象:不明显高温 C+2CuO=====2Cu+CO2↑现象:固体由黑色变成红色并减少,同时有能使纯净石灰水变浑浊的 气体生成 高温 3C+2Fe2O3=====4Fe+3CO2↑现象:固体由红色逐渐变成银白色,同时黑色的固体减少,有能使 纯净的石灰水变浑浊的气体生成 CO2+C 高温 ====2CO 现象:黑色固体逐渐减少 3C+2H2O=CH4+2CO 现象:生成的混和气体叫水煤气,都是可以燃烧的气体跟二氧化碳有关的化学方程式: C+O2点燃 ====CO2 现象:生成能使纯净的石灰水变浑浊的气体 Ca(OH)2+CO2===CaCO3↓+H2O 现象:生成白色的沉淀,用于检验二氧化碳