第9章 醇、酚、醚
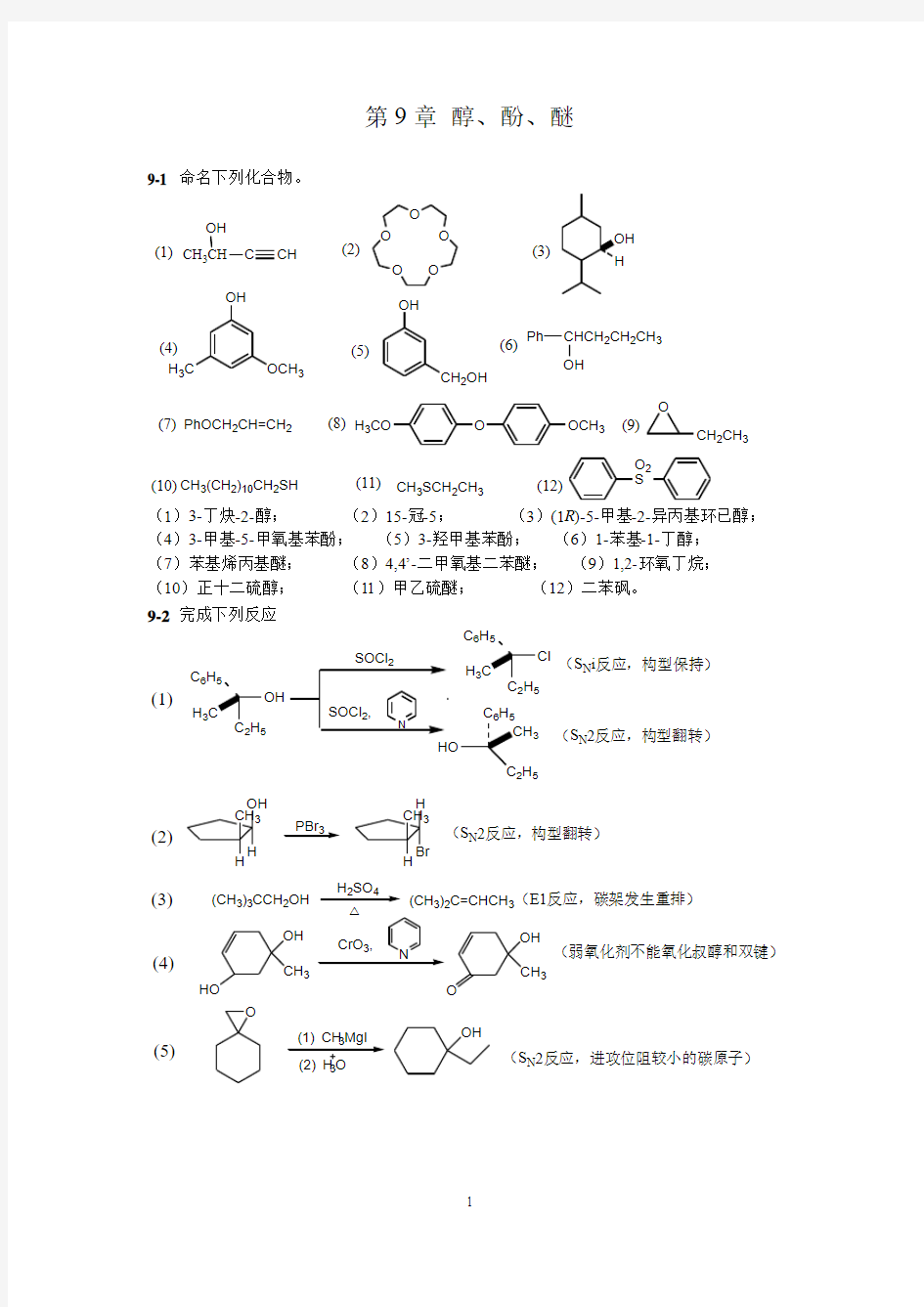
9-1 命名下列化合物。
CH 3CH
OH
C
CH
O O
O O
O OH
H 3C
OCH 3
OH
CH 2OH
Ph
CHCH 2CH 2CH 3OH
PhOCH 2CH=CH 2O
OCH 3
H 3CO
O
CH 2CH 3
CH 3(CH 2)10CH 2SH
CH 3SCH 2CH 3
O 2S
(1)(2)
(3)
(4)
(5)
(6)
(7)(8)(9)
(10)(11)(12)
(1)3-丁炔-2-醇; (2)15-冠-5; (3)(1R )-5-甲基-2-异丙基环已醇; (4)3-甲基-5-甲氧基苯酚; (5)3-羟甲基苯酚; (6)1-苯基-1-丁醇; (7)苯基烯丙基醚; (8)4,4’-二甲氧基二苯醚; (9)1,2-环氧丁烷; (10)正十二硫醇; (11)甲乙硫醚; (12)二苯砜。 9-2 完成下列反应
(1)
25
H 3C 6H
5
25
H 3C 6H 5
2H 5
3
(S N i 反应,构型保持)
(S N 2反应,构型翻转)
H
OH CH 3
H PBr 3
H
H CH 3Br
(S N 2反应,构型翻转)
(CH 3)3CCH 2OH
H 2SO 4
CrO 3,
(CH 3)2C=CHCH 3(E1反应,碳架发生重排)
HO
OH CH 3
N
O
OH
CH 3
(弱氧化剂不能氧化叔醇和双键)
O
3OH
(S N 2反应,进攻位阻较小的碳原子)
(2)
(3)(4)
(5)
H
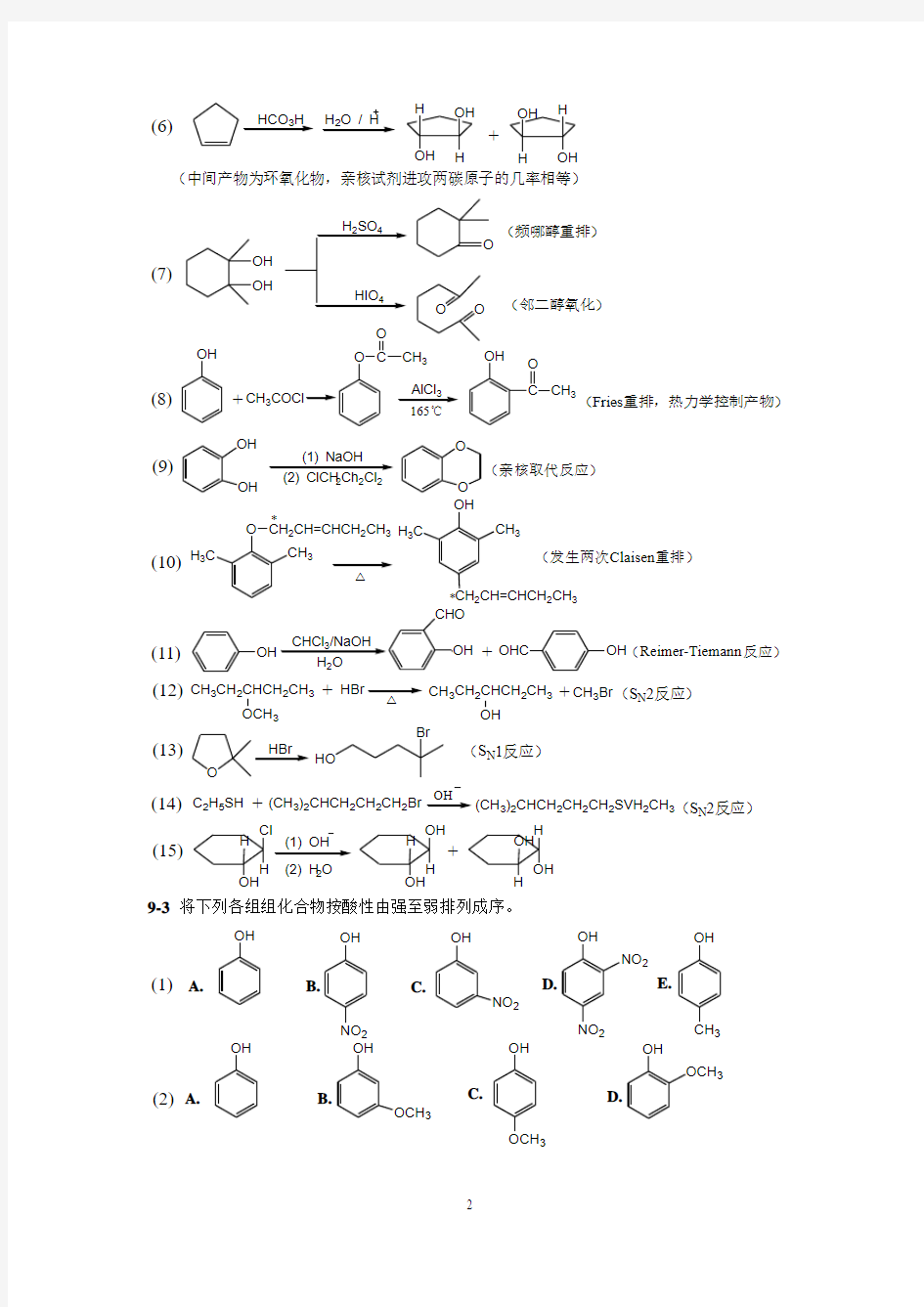
OH HCO 3H H 2O / H
(6)
OH
H OH
OH
H +
(中间产物为环氧化物,亲核试剂进攻两碳原子的几率相等)
CH 3AlCl 3(8)OH
+O CH 3O
OH
C
O CH 3
(Fries 重排,热力学控制产物)
(7)
OH OH
O
O
O (频哪醇重排)
(邻二醇氧化)
222(10)
O CH 2CH=CHCH 2CH 3OH
(1) NaOH (9)
OH
OH
O
O (亲核取代反应)
H 3C
CH 3
*
OH
H 3C
CH 3
CH 2CH=CHCH 2CH 3
*
(发生两次Claisen 重排)
OH OHC +
(Reimer-Tiemann 反应)
(11)
C 2H 5SH
(13)
CH 3CH 2CHCH 2CH 3
(15)
CH 3Br +
(12)OCH 3
+
CH 3CH 2CHCH 2CH 3
OH
+(S N 2反应)
HO
Br
(S N 1反应)
(CH 3)2CHCH 2CH 2CH 2Br
+OH
(CH 3)2CHCH 2CH 2CH 2SVH 2CH 3(S N 2反应)
OH H
Cl
H H OH H OH
OH
H
OH
H (1) OH (2) H 2O
(14)
9-3 将下列各组组化合物按酸性由强至弱排列成序。
OH
OH
OH
OH
OH
NO 2NO 2
NO 2
NO 2
CH 3
A.
B.
C.
D.
E.
OH
OH
OH
OH
OCH 3
OCH 3
OCH 3
A.
B.
C.
D.
(1)(2)
(1)D >B >C >A >E ; (2)B >A >D >C 。 9-4 将下列化合物按分子内脱水反应的相对活性排列成序。
OH
OH
A. B.
C.
A.
B. C.(1)(2)CHCH 3OH
CH 3CH 2CH 2OH
CH 2=CHCHCH 3
OH
(CH 3)2CHOH
(1)B >A >C ; (2))B >A >C 。
9-5 将下列各组化合物按与氢溴酸反应的相对活性排列成序。
CH 2OH A. B. C.(1)(2)CH 2OH CH 2OH
H 3C O 2N CH 2OH
A.
B.
C.
CHOH CH 2CH 2OH
CH 3
(1)B >A >C ; (2))B >A >C (从中间体碳正离子稳定性考虑)。 9-6 试写出除去下列化合物中少量杂质的方法和原理。 (1)C 2H 5OH 中含有少量H 2O ;(2)(C 2H 5)2O 中含有少量H 2O 和C 2H 5OH ; (3)C 2H 5Br 中含有少量C 2H 5OH ;(4)n -C 6H 14中含有少量(C 2H 5)2O 。 (1)加Mg ,加热回流,蒸出乙醇;
(2)先加CaCl 2除大部分水和乙醇,再加入钠,蒸出乙醚;
(3)用H 2SO 4洗涤,分液,蒸出C 2H 5Br 。醇可H 2SO 4与形成烊盐并溶于H 2SO 4中。 (4)用H 2SO 4洗涤,分液,蒸出n -C 6H 14。 9-7用化学方法鉴别下列各组化合物。
OH
E. D.C.B. C.(1)(2)CH 3CH 2CH 2CH 2OH
CH 3CH 2CHCH 3
OH
(CH 3)3COH
A.
B.CH 2=CHCH 2Br
CH 3CHCH 2OH
OH
(CH 3)3CBr
CH 3CH 2OCH 2CH 3
n -C 4H 10
F.A.
(1)
A
B C 试剂片刻混浊
浓HCl/ZnCl 2
片刻混浊
(2)
FeCl 3A B
C
试剂
D
E
F
(蓝紫色)(褪色)
溶
浓H 2SO 4
Br 2/CCl 4
(1)HIO 4,(2)AgNO 3AgNO 3/C 2H 5
OH
+
+++
9-8 完成下列转化。
(1)
CH 2Br CH 2CH
CH 2
O
CH 2CH
CH 2O
Mg
3CH 3CO 3H
H +
O
CH 2
Br
CH 2MgBr
CH 2CH 2CH 2OH CH 2CH=CH 2
方法之二
CH 2Br
3CH 2C
CH
CH 2CH
CH 2
O CH 3CO 3H
2CH=CH 2
(2)
OH 3
OH
3
CHCH=CH 2
CH 3
NaOH
CH 3CH=CHCH 2Cl
OH
CH 3
OH
CH 3
CHCH=CH 2
CH 3
ONa
CH 3
OCH 2CH=CHCH 3
CH 3
(3)
COOH
卤代烃与NaCN 反应,虽然能制备目标产物,但不是理想的合成路线,因为NaCN 是剧毒物。
(4)
OH
OH
Cl
OH
H O
OH
Cl
3OH
SO 3H
(5)
O
O
O
O
O
O Cl NaCl
ONa
+
+
9-9 用适当的原料合成下列化合物。
(4)
(1)
(3)CH 3CH 2CH 2OCH(CH 3)2
(2)CH 3CH 2OCH=CH 2O
H 3CH 2C
CH 2CH 2OH
(CH 3)3CCHOCH(CH 3)2
3
(1)
3CH 2CH 2OCH(CH 3)2
△(2)
3CH 2OCH=CH 2
(1)
3H 2SO 4+
(CH 3)2CHONa
CH 3CH 2CH 2CH 3CH 2OH
3CH 2OCH 2CH 2OH
+
O CH 2CH 3
CH 2CH 2
OH
OC 2H 5
O
+
(CH 3
)3CCH=CH 2(1) Hg(OOCCF 3)2
4
(4)(CH 3)2
(CH 3)3CCHOCH(CH 3)
2
3
该反应生成醚可避免消除重排等副反应,但所用试剂毒性较大。
9-10 化合物A 是一种性引诱剂,请给出它的系统命名法的名称,并选择适当原料合成化合
物A 。
A 的名称:(7R ,8S )-2-甲基-7,8-环氧十八烷。
(1) B 2H 6
2-(C 2H 5)2
O
A Br
OH
CH 3CO 3H
(±)
9-11 推测下列反应的机理,并用弯箭头表示出电子转移方向。
HO
3(1)
HO
3
H
3
(2)
H CH 2OH
△
+
+
CH 3OH (3)
+
3
Ph
H 3CO (±)(±)
CH 3OH
H +
△
+
2
3Ph
H 3CO
(±)(±)
2Ph HO CH 3
Ph H 3CHO
(±)+(±)
(4)
H 2
O
(5)
H +
O
OH
H +
OH
OH
H
重排
(6)
(CH 3)2C C(CH 3)2I
OH
(CH 3)3C
C
CH 3
O
Ag +
H +
重排
(CH 3)2C
C I
OH
(CH 3)3C
C
CH 3
O +
CH 3CH 3(CH 3)2C OH
3
CH
3
(CH 3)2CH
3
CH 3
(CH 3)2C
C CH 3
OH
CH 3
9-12 推断A 、B 、C 的构造式。(利用酚的性质,烯烃的氧化,Claisen 重排) 各化合物之间的关系如下:
HCHO
A (C 10H 12O)
10H 12O)
200℃
(1)NaOH,(2)CH 3Br
(1)O 3, (2)Zn, H 2O 3
NaOH
3, (2)Zn, H 2O 3(1) KMnO 4, OH -(2) H 3O
COOH
OCH 3
化合物B 的信息较多,是解题的关键。
OH
CH 2CH=CHCH 3
O
H C
CH=CH 2
CH 3
OCH 3
CH 2CH=CHCH 3
A
B C
9-13 推断A 的构造式,并标明质子的化学位移及红外吸收的归属。(利用酚的性质、IR 谱
和1
H NMR 谱)
化合物A 的不饱和度为4,可能含有苯环;A 能溶于NaOH 溶液,但不溶于NaHCO3溶液,可能为酚;结合IR 谱数据可知,A 为对位二取代(830cm -1有吸收峰)酚类。再结合1
H NMR 数据可推测A 可能的构造式为:
OH
(H3C)3C
1.37.0 4.9
(9H,s)(4H,m)(1H,s)
δ:
IR:3 250cm-1为νO—H伸缩振动吸收峰;830cm-1为νAr—H(面外)弯曲振动吸收峰。9-14推测化合物构造式。(醇的亲核取代反应,消去反应,烯烃的氧化反应、水解反应)
CH3
CH3OH
OH
CH3
CH3
CH3
CH3
HO
HO
A. B. C.
9-15为什么RX、ROH、R—O—R都能发生亲核取代反应?试说明它们发生亲核取代反应的异同点。
自己归纳总结。(抓住结构与性质的关系,亲核取代反应)
9-16说明烯丙基卤与烯丙基醇,苄卤与苄醇的取代反应有何异同。
自己归纳总结。(抓住结构与性质的关系)
9-17试说明HI分解醚的反应是如何按S N2或S N1机理进行的,为什么HI比HBr更好?
醚有弱碱性,与HX生成烊盐,加大了C—O键的极性,C上正电荷更高,X-对其进行亲核进攻,醚键断裂,发生了S N2反应;如果是叔丁基醚,由于叔丁基碳正离子较稳定,反应以S N1机理进行。
HI比HBr更好,因为前者酸性较强,有利于生成烊盐,且亲核性I->Br-
9-18为什么醚蒸馏前必须检验是否有过氧化物存在?(RCH2)2O和(R2CH)2O哪个更容易生成过氧化物?
久置的醚中可含有过氧化物。在蒸馏乙醚时,其中含有的过氧化物因乙醚的蒸出而浓度逐渐增大,受热时会发生爆炸。因此,蒸馏醚前必须检验是否有过氧化物存在。可用KI淀粉试纸进行检验,如果试纸变蓝,则表示有过氧化物,则可以向醚中加入5%FeSO4溶液,经充分搅拌,可以破坏其过氧化物。醚的过氧化物的形成是自由反应,(R2CH)2O比(RCH2)2O 更容易形成过氧化物。
9-19说明实验现象。(反应介质对S N2、S N1机理的影响)
(CH3)3COCH
3
I(CH3)3COH
CH3OH(CH
3
)3CI +
+
在乙醚中,反应介质的极性较低,有利于S N2机理,亲核试剂I-进攻空间位阻小的甲基碳原子;在水溶液中,反应介质的极性很强,有利于S N1机理,生成较稳定的叔碳正离子中间体。
8-20试说明实验现象。(环醚在不同介质中开环反应机理及开环规律)
在酸性介质中,H+催化反应按S N1机理进行,生成较稳定的碳正离子。在碱性介质中,反应按S N2机理进行,亲核试剂进攻空间位阻小的碳原子。
第10章醛、酮、醌
10-1 命名下列化合物。
(1)3-甲基-1-苯基-1-戊酮;(2)2,4,4-三甲基戊醛;(3)1-(1-环已烯基)丁酮;
(4)(E )-苯基丙基酮肟; (5)3-丁酮缩乙二醇; (6)2-环已烯酮; (7)三氯乙醛缩二甲醇; (8)2-戊酮苯腙; (9)2,6-萘醌; (10)2,4-已二酮; (11)((E )-间甲基苯甲醛肟。
10-2 写出下列反应的主要产物。
PhCHO
HCOONa +浓NaOH
HCHO
2OH
+
(Cannizzaro 反应)
O
Zn-Hg / HCl
HCN
H 3O
OH COOH
O
(Clemmensen 还原)
H 3C
C CH 3
O Mg 66
H 3O
H 2SO 4
△
(CH 3)2C C(CH 3)OH OH
(H 3C)3C
C CH 3
O
(pinacol 重排)(1)(2)
(3)
(4)
+
HCHO
(Mannich 反应)
+
HCl
(5)
(6)
O
N H
CH 2CH 2N
O
CH 3
O
CH
3
CH 3
OH
(黄鸣龙还原)
CO 3Cl
+
CO 2H
Cl
+
(Baeyer-Villiger reaction)
O
NH 2+
PCl 5
H N
O
(Beckmann 重排)
O
(1) HSCH 2CH 2SH
2O
(1) Cl 2 / NaOH 3OH
O
(卤仿反应)(7)
(8)(9)
(10)
CHCl 3
+
(Wittig reaction)
CH 3MgBr +
3(13)
(12)
(11)O
O
(1,4-加成产物)
2CH 3
)
10-3 比较下列化合物的亲核加成反应活性。
(2)
(1)C
O
CH 3
H 3C C CH 3
O
H 3C
C H
O
C
O CH 3
H 3C
(3)(4)
(3)>(1)>(2)>(4)
10-4 将下列化合物按烯醇式的含量多少排列成序。 CH 3COCHCOCH 3
CH 3COCH 2CH 3
(2)(1)Ph C
H 2
C O
(3)(4)3
CH 3COCH 2COCH 3
C CH 3
O
(1)>(4)>(3)>(2)
10-5 指出下列化合物中,哪些能发生碘仿反应?哪些能与饱和NaHSO 3反应?
(2)(1)O
(3)(4)(5)ICH 2CHO
CH 3CH 2CHO
C 6H 5COCH 3
CH 3CHO
CH 3CH 2CH 2OH
CH 3CH 2CCH 2CH 3
CH 3CH 23
OH
(7)(6)(8)
O
能与饱和NaHSO 3反应的有(1)、(2)、(5)、(8)[脂肪族甲基酮、大多数醛和8个碳以下的脂肪酮能进行此反应]。
能发生碘仿反应的是(1)、(3)、(4)、(5)。
10-6 用简单的化学方法区别下列化合物。
(1)2-已醇 (2)2-已酮 (3)3-已酮 (4)已醛
3
无变化
不反应白)
不反应
10-7设计用化学方法分离苯甲酸、苯酚、环已酮和环已醇混合物的方案,写出操作流程图,
并鉴别得到的化合物。
作为分离题,必须得到纯的化合物。
过滤
与NaHCO 3
与与Na 反应有气体放出
与NaHSO 3反应有沉淀生成
COOH
3O
OH
10-8 完成下列转化。
O
COOH
(1)
Grignard 试剂的制备及在合成中的应用。
(1)Mg. (C 2H 5)2O 2
OH
MgBr
CH 2CH 2OH CH 2CH 2Br
2CH 2COOH
(2) H 2O
3
(2)
Br
O OH
O
Br O
O O
O
O Mg 252
酮羰基的保护与去保护;Grignard 试剂的制备及应用。
(3)
OH CHO
稀2
,
羟醛缩合反应。
(4)
OH
OH
O
Li
PCl
3
OH
OH
227
OH
Cl
Li
酮的生成;与Grignard 试剂的反应;金属有机化合物的生成;与环氧化合物的反应。
(5)
OH
格氏试剂与酮反应制叔醇。
3C(CH 2OH)3
(6)
OH
CH 3CH 3CHO 3 HH 2+OHCC(CH 2OH)3
SH SH
Ni
CH 3C(CH 2OH)3
后面一步还原可用黄鸣龙反应还原,但不能用Zn-Hg/HCl 反应。
(7)
2 CH 3CHO
CH 3CHCH 2CHO
OH
CH 3CHCH 2CH 2OH
OH
浓H 2SO 4
稀OH
CH 3CH 2=CH-CH=CH 2
2=CH-CH=CH 2
羟醛缩合反应;还原反应。
NaOCl
(8)
CH 3COCH 3
稀OH H
CH 3COCH 3
(CH 3)2C=CHCOOH
23)2C=CHCOCH 3
3)2C=CHCOONa
(CH 3)2C=CHCOOH
羟醛缩合反应;碘仿反应。
10-9 我国盛产山茶籽数见不鲜,其主要成分是柠檬醛,设计以它为原料合成香料β-紫罗兰
酮的合成路线,写出反应式。
CHO
柠檬醛
β-紫罗兰酮
O 稀OH +
CHO
O
O
羟醛缩合反应;烯烃的性质;碳正离子的反应。 10-10
出下列反应的机理。
OH
OH
C CH 3
CH
3
HO
(1)
H
3
C H 3C H 3C
2
3
H
酮、醇的Lewis 碱性;芳环亲电取代反应机理。
3H HOCH 2CH 2CH 2CHO
(2)O
H
OCH 3+
H 2O
HOCH 2CH 2CH 2CH O
H
OH
H O
OH H
O
H OH 2H 2O O
O
OCH 3H
H O
H
OCH 3
缩醛形成的机理。
OH
(3)
O
OH
O
O
O
OH
H 2O O
O
O
O
OH
H H 2O
羟醛缩合反应及其逆反应机理。
10-11 推测化合物构造式及写出相应的反应式。
H 3C
C
C H
O
C H
CH
H 3C
C H 2
C O
CH
CH 3CH 33C
C C H
OH C H
CH 3
3
CH H 2
C O
CH H 3C H 3C
ONa
C
H 2
C O CH H 3C H 3C
H 2C
C C H C H
CH CH 3
H 3C
C C
H
OH
C H
CH CH 3
Br 2/NaOH
Pd KHSO 4
2
H 3C CH 3
COOH A
B
C
D
E
B
(1,4-共轭加成产物)(1,2-加成产物)
α,β-不饱和酮的亲核加成反应;卤仿反应;双烯合成。 10-12 推断A ~ E 的构造式。
E
3
3
还有另一组即S ,S 构型。 旋光性;酮的性质;烯烃的性质;H NMR 谱。 10-13 写出A 的构造式及相关反应式。
A
CH 3
3)2
O
2CH(OCH 3)2O
CHI CH 32CHO O
CH 32COONH 4
O
Ag(NH 3)2OH
2SO 4
2+
+
缩醛的性质;碘仿反应;H NMR 谱。
10-14 试说明影响醛酮发生亲核加成反应活性的因素。
电子效应:羰基碳原子上电子密度低,有利于反应,即连吸电子基反应活性高; 空间效应:空间位阻大,不利于亲核试剂进行,反应活性低。
第11章 羧酸及其衍生物
11-1 将下列各组化合物按酸性由强至弱排列成序。
CH 3COOH
ClCH 2COOH
Cl 3CCOOH
OH
A. B. C.
D.A.
B.
C.
D.
COOH
Br COOH
NO 2COOH
OCH 3
COOH
NO 2NO 2
COOH
OH
COOH
COOH
OH
A. B.
C.
(1)
(2)
(3)
(1)D >B >A >C ; (2)C >B >A >D ; (3)B >A >C 。 知识点:羧酸的酸性。
11-2 将下列各组化合物按水解反应速率由大至小排列成序。
CH 3COCl
(CH 3CO)2O
CH 3CONHCH 3
A. B. C. D.COOCH 3
NO 2
COOCH 3
CH 3
COOCH 3
A.
B.
C.
(1)
(2)CH 3COOC 2H 5
(1)A >B >D >C ; (2)A >C >B 。
知识点:羧酸衍生物水解反应活性。水解反应是亲核加成-消除反应,连有吸电子基有利于反应进行。
11-3 比较下列酸在H +催化下进行酯化反应的速率。
HCOOH CH 3COOH CH 3CH 2COOH
(1)(2)(3)(CH 3)2CHCOOH (4)
(1)>(2)>(3)>(4) 知识点:酸酯化反应活性。 11-4 完成下列反应。
(1)
COOH
OH OH
O
O
O
+
(1) LiAlH 4(2)H 2C
COOH
2H 2C
CH 2OH
SOCl 2
(3)H 3C CH 2CH 23C CH 2CH 2COCl
H 3C
O
AlCl 3
(分子内酰基化)
(1) Zn, CH 3CH(Cl)COOEt
(Reformasky 反应)
(4)
(2) H 2O
O
OH
CHCOOC 2H 5CH 3
(5)
Br 2/红磷
CH 2
COOH
CHCOOH
Br
(酰胺还原)
(6)
N H
O
(Hofmann 降解)
(7)
NaOH+Br 2
2
C 6H 5
H 32
C 6H 5
H 3
(8)
△
H 3O
(Claisen 酯缩合反应, Wittig 反应, Mannich 反应)
32(9)
△
COOH
COOH O
(10)
O
O
3
(酯与格氏试剂反应,羟醛缩合反应)
HCOOC 2H 5
NaOC 2H 5(11)
+
C 2H 5OH
CHO
(12)
O O
33
CH 3COOC 2H 5
AlPO 4(13)CH 3COOH
2CH 3CH 2OH
H 2C
C O
知识点:羧酸及其衍生物的化学性质。
11-5 给下列反应式填上适当的试剂。
(1)①LiAlH 4,②H 2O ; (2)Na / C 2H 5OH ;
(3)①LiAlH 4,②H 2O ; (4)①HSCH 2CH 2SH ,②H 2 / Ni ; (5)H 2 / Pd-BaSO 4,喹啉; (6)①LiAlH 4,②H 2O ; (7)①NaBHH 4,②H 2O 或Al[OCH(CH 3)2]3 / (CH 3)2CHOH 。 知识点:还原剂的选择性还原。
11-6 用化学方法分离下列各组化合物,并鉴定分离出的化合物。 (1)A. 2-辛醇
B. 2-辛酮
C.正辛酸 (2)A. 苯酚 B. 苯甲醚 C.苯甲酸 分离要求得纯化合物。 水相
H 3
2-辛醇
2-辛酮
正辛酸
A. B.滤液
B 水溶性物质
C 的钠盐B (蒸馏
分出的A,B,C 可根据化合物的沸点鉴别
(1)
有机相
过滤NaOH H
A. B. C.
过滤
C 的钠盐
A
H +
C
(2)
苯酚苯甲醚
苯甲酸
A B
A 用FeCl 3显色鉴别,
B 可以根据沸点鉴别,
C 与NaHCO 3反应有气体放出。 知识点:利用化学性质、物理性质分离提纯化合物。
11-7 下列反应是否容易进行,并解释之。 (1)容易。因为碱性:H 2O >Cl -
(2)不容易。在本条件下易发生酸碱中和反应成盐,而不易进行亲核取代反应(—NH 2取代—OH )。
(3)容易。OH - 的碱性大于离去基团CH3COO - 的碱性。
(4)容易。尽管NH 2- 的亲核性比OH - 强,但在碱性溶液中生成了较稳定的RCOO -
。因此
反应趋于正反应方向。
(5)不容易。因为CH 3O - 的亲核性比Br - 强得多。 11-8 完成下列转化。
CH 3CH 2OH
CH 3CH 2OH
CH 3CH 2CHCOOH
CH 3
CrO 3N
,
CH 3CH 3稀OH 22,CH 3CH=CHCH 3HBr
CH 3CH 23
Br
252(2) CO 2
CH 3CH 2CHCH 3
3CH 3CH 2CH 3
(1)
羟醛缩合反应;格氏试剂与CO 2反应得到多一个碳原子的酸。
HOCH 2CH 2OH
3252(2)H 3O
(2)
O
O O
O
OH
O
O
O
+O
O
O O
O
OH
酮羰基官能团保护;酯与格氏试剂反应合成醇。
HO 2C(CH 2)4CO 2H
HNO 3Ba(OH)2(3)
O O
O
O
环酮氧化,二元羧酸受热变化。
K 2Cr 2O 7,H
+
3(2)(1) C 2H 5MgBr/Et 2O
H 3
O
(4)
OH
O CH 2CH 3COOC 2H 5
OH CH 2OH
CH 2CH Br
2CH CH 2CH COOH
2CH 32H 5
仲醇氧化为酮;格氏试剂在合成中的应用;酯化反应。
CH 3CH 2OH
CH 3CH 2OH
CH 3CHCH 2CO 2C 2H 5
OH
CrO 3N
,
CH 3,(1) Zn, BrCH 2COOC 2H 5
(2)H 3O
(5)3CHCH 2CO 2C 2H 5
OH
Reformatsky 反应。
CH 3CH 2CO 2H
CH 3CH 2CN SOCl 2
(6)NH 3
P 2O 5CH 3CH 2CH 3CH 2CO 23CH 2CONH
CH 3CH 2CN
羧酸及其衍生物的性质。
H 3O (7)
OH CN
OH COOH
2
仲醇的氧化;酮与HCN 加成;腈的彻底水解;交酯的合成。
3NBS 3
CCl 4HOCH 2CH 2OH
PCC
CH 3CH 2CH 2CO 2H H 3CH 2C
(8)
CH 3
COCH 3
H 3C
COCH 3
BrH 2C C
CH 2O O H 3C (2)(1) Mg, 醚
C CH 2CH 2CH 2OMgBr
O O H 3C O 2OH
C CH 2CH 2CHO
H 3C
O
2CH 2CO 2H
羰基保护;氧化还原反应。
11-9 用乙酰乙酸乙酯或丙二酸二乙酯为原料,合成下列化合物(其它试剂任选)。 CH 3COCH 2CO 2C 2H
(1)(2) BrCH 2CH 2CH 2Br 25(3) C 2H 5ONa
COCH 3
COOC 2H 53
CH 3COCH 2CO 2C 2H 5
H +
3C (2)222525 稀OH
-
C CH
O CO 2C 2H 5
CH 2CO 2C 2H 5H 3C
C CH
O COO
CH 2COO
H 3C C
H 2
C O CH 2COOH
CH 3COCH 2CO 2C 2H 5
3C
(3)222252
C CH
O CO 2C 2
CH 2
H 3C
C
C
H
O
CO 2C 2H 5
3 -CH 2CH 23
3COCH 3
COCH 3
(4)22225 稀OH -
CH 2(COOEt)2
,
H +25COOEt △
COOEt 222Cl 2Cl 22COOEt COOEt
COO COO
COOH
3322,△
CH 3COCH 2CO 2C 2H H 3C
(5)222(1)C 2H 5ONa C CH
O CO 2C 2H 5
CH 2CH 2CH=CH 2
H 3O
(1) 5%NaOH H 3C
C
H 2C O CH 2CH 2CH=CH 2H 3C C H 2
C CH 2CH 2CH O O CH 2O H 3C C H 2C O CH 2CH 22OH
OH
O O CH 3
HCl
Ph 3P=CH 2
,(1) C 2H 5ONa △
CH 3COCH 2CO 2C 2H 5
H 3C
(6)(2) C 6H 5CH 2Cl (1)C 2H 5ONa C CH
O CO 2C 2H 5
CH 2C 6H 5
3(1) 5%NaOH 3C
C
C
O CO 2C 2H 52C 6H 5
CH 3
H 3C
C
H C
O CH 2C 6H 5
3
H 3C
C H C
CH 2
CH 2C 6H 5
3
乙酰乙酸乙酯、丙二酸的性质。
11-10 设计以环已烷为起始原料合成尼龙-6的合成路线,并指出各步反应的类型。
第十三章羧酸及其衍生物用系统命名法命名下列化合物: 1.CH 3 (CH2)4COOH2.CH3CH(CH3)C(CH3)2COOH3.CH3CHClCOOH 4.COOH 5.CH 2 =CHCH2COOH6.COOH 7. CH3COOCH38 . HOOC COOH9 . CH2COOH 10.(CH 3 CO)2O11. O CO CH312.HCON(CH 3 )2 13. COOH O2N O2N 14 . CO NH 3,5-二硝基苯甲酸邻苯二甲酰亚胺
15. CH 3CHCHCOOH CH 3 OH 16. OH COOH 2-甲基-3-羟基丁 酸1-羟基-环己基甲酸 一、 写出下列化合物的构造式: 1。草酸2,马来酸3,肉桂酸4,硬脂酸
5.α-甲基丙烯酸甲酯6,邻苯二甲酸酐7,乙酰苯胺8,过氧化苯甲酰胺 CH 2=C CH 3 COOCH 3 CO O NHCOCH 3 O O OO NH C O H 2NCOOC 2H 5 C C NH O O O H 2N C NH 2 NH CO O CO n CH 2 CH O C O CH 3 []n 三、写出分子式为C 5H 6O 4的不饱和二元酸的所有异构体(包括顺反异构)的结构式,并指出那些容易生成酸酐: 解:有三种异构体:2-戊烯-1,5-二酸;2-甲基-顺丁烯二酸;2-甲基-反丁烯二酸。其中2-甲基-顺丁烯二酸易于生成酸酐。 C C H COOH COOH C C H COOH CH 3 HOOC CH 3 HOOC CH=CHCH 2COOH 2-戊烯 -1,5-二酸;2-甲基-顺丁烯二酸;2-甲基-反丁烯二酸 四、比较下列各组化合物的酸性强度: 1,醋酸,丙二酸,草酸,苯酚,甲酸
有机化学第二版高占先全章答案完整版第章精 编版 MQS system office room 【MQS16H-TTMS2A-MQSS8Q8-MQSH16898】
有机化学第二版(高占先)(全14章答案完整版)_第1-7章史上最全的《有机化学第二版(高占先)》全14章答案完整版!!其中包括各种判断题、推断题、思考题以及合成题的答案!! Ps:亲!给好评,有送财富值哦! #^_^!! 1-3 写出下列化合物短线构造式。如有孤对电子对,请用黑点标明。 1-5 判断下列画线原子的杂货状态 (1)sp2,(2)sp,(3)sp,(4)sp3,(5)sp,(6)sp。 1-6哪些分子中含有极性键?哪些是极性分子?试以“”标明极性分子中偶极 矩方向。 答:除(2)外分子中都含有极性键。(2)和(3)是非极性分子,其余都是极性分子。分子中偶极矩方向见下图所示,其中绿色箭头所示的为各分子偶极矩方向。1-7 解释下列现象。 (1)CO 2 分子中C为sp杂化,该分子为直线型分子,两个C=O键矩相互抵消,分子偶极矩为零,是非极性分子;而SO2分子中S为sp2杂化,分子为折线型,两个S —O键矩不能抵消,是极性分子。 (2)在NH 3中,三个N—H键的偶极朝向N,与电子对的作用相加;而NF 3 中三个N —F键的偶极朝向F,与N上的未成对电子的作用相反并有抵消的趋势。 (3)Cl和F为一同主族元素,原子共价半径是Cl比F大,而电负性是F比Cl 大。键的偶极矩等于μ=qd,q为正电荷中心或负电荷中心上的电荷量,d为正负电荷中心的距离。 HCl键长虽比HF的长,但F-中心上的电荷量大大于Cl-上的电荷量,总的结果导致HF的偶极矩大于HCl。所以键长是H—Cl较长,偶极矩是H—F 较大。 1-8 将下列各组化合物中指定键的键长由长到短排列并说明理由。 答:(1)从乙烷,乙烯到乙炔,碳原子杂化态由sp3到sp2至sp,s成份提高,拉电子能力增强,虽同属于碳氢键但键长缩短。 (2)键长顺序为C—I>C—Br>C—Cl>C—F。因为卤素原子核外电子层数为I>Br>Cl>F,即其范德华半径为I>Br>Cl>F,则其原子共价半径I>Br>Cl>F。(3)碳碳键键长为乙烷>乙烯>乙炔。因为碳原子杂化态由sp3到sp2至sp,其共价键分别为单键、双键和叁键,碳碳原子间的作用力是乙烷<乙烯<乙炔,作用力越强,则两原子被拉得越紧,键长越短。 1-9 将下列各组化合物按酸性由强到弱排列。 (1)D>A>C>B;(2)A>B>D>C 1-10 下列物种哪些是:(1)亲核试剂,(2)亲电试剂,(3)既是亲核试剂又是亲电试剂? 答;(1)亲核试剂:Cl-,H 2O,CH 3 OH,CH 2 =CH 2 ,HCHO,CH 3 CN,-CH 3 ; (2)亲电试剂:H+, AlCl 3,Br+,Fe3+,+NO 2 ,HCHO,CH 3 CN,+CH 3 ,ZnCl 2 ,Ag+, BF 3 ; (3)既是亲核试剂又是亲电试剂: HCHO,CH 3 CN; (4)两者都不是的:CH 4 。 1-11 按质子酸碱理论,下列化合物哪些是酸?哪些是碱?哪些既是酸又是碱? 答:酸:NH 3,HS-,HBr,H 2 O,NH 4 +,HCO 3 -;
有机化学实验考试试题(含答案) 一、填空(1’×50) 1. 蒸馏时,如果馏出液易受潮分解,可以在接受器上连接一个干燥管,以防止空气中的水分的侵入。 2.减压过滤的优点有:(1) 过滤和洗涤速度快;(2) 固体和液体分离的比较完全;;(3)滤出的固体容易干燥。。 3. 液体有机物干燥前,应将被干燥液体中的水份尽可能分离净,不应见到有水层。 4.减压蒸馏装置通常由克氏蒸馏烧瓶;冷凝管;两尾或多尾真空接引管;接受器;水银压力计;温度计;毛细管(副弹簧夹);干燥塔;缓冲瓶;减压泵。等组成。 5. 减压蒸馏时,往往使用一毛细管插入蒸馏烧瓶底部,它能冒出气泡,成为液体的沸腾中心,同时又起到搅拌作用,防止液体暴沸。 6.减压蒸馏操作中使用磨口仪器,应该将磨口部位仔细涂油;操作时必须先调好压力后才能进行加热蒸馏,不允许边调整压力边加热;在蒸馏结束以后应该先停止加热,再使系统与大气相同,然后才能停泵。 7.在减压蒸馏装置中,氢氧化钠塔用来吸收酸性气体和水,活性炭塔和块状石蜡用来吸收有机气体,氯化钙塔用来吸收水。 8.减压蒸馏操作前,需估计在一定压力下蒸馏物的沸点,或在一定温度下蒸馏所需要的真空度。 9.减压蒸馏前,应该将混合物中的低沸点的物质在常压下首先蒸馏除去,防止大量有机蒸汽进入吸收塔,甚至进入泵油,降低油泵的效率。 10.蒸馏烧瓶的选择以液体体积占烧瓶容积的1/3-2/3 为标准,当被蒸馏物的沸点低于80℃时,用水浴加热,沸点在80-200℃时用油浴加热,不能用电热套直接加热。 11.安装减压蒸馏装置仪器顺序一般都是从下到上,从左到右。要准确端正,横看成面,竖看成线。 12.写四种破乳化的方法长时间静置、水平旋转摇动分液漏斗、用滤纸过滤、加乙醚、补加水或溶剂,再水平摇动、加乙醇、离心分离、超声波、加无机盐及减压(任意四个就可以了) 二、单选(1’×10) 1. 当混合物中含有大量的固体或焦油状物质,通常的蒸馏、过滤、萃取等方法都不适用时,可以采用(C)将难溶于水的液体有机物进行分离。 A.回流 B.分馏 C.水蒸气蒸馏 D.减压蒸馏 2.在使用分液漏斗进行分液时,下列操作中正确的做法是(C)。 A分离液体时,分液漏斗上的小孔未于大气相通就打开旋塞。 B分离液体时,将漏斗拿在手中进行分离。 C上层液体经漏斗的上口放出。 D没有将两层间存在的絮状物放出。 3. 使用和保养分液漏斗做法错误的是(D)。 A分液漏斗的磨口是非标准磨口,部件不能互换使用。 B使用前,旋塞应涂少量凡士林或油脂,并检查各磨口是否严密。
华东理工大学有机化学第二版答案【篇一:华东理工大学有机化学答案】 xt>一、大赛主题 “女性工程师储才班”是由华东理工大学和普莱克斯公司共同发起并 管理的“虚拟班级”,旨在帮助理工科背景的女大学生不断提升自我 价值,发挥“女性优势”,做好职业规划,使其成为卓越女性工程师。 为了使“储才班”吸引更多优秀的女性学生报名参和,同时能够在学 生们中获得一定的知名度和影响力,将“专注于女性的职业角色和思 维模式”的理念得以重视和发扬,现在全校范围内开展“储才班”班级 班训(口号)和班标(logo)征集大赛。 二、参赛要求 1、面向对象:华东理工大学全体学生 2、出现以下情况,自动免除参赛资格:违背法律和法规;内容不健康;涉嫌舞弊,侵犯他人知识产权;内容不属实,弄虚作假;组委 会认为的其他不当行为。 三、、作品要求 1、内容要求:主题围绕华理工科女性、化工工程师、领导力精英素质、普莱克斯企业文化等元素。 【班训】主题突出,简洁易懂,积极健康,反映班级精神、班级特点、班级目标 【班标】设计新颖,图案简介,内涵丰富,体现创新及良好的艺术 修养 2、提交要求:
【班训】作品以电子版(word)上交,字数少于16字,配以200 字以内的文字说明 【班标】作品以jpg格式上交,2mb以内,请另外附上电子版设计 说明,班标的设计可使用于名片、网站、文件纸和对外宣传册,在 较小尺寸的情况下仍能轻易识别。 四、大赛安排 2月下旬通过网络平台发布通知; 3月20日-3月23日通过网络投票和公司评审相结合的方式确定 最终采用的班标班训,被采用者获得金奖,金奖采用者将获得奖金1000元/作品。其余参赛者分别获银奖(500元/作品)和提名奖。 五、奖项设置 金奖2名(班训、班标比赛各一名,奖金1000元/作品),银奖4 名(各2名,奖金500元/作品),提名奖若干名。 【篇二:华东理工大学有机化学专业2016年考研经验】ss=txt>研经验 有机化学今年情况:划线是51 51 100 100 330,最高分 417(一 女生被院长招走)最低分330,官方预招43个,去了55人复试, 结果有14个人复试不及格,所以就招了39,至于后面有没有调剂我 不得而知,复试后排名和初试排名还是有一些变化的,刷的最高分 是400分,所以复试很重要。 选学校: 华东理工大学原名是华东化工学院,顾名思义化工很强,这个全国 都公认的,即使世纪初的这十几年没落了,但是瘦死的骆驼比马大,在华理还是第一大院,也是最好的院这毋庸置疑。而现在华理的校 长是搞药学的,所以近些年华理的药学院和生工学院很强势,下来 就是有机化学专业所在的化学和分子工程学院了,前几个就不说了,
有机化学(第二版)课后习题参考答案 第一章绪论 1-1 扼要解释下列术语. (1)有机化合物(2) 键能、键的离解能(3) 键长(4) 极性键(5) σ键 (6)π键(7) 活性中间体(8) 亲电试剂(9) 亲核试剂(10)Lewis碱 (11)溶剂化作用(12) 诱导效应(13)动力学控制反应(14) 热力学控制反应 答:(1)有机化合物-碳氢化合物及其衍生物 (2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。 键的离解能:共价键断裂成两个原子所吸收的能量称为键能。以双原子分子AB为例,将1mol气态的AB 拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。 应注意的是,对于多原子分子,键能与键的离解能是不同的。分子中多个同类型的键的离解能之平均值为键能E(kJ.mol-1)。 (3) 键长:形成共价键的两个原子核之间距离称为键长。 (4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。 (5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。 (6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。 (7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。 (8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。 (9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。 (10) Lewis碱:能提供电子对的物种称为Lewis碱。 (11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。 (12)诱导效应:由极性键的诱导作用而产生的沿其价键链传递的电子对偏移(非极性键变成极性键)效应称为诱导效应。它可分为静态诱导效应和动态诱导效应。 (13)动力学控制反应:在有机反应中,一种反应物可以向多种产物方向转变时,在反应未达到平衡前,利用反应快速的特点来控制产物组成比例的,称为动力学控制或速率控制。 (14) 热力学控制反应:在有机反应中,一种反应物可以向多种产物方向转变时,在反应未达到平衡前,用平衡到达来控制产物组成比例的,称为热力学控制或平衡控制。 1-2 简述处理化学键的价键法、分子轨道法和共振论。 答:价键法要点:价键的形成可看作是原子轨道的重叠或电子配对的结果。两个原子如果都有未成键的电子,并且自旋方向相反,则可以配对,也就是原子轨道可重叠形成共价键;重叠部分越大,所形成的共价键越牢固,因此要尽可能地使原子轨道让某一方向互相接近,以达到最大的重叠(共价键的方向性);一个原子的未成到电子如果已经配对,它就不能再与其他原子的未成对电子配对(共价键的饱和性);能量相近的原子轨道可以进行杂化,组成能量相等的杂化轨道,这样可使成键能力更强,体系能量降低,成键后可达到最稳定的分子状态。 分子轨道法要点:分子中的原子以一定的方式连接形成分子轨道,分子中的电子分布在分子轨道中,分子轨道可以由组成分子的原子轨道线性组合得到;分子轨道的数目与组成分子轨道的原子轨道数目相等;每个分子轨道有一定的能量,每个分子轨道只能容纳两个自旋方向相反的电子,即同样遵循能量最低原理、泡利不相容原理和洪特规则。
1、蒸馏有何应用?恒沸混合物能否用蒸馏法分离? 2、在蒸馏装置中,把温度计水银球插至液面上或温度计水银球上端在蒸馏头侧管下限的水平线以上或以下,是否正确?为什么? 3、蒸馏前加入沸石有何作用?如果蒸馏前忘记加沸石,能否立即将沸石加至将近沸腾的液体中?当重新进行蒸馏时,用过的沸石能否继续使用? 1、答:蒸馏过程主要应用如下: (1)分离沸点有显著区别(相差30℃以上)的液体混合物。 (2)常量法测定沸点及判断液体的纯度。 (3)除去液体中所夹杂的不挥发性的物质。 (4)回收溶剂或因浓缩溶液的需要而蒸出部分的溶剂。 恒沸混合物不能用蒸馏法分离。 2、答:都不正确。温度计水银球上端应与蒸馏头侧管的下限在同一水平线上,以保证在蒸馏时水银球完全被蒸气所包围,处于气液共存状态,才能准确测得沸点。 3、答:蒸馏前加入沸石的作用是引入气化中心,防止液体过热暴沸,使沸腾保持平稳。如果蒸馏前忘记加沸石,决不能立即将沸石加至将近沸腾的液体中,因为这样往往会引起剧烈的暴沸泛液,也容易发生着火等事故。应该待液体冷却至其沸点以下,再加入沸石为妥。当重新进行蒸馏时,用过的沸石因排出部分气体,冷却后孔隙吸附了液体,因而可能失效,不能继续使用,应加入新的沸石。 1、测定熔点时,若遇下列情况将产生什么结果? (1)熔点管壁太厚。
(2)熔点管不洁净。 (3)样品未完全干燥或含有杂质。 (4)样品研得不细或装得不紧密。 (5)加热太快。 2、为什么要求熔点的数据要有两个以上的重复?要达到此要求,操作上须注意些什么? 3、两个样品,分别测定它们的熔点和将它们按任何比例混合后测定的熔点都是一样的,这说明什么? 1、答:结果分别如下: (1)熔点管壁太厚,将导致所测熔点偏高。 (2)熔点管不洁净,将导致所测熔点偏低,熔程变宽。 (3)样品未完全干燥或含有杂质,将导致所测熔点偏低,熔程变宽。 (4)样品研得不细或装得不紧密,将导致所测熔点偏高,熔程变宽。 (5)加热太快,将导致熔点偏高。 2、答:为了减少误差。要达到此要求,不可将已测样品冷却固化后再作第二次测定。每次应更换新的样品管,重新测定。 3、答:这说明两个样品是同一化合物。 1、重结晶一般包括哪几个步骤?各步骤的主要目的是什么?
有机化学第二版(高占先)(全14章答案完整版)_第8-14章史上最全的《有机化学第二版(高占先)》全14章答案完整版!!其中包括各种判断题、推断题、思考题以及合成题的答案!! Ps:亲!给好评,有送财富值哦! #^_^!! 第8章卤代烃 8-2 完成下列各反应式。 (CH3)3CBr C2H5OH(CH3)2C=CH2 + CH3CH=CH2HBr +O O CH3CH2CH2CH3CH2CH2CN NaCN (1) (2) (CH3)2CHCH=CH2Br +500℃(CH 3 )2CCH=CH2 Br H2O (CH3)2C=CHCH2Br + (CH3)2CCH=CH2 OH (CH3)2C=CHCH2OH + (3) NaCN KOH 25 (4) (5) (6)ClCH=CHCH2Cl CH3 +ClCH=CHCH23 O Br Br Br CN CH2CHCH3 Br CH=CHCH3
CH3 Br 2 NH3(l) CH3 NH2 CH3 2 + Cl Cl NO2 NaOH-H2O OH Cl NO 2 ZnCl2 (HCHO + HCl) + CH2Cl Mg CH2MgCl CH2COOH ClCH2CHCH2CH2CH3 PhCH2MgCl CH3 +PhCH2CH2CHCH2CH2CH3 CH3 (7) (8) (9) (10) 3 RC CLi (11) RC CR' RC CCOOH RC CCH2CH2OH CHBr3 Br Br (12) 8-3写出下列反应主要产物的构型式。 C2H5 CH 3NaI +C C2 H5 CH3 NaSCH3 + (S N2) (S N2) (S N2) CH3 I 2 (CH2)4CH3 H H2O CH3 H CH2(CH2)4CH3 HO C Br CH2CH2CH3CCH2CH3 H2 Lindar催化剂 C H C CH2CH2CH3 H (1) (2) (3) (4)
第一章 有机化合物的结构和性质 无课后习题 第二章 烷烃 1.用系统命名法命名下列化合物: 1.(CH 3)2CHC(CH 3)2 CHCH 3 CH 32. CH 3CH 2CH CHCH 2CH 2CH 3 CH 3CH(CH 3)2 2,3,3,4-四甲基戊烷 3-甲基-4-异丙基庚烷 3. CH 3CH 2C(CH 3)2CH 2CH 3 4.CH 3CH 3CH 22CH 2CCH 2CH 3 CHCH 3CH 3 CH 2CH 3 1 2 3 4 5 6 7 8 3,3-二甲基戊烷 2,6-二甲基-3,6-二乙基辛烷 5.1 2 3 4 5 6 7 6 . 2,5-二甲基庚烷 2-甲基-3-乙基己烷 7 . 8. 1 2 3 4 5 67 2,4,4-三甲基戊烷 2-甲基-3-乙基庚烷 2.写出下列各化合物的结构式: 1.2,2,3,3-四甲基戊烷 2,2,3-二甲基庚烷 CH 3 C C CH 2CH 3 CH 3 CH 3CH 3 CH 3CH 3 CH 3CHCHCH 2CH 2CH 2CH 3 CH 3 3、 2,2,4-三甲基戊烷 4、2,4-二甲基-4-乙基庚烷 CH 3C CHCH 3 CH 3CH 3 CH 3 CH 3CHCH 2CCH 2CH 2CH 3 3 CH 3CH 3 5、 2-甲基-3-乙基己烷 6、三乙基甲烷
CH 3 CH 3CHCHCH 2CH 2CH 3 2CH 3 CH 3CH 2CHCH 2CH 3 2CH 3 7、甲基乙基异丙基甲烷 8、乙基异丁基叔丁基甲烷 CH 3CHCH(CH 3)2 CH 2CH 3 CH 3CH 2CH C(CH 3)3 CH 2CHCH 3 CH 3 3.用不同符号表示下列化合物中伯、仲、叔、季碳原子 3 CH 2 C CH 3 2CH 3C CH 3CH 3 1. 1 1 1 1 1 1 2CH 3 4 02. 4 03 1 323) 33 4. 2. 3. 4. 5. 6. 1. 5.不要查表试将下列烃类化合物按沸点降低的次序排列: (1) 2,3-二甲基戊烷 (2) 正庚烷 (3) 2-甲基庚烷 (4) 正戊烷 (5) 2-甲基己烷 解:2-甲基庚烷>正庚烷> 2-甲基己烷>2,3-二甲基戊烷> 正戊烷
部分思考题答案: 1、茶叶中咖啡碱的提取实验该如何操作才能减少产物的损失? 索氏提取器萃取充分;升华时水分除干净;样品变茶砂;升华装置不漏气;严格控制升华温度。 2、乙酸正丁酯制备实验有哪些方式可提高乙酸正丁酯的收率?对乙酸正丁酯的粗产品进行水洗和碱洗的目的是什么?如果最后蒸馏后收集得到的乙酸正丁酯混浊是何原因? 增加某一种反应物浓度,减少(某一种)生成物浓度(去除反应中形成的水,使用分水器)等方式。 (1)水洗目的是除去水溶性杂质,如未反应的醇,过量碱及副产物少量的醛等。 (2)碱洗目的是除去酸性杂质,如未反应的醋酸,硫酸,亚硫酸甚至副产物丁酸。蒸馏时仪器没有完全干燥,产物中含有水分,造成乙酸正丁酯混浊。 3、为什么蒸馏时最好控制馏出液的速度为1-2D/S为宜? 在整个蒸馏过程中,应使温度计水银球上常有被冷凝的液滴,让水银球上液滴和蒸气温度达到平衡。所以要控制加热温度,调节蒸馏速度,通常以1-2D/S 为宜,否则气液达不到平衡。蒸馏时加热的火焰不能太大,否则会在蒸馏瓶的颈部造成过热现象,使一部分液体的蒸气直接受到火焰的热量,这样由温度计读数会偏高;另一方面,蒸馏也不能进行的太慢,否则由于温度计的水银球不能为馏出液蒸气充分、浸润而使温度计上读数偏低或不规则。 4、重结晶时理想溶剂应具备哪些条件? (1)溶剂不与被提纯物发生化学反应;(2) 被提纯物在溶剂中的溶解度应随温度变化,即高温时溶解度大,而低温时溶解度小;(3)杂质在溶剂中的溶解度很大,或者很小;(4) 被提纯物在溶剂中能形成很好的结晶,并且容易分离;(5)溶剂应无毒,沸点较低,操作安全,价格合适并有利于回收利用。 5、重结晶的主要操作过程及各步骤的目的 (1)热饱和溶液的制备。溶剂充分分散产物和杂质,以利于分离提纯。 (2)脱色。吸附色素和树脂状杂质。 (3)热过滤。除去不溶物质。 (4)冷却结晶。进一步与可溶性杂质分离。 (5)过滤。晶体从留在母液中的杂质彻底分离。
第二章 烷烃作业参考答案 1、 共有九种: CH 3-CH 2-CH 2-CH 2-CH 2-CH 2-CH 3 CH 3-CH-CH 2-CH 2-CH 2-CH 3 2CH 3-CH 2-CH-CH 2-CH 2-CH 3 3CH 3-CH-CH-CH 2-CH 3 3CH 3CH 3-CH-CH 2-CH-CH 3 CH 3 CH 3 CH 3-C-CH 2-CH 2-CH 3 CH 3 CH 3 CH 3-CH 2-C-CH 2-CH 3 CH 3 CH 3-CH 2-CH-CH 2-CH 2 CH 2-CH 3 CH 3-C 3 CH 3CH-CH 3 CH 3 2、(1)3-甲基戊烷 (2)2,5-二甲基-3,4-二乙基己烷 (3)2,2,3,4-四甲基戊烷 (4)2-甲基-5-乙基庚烷 (5)2-甲基-3-环丁基丁烷 (6)顺-1-甲基-3-乙基环戊烷(7)反-1-甲基-4-乙基环己烷 (8)1-甲基-4-乙基-3-叔丁基环己烷 3、(1) (2) CH 3-CH-CH 2-CH 2-CH 3 3 CH 3-C-CH 2CH 3H 3 C H 3 (3) (4) CH 3-CH-CH-CH-CH-CH 3 3CH 3CH 2 CH 3 2CH 3 3)3 4、(1) (2) CH 3CH 2-C CH 3 CH-CH 3 CH 3 CH 3-C-CH-CH-CH 33CH 3 3 CH 3-CH-C-CH 2-CH 3CH 3CH 3CH 3 CH 3-C-CH 2-CH-CH 3 CH 3CH 3 CH 3 5、(1)错。改为:2,2-二甲基丁烷 (2)错。改为:2,2,5-三甲基-4-乙基己烷 (3)正确 (4)错。改为:2,2-二甲基丁烷
第六章 不饱和烃 6-1 命名下列各化合物。 (CH 3)2CHCH 2 CH 2 CH 3 CH 2CH(CH 3)2 C C H 3C H C CH 2 H H 3CH 2CH 3 H CH 3 1 2 3 4 5 6 7 8 9 12 34 5 6 78 C C C 25 H 3C C 3)3 C C 2H 5 2,4-二甲基-1-戊烯 3-异丁基环已烯(E )-1,3-戊二烯(S )-6-甲基-1,3-环辛二烯(3R ,4Z )-3,6-二甲基-5-丙基-4-壬烯 (E )-3-甲基-4-叔丁基-3-辛烯-5-炔 1 2 3 4 5 (1)(2) (3) (4)(5)(6) (2)也可命名为:3-(2-甲基丙基)环已烯 6-2 按要求比较反应活性。 (1)B >C >A ; (2)A >B >C >D >E ; (3)A >C >B >D ; (4)B >A >C >D . 6-3 将下列各组碳正离子按稳定性由大到小排列成序。 (1)B →A →C →D ; (2)A →C →B 。 (3)C →D → B →A 6-4 指出下列分子中各存在哪些类型的共轭体系? (1)、(3)和(4)都是p-π共轭体系;(2)π-π和p-π共轭体系。 (1)和(4)还有π-σ和p-σ超共轭。 6-5下列各对结构式是构造异构体系还是共振结构关系? (1)构造异构体; (2)、(3)和(4)共振结构。 6-6 下列各组极限结构式,哪一个极限结构对共振杂化体的贡献较大? (1) B 式(负电荷处在电负性较大的O 上比处在C 上稳定) ; (2) B 式(B 式中所有原子均有完整的价电子层,而在A 式中+C 上没有完整的价电子层); (3)A 式(A 式的正离子为三级碳正离子,正电荷较分散)。 6-7 将下列烯烃按稳定性由大至小排列。 稳定性由大至小顺序为:(2)→(4)→(1)→(3) 反式烯烃比顺式烯烃稳定,内烯烃比端烯烃稳定,双键上取代基多的烯烃比取代基少的烯烃稳定。 6-8查阅并比较(Z )-2-丁烯与(E )-2-丁烯;(Z )-1,2-二氯乙烯与(E )-1,2-二氯乙烯的熔沸点、偶极矩,说明结 构与熔沸点的关系。 经查阅(见下表),题中所给的二组顺反异构体中,Z 型的皆有一定偶极矩,是极性分子,分子间作用较大,因而沸点比E 型的高;而E 型的偶极矩为0,是非极性分子,但对称性较好,有对称中心。熔点比Z 型的高。
化学系基础有机化学实验竞赛试题 1.提纯固体有机化合物不能使用的方法有:( A) A.蒸馏;B.升华;C.重结晶;D.色谱分离; 2.重结晶提纯有机化合物时,一般杂质含量不超过:( B ) A.10%;B.5%;C.15%;D.0.5%; 3.重结晶提纯有机化合物脱色时,活性炭用量不超过:( B ) A.10%;B.5%;C.15%;D.0.5%; 4.重结晶时的不溶性杂质是在哪一步被除去的? ( B ) A.制备过饱和溶液;B.热过滤;C.冷却结晶;D.抽气过滤的母液中; 5.用混合溶剂重结晶时,要求两种溶剂;( C) A.不互溶;B.部分互溶;C.互溶; 6.测熔点时,若样品管熔封不严或加热速度过快,将使所测样品的熔点分别比实际熔点:( B ) A.偏高,偏高;B.偏低,偏高;C.偏高,不变;D.偏高,偏低; 7.如果一个物质具有固定的沸点,则该化合物:( B ) A.一定是纯化合物;B.不一定是纯化合物;C.不是纯化合物; 8.微量法测定沸点时,样品的沸点为:( B ) A.内管下端出现大量气泡时的温度;B.内管中气泡停止外逸,液体刚要进入内管时的温度;C.内管下端出现第一个气泡时的温度; 9.利用折光率能否鉴定未知化合物? ( A ) A.能;B.不能;C.不一定; 10.下面哪种干燥剂不适用于干燥N,N,N’,N’-四甲基乙二胺:( CD ) A.MgSO4;B.CaH2;C.P2O5;D.CaCl2; 11.用下列溶剂萃取水溶液时,哪种有机溶剂将在下层? ( BD ) A.二氯甲烷;B.乙醚;C.乙酸乙酯;D.石油醚; 12.乙醇中含有少量水,达到分离提纯目的可采用:( C ) A.蒸馏;B.无水硫酸镁;C.P2O5;D.金属钠; 13.搅拌器在下列何种情况下必须使用:( B ) A.均相反应;B.非均相反应;C.所有反应 14.乙酸乙酯制备实验中,馏出液用饱和碳酸钠溶液洗涤后用饱和食盐水洗涤的作用是除去:( A ) A.碳酸钠;B.乙酸;C.硫酸;D.乙醇 15.手册中常见的符号n D20,mp和bp分别代表:( B ) A.密度,熔点和沸点;B.折光率,熔点和沸点;C.密度,折光率和沸点;D.折光率,密度和沸点 1.遇到酸烧伤时,首先立即用( 大量水洗),再用3-5%的( 碳酸氢钠) 洗,然后涂烫伤膏。 2.顺-丁烯二酸在水中的溶解度比反-丁烯二酸( 大),因为前者( 极性大)。 3.固体化合物中可熔性杂质的存在,将导致化合物的熔点(降低),熔程( 增长)。 4.在两种或两种以上的液体混合物的沸点彼此接近时,可以利用( 分馏),的方法来进行分离,并利用( 沸点-组成曲线or相图)来测定各馏分的组成。 5.在加热蒸馏中忘记加沸石,应先将体系( 冷却),再加入沸石;中途因故停止蒸馏后,重新加热蒸馏时要( 补加)沸石。 6.减压蒸馏装置包括蒸馏、( 减压)、( 检测) 和保护四个部分,为防止损坏抽气泵,保护部分常使用氯化钙、氢氧化钠、石蜡等干燥塔,它们的功能分别是:( 吸收水分)、( 吸收酸性气体)、和( 吸收烃类溶剂)。
第五章饱和烃 5-1 写出符合下列条件的C7H16的构造式,并各以系统命名法命名。 (1)庚烷(3)3-甲基已烷 (4)2,2-二甲基戊烷(5)2,3-二甲基戊烷(6)2,4-二甲基戊烷 (7)3,3-二甲基戊烷(8)3-乙基戊烷(9)2,2,3-三甲基丁烷 5-2 写出下列烷基的名称及常用缩写符号。 (1)甲基(Me—);(2)乙基(Et—);(3)正丙基(n-Pr—);(4)异丙基(i-Pr—);(5)正丁基(n-Bu—);(6)异丁基(i-Bu—);(7)仲丁基(s-Bu—); (8)叔丁基(t-Bu—)。 5-3 比较下列化合物沸点的高低,并说明原因。 (1) CH3(CH2)4CH3(2) (CH3)2CH(CH2)2CH3 (3)CH3CH2C(CH3)3(4) CH3CH2CH(CH3)CH2CH3 (1)>(4) >(2)>(3)同碳数的烷烃异构体,含支链越多,分子间作用力越弱,沸点越低。 5-4 完成下列反应式: OSO3 H Br Br Br (1) HO2C(CH2)4CO2H HNO3 + (2)
Br Br -60℃ Br 2 +(3) CH(CH 3) 2 CO 2H 2O Cl +Cl Cl Cl 碳正离子重排导致的产物 ++ CH(CH 3)2Br C(CH 3)2Br + (4)Br HBr (5) 5-5 比较下列化合物构象的稳定性大小。 1,4-二甲基环已烷的构象稳定性(1)<(2)。原因是(1)中的二个甲基均处于a 键上,而(2)中的二个甲基则皆处于e 键上,后者构象能量较低,较稳定。 3 H 3 3 CH 3 CH 3 H 3C CH 3 (1) (2) 5-6 下列异构体中哪个最稳定? 题目所示二甲基环已酮三个异构体对应的构象式如下,从中可看出(3)最稳定,因为其两个甲基均处于e 键上,体系能量较低。 O O O (1) (2)(3) 5-7 环丙烷内能高是由哪些因素造成的? 环丙烷分子中碳原子为不等性sp 3杂化,轨道重叠比开链烷烃的小,形成的碳碳共价键键能小(即有角张力),容易断裂,不如开链烷烃牢固;其次是环丙烷的三个碳原子共平面,
第十三章官能团的合成 13.1 烷烃的合成方法 13.1.1 卤代烃和金属有机化合物的偶联反应 13.1.1.1 Corey-House反应,制备新的、较大碳架的重要方法 其中,R=伯,仲,叔烷基或其它烃基 X=Cl,Br,I R’=伯烷基,为了获得较多产率,R’X应用伯卤代烷 例: 13.1.1.2 Wiirtz反应合成高级且对称的烷烃 ●其中:R=烷基,X=Cl,Br或I 例: 13.1.2 烯烃或炔烃的还原
是合成烷烃的重要方法,特别是烯烃的还原,需要使用催化剂,一般为镍,钯或铂作催化剂 例: 13.1.3 卤代烷的还原 X=F,Cl,Br,I 13.1.3.1 使用Grigrard试剂 其中:R=伯,仲或叔烷基;X=Cl,Br,I 例: 13.1.3.2 使用LiAlH4
R,X同前 例: 13.1.3.3 使用LiBH4-LiH的混合物 例: 例1:选择少于或等于4个碳原子得有机化合物合成: 分析:目标分子是具有五个碳原子的开链烷烃,原料最多只能含四个碳,因此需考虑添加碳原子。选择怎样得R2CuLi和R’X来获得目标分子,一般通过对目标分子进行切割(一般在分支上进行)来选择,有两种方式A,B。用A法的合成路线如下: 例2:
答: 13.2 烯烃的合成13.2.1 卤代烃脱卤代氢 其中:X=Cl,Br或I ●产物符合扎伊采夫规则 例: 13.2.2 醇脱水 其中酸=H2SO4,H3PO4,Al2O3等 ●产物符合扎伊采夫规则 例:
13.2.3邻二卤代烃脱卤素 其中:X=Cl,Br,I 邻二卤代烃是由烯烃加成而得,故用此反应合成烯烃并无意义,此反应主要用于保护双键例: 13.2.4 炔烃的还原 a.催化还原 其中:Cat=Pd/c (Lindlar cat.)或Ni-B(P-2cat) ●主要得到顺式烯烃 例:
考试科目:2013-2014第一学期有机实验试题 一、填空题(每空1分,共10分) 1、蒸馏是有机化学实验中常用的分离提纯方法,要求混合物的沸点差至少大于()。蒸馏时,盛混合物的烧瓶中,液体体积应小于()。当产品沸点高于140℃,应该采用()冷凝管。 2、蒸馏时,如果馏出液易受潮分解,可以在接受器上连接一个(),以防止()的侵入 3、进行蒸馏时至少要准备两个接收瓶,因为在达到预期物质的沸点之前会有沸点较低的液体先蒸出,这部分液体称为() 4、在蒸馏装置中,温度计水银球的位置()。 5、比移值是指()的比值。 6.分馏操作中,液泛现象是指(),回流比是指()。 二、选择题(每小题2分,共20分)。 1、在使用分液漏斗进行分液时,下面正确的做法是() A.分离液体时,分液漏斗上的小孔未于大气相通就打开旋塞。 B.分离液体时,将漏斗拿在手中进行分离。 C.上层液体经漏斗的上面的口放出 D. 将两层间存在的絮状物放出。 2、低沸点液体蒸馏时 (如溴乙烷),除了与一般蒸馏操相同以外,还要强调的是() A、都有一处通大气 B、接受器用冰水浴冷却 C、要加沸石 D、不能用明火加热 3.重结晶的常压热过滤常用的仪器是( )。 A、有颈漏斗 B、热滤漏斗 C、玻璃丁漏斗 D、布氏漏斗 4、乙酸乙酯中含有()杂质时,可用简单蒸馏的方法提纯乙酸乙酯。 A.正丁醇 B.有色有机杂质 C.乙酸 D.水. 5. 在重结晶时,下面操作正确的是() A.为避免热滤时晶体析出,可以加过量50%-100%的溶剂 B.为了节省时间,溶液处于沸腾状态下,不需冷却,就可加入活性炭脱色 C.活性炭可以一开始就加入 D.溶剂的用量是根据溶解度计算量多加20-30% 6、当加热后已有馏分出来时才发现冷凝管没有通水,应该() A、立即停止加热,待冷凝管冷却后,通入冷凝水,再重新加热蒸馏。 B、小心通入冷凝水,继续蒸馏。 C、先小心通入温水,然后改用冷凝水,继续蒸馏。 D、继续蒸馏操作。 7、水蒸气蒸馏结束时,应该先() A、停止通水 B、停止加热 C、停止接收产品 D、打开T形管螺旋夹 8、用薄层色谱分离混合物时,下列溶剂洗脱能力最强的是() A、乙酸 B、乙醇 C、乙酸乙酯 D、石油醚
一、填空题。(每空1分,共20分) 1、将液体加热至沸腾,使液体变为蒸气,然后使蒸气冷却再凝结为液体,这两个过程的联合操作称为()。 2、减压蒸馏装置中蒸馏部分由()、()、()、()及()、()等组成。 3、熔点是指(),熔程是指(),通常纯的有机化合物都有固定熔点,若混有杂质则熔点(),熔程()。 4、()是纯化固体化合物的一种手段,它可除去与被提纯物质的蒸汽间有显著差异的不挥发性杂质。 5、按色谱法的分离原理,常用的柱色谱可分为()和()两种。 6、芳胺的酰化在有机合成中有着重要的作用,主要体现在()以及()两个方面。 7、采用重结晶提纯样品,要求杂质含量为()以下,如果杂质含量太高,可先用(),()方法提纯。 8、在从天然物槐花米中提取芦丁,提取液中加入生石灰可以()芦丁,加入盐酸可以沉淀芦丁。二、选择题。(每空2分,共20分) 1、常用的分馏柱有()。A、球形分馏柱 B、韦氏(Vigreux)分馏柱 C、填充式分馏柱 D、直形分馏柱 2、水蒸气蒸馏应用于分离和纯化时其分离对象的适用范围为()。A、从大量树脂状杂质或不挥发性杂质中分离有机物B、从挥发性杂质中分离有机物C、从液体多的反应混合物中分离固体产物 3、在色谱中,吸附剂对样品的吸附能力与()有关。A、吸附剂的含水量 B、吸附剂的粒度 C、洗脱溶剂的极性 D、洗脱溶剂的流速 4、环己酮的氧化所采用的氧化剂为() A、硝酸 B、高锰酸钾 C、重铬酸钾5.1)卤代烃中含有少量水()。2)醇中含有少量水()。3)甲苯和四氯化碳混合物()。 4)含3%杂质肉桂酸固体()。A、蒸馏 B、分液漏斗 C、重结晶 D、金属钠 E、无水氯化钙干燥 F、无水硫酸镁干燥 G、P2O5 H、NaSO4干燥 6、重结晶时,活性炭所起的作用是()。A、脱色 B、脱水 C、促进结晶 D、脱脂 7、正丁醚合成实验是通过()装置来提高产品产量的?A、熔点管 B、分液漏斗 C、分水器 D、脂肪提取器 三、判断题。(每题1分,共10分) 1、液体的蒸气压只与温度有关。即液体在一定温度下具有一定的蒸气压。() 2、在蒸馏低沸点液体时,选用长颈蒸馏瓶;而蒸馏高沸点液体时,选用短颈蒸馏瓶。() 3、薄层色谱可用于化合物纯度的鉴定,有机反应的监控,不能用于化合物的分离。() 4、化合物的比移值是化合物特有的常数。() 5、重结晶实验中,加入活性碳的目的是脱色。() 6、在进行正丁醚的合成中,加入浓硫酸后要充分搅拌。() 7、在使用分液漏斗进行分液时,上层液体经漏斗的下口放出。() 8、纯净的有机化合物一般都有固定的熔点。() 9、微量法测定沸点时,当毛细管中有一连串气泡放出时的温度即为该物质的沸点。() 10、硫酸洗涤正溴丁烷粗品,目的是除去未反应的正丁醇及副产物1-丁烯和正丁醚。() 四、实验装置图。(每题10分,共20分)1、请指出以下装置中的错误之处?并画出正确的装置。 2、画出柱层析装置示意图,并简述实验的基本操作过程和注意事项。五、简答题。(每题6分,共30分) 1、简述减压蒸馏操作的理论依据。当减压蒸馏结束时,应如何停止减压蒸馏?为什么?() 2、什么叫共沸物?为什么不能用分馏法分离共沸混合物? 3、在乙酰苯胺的制备过程中,为什么是冰醋酸过量而不是
第十三章羧酸衍生 物 1.说明下列名词。 酯、油脂、皂化值、干性油、碘值、非离子型洗涤剂、阴离子型洗涤剂、不对称合成。 1. 解: 醇与酸(含无机酸和有机酸)相互作用得到的失水产物叫做酯。例如,乙醇和乙酸作用失去1分子水的产物是乙酸乙酯;乙醇和浓硫酸作用失去1分子水的产物是硫酸 氢乙酯(C 2H 5 OSO 2 OH)。 油脂是高级脂肪酸的甘油酯。
通常存在于自然界的动植物体,而且,其中的脂肪酸通常是10个以上双数碳原子的混合酸。 1g 油脂完全皂化所需氢氧化钾的质量(单位 mg)称为皂化值。他是测定油脂中脂肪酸含量的1种参考数据。 具有在空气中很快变成1层干硬而有弹性膜特性的含有共轭双键脂肪酸的油脂称为干性油。 100g 油脂所能吸收碘的质量(单位 g)称为碘值,它是决定油脂不饱和程度高低的重要指标。 与肥皂结构和作用相类似,但在水中不解离的1种中性非离子的
分子状态或胶束状态的1类合成洗涤剂称为非离子型洗涤剂。2.试用反应式表示下列化合物的合成路线。 (1)由氯丙烷合成丁酰胺;(2)由丁酰胺合成丙胺;(3)由邻氯苯酚、光气、甲胺合成农药“害扑威” Cl OCONHCH3 解: (1) CH3CH2CH2Mg/Et2O 3 CH2CH21) CO2 2 + CH3CH2CH2CO2H 1) NH3 3 CH2CH2CONH2 (2) CH3CH2CH2CONH NaOH/Br2 CH3CH2CH2NH2 Cl OH + O Cl Cl Cl O C Cl CH3NH2 Cl OCONHCH3 (3) 路线1
Cl OH +O Cl Cl CH 3NH Cl OCONHCH 3 路线2 C N H 3C 3.用简单的反应来区别下列各组化合物。 (1) CH 3CH(Cl)COOH 和CH 3CH 2COCl (2) 丙酸乙酯和丙酰胺 (3)CH 3COOC 2H 5和CH 3CH 2COCl (4)CH 3COONH 4和CH 3CONH 2 (5) (CH 3CO)2O 和CH 3COOC 2H 5 解: CH 3CH 2COCl C H 3 无白色沉淀 (白) (1) CH 3CH 2CONH 2 C H 3 CH 2COOCH 2CH 2CH 无NH 3(2) NH 3
高中有机化学实验题(一) 1.实验室制取乙烯的反应原理为CH3CH2OH CH2===CH2↑+H2O, 反应时,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫。 试回答下列问题: (1)图中①②③④装置盛放的试剂分别是(填标号):①________,②________,③________, ④________。 A.品红溶液B.NaOH溶液C.浓硫酸D.酸性高锰酸钾溶液 (2)能说明SO2存在的现象是______________________________________________。 (3)使用装置②的目的是________________________________________________。 (4)使用装置③的目的是__________________________________________________。 (5)确证乙烯存在的现象是____ _______________。 2.实验室制取硝基苯,应选用浓硫酸、浓硝酸在55℃~60℃条件下生成。 (1)实验时选用的加热方式是() A.酒精灯直接加热B.热水浴加热C.酒精喷灯加热 (2)选择该种加热方式的优点是_____________________________________。 3.已知下表数据: (1)写出该反应的化学反应式。 (2)按装置图安装好仪器后,在大试管中配制好体积比为3︰2的乙醇和乙酸,加热至沸腾,很久也没有果香味液体生成,原因是。 (3)根据上表数据分析,为什么乙醇需要过量一些,其原因是。 按正确操作重新实验,该学生很快在小试管中收集到了乙酸乙酯、乙酸、乙醇的混合物。现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。