
晶体的类型与性质
本单元知识概要
【学习目标】
1. 了解离子晶体、分子晶体、原子晶体、金属晶体的结构和性质。
2. 理解组成晶体的粒子间相互作用及其与晶体性质之间的相互关系。
3. 掌握晶体类型的判断方法。
4. 借助数学方法,培养空间想象能力。
【知识概要】
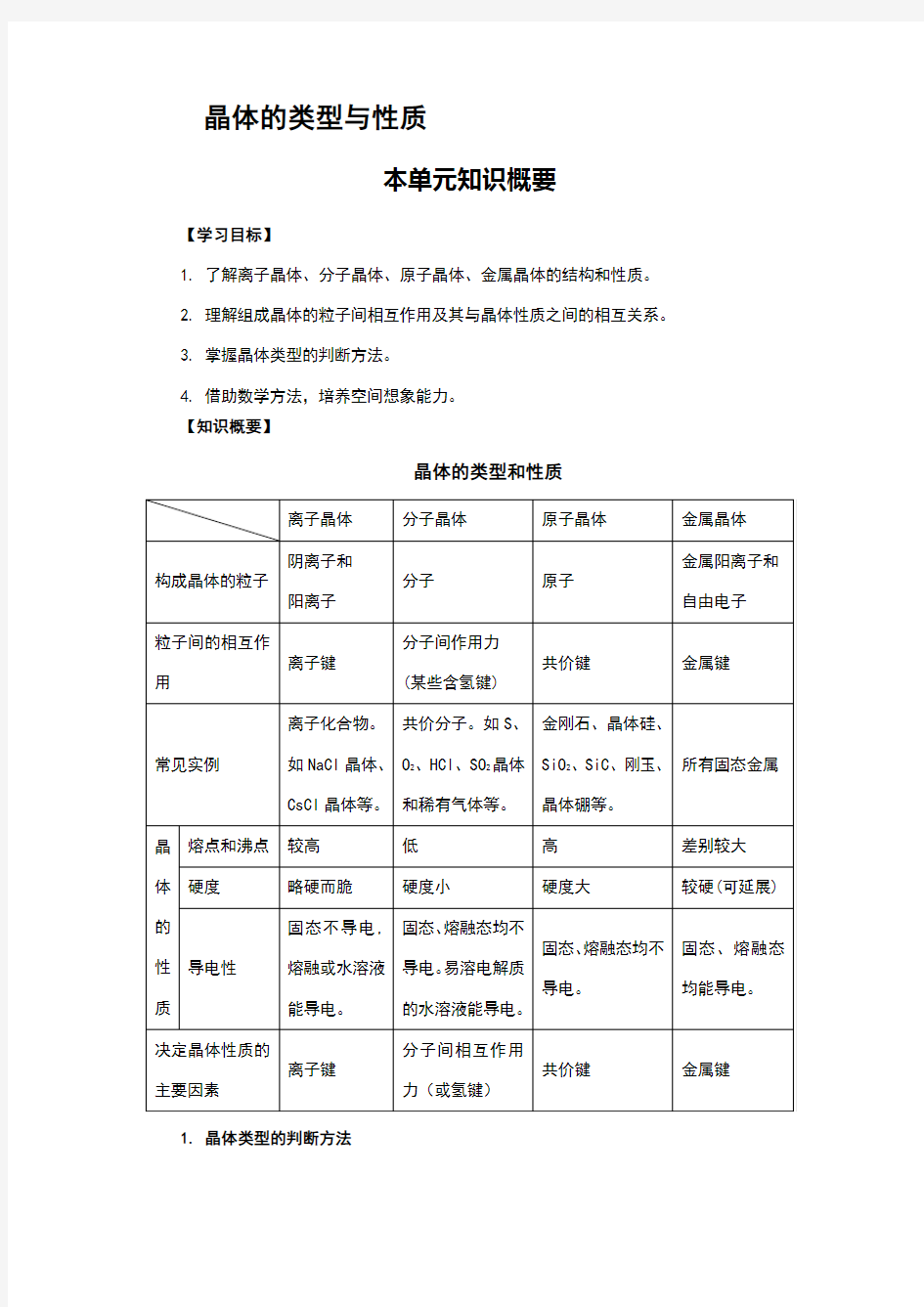
晶体的类型和性质
1. 晶体类型的判断方法
⑴依据组成晶体的粒子和粒子间的相互作用判断
离子晶体的组成粒子是阴、阳离子,粒子间的相互作用是离子键;原子晶体的组成粒子是原子,粒子间的相互作用是共价键;分子晶体的组成粒子是分子,粒子间的相互作用是分子间作用力(即范德瓦耳斯力);金属晶体的组成粒子是金属阳离子和自由电子,粒子间的相互作用是金属键。
(2) 依据物质的分类判断
金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类(AlCl3除外)是离子晶体。大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除S i O2外)、酸、绝大多数有机物(除有机盐外)、稀有气体的固态是分子晶体。常见的原子晶体单质有金刚石、晶体硅、晶体硼等;常见的原子晶体化合物有碳化硅、二氧化硅、刚玉等。常温下,金属单质(汞除外)与合金都是金属晶体。
(3) 依据晶体的熔点判断
离子晶体的熔点较高,常在数百至1000余度。原子晶体的熔点最高,常在1000度至几千度。分子晶体的熔点低,常在数百度以下至很低温度。多数金属晶体的熔点高,但也有相当低的(如汞)。
⑷依据导电性判断
离子晶体在水溶液中及熔化时都能导电。原子晶体一般为非导体,不能导电。分子晶体为非导体,固态、液态均不导电,但分子晶体中的电解质(主要是酸和典型非金属氢化物)溶于水,使分子内的化学键断裂形成自由离子,故溶液能导电,金属晶体是电的良导体,能导电。
⑸依据硬度和机械性能判断
离子晶体硬度较大或略硬而脆。原子晶体硬度大。分子晶体硬度小且较脆。金属晶体多数硬度大,但也有较低的,且具有延展性。
2. 晶体熔、沸点高低的比较方法
⑴离子晶体
一般地讲,化学式与结构相似的离子晶体,阴、阳离子半径越小,所带电荷越多,离子键越强,熔、沸点越高,如:NaCl>KCl>CsCl。
⑵ 原子晶体
键长(成键原子半径之和)越短,键能越大,共价键越强,熔、沸点越高。如:金刚石>
碳化硅>晶体硅。
⑶ 分子晶体
组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔、沸点越高,
如:I 2>Br 2>Cl 2>F 2;H 2Te>H 2Se>H 2S 。但具有氢键的分子晶体,如:NH 3、H 2O 、HF 等熔、沸点
反常地高。绝大多数有机物属于分子晶体,其熔、沸点遵循以下规律:
① 组成和结构相似的有机物(同系物),随相对分子质量增大,其熔、沸点升高,如:
CH 4 ② 链烃及其衍生物的同分异构体,其支链越多,熔、沸点越低,如CH 3(CH 2)3CH 3> CH 3 CH 2CH(CH 3)2>(CH 3)4C ;芳香烃的异构体有两个取代基时,熔、沸点按邻、间、对位降低。如: > > ③ 在高级脂肪酸和油脂中,不饱和程度越大,熔、沸点越低。例如: C 17H 35COOH >C 17H 33COOH ;(C 17H 35COO)3C 3H 5>(C 17H 33COO)3C 3H 5。 ⑷ 金属晶体 在同类金属晶体中,金属离子半径越小,阳离子所带的电负荷数越多,金属键越强,熔、 沸点越高,如:Li >Na >K >Rb >Cs ,合金的熔点低于它的各成分金属的熔点,如Al >Mg > 铝镁合金。 ⑸ 不同类型的晶体 一般是原子晶体的熔、沸点最高,分子晶体的熔、沸点最低,离子晶体的熔、沸点较高, 大多数金属晶体的熔、沸点较高,如:金刚石>氧化镁;铁>水。 应注意离子晶体、原子晶体、分子晶体、金属晶体熔化时,化学键不被破坏的只有分子 晶体,分子晶体熔化时,被破坏的是分子间作用力。 第一节 离子晶体、分子晶体和原子晶体 CH 3CH 3CH 3 CH 3 CH 3CH 3 例题 例1下列每组物质发生状态变化时,所克服的粒子间相互作用属于同种类型的是( ) A. 食盐和蔗糖熔化 B. 二氧化硅和硫熔化 C. 碘和干冰升华 D. 二氧化硅和氧化钠熔化 解析食盐是离子晶体,状态变化时所克服的是离子键;蔗糖、硫、碘、干冰都是分子晶体,状态变化时所克服的是分子间作用力;二氧化硅是原子晶体,状态变化时所克服的是共价键。 【答案】C 例2 根据以下两组事实材料,回答下列问题: 材料一: 材料二: (1)钠的卤化物熔点的变化规律是 _______ ,卤素单质的熔点变化规律是 ___________ 。依据所学物理、化学原理对上述规律加以合理的解释。 (2)金刚石、晶体硅、二氧化硅、碳化硅的熔点按从高到低的顺序排列为___________ ____。依据所学化学原理对上述规律加以合理的解释 _ 。 解析(1)由材料一可知:钠的卤化物熔点由NaF到NaI逐渐降低;卤素单质的熔点由F2到I2逐渐增高。由材料二可知;金刚石、晶体硅、二氧化硅、碳化硅的熔点按从高到低的顺序排列为:金刚石>二氧化硅>碳化硅>晶体硅。(2)物质由固态变成液态(或气态)时, 必须吸收能量克服粒子间的相互作用,粒子间的相互作用越强,表现为固体物质的熔点越高。离子键的实质是静电相互作用,根据库仑定律:2 21r Q Q k F =,离子半径越小,带电荷越多,离子键越强,离子晶体的熔点越高。分子间作用力的强弱决定分子晶体熔点的高低。结构相 似,相对分子质量越大,分子间作用力越强,表现为分子晶体的熔点越高。对原子晶体来说, 熔化时必须克服共价键,因此,共价键的强弱决定原子晶体熔点的高低。键长(成键两原子 半径之和)越短,共价键越强,表现为原子晶体的熔点越高。 【答案】(1)由NaF 到NaI 逐渐降低 由F 2到I 2逐渐增高 钠的卤化物属于离子晶 体,由F - 到I - 所带电荷数相等、半径逐渐增大,离子键由NaF 到NaI 逐渐减弱,故它们 的熔点逐渐降低;卤素的单质属于分子晶体,它们的结构相似,由F 2到I 2相对分子质量逐 渐增大,分子间作用力逐渐增强,故它们的熔点逐渐增高 (2)金刚石>二氧化硅>碳化 硅>晶体硅 金刚石、晶体硅、二氧化硅、碳化硅都属于原子晶体,键长(原子半径之和): Si —Si >C —Si >Si —O >C —C ,共价键逐渐增强,所以,晶体硅、碳化硅、二氧化硅、金刚 石的熔点逐渐升高。 例3 如下图所示,直线交点处的圆圈表示NaCl 晶体中Na + 或Cl - 所处的位置。这两 种离子在空间三个相互垂直的方向上都是等距离排列的。⑴ 请将 其中代表Na + 的圆圈涂黑(不必考虑体积大小),以完成NaCl 晶体 结构示意图。⑵ 晶体中,在每个Na + 的周围与它最接近的且距离 相等的Na + 共有______个。⑶ 晶体中每一个重复的结构单元叫晶 胞。在NaCl 晶胞中正六面体的顶点上、面上、棱上的Na + 或Cl - 为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl - 的个数等于______,即(填计算式)_____;Na + 的个数等于_____ 即(填计算式)_____________。 解析 ⑴ 由课本知识涂黑右图。⑵ 从体心Na + 看,与它最接近的 且距离相等的Na + 离子共有12个。⑶ 根据离子晶体的晶胞,求阴、阳 离子个数比的方法是:①处于顶点的离子,同时为8个晶胞共有,每个离 子有1/8属于晶胞;②处于棱上的离子,同时为4个晶胞共有,每个离子有1/4属于晶胞; ③处于面上的离子,同时为2个晶胞共有,每个离子有1/2属于晶胞;④处于晶胞内部(体 心)的离子,则完全属于该晶胞。由此可知,右图NaCl 晶胞中, 含Cl - 离子8×81 +6×2 1=4个,含Na + 离子;12×41+1=4个。 【答案】(1)右图 (2)12个 (3)8×81 +6× 21=4个、12×41+1=4个 练 习 一、填空题 1.下列七种晶体:A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G. 金刚石 (1)属于原子晶体的化合物是(填代号,下同)_________,直接由原子构成的晶体是 _________,直接由原子构成的分子晶体是_________。 (2)由极性分子构成的晶体是_________,含有共价键的离子晶体是_________,属于 分子晶体的单质是_________。 (3)在熔融状态下能导电的是_________。 2.下表是HX 晶体的熔点: 在HX 晶体中,HF 的熔点反常,比HCl 的熔点高,其原因为_________________________ ______________________________________________________________________________; HF 极易溶于水,在HX 的水溶液中,只有HF 是弱酸,其原因为_________________________ _______________________________________________________________________________ ;HX 的固态均属于_______晶体。 二、选择题(每小题有1个或2个选项符合题意) 1. 下列物质的晶体中不存在分子的是 ( ) A.二氧化碳 B. 二氧化硅 C. 二氯化镁 D. 二氧化硫 2. 下列有关晶体的叙述中错误的是 () A.离子晶体中一定存在离子键 B. 原子晶体中只存在共价键 C. 分子晶体中同时存在共价键和分子间相互作用力 D. 稀有气体的原子能形成分子晶体 3.氮化硅(Si3N4)是一种新型的耐高温耐磨材料,在工业上有广泛用途,它属于( ) A.分子晶体 B.原子晶体 C.离子晶体 D.离子化合物4.关于晶体的下列说法正确的是 () A. 在晶体中只要有阴离子就一定有阳离子 B.在晶体中只要有阳离子就一定有阴离子 C. 原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低 5.下列变化过程中,共价键被破坏的是() A. 碘晶体升华 B. HCl气体溶于水 C. 冰熔化 D. 金刚石熔化 6.下列各组物质中,按熔点由低到高的顺序排列的是 () A. CO2、KCl、SiO2 B. O2、I2、Hg C. NaCl、KCl、CsCl D. Cl2、Br2、I2 7.下列各物质的晶体中,化学键类型相同、晶体类型也相同的是() A. SO2和SiO2 B. CO2和H2O C. NaCl和HCl D. CCl4和KCl 8.下列性质中,能比较充分证明某晶体属于离子晶体的是 () A. 具有较高的熔点 B. 固体不导电,水溶液能导电 C. 固体不导电,熔融状态能导电 D. 固体、液体、均能导电 9.元素R是周期表中非金属性最强的元素,有关R的说法不正确的是 () A. R的单质在固态时以原子晶体存在 B. R的气态氢化物在固态或水溶液中均有氢键存在 C. R所在族元素的单质在固态时属于同一晶体类型 D. R元素的单质不可能用还原的方法制得 10. 根据下表几种物质的熔沸点数据判断下列说法错误的是() A. SiCl4是分子晶体 B. 单质B可能是原子晶体 C. AlCl3加热能升华 D. NaCl中键的强度比MgCl2中的小 三、问答题 1. 为什么乙醇极易溶于水 2. 为什么H2O比H2S的沸点高 第二节金属晶体 例题 例1下列说法正确的是() A. 金属的导电过程是物理变化 B. 晶体内有阳离子时必然有阴离子 C. Li、Na、K的熔、沸点依次升高、硬度依次增大 D. Na、Mg、Al的熔、沸点依次升高、硬度依次增大 解析金属的导电,实质是自由电子在外电场作用下作定向移动,未发生化学变化;离子晶体中既有阳离子又有阴离子,而金属晶体中只有阳离子和自由电子,没有阴离子;金属晶体的熔沸点、硬度由金属键强弱决定,金属离子所带的电荷数越高、离子半径越小,则金属键越强,金属晶体的熔沸点越高,硬度越大;Li、Na、K形成阳离子时所带电荷数相同,但离子半径依次增大,金属键依次减弱,所以,Li、Na、K的熔沸点依次降低、硬度依次减弱;Na、Mg、Al形成阳离子时所带电荷数依次增大,离子半径依次减小,金属键依次增强,所以,Na、Mg、Al的熔、沸点依次升高,硬度依次增大。 【答案】AD 例2根据实验室测定硫酸铜晶体结晶水含量的实验,请填空: (1)从下列仪器中选取所需要的仪器(用标号字母填写)______________________。 a. 托盘天平(带砝码) b. 研钵 c. 试管夹 d. 酒精灯 e. 蒸发皿 f. 玻璃棒 g. 坩锅 h. 干燥器 i. 石棉网 j. 三脚架 除上述仪器外,还需要的仪器是。 (2)某同学通过实验,得到以下数据: 请写出结晶水含量(x %)的计算表达式_________________________________。 该同学测定的结果偏高还是偏低_________。 从下列分析中选出该同学产生误差的原因可能是(填写字母) 。 A. 加热前称量时容器未完全干燥 B. 最后两次加热后的质量相差较大(大 于 g) C. 加热后容器未放入干燥器中冷却 D. 加热过程中有少量晶体溅失 解析 硫酸铜晶体中结晶水含量的理论值为:%36%100g 250g 90%=?=x ;实验测得硫酸铜晶体中结晶水含量的实验值为:%44%100g 4.5g 9.7g 8.6g 9.7%=?--=x 。故该同学测定的 结果偏高。导致误差偏高的原因分析如下: A. 加热前称量时容器未干燥,加热后水蒸发,被算成结晶水,故结果偏高; B. 最后两次加热后的质量相差大于 g ,说明灼烧不充分,故结晶水含量偏低; C. 加热后没有放在干燥器中冷却,冷却过程中又吸收空气中的水蒸气,质量变大, 故 结晶水含量偏高; D. 加热过程中晶体溅失,质量变小,错误当成了脱去的结晶水,故结晶水含量偏高。 【答案】(1) a 、b 、d 、f 、g 、h 、j 坩锅钳、泥三角、药匙 (2)%100123 2?--W W W W 偏高 ACD 。 练 习 一、选择题(每小题有1个或2个选项符合题意) 1. 金属的下列性质中,不能用金属晶体结构加以解释的是 ( ) A. 易导电 B. 易导热 C. 有延展性 D. 易腐蚀 2. 金属晶体的形成是因为晶体中存在 ( ) A. 金属原子间的相互作用 B. 金属原子与自由电子间的相互作用 C. 金属离子间的相互作用 D. 金属离子与自由电子间的相互作用 3. 能正确描述金属通性的是 () A. 具有金属光泽 B. 易导电、导热 C. 具有较高的熔点、沸点 D. 具有强还原性 4. 下列有关金属的说法正确的是 () A. 碳族元素中,既含有金属元素,又含有非金属元素,金属单质的熔点一定比非金属 单质的熔点高 B. 一般说来,金属晶体的熔、沸点比分子晶体的熔、沸点高 C. 金属单质在常温常压下都是固体 D. 同主族金属元素的单质,其熔、沸点从上到下依次升高 5. 下列物质在晶体状态下还能导电的是() A. 氯化钠 B. 金属铷 C. 金刚石 D. 干冰 6. 在固态、液态均能导电的晶体是 () A. 离子晶体 B. 原子晶体 C. 分子晶体 D. 金属晶体 7. 镁铝两元素相比较,铝具有 () A. 较小的硬度 B. 较低的熔点 C. 较弱的还原性 D. 较小的离子半径 8. 下列比较关系正确的是 ( ) A. 熔点:K>Rb>Cs B. 熔点:Ba>Mg>Ca C. 硬度:Na>Mg>Al D. 硬度:Al>Mg>Na 9. 金属导电的原因是 () A. 金属晶体中金属阳离子和自由电子间的相互作用较弱 B. 金属晶体中的自由电子在外电场作用下可发生定向移动 C. 金属晶体中的阳离子在外电场作用下可发生定向移动 D. 金属晶体在外电场作用下可失去电子 10. X和Y两元素的质子数之和为30,X原子的核外电子数比Y原子的核外电子数少4,下列说法不正确的是() A. X的单质在固态时属于金属晶体 B. Y的单质在固态时属于原子晶体 C. X和Y形成的化合物在固态时属于分子晶体 D. Y与碳元素组成的化合物中Y—C的夹角为90° 二、填空题 某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的质量分数,采用以下实验步骤进行测定: ①准确称量m g样品(2 g ~3 g范围内); ②向样品中加入10 mL 6 mol·L-1盐酸,再加入蒸馏水,配成250 mL溶液; ③量取25 mL操作②中的溶液,加入3 mL溴水,加热使之反应完全; ④趁热加入10 % 氨水至过量,充分搅拌,使沉淀完全; ⑤过滤,将沉淀洗净、灼烧、冷却、称重,反复操作至恒重。 请根据上面描述回答: (1)在称量样品时,若称量前天平的指针偏向标尺的左方,称量读数时指针刚好在标 尺的零点上,则称得样品的质量 (填编号),使测定结果 (偏高、偏低、无影响)。 A. 比m g多 B. 比m g少 C. 恰好m g (2)加入溴水后,发生反应的离子方程式是:________________________________。 (3)加氨水要过量的原因是:_______________________________________________。 (4)为了检验沉淀是否洗净,方法是:。 (5)若坩埚质量是W1 g,坩埚与灼烧后的固体的总质量是W2 g,则样品中铁元素的质量分数是:______________。 综合例题 例1已知有关物质的熔、沸点数据如下表: 请参考以上数据回答下列问题: 1.工业上常用电解熔融MgCl2的方法生产金属镁,电解熔融Al2O3与冰晶石熔融混合物的方法生产金属铝。 (1)为什么不用电解熔融MgO的方法生产镁 答:_____________________________________________________________________。 (2)为什么不用电解熔融AlCl3的方法生产铝 答:_____________________________________________________________________。 2.设计简单可靠的实验证明MgO和AlCl3所属的晶体类型,其实验方法是: 。 解析 1. 因为MgO的熔点远高于MgCl2的熔点,所以,电解熔融MgO将需要更高的温度,消耗更多的能源,操作也不方便;依据表中数据,AlCl3易升华,熔、沸点低,故属于分子晶体,熔融时不能导电,所以,不能电解。2. 将MgCl2和AlCl3晶体加热至熔融状态,作导电实验,能导电的是MgCl2,属于离子晶体;不能导电的是AlCl3,属于分子晶体。 【答案】1. (1) MgO 的熔点远高于MgCl 2的熔点,所以,电解熔融MgO 将需要更高的 温度,消耗更多的能源,操作也不方便 (2)AlCl 3属于分子晶体,熔融时不能导电,所 以,不能电解 2. 将MgCl 2和AlCl 3晶体加热至熔融状态,作导电实验,能导电的是MgCl 2, 属于离子晶体;不能导电的是AlCl 3,属于分子晶体 例2 石墨是层状晶体,每一层内碳原子排列成正六边形(如图): 一个个正六边形延伸排列成平面网状结构。如果将每对相邻的碳原子间的化学键视为一 个化学键,则石墨晶体每一层内碳原子数与C —C 键数之比为( ) A. 1:1 B. 1:2 C. 1:3 D. 2:3 解析 以 为结构单元,则每个碳原子同时为三个正六边形所共有,所以,每个正六 边形实际拥有的碳原子数为:23 16=? ,而正六边形的每个边(即化学键数)被两个正六边形共同拥有,故每个正六边形实际拥有的边数(即化学键数)为:3216=?。 所以,碳原子数:化学键数= 2:3。 【答案】D 例3 已知晶体硼的基本结构单元是由硼原子组成的正十二面体结构 (如图所示),其中有二十个等边三角形的面和一定数目的顶点,每个顶点 各有一个硼原子。根据图形推算得出此基本结构单元是由 个硼原子 构成。其中B —B 键的键角为_________。 解析 因为正十二面体有20个等边三角形形成的面,而等边三角 形的边都是由两个三角形所共用,故此多面体的棱边数为:20×3×2 1= 30。又设此多面体的顶点数(即硼原子数)为x ,因为每个顶点连有5条棱边,每个棱边为两个顶点所共有, 故多面体的棱边数为:x ×5×2 1= 30,解得x = 12。键角为等边三角形的内角,即60°。 … ∞ 硼晶体结构 【答案】12个 60° 第一单元检测题 一、选择题(每小题有1个或2个选项符合题意) 1. 下列各类物质在固态时,只能形成离子晶体的是 ( ) A. 强碱 B. 强酸 C. 金属单质 D. 非金属单质 2. 下列晶体中,属于原子晶体的化合物是 () A. 氢氧化钠 B. 干冰 C. 水晶 D. 晶体硅 3. 下列物质属于分子晶体的化合物是 () A. 水晶 B. 硫磺 C. 干冰 D. 食盐 4. 实现下列变化时,需要克服相同类型的相互作用的是 () A. 水晶和干冰的熔化 B. 食盐和冰醋酸的熔化 C. 液溴和液汞的汽化 D. 纯碱和烧碱的熔化 5. 氮化硅是一种超硬、耐磨、耐高温的新型合成材料。下列各组物质熔化时所克服的粒子间相互作用与氮化硅熔化时所克服的粒子间相互作用相同的是() A. KNO3和金刚石 B. 晶体硅和水晶 C. 冰和干冰 D. 萘和蒽 6. 下列物质的晶体结构是正四面体结构,且键角不是109°28′的是 ( ) A. 氨气 B. 金刚石 C. 白磷 D. 甲烷 7. 如果分子间作用力为a kJ·mol-1化学键为b kJ·mol-1,则两者的大小关系正确的是 () A. a>b B. a C. a=b D. 无法确定 8. 下列性质符合于离子晶体的是 () A. 熔点1071 ℃,易溶于水,水溶液和熔融状态时均能导电 B. 能溶于CS2,熔点℃,沸点℃ C. 熔点℃,液态时不能导电,水溶液能导电 D. 熔点℃,质软,导电,密度g·mL-1 9. 在下列各组物质的晶体中,化学键的类型和晶体类型都相同的是() A. SO2和SiO2 B. NaCl和HCl C. SiC和Cu D. 苯和CCl4 10. 下列各组物质中,按熔点由低到高的顺序排列的是() A. Na、Mg、Al B. CO2、KCl、SiO2 C. Na、K、Rb D. SiC、金刚石、Si 11. 下列物质的熔点由高到低排列,错误的是 () A. 金刚石>硅>碳化硅 B. Li>Na>K>Rb C. NaCl>KCl>RbCl>CsCl D. F2>Cl2>Br2>I2 12. 科学家用激光将置于铁室中的石墨炸松,再用射频火花喷射氮气,此时碳氮原子结合成碳氮化合物薄膜,这种化合物可能比金刚石更坚硬,其原因可能是() Ca O Ti 钙钛矿晶体 A. 碳氮原子构成具有空间网状结构的晶体 B. 碳氮原子间的键比金刚石中C—C更短 C. 氮原子最外层电子数比碳原子最外层电子数多 D. 碳、氮原子单质的化学性质都不活泼 13. 右图为超导领域里的一种化合物——钙钛矿晶体结 构,该结构是具有代表性的最小重复单元(即晶胞),该晶体结构中元素氧、钛、钙的物质的量之比是() A. 3:1:1 B. 1:3:1 C. 8:3:1 D. 1:2:1 14. 下列物质的熔点高低顺序排列正确的是 () A. 金刚石>生铁>纯铁>钠 B. Mg>Ca>Ba C. HI>HBr>HCl>HF D. 金刚石>晶体硅>二氧化硅>碳化硅 15. 下列说法正确的是 ( ) A. 由非金属元素构成的化合物一定是分子晶体 B. 含有极性键的化合物一定属于分子晶体 C. 只要是离子晶体,其熔点一定比分子晶体高 D. 含有离子键的化合物一定属于离子晶体 16. 下列说法中错误的是 ( ) A. 离子晶体中可能含有共价键 B. 分子晶体中肯定不含离子键 C. 分子晶体中一定含有共价键 D. 原子晶体中肯定含有非极性共价键 二、填空题 1. 在金刚石的空间网状结构中,含有由共价键形成的碳原子封闭环,其中最小的封闭碳原子环上有____个碳原子,任意两个C—C键之间的角都是________,每个碳原子同时被___个封闭碳原子环所共用。 2. 在金属铁、单质碘、氟化钾、氯化铵、晶体硅五种物质的晶体中,属于原子晶体的是____________,属于分子晶体的是___________,属于离子晶体的是____________________,属于金属晶体的是_____________。 3. 固体氯化钠是_____晶体。每个钠离子周围有___个氯离子,每个氯离子周围有___个钠离子;钠离子的半径______(大于、小于、等于)氯离子的半径。M元素与钠元素同主族,属于第六周期,则在MCl晶体中,每个M离子周围有____个氯离子,每个氯离子周围有个____M+离子。MCl的电子式为___________,固态时___导电,熔融态时____导电。 4. 依据下表提供的实验数据回答下列问题: (1)钠的卤化物的熔点变化规律是:__________________________________,其理论解释为:__________________________________________________________________________ _______________________________________________________________________________;碱金属的氯化物的熔点变化规律是:___________________________,其理论解释为:_____ _______________________________________________________________________________ _ _____________________________;硅的卤化物的熔点变化规律是:, 其理论解释为:__________________________________________________________________ _______________________________________________________________________。 (2)碱金属的氯化物熔点比硅的卤化物的熔点高得多,其原因是___________________ __________________________。 5.下图代表一些晶体的结构,它们分别是氯化钠、氯化铯、干冰、金刚石结构中的一部分。 请回答下列问题: (1)其中代表金刚石的是(填字母编号,下同)____,其中每个碳原子与_____个碳原子最近且距离相等,金刚石属于______晶体,其中C —C 键的夹角为_________。 (2)其中代表氯化钠的是_____,其中每个钠离子周围与它最接近且距离相等的氯离子有_____个,氯化钠属于________晶体。 (3)其中代表干冰的是____,干冰属于____晶体,组成干冰晶体的作用力是__________,CO 2分子内部的作用力是_____,干冰汽化时克服的相互作用是____________。 (4)其中代表氯化铯的是_____,其中每个铯离子周围与它最接近且距离相等的氯离子有_____个,氯化钠属于________晶体。 D A C B B A C