
在25Mpa压力下,液体中的溶解氧是多少?
就是水,里面加了一些杀菌剂和防腐剂,不过时间长了,可能已经被氧化掉了
你可以按照水的溶解度计算
补充回答:氧在水中的溶解度和溶解氧值是两个既相区别而又相联系的概念。氧在水中的溶解度指的是水体和大气处于平衡时氧的最大溶解浓度,它的数值与温度、压力、水中溶质量等因素有关。水中溶解氧值则一般是指非平衡状态下的水中溶解氧的浓度。
它的数值与水体曝气作用、光合作用、呼吸作用及水中有机污染物的氧化作用等因素有关。这两个概念之间的差异是由于大气和水体界面间氧气传质动力过程较慢而引起的。
①氧在水中的溶解度
若已知当25℃下水蒸气在空气中含量为0.0313摩尔分数以及干空气中含20.95%O2时,则可应用道尔顿分压定律和亨利定律算出标准条件下氧在水中溶解度[O2(aq)]:[O2(aq)]=Ko2·po2=1.28×10-8×(1.0000-0.0313)0×1.013×105×O.2095
=2.63×10-4mol/L(相当于8.4mg/L)
由(4-2)式可导出在定压条件下温度对氧气在水中溶解度影响的关系式:
式中C1和C2——分别为绝对温度T1和T2下气体在水中溶解度(mg/L);
△H——溶解热(J/mol);
R——气体常数(8.314J/K·mol)。
压力对氧气在水中溶解度的影响可用下列公式表述:
式中C1和C2——分别为标准气压和P2气压下氧气在水中的溶解度(mg/L);
p——确定温度下饱和水蒸气的压力(p和P2的单位为帕)。
P:25℃水饱和蒸汽压为3.169×103Pa
C1:=2.63×10-4mol/L(相当于8.4mg/L)N2:8.93×10-4mol/L
C2:现在增压罐压力0.8MPa,即8.0×105Pa,
计算得:C2=21.356×10-4moL/L=0.1367g/L=0.0478L/L,约100L水溶解4.78L氧气计算得:C2=72.51×10-4moL/L=0.203g/L=0.1624L/L,约100L水溶解16.24L氮气
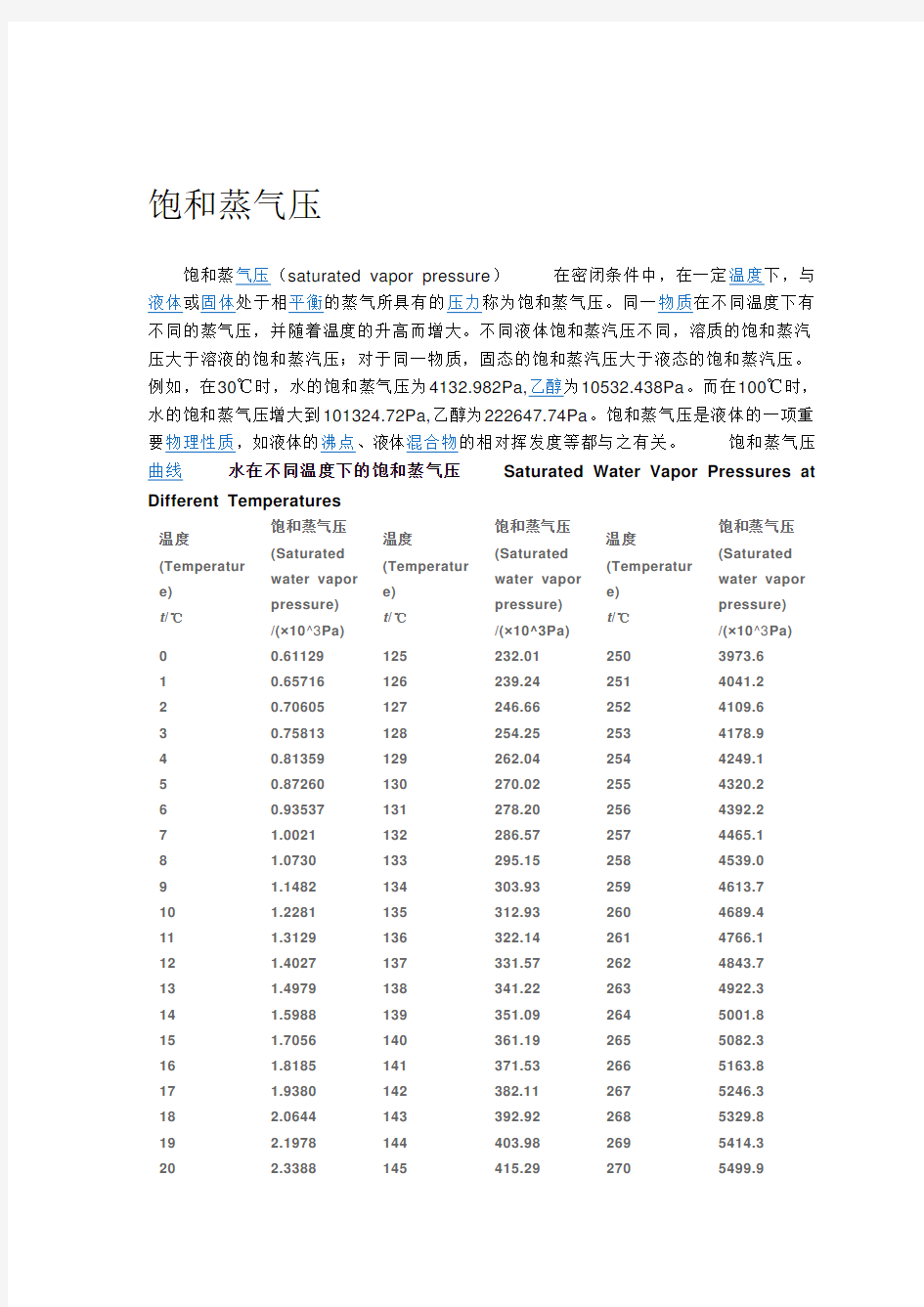
饱和蒸气压
饱和蒸气压(saturated vapor pressure)在密闭条件中,在一定温度下,与液体或固体处于相平衡的蒸气所具有的压力称为饱和蒸气压。同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸汽压不同,溶质的饱和蒸汽压大于溶液的饱和蒸汽压;对于同一物质,固态的饱和蒸汽压大于液态的饱和蒸汽压。例如,在30℃时,水的饱和蒸气压为4132.982Pa,乙醇为10532.438Pa。而在100℃时,水的饱和蒸气压增大到101324.72Pa,乙醇为222647.74Pa。饱和蒸气压是液体的一项重要物理性质,如液体的沸点、液体混合物的相对挥发度等都与之有关。饱和蒸气压曲线水在不同温度下的饱和蒸气压Saturated Water Vapor Pressures at Different Temperatures
温度(Temperatur e)
t/℃饱和蒸气压
(Saturated
water vapor
pressure)
/(×10^3Pa)
温度
(Temperatur
e)
t/℃
饱和蒸气压
(Saturated
water vapor
pressure)
/(×10^3Pa)
温度
(Temperatur
e)
t/℃
饱和蒸气压
(Saturated
water vapor
pressure)
/(×10^3Pa)
00.61129125232.012503973.6 10.65716126239.242514041.2 20.70605127246.662524109.6 30.75813128254.252534178.9 40.81359129262.042544249.1 50.87260130270.022554320.2 60.93537131278.202564392.2
7 1.0021132286.572574465.1
8 1.0730133295.152584539.0
9 1.1482134303.932594613.7
10 1.2281135312.932604689.4
11 1.3129136322.142614766.1
12 1.4027137331.572624843.7
13 1.4979138341.222634922.3
14 1.5988139351.092645001.8
15 1.7056140361.192655082.3
16 1.8185141371.532665163.8
17 1.9380142382.112675246.3
18 2.0644143392.922685329.8
19 2.1978144403.982695414.3
20 2.3388145415.292705499.9
21 2.4877146426.852715586.4
22 2.6447147438.672725674.0
23 2.8104148450.752735762.7
24 2.9850149463.102745852.4
25 3.1690150475.722755943.1
26 3.3629151488.612766035.0
27 3.5670152501.782776127.9
28 3.7818153515.232786221.9
29 4.0078154528.962796317.2
30 4.2455155542.992806413.2
31 4.4953156557.322816510.5
32 4.7578157571.942826608.9
33 5.0335158586.872836708.5
34 5.3229159602.112846809.2
35 5.6267160617.662856911.1
36 5.9453161633.532867014.1
37 6.2795162649.732877118.3
38 6.6298163666.252887223.7
39 6.9969164683.102897330.2 407.3814165700.292907438.0 417.7840166717.832917547.0 428.2054167735.702927657.2 438.6463168753.942937768.6 449.1075169772.522947881.3 459.5898170791.472957995.2 4610.094171810.782968110.3 4710.620172830.472978226.8 4811.171173850.532988344.5 4911.745174870.982998463.5 5012.344175891.803008583.8 5112.970176913.033018705.4 5213.623177934.643028828.3 5314.303178956.663038952.6 5415.012179979.093049078.2 5515.7521801001.93059205.1 5616.5221811025.23069333.4 5717.3241821048.93079463.1 5818.1591831073.03089594.2 5919.028*******.53099726.7 6019.9321851122.53109860.5 6120.8731861147.93119995.8 6221.8511871173.831210133 6322.8681881200.131310271
6423.9251891226.131410410 6525.022*******.231510551 6626.1631911281.931610694 6727.3471921310.131710838 6828.5761931338.831810984 6929.852*******.031911131 7031.1761951397.632011279 7132.5491961427.832111429 7233.9721971458.532211581 7335.4481981489.732311734 7436.9781991521.432411889 7538.5632001553.632512046 7640.2052011568.432612204 7741.9052021619.732712364 7843.6652031653.632812525 7945.4872041688.032912688 8047.3732051722.933012852 8149.3242061758.433113019 8251.3422071794.533213187 8353.4282081831.133313357 8455.5852091868.433413528 8557.8152101906.233513701 8660.1192111944.633613876 8762.4992121983.633714053 8864.9582132023.233814232 8967.4962142063.433914412 9070.1172152104.234014594 9172.8232162145.734114778 9275.6142172187.834214964 9378.4942182230.534315152 9481.4652192273.834415342 9584.5292202317.834515533 9687.6882212362.534615727 9790.9452222407.834715922 9894.3012232453.834816120 9997.7592242500.534916320 100101.322252547.935016521 101104.992262595.935116825 102108.772272644.635216932 103112.662282694.135317138 104116.672292744.235417348 105120.792302795.135517561 106125.032312846.735617775
107129.392322899.035717992 108133.882332952.135818211 109138.502343005.935918432 110143.242353060.436018655 111148.122363115.736118881 112153.132373171.836219110 113158.292383288.636319340 114163.582393286.336419574 115169.022403344.736519809 116174.612413403.936620048 117180.342423463.936720289 118186.232433524.736820533 119192.282443586.336920780 120198.482453648.837021030 121204.852463712.137121286 122211.382473776.237221539 123218.092483841.237321803 124224.962493907.0--
饱和蒸气压 编辑[bǎo hézhēng qìyā] 在密闭条件中,在一定温度下,与固体或液体处于相平衡的蒸气所具有的压力称为饱和蒸气 压。同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸气 压不同,溶剂的饱和蒸气压大于溶液的饱和蒸气压;对于同一物质,固态的饱和蒸气压小于 液态的饱和蒸气压。 目录 1定义 2计算公式 3附录 ?计算参数 ?水在不同温度下的饱和蒸气压 1定义编辑 饱和蒸气压(saturated vapor pressure) 例如,在30℃时,水的饱和蒸气压为4132.982Pa,乙醇为10532.438Pa。而在100℃时,水的 饱和蒸气压增大到101324.72Pa,乙醇为222647.74Pa。饱和蒸气压是液体的一项重要物理性 质,液体的沸点、液体混合物的相对挥发度等都与之有关。 2计算公式编辑 (1)Clausius-Claperon方程:d lnp/d(1/T)=-H(v)/(R*Z(v)) 式中p为蒸气压;H(v)为蒸发潜热;Z(v)为饱和蒸汽压缩因子与饱和液体压缩因子之差。 该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2)Clapeyron 方程: 若上式中H(v)/(R*Z(v))为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron方 程:ln p=A-B/T 式中B=H(v)/(R*Z(v))。 (3)Antoine方程:lg p=A-B/(T+C) 式中,A,B,C为Antoine常数,可查数据表。Antoine方程是对Clausius-Clapeyron方程最 简单的改进,在1.333~199.98kPa范围内误差小。 3附录编辑 计算参数 在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公 式如下 lgP=A-B/(t+C)(1) 式中:P—物质的蒸气压,毫米汞柱; t—温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2) 公式进行计算 lgP=-52.23B/T+C (2) 式中:P—物质的蒸气压,毫米汞柱; 表1 不同物质的蒸气压 名称分子式范围(℃) A B C 1,1,2-三氯乙烷C2H3Cl3 \ 6.85189 1262.570 205.170 1,1,2一三氯乙烯C2HCl3 \ 7.02808 1315.040 230.000 1,2一丁二烯C4H6 -60~+80 7.16190 1121.000 251.000
水蒸气是一种离液态较近的气体,在空气处理中应用广泛,易获得污染小。以实践经验总结出的数据图表作为计算依据 饱和水蒸气压力温度密度表 温度 (t) 压力 (P) 密度(ρ) 温度 (t) 压力 (P) 密度(ρ) ℃ MPa kg/m3 ℃ MPa kg/m3 100 128 101 129 102 130 103 131 104 132 105 133 106 134 107 135 108 136 109 137 110 138 111 139 112 140 113 141 114 142 115 143 116 144 117 145 118 146 119 147
120 148 121 149 122 150 123 151 124 152 125 153 126 154 127 155 温度 (t) 压力 (P) 密度(ρ) 温度 (t) 压力 (P) 密度(ρ)℃ MP a kg/m3 ℃ MPa kg/m3 156 184 157 185 158 186 159 187 160 188 161 189 162 190 163 191 164 192 165 193 166 194 167 195 168 196 169 197 170 198 171 199
174 202 175 203 176 204 177 205 178 206 179 207 180 208 181 209 182 210 183 211 温度 (t) 压力 (P) 密度(ρ) 温度 (t) 压力 (P) 密度(ρ)℃ MPa kg/m3 ℃ MPa kg/m3 212 231 213 232 214 233 215 234 216 235 217 236 218 237 219 238 220 239 221 240 222 241 223 242
水在不同温度下的饱和 蒸气压 Document number:WTWYT-WYWY-BTGTT-YTTYU-2018GT
饱和蒸(saturatedvaporpressure) 在密闭条件中,在一定下,与或处于相的蒸气所具有的称为饱和蒸气压。同一在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸汽压不同,溶剂的饱和蒸汽压大于溶液的饱和蒸汽压;对于同一物质,固态的饱和蒸汽压小于液态的饱和蒸汽压。例如,在30℃时,水的饱和蒸气压为,为。而在100℃时,水的饱和蒸气压增大到,乙醇为。饱和蒸气压是液体的一项重要,如液体的、液体的相对挥发度等都与之有关。 饱和蒸气压 水在不同温度下的饱和蒸气压 SaturatedWaterVaporPressuresatDifferentTemperatures
饱和蒸汽压公式 (1)Clausius-Claperon方程:dlnp/d(1/T)=-H(v)/(R*Z(v)) 式中p为蒸汽压;H(v)为蒸发潜热;Z(v)为饱和蒸汽压缩因子与饱和液体压缩因子之差。 该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2)Clapeyron方程: 若上式中H(v)/(R*Z(v))为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron方程:lnp=A-B/T 式中B=H(v)/(R*Z(v))。 (3)Antoine方程:lnp=A-B/(T+C) 式中,A,B,C为Antoine常数,可查数据表。Antoine方程是对Clausius-Clapeyron方程最简单的改进,在~范围内误差小。 附录 在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公式如下 lgP=A-B/(t+C)(1) 式中:P—物质的蒸气压,毫米汞柱; t—温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2)公式进行计算 lgP=T+C(2) 式中:P—物质的蒸气压,毫米汞柱; 表1不同物质的蒸气压 名称分子式范围(℃)ABC 银Ag1650~1950公式(2) 氯化银AgCl1255~1442公式(2)三氯化铝AlCl370~190公式(2)氧化铝Al2O31840~2200公式(2)
饱和蒸气压(saturated vapor pressure) 在密闭条件中,在一定温度下,与液体或固体处于相平衡的蒸气所具有的压力称为饱和蒸气压。同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸汽压不同,溶剂的饱和蒸汽压大于溶液的饱和蒸汽压;对于同一物质,固态的饱和蒸汽压小于液态的饱和蒸汽压。例如,在30℃时,水的饱和蒸气压为,乙醇为。而在100℃时,水的饱和蒸气压增大到,乙醇为。饱和蒸气压是液体的一项重要物理性质,如液体的沸点、液体混合物的相对挥发度等都与之有关。 饱和蒸气压曲线 水在不同温度下的饱和蒸气压 Saturated Water Vapor Pressures at Different Temperatures
编辑本段饱和蒸汽压公式 (1)Clausius-Claperon方程:d lnp/d(1/T)=-H(v)/(R*Z(v)) 式中p为蒸汽压;H(v)为蒸发潜热;Z(v)为饱和蒸汽压缩因子与饱和液体压缩因子之差。 该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2)Clapeyron 方程: 若上式中H(v)/(R*Z(v))为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron 方程:ln p=A-B/T 式中B=H(v)/(R*Z(v))。 (3)Antoine方程:ln p=A-B/(T+C) 式中,A,B,C为Antoine常数,可查数据表。Antoine方程是对Clausius-Clapeyron方
程最简单的改进,在~范围内误差小。 编辑本段附录 在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公式如下 lgP=A-B/(t+C)(1) 式中:P—物质的蒸气压,毫米汞柱; t—温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2)公式进行计算 lgP=T+C (2) 式中:P—物质的蒸气压,毫米汞柱; 表1 不同物质的蒸气压 名称分子式范围(℃) A B C 银Ag 1650~1950 公式(2)250 氯化银AgCl 1255~1442 公式(2) 三氯化铝AlCl3 70~190 公式(2)115 氧化铝Al2O3 1840~2200 公式(2)540 砷As 440~815 公式(2)133 砷As 800~860 公式(2) 三氧化二砷As2O3 100~310 公式(2) 三氧化二砷As2O3 315~490 公式(2) 氩Ar ~ 公式(2) 金Au 2315~2500 公式(2)385 三氯化硼BCl3 …… 钡Ba 930~1130 公式(2)350 铋Bi 1210~1420 公式(2)200 溴Br2 …… 碳 C 3880~4430 公式(2)540 二氧化碳CO2 …… 二硫化碳CS2 -10~+160 一氧化碳CO -210~-160 四氯化碳CCl4 …… 钙Ca 500~700 公式(2)195 钙960~1100 公式(2)370 镉Cd 150~ 公式(2)109 镉500~840 公式(2) 氯Cl2 (240) 二氧化氯ClO2 -59~+11 公式(2) 钴Co 2374 公式(2)309 铯Cs 200~230 公式(2) 铜Cu 2100~2310 公式(2)468 氯化亚铜Cu2Cl2 878~1369 公式(2) 铁Fe 2220~2450 公式(2)309 氯化亚铁FeCl2 700~930 公式(2)
饱和水蒸气压表
二、Wexler的饱和水汽压表 温度℃.0 .1 .2 .3 .4 .5 .6 .7 .8 .9 变化率Pa Pa Pa Pa Pa Pa Pa Pa Pa Pa Pa/度 0 611.213 615.667 610.158 624.662 629.203 633.774 638.373 643.003 647.662 652.350 44.400 1 567.069 661.819 666.598 671.408 676.249 681.121 686.024 690.958 695.923 700.920 47.340 2 705.949 911.010 716.10 3 721.228 726.386 731.576 736.799 742.055 747.34 4 752.667 50.448 3 758.023 763.412 768.836 774.29 4 779.786 785.312 790.873 796.469 802.100 807.766 53.729 4 813.467 819.204 824.977 830.786 836.631 842.512 848.429 854.384 860.37 5 866.403 57.192 5 872.469 878.572 884.713 890.892 897.109 903.364 909.658 915.991 922.362 928.773 60.845 6 935.223 941.712 948.241 954.810 961.419 968.069 974.759 981.490 988.262 995.075 64.969 7 1001.93 1008.83 1005.76 1022.74 1029.77 1036.069 974.759 981.490 988.262 1065.52 68.75 8 1072.80 1080.13 1087.50 1094.91 1102.37 1109.87 1117.42 1125.01 1132.65 1140.33 73.03 9 1148.06 1155.84 1163.66 1171.53 1179.45 1187.41 1195.42 1203.48 1211.58 1219.74 77.53 10 1227.94 1236.19 1244.49 1252.84 1261.24 1269.68 1278.18 1286.73 1295.33 1303.97 82.26 11 1312.67 1321.42 1330.22 1339.08 1347.98 1356.94 1365.95 1375.01 1384.12 1393.29 87.24
水蒸气压和相对湿度的计算公式 要求水蒸气压和相对湿度时,虽然最好用通风乾湿计,但也可采用不通风乾湿计。由乾湿计计算水 蒸气压和相对湿度的公式为: 1. 从通风乾湿计的度数计算水蒸气压: (1)湿球不结冰时 e =E’w–0.5(t-t’)P/755 (2)湿球结冰时 e =E’i –0.44(t-t’)P/755 式中, t:乾球读数(oC) t’:湿球读数(oC) E’w:t’(oC)的水饱和蒸气压 E’i:t’(oC)的冰饱和蒸气压 e:所求水蒸气压 P:大气压力 2. 从不通风乾湿计的度数计算水蒸气压: (1)湿球不结冰时 e=E’ w-0.0008P(t-t’) (2)湿球结冰时 e=E’ i-0.0007P(t-t’) 此处所用符号的意义同上。压力单位都统一用mmHg或mb。 3.求相对湿度: H=e/Ew×100 式中H为所求相对湿度(%),Ew为t(oC)的饱和蒸气压(即使在0oC以下时也不使用Ei)。
水的蒸气压 水和所有其它液体一样,其分子在不断运动着,其中有少数分子因为动能较大,足以冲破表面张力的影响而进入空间,成为蒸气分子,这种现象称为蒸发。液面上的蒸气分子也可能被液面分子吸引或受外界压力抵抗而回入液体中,这种现象称为凝聚。如将液体置于密闭容器内,起初,当空间没有蒸气分子时,蒸发速率比较大,随着液面上蒸气分子逐渐增多,凝聚的速率也随之加快。这样蒸发和凝聚的速率逐渐趋于相等,即在单位时间内,液体变为蒸气的分子数和蒸气变为液体的分子数相等,这时即达到平衡状态,蒸发和凝聚这一对矛盾达到暂时的相对统一。当达到平衡时,蒸发和凝聚这两个过程仍在进行,只是两个相反过程进行的速率相等而已。平衡应理解为运态的平衡,绝不意味着物质运动的停止。 与液态平衡的蒸气称为饱和蒸气。饱和蒸气所产生的压力称为饱和蒸气压。每种液体在一定温度下,其饱和蒸气压是一个常数,温度升高饱和蒸气压也增大。水的饱和蒸气压和温度的关系列于表中。 表水的蒸气压和温度的关系
水的饱和蒸汽压与温度对应表 蒸气压蒸气压指的是在液体(或者固体)的表面存在着该物质的蒸气,这些蒸气对液体表面产生的压强就是该液体的蒸气压。比如,水的表面就有水蒸气压,当水的蒸气压达到水面上的气体总压的时候,水就沸腾。我们通常看到水烧开,就是在100摄氏度时水的蒸气压等于一个大气压。蒸气压随温度变化而变化,温度越高,蒸气压越大,当然还和液体种类有关。一定的温度下,与同种物质的液态(或固态)处于平衡状态的蒸气所产生的压强叫饱和蒸气压,它随温度升高而增加。如:放在杯子里的水,会因不断蒸发变得愈来愈少。如果把纯水放在一个密闭的容器里,并抽走上方的空气。当水不断蒸发时,水面上方气相的压力,即水的蒸气所具有的压力就不断增加。但是,当温度一定时,气相压力最终将稳定在一个固定的数值上,这时的气相压力称为水在该温度下的饱和蒸气压力。当气相压力的数值达到饱和蒸气压力的数值时,液相的水分子仍然不断地气化,气相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸气的冷凝速度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。所以,液态纯物质蒸气所具有的压力为其饱和蒸气压力时,气液两相即达到了相平衡。饱和蒸气压是物质的一个重要性质,它的大小取决于物质的本性和温度。饱和蒸气压越大,表示该物质越容易挥
发。 当气液或气固两相平衡时,气相中A物质的气压,就为液相或固相中A物质的饱和蒸气压,简称蒸气压。下面为影响因素: 1.对于放在真空容器中的液体,由于蒸发,液体分子不断进入气相,使气相压力变大,当两相平衡时气相压强就为该液体饱和蒸汽压,其也等于液相的外压;温度升高,液体分子能量更高,更易脱离液体的束缚进入气相,使饱和蒸气压变大。 2.但是一般液体都暴露在空气中,液相外压=蒸气压力+空气压力=101.325KPa),并假设空气不溶于这种液体,一般情况由于外压的增加,蒸气压变大(不过影响比较小) 3.一般讨论的蒸气压都为大量液体的蒸气压,但是当液体变为很小的液滴是,且液滴尺寸越小,由于表面张力而产生附加压力越大,而使蒸气压变高(这也是形成过热液体,过饱和溶液等亚稳态体系的原因)。所以蒸气压与温度,压力,物质特性,在表面化学中液面的曲率也有影响. 不同物质的蒸气压不同,下面总结给出水在不同温度下的饱和蒸气压:
There is a large number of saturation vapor pressure equations used to calculate the pressure of water vapor over a surface of liquid water or ice. This is a brief overview of the most important equations used. Several useful reviews of the existing vapor pressure curves are listed in the references. Please note the updated discussion of the WMO formulation. 1) Vapor Pressure over liquid water below 0°C ?Goff Gratch equation (Smithsonian Tables, 1984, after Goff and Gratch, 1946): Log10p w = -7.90298 (373.16/T-1) [1] + 5.02808 Log10(373.16/T) - 1.3816 10-7 (1011.344 (1-T/373.16)-1) + 8.1328 10-3 (10-3.49149 (373.16/T-1) -1) + Log10(1013.246) with T in [K] and p w in [hPa] ?WMO (Goff, 1957): Log10p w = 10.79574 (1-273.16/T)[2] - 5.02800 Log10(T/273.16) + 1.50475 10-4 (1 - 10(-8.2969*(T/273.16-1))) + 0.42873 10-3 (10(+4.76955*(1-273.16/T)) - 1) + 0.78614 with T in [K] and p w in [hPa] (Note: WMO based its recommendation on a paper by Goff (1957), which is shown here. The recommendation published by WMO (1988) has several typographical errors and cannot be used. A corrigendum (WMO, 2000) shows the term +0.42873 10-3 (10(-4.76955*(1-273.16/T)) - 1) in the fourth line compared to the original publication by Goff (1957). Note the different sign of the exponent. The earlier 1984 edition shows the correct formula.) ?Hyland and Wexler (Hyland and Wexler, 1983): Log p w = -0.58002206 104 / T [3] + 0.13914993 101
水的饱和蒸汽压与温度对应表 饱和蒸汽压力所对应的温度 压力/Mpa l/kg温度/℃汽化潜热 kJ/kg 汽化潜热 kca 0.1 99.634 2257.6 539.32 0.12 104.81 2243.9 536.05 0.14 109.318 2231.8 533.16 0.16 113.326 2220.9 530.55 0.18 116.941 2210.9 528.17 0.2 120.24 2201.7 525.97 0.25 127.444 2181.4 521.12 0.3 133.556 2163.7 516.89 0.35 138.891 2147.9 513.12 0.4 143.642 2133.6 509.7 0.5 151.867 2108.2 503.63 0.6 158.863 2086 498.33 0.7 164.983 2066 493.55 0.8 170.444 2047.7 489.18 0.9 175.389 2030.7 485.12 1 179.916 2014.8 481.32 1.1 184.1 1999.9 477.76 1.2 187.995 1985.7 474.37 1.3 191.644 197 2.1 471.12 1.4 195.078 1959.1 468.01 1.5 198.327 1946.6 465.03 1.6 201.41 1934.6 46 2.16 1.7 204.346 1923 459.39 1.8 207.151 1911.7 456.69 1.9 209.838 1900.7 454.06 2 212.417 1890 451.51 2.2 217.289 1869.4 446.58 2.4 221.829 1849.8 441.9 温度℃压力Kg/cm2 温度℃压力Kg/cm2 温度℃压力Kg/cm2 100 1.0332 118↓ 1.8995 136↓ 3.286 101 1.0707 119 1.9612 137 3.382 102 1.1092 120 2.0245 138 3.481 103 1.1489 121 2.0895 139 3.582 104 1.1898 122 2.1561 140 3.685 105 1.2318 123 2.2245 141 3.790 106 1.2751 124 2.2947 142 3.898 107 1.3196 125 2.3666 143 4.009 108 1.3654 126 2.4404 144 4.122 109 1.4125 127 2.5160 145 4.237
饱和蒸汽压
饱和蒸气压 编辑 [b ǎo h ézh ēng q ìy ā] 饱和蒸汽压即饱和蒸气压。 在密闭条件中,在一定温度下,与固体或液体处于相平衡的蒸气所具有的压力称为饱和蒸气压。同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸气压不同,溶剂的饱和蒸气压大于溶液的饱和蒸气压;对于同一物质,固态的饱和蒸气压小于液态的饱和蒸气压。 蒸汽压指的是在液体(或者固体)的表面存在着该物质的蒸汽,这些蒸汽对液体表面产生的压强就是该液体的蒸汽压。比如,水的表面就有水蒸汽压,当水的蒸汽压达到水面上的气体总压的时候,水就沸腾。我们通常看到水烧开,就是在100 摄氏度时水的蒸汽压等于一个大气压。蒸汽压随温度变化而变化,温度越高,蒸汽压越大,当然还和液体种类有关。一定的温度下,与同种物质的液态(或固态) 处于平衡状态的蒸汽所产生的压 强叫饱和蒸汽压,它随温度升高而增加。如:放在杯子里的水,会因不断蒸发变得愈来愈少。如果把纯水放在一个密闭的容器里,并抽走上方的空气。当水不断蒸发时,水面上方汽相的压力,即水的蒸汽所具有的压力就不断增加。但是,当温度一定时,汽相压力最终将稳定在一个固定的数值上,这时的汽相压力称为水在该温度下的饱和蒸汽压力。当汽相压力的数值达到饱和蒸汽压力的数值时,液相的水分子仍然不断地气化,汽相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸汽的冷凝速度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。所以,液态纯物质蒸汽所具有的压力为其饱和蒸汽压力时,汽液两相即达到了相平衡。饱和蒸汽压是物质的一个重要性质,它的大小取决于物质的本性和温度。饱和蒸汽压越大,表示该物质越容易挥发。 1 定义编辑 饱和蒸气压( saturated vapor pressure ) 例如,在30℃时,水的饱和蒸气压为4132.982Pa, 乙醇为10532.438Pa 。而在100 ℃时,水的饱和蒸气压增大到101324.72Pa, 乙醇为222647.74Pa 。饱和蒸气压是液体的一项重要物理性质,液体的沸点、液体混合物的相对挥发度等都与之有关。 2 计算公式编辑 (1) Clausius-Claperon 方程:d lnp/d(1/T)=-H(v)/(R*Z(v)) 式中p 为蒸气压;H(v) 为蒸发潜热;Z(v) 为饱和蒸汽压缩因子与饱和液体压缩因子之差。该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2) Clapeyron 方程: 若上式中H(v)/(R*Z(v)) 为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron 方程:ln p=A-B/T 式中B=H(v)/(R*Z(v)) 。 (3) Antoine 方程:lg p=A-B/(T+C) 式中,A,B,C 为Antoine 常数,可查数据表。Antoine 方程是对Clausius-Clapeyron 方程最简单的改进,在 1.333~199.98kPa 范围内误差小。 3 附录编辑 计算参数 在表 1 中给出了采用Antoine 公式计算不同物质在不同温度下蒸气压的常数A、 B 、C 。其公式如下 lgP=A-B/(t+C) ( 1) 式中:P —物质的蒸气压,毫米汞柱; t—温度,℃ 公式( 1)适用于大多数化合物;而对于另外一些只需常数 B 与 C 值的物质,则可采用( 2)公式进行计算 lgP=-52.23B/T+C ( 2 )
在表 1 中给出了采用Antoine 公式计算不同物质在不同温度下蒸气压 的常数A、B、C。其公式如下 lgP=A-B/(t+C)(1) 式中:P—物质的蒸气压,毫米汞柱; t —温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用 (2)公式进行计算 lgP=T+C (2) 式中:P—物质的蒸气压,毫米汞柱; 表 1 不同物质的蒸气压 名称分子式范围(℃) A B C 1,1,2- 三氯乙烷C2H3Cl3 1,1,2 一三氯乙烯C2HCl3 1,2 一丁二烯C4H6 -60 ~+80 1,3 一丁二烯C4H6 -80 ~+65 2- 甲基丙烯-1 C4H8 2- 甲基丁二烯-1,3 C5H8 -50 ~+95 α - 甲基綦C11H10 α - 萘酚C10H8O β- 甲基萘C11H10 β - 萘酚C10H8O 氨NH3 -83 ~+60 氨基甲酸乙酯C3H7O2N 钡Ba 930~1130 公式(2) 苯C6H6 苯胺C6H7N 苯酚C6H6O 苯甲醇C7H8O 20~113
苯甲醇 C7H8O 113~300 苯甲醚 C7H8O 苯甲酸C7H6O2 60~110 公式(2) 苯甲酸甲酯 C8H8O2 25~100 苯甲酸甲酯 C8H8O2 100~260 苯乙烯 C8H8 铋Bi 1210~1420 公式(2) 蓖C14H10 100~160 公式(2) 蓖 C14H10 223~342 公式(2) 蓖醌C14H3O2 224~286 公式(2) 蓖醌C14H3O2 285~370 公式(2) 丙酸C3H6O2 0~60 丙酸C3H6O2 60~185 丙酮C3H6O 丙烷C3H8 丙烯C3H6 丙烯腈C3H3N -20 ~+140 铂Pt 1425~1765 公式(2) 草酸C2H2O4 55~105 公式(2) 臭氧O3 醋酸甲酯C3H6O2 氮N2 -210 ~-180 碲化氢H2Te -46 ~0 公式(2) 碘I2 碘化钾KI 843~1028 公式(2) 碘化钾KI 1063~1333 公式(2) 碘化钠NaI 1063~1307 公式(2) 碘化氢HI -97 ~-51 公式(2) 碘化氢HI -50 ~-34 公式(2)
水的饱和蒸汽压与温度对应表 一、水的饱和蒸汽压与温度的关系 蒸汽压是一定外界条件下,液体中的液态分子会蒸发为气态分子,同时气态分子也会撞击液面回归液态。这是单组分系统发生的两相变化,一定时间后,即可达到平衡。平衡时,气态分子含量达到最大值,这些气态分子对液体产生的压强称为蒸气压。 水的表面就有水蒸气压,当水的蒸气压达到水面上的气体总压的时候,水就沸腾。我们通常看到水烧开,就是在100摄氏度时水的蒸气压等于一个大气压。蒸气压随温度变化而变化,温度越高,蒸气压越大,当然还和液体种类有关。 一定的温度下,与同种物质的液态(或固态)处于平衡状态的蒸气所产生的压强叫饱和蒸气压,它随温度升高而增加。如:放在杯子里的水,会因不断蒸发变得愈来愈少。如果把纯水放在一个密闭的容器里,并抽走上方的空气。当水不断蒸发时,水面上方气相的压力,即水的蒸气所具有的压力就不断增加。但是,当温度一定时,气相压力最终将稳定在一个固定的数值上,这时的气相压力称为水在该温度下的饱和蒸气压力。当气相压力的数值达到饱和蒸气压力的数值时,液相的水分子仍然不断地气化,气相的水分子也不断地
冷凝成液体,只是由于水的气化速度等于水蒸气的冷凝速度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。所以,液态纯物质蒸气所具有的压力为其饱和蒸气压力时,气液两相即达到了相平衡。饱和蒸气压是物质的一个重要性质,它的大小取决于物质的本性和温度。饱和蒸气压越大,表示该物质越容易挥发。 二、水的饱和蒸汽压与温度对应表 水的饱和蒸汽压与温度对应表
三、水的饱和蒸汽压与温度的换算公式 当10℃≤T≤168℃时,采用安托尼方程计算:lgP=7.07406-(1657.46/(T+227.02)) 式中:P——水在T温度时的饱和蒸汽压,kPa; T——水的温度,℃ 四、水的饱和蒸汽压曲线
饱和水气压 饱和是一种动态平衡态,在该状态下,气相中的水汽浓度或密度保持恒定。在整个湿度的换算过程中,对于饱和水蒸气压公式的 选取显得尤为重要,因此下面介绍几种常用的。 (1)、克拉柏龙-克劳修斯方程 该方程是以理论概念为基础的,表示物质相平衡的关系式,它把饱和蒸汽压随温度的变化、容积的变化和过程的热效应三者联系 起来。方程如下: T-为循环的温度;dT-为循环的温差;L-为热量,这里为汽化潜热(相变热);ν-为饱和蒸汽的比容;ν^-为液体的比容;e-为饱和 蒸汽压。 这就是著名的克拉柏龙-克劳修斯方程。该方程不但适用于水的汽化,也适用于冰的升华。当用于升华时,L为升华潜热。 (2)、卡末林-昂尼斯方程 实际的蒸汽和理想气体不同,原因在于气体分子本身具有体积,分子间存在吸引力。卡末林 - 昂尼斯气体状态方程考虑了这种 力的影响。卡末林-昂尼斯于1901年提出了状态方程的维里表达式(e表示水汽压)。 这些维里系数都可以通过实验测定,其中的第二和第三维里系数都已经有了普遍的计算公式。例如接近大气压力,温度在150K 到400K时,第二维里系数计算公式: 一般在我们所讨论的温度范围内,第四维里系数可以不予考虑。
(3)、Goff-Grattch 饱和水汽压公式 从1947年起,世界气象组织就推荐使用 Goff-Grattch 的水汽压方程。该方程是以后多年世界公认的最准确的公式。它包括两 个公式,一个用于液 - 汽平衡,另一个用于固 - 汽平衡。 对于水平面上的饱和水汽压 式中,T0为水三项点温度 273.16 K 对于冰面上的饱和水汽压 以上两式为 1966 年世界气象组织发布的国际气象用表所采用。 (4)、Wexler-Greenspan 水汽压公式 1971年,美国国家标准局的 Wexler 和 Greenspan 根据 25 ~ 100 ℃范围水面上饱和水汽压的精确测量数据,以克拉柏龙 一克劳修斯方程为基础,结合卡末林 - 昂尼斯方程,经过简单的数学运算并参照试验数据作了部分修正,导出了 0 ~100 ℃ 范 围内水面上的饱和水汽压的计算公式,该式的计算值与实验值基本符合。 式中常数项的个数 n 一般取 4 ~ 8 ,例如 n 为 4 时,各项系数为: C 0 =-0.60436117 × 10 4 、 C 1 =0.1893292601 × 10 2 、 C 2 =-0.28244925 × 10 -1 、C 3 =0.17250331 × 10 -4 、 C 4 =0.2858487 × 10
饱和蒸气压 编辑[bǎo hé zhēng qì yā] 在密闭条件中,在一定温度下,与固体或液体处于相平衡的蒸气所具有的压力称为饱和蒸气 压。同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸气 压不同,溶剂的饱和蒸气压大于溶液的饱和蒸气压;对于同一物质,固态的饱和蒸气压小于 液态的饱和蒸气压。 目录 1定义 2计算公式 3附录 ?计算参数 ?水在不同温度下的饱和蒸气压 1定义编辑 饱和蒸气压(saturated vapor pressure) 例如,在30℃时,水的饱和蒸气压为4132.982Pa,乙醇为10532.438Pa。而在100℃时,水 的饱和蒸气压增大到101324.72Pa,乙醇为222647.74Pa。饱和蒸气压是液体的一项重要物理 性质,液体的沸点、液体混合物的相对挥发度等都与之有关。 2计算公式编辑 (1)Clausius-Claperon方程:d lnp/d(1/T)=-H(v)/(R*Z(v)) 式中p为蒸气压;H(v)为蒸发潜热;Z(v)为饱和蒸汽压缩因子与饱和液体压缩因子之差。 该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2)Clapeyron 方程: 若上式中H(v)/(R*Z(v))为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron 方程:ln p=A-B/T 式中B=H(v)/(R*Z(v))。 (3)Antoine方程:lg p=A-B/(T+C) 式中,A,B,C为Antoine常数,可查数据表。Antoine方程是对Clausius-Clapeyron方程 最简单的改进,在1.333~199.98kPa范围内误差小。 3附录编辑 计算参数 在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公 式如下 lgP=A-B/(t+C) (1) 式中:P—物质的蒸气压,毫米汞柱; t—温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2) 公式进行计算 lgP=-52.23B/T+C (2) 式中:P—物质的蒸气压,毫米汞柱; 表1 不同物质的蒸气压 名称分子式范围(℃)A B C 1,1,2-三氯乙烷C2H3Cl3\ 6.851891262.570205.170 1,1,2一三氯乙烯C2HCl3\7.028081315.040230.000 1,2一丁二烯C4H6-60~+807.161901121.000251.000
饱和水蒸气压公式 饱和是一种动态平衡态,在该状态下,气相中的水汽浓度或密度保持恒定。在整个湿度的换算过程中,对于饱和水蒸气压公式的选取显得尤为重要,因此下面介绍几种常用的。 (1)、克拉柏龙-克劳修斯方程 该方程是以理论概念为基础的,表示物质相平衡的关系式,它把饱和蒸汽压随温度的变化、容积的变化和过程的热效应三者联系起来。方程如下: T-为循环的温度;dT-为循环的温差;L-为热量,这里为汽化潜热(相变热);ν-为饱和蒸汽的比容;ν^-为液体的比容;e-为饱和蒸汽压。 这就是著名的克拉柏龙-克劳修斯方程。该方程不但适用于水的汽化,也适用于冰的升华。当用于升华时,L为升华潜热。 (2)、卡末林-昂尼斯方程 实际的蒸汽和理想气体不同,原因在于气体分子本身具有体积,分子间存在吸引力。卡末林 - 昂尼斯气体状态方程考虑了这种力的影响。卡末林-昂尼斯于1901年提出了状态方程的维里表达式(e表示水汽压)。 这些维里系数都可以通过实验测定,其中的第二和第三维里系数都已经有了普遍的计算公式。例如接近大气压力,温度在150K到400K时,第二维里系数计算公式: 一般在我们所讨论的温度范围内,第四维里系数可以不予考虑。 (3)、Goff-Grattch 饱和水汽压公式 从1947年起,世界气象组织就推荐使用 Goff-Grattch 的水汽压方程。该方程是以后多年世界公认的最准确的公式。它包括两个公式,一个用于液 - 汽平衡,另一个用于固 - 汽平衡。 对于水平面上的饱和水汽压 式中,T0为水三项点温度 273.16 K 对于冰面上的饱和水汽压 以上两式为 1966 年世界气象组织发布的国际气象用表所采用。 (4)、Wexler-Greenspan 水汽压公式 1971年,美国国家标准局的 Wexler 和 Greenspan 根据 25 ~ 100 ℃范围水面上饱和水汽压的精确测量数据,以克拉柏龙一克劳修斯方程为基础,结合卡末林 - 昂尼斯方程,经过简单的数学运算并参照试验数据作了部分修正,导出了 0 ~ 100 ℃范围内水面上的饱和水汽压的计算公式,该式的计算值与实验值基本符合。
硫饱和蒸汽压计算公式 lnPs=89.273-13463/T-8.9643lnT 式中T为温度,K Ps为蒸汽压,Pa 在计算冷凝器中硫浓度时,应根据温度算出Ps,再用Ps/P 算出S8的摩尔体积浓度,乘以8即为S的摩尔体积浓度。 9.33×10-4kPa 6.67×10-3kPa 172.0kPa 3.47×10-3kPa 95.4℃119.3℃151.0℃113.0℃ 如图所示,各实线为其相邻两相共存平衡线。可以看出,在室温下斜方硫(R)是稳定的。由于晶体转变是个慢过程,故只能徐缓加热到95.4℃ 时斜方硫才逐 渐转变为单斜硫,一旦加热太快,则可使斜方硫以介稳态平衡到它的熔点
(113.0℃)而不必经过单斜硫。95.4℃ 以上单斜硫是稳定的,于119.3℃ 开始溶解。在95.4℃ 时两种不同晶型的固体(R 和 M)与硫蒸气平衡共存,此温度称为"转变温度",因它处于斜方硫和单斜硫熔点以下,故转变可以在任一方向进行,即相转变是可逆的,这种相转变叫做对称异构(双变)现象的同质多晶体转变,简称多晶体中的"互变现象",但也有许多物质其晶型转变是不可逆的,即只能朝一个方向变化。此类物质的熔点比转变温度低,故在物质未达到转变温度之前就溶解了,这种相转变称之单变现象的同质多晶型转变,例如磷就表现出此类性质。 图中虚线OB代表介稳平衡,此即过热斜方硫的蒸气压曲线。若加热太快,体系可超过95.4℃,沿BO线上升而不转变为单斜硫。虚线OE代表 介稳平衡,即过热斜方硫的熔化曲线。虚线OC代表介稳平衡,即过冷液硫的蒸气压曲线,虚线BH代表介稳平衡,即过冷单斜硫的蒸气压曲线。D 点为临界点,高于此点温度只有气相存在。 硫磺的蒸汽压力及其组成(选至设计院资料) 固体: 正交晶(20~80℃) logP=11.644-5166/T 单斜晶(96~116℃) logP=11.364-5082/T 液体: (25~74℃) LogP=8.70-4055/T (102~325℃) LogP=14.7-0.0062238T-5405.1/T
饱和蒸汽压与温度计算关系.汇总
————————————————————————————————作者:————————————————————————————————日期: 2
在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公式如lgP=A-B/(t+C) (1)式中:P—物质的蒸气压,毫米汞柱;1mm汞柱=133.3Pa,一个标准大气压约760mm汞柱t—温度,℃。公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2)公式进行计算 lgP=-52.23B/T+C (2)式中:P—物质的蒸气压,毫米汞柱;这是所有单位的换算:1兆帕(MPa)=145磅/英寸 2(psi)=10.2千克/厘米2(kg/cm2)=10巴(bar)=9.8大气压(atm) 1磅/英寸2(psi)=0.006895兆帕(MPa)=0.0703千克/厘米2(kg/cm2)=0.0689巴(bar)=0.068大气压(atm) 1巴(bar)=0.1兆帕(MPa)=14.503磅/英寸2(psi)=1.0197千克/厘米2(kg/cm2)=0.987大气压(atm) 1大气压(atm)=0.101325兆帕(MPa)=14.696磅/英寸2(psi)=1.0333千克/厘米2(kg/cm2)=1.0133巴(bar) 名称分子式范围(℃) A B C T温度℃ 银Ag 1650~1950 公式(2)250 8.76 氯化银AgCl 1255~1442 公式(2)185.5 8.179 三氯化铝AlCl3 70~190 公式(2)115 16.24 氧化铝Al2O3 1840~2200 公式(2)540 14.22 砷As 440~815 公式(2)133 10.800
水的饱和蒸汽压和温度对应表 来源: 发布时间: 2011-08-18 08:33 3392 次浏览大小: 16px14px12px 温度(Temperature) 饱和蒸气压(Saturated water vapor pressure) 温度(Temperature) 饱和蒸气压(Saturated water vapor pressure) 温度(Temperatu 温度(Temperatu re) 饱和蒸气 压 (Saturated water vapor pressure) 温度 (Temperature) 饱和蒸气 压 (Saturated water vapor pressure) 温度 (Temperatu re) 饱和蒸气 压(Saturated water vapor pressure) t/℃ /(×10^3 Pa)t/℃ /(×10^3 Pa)t/℃ /(×10^3 Pa) 00.61129125232.012503973.6 10.65716126239.242514041.2 20.70605127246.662524109.6 30.75813128254.252534178.9 40.81359129262.042544249.1 50.8726130270.022554320.2 60.93537131278.22564392.2 7 1.0021132286.572574465.1 8 1.073133295.152584539 9 1.1482134303.932594613.7 10 1.2281135312.932604689.4 11 1.3129136322.142614766.1 12 1.4027137331.572624843.7 13 1.4979138341.222634922.3 14 1.5988139351.092645001.8 15 1.7056140361.192655082.3 16 1.8185141371.532665163.8 17 1.938142382.112675246.3