
【实验名称】
Authorware软件教学——Authorware移动图标的使用
【实验目的和要求】
(一)移动图标介绍
1、移动图标使得显示对象从一个位置移到另一个位置,移动图标
操作的对象包括一个显示交互图标或计算图标的显示内容
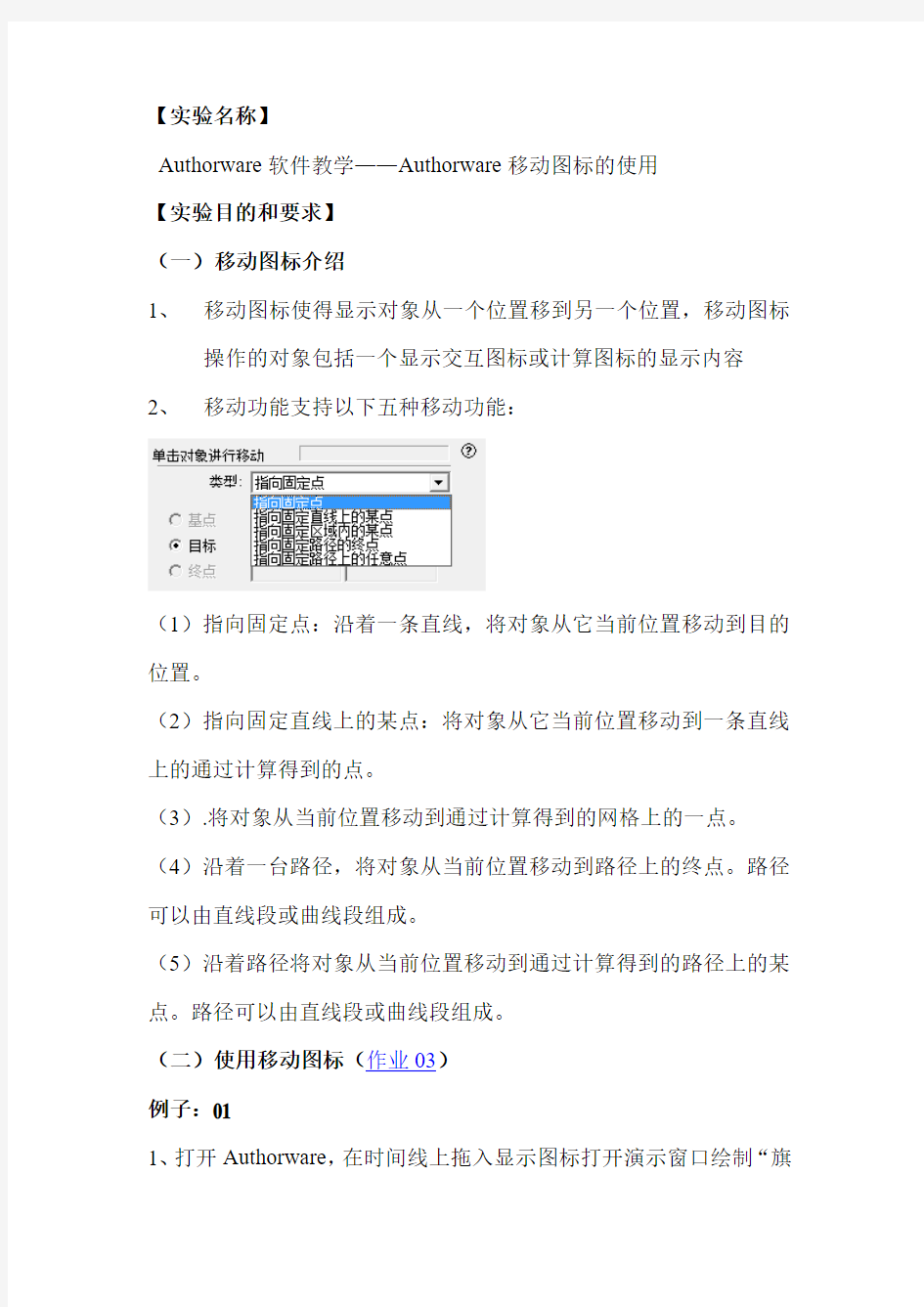
2、移动功能支持以下五种移动功能:
(1)指向固定点:沿着一条直线,将对象从它当前位置移动到目的位置。
(2)指向固定直线上的某点:将对象从它当前位置移动到一条直线上的通过计算得到的点。
(3).将对象从当前位置移动到通过计算得到的网格上的一点。(4)沿着一台路径,将对象从当前位置移动到路径上的终点。路径可以由直线段或曲线段组成。
(5)沿着路径将对象从当前位置移动到通过计算得到的路径上的某点。路径可以由直线段或曲线段组成。
(二)使用移动图标(作业03)
例子:01
1、打开Authorware,在时间线上拖入显示图标打开演示窗口绘制“旗
台和旗杆”如:例1图标。
2、再拖入一个显示图标打开(注意:打开这个显示图标是按住shift 键不放,再去双击显示图标,这样两个显示图标就同时出现,方便绘制旗子)。绘制一个红色的旗子。
3、再拖入一个“移动图标”双击图标—类型是指向固定点。
4、按提示将旗子由底部用鼠标拖到旗杆的顶部放开鼠标。完成—运行—观看效果。
例子:02
1、将例子的图标复制粘贴一次。
2、双击移动图标;将类型改成指向固定直线上的某点。
如例2
3、在起点“0”将旗子拖到终点“100”。
4、在“目标”中填“50”,运行观看效果
5、再“目标”中填“b”
6、在流程线上再拖入一个计算图标定义变量为“b”
7、双击计算图标填入“b:=Random(0, 100, 20)”这个随机函数。
运行观看效果。
例子:03
1、如例3,将类型改成指向固定区域上的某点
2、这和将指向固定直线上的某点相似,只是一个是一维直线
的,这个是二维平面区域上的。
例子:04
1、拖入显示图标绘制一个“地球”圆形的
2、再拖入一个图标绘制一个“月球”小圆形
3、按住shift显示两个图标内容。
4、拖入移动图标:将类型改成指向固定路径的终点
5、将月球拖着沿着地球画出一个近似的圆,双击圆上的三角形变
成圆形,调节知道非常接近圆形,完成。
6、将时间调节为5秒
7、运行观察效果(例4)
例子:5
1、(如例5:幸运大转盘)流程线上拖入一个显示图标
2、在这个图标上绘制一个圆盘,分别在四个方向上表示出“25分、50分、75分、100分”
3、再在时间线上拖入一个显示图标,用于旋转的指针。
4、拖入移动图标:将类型改成指向固定路径的任意点。
5、将指针拖着沿着地球画出一个近似的圆,双击圆上的三角形变成圆形,调节知道非常接近圆形。
6、再“目标”中填“a”
7、在流程线上再拖入一个计算图标定义变量为“b”
8、双击计算图标填入“b:=Random(0, 100, 20)”这个随机函数。运行观看效果。
【实验结果及分析】
1、完成五种不同的移动效果的学习。
2、知道计算图标的使用
3、运用简单的函数如随机函数。
4、完成五种移动方式的平时作业。【评语及成绩】
移动端H5页面设计实战 目录 为什么要设计H5页面............................................................. 错误!未定义书签。赛程魔方3D旋转界面设计 ...................................................... 错误!未定义书签。双屏互动游戏设计................................................................... 错误!未定义书签。资讯与游戏的结合设计............................................................ 错误!未定义书签。刮刮乐在移动端互动游戏中的微创新 ........................................ 错误!未定义书签。互动调查小游戏的设计创新 ..................................................... 错误!未定义书签。设计小贴士 ............................................................................ 错误!未定义书签。
为什么要设计H5页面 移动设备的普及给媒体和娱乐带来了一场革命。根据中国互联网信息中心(CNNIC)2014年7月的报告显示,中国网民中,手机使用率达83.4%,已经超过传统PC整体80.9%的使用率。其中,手机网络新闻的使用率为74.2%,仅次于即时通信和搜索,远超其他手机网络应用。在资讯移动化的趋势下,观察近期各大门户在重大事件报道中的表现,会发现移动优先、产品社会化、交互趣味化是三个重要的趋势。其中,基于HTML5技术的移动Web页面(以下简称H5页面),较完美地融合了上述三种属性,成为当下最受关注的内容报道形态,也引爆了社交平台上的大规模分享行为。 就像CD取代磁带成为一种更高效的音乐播放方式一样,数字文件也将取代CD,依此类推,智能手机也将会替代PC的一部分重要功能。尽管仍有争议,但不可否认的是,移动互联网时代已经到来,随着用户从PC向移动端的迁移,从大屏到小屏,从鼠标键盘到多点触控,移动端逐渐成为媒体报道的前沿阵地。 一提起移动端,大家首先想到的就是手机上安装的移动应用,比如微信、腾讯新闻客户端、QQ浏览器等。我们称这些应用为原生应用(Native App),因为它们是需要安装在用户设备上的软件,它们的代码和界面都是针对所运行的平台开发和设计的。这些原生应用能够最大程度地发挥用户设备的性能,例如使用存储空间实现离线阅读,利用图形加速实现界面动效,以及利用摄像头来上传图片,等等。但跟Web专题相比,移动应用的开发周期长,开发者需要将产品提交到应用商店供用户下载使用。以苹果的iOS应用开发为例,开发者在应用商店要发布应用,需要通过约耗时8天的人工审核。因此,把PC端的Web专题做成一个个移动应用是不现实的。 除了原生应用之外,在移动端还有一种产品形态——移动Web页面。它源自于移动互联网诞生初期的WAP页面,有着和PC网页同样的优点:开发周期短、发布和更新方便。此外,用户只需要借助手机浏览器或者内嵌手机浏览器的应用就可以访问,比原生应用要方便得多。但在2014年前,因用户渠道和设备性能的原因,移动Web页面的形态通常都非常简单,也很少有用户互动。2014年,HTML5技术的普及、智能手机的更新换代和新闻客户端、微信等渠道用户的增长彻底改变了这一点。 在移动端,要在网页上实现交互和动效需要借助HTML5技术(例如CSS3媒体查询、CSS3动画、Canvas等)。现在的手机浏览器大都支持HTML5的核心技术,例如对触摸事件和手势的响应、播放声音和视频、渲染CSS变换,以及获取设备的加速度传感器数据等。这些技术衍生了诸如互动小游戏、交互型动画页面、可视化新闻等,为市场营销、媒体报道等提供了大量不同形式的载体,同时为产品策划与视觉设计带来了更多的想象空间。
高考化学平衡移动原理及图像专题
Ⅰ、等效平衡规律: 在一定条件下(恒温恒容或恒温恒压),对同一可逆反应,起始时加入物质的物质的量不 某温度时反应B A C 2达到平衡状态,若升高温度,C 的平衡浓度增大,则正反 应为 热反应。如果A 为气态,且增大压强A 的平衡浓度增大,则B 为 态或 态,C 为 态。如A 为气态,加压时B 的量不变,则B 为 态,C 为 态。 例题1 500℃,向一体积固定的密闭容器中分别充入不同量的气体,发生反应 2SO 2(g)+O 2(g) 2SO 3(g),共进行了6次实验,每次物质的量分别为:①2amolSO 2+amolO 2; ②2amolSO 3;③amolSO 2+0.5amolO 2+amolSO 3;④4amolSO 2+2amolO 2;⑤4amolSO 3; ⑥amolSO 2+0.5amolO 2+3amolSO 3。试分析,6次反应分别达到平衡时SO 3的平衡浓度相同的组合是( ) A.①②③ B.①③⑤ C.②④⑥ D.④⑤⑥ 练习1 某温度下1 L 密闭容器中加1 mol N 2和3 mol H 2,使反应N 2+3H 2 2NH 3 达到平衡,测得平衡混合气体中N 2、H 2、NH 3物质的量分别为m mol 、n mol 、g mol 。如温度不变,只改变初始加入的物质的量,而要求m 、n 、g 的值维持不变,则N 2、H 2、NH 3加入的物质的量用x 、y 、z 表示时,应满足条件: (1)若x=0,y=0,则z= 。 (2)若x=0.75 mol ,则y= ,z= 。 (3)x 、y 、z 应满足的一般条件是(请用两个方程式表示,其中一个含x 和y ,另一个只含y 和z) 。 例题2 在气相条件下(T=500 K),有相同体积的甲、乙两容器,甲容器充人1 g SO 2、 l gO 2,乙容器充人2 g SO 2、2g O 2则下列叙述中正确的是( ) A .化学反应速率:乙>甲 B .平衡后SO 2的浓度:乙>甲 C .SO 2转化率:乙<甲 D .平衡后O 2的体积分数:乙>甲 练习2 在恒温时,一固定容积的容器内发生如下反应:2NO 2(g) N 2O 4(g), 达平 衡时,再向容器内通入一定量的NO 2(g),重新达到平衡后,与第一次平衡时相比,NO 2的转化率( ) A .不变 B .增大 C .减小 D .无法判断
化学平衡移动的图像一、化学平衡的移动 二、影响化学平衡移动的条件 1、浓度的变化对化学平衡的影响
结论:其它条件不变的情况下,①增大反应物浓度或减小生成物浓度平衡向正方向移动 ②增大生成物浓度或减小反应物浓度平衡向逆方向移动 2、温度变化对化学平衡的影响 温度的改变对正逆反应速率都会产生影响,但影响的程度不同,温度的变化对吸热反应的速率比放热反应的速率影响大。 表现在: 升高温度,正、逆反应速率都增大,但增大的倍数不一样,吸热反应增大的倍数大。 降低温度,正、逆反应速率都减小,但降低的倍数不一样,吸热反应降低的倍数大。 结论:在其他条件不变时,温度升高,会使化学平衡向吸热反应的方向移动,温度降低会使化学平衡向放热的方向移动。 注意:温度的变化一定会影响化学平衡,使平衡发生移动 3、压强的变化对化学平衡的影响 对于反应前后气体分子数有变化的体系: 结论:增加压强可使平衡向气体分子数目减小的方向移动; 减小压强可使平衡向气体分子数目增大的方向移动.
对于反应前后气体分子数目不变的反应: 结论:对于反应前后气体分子数目不变的反应,改变压强平衡不移动。 4、使用催化剂对化学平衡的影响 结论:催化剂同等程度的改变正、逆反应速率(V正=V逆) 使用催化剂,对化学平衡无影响。 正催化剂能缩短平衡到达的时间 [总结]改变反应条件时平衡移动的方向
5、化学平衡移动原理——勒夏特列原理 早在1888年,法国科学家勒夏特列就发现了这其中的规律,并总结出著名的勒夏特列原理,也叫化学平衡移动原理: 勒夏特列原理:如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。 注意: ①是“减弱”这种改变,不是“消除”这种改变 ②勒夏特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡、沉淀平衡、水解 平衡等),未平衡状态不能用此来分析 ③平衡移动原理只能用来判断平衡移动方向,但不能用来判断建立平衡所需时间。
专题强化训练 巧解化学反应速率和化学平衡的图象题 (45分钟100分) 一、选择题(本题包括7小题,每题6分,共42分) 1.一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。 下列判断正确的是( ) A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等 B.溶液酸性越强,R的降解速率越小 C.R的起始浓度越小,降解速率越大 D.在20~25 min之间,pH=10时的平均降解速率为0.04 mol·L-1·min-1 【解析】选A。在0~50 min内,pH=2和pH=7时反应物R都完全反应,降解率都为100%,A正确;R的降解速率与溶液的酸碱性及起始浓度均有关系,因此根据图中曲线所示,由于起始浓度不同,故不能判断R的降解速率与溶液酸碱性的直接关系,B、C错误;pH=10时,在20~25 min之间,R的平均降解速率为=0.04×10-4mol·L-1·min-1,D错误。 2.(2015·武汉模拟)有一化学平衡mA(g)+nB(g)pC(g)+qD(g),如图所示的是
A的转化率与压强、温度的关系。下列叙述正确的是( ) A.正反应是放热反应;m+n>p+q B.正反应是吸热反应;m+n
化学平衡图像 说明: 对于化学反应速率和化学平衡的有关图象问题,可按以下的方法进行分析: ①看图像,认清坐标系,搞清纵、横坐标所代表的意义,并与勒夏特列原理挂钩。所谓看图像,是指:一看面(即横坐标和纵坐标的意义),二看线(即线的走向和变化趋势),三,看点(即起点、折点、交点和终点),四看要不要做辅助线(如等温线、等压线、平衡线等),五看量的变化(如温度、浓度、压强、转化率、产率、百分含量等的变化趋势)等,这是解题的基础。 ②紧扣可逆反应的特征,搞清正反应方向是吸热还是放热,体积增大还是减小、不变,有无固体、纯液体物质参加或生成等。 ③看清速率的变化及变化量的大小关系,注意图像的走向是否符合给定的反应,在条件与变化之间搭 桥;也可以根据坐标的数据,判断反应物或生成物在方程式中的系数,或据此求反应速率。 ④看清起点、拐点、终点,注意图像是否经过“原点”,即是否有“0”项,尤其是特殊点的意义,看清曲线的变化趋势。 二个原则: ⑤先拐先平—数值大原则:例如,在转化率-时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。 ⑥定一议二原则:勒夏特列原理只适用于一个条件的改变,所以图像中有多个变量时,先固定一个量,再讨论另外两个量的关系。 ⑦注意图像题中物质的转化率与百分含量的关系:某物质的转化率与其“百分数”相反。 一、选择题(本题包括35小题,每小题2分,共70分。每小题有一个或两个选项符合题意。) 1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物 质的量随时间变化的曲线如右图所示,下列描述正确的是 () A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) B.反应开始时10s,X的物质的量浓度减少了0.79mol/L C.反应开始时10s,Y的转化率为79.0% D.反应的化学方程式为:X(g)+Y(g)Z(g) 2.T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是()
html5页面设计 北京千锋互联科技有限公司是中国最早从事移动互联网研发和培训的机构之一,千锋集团旗下现有千锋教育、移动产业、项目研发、创业孵化业务,是国内最大的移动互联网人才培训和人才提供商。公司总部位于北京,目前已在深圳、上海、郑州、广州、大连、武汉、成都、西安成立了分公司。 千锋集团旗下的千锋教育一直秉承“用良心做教育,做真实的自己”的理念,是中国移动互联网研发培训领导品牌,全力打造移动互联网高端研发人才服务平台。千锋教育每年培训和输送近万名移动互联网研发人员,是唯一真正获得企业一致好评的移动互联网培训机构,从千锋走出的学员在业界得到了广泛认可。2014年,千锋教育集团成为教育部教育管理信息中心“移动互联网应用开发指定实训基地”。截止目前,千锋教育已与500多家高等院校建立深度合作关系,并携手教育部教育管理信息中心举办《高等院校骨干教师iOS/Android暑期培训班》,千锋讲师团队技术水平得到业界一致认可,好评如潮。千锋教育组织的技术研讨会名企云集,是千锋和企业之间紧密合作的桥梁。千锋讲师发布的免费培训视频、学习资料、源码下载等浏览量近千万,每年约有数百万研发人才从中获益。 一、千锋教育八大优势 1、中国移动互联网研发培训领导品牌,专注iOS、Android 、HTML5、UI等技术研发培训,坚持“用 良心做教育,做真实自己”的理念; 2、业内唯一一家敢推出“两周免费试听,不满意不缴费”的政策,让学员更真实的了解千锋、了解自 己是否适合做开发; 3、零学费入学,工作后分期还款,业内学员毕业薪水最高,培训就业协议明确写出薪水保障,平均薪 水专科5000、本科6000、硕士7000; 4、权威资深师资阵容,业内最具责任心、最懂教学、拥有最强技术、有大型项目经验实战派讲师授课, 由业内知名专家及企业技术骨干组成; 5、自主研发QFTS 教学保障系统,拥有自主知识产权的开发培训课程体系,讲练学相结合,课程内 容紧贴当前前沿实用技术和企业实际需求; 6、企业级项目实战训练,从千锋科技及合作企业项目中研发出几十个企业级教学项目,让学员参与真 实的企业级项目研发,最后让学员能够独立设计开发自己的上线项目; 7、最严格、最科学、最负责的教学就业管理制度,班主任、职业规划师全程跟班,把握每个学员的学 习状态,并有专业的职业素养课和就业指导课,保证教学及就业质量; 8、免费加入千锋开发者联盟,为会员提供免费技术支持及终身就业服务,免费参加千锋举办的各类技
化学平衡图像 一、选择题(本题包括35小题,每小题2分,共70分。每小题有一个或两个选项符合题意。) 1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是() A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) B.反应开始时10s,X的物质的量浓度减少了0.79mol/L C.反应开始时10s,Y的转化率为79.0% D.反应的化学方程式为:X(g)+Y(g)Z(g) 2.T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是() A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 B.t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动 C.T℃时,在相同容器中,若由0.3mol·L—1 A 0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1 D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 3.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T 1、T3温度时达到过化学平衡 B.该反应在T2温度时达到过化学平衡 C.该反应的逆反应是放热反应 D.升高温度,平衡会向正反应方向移动 4.右图表示反应N2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是() A.t0~t1 B. t2~t3 C. t3~t4 D. t 5~t6 5.反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是()
高考化学平衡移动练习 题含答案 TPMK standardization office【 TPMK5AB- TPMK08-
化学平衡移动专题练习 1.在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是() A.反应混和物的浓度B.反应物的转化率 C.正、逆反应速率 D.反应混和物的压强 2.在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是() A.2NO+O2 2NO2B.Br2(g)+H2 2HBr C.N2O4 2NO2 D.6NO+4NH3 5N 2+3H2O 3.在某温度下,反应ClF(g) + F2(g) ClF3(g)(正反应为放热反应)在密闭容器中达到平衡。下列说法正确的是 ()A.温度不变,缩小体积,Cl F的转化率增大 B.温度不变,增大体积,Cl F3的产率提高 C.升高温度,增大体积,有利于平衡向正反应方向移动 D.降低温度,体积不变,F2的转化率降低 4.已建立化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列有关叙述正确的是 ()①生成物的百分含量一定增加②生成物的产量一定增加 ③反应物转化率一定增大④反应物浓度一定降低 ⑤正反应速率一定大于逆反应速率⑥使用了合适的催化剂 A.①②B.②⑤C.③⑤D.④⑥ 5.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的60%,则() A.平衡向逆反应方向移动了B.物质B的质量分数增加了C.物质A的转化率减小了D.a>b 6.在一固定容积的密闭容器中充入2mol NO2,一定温度下建立如下平衡:2NO2(g) N2O4此时平衡混合气体中NO2的体积分数为x%;若再充入1mol N2O4,在温度不变的情况下,达到新平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是() A.x>y B.x=y C.x<y D.不能确定 7.下列事实中,不能用列夏特列原理解释的是 ( )A.溴水中有下列平衡:Br2+H2O HBr+HBrO当加入AgNO3溶液后溶液颜色变浅 B.对二氧化硫的品红溶液加热可使颜色变深 C.反应CO+NO2CO2+NO(正反应放热),升高温度可使 平衡向逆反应方向移动 D.合成氨反应N2+3H22NH3(正反应放热)中使用催化剂8.在密闭容器中进行H2(g)+Br2(g) 2HBr(g)+Q;反应达到平衡后,欲使颜色加深,应采取的措施是 () A.升温B.降温C.减小容器体积D.增大容器体积9.在体积可变的密闭容器中,反应mA(g)+nB(s) pC (g)达到平衡后,压缩容器的体积,发现A的转化率随之降 低。下列说法中,正确的是() A.(m+n)必定小于p B.(m+n)必定大于p C.m必定小于p D.n必定大于p 10.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s);△H>0,下列叙述正确的是 () A.加入少量W,逆反应速率增大 B.当容器中气体压强不变时,反应达到平衡 C.升高温度,平衡逆向移动 D.平衡后加入X,上述反应的△H增大 11.一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应2SO2+O2 2SO3平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物 质,平衡时SO3的物质的量可能大于n的是() A.1 mol SO2+1 mol O2+1 mol SO3 B.4 mol SO2+ 1 mol O2 C.2 mol SO2+1 mol O2+2 mol SO3 D.2 mol SO2+ 1 mol O2 12.下列说法中正确的是()A.可逆反应的特征是正反应速率和逆反应速率相等B.其他条件不变时,升高温度可使化学平衡向放热反应的方向移动 C.其他条件不变时,增大压强会破坏有气体存在的反应的平衡状态 D.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态 13.在一定条件下,向5L密闭容器中充入2mol A气体和1mol B 气体,发生可逆反应: 2A(g)+B(g) 2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为 () A.67%B.50%C.25%D.5% - 6 -
2014年移动端界面设计分析 移动互联网时代的悄然袭来改变着我们的生活方式,因此有大批设计力量涌入了移动端的设计领域中,这也说明了大家越来越重视用户在各个设备终端层面的体验。在规划产品时,往往会把PC端和移动端的产品放在同等重要的地位进行思考。然而,设备的多样性和产品形态的多样性为设计师们带来的既是更多的发挥空间,也同样是更大的挑战。这些产品在设计之间有何不同?如何规划不同平台上产品的功能?设计时有哪些差异?2014移动端的界面设计是非常值得探讨的话题。 1.唯一主色调 2014年,追求极简设计风格,主色调可能只是选定一种色彩,然后调整透明度或者饱和度,(说得通俗些就是将色彩变淡或则加深),从而产生新的色彩,这样能够很好的表达界面层次、重要信息,并且展现良好的视觉效果。这样的页面看起来色彩统一,有层次感。当前上线的一些移动应用都采用极少的色彩,甚至放弃所有的颜色。仅仅用一个主色调就能展现良好的视觉效果。 2.多彩色风格设计 Metro引领的多彩色风格是与唯一主色调形成对照关系的设计风格,多彩撞色更多的表现于多种纯色块的使用,就是很简单的纯颜色,只需要注意多彩配色的方式,就能得到很好的视觉效果。多彩色拼接的设计风格,一屏式的页面排版布局,总体来说是时尚大气简洁的设计。“多彩撞色”的概念,在2014年手机端仍会继续发展。
3.信息框架扁平化 在设计的表现形式上我们追求界面扁平,注重通过弱化视觉效果来强化应用的功能。在移动设备上,过多的层级会使用户失去耐心而放弃对产品的使用。而且移动端上页面小,没太多地方摆多层的tabs导航或者面包屑导航,就只剩下左上角的一个“返回”按钮作为导航了,可以一次接一次的深入,但跳转了三、四次后,再看左上角的“返回”按钮,你已经很难判断出将会返回到哪里了。应该从信息架构角度,再进一步的去应用扁平化的设计理念,信息框架扁平化的目的是减少信息层级,追求信息到达用户的最短距离,从根本上解决上述问题。扁平化思想是一种让设计者在界面设计过程中减少信息层级的思想。 4.动态数据可视化 数据可视化设计是将枯燥繁琐的列表和文字转换为直观的饼图、扇形图、折线型、柱状图等丰富直观的设计元素,提高用户体验。而且现今数据可视化不只是静态展现数据,用户希望通过互动及时获取数据流,若以动态效果来呈现,能多维度呈现给用户实时信息,同时能与用户形成互动,提高数据表现的趣味性。动态数据可视化将更加强调数据转译实时更新的图形,以及动态的图形化表达。
一、填空题 1、为了有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物含量、使用清洁能源显得尤为重要。 (1)已知:4NH3(g)+5O2(g)4NO(g)+6H2O(g)?? ?H = -905.48 kJ·mol-1 N2(g)+O2(g)2NO(g)?? ?H = +180.50 kJ·mol-1 则4NH3(g)+6NO(g)5N2(g)+6H2O(g)的?H =????????????? ?。 (2 N (g) v2正=k2 ①(g) ②(g)2NO 达式 (3N (g) M 2、将等物质的量的A、B、C、D四种物质混合后,充入一容积为V的密闭容器,此时容器内压强为p。然后在一定条件下发生如下反应:a A(?)+b B(?)c C(g)+d D(?)。当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了n mol,D增加了1.5n mol,此时达到化学平衡。 (1)该化学方程式中,各物质的化学计量数分别为: a________;b________;c________;d________。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,则在上述平衡混合物中再加入B物质,上述平衡 ________。 A.向正反应方向移动B.向逆反应方向移动 C.不移动? ??????????????D.条件不够,无法判断 (3)若只升高温度,反应一段时间后,测知四种物质的物质的量又重新相等,则正反应为________反应(填“放热”或“吸热”)。 3、工业合成氨N 2+3H22NH3,反应过程中的能量变化如图所示,据图回答下列问题: ,理 A.3V(N2 B C D.C(N2 E. F. (3) (4)450 (5)填字母代号)。 a.高温高压b.加入催化剂c.增加N2的浓度d.增加H2的浓度e.分离出NH3 二、选择题 4、下列与化学反应能量变化相关的叙述正确的是(? ) A 生成物能量一定低于反应物总能量?????? B 放热反应的反应速率总是大于吸热反应的反应速率
让人印象深刻的7种移动端UI设计风格 如果你是一个APP狂热分子,你会花大量的时间在各种APP的尝鲜中,你会明显感受到一些APP在采用着某种风格鲜明的设计语言,来标榜自己的独特之处,行成自己的设计风格,甚至引领设计风向。去年我们关注到随着Metro设计风格的影响和iOS7的发布,APP明显都开始尝试扁平化的设计语言了,除此之外,还有哪些显性化的设计语言崭露头角呢?在这篇文章里,我想分享一些日益显性的设计语言,让人一眼就记住它的风格,有一些已经随着优秀设计师的摸索,融入到国内移动产品设计里了,而有一些,确实是刚刚在萌芽阶段,需要更进一步的摸索和尝试。 一、唯一主色调|Simple color schemes 为什么我们要定义一个界面多种颜色?仅仅用一个主色调,是不是就能够很好的表达界面层次、重要信息,并且能展现良好的视觉效果?事实上也正是如此,随着iOS7的发布,我们看到越来越多唯一主色调风格的设计,会采用简单的色阶,配套灰阶来展现信息层次,但是绝不采用更多的颜色。
卡塔尔航空公司 卡塔尔公司航空就是这样的设计案例,整个界面采用粉色的主色调,从标题栏到标签页,从操作按钮到提示信息,除了黑白灰之外,全部采用粉色设计,这种简介的的配色风格,反倒起到了很好的信息传达效果,也具有良好的视觉表现力,设计师在内容排版上的技巧实在是加分。 Readability采用红色主色调设计,连提示信息背景色、线性按钮和图标都采用红色主色调,界面和LOGO也完全是一个色系的。而Vivino采用蓝色主色调设计,信息用深蓝、浅蓝加以区隔。Eidetic采用橙色主色调设计,其中的关键操作按钮甚至整个用橙色提亮,信息图标也用深橙色、浅橙色来表达程度。 可以说唯一主色调设计手法,是真的做到了移动端APP的最小化(Minimal)设计,减少冗余信息的干扰,使用户专注于主要信息的获取。
化学平衡移动专题练习 1.在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是() A.反应混和物的浓度B.反应物的转化率 C.正、逆反应速率D.反应混和物的压强 2.在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是() A.2NO+O22NO2B.Br2(g)+H22HBr C.N2O42NO2 D.6NO+4NH35N2+3H2O 3.在某温度下,反应ClF(g) + F2(g)ClF3(g)(正反应为放热反应)在密闭容器中达到平衡。下列说法正确的是()A.温度不变,缩小体积,Cl F的转化率增大 B.温度不变,增大体积,Cl F3的产率提高 C.升高温度,增大体积,有利于平衡向正反应方向移动 D.降低温度,体积不变,F2的转化率降低 4.已建立化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列有关叙述正确的是()①生成物的百分含量一定增加②生成物的产量一定增加 ③反应物转化率一定增大④反应物浓度一定降低 ⑤正反应速率一定大于逆反应速率⑥使用了合适的催化剂 A.①②B.②⑤C.③⑤D.④⑥ 5.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的60%,则() A.平衡向逆反应方向移动了B.物质B的质量分数增加了C.物质A的转化率减小了D.a>b 6.在一固定容积的密闭容器中充入2mol NO2,一定温度下建立如下平衡:2NO2(g) N2O4此时平衡混合气体中NO2的体积分数为x%;若再充入1mol N2O4,在温度不变的情况下,达到新平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是() A.x>y B.x=y C.x<y D.不能确定 7.下列事实中,不能用列夏特列原理解释的是( )A.溴水中有下列平衡:Br2+H2O HBr+HBrO当加入AgNO3溶液后溶液颜色变浅 B.对二氧化硫的品红溶液加热可使颜色变深 C.反应CO+NO2CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 D.合成氨反应N2+3H22NH3(正反应放热)中使用催化剂8.在密闭容器中进行H2(g)+Br2(g) 2HBr(g)+Q;反应达到平衡后,欲使颜色加深,应采取的措施是() A.升温B.降温C.减小容器体积D.增大容器体积 9.在体积可变的密闭容器中,反应mA(g)+nB(s)pC (g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。 下列说法中,正确的是() A.(m+n)必定小于p B.(m+n)必定大于p C.m必定小于p D.n必定大于p 10.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s);△H>0,下列叙述正确的是() A.加入少量W,逆反应速率增大 B.当容器中气体压强不变时,反应达到平衡 C.升高温度,平衡逆向移动 D.平衡后加入X,上述反应的△H增大 11.一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应2SO2+O22SO3平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是()A.1 mol SO2+1 mol O2+1 mol SO3 B.4 mol SO2+1 mol O2 C.2 mol SO2+1 mol O2+2 mol SO3 D.2 mol SO2+1 mol O2 12.下列说法中正确的是()A.可逆反应的特征是正反应速率和逆反应速率相等B.其他条件不变时,升高温度可使化学平衡向放热反应的方向移动C.其他条件不变时,增大压强会破坏有气体存在的反应的平衡状态D.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态 13.在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应: 2A(g)+B(g) 2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为() A.67%B.50%C.25%D.5% 14.对于平衡体系:aA(g)+bB(g) cC(s)+dD(g)+Q;有下列判断,其中不正确的是()
化学反应速率和化学平衡图像 班别姓名学号1、速率——时间图 此类图像定性揭示了V 正、V 逆 ,对于条件的改变随时间变化的规律,体现了平 衡移动的方向和平衡的特征。认识此类图像的关键:若改变单一物质的浓度,图像是连续的,若改变体系的温度和压强,则图像不连续。对于反应: mA(气)+nB(气)pC(气)+qD(气) +Q,请根据提示完成以下的图像(→表示平衡向正反应方向移动,←表示平衡向逆反应方向移动)。 ( )( )( )(1)增大反应物浓度(2)减少生成物浓度(3)增大生成物浓度 ()( )()(4)减少反应物浓度(5)升高温度(Q>0)(6)降低温度(Q>0) ()()
() (7)升高温度(Q<0)(8)降低温度(Q<0)(9)加压(m+n=p+q) ()( )( ) (10)减压(m+n=p+q) (11)加压(m+n>p+q) (12)减压(m+n>p+q) ()()() (13)加压(m+n (1)、该反应的化学方程式; (2)、反应开始至3min末,Y的反应速率为; (3)、该反应是由开始的(正反应、逆反应、正逆么应同时) 3、全程速率—时间图 此类图像的分析要抓住各个阶段的主要矛盾——影响速率的主要因素。如Z n与足量的盐酸反应,反应速率随时间的变化情况如图(17)所示。其中A~B速率变化的原因是;B~C速率变化的原因是。 4、含量(或转化率)—时间—温度(或压强)图 此类图像的分析应注意3个方面的问题: (1)纵坐标表示的意义;即是反应物还是生成物的含量,还是反应物的转化率?(2)达平衡的时间:温度越高(或压强越大),反应的速率越大,达到平衡的时间越短。 (3)平衡线的高低:根据纵坐标的含义与反应方程式的特点(放热或吸热以及反应前后气体分子数的关系)来判断平衡线的高低。 以反应mA(气)+nB(气)pC(气)+qD(气)+Q为例,图示如下: (18)当P一定,则Q (19)当T一定,则m+np+q Ⅱ 化学平衡移动的图像 例题3 对于可逆反应aA (g )+bB (g )cC (g )+dD (g ) ,达平衡后改变某条件时,发生如右图所示的变化,下列选项叙述正确的是 A .d c b a +<+,减压 B .d c b a +>+,加压 C .d c b a +<+,加压 D .d c b a +>+,减压 练习 3 在容积不变.... 的密闭容器中存在如下反应:2SO 2(g)+O 2(g)2SO 3(g);正反应放热。 某研究小组研究了其他条件不变时,改变某一.. 条件对上述反应的影响,下列分析正确的是: I II III A.图I 研究的是t 0时刻增大O 2的浓度对反应速率的影响 B.图II 研究的是t 0时刻加入催化剂后对反应速率的影响 C.图III 研究的是催化剂对平衡的影响,且甲的催化效率比乙高 D.图III 研究的是温度对化学平衡的影响,且乙的温度较高 巩固练习 1.在密闭容器中发生反应:2SO 2(g)+O 2(g) 2SO 3(g)。起始时SO 2和O 2分别为1mol 和 0.5mol ,达到平衡时SO 2的转化率为90%。若从SO 3开始进行反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO 3的物质的量及其转化率分别为( ) A.1mol 和20% B.1mol 和10% C.0.5mol 和20% D.2mol 和10% 2.在恒温恒容的的甲、乙密闭容器中,分别充入1molNH3和2molNH3,平衡时,甲、乙两容器中混合气体的平均式量分别为x 和y ,则x 和y 的大小关系为( ) A.x >y B.x <y C.x =y D.无法判断 3.一定条件下,向一带活塞的密闭容器中充入2molSO 2和1molO 2,发生下列反应:2SO 2(g)+O 2(g) 2SO 3(g)达到平衡后改变下述条件,SO 3气体平衡浓度不改变的是( ) A.保持温度和容器体积不变,充入1molSO 3(g) B.保持温度和容器内压强不变,充入1molSO 3(g) C.保持温度和容器内压强不变,充入1molO 2(g) D.保持温度和容器内压强不变,充入1molAr(g) 4.图中表示外界条件(t 、p )的变化对下列反应的影响: L(s)+G(g) 2R(g)-Q ,y 轴表示的是( ) (A) 平衡时,混合气中R 的百分含量 (B) 平衡时,混合气中G 的百分含量 (C) G 的转化率 (D) L 的转化率 平衡移动和图像问题 知识梳理 一、运用勒夏特列原理解释实际问题 1.勒夏特列原理 如果改变影响平衡的一个条件(如浓度、温度或压强等)时,平衡就能向减弱这种改变的方向移动。 2.几个问题: (1)气体在水中的溶解度随着温度的升高而降低,压强的增大而增大,为什么? (2)为什么用饱和食盐水除去氯气中的HCl气体? 【答案】(1)存在溶解平衡,例:CO2(g)CO2(aq)+Q,升高温度,平衡向生成气体二氧化碳的方向移动,所以升高温度,气体的溶解度减小;增大压强,平衡向溶解的方向移动,所以加压,气体的溶解度变大。 (2)氯气溶于水,存在可逆反应Cl2+H2O HCl+HClO,利用饱和食盐水,首先HCl极易溶于水,而在饱和食盐水中,氯离子的含量较大,使得上述平衡逆向移动,减少了氯气的损失。 【练一练】 1.下列事实不能用勒夏特列原理解释的是() A.饱和食盐水法收集Cl2 B.温度控制在500℃有利于合成氨反应 C.加入催化剂有利于氨的合成 D.工业制取金属钾Na(l)+ KCl(l)NaCl(l)+ K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来 【答案】C 2.下列有关合成氨工业的叙述,可用勒沙特列原理来解释的是() A.使用铁触媒,使N2和H2的混合气体有利于合成氨 B.高压比常压条件更有利于合成氨的反应 C.500℃左右比室温更有利于合成氨的反应 D.合成氨时采用循环操作,可提高原料的利用率 【答案】B 二、应用勒沙特列原理讨论平衡移动影响因素及方向 1.浓度 其他条件不变的条件下,增大反应物的浓度或减小生成物的浓度,平衡向__________方向移动。反之依然。 注意点:增加或减少固态物质(或液态纯物质)不能使平衡发生移动。 2.温度 升高温度,平衡向__________方向移动;降低温度,平衡向___________方向移动 注意点:对任何一个平衡体系,温度改变都会使平衡发生移动。 3.压强 在含有气态物质的平衡体系里,增大压强,平衡向着__________的反应方向移动; 降低压强,平衡向着__________的反应方向移动。 注意点: ①因压强的影响实质是浓度的影响,所以只有当这些“改变”能造成浓度改变时,平 衡才有可能移动。 ②对反应前后气体体积不变的平衡体系,压强改变________使平衡态发生移动。 ③恒温恒容下,向容器中充入惰性气体,平衡______________。因压强虽增加,但各 反应物和生成物的浓度都不改变。 ④恒温恒压下,向容器中充入惰性气体,平衡会向_______________的反应方向移动。 因容器体积要增加,各反应物和生成物的浓度都降低引起平衡移动。 4.催化剂 可以极大程度地改变反应的速率,缩短(或延缓)到达平衡所需的时间,因催化剂能同等程度 ....改变正逆反应速率,故对平衡状态不影响,即使用催化剂不能改变可逆反应所能达到的最大限度,不能提高反应转化率,不能改变原有平衡的各组份含量。 答案正反应吸热反应放热反应气体体积缩小气体体积增大不会不发生移动气体体积增大三、常见的几种平衡图像反应mA(气)+nB(气) pC(气)+qD(气) + Q 1.速率-时间图 ①增大反应物浓度②升高温度 1 §2.3化学平衡(第三课时)化学平衡移动的图像专题训练 一、化学平衡图像题的分析方法与思路 1.化学平衡图像题的主要特点: 该类题目的主要特点是通过多种图像,对化学反应速率和化学平衡的有关知识、 规律进行分析考察,题目特别注重对知识综合应用能力和分析判断能力的考查。 2.解题的方法及思路 (1)看懂图像:一看 面(图像形状,横、纵坐标的含义),二看线(走向,变化趋势),三看点(起点、终点、交点、拐点),四看是否需作辅助线(等温线、等压线、平衡线等),五看量的变化(浓度的变化,温度变化) (2)联想规律:外界条件的改变对化学反应速率和化学平衡移动的影响规律。 (3)作出判断:根据图像中表现的关系与所学规律相对比,做出符合题目要求的判断。 3.解化学平衡图像题的原则: “先拐先平衡,数值大”原则:含量与时间变化关系的图像中,先出现拐点的则先到达平衡,说明该曲线表示的温度较大或压强较高。a A(g)+bB(g) cC(g) (1) 图1 图2 在图1中,P1 P2 ,a+b c (填“<”“>”) 在图2中T1 T2,正反应为 反应(吸热或放热) (2)“定一议二”原则:在含量与温度、压强变化图像中,先确定一个量不变,再讨论另外两个量的关系。 即定温看压强或定压看温度变化,由曲线的高低走势,结合平衡移动原理和指定的可逆反应,确定平衡的移动 方向,反应的热效应,反应两边气体体积的大小等。 mA(g)+nB(g) qC(g)+qD (g ) 图3 图4 图3中正反应为 反应,m+n p+q ;图4中,正反应为 反应,m+n p+q 。 二、图像的常见类型: 1.物质的量(或浓度)———时间图象: 例1:某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时 间变化的关系如所示,则该反应的化学方程式为 , 2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、 _________。 2.速率-时间图: 【例2】对于mA(g)+nB(g) pC(g)+qD(g),能引起 如图5平衡移动的因素可能是: 能引起如图6平衡移动的因素可能是: 【例3】把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气 发生的速率变化情况如图2所示,其中t1~t2速率变化的主要原因是 ;t2~t3速率变化的主要原因是 。 [答案]反应是放热反应,温度升高使化学反应速率提高;盐酸物质的量 浓度变小使化学反应速率降低。 3.速率—压强(或温度)图象 【例4】符合如图的反应为( )。 A.N2O3(g)NO2(g)+NO(g) B.3NO2(g)+H2O(l )2HNO3(l )+NO(g) C.4NH3(g)+5O2(g)4NO(g)+6H2O(g) D.CO2(g)+C(s)2CO(g) 4.含量-时间图 【例5】在A (g )+B (g )=C (g )+D (g )的反应体系中,C 的百分 含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,应的图为( ) A . B C D 5.转化率-时间图 【例6】对于可逆反应:m A(g)+n B(g)x C(g) ΔH =?,在不同温度及压强(P 1,P 2)条件下,反应物A 的转化率如下图所示,下列判断正确的是 ( ) A .ΔH >0,m +n >x B .ΔH <0,m +n >x C .ΔH >0,m +n <x D .ΔH <0,m +n <x 6、温度(T )类 【例5】反应X(g)+3Y(g) 2Z(g)(正反应为放热反应),在不同温度、不同压强(p 1>p 2)下达到平衡时, 混合气体中Z 的百分含量随温度变化的曲线应为图中的 ( ) P A% 500 ℃ 200 ℃ 1.01*107 Pa 1.01*106 Pa A 的 转 化 率 T 图5 图6 图 2 氢气发生速率变化曲线 例 4 曲线图 左逆右正化学平衡移动的图像
高中化学17平衡移动和图像问题
化学平衡移动的图像专题