
United States/Canada 800.662.2566Asia Paci?c +1.650.919.7300Europe +33.(0)1.3904.6880Japan +81.(0)77.543.6116Clontech Laboratories, Inc.A T akara Bio Company U s e r M a n u a l Antibodies Protocol Guide PT3407-1 (PR99224) Published 14 September 1999
Antibodies Protocol Guide Table of Contents I. Introduction 3 II. Materials Required 3 III. Western Blotting 4 A. Preparation of Cell Lysate and Electrophoresis 4 B. Western Blotting 5 IV. Immunoprecipitation 6 A. Preparation of Cell Lysate 6 B. Immunoprecipitation 7 V. Immunofluorescence and immunocytochemistry 8 A. Sample Preparation 8 B. Immunofluorescence 9 C. Immunocytochemistry 9 VI. ELISA 11 VII. References 12 Notice to Purchaser Clontech products are to be used for research purposes only. They may not be used for any other purpose, including, but not limited to, use in drugs, in vitro diagnostic purposes, therapeutics, or in humans. Clontech products may not be transferred to third parties, resold, modified for resale, or used to manufacture commercial products or to provide a service to third parties without written ap-proval of Clontech Laboratories, Inc. Clontech, the Clontech logo and all other trademarks are the property of Clontech Laboratories, Inc. Clontech is a Takara Bio Company. ?2006
免疫共沉淀实验原理及方法 免疫共沉淀(CoIP)概述及原理 免疫共沉淀(Co-Immunoprecipitation,CoIP)是研究蛋白-蛋白间相互作用的经典方法,属于免疫沉淀技术的一类,常被用于鉴定特定蛋白复合物的中未知蛋白组分。免疫共沉淀的设计理念是,假设一种已知蛋白是某个大的蛋白复合物的组成成员,那么利用这种蛋白的特异性抗体,就可能将整个蛋白复合物从溶液中“拉”下来(常说的“pull-down”),进而可以用于鉴定这个蛋白复合物中的其他未知成员。免疫共沉淀的特点可以概括为两点,第一是天然状态,第二是蛋白复合物。 免疫共沉淀的优势: 与其他研究蛋白质相互作用技术(如GST-Pull down、酵母双杂交等)相比,免疫共沉淀鉴定的相互作用蛋白是在细胞内与目的蛋白发生的天然结合,避免了人为的影响,因此符合体内实际情况,得到的蛋白可信度更高。 免疫共沉淀的局限性和注意事项: 1. 免疫共沉淀是建立在蛋白复合物成员间彼此紧密结合的基础上,意味着松散结合的蛋白组分很可能检测不到; 2. 由于蛋白质形成复合物以后,某些表位就会被掩盖,因此可能导致使用某一种pull-down抗体,无论怎么增加抗体浓度,也极少能将不到一半的目标蛋白复合物沉淀出来,如有必要最好使用多种不同抗体分别进行CoIP;
3. 由于检测的是天然状态,因此在不同的时间和不同的处理下,CoIP拉下来的蛋白复合物都可能是不同的,当然随着实验次数的增加,得到的蛋白复合物成员也会越来越庞大; 4. 如果使用Western Blot的方法检测的蛋白复合物中的目标蛋白,则需要在试验前进行预测,具有一定的冒险性;当然如果将蛋白复合物直接进行质谱分析就不存在上述问题,但需要得到较高纯度和浓度的蛋白复合物样品也非易事,并且成本较高; 5. CoIP鉴定得到的蛋白间相互作用可能是直接作用也可能是间接作用,进一步区分还需要进行GST-Pull down等实验检测; 6. 为了保证CoIP实验的可靠性和严谨性,需要使用复合物的不同成员分别独立进行CoIP实验,并且结果应该能够彼此验证,因为原则上使用复合物的任一成员进行CoIP都会得到其他所有成员[1] 免疫共沉淀的一般操作流程(中英文对照):
1.免疫沉淀(Immunoprecipitation, IP): A.蛋白样品的准备: A1.对于10厘米细胞培养皿中的贴壁细胞,吸除细胞培养液,PBS洗涤一次,然后加入500微升至2毫升细胞裂解液裂解细胞。可以使用碧云天生产的Western及IP细胞裂解液(P0013)或各种RIPA裂解液(P0013B、P0013C、P0013D或P0013E)等进行细胞的裂解。 A2.对于组织样品参考贴壁细胞使用裂解液的比例进行裂解。 A3.对于悬浮细胞,离心收集细胞后,PBS洗涤一次,然后参考贴壁细胞的裂解方法进行裂解。 注:详细的裂解方法参考不同裂解液的详细使用方法。对于不同的培养器材,参考10厘米培养皿的裂解液的用量进行裂解。如果裂解获得的蛋白样品浓度过高,可以用裂解液或PBS适当稀释,如果蛋白样品浓度过低,在以后的裂解过程中宜适当减少裂解液的用量。 B.去除非特异性结合(可选做): B1.取200微升至1毫升蛋白样品,蛋白量约为200微克至1毫克,加入约1微克和免疫沉淀时使用的IgG种属相同的普通IgG和20微升充分重悬的Protein G Agarose,4℃缓慢摇动30分钟至2小时。 B2.2500rpm(约1000g)离心5分钟,取上清用于后续的免疫沉淀。 注:所谓种属相同的IgG是指,例如后续免疫沉淀时用的是小鼠IgG,则在本步骤中可以加入normal mouse IgG,如无normal IgG可以加入其它不影响后续检测的其它mouse IgG类型的抗体。通过和nor mal IgG和Protein G Agarose的孵育,可以充分降低非特异性的结合,降低背景。 C.免疫沉淀: C1.加入0.2-2微克用于免疫沉淀的一抗,4℃缓慢摇动过夜。 C2.再加入20微升充分重悬的Protein G Agarose,4℃缓慢摇动1-3个小时。(为方便后续的洗涤操作可以把加入充分重悬的Protein G Agarose的量调整为40微升。) C3.2500rpm(约1000g)离心5分钟,或瞬时高速离心,小心吸除上清,注意宁可留下少量上清也不能吸掉Protein G Agar ose。 C4.用准备蛋白样品时的裂解液或PBS洗涤沉淀5次,裂解液或PBS的用量每次为0.5-1毫升。洗涤时离心条件和吸除上清的要求同上面的步骤C3。 C5.完成最后一次洗涤后,去除上清,加入20-40微升1XSDS-PAGE电泳上样缓冲液Vortex重悬沉淀,瞬时高速离心把样品离心至管底。 C6.100℃或沸水浴处理3-5分钟,取部分或全部样品用于SDS-PAGE电泳,暂时不用的样品可以-20℃保存。 2.免疫共沉淀: 参考免疫沉淀的方法进行,但免疫共沉淀(co-IP)通常必须使用未经冻存的新鲜蛋白样品。普通的免疫沉淀虽然可以使用冻存的蛋白样品,但也宜用新鲜的蛋白样品为佳。 免疫共沉淀 一原理: IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“prorein A"特异性地结合到免疫球蛋白的FC片段的现象活用开发出来的方法。目前多用精制的prorein A预先结合固化在argarose的beads上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A就能吸附抗原达到精制的目的。 实验最需要注意点就是抗体的性质。抗体不同和抗原结合能力也不同,免染能结合未必能用在IP反应。建议仔细检查抗体
Pierce? Co-Immunoprecipitation (Co-IP) Kit(26149) 中文说明书 介绍: Thermo 公司的Pierce?免疫共沉淀试剂盒,可通过将铆钉抗体固定在琼脂 糖支撑物上,从裂解液中或其他复杂混合物中,分离出天然蛋白复合物。Co-IP 是一种研究蛋白与蛋白相互作用通用的方法,该方法使用一种诱饵蛋白与抗原 进行免疫沉淀反应,然后可通过免疫共沉淀任何与诱饵蛋白具有相互作用的猎 物蛋白。传统的Co-IP方法使用蛋白A或G共同洗脱抗体的重链和轻链,这很 可能导致将相关的蛋白一起洗脱下来,掩盖一些重要的结果。Pierce?免疫共沉 淀试剂盒通过将共价结合抗体固定在一个胺类活性反应树脂上解决了这一问题。该试剂盒包含足够的用于蛋白结合和恢复的缓冲液,完成对照试验的高校离心 柱和收集管,这些产品进一步缩短了操作实验的时间。 重要产品信息: 略 Co-IP实验步骤: A.抗体固定 注意:以下试验步骤是针对用无胺和其他载体蛋白稀释的10-75μg亲和纯 化抗体(参考重要产品信息一节)。根据实际使用比例参考这一协议步骤。参 考重要产品信息节表1中的建议抗体用量和树脂体积用量。 1.室温平衡胺连接耦合树脂(AminoLink?Plus Coupling Resin)和试剂; 2.为每个Co-IP反应准备2ml 1×Coupling Buffer(超纯水稀释20×Coupling Buffer);
3.轻轻涡旋混匀装有AminoLink?Plus Coupling Resin的瓶子,使其处于悬浮状态。使用大口径(或剪掉一段枪头端),添加50μl树脂悬液到Pierce提供的离心柱中,将离心柱放入微量离心管中,1000g离心1min,弃滤液; 4.添加200μl 1×Coupling Buffer 清洗树脂2次,离心弃滤液; 5.将离心柱放于纸巾上,轻巧离心柱底部,去除剩余的液体,插上底塞; 6.准备10-75μg亲和纯化抗体用于结合蛋白,调整体积至200μl,使用足够的超纯水和20×Coupling Buffer来制备1×Coupling Buffer。例如:添加10μl 20×Coupling Buffer,180μl超纯水和10μl浓度为1μg/μl。可直接添加含有超纯水、20×Coupling Buffer、亲和纯化抗体的树脂在离心柱中。 7.在通风厨中,每200μl反应体系,添加3μl氰基硼氢化钠溶液; 注:氰基硼氢化钠属剧毒物质,操作时要小心并穿戴防护服。 8.拧紧离心柱上螺帽,室温涡旋孵育90-120min,确保浆体在孵育过程中处于悬浮状态; 9.握紧底塞,拧开并拿走螺帽,将离心柱置于收集管中离心,保存滤液以便验证抗体耦合; 10.打开螺帽,添加200μl 1×Coupling Buffer,离心弃滤液,重复此步骤1次; 11. 向离心柱中添加200μl Quenching Buffer,离心弃滤液; 12. 将离心柱放于纸巾上,轻巧离心柱底部,去除残留液体,插上底塞。在树脂上添加200μl Quenching Buffer; 13. 在通风厨中,添加3μl氰基硼氢化钠溶液,拧紧螺帽;轻轻摇动并孵育15min; 14.取出底塞,拧开螺帽,将离心柱置于一收集管中,离心弃滤液; 15.打开螺帽,采用200μl 1×Coupling Buffer洗脱树脂,离心。再次重复此步骤; 16.用150μl Wash Solution洗脱树脂6次,每次洗脱后离心; 17.不管是进行细胞裂解、Co-IP,还是储存树脂,都需要继续进行下列步骤; 18.用200μl 1×Coupling Buffer洗脱树脂2次,每次需离心;
论坛里发的都是关于细胞的免疫共沉淀的实验方法,这是我做组织时用到的方法,希望能给大家有点帮助 实验方法如下: 第一步:制备组织裂解物 1. 把组织剪切成细小的碎片。 2. 融解Western及IP细胞裂解液,混匀。取适当量的裂解液,在使用前数分钟内加入PMSF,使PMSF的最终浓度为1mM。 3. 按照每20毫克组织加入100-200微升裂解液的比例加入裂解液。(如果裂解不充分可以适当添加更多的裂解液,如果需要高浓度的蛋白样品,可以适当减少裂解液的用量。) 4. 用玻璃匀浆器匀浆,直至充分裂解。 5. 充分裂解后,10000-14000g离心3-5分钟,取上清,即可进行后续的PAGE、Western、免疫沉淀和免疫共沉淀等操作。 6. 如果组织样品本身非常细小,可以适当剪切后直接加入裂解液裂解,通过强烈vortex使样品裂解充分。然后同样离心取上清,用于后续实验。 或 1. 使用洁净的工具用最快的速度切取待测组织。最好在冰上操作。以防止蛋白降解 2. 将组织放入圆底离心管中,浸入液氮以达到“snap freeze”. 如果马上裂解则将组织冰浴,否则将组织保存-80°C以备后用。 3. 每5mg组织加入300ul裂解液,使用玻璃匀浆器匀浆,直至充
分裂解。 4. 用300ul裂解液冲洗刀片两次,然后将组织液在4°C缓慢摇动2小时 5. 12000rpm 4°C.离心20分钟。轻轻的将离心管取出冰浴,将上清吸出到新的预冷的离心管中(保持冰浴),弃沉淀。 裂解液的体积要根据组织量来确定。蛋白提取物不能太过稀释一方面避免蛋白的损失,另一方面也减少后续电泳的上样量(如果需要的话)。蛋白的合适浓度为1-5 mg/ml ,最低不能少于0.1 mg/ml。第二步:预纯化裂解物 使用无关抗体或血清可以将裂解物非特异性结合Ig的蛋白去除,随后加入的agarose beads一方面将裂解物中非特异结合agarose 或sepharose beads的蛋白去除,另一方面也将加入的无关抗体和血清蛋白去除。经过处理的裂解物所得试验结果背景更低、信噪比更好。但如果最后是使用WB来检测的话,预纯化就不是特别的必要了。 主要步骤: 1. 每1ml裂解物加入50ul和IP抗体来源及亚型相同的无关抗体(例如后续免疫沉淀时用的是小鼠IgG,则在本步骤中可以加入normal mouse IgG)或者正常血清(常用兔血清),冰浴1小时 2. 加100 μl Preotein A/G agarose beads,4°C缓慢摇动10-30分钟 3. 14,000 x g 4°C离心10分钟 4. 取上清,弃沉淀
精心整理 免疫共沉淀详细步骤 实验原理 当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互白质Y beads )蛋1.RIPABuffer 配制: 基础成分: Tris-HCl (缓冲液成分,防止蛋白变性) NaCl (盐份,防止非特异蛋白聚集)
NP-40(非离子去污剂,提取蛋白;用H2O配制成10%储存液) 去氧胆酸钠(离子去污剂,提取蛋白;用H2O配制成10%储存液;避光保存) 注意:准备激酶(致活酶)实验时,不要加去氧胆酸钠,因为离子型去污剂能够使酶变性,导致活性丧失。 RIPA蛋白酶抑制剂 EDTA RIPA 激活的 NaF( 2. 配制 1) 直到全部溶解,用HCl调节PH值到7.4 2)加10ml10%的NP-40 3)加2.5ml10%的去氧胆酸钠,搅拌,直到溶液澄清 4)加1ml100mM的EDTA,用量筒定容到100ml,2-8℃保存
5)理论上,蛋白酶和磷酸酯酶抑制剂应该在使用当天同时加入(抑蛋白酶肽,亮抑酶肽,胃蛋白酶抑制剂各100μl;PMSF,Na3VO4,NaF各500μl),但是PMSF在水溶液中很不稳定,30分钟就会降解一半,所以PMSF应该在使用前现加,其他抑制剂成分可以在水溶液中稳定5天。 各种成分在工作液中的终浓度: 预冷PBS,RIPABuffer,细胞刮子(用保鲜膜包好后,埋冰下),离心机 1.用预冷的PBS洗涤细胞两次,最后一次吸干PBS; 2.加入预冷的RIPABuffer(1ml/107个细胞、10cm培养皿或150cm2培养瓶, 0.5ml/5×106个细胞、6cm培养皿、75cm2培养瓶); 3.用预冷的细胞刮子将细胞从培养皿或培养瓶上刮下,把悬液转到1.5EP管中,4℃,缓慢晃动15min(EP管插冰上,置水平摇床上);
免疫沉淀与免疫共沉淀原理及方法 一、基本概念 免疫沉淀(immunoprecipitation)是利用抗体可与抗原特异性结合的特性,将抗原(常为靶蛋白)从混合体系沉淀下来,初步分离靶蛋白的一种方法。 免疫共沉淀(coimmunoprecipitation)是一种在体外探测两个蛋白分子间是否存在特异性相互作用的一种方法。其原理是如果两个蛋白在体外体系能够发生特异性相互作用的话,那么当用一种蛋白的抗体进行免疫沉淀时,另一个蛋白也会被同时沉淀下来。与酵母双杂交技术不同,免疫共沉淀技术所利用的是抗原和抗体间的免疫反应,是一种基于体外非细胞的环境中研究蛋白质与蛋白质的相互作用的方法。 不难看出,免疫共沉淀与免疫沉淀技术所使用的原理与方法大致相似,所不同的是,在免疫共沉淀中,对靶蛋白的结合与沉淀由另一个与之发生相互作用的蛋白替代。在免疫共沉淀或免疫沉淀的基础上,通过进一步与其它技术的结合,如聚丙烯酰胺凝胶电泳,还可进一步对靶蛋白的的分子量等特性进行鉴定。 二、抗体的选择 (一)多克隆抗体 多克隆抗体因其制备相对简单,可与靶蛋白分子的多个位点结合,所形成的抗原抗体复合物较稳定因而应用的最为广泛。但多克隆抗体的缺点在于非特异性结合较多,常会导致反映本底(是否是背景)升高和一定的假阳性结果。 (二)单克隆抗体 与多克隆抗体相比,单克隆抗体往往只结合一种抗原表位,具有单一结合特异性,所以发生非特异结合的机会少,可被用于确定靶蛋白上某一部位的特殊结构,甚至可被用于区分相同靶蛋白的不同形式如构象变化和修饰。但反过来,单克隆抗体仅与单一表位结合的特性也会引起具有同一表位的不同靶蛋白间的交叉反应。 三、免疫沉淀方法 免疫沉淀的靶蛋白一般来自细胞裂解液,可以是被同位素标记的也可以是未被标记的。若为前者,免
免疫共沉淀操作步骤 具体步骤: 1. 细胞用预冷的PBS液洗涤2次,最后洗涤完成后吸干PBS液。 2. 加入预冷的RIPA Buffer(1ml/107个细胞、6cm培养皿、75cm2培养瓶)。 3. 刮留细胞:用预冷的细胞刮子将细胞从培养皿或培养瓶中上刮下,将悬液转入 1.5mlEP 管中,EP管插冰上,置于水平摇床上缓慢晃动15min。 4. 4℃,14000g离心15min。 5. 立即将上清液转移到一个新的离心管中。 6. 准备Protein A琼脂糖,用PBS液洗两遍珠子,然后用PBS液配制成50%浓度。 *为避免操作中破坏琼脂糖珠,减掉移液器枪头的尖部分。 7. 每ml总蛋白中加入100ul Protein A琼脂糖珠(50%),EP管插冰上,置于水平摇床上4℃摇晃10min。 *目的是去除非特异性杂蛋白,可降低背景。 8. 4℃,14000g 离心15min,将上清转移到一个新的离心管中。 9. 测定蛋白浓度,可选用Bradford法做蛋白标准曲线。 10. 蛋白定量,分装,-20℃保存,可保存1个月。 11. 用PBS液将总蛋白稀释至约1ug/ml。 12. 加入500ul稀释好的兔抗到总蛋白中。 13. 于摇床上4℃缓慢摇动抗原抗体混合物,可选择过夜或室温放置2h。 14. 加入100ul Protein A琼脂糖珠用以捕捉抗原抗体复合物,摇床4℃缓慢摇动抗原抗体混合物过夜或者室温孵育1h。 15. 14000rpm瞬时离心5s,去上清,收集琼脂糖珠-抗原抗体的复合物。 16. 用800ul预冷RIPA buffer冲洗3遍。
17. 用60ul 2倍上样缓冲液将琼脂糖珠-抗原抗体复合物悬起,轻轻敲打混匀。 18. 将上样样品煮5min。 19. 14000g离心,收集剩余琼脂糖珠。 20. 将上清电泳,电泳前应再次煮5min变性。 21. 上清也可以暂时冻-20℃,留待以后电泳。 基础成分 (1)Tris-HCl(防止蛋白变性的缓冲液成分) (2)NaCl(防止非特异性蛋白聚集的盐分) (3)NP-40(用H2O配置成10%储存液。NP-40为非离子去污剂,用于提取蛋白) (4)去氧胆酸钠(用H2O配置成10%储存液;提取蛋白用离子去污剂;避光保存) *因为离子型去污剂能够使酶变性,导致活性丧失,准备激酶(致活酶)实验时,不要加去氧胆酸钠。
实验方法如下: 第一步:制备组织裂解物 1. 把组织剪切成细小的碎片。 2. 融解Western及IP细胞裂解液,混匀。取适当量的裂解液,在使用前数分钟内加入PMSF,使PMSF的最终浓度为1mM。 3. 按照每20毫克组织加入100-200微升裂解液的比例加入裂解液。(如果裂解不充分可以适当添加更多的裂解液,如果需要高浓度的蛋白样品,可以适当减少裂解液的用量。) 4. 用玻璃匀浆器匀浆,直至充分裂解。 5. 充分裂解后,10000-14000g离心3-5分钟,取上清,即可进行后续的PAGE、Western、免疫沉淀和免疫共沉淀等操作。 6. 如果组织样品本身非常细小,可以适当剪切后直接加入裂解液裂解,通过强烈vortex使样品裂解充分。然后同样离心取上清,用于后续实验。 或 1. 使用洁净的工具用最快的速度切取待测组织。最好在冰上操作。以防止蛋白降解 2. 将组织放入圆底离心管中,浸入液氮以达到“snap freeze”. 如果马上裂解则将组织冰浴,否则将组织保存-80°C以备后用。 3. 每5mg组织加入300ul裂解液,使用玻璃匀浆器匀浆,直至充分裂解。 4. 用300ul裂解液冲洗刀片两次,然后将组织液在4°C缓慢摇动2小时 5. 12000rpm 4°C.离心20分钟。轻轻的将离心管取出冰浴,将上清吸出到新的预冷的离心管中(保持冰浴),弃沉淀。 裂解液的体积要根据组织量来确定。蛋白提取物不能太过稀释一方面避免蛋白的损失,另一方面也减少后续电泳的上样量(如果需要的话)。蛋白的合适浓度为1-5 mg/ml ,最低不能少于0.1 mg/ml。 第二步:预纯化裂解物 使用无关抗体或血清可以将裂解物非特异性结合Ig的蛋白去除,随后加入的agarose beads一方面将裂解物中非特异结合agarose 或sepharose beads的蛋白去除,另一方面也将加入的无关抗体和血清蛋白去除。经过处理的裂解物所得试验结果背景更低、信噪比更好。但如果最后是使用WB来检测的话,预纯化就不是特别的必要了。 主要步骤: 1. 每1ml裂解物加入50ul和IP抗体来源及亚型相同的无关抗体(例如后续免疫沉淀时用的是小鼠IgG,则在本步骤中可以加入normal mouse IgG)或者正常血清(常用兔血清),冰浴1小时 2. 加100 μl Preotein A/G agarose beads,4°C缓慢摇动10-30分钟 3. 14,000 x g 4°C离心10分钟 4. 取上清,弃沉淀 为提高蛋白回收率,可将Preotein A/G agarose beads(上述沉淀)用裂解液洗涤1-2次,所得上清和前面的合在一起 Note:要确保最大可能将正常血清(或无关Ig)从标本中去除。 第三步:免疫沉淀 1. 取10-500 μg细胞裂解物,加入推荐量的抗体:抗体用量取决于蛋白的量以及抗体的亲和力。可参考说明书推荐的抗体用量,如果说明书没有推荐,也可以参考以下数据:. o 多抗血清:1-5 μl o 亲和纯化的多抗:1 μg o 腹水(单抗):0.2-1 μl
·因为你IP的时候用的抗体,为了说明是你的抗体特异性的IP下来的东西,而不是其他抗体IP 下来的,所以要用IgG作为对照。 当细胞在非变性条件下被裂解时,完整的细胞内存在的许多蛋白质-蛋白质间结合的保持下来。这一事实可被用于检测和确定生理条件下相关的蛋白质-蛋白质之间的相互作用。这种方法叫做免疫共沉淀 IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“prorein A"特异性地结合到免疫球蛋白的FC 片段的现象活用开发出来的方法。目前多用精制的prorein A预先结合固化在argarose的beads上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A就能吸附抗原达到精制的目的。 其优点为:(1)相互作用的蛋白质都是经翻译后修饰的,处于天然状态;(2)蛋白的相互作用是在自然状态下进行的,可以避免人为的影响;(3)可以分离得到天然状态的相互作用蛋白复合物。缺点为:(1)可能检测不到低亲和力和瞬间的蛋白质-蛋白质相互作用;(2)两种蛋白质的结合可能不是直接结合,而可能有第三者在中间起桥梁作用;(3)必须在实验前预测目的蛋白是什么,以选择最后检测的抗体,所以,若预测不正确,实验就得不到结果,方法本身具有冒险性。 实验流程为: (1)转染后24-48 h 可收获细胞,加入适量细胞裂解缓冲液(含蛋白酶抑制剂),冰上裂解30min, 细胞裂解液于4°C,最大转速离心30 min后取上清; (2)取少量裂解液以备Western blot分析,剩余裂解液加1μg相应的抗体加入到细胞裂解液,4°C缓慢摇晃孵育过夜; (3)取10μl protein A 琼脂糖珠,用适量裂解缓冲液洗3 次,每次3,000 rpm 离心3 min; (4)将预处理过的10μl protein A 琼脂糖珠加入到和抗体孵育过夜的细胞裂解液中4°C缓慢摇晃孵育2-4h,使抗体与protein A琼脂糖珠偶连; (5)免疫沉淀反应后,在4°C 以3,000 rpm 速度离心3 min,将琼脂糖珠离心至管底;将上清小心吸去,琼脂糖珠用1ml裂解缓冲液洗3-4次;最后加入15μl 的2×SDS 上样缓冲液,沸水煮5分钟; (6)SDS-PAGE, Western blotting或质谱仪分析。 注意的问题: (1)细胞裂解采用温和的裂解条件,不能破坏细胞内存在的所有蛋白质-蛋白质相互作用,多采用非离子变性剂(NP40或Triton X-100)。每种细胞的裂解条件是不一样的,通过经验确定。不能用高浓度的变性剂(0.2%SDS),细胞裂解液中要加各种酶抑制剂,如商品化的cocktailer。 (2)使用明确的抗体,可以将几种抗体共同使用 (3)使用对照抗体: 单克隆抗体:正常小鼠的IgG或另一类单抗 兔多克隆抗体:正常兔IgG 在免疫共沉淀实验中要保证实验结果的真实性,应注意以下几点: (1) 确保共沉淀的蛋白是由所加入的抗体沉淀得到的,而并非外源非特异蛋白,单克隆抗体的使用有助于避免污染的发生;
关于染色质免疫共沉淀ChIP实验原理及实验总结 ChIP实验原理 在活细胞状态下固定蛋白质-DNA复合物,并将其随机切断为一定长度范围内的染色质小片段,然后通过免疫学方法沉淀此复合体,特异性地富集目的蛋白结合的DNA片段,通过对目的片断的纯化与检测,从而获得蛋白质与DNA相互作用的信息。 可以利用ChIP研究转录因子(transcription factor, TF)与启动子(promoter)的关联性。由于ChIP采用甲醛固定活细胞或者组织的方法,所以能比较真实的反映细胞内TF与Promoter的结合情况。这个优势是EMSA这个体外研究核酸与蛋白相互结合的实验方法所不能比拟的。当用甲醛处理时,相互靠近的蛋白与蛋白,蛋白与核酸(DNA或RNA)之间会产生共价键。细胞内,当TF与Promoter相互结合(生物意义上的结合)时,它们必然靠的比较近,或者契合在一起,这个时候用甲醛处理,能使它们之间产生共价键。 一般ChIP的流程是:甲醛处理细胞——收集细胞,超声破碎——加入目的蛋白的抗体,与靶蛋白-DNA复合物相互结合——加入Protein A,结合抗体-靶蛋白-DNA复合物,并沉淀——对沉淀下来的复合物进行清洗,除去一些非特异性结合——洗脱,得到富集的靶蛋白-DNA复合物——解交联,纯化富集的DNA-片断——PCR分析。 ChIP实验步骤 第一天:
(一)、细胞的甲醛交联与超声破碎。 1、取出1平皿细胞(10cm平皿),加入243ul 37%甲醛,使得甲醛的终浓度为1%。(培养基共有9ml) 2、37摄氏度孵育10min。 3、终止交联:加甘氨酸至终浓度为0.125M。 450ul 2.5M甘氨酸于平皿中。混匀后,在室温下放置5min即可。 4、吸尽培养基,用冰冷的PBS清洗细胞2次。 5、细胞刮刀收集细胞于15ml离心管中(PBS依次为5ml,3ml和3ml)。预冷后2000rpm 5min收集细胞。 6、倒去上清。按照细胞量,加入SDS Lysis Buffer。使得细胞终浓度为每200ul含2×106个细胞。这样每100ul溶液含1×106个细胞。再加入蛋白酶抑制剂复合物。 假设MCF7长满板为5×106个细胞。本次细胞长得约为80%。即为4×106个细胞。因此每管加入400ul SDS Lysis Buffer。 将2管混在一起,共800ul。 7、超声破碎:VCX750,25%功率,4.5S冲击,9S间隙。共14次。当然,如果实验室有Bioruptor这种神器的话那就轻松了。 (二)、除杂及抗体哺育。 8、超声破碎结束后,10,000g 4度离心10min。去除不溶物质。 留取300ul做实验,其余保存于-80度。 300ul中,100ul加抗体做为实验组;100ul不加抗体做为对照组;100ul 加入4ul 5M NaCl (NaCl终浓度为0.2M),65度处理3h解交联,跑电泳,
免疫共沉淀(CoIP)-精品 2020-12-12 【关键字】方法、作用 标签:免疫共沉淀蛋白质 免疫共沉淀(Co-Immunoprecipitation)可以:(1)测定两种目标蛋白质是否在体内结合;(2)确定一种特定蛋白质的新的作用搭档;(3)分离得到天然状态的相互作用蛋白复合物。 详细 实验方法 免疫共沉淀(Co-IP) 实验方法原理免疫共沉淀(Co-Immunoprecipitation)是以抗体和抗原之间的专一性作用为基础的用于研究蛋白质相互作用的经典方法。是确定两种蛋白质在完整细胞内生理性相互作用的有效方法。 其原理是:当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。如果用蛋白质X的抗体免疫沉淀X,那么与X在体内结合的蛋白质Y也能沉淀下来。目前多用精制的proreinA预先结合固化在argarose的beads上,使之与含有抗原的溶液及抗体反应后,beads上的proreinA就能吸附抗原达到精制的目的。这种方法常用于测定两种目标蛋白质是否在体内结合;也可用于确定一种特定蛋白质的新的作用搭档。 实验材料蛋白质 试剂、试剂盒RIPA BufferPBSProtein Aagarose琼脂糖考马斯亮蓝染色液 仪器、耗材离心机摇床EP管细胞刮子离心管培养板电泳仪电泳槽高效液相色谱仪 实验步骤一、试剂准备 1. 预冷PBS,RIPA Buffer,细胞刮子(用保鲜膜包好后,埋冰下),离心机。 2. 用预冷的PBS洗涤细胞两次,最后一次吸干PBS。 3. 加入预冷的RIPA Buffer(1 ml/107个细胞、10 cm培养皿或150 cm2培养瓶,0.5 ml/5×106个细胞、6 cm培养皿、75 cm2培养瓶)。 4. 用预冷的细胞刮子将细胞从培养皿或培养瓶上刮下,把悬液转到1.5EP管中,4℃,缓慢晃动15 min(EP管插冰上,置水平摇床上)。 5. 4℃,14000 g离心15 min,立即将上清转移到一个新的离心管中。 6. 准备Protein A agarose,用PBS 洗两遍珠子,然后用PBS配制成50%浓度,建议减掉枪尖部分,避免在涉及琼脂糖珠的操作中破坏琼脂糖珠。 7. 每1 ml总蛋白中加入100 μl Protein A琼脂糖珠(50%),4℃摇晃10 min(EP管插冰上,置水平摇床上),以去除非特异性杂蛋白,降低背景。 8. 4℃,14000 g离心1 5min,将上清转移到一个新的离心管中,去除Protein A珠子。
免疫沉淀技术的原理和抗体选择 随着生物技术的发展,蛋白质与基因之间的互作逐渐成为科研人员的关注热点,染色免疫沉淀技术由此而生,并被应用到各个科研领域当中。本文聚焦染色质免疫沉淀技术的原理、应用和抗体选择等问题,让您对其有更全面的了解和认识。 随着人类基因组测序工作的基本完成,功能基因组学的研究逐渐成为研究的热点。而基因表达的调控又是功能基因组学的一个重要研究领域。研究某个蛋白因子的调控功能,可以通过对蛋白活性(激活或抑制其活性),蛋白数量(过表达Overexpression或基因缺陷型Knockout), 以及蛋白功能(功能缺陷型蛋白Dominant-negative mutation)的控制,影响下游基因的表达,而下游基因的变化又可以通过基因芯片(cDNA Microarray),抑制消减杂交(Suppression Subtractive Hybridization),差异显示RT-PCR等方法进行研究。然而这些方法都无法提供证据证明这些变化是受某个蛋白因子直接调节的,还是间接的其他变化导致的结果。所以,要想提供蛋白因子直接调控的证据,就要直接检测蛋白质-DNA的相互作用。传统的方法包括转录因子结合实验(Transcription Factor Assay),电泳迁移率变动分析(electrophoretic mobility shift assay),DNase I 足印法(DNase I footprinting),酵母单杂交系统等。但这些方法都有一定的局限性,不能充分反映生理情况下DNA与蛋白相互作用的真实情况,而且很难捕捉到在染色质水平上基因表达调控的动态瞬时事件。 染色质免疫沉淀技术(Chromatin Immunoprecipitation,简称ChIP)是研究体内蛋白质与DNA相互作用的一种技术。它利用抗原抗体反应的特异性,可以真实地反映体内蛋白因子与基因组DNA结合的状况。特别是近年来由于该技术不断的发展和完善,其应用范围已经从研究目的蛋白与已知靶序列间的相互作用,发展到研究目的蛋白与整个基因组的未知序列的相互作用;从研究一个目的蛋白与DNA 的相互作用,发展到研究两个蛋白与DNA共同结合的相互作用;从研究启动子区域的组蛋白的修饰,发展到研究结合在DNA序列上的蛋白复合物。随着对基因功能研究的不断深入,这项技术正越来越多的被应用于科研的各个领域。 ChIP技术的原理 染色质免疫沉淀技术的原理是:在生理状态下把细胞内的DNA与蛋白质交联在一起,通过超声或酶处理将染色质切为小片段后,利用抗原抗体的特异性识别反应,将与目的蛋白相结合的DNA片段沉淀下来。染色质免疫沉淀技术一般包括细胞固定,染色质断裂,染色质免疫沉淀,交联反应的逆转,DNA的纯化,以及DNA的鉴定。因为ChIP实验涉及的步骤多,结果的重复性较低,所以对ChIP实验过程的每一步都应设计相应的对照,而且对结果的分析也需要有一定的经验。对于刚刚开始使用ChIP技术的研究人员来说,使用成熟的商品化试剂盒和相关的技术服务会达到事半功倍的效果,比如millipore.html' target='_blank'>Millipore公司的EZ-ChIP试剂盒就是专门为初学者设计的入门产品。下面我们就最基本的实验步骤,实验中的小技巧以及需要注意的问题简单介绍一下。
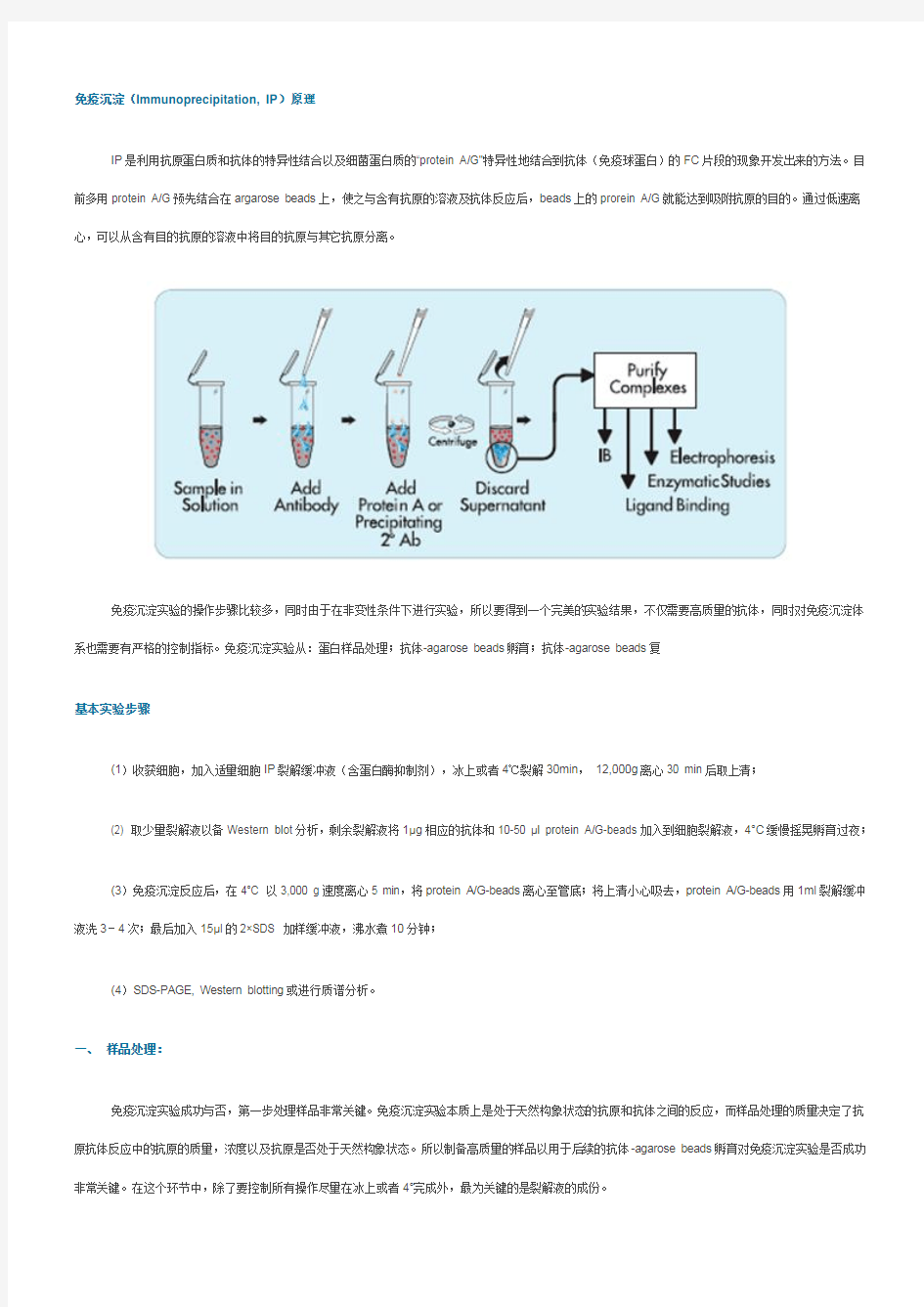
免疫共沉淀原理及步骤 免疫沉淀(Immunoprecipitation, IP)原理 IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“protein A/G"特异性地结合到抗体(免疫球蛋白)的FC片段的现象开发出来的方法。目前多用protein A/G预先结合在argarose beads上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A/G就能达到吸附抗原的目的。通过低速离心,可以从含有目的抗原的溶液中将目的抗原与其它抗原分离。 免疫沉淀实验的操作步骤比较多,同时由于在非变性条件下进行实验,所以要得到一个完美的实验结果,不仅需要高质量的抗体,同时对免疫沉淀体系也需要有严格的控制指标。免疫沉淀实验从:蛋白样品处理;抗体-agarose beads孵育;抗体-agarose beads复合物洗涤到最后的鉴定,每步都非常关键,需要严格控制实验流程中每个关键步骤的质量,才能最终达到你的实验目的。 IP实验步骤 基本实验步骤 (1)收获细胞,加入适量细胞IP裂解缓冲液(含蛋白酶抑制剂),冰上或者4℃裂解30min, 12,000g 离心30 min后取上清; (2) 取少量裂解液以备Western blot分析,剩余裂解液将1μg相应的抗体和10-50 μl protein A/G-beads加入到细胞裂解液,4°C缓慢摇晃孵育过夜; (3)免疫沉淀反应后,在4°C 以3,000 g速度离心5 min,将protein A/G-beads离心至管底;将上清小心吸去,protein A/G-beads用1ml裂解缓冲液洗3-4次;最后加入15μl的2×SDS 加样缓冲液,沸水煮10分钟; (4)SDS-PAGE, Western blotting或进行质谱分析。一、样品处理: 免疫沉淀实验成功与否,第一步处理样品非常关键。免疫沉淀实验本质上是处于天然构象状态的抗原和抗体之间的反应,而样品处理的质量决定了抗原抗体反应中的抗原的质量,浓度以及抗原
染色体免疫共沉淀(Chip)实验报告 步骤一:样品准备 试剂和仪器: Biopulverizer(biospec) 37% formaldehyde 甘氨酸(Glycine) PBS protease inhibitors 步骤二:细胞交联 1. 向客户提供的细胞沉淀中加入1ml 细胞培养基,混匀细胞后转移到15ml离心管中。 2. 向15ml离心管中加入270ul 37%甲醛溶液,使得甲醛的终浓度为1%,室温温育10min。 3. 向反应体系中各加入505ul 2.5M甘氨酸到终浓度为125mM,室温温育5min以终止交联反应。 4. 135x g,4°C离心10min,去上清,并用冰冷的10ml 1XPBS迅速漂洗两次。 5. 吸净PBS后,加入1ml PBS+protease inhibitors混合液,并转移到1.5ml离心管中。800Xg,4°C离心 5min,小心去掉上清。 步骤三:细胞裂解 试剂: 裂解缓冲液1: 50mM Hepes-KOH pH7.5; NaCl 140mM; EDTA 1mM; glycerol 10%;NP-40 0.5%; Tritonx -100 0.25%。 裂解缓冲液2: 10mM Tris-HCl pH8.0; NaCl 100mM; EDTA 1mM pH8.0; Na-Deoxycholate 0.1% Protease inhibitors。 步骤: 1. 加入蛋白酶抑制剂(终浓度为1x) 到所有的裂解缓冲液中。 2. 用1ml的裂解缓冲液1重悬上述处理的样品,4°C旋转混合10min后,800g,4°C离心5min,弃上清。 3. 用300ul 裂解缓冲液2重悬样品,冰上放置30min。 步骤四:超声破碎DNA 仪器: Bioruptor(Diagenode) 步骤: (1)、将超声仪器Bioruptor 调到中档“Mid”(M)。 (2)、在超声池中注入一定量的冰水。 (3)、将上述1.5ml Ep管置于超声固定架中。 (4)、将带有Ep管的固定架放入已注入冰水的超声池中,超声10分钟。(30 seconds “ON” & 30 seconds “OFF”。) (5)、超声完成后,各取25ul直接接交联和纯化(具体操作见后洗脱和纯化步骤)后于2%琼脂糖凝胶电泳。超声后电泳图附件1。
染色质免疫共沉淀技术(ChIP) 真核生物的基因组DNA以染色质的形式存在。因此,研究蛋白质与DNA在染色质环境下的相互作用是阐明真核生物基因表达机制的基本途径。染色质免疫沉淀技术(chromatin immunoprecipitation assay, CHIP)是目前唯一研究体内DNA 与蛋白质相互作用的方法。它的基本原理是在活细胞状态下固定蛋白质-DNA 复合物,并将其随机切断为一定长度范围内的染色质小片段,然后通过免疫学方法沉淀此复合体,特异性地富集目的蛋白结合的DNA片段,通过对目的片断的纯化与检测,从而获得蛋白质与DNA相互作用的信息。CHIP不仅可以检测体内反式因子与DNA的动态作用,还可以用来研究组蛋白的各种共价修饰与基因表达的关系。而且,CHIP与其他方法的结合,扩大了其应用范围:CHIP与基因芯片相结合建立的CHIP-on-chip方法已广泛用于特定反式因子靶基因的高通量筛选;CHIP与体内足迹法相结合,用于寻找反式因子的体内结合位点;RNA-CHIP 用于研究RNA在基因表达调控中的作用。由此可见,随着CHIP的进一步完善,它必将会在基因表达调控研究中发挥越来越重要的作用。 染色体免疫共沉淀(Chromatin Immunoprecipitation,ChIP)是基于体内分析发展起来的方法,也称结合位点分析法,在过去十年已经成为表观遗传信息研究的主要方法。这项技术帮助研究者判断在细胞核中基因组的某一特定位置会出现何种组蛋白修饰。ChIP不仅可以检测体内反式因子与DNA的动态作用,还可以用来研究组蛋白的各种共价修饰与基因表达的关系。近年来,这种技术得到不断的发展和完善。采用结合微阵列技术在染色体基因表达调控区域检查染色体活性,是深入分析癌症、心血管疾病以及中央神经系统紊乱等疾病的主要代谢通路的一种非常有效的工具。 它的原理是在保持组蛋白和DNA联合的同时,通过运用对应于一个特定组蛋白标记的生物抗体,染色质被切成很小的片断,并沉淀下来。IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“prorein A”特异性地结合到免疫球蛋白的FC片段的现象活用开发出来的方法。目前多用精制的prorein A预先结合固化在argarose的beads上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A就能吸附抗原达到精制的目的。实验最需要注意点就是抗体的性质。抗体不同和抗原结合能力也不同,免染能结合未必能用在IP反应。建议仔细检查抗体的说明书。特别是多抗的特异性是问题。其次,要注意溶解抗原的缓冲液