
2020届高三化学第一轮复习精品学案(紧扣考纲·精华版)卤
族元素高中化学
第三讲卤族元素
【考纲要求】
1.卤素在性质上的相似性、特性和递变规律。
2 以.卤素知识为载体,判定〝拟卤素〞具有或不具有的性质,即信息迁移题。
3.综合考查.卤素单质的制备、收集、性质、储存与其它物质反应等实验题运算。
教与学方案
笔记与反思
【自学反馈】
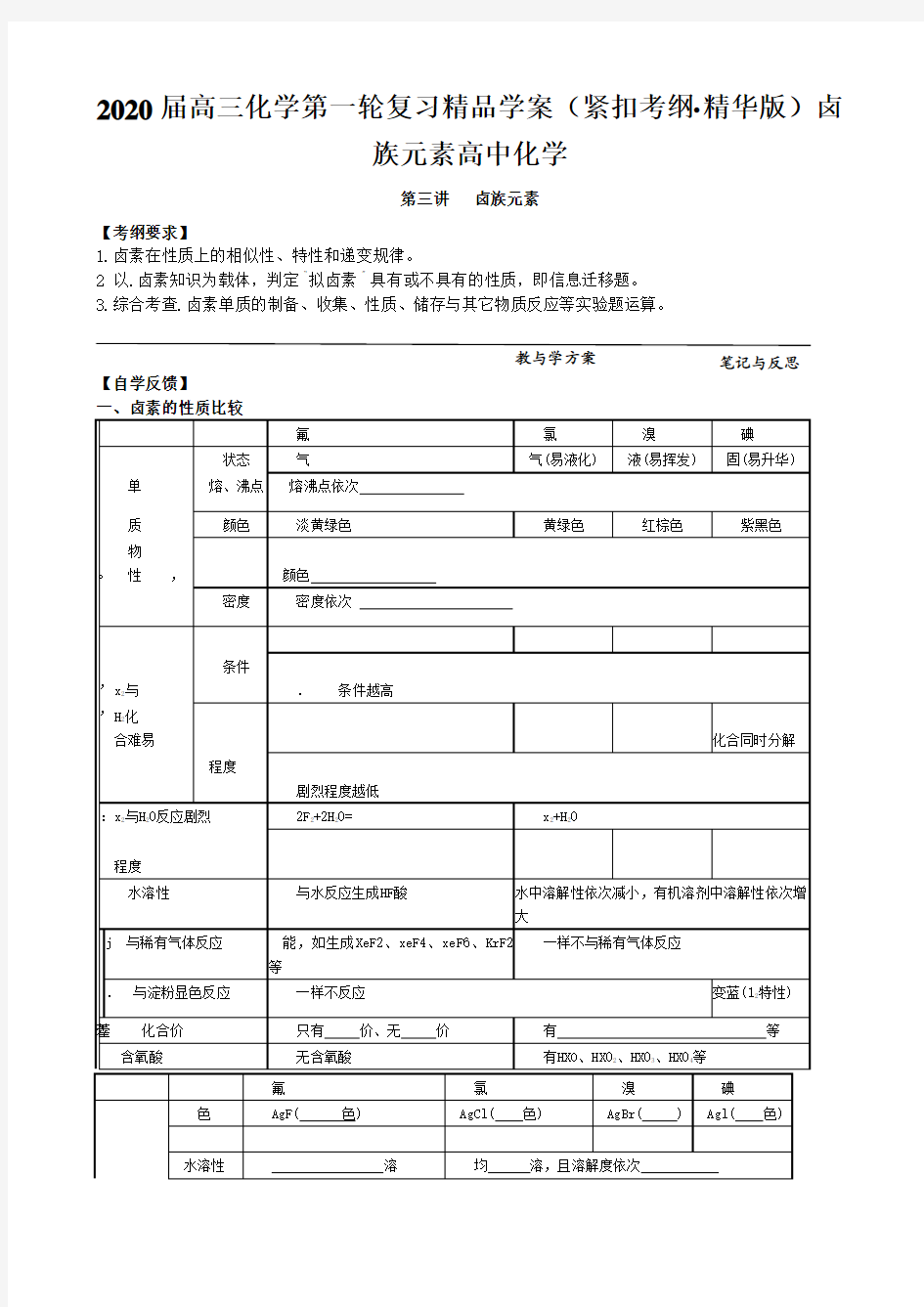
一、卤素的性质比较
二、相似性和递变性
(1)相似性
1.最外层差不多上个电子,常见的负化合价为价。氯、溴、碘的正化合价为+1、+2、+3、+5、+7价。
2. 卤素差不多上爽朗的,具有性。与水、碱溶液反应时,除氟气外均可发生卤素的自身氧化还原反应。
3.卤化氢为气体,溶与水,在潮湿空气中形成,水溶液差不多上挥发性的酸。
4.均可与金属单质作用生成,与氢气化合形成 (HX),与水反应:X2+H20=HX+HXO(x为 Cl、Br、I)。
5、最高价氧化物(R207)对应水化物均为,其水溶液呈性(F例外,不存在R207和HR04)。
6、含氧酸盐不稳固,具有较强的性;
7、单质都有毒,单质在有机溶剂中的溶解度比水中。
(2)递变性:
1、卤素原子随核电荷数的,原子半径逐步,核对最外层电子的吸引力逐步,单质的氧化性依次;
2、(从F—I,下同)单质的颜色逐步,密度逐步,熔沸点依次,毒性逐步,在有机溶剂中的溶解度逐步;
3、与氢气化合能力由到,氢化物的稳固性由到,氢化物水溶液的酸性由
到,氢化物的还原性由到;
4、同一元素含氧酸随元素价态降低氧化性,酸性 (如氧化性HCIO>HCl03>HCl04;酸性HCIO 5、同一价态(cl、Br、I)含氧酸氧化性,酸性 (如:氧化性HCl03 6、卤化银的颜色逐步,溶解度逐步。 (3)专门性: 1.Br2是常温下唯独呈液态的非金属单质,易挥发,蒸气有毒。储存液溴采纳水封法。 2.I2单质易升华,淀粉遇I2变蓝;AgI可用与人工降雨,碘盐可防止甲状腺肿。 3.HClO4是常见含氧酸中最强酸,而HClO是氯的含氧酸中氧化性最强的酸。 4.F2、HF均腐蚀玻璃。AgF易溶与水。 5.F2不能把氯、溴、碘从氢化物或盐溶液中置换出来,因发生2F2 + 2H2O = 4HF + O2 6、氟元素的化合价只有价,无含氧酸、氟单质能与稀有气体反应,生成一系列化合物(如XeF2 KrF2等),氟单质与水发生置换反应:2F2+2H20=4HF+02; 7、氟化氢由于形成分子间键相互缔合,沸点反常的; 8、氢氟酸是酸,但能腐蚀玻璃4HF+Si02===SiF4 +2H20; 9、AgX中只有溶于水,且不具有感光性;CaX2中只有难溶于水; 10、溴、碘在不同极性的溶剂中生成不同颜色的溶液 (如碘水,呈棕色;I,的CCl。溶液呈紫红色)。 溴、碘易溶于有机溶剂中,因溶解量的多少不一,出现深浅也不一样。 【例题解析】 [例1]F2是氧化性最强的非金属单质,在加热条件下,等物质的量的F2与烧碱完全反应,生成NaF、H2O 和另一种气体,该气体可能是〔〕 A.H2 B.HF C.O2 D.OF2 解题思路: 。 易错点: 。 [例2]在一定条件下,RO3n-和I-发生反应的离子方程式如下: RO3n- + 6I-+ 6H+=R-+3I2+3H2O 〔1〕 RO3n-中R元素的化合价是。 〔2〕R元素的原子最外层电子数是。 解题思路: 。 易错点: 。 【考题再现】 1.(03年上海高考题) 向 NaBr、NaI、Na2SO3混合溶液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是〔〕 A.NaCl 、 Na2SO4 B.NaCl 、NaBr、Na2SO4 C. NaCl 、 Na2SO4、I2 D. NaCl 、NaI、 Na2SO4 思维方法: 。 展望高考: 2.(02年江苏综合)在100ml含等物质的量HBr和H2SO3的溶液里通入0.01molCl2,有一半Br-变为Br2(Br2能氧化H2SO3) 。原溶液中HBr和H2SO3的浓度都等于〔〕 A.0.0075mol/L B.0.0018 mol/L C. 0.075 mol/L D.0.08 mol/L 思维方法: 。 展望高考: 【巩固练习】 1.课堂反馈 1.以下变化规律错误的选项是〔〕 A.微粒半径:F- B.稳固性:HI>HBr>HCl>HF C.水溶液酸性:HF< HCl < HBr < HI D.阴离子的还原性:F- 2.以下物质的储存方法正确的选项是〔〕 A.氢氟酸储存在塑料盖的玻璃瓶中 B.氯水盛放在棕色细口瓶中 C.液溴盛放在用橡皮塞的玻璃瓶中 D.固态碘放在棕色细口瓶中3.碘跟氧能够形成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是〔〕 A.I2O3 B. I2O4 C. I4O7 D. I4O9 4.都能使溴水因发生化学反应而褪色的物质是〔〕 A.H2S,NaOH溶液,裂化汽油,石炭酸 B.AgNO3溶液,CCl4,氯水 C.甲苯,异戊二烯,乙醇 D.Na2SO3溶液,FeCl2溶液,氨水,K2SO4溶液 5.BrCl能发生以下反应:nBrCl+2M=MCl n+MBr n〔M为+n价金属元素〕,BrCl +H2O=HCl+HBrO;以下推论不正确的选项是〔〕 A.BrCl具有和卤素单质相似的化学性质 B.BrCl和M反应时,BrCl只作氧化剂 C.BrCl和NaOH溶液反应生成NaCl、NaBrO两种盐 D.将BrCl跟FeSO4溶液反应,溶液会变成无色 6.由于碘是卤素中原子半径较大的元素,可能出现金属性。以下事实最能够讲明那个结论的是〔〕 A.差不多制得了IBr、ICl等卤素互化物 B.差不多制得了I2O5等碘的氧化物 C.差不多制得了I(NO3)3,I(ClO4)3?2H2O等含I3+离子的化合物 D.碘〔I2〕易溶于KI等碘化物溶液,形成I3-离子 课外作业 1.以下各种液体分不跟溴水混合并振荡、静置,混合物分为上下两层,上层几乎无色的是〔〕A.CCl4 B. 苯 C. KI溶液 D. 酒精2.向KI溶液中加入AgNO3溶液,直到完全反应为止。结果反应后溶液的质量恰好等于KI溶液的质量,那么该AgNO3溶液中溶质的质量分数为〔〕A.50% B. 48.8% C. 38.2% D.72.3% 3.某温度下CaF2饱和溶液的物质量浓度为2×10-4mol/L,那么在此温度下CaF2的溶解度为〔设CaF2在水中达到饱和时,溶液密度为1g/cm3〕〔〕A. 1.56×10-3g B. 1.56×10-2g C. 7.8×10-4g D. 无法运算 4.以下各组物质,不用任何化学试剂即可鉴不的是〔〕A.氯化氢、溴化氢、碘化氢 B. 氯水、NaBr溶液、盐酸 C.NaCl溶液、NaBr溶液、KI溶液 D. 盐酸、NaCl溶液、AgNO3溶液、Na2CO3溶液 5.氟气是氧化性最强的非金属单质。在加热条件下,等物质的量的氟与烧碱完全反应,生成NaF、H2O和另一种气体,该气体可能是〔〕A.H2 B. HF C. O2 D. OF2 6.把112ml〔标准状况〕的氯气通入100ml、1mol/L的FeBr2溶液中,其反应的离子方程式 是。 7.在淀粉碘化钾溶液中,滴加少量的NaClO溶液,并加入少量硫酸,溶液赶忙变蓝。反应的离子方程式 是。在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐步消逝,这是因 为,离子方程式 是。以上试验条件下,ClO-、I2、SO42-的氧化性由强到弱的顺序 是。 8.AgF易溶于水,AgCl、AgBr、AgI都具有感光性,在光照下容易发生分解。现将5ml Ag+浓度为0.1mol/L的溶液与等物质的量的碱金属盐混合,恰好完全反应。待卤化物沉淀后过滤,并在200W灯泡下烘干,得到固体物质1.297×10-2g。 ①试分析溶液中析出的沉淀是不是卤化银? ②试通过运算确定溶液中析出的沉淀物的相对分子质量是它的化学 式。 卤族元素 [卤族元素] 简称卤素.包括氟(F)、氯(C1)、溴(Br)、碘(I)和放射性元素砹(At).在自然界中卤素无游离态,都是以化合态的形式存在(1)位置:VIIA (2)原子结构:相同点:最外层电子数均为7 不同点:F I电子层数逐渐增多,原子半径逐渐增大。 (3)相似性: ①单质均为双原子非极性分子 ②主要化合价为 -1价,最高正价为+7价(F除外) ③都具有强氧化性 [卤素单质的物理性质] 说明 (1)实验室里,通常在盛溴的试剂瓶中加水(即“水封”),以减少溴的挥发. (2)固态物质不经液态而直接变成气态的现象,叫做升华.升华是一种物理变化.利用碘易升华的性质,可用来分离、提纯单质碘. (3)Br2、I2较难溶于水而易溶于如汽油、苯、四氯化碳、酒精等有机溶剂中.医疗上用的碘酒,就是碘(溶质)的酒精(溶剂)溶液.利用与水互不相溶的有机溶剂可将Br2、I2从溴水、碘水中提取出来(这个过程叫做萃取). [卤素单质的化学性质] (1)卤素的原子结构及元素性质的相似性、递变性. (2)卤素单质与氢气的反应. H 2 + F 2 = 2HF (冷暗处爆炸) H 2 +Cl 2 = 2HCl (光照爆炸,点燃) H 2 +Br 2 2HBr H 2 +I 2 2HI 长期加热并不断分解 卤化氢:易溶于水,在空气中形成白雾。 ①HCl 山东省淄博第一中学2018届高三上学期期中考试 英语试题 注意事项: 1. 本试题分第Ⅰ卷和第Ⅱ卷两部分。第Ⅰ卷为选择题,共100分;第Ⅱ卷为非选择题,共50分,满分150分,考试时间为120分钟。 2. 第Ⅰ卷共9页,60小题,每题只有一个正确答案,请将选出的答案标号涂在答题卡上。 第一部分:听力(共两节,满分30分) 第一节 听下面5段对话。每段对话后有一个小题,从题中所给的A、B、C三个选项中选出最佳选项。听完每段对话后,你都有10秒钟的时间来回答有关小题和阅读下一小题。每段对话仅读一遍。 1. How will the woman go to Vienna? A. By car. B. By train. C. By plane. 2. Where does the conversation take place? A. In a shop. B. In a hotel. C. In a laundry. 3. Where will the woman go first? A. To a cinema. B. To a restaurant. C. To a bank. 4. What are the two speakers doing? A. Watching TV. B. Listening to the radio. C. Playing a game live. 5. What did the boy use to wear to school? A. A hat. B. A tie. C. A jacket. 第二节(共15小题;每小题1.5分,满分22.5分) 听下面5段对话或独白。每段对话或独白后有几个小题,从题中所给的A、B、C三个选项中选出最佳选项,并标在试卷的相应位置。听每段对话或独白前,你将有时间阅读各个小题,每小题5秒钟;听完后,各小题将给出5秒钟的作答时间。每段对话或独白读两遍。 听下面一段对话,回答第6和第7两个小题。 6. Where are the speakers? A. In a theatre. B. In a restaurant. C. To a plane. 卤族元素化学方程式总结 一、化合反应 1.H2+Cl2 2 HCl 火焰苍白色 2.H2+Cl2 2 HCl 混合气体在强光照的条件下发生爆炸,属于光化学反应 3.H2+F混合即发生爆炸 4.H2+ 5.H2+I2 6. 2 Na +产生白烟 7.Cu +2棕黄色的烟,溶液绿色或蓝色 8. 2 Fe +3褐色的烟,溶液棕黄色 9.Zn +I2少量水作催化剂 10. 2 Ag +变色眼镜 11.Xe(过量XeF2F2能和惰性气体反应 12. 2 HCl +O2↑次氯酸不稳定,在光照或加热的条件下分解 13. 2 HX +O2↑X=Cl、Br、I 14.+Cl2AgX的感光性 15. 2 Ag +Br2 16. 2 AgX 2 Ag +X2X=Cl、Br、I 三、复分解反应 17.Na2CO3+2 AgNO3Ag2CO3↓+ 2 NaNO3白色或淡黄色沉淀 18.Ag2CO3+2 HNO3 2 AgNO3+H2O +CO2↑ 19.Ag2CO3+2 HCl 2 AgCl↓+H2O +CO2↑ 20.Ag2CO3+H2SO4Ag2SO4↓+H2O +CO2↑ 21.NaCl +AgNO3AgCl↓+NaNO3白色沉淀 22.NaBr +AgNO3AgBr↓+NaNO3淡黄色沉淀 23. KI + AgNO 3 AgI ↓+ KNO 3 黄色沉淀 24. Ca(ClO)2 + 2 HCl CaCl 2 + 2 HClO 强酸制弱酸 酸性:HCl >HClO 25. Ca(ClO)2 + 2 CO 2 + 2 H 2O Ca(HCO 3)2 + 2 HClO 强酸制弱酸 酸性:H 2CO 3>HClO 26. SiO 2 + 4 HF SiF 4↑+ 2 H 2O 雕刻玻璃;酸性氧化物和酸反应 27. NaCl + H 2SO 4(浓)4 + HCl ↑ 28. 2 NaCl + H 2SO 4(Na 2SO 4 + 2 HCl ↑ (HSO 4-+42― ―Q ) 29. NaCl + NaHSO Na 2SO 4 + HCl ↑ 30. CaF 2 + H 2SO 4(浓)CaSO 4 + 2 HF ↑ 萤石和浓硫酸反应 31. NaBr + H 3PO 4(浓)NaH 2PO 4 + HBr ↑ 32. NaI + H 3PO 4(浓) NaH 2PO 4 + HI ↑ 四、置换反应 33. 2 F 2 + 2 H 2O 4 HF + O 2 氧化性:F 2>O 2 34. 2 NaBr + Cl 2 2 NaCl + Br 2 卤素之间的置换反应 35. 2 KI + Br 2 2 KBr + I 2 36. 2 KI + Cl 2 2 KCl + I 2 氧化性Cl 2>Br 2>I 2 37. 2 NaX(s) + F 2 2 NaF + X 2 F 2和固体NaX 发生置换反应,X =Cl 、Br 、I 五、复杂的氧化还原反应 38. Cl 2 + H 2O HCl + HClO HClO 有强氧化性,漂白性和杀菌消毒能力 39. X 2 + H 2O HX + HXO X =Cl 、Br 40. Cl 2 + 2 NaOH NaCl + NaClO + H 2O 实验室余氯吸收 41. 2 Cl 2 + 2 Ca(OH)2 CaCl 2 + Ca(ClO)2 + 2 H 2O 高中卤族元素化学方程式汇编 高中卤族元素化学方程式汇编 Cl2+Cu Cu Cl2 3Cl2+2Fe 2FeCl3 Cl2+2 Na 2Na Cl Cl2 + H2 2HCl 3Cl2 +2 P 2PCl3 Cl2 + PCl3 PCl5 Cl2+H2O==HCl+HClO Cl2+2NaOH===NaCl+NaClO+H2O 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O Cl2+2FeCl2===2FeCl3 Ca(ClO)2+H2O+ CO2(少量)== Ca CO3↓+2 HClO Ca(ClO)2+2H2O+ 2CO2(多量)== Ca(HCO3)2↓+2 HClO Ca(ClO)2+2 HCl == Ca Cl2+2 HClO(强酸制弱酸) 2HClO 2HCl+O2↑ F2 + H2 === 2HF 2F2 +2H2O===4HF+O2 Br2 + H2 === 2H Br(500oC) I2 + H2 2HI 2Cl2+2NaBr===2NaCl+Br2 Cl2 +2 K I ===2 K Cl+I2 HCl + AgNO3 === AgCl↓+ HNO3 Br2 +2 K I ===2 K Br+I2 4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O HCl + AgNO3 === AgCl↓ + HNO3 HCl + AgNO3 =AgCl↓(白色)+HNO3 NaBr+AgNO3 = AgBr↓(浅黄色)+NaNO3 NaI + AgNO3 === AgI↓(黄色)+ Na NO3 2AgBr 2Ag+Br2(AgCl、AgI类似) Na2SO3+ H2O +Cl2== Na2SO4 淄博市2018年普通高中分学校招生计划 单位班数人数 总计621 30796 一、淄川区92 4520 山东省淄博第四中学26 1300 山东省淄博第四中学新疆班 3 131 山东省淄博第四中学新疆班(预科) 3 129 淄博市育才中学(民办) 2 100 淄博市淄川中学20 1000 淄川金城中学(民办) 6 300 淄博第十中学10 460 淄川般阳中学20 1000 山东省淄博第二中学 2 100 二、张店区129 6290 山东省淄博第五中学16 800 山东省淄博第十七中学13 650 淄博实验中学32 1600 淄博实验中学(中美班) 3 90 淄博市张店区第一中学 6 300 淄博市张店区铝城第一中学 4 200 山东省淄博第十一中学20 1000 山东省淄博第十一中学(中加班) 2 60 山东省淄博第十八中学 6 300 淄博中学22 1100 淄博高新区外国语学校(民办) 3 90 山东省淄博第一中学 2 100 三、博山区62 3086 山东省淄博第一中学28 1386 — 1 — 淄博市博山区实验中学22 1100 山东省淄博第二中学 2 100 万杰朝阳学校(民办)10 500(市外230)四、临淄区96 4800 山东省淄博第七中学24 1200 淄博市临淄中学48 2400 临淄区英才中学(民办)24 1200(市外800)五、周村区48 2400 山东省淄博第六中学26 1300 淄博市周村区实验中学22 1100 六、桓台县72 3600 山东省桓台第一中学30 1500 山东省桓台第二中学28 1400 桓台县渔洋中学14 700 七、高青县48 2400 山东省高青一中40 2000 淄博鲁才高级中学(民办)8 400(市外50)八、沂源县74 3700 沂源县第一中学40 2000 沂源县第二中学20 1000 山东省沂源县鲁山学校(民办)14 700(市外100) — 2 — 文件编号:GD/FS-9083 (计划范本系列) 高中化学教研工作计划详 细版 When The Goal Is Established, It Analyzes The Internal And External Conditions Of Organization, And Puts Forward The Organizational Goals To Be Achieved And The Ways To Achieve Them. 编辑:_________________ 单位:_________________ 日期:_________________ 高中化学教研工作计划详细版 提示语:本计划文件适合使用于目标确立时,根据对组织外部环境与内部条件的分析,提出在未来一定时期内要达到的组织目标以及实现目标的方案途径。文档所展示内容即为所得,可在下载完成后直接进行编辑。 一、指导思想 坚持以科学发展观与和谐教育目标为指导,进一步加强素质教育,立足龙岗化学教学实际,深化课程教学改革,强化课堂教学研究,加强教学实施指导,以人为本,以服务为宗旨,促进教育均衡发展、和谐发展,为提高高中化学教学质量,作出应有贡献。 二、工作思路 1.聚焦课堂,服务教学。积极围绕“优质高效的课堂教学”开展教学调研、课改实践、教学研训、质量监控等教研活动,努力提高课堂教学效率。 2、以教师专业发展为中心,积极开展教学研究、教学指导和教学服务工作,努力提高教师专业发 展水平。 3、以教研为平台,做好资源整合工作,尝试开展网络教研教学活动,提高教研实效。 4.立足校本,研训一体。深入学校教研组,指导科组建设和校本教研,督促课改实验,逐步形成教、学、研一体化的务实高效的学校教研机制。 5. 创设平台,促进发展。配合区教研室的统一部署,积极创新和充分利各种激励手段,搭建丰富多彩的发展平台,为教师提供充分展示自我,发展自我的机会。 三、工作重点 聚焦课堂,提高教学效率 1、加强课堂教学研究,努力提高课堂教学的有效性。大力倡导和推行启发式教学,加强课堂教学质效研究。要以促进每个学生素质发展为目标,着力解 淄博一中高2017级2018—2019学年第二学期期中考试 信息技术试题 2019年4月 注意事项: 1.本试题分第Ⅰ卷和第Ⅱ卷两部分。第Ⅰ卷为选择题,共60分;第Ⅱ卷为非选择题,共40分,满分100分,考试时间为40分钟。 2.第Ⅰ卷共4页,25小题,1-15每小题2分,16-25每小题3分;请将选出的答案标号(A、B、C、D)涂在答卷纸上。 第Ⅰ卷(共60分) 一、单项选择题(25小题) 1、OCR(光学字符识别)软件可以实现的功能() A、将印刷的书刊扫描成图像文件 B、识别图像中的字符 C、识别文本中的字符 D、将文本文件转换为图像文件 2、下列关于矢量图的说法正确的是() A、色彩和层次丰富的照片常用矢量图 B、矢量图放大后会出现失真 C、矢量图是像素的集合 D、矢量图又叫向量图 3、随着计算机技术的发展,模式识别的应用越来越广泛,比如语音输入、光学字符识别(OCR)、手写输入等。这些主要都是得益于() A、多媒体技术的发展 B、虚拟现实的实现 C、人工智能技术的发展 D、网络技术的发展 4、在Word2003文档中插入“页眉和页脚”,可以使用的菜单命令是() A、表格 B、视图 C、编辑 D、格式 5、在Excel中,要输入012017后能够保留前缀0,正确的输入方法是() A 、“012017 B、’012017 C、=012017 D、012017 6、“才高八斗,学富五车”用来形容一个人的知识非常多,因当时使用笨重的书简,以至于搬家时要用车来拉。从信息技术发展来看,这是属于第几次信息技术革命以前的事?() A、第三次 B、第二次 C、第四次 D、第一次 7、在Excel中输入数值“123”时默认对齐方式右对齐,那么将该单元格格式改为“文本”时的对齐方式是() A、居中 B、左对齐 C、右对齐 D、分散对齐 8、小明下载了一个名为“世界真奇妙.3gp”的文件,但无法打开观看,他应该() A、在计算机上安装相应的文件播放软件 B、将文件扩展名改为avi,再双击打开 C、将文件扩展名改为doc,用word打开 D、将文件删除 9、有一个网页包含下列元素:①文字、②图片、③超链接、④音频,将该网页以“文本文件”类型保存到本地磁盘,则保存下来的文件内容包括() A、① B、①② C、①②③④ D、①②③ 10、在GB2312字符集中,用两个字节表示一个汉字的编码,那么一个汉字所占用的二进制位为() A、 2位 B、 4位 C、8位 D、 16位 11、二进制运算规则为:1+1=10,1*1=1,那么二进制算式11*11等于() A、 121 B、1011 C、1001 D、都不对 12、下列属于数据库管理系统软件的是() A、 Access B、 VB C、 WinZip D、 FlashGet 13、将本地电脑收藏夹的文件复制到其他电脑上,不能实现收藏夹内网址的快速迁移() A、正确 B、错误 14、艺术字在word文档中是作为“图片”插入的。()A、正确B、错误 15、控制论的奠基人维纳认为,信息和物质、能源是人类生存和发展所依赖的三大要素。() A、正确 B、错误 16、在VB语言中,字符串运算符“+”和“&”的作用是把两个或多个字符串连接成一个字符串,则表达式"20" + "13" & "20+13"的运算结果是() A、"3333" B、 "201333" C、 "201320+13" D、 "332013" 17、已知在VB语言中,Int(x)函数的功能是返回不大于x的最大整数,fix(x)函数的功能是返回x的整数部分(截掉x的小数部分),则表达式int(2.88)+fix(-3.89))的值是() A、 0 B、其他三个选项答案均不对 C、 -1 D、 -2 18、在VB语言中,下列合法的变量名是() 编号:YB-JH-0958 ( 工作计划) 部门:_____________________ 姓名:_____________________ 日期:_____________________ WORD文档/ A4打印/ 可编辑 高中化学教研组工作计划(通 用版) Frequently formulating work plans can make people’s life, work and study more regular, and develop good habits, which is a habit necessary for success in doing things 高中化学教研组工作计划(通用版) 摘要:经常制订工作计划,可以使人的生活、工作和学习比较有规律性,养成良好的习惯,因为习惯了制订工作计划,于是让人变得不拖拉、不懒惰、不推诿、不依赖,养成一种做事成功必须具备的习惯。本内容可以放心修改调整或直接使用。 【篇一】 一、指导思想 为解决教育教学中存在的问题和提高教学质量为突破口,以提 高教师实施新课程改革为契机,以集体备课研究为中心,以提高教 学质量为目标,进一步深化教育科研理论的学习和校本研究制度建 设,为创科研型优秀备课组而努力奋斗。 坚持教育创新,深化教育改革,以“学习——研究——指导— —服务”为基本职能,以改革课堂教学为主体,以提高师资素质为 关键,全面推进素质教育,提高教学质量,结合学科特点,加强学 生的思想品德及爱国主义教育。 二、工作目标 1、组织教师钻研大纲、钻研考纲、钻研教材、钻研教法、教研 学生,尤其是在钻研教法上狠下功夫。 卤族元素及溴、碘的提取 1.我们日常生活中蕴藏着丰富的化学知识,利用日常生活中常见的物质:碘酒、食盐、食醋、84消毒液(内含NaClO),不能完成的任务是() A.检验奶粉中是否加有淀粉 B.除去煮水锅中的水垢 C.检验自来水中是否有Cl- D.洗去白色衣服上的番茄汁 解析:选C可用碘酒检验买来的奶粉中是否加有淀粉,加入碘酒,如果变蓝色证明含有淀粉,A不符合题意;水垢的主要成分是碳酸钙,而食醋中含醋酸,碳酸钙可以与醋酸反应,B不符合题意;实验室用硝酸酸化的硝酸银溶液检验氯离子,缺少硝酸银溶液,所以无法完成检验,C符合题意;次氯酸具有强氧化性,利用84消毒液可洗去白色衣服上的番茄汁,D不符合题意。 2.(2018·江苏高考)下列有关从海带中提取碘的实验原理和装置能达到实验目的的是() A.用装置甲灼烧碎海带 B.用装置乙过滤海带灰的浸泡液 C.用装置丙制备用于氧化浸泡液中I-的Cl2 D.用装置丁吸收氧化浸泡液中I-后的Cl2尾气 解析:选B A项,灼烧碎海带应在坩埚中进行,不能用烧杯,装置甲不能达到实验目的;B项,用装置乙过滤海带灰浸泡液能达到实验目的;C项,用浓盐酸和MnO2制取氯气需要加热,装置丙不能达到实验目的;D项,吸收Cl2应用NaOH溶液,装置丁不能达到实验目的。 3.在玻璃中加入溴化银(AgBr)和CuO可制得变色镜片,其中所含物质及变色原理如图所示,下列说法不正确的是() A.溴化银应避光保存 B.变色镜片可反复变色 C.变色镜片颜色变深的过程发生了化合反应 D.变色镜片中的氧化铜在变色过程中质量不变 解析:选C根据题图知,溴化银见光易分解,所以AgBr应该避光保存,A正确;根据题图知,在强光照射条件下,溴化银分解生成Ag和溴,在暗光下,二者反应生成AgBr,所以变色镜片可反复变色,B正确;AgBr分解生成Ag和溴是分解反应,Ag和溴在催化剂条件下反应生成AgBr是化合反应,C错误;催化剂在反应中只改变反应速率,但本身质量不变,CuO是催化剂,所以变色镜片中的CuO在变色过程中质量不变,D正确。 4.某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是() A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强 B.F处棉花球变成蓝色,说明Br2的氧化性比I2强 C.E处发生反应的离子方程式为Cl2+2Br-===2Cl-+Br2 D.G装置中NaOH溶液与Cl2反应的离子方程式为 2OH-+Cl2===ClO-+Cl-+H2O 解析:选B E处发生反应Cl2+2Br-===2Cl-+Br2,则E处棉花球变成黄色,说明Cl2的氧化性比Br2强,A、C正确;F处可能发生反应Cl2+2I-===2Cl-+I2,也可能发生反应Br2+2I-===2Br-+I2,F处棉花球变蓝色只能说明有碘单质生成,由于氯气的干扰,所以不能说明Br2的氧化性比I2强,B错误;G为尾气处理装置,装置中NaOH溶液与Cl2反应的离子方程式为2OH-+Cl2===ClO-+Cl-+H2O,D正确。 5.海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法不正确的是() 一、第九章静电场及其应用选择题易错题培优(难) 1.如图所示,一带电小球P用绝缘轻质细线悬挂于O点。带电小球Q与带电小球P处于同一水平线上,小球P平衡时细线与竖直方向成θ角(θ<45°)。现在同一竖直面内向右下方缓慢移动带电小球Q,使带电小球P能够保持在原位置不动,直到小球Q移动到小球P位置的正下方。对于此过程,下列说法正确的是() A.小球P受到的库仑力先减小后增大 B.小球P、Q间的距离越来越小 C.轻质细线的拉力先减小后增大 D.轻质细线的拉力一直在减小 【答案】AD 【解析】 【分析】 【详解】 画出小球P的受力示意图,如图所示 当小球P位置不动,Q缓慢向右下移动时,Q对P的库仑力先减小后增大,根据库仑定律可得,QP间的距离先增大后减小;轻质细线的拉力则一直在减小,当Q到达P的正下方时,轻质细线的拉力减小为零,故选AD。 2.电荷量相等的两点电荷在空间形成的电场有对称美.如图所示,真空中固定两个等量异种点电荷A、B,AB连线中点为O.在A、B所形成的电场中,以O点为圆心半径为R的圆面垂直AB连线,以O为几何中心的边长为2R的正方形平面垂直圆面且与AB连线共面, 两个平面边线交点分别为e、f,则下列说法正确的是( ) A.在a、b、c、d、e、f六点中找不到任何两个场强和电势均相同的点 B.将一电荷由e点沿圆弧egf移到f点电场力始终不做功 C.将一电荷由a点移到圆面内任意一点时电势能的变化量相同 D.沿线段eOf移动的电荷,它所受的电场力先减小后增大 【答案】BC 【解析】 图中圆面是一个等势面,e、f的电势相等,根据电场线分布的对称性可知e、f的场强相同,故A错误.图中圆弧egf是一条等势线,其上任意两点的电势差都为零,根据公式 W=qU可知:将一正电荷由e点沿圆弧egf移到f点电场力不做功,故B正确.a点与圆面内任意一点时的电势差相等,根据公式W=qU可知:将一电荷由a点移到圆面内任意一点时,电场力做功相同,则电势能的变化量相同.故C正确.沿线段eof移动的电荷,电场强度先增大后减小,则电场力先增大后减小,故D错误.故选BC. 【点睛】等量异种电荷连线的垂直面是一个等势面,其电场线分布具有对称性.电荷在同一等势面上移动时,电场力不做功.根据电场力做功W=qU分析电场力做功情况.根据电场线的疏密分析电场强度的大小,从而电场力的变化. 3.如图所示,竖直平面内固定一倾斜的光滑绝缘杆,轻质绝缘弹簧上端固定,下端系带正电的小球A,球A套在杆上,杆下端固定带正电的小球B。现将球A从弹簧原长位置由静止释放,运动距离x0到达最低点,此时未与球B相碰。在球A向下运动过程中,关于球A 的速度v、加速度a、球A和弹簧系统的机械能E、两球的电势能E p随运动距离x的变化图像,可能正确的有() A.B. C.D. 文件编号:GD/FS-1950 (计划范本系列) 高中化学教研工作计划详 细版 When The Goal Is Established, It Analyzes The Internal And External Conditions Of Organization, And Puts Forward The Organizational Goals To Be Achieved And The Ways To Achieve Them. 编辑:_________________ 单位:_________________ 日期:_________________ 高中化学教研工作计划详细版 提示语:本计划文件适合使用于目标确立时,根据对组织外部环境与内部条件的分析,提出在未来一定时期内要达到的组织目标以及实现目标的方案途径。文档所展示内容即为所得,可在下载完成后直接进行编辑。 一、指导思想 高中化学教学要以全日制普通中学教科书(经全国中小学教材审定委员会20XX年审查通过)和20XX 年高考考试大纲为蓝本,以系统掌握化学基础知识和化学基本技能为基础,以提高课堂教学效率为重点,以培养学生能力为突破口,全面贯彻教育方针,提高学生的素质。 二、教学进度计划 上学期、下学期、上学期、下学期、第一次质检、第二次质检 第一至四章一册第五章至第二册第一章 理:第二册第二至五章第二节 文:第二册第一至四章 理:第二册全部内容加高三部分内容 文:第二册第五至七章高三、高一内容高中全部无机内容 三、队伍建设 原则:立体互动,以教为研,以研促教,机制创新,整体发展。 1、各高中要建立一个由各年级中观念新颖、品德高尚、业务过硬的教师组成的相对稳定的化学核心科组,其主要任务是负责全校高中的研究和指导,确立研究课题并组织实施,指导各中心组开展各种教研活动,指导常规教学及系统培养化学青年教师,评估教学效果,评审教师教学论文等。 2、各年级成立教研中心组。其主要任务是组织开展本年级的常规教学研究(主要是进行教材处理、 第三章常见元素的单质及其重要化合物 第一节卤素 【知识网络】 1.分清氯水、溴水的成分,反应时的作用和褪色的原理。 氯水中正因为存在可逆反应Cl2+H2O HCl+HClO,使其成分复杂且随着条件的改变,平衡发生移动,使成分发生动态的变化。当外加不同的反应物时,要正确判断是何种成分参与了反应。氯水中的HClO能使有色物质被氧化而褪色。反之,也有许多物质能使氯水、溴水褪色,发生的变化可属物理变化(如萃取),也可属化学变化,如歧化法(加碱液)、还原法(如Mg、SO2等)、加成法(加不饱和的有机物)等。值得一提的是有时虽然发生化学变化,但仍生成有色物,如Br2与Fe或KI反应。 2.区分清楚萃取和分液的原理、仪器、操作以及适用范围与其他物质分离方法不同。 萃取和分液是物质分离的众多方法之一。每一种方法适用于一定的前提。分液适用于分离互不相溶的两种液体,而萃取是根据一种溶质在两种互不相溶的溶剂中溶解性有很大差异从而达到提取的目的。一般萃取和分液结合使用。其中萃取剂的合理选择、分液漏斗的正确使用、与过滤或蒸馏等分离方法的明确区分等是此类命题的重点和解决问题的关键。 命题以选择何种合适的萃取剂、萃取后呈何现象、上下层如何分离等形式出现。解题关键是抓住适宜萃取剂的条件、液体是否分层及分层后上下层位置的决定因素。分液操作时注意“先下后上、下流上倒”的顺序。为确保液体顺利流出,一定要打开上部塞子或使瓶塞与瓶颈处的小孔或小槽对齐,与大气相通。 【典型例题评析】 例1 氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的生成物是(1998年全国高考题) A.HI和HClO B.HCl和HIO C.HClO3和HIO D.HClO和HIO 高中化学知识点总结:卤族元素 1.氯气 (1)分子式Cl2电子式结构式Cl—Cl (2)物理性质:黄绿色有刺激性气味、有毒、易液化能溶于水(1:2)。 (3)化学性质: ①与金属反应将金属氧化成高价态Cu+Cl2=CuCl2(棕黄色烟) ②与非金属反应 H2+Cl2=2HCl(苍白色火焰,工业上制HCl), H2+Cl2=2HCl(爆炸) ③与水反应 Cl2+H2O=HCl+HClO,HCIO是一种弱酸(HClO=H++ClO–),具有强氧化性,可进行漂白、消毒杀菌等,在光照下易分解:2HClO=2HCl+O2↑ ④与碱反应 Cl2+2NaOH=NaCl+NaClO+H2O(用于吸收多余Cl2) 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2漂白粉(混合物)+2H2O 漂白粉的有效成分为Ca(ClO)2在空气中易失效变质: Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO ⑤与还原性物质反应 Cl2+2Br –=2Cl–+Br2Cl2+H2S=2HCl+S↓ (4)制法: ①实验室制法 MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O ②业制法 2NaCl+2H2O=2NaOH+H2↑+Cl2↑ 2NaCl(熔融)=2Na+Cl2↑ 2.卤族元素 (1)卤族元素性质的通性及递变性 ①元素周期表中的位置:第ⅦA族 ②原子结构相同点:最外层电子数均为7个同点:电子层数不同 ③主要性质的相似性:单质均为双原子非极性分子;主要化合价为?l价,最高正价为+7价(F除外);单质具有强氧化性。 ④主要性质的递变性。(从F到I)原子半径和离子半径逐渐增大;非金属性及单质氧化性逐渐减弱,即氧化性F2>Cl2>Br2>I2;与H2化合生成HX的反应由易至难,且氢化物的稳定性由强到弱,即稳定性HF>HCl>HBr>HI;最高价氧化物的承化物的酸性逐渐减弱;卤离的还原性增强,前面元素的单质能把后面的元素置换出来。单质的颜色变深,熔沸点升高。 (2)卤素及其化合物特性归纳 ①Cl2、Br2、I2与水反应类型相同,可用通式X2+H2O=HX+HXO,而F2特殊F2+2H2O=4HF+O2,由此得出它们与碱反应Cl2、Br2、I2相同,F2不同。 ②F2、Cl2、Br2与Fe作用得+3价铁,而I2+Fe=FeI2。 ③Cl–、Br –、I–跟AgNO3分别产生白色沉淀、浅黄色沉淀、黄色沉淀;而AgF可溶于水,无色溶液。 高中化学必修一测试题 可能用到的相对原子质量:H:1 Mg:24 C:12 O:16 S:32 Cl:35.5 Na:23 Al:27 K:39 Fe:56 Cu:64 Zn:65 第Ⅰ卷选择题(共48 分) 一 、 选择题(本 大 题包括16个小题,每小 题3分,共 4 8 分 。 每 . 正确选项符合题意) 1.以下是一些常用的危险品标志,装运浓硫酸的包装箱应贴的图标是( ) A B C D 2.已知由NaHS 、MgSO 4、NaHSO 3组成的混合物,硫元素的质量分为a%,则混合物中氧元素的质量分数为 ( ) A.a% B.2a% C.1―1.75a% D.1―0.75a% 3.下列各组物质中,与O 2和O 3的关系相同的一组是( ) A .Na 和Na + B .金刚石和C 60 C .1H 2和2H 2 D .水和重水 1 1 4.氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性。下列叙述中不正确的是 A.红热的铜丝在氯气中剧烈燃烧,生成棕黄色烟。 B.钠在氯气中燃烧,生成白色的烟。 C.纯净的氢气在氯气中安静的燃烧,在集气瓶口形成白色烟雾。 D.氯气能与水反应生成盐酸和次氯酸,次氯酸见光易分解。 5.某学生想利用下图装置(烧瓶位置不能移动)收集下列气体:① H 2②Cl 2③CH 4④HCl⑤NH 3⑥ NO ⑦NO 2⑧SO 2, 下列操作正确的是 A.烧瓶是干燥的,由 A 进气收集①③⑤ B.烧瓶是干燥的,由 B 进气收集②④⑥⑦⑧ C.在烧瓶中充满水,由 A 进气收集①③⑤⑦ D.在烧瓶中充满水,由 B 进气收集⑥ 6.下列叙述中正确的是( ) A .碳族元素都是非金属元素,其非金属性随核电荷数的增加而减弱 B .碳族元素的单质都有导电性 C .硅酸的酸性比碳酸的强 2017-2018学年高中化学教研组上学期工作计划 一、指导思想 根据常州市教科院和xx区教师发展中心工作计划,本学期高中化学教研工作的思路是:努力实施和推进新课程改革,以课堂教学过程中师生面临的实际问题为重心,以教师和学生发展为根本,以教科研为手段,以课题研究为抓手。加强对课程与教材的研究,加强对教法与学法的研究,加强对课堂教学的研究,加强高考工作的研究,加强教学资源的建设。立足服务,正确指导,有效管理,力求在新形势下本区域化学教研工作均衡发展和可持续发展。 二、工作重点 1.认真学习《常州市中小学学科教学建议》,加强教学常规管理。努力创新教学方式和学习方式,加强对课堂教学有效性的研究与反思,提高课堂教学效率。努力打造化学精彩课堂,引领师生成长。以高中化学教学中的关键问题为抓手,进一步强化化学实验教学,开展以发展学生化学学科核心素养为目标的课堂教学研究。 2.加强对高考和小高考工作的研究,重视《课程标准》、《考试说明》的学习与研究,认清形势、把握方向,制定科学有效的备考策略和详细计划。备考工作坚持从基础年级做起,整个学段要统筹考虑。 3. 加强学习高中化学新课程标准,研究新课程必修模块和选修模块的课堂教学策略。高一年级重点是研究初、高中的衔接问题和新课标下必修课教学的要求问题。高二年级重点是做好必修模块和选修模块教学内容和方法的衔接,策略和方法的研究,努力解决选修课的难 点问题。高三年级重点是加强对2017高考的研究和总结,认清形势、把握方向,制定科学有效的备考策略,要根据课标要求、高考要求、学生要求、学校要求制定好符合本校实际的复习计划,并有效实施。认真做好两次模考的分析工作,及时调整本校的复习方法和措施。 4.加强对教研方式的研究,通过区域教研、校本教研、网络教研、联合教研等多种研修方式,努力质化校本教研,并在立足校本的基础上加强合作。在有条件的学校尝试学科发展规划的研制工作。继续加强学校教研组、备课组建设,努力倡导主题研究式教研活动、学术沙龙活动、同题异构及异题同构等多种形式的活动,营造化学教学的学术研究氛围,加强教研活动的针对性和有效性。加强校际交流与合作,做好青年教师培养工作和部分学校薄弱学科的扶持工作。 5.加强对课题研究针对性的细化和落实,改善研究方式,提高研究效果,提升教科研能力与水平。抓好已立项课题的研究和管理工作,并在新课程改革中从实施、评价和教学技术等方面开展多角度、多层面的专项性课题研究。 6.加强对课程资源的开发和利用,做到共享资源,分享经验与智慧。通过现场研讨和 QQ群等渠道积极推进高中化学教学的交流与合作,增强交流的便利性、即时性和开放性。加大技术改变课堂的探索和实践,加强技术与学科教学的有效整合。各校要积极参与省教研室“教学新时空”在线学习和同步教研活动。适时组织并做好向先进地区、单位的学习交流活动。进一步拓宽广大化学老师参与交流和研究的路径和平台。 三、主要活动 八、九月份: 卤族元素教学设计 ●教学用具 第一课时:投影仪、保存少量液溴的试剂瓶、封有碘的玻璃管、I2 固体、溴水、碘水、酒精、CCl4 溶 液、酒精灯、试管夹、火柴。p1EanqFDPw 第二课时:投影仪、溴水、碘水、KI 溶液、氯水、NaBr 溶液、NaCl 溶液、CCl4 溶液、AgNO3 溶液、 稀 HNO3、淀粉液、胶头滴管。DXDiTa9E3d ●教学过程 ★第一课时 [引入课题]上节课我们学习了有关氯气的性质,知道构成氯分子的氯原子最外层有 7 个电子,在自 然界存在的元素中,还有另外四种元素原子的最外层电子数也是 7,它们是氟、溴、碘、砹,我们把这些原 子最外层电子数均为 7 的元素称为卤族元素,简称卤素。RTCrpUDGiT [板书]第二节 卤族元素 [讲解]我们知道,元素的性质与原子的结构有密切的联系。下面我们来分析卤素原子结构上的异同 点。 [投影]卤素的原子结构 ( 工作计划 ) 单位:_________________________ 姓名:_________________________ 日期:_________________________ 精品文档 / Word文档 / 文字可改 2020-2021学年度高中化学教研 组工作计划(最新) The work plan has clear goals and specific steps to enhance work initiative, reduce blindness, and make work proceed in an orderly manner. 2020-2021学年度高中化学教研组工作计 划(最新) 20xx-20xx学年度高中化学教研组工作计篇1 一、指导思想 坚持以科学发展观与和谐教育目标为指导,进一步加强素质教育,立足龙岗化学教学实际,深化课程教学改革,强化课堂教学研究,加强教学实施指导,以人为本,以服务为宗旨,促进教育均衡发展、和谐发展,为提高高中化学教学质量,作出应有贡献。 二、工作思路 1、聚焦课堂,服务教学。积极围绕“优质高效的课堂教学”开展教学调研、课改实践、教学研训、质量监控等教研活动,努力提高课堂教学效率。 2、以教师专业发展为中心,积极开展教学研究、教学指导和教学服务工作,努力提高教师专业发展水平。 3、以教研为平台,做好资源整合工作,尝试开展网络教研教学活动,提高教研实效。 4、立足校本,研训一体。深入学校教研组,指导科组建设和校本教研,督促课改实验,逐步形成教、学、研一体化的务实高效的学校教研机制。 5、创设平台,促进发展。配合区教研室的统一部署,积极创新和充分利各种激励手段,搭建丰富多彩的发展平台,为教师提供充分展示自我,发展自我的机会。 三、工作重点 聚焦课堂,提高教学效率 1、加强课堂教学研究,努力提高课堂教学的有效性。大力倡导和推行启发式教学,加强课堂教学质效研究。要以促进每个学生素质发展为目标,着力解决学生主动乐学和学习习惯养成的问题,有效提升学生的学业成绩和综合素质。高中化学卤族元素知识点归纳
英语---山东省淄博第一中学2018届高三上学期期中考试
卤族元素化学方程式总结
高中卤族元素化学方程式汇编
淄博市2018年普通高中分学校招生计划
高中化学教研工作计划详细版
山东省淄博第一中学2018-2019学年高二下学期期中考试信息技术试题(含答案)
高中化学教研组工作计划(通用版)
高中化学 卤族元素及溴、碘的提取
山东省淄博第一中学物理 静电场及其应用专题试卷
高中化学教研工作计划详细版
高考化学 卤族元素知识精讲
高中化学知识点总结:卤族元素
2019-2020山东淄博一中人教版高中化学必修一期末模拟测试题
2017-2018学年高中化学教研组上学期工作计划
高中化学《卤族元素》详细教案设计
●教学目标 知识目标 1.归纳卤族元素性质变化规律; 2.解释可逆反应的涵义; 3.识别卤素的一些特殊性质; 4.区别卤化银的性质、用途; 5.制定卤离子的检验及其干扰离子的排除方案; 6.列举碘与人体健康等知识; 7.联系生产和生活实际,通过对卤化物、海水资源及其综合利用的阅读,复述有关卤素的现代科技发 展的情况。 能力目标 1.通过对卤素与氯气性质的比较,初步形成元素族的概念; 2.通过卤素性质随着核电荷数的增加,原子半径的增大而递变的规律,学会对同族元素性质进行类比 和递变的推理、判断;b5E2RGbCAP 3.学会对氯、溴、碘和卤化物进行鉴别。 情感目标 通过对卤族元素的结构决定其性质上相似性和递变性的学习,进一步接受结构决定性质的原理。 ●教学重点 卤素性质的相似性与递变性及与原子结构的关系。 ●教学难点 通过卤素性质的比较,总结出性质的递变规律。 ●教学方法 引导-探究-实验验证 ●课时安排 第一课时:卤素的物理性质及卤素与氢气、水的反应。 第二课时:卤素单质间的置换反应,卤化银和碘化合物的知识。
[讲解]卤族元素中的砹是放射元素,在中学阶段不讨论。 [学生分析、比较] [板书]卤素原子结构的异同。 相同点:最外层均有 7 个电子 不同点: (1)核电荷数不同, (2)电子层数不同, (3)原子半径不同。 [过渡]卤素原子结构上的这种相似性与递变性,是如何反映在元素性质上的呢?下面,我们就来学习 卤族元素的性质。5PCzVD7HxA [板书]一、卤素单质的物理性质 [教师]请大家根据表 4—1,总结出卤素单质在颜色、状态、密度、熔沸点、溶解性等各方面的递变 规律。 [学生总结]
?深 [板书]颜色:浅 ?? ? 液 ?? ?固 状态:气 ??2020-2021学年度高中化学教研组工作计划(最新)