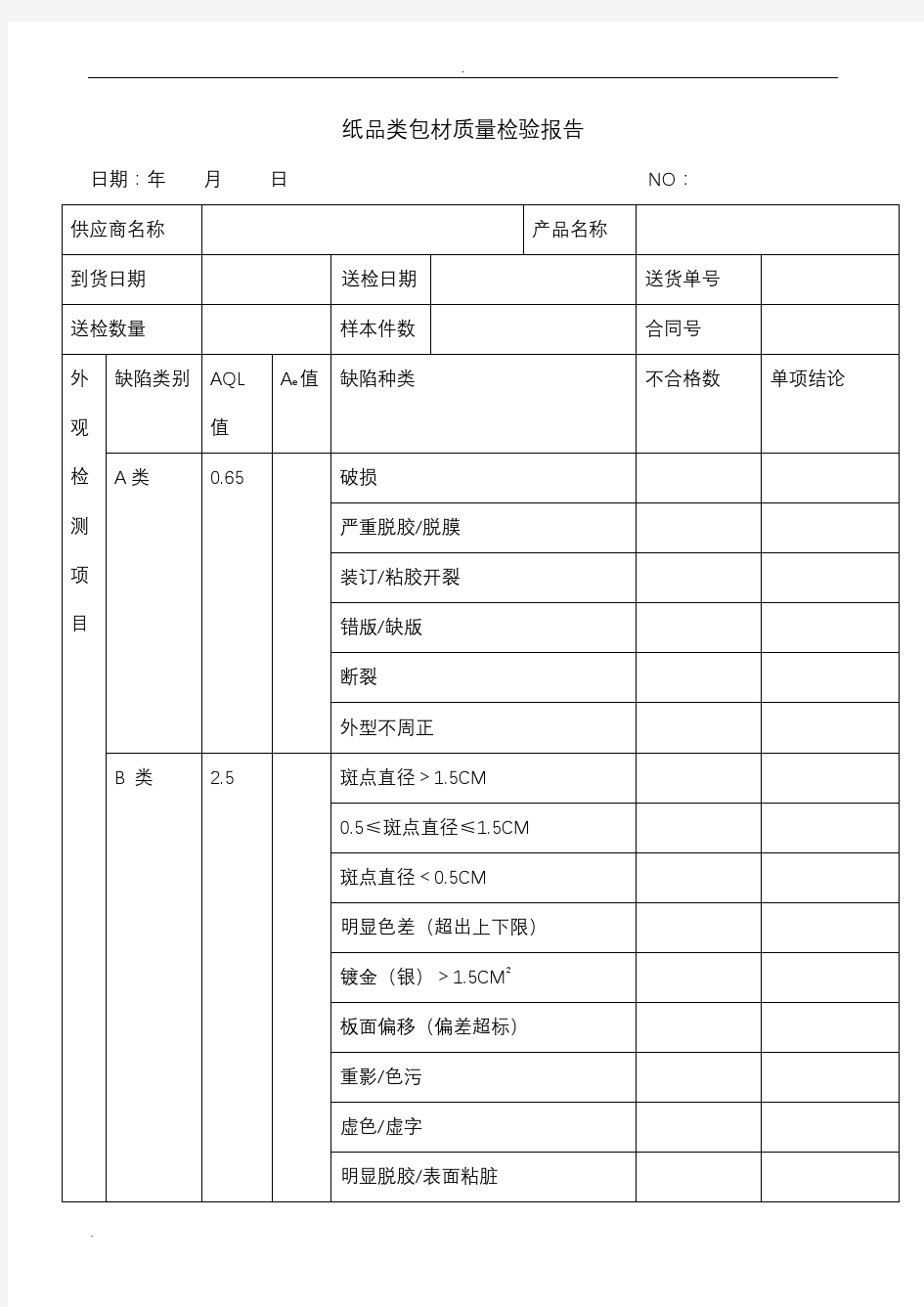
磷酸肌酸钠原料药批 生产记录
兔肉处理岗位生产指令单 格式号:YL·G02-07-006-01-LJ-01 生产指令指令日期指令号 生产日期生产批号 投料量兔肉 kg 指令者复核者接受者 本岗位本批生产小结兔肉收率>25% 兔肉合格品 kg ×100%= % 领用兔肉 kg 岗位负责人: 年月日 工艺员评价1.本批生产过程无偏离规程作业。□ 2.本批生产过程中工艺卫生符合要求。□ 3.本批清场符合要求。□ 4.本批生产记录清晰、完整。□ 工艺员: 年月日
兔肉处理岗位操作记录 格式号:YL·Z02-02-107-01 生产批号 生产日期年月日时分—时分 操作指令及工艺参数实际操作记录 按《兔肉处理岗位标准操作规程》[YL·Z02-02-107]进行操 作。 1生产前检查 上批清场合格证 清洁状态标识 设备运行状态标识 公用系统 2挂状态标识 3根据生产指令领取所需原辅料 4操作过程 4.1将领用兔肉用纯化水洗两遍,洗净血垢后,再用注射用水冲洗一遍,将水控干,用手术刀片将兔肉剔下,再用不锈钢菜刀切成1cm左右的小块,装入保鲜袋中冻存,标明品名、批号、数量和生产日期。 4.2及时填写操作记录及物料结存台帐。 4.3操作前用纯化水清洗工具和双手。 5清场 5.1本批生产文件及状态标识及时清除。 5.2容器具已清洁。 5.3清洁墙面、门窗、地面。 5.4清除废弃物。 5.5清洁废物桶。有□无□ 已清洁□待清洁□ 备用□其它□ 正常□异常□ 已挂状态标识□ 领用兔肉 kg 非用肉组织 kg 不合格 kg 兔肉合格品 kg 兔肉收率 % 时间:时分至时分 已清除□未清除□ 已清洁□未清洁□ 已清洁□未清洁□ 已清除□未清除□ 已清洁□未清洁□ 检查情况:合格□不合格□检查人: 操作者:复核者:
化妆品生产表单汇总 汇总人:杜超衍日期:2016年5月1日 - 1 - / 56
表1 供应商评价表 (5) 表2 合格供应商汇总表 (6) 表3 到货通知单 (7) 表4 物料入库单 (8) 表5 采购物资检验/验证结果通知单 (9) 表6 采购物资出入库台账 (10) 表7 进货台账 (11) 表8 批生产指令 (12) 表9 领料单 (14) 表10 称量记录 (16) 表11 配料记录 (17) 表12 投料记录 (18) 表13 成品检验报告单 (19) 表14 喷码、装盒记录 (20) 表15 物料平衡计算表 (21) 表16 成品同意放行审核记录 (22) 表17 成品同意放行单 (23) 表18 产品销售记录 (24) 表19 不合格品处理审批表 (25) - 2 - / 56
表20 不合格品销毁记录 (26) 表21 不合格品台账 (27) 表22 化妆品不良反应报告 (28) 表23 投诉处理记录 (29) 表24 运输车辆清洁记录 (30) 表25 生产用具清洗、消毒记录 (31) 表26 拆包、消毒记录 (32) 表27 机器设备维修清洗保养记录 (33) 表28 纯化水系统、贮罐及输送管道清洁消毒记录 (34) 表29 虫害鼠害检查处理记录 (35) 表30 化妆品安全风险分析记录表 (36) 表31 温湿度记录 (37) 表32 压差记录 (38) 表33 人员进入车间审批表 (39) 表34 内审自查报告 (40) 表35 物料货位卡 (41) 表36 成品货位卡 (42) 表37 场所清洁消毒记录 (43) 表38 清场记录 (44) - 3 - / 56
质量手册示例 版本号: 文件编号: 质量手册 发放序号:______ 持有人:______ ×××化妆品有限公司 发布日期: ××××年×月×日实施日期××××年×月×日
目录 颁布令 前言 1.质量方针、卫生质量目标 2.组织机构及职责 3.生产、质量管理人员的要求 4.环境卫生的要求 5.车间及设施卫生的要求 6.原料、辅料卫生的要求 7.生产加工卫生的要求 8.包装、储存、运输卫生的要求 9.有毒有害物品的控制 10.检验的要求 11.质量记录的控制 12.保证卫生质量体系有效运行的要求 13.质量手册的管理 颁布令 质量管理是涉及到我公司生存发展的一个环节,为了进一步完善企业的质量制度,加强各具体操作部门的规范化管理,由公司品管科负责,工场、办公室配合,共同编制了此本“质量手册”,现印发给各部门,希望以此能使我公司质量管理水平达到一个新的台阶,从而保证各项产品质量,提高企业整体效益。 本质量手册由××××年×月×日起实施。 总经理:××× 前言 我公司是一家专业生产销售××、××、××化妆品等的综合性××化妆品加工企业。为了保证产品质量,提高产品档次,增加产品在国际市场上的竞争
性,依据《》,特编制此地质量手册。 质量手册涉及到生产、检验、财务等各部门,它的编制实施进一步完善了本公司的质量管理制度,对加强各具体操作部门的规范化管理,提高企业整体效益更具有极其重要的作用。 一、卫生质量方针、卫生质量目标 1、概述: 卫生质量方针、目标是企业就产品质量所提出的一项要求,制定的一个方向。卫生质量方针、目标的制定,能正确引导企业在卫生质量方面持续改进、不断完善。 2、卫生质量方针、卫生质量目标 卫生质量方针:质量第一,用户至上,让顾客满意放心。 卫生质量目标:以质量为本,狠抓管理,创名牌、立信誉、争市场,以质量求生存。 成品合格率100% 加强质量管理,规范工艺操作,向顾客提供安全卫生的化妆品。 3、措施: 各部门应严格执行本手册规定,从管理技术、质量行为规范化等方面采取必要的措施促进执法力度。 4、依据及参考文件 (1)《》 (2)《》 (3)《》 二、组织机构及其职责 1、概述: 本单阐述了本公司的行政机构和质量管理机构的设置,规定了质量管理机构、部门和各级人员的质量责任,以保证各质量机构、部门和各级人员有效地、协调地开展各项质量活动,确保本公司质量方针、质量目标的实现。 2、织机构: (1)公司管理机构:其机构设置及隶属关系见附件1。 (2)质量管理机构:其机构设置及隶属关系见附件2。
BATCH PRODUCTION RECORD The following code has been given to the finished product. Revision level: Reasons for Revision:
INPUT DETAILS
Product Name: Flunixin meglumine Doc No: Batch No: Stage: Ⅰ PRODUCT OUTPUT DETAILS Out put weight/ Output Molecule mass Actual yield ratio calculation: Yield ratio = -------------------------------------------------- Input weight / Input Molecule mass Calculated by Verified by
Product Name: Flunixin meglumine Doc No: Batch No: Stage: Ⅰ Op. No Operation Date Time (hrs) Remarks Done by Checked by From To Duration 01 Make sure that R2201 is clean and dry 02 Charge 98kg of purified water , 53kg of MA , 38.7kg of CA , and 3.67kg of TS into R2201 03 Start agitation and keep for 15~20minutes 04 Heat to reflux and maintain the reflux for 2 hours at 10±5℃ 05 Prepare 36% potassium hydroxide solution by adding 25.2kg of potassium hydroxide and 44.8kg of purified water 06 Add 30.5kg of hydrochloric acid and 9.5kg of purified water to prepare another 23% hydrochloric acid solution 07 Then charge excess 4 kg of purified water to R2201 08 Adjust the reaction mass at pH=9 by dropping 36% potassium hydroxide solution 09 Cool the temperature below 10℃ and recheck whether pH is still at 9~10, if not , add 36% potassium hydroxide further to correct it 10 Make sure that ST2202 is dry and clean 11 Centrifuge the mass from R2201 and wash the wet cake and R2201 with 100kg of purified water (clean the R2201 as per procedure specified in Page No of) 12 Spin dry for 40~50minutes and introduce mother liquid back R2201 Note: Shift in–charge should cross check the S. No:and shall sign in ‘checked by’ column.
药品化妆品批生产记录模板
药品(化妆品)批生产记录 产品名称: 产品规格: 产品批号: 产品批量: 编制人: 审核人: 批准人:
生产指令 产品名称产品规格 /支、瓶产品批号计划批量支(KG) 指令依据《批生产记录、批包装记录管理规定》 指令人审核人批准人 指令日期年月日审核日期年月日批准日期年月日y 接受部门接受人接受日期年月日 批配方 序号原料名称单位用量/100kg 投料量序号原料名称单位用量/100kg 投料量 1 Kg 2 2 Kg 2 Kg 2 3 Kg 3 Kg 2 4 Kg 4 Kg 2 5 Kg 5 Kg 2 6 Kg 6 Kg 2 7 Kg 7 K28 Kg 8 Kg 29 Kg 9 Kg 30 Kg 10 Kg 31 Kg 11 Kg 32 Kg 12 Kg 33 Kg 13 Kg 内包材名称单位用量/100kg用量14 Kg 15 Kg 1 玻璃瓶个 16 Kg 2 毛刷、盖个 17 Kg 3 18 Kg 4 19 Kg 5 20 Kg 6 21 Kg 7 工艺要求:①严格按各工序标准操作法进行操作; ②配制后进行中间体检验,不合格中间体不许流入下道工序; ③灌装后进行半成品检验,不合格半成品不许包装入库。 其他要求:①车间主任要详细阅读批生产指令,按批生产指令要求将批指令分解至岗位,岗位操作人员严格按限额领料单领取物料,按车间主任下达的岗位生产指令进行生产。 ②所有设备应有“完好”证、“已清洁”状态标示; ③所有物料应有“物料卡”、半成品(中间体)应有“流转证”; ④操作间应有“清场合格证”; ⑤严格执行各岗位操作法、设备操作规程; ⑥严格执行洁净区操作规程。 ○7如有偏差,应详细调查,解释原因。 备注:批包装指令下达后方可进行包装。
CTD格式申报资料撰写要求(原料药) 一、目录 3.2.S 原料药 3.2.S.1 基本信息 3.2.S.1.1 药品名称 3.2.S.1.2 结构 3.2.S.1.3 理化性质 3.2.S.2 生产信息 3.2.S.2.1 生产商 3.2.S.2.2 生产工艺和过程控制 3.2.S.2.3 物料控制 3.2.S.2.4 关键步骤和中间体的控制 3.2.S.2.5 工艺验证和评价 3.2.S.2.6 生产工艺的开发 3.2.S.3 特性鉴定 3.2.S.3.1 结构和理化性质 3.2.S.3.2 杂质 3.2.S.4 原料药的质量控制 3.2.S. 4.1 质量标准 3.2.S. 4.2 分析方法 3.2.S. 4.3 分析方法的验证 3.2.S. 4.4 批检验报告 3.2.S. 4.5 质量标准制定依据 3.2.S.5 对照品 3.2.S.6 包装材料和容器 3.2.S.7 稳定性 3.2.S.7.1 稳定性总结 3.2.S.7.2 上市后稳定性承诺和稳定性方案 3.2.S.7.3 稳定性数据 二、申报资料正文及撰写要求 3.2.S.1 基本信息 3.2.S.1.1药品名称 提供原料药的中英文通用名、化学名,化学文摘(CAS)号以及其它名称(包括国外药典收载的名称)。 3.2.S.1.2 结构 提供原料药的结构式、分子式、分子量,如有立体结构和多晶型现象应特别说明。 3.2.S.1.3 理化性质 提供原料药的物理和化学性质(一般来源于药典和默克索引等),具体包括如下信息:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),粒度等。 3.2.S.2 生产信息 3.2.S.2.1生产商
附件2 化学仿制原料药CTD格式申报资料撰写要求 一、目录 3.2.S 原料药 3.2.S.1 基本信息 3.2.S.1.1 药品名称 3.2.S.1.2 结构 3.2.S.1.3 理化性质 3.2.S.2 生产信息 3.2.S.2.1生产商 3.2.S.2.2生产工艺和过程控制 3.2.S.2.3物料控制 3.2.S.2.4关键步骤和中间体的控制 3.2.S.2.5工艺验证和评价 3.2.S.2.6生产工艺的开发 3.2.S.3 特性鉴定 3.2.S.3.1结构和理化性质 3.2.S.3.2杂质 3.2.S.4 原料药的质量控制 3.2.S. 4.1质量标准 3.2.S. 4.2分析方法 3.2.S. 4.3分析方法的验证
3.2.S. 4.4批检验报告 3.2.S. 4.5质量标准制定依据 3.2.S.5对照品 3.2.S.6包装材料和容器 3.2.S.7稳定性 3.2.S.7.1稳定性总结 3.2.S.7.2上市后稳定性承诺和稳定性方案 3.2.S.7.3稳定性数据 二、申报资料正文及撰写要求 3.2.S.1 基本信息 3.2.S.1.1药品名称 提供原料药的中英文通用名、化学名,化学文摘(CAS)号以及其他名称(包括国外药典收载的名称),应与中国药典或上市产品收载一致。 3.2.S.1.2 结构 提供原料药的结构式、分子式、分子量,如有立体结构和多晶型现象应特别说明,应与中国药典或上市产品收载一致。 3.2.S.1.3 理化性质 提供文献(一般来源于药典和默克索引等)收载的原料药的物理和化学性质,具体包括如下信息:性状(如外观、颜色、物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),粒度等。 列表提供与已上市产品或药典收载标准进行理化性质比较研究的资
LOTION AND GEL FILLING BATCH PRODUCTION RECORD 化妆品灌装包装生产记录 起草/日期DRAFT BY: ________________________ 审核/日期CHECKED BY: ______________________ 生效日期ISSUE DATE: ______________________
LINE# MACHINE#: MFG.DATE: 流水线号:____________________ 设备号: 生产日期: 灌装、包装生产记录FILLING AND PACKAGING BATCH PRODUCTION RECORD SUPERVISOR PRE-FILLING REVIEW (CHECK ALL THAT APPL Y) –灌装前主管复核目录(如被执行, 请打钩号) [ ]ALL MATERIAL OF PREVIOUS PRODUCTS MUST HA VE BEEN CLEARED AND CLEANED. 上批产品所余物料已清除或退料,以防交叉污染。 [ ] THE FILLING EQUIPMENT AND SURFACE OF LINE MUST BE INTEGRITY AND HAS BEEN CLEANED. THE RESULTS MUST BE RECORDED. 灌装设备和流水线表面完整及功能正常,已被清洁消毒并记录。 [ ]BEFORE STARTING PRODUCE.THERE MUST HAS STANDARD SAMPLE ON LINE. 产品是否有标样。 [ ] ALL BULK HA VE STAGED, IDENTIFIED AND ARE WITHIN EXPIRA TION DA TE 所有半制品及包装材料有标识, 准备就绪, 确认无误, 并在有效期内. [ ] ALL EQUIPMENT HAS BEEN CLEANED 所有设备按照已被清洁消毒. [ ] THE FORMULA HAS BEEN ISSUED AND APPROVED BY THE QUALITY CONTROL DEPARTMENT 此生产记录是否由品保部门发放和确认. [ ] THE FILLING AND PACKAGING PERSONNEL ASSIGNED TO THIS BATCH HA VE BEEN TRAINED 灌装和包装此批产品的配制工是否被适当地培训. [ ] PACKAGING SUPERVISION HAS REVIEWED ALL THE REQUIREMENTS WITH THE PERSONNEL ASSIGNED TO FILL AND PACKAGE THIS BATCH 包装部门管理人员已确认灌装和包装所需的所有必要条件. _______________________________________DATE (日期): _____._____._______ SUPERVISOR (生产主管)
目录 封面 (2) 目录 (4) 批生产指令单 (5) 开工前现场检查表 (6) XXXXX 岗位生产记录(一)(一) (7) XXXXX 岗位生产记录(二) (8) XXXXX 岗位生产记录(三) (9) 一般生产区岗位清场记录 (10) XXXXX 岗位生产记录(一) (11) XXXXX 岗位生产记录(二) (12) XXXXXXXX岗位生产记录(三) (13) XXXXXXXXX岗位生产记录(四) (14) 附录一叠氮化液的配制记录 (14) XXXXXXXXX岗位生产记录(一) (16) XXXXX双氧化岗位生产记录(二) (17) XXXXXXXXXX岗位生产记录(三) (18) XXXXXXXXX岗位生产记录(四) (19) 中间体检验报告单 (20) 原料药一般生产区岗位清场记录 (21) XXXXX炔化岗位生产记录(一) (22) XXXXX炔化岗位生产记录(二) (23) XXXXX炔化岗位生产记录(三) (24) XXXXX炔化岗位生产记录(四) (25) XXXXX炔化岗位生产记录(五) (26) XXXXX炔化岗位生产记录(六) (27) XXXXX炔化岗位生产记录(七) (28) 原料药一般生产区岗位清场记录 (29) XXXXX脱保护基精制岗位生产记录(一) (30) XXXXX脱保护基精制岗位生产记录(二) (31) XXXXX脱保护基精制岗位生产记录(三) (32) XXXXX脱保护基精制岗位生产记录(四) (33) XXXXXXXXX护基岗位生产记录(五) (34) XXXXX脱保护基精制岗位生产记录(六) (35) 原料药洁净区岗位清场记录 (36) XXXXX干燥岗位生产记录 (37) 原料药洁净区岗位清场记录 (38) 批包装指令单 (39)